Diagnóstico y Tratamiento de la Recidiva del Síndrome Hemolítico Urémico atípico, Glomeruloesclerosis Segmentaria y Focal, Hiperoxaluria, Amiloidosis y Glomerulopatías por Depósito Fibrilar No Amiloide
Palabras clave
Glomerulonefritis inmunotactoide, Glomerulonefritis fibrilar, Nefropatía por cadenas ligeras, oxalosis, hiperoxaluria
Coordinador del grupo: Ángel Alonso Melgar
Ángel Alonso Melgar 1; Julia Fijo López-Viota 2; Pedro Ortega López 3; Paloma Martín Moreno 4; Pilar Fraile Gómez 5; Alex Gutiérrez Dalmau 6; Mireia Aguirre Meñica 7; Natalia Polanco Fernández 8, Yolanda Calzada Baños 9; Santiago Llorente Viñas 10; María Ovidia López Oliva 1, Nuria Serra Cabañas 11; Cristina Galeano 12; María Luisa Suárez Fernández 13; Leónidas Luis Cruzado Vega 14; Olalla Álvarez Blanco 15; Marina Muñoz López 16; Pilar Galindo Sacristán 17; Rosa Sánchez Hernández 18; Álvaro Molina Ordás 19; Nuria Garra 20; Ernesto Fernández Tagarro 21; David Ramos Escorihuela 3.
1. Hospital La Paz. Madrid, 2. Hospital Virgen del Rocío. Sevilla, 3. Hospital La Fe. Valencia, 4. Hospital General de Salamanca, 5. Clínica Universitaria de Navarra, 6. Hospital Miguel Servet. Zaragoza, 7. Hospital de Cruces. Bilbao, 8. Hospital Doce de Octubre. Madrid, 9. Hospital San Joan de Deu. Barcelona, 10. Hospital Virgen de la Arrixaca. Murcia, 11. Fundación Puigvert. Barcelona, 12. Hospital Ramón y Cajal. Madrid, 13. Hospital Central de Asturias. Oviedo, 14. Hospital General de Elche. Alicante, 15. Hospital Gregorio Marañón. Madrid, 16. Hospital Vall d'Hebrón. Barcelona, 17. Hospital Virgen de las Nieves. Granada, 18. Hospital General de Villalba. Madrid, 19. Hospital General de Segovia, 20. Hospital de Manresa. Barcelona, 21. Hospital Insular de Canarias. Las Palmas
RECIDIVA EN EL TRASPLANTE RENAL DEL SÍNDROME HEMOLÍTICO URÉMICO ATÍPICO (SHUa)
Véase Síndrome Hemolítico Urémico. Nefrología al Día
Véase Atlas Histológico de Microangiopatía Trombótica. Nefrología al Día
El síndrome hemolítico urémico (SHUa) es una entidad definida por la tríada: anemia hemolítica microangiopática no inmune, trombocitopenia e insuficiencia renal aguda, la diana de la lesión descansa en el endotelio vascular
El término microangiopatía trombótica (MAT) se define como una lesión histológica de arteriolas y capilares que se caracteriza por la inflamación de la pared vascular, desprendimiento de células endoteliales y acumulación de proteínas y restos celulares, así como la presencia de trombos plaquetarios que ocluyen las luces vasculares
A diferencia de la forma esporádica, de presentación más frecuente, el síndrome hemolítico urémico atípico es una enfermedad ultra rara que afecta a adultos y niños y cuya lesión fundamental es el endotelio vascular, y aunque lesiona predominantemente los vasos renales, tiene un carácter sistémico con frecuente afectación extrarrenal. Su etiopatogenia radica en una desregulación de la vía alternativa del complemento de causa genética, en la que un 60% son mutaciones conocidas. La expresión de la mutación en homocigosis o heterocigosis compuesta desarrollaría la enfermedad, aunque dependiendo casi siempre de la existencia de un estímulo desencadenante. La forma familiar se produce entre un 16-30% de los casos, siendo la razón por la que las formas familiares no sean más frecuentes el hecho de que la penetrancia de la enfermedad es del 50%. Además, la presentación clínica del SHUa es variable entre los miembros de la misma familia. El consejo genético es difícil dado que el riesgo de desarrollar la enfermedad en un familiar con la misma mutación depende de la presencia de haplotipos de riesgo conocidos o polimorfismos. La enfermedad puede manifestarse a cualquier edad
Categorización del riesgo de recidiva de SHUa en pacientes trasplantados
El riesgo de recidiva del aHUS en el trasplante renal está condicionado, especial y fuertemente, por factores genéticos predisponentes, pero también y en menor grado por factores desencadenantes [1][2][3][4][5][6][7] (Grado de recomendación: A)
Otras causas secundarias que condicionan la aparición de un Síndrome Hemolítico Urémico y que pueden conducir a la pérdida de función renal en los riñones nativos y la necesidad de un trasplante renal, como enfermedades autoinmunes o sistémicas, trasplantes de otros órganos, infecciones, glomerulopatías y en las que puede coexistir una activación del complemento sin alteración genética de la regulación del mismo deben se excluidas de esta entidad.
El SHU clásico inducido por shiga-toxina (STEC) y que induce la formación de microtrombos y adhesión de moléculas al endotelio vascular, no recidiva en el trasplante renal, pese a que en el cuadro inicial pueda existir una activación del complemento.
El abordaje del riesgo de recidiva de forma individualizada basado en estudios genéticos de las proteínas reguladoras del complemento permite implementar un tratamiento terapéutico personalizado que se basa en el bloqueo del complemento [1][2][4] (Grado de recomendación: A)
Estudios iniciales de cohortes y registros (Francia y otros registros internacionales) ratificados por KDIGO 2016 identifican con precisión tres grupos de pacientes con diferentes resultados postrasplante y que estratifican el riesgo de recidiva en alto, moderado y bajo [1][2][3][4][5][6][7] (Grado de recomendación: A).
El riesgo de recidiva llega a ser del 50 al 80% en aquellos pacientes con riesgo moderado o alto, que presentan mutaciones en genes de proteínas solubles reguladoras de la vía alternativa del complemento; pero, por el contrario, la falta de recurrencia entre los portadores de las variantes aisladas de genes que codifican proteínas ancladas a la membrana hace inútil el bloqueo del complemento en esta subpoblación de bajo riesgo [4] (Grado de recomendación: A).
Podríamos estratificar el riesgo de recurrencia en tres niveles:
Pacientes con riesgo alto de recurrencia (mayor del 70% en pacientes no tratados con bloqueo del complemento) [1][2][3][4][5][6]:
Mutaciones con variantes patogénicas en factor H (CFH)
Mutaciones en C3 o factor B (CFB) con ganancia de función
Combinaciones o variantes múltiples de las anteriores
Polimorfismos en CFH
Historia de recurrencia previa en un trasplante anterior
Gen híbrido en factor H y proteína relacionada 1 (CFH/CFHR1)
Pacientes con riesgo moderado / alto de recurrencia (50% en pacientes no tratados con bloqueo del complemento) [1][2][3][4][5][6]:
Mutaciones con variantes patogénicas en factor I (CFI)
Ausencia de variante patogénica conocida
Anticuerpos anti-factor H presentes en el momento del trasplante
Pacientes con riesgo bajo de recurrencia (No recurrencia en pacientes no tratados con bloqueo del complemento) [1][2][3][4][5][6]:
Mutaciones con variantes patogénicas en Cofactor de membrana (MCP)
Variantes patogénicas conocidas en gen de diacil-glicerol kinasa DGKE
Polimorfismos en ausencia de mutaciones patogénicas
Antecedentes de anticuerpos anti-factor H no presentes en el momento del trasplante.
Asimismo, podríamos estratificar el riesgo de pérdida del injerto renal en aquellos pacientes con antecedentes de síndrome hemolítico-urémico y trasplante renal tratados y no tratados mediante inhibición del complejo de ataque a la membrana
Supervivencia actuarial del injerto a 5 años (muerte sin fracaso del injerto censurada) en pacientes con alto riesgo de recurrencia [4][5][6].
• 98% en tratados
• 50% en no tratados
Supervivencia actuarial del injerto (muerte sin fracaso del injerto censurada) en pacientes con moderado riesgo de recurrencia [4][5][6]:
• 99% en tratados
• 75% en no tratados
Supervivencia actuarial del injerto (muerte sin fracaso censurada) en pacientes con bajo riesgo de recurrencia [4][5][6].
• 75 % en tratados
• 75% en no tratados
En líneas generales, la recurrencia postrasplante suele aparecer durante el primer año y habitualmente de forma inmediata y casi siempre podemos identificar un factor desencadenante o trigger [4][5][6]; entre ellos en aquellos pacientes trasplantados con donantes procedentes de muerte encefálica en los que se ha objetivado un aumento de los niveles circulantes de C5a y la formación de complejos de ataque de membrana (MAC). Pero también en el daño por isquemia-reperfusión secundario a la donación en asistolia que se asocia con un estado proinflamatorio reduciéndose la capacidad de CFH de unirse al endotelio, lo que lleva a una mayor formación de MAC.
Se han descrito también como triggers las infecciones como citomegalovirus (CMV), Poliomavirus BK, parvovirus B19, virus influenza e infecciones del tracto respiratorio o infecciones gastrointestinales y tanto los calcineurínico-antagonistas (ICN) como los inhibidores de mTOR (imTOR); de hecho, algunos estudios han demostrado que los imTOR se podrían relacionar con la recurrencia de SHUa de una forma más significativa que los ICN. Finalmente, los episodios de rechazo se han relacionado también como desencadenantes de recurrencias de SHUa.
Pero independientemente del "trigger" desencadenante, la recidiva está fuertemente ligada a la presencia de mutaciones objetivadas, presentando, hasta 4 veces más riesgo de recurrencia, los pacientes con mutaciones en CFH, C3 y CEBE comparado con los pacientes que no presentan mutación. Dependiendo de las series, el riesgo de recidiva en aquellos pacientes con SHUa en los que no se ha objetivado mutación varía de bajo a moderado, teniendo un riesgo bajo de recidiva los pacientes sin mutaciones o con haplotipos de riesgo en CFH, por lo tanto, en pacientes seleccionados sin mutaciones genéticas, es posible el cese de la profilaxis de bloqueo del complemento [6] [17] [18] [19]
1.1. SHUa de novo en pacientes trasplantados sin antecedentes de la enfermedad en el riñón nativo
En la aparición de una MAT postrasplantedebemos considerar siempre si se trata de una recidiva de la enfermedad primaria (la causa más frecuente de recidiva es el SHUa), o es una aparición de novo. La MAT de novo constituye, con mucho, la gran mayoría de los casos reportados de MAT postrasplantecon una frecuencia variable: 1,5% – 14% [20]. Por supuesto, si, como en ocasiones, la MAT no está diagnosticada como enfermedad primaria, una MAT en el postrasplantepuede ser mal definida como de MAT de novo. No obstante, hay enfermedades primarias que podrían recidivar en el injerto como una MAT como el lupus eritematoso sistémico (LES), la púrpura trombótica trombocitopénica (PTT) o el síndrome antifosfolípido.
Debemos considerar la realización de estudios funcionales y genéticos de genes reguladores del complemento en la aparición de una MAT de novo en el riñón trasplantado (sin diagnóstico de aHUS en riñón nativo) si coinciden una o más de estas opciones [21] [22] [23] [24]:
• Enfermedad primaria no conocida y en especial aquellas que causan con hipertensión maligna [21].
• Manifestaciones sistémicas
• Pacientes jóvenes
• Pérdida de un injerto anterior en circunstancias no aclaradas
• Desarrollo inmediato o muy precoz de la MAT (En general las adquiridas suelen desarrollarse entre los tres y seis meses post-trasplante)
Entre las causas no genéticas que se asocian con el desarrollo de una MAT postrasplante debemos considerar:
• La recidiva de aHUS no conocida,
• Hipertensión arterial grave [21]
• Tratamiento con CNI [23] y en especial con la asociación CNI + imTOR [24] (a evitar siempre en mutaciones conocidas de genes reguladores del complemento)
• Infecciones virales: hepatitis C crónica, con o sin seropositividad anti-cardiolipina, Parvovirus B19, Poliomavirus BK, Influenza y CMV
• Otros fármacos: Leflunamida y la Ribavirina.
Aunque las circunstancias anteriores se presentan con frecuencia en el trasplante, son muy pocos los pacientes que desarrollan MAT. La hipótesis más aceptada es que sólo los pacientes con una susceptibilidad subyacente del endotelio y/o un estado pro-coagulante activo desarrollen esta complicación. El mecanismo por el cual todas estas causas producen MAT no está claro, aunque la activación del complemento en el riñón es el denominador común [20]
En cuanto a la actitud terapéutica ante la aparición de una MAT de novo post-trasplante, no hay directrices generales, pero como norma general, el tratamiento debe ir encaminado a corregir el factor desencadenante, retirando o minimizando la causa principal, entre ellas, reducir o retirar transitoria o definitivamente el CNI o el imTOR para limitar el insulto nefrotóxico [20] [21] [22] [23] [24]. Dado que en esta situación se pueden producir fracaso del injerto en porcentajes variables según las series (60 al 100%) se deben balancear cuidadosamente riesgos y beneficios, entre ellos el mantenimiento del CNI con una vigilancia estricta de la situación clínica. Es una práctica frecuente y sugerida por algunos autores asociar tratamientos cortos con fármacos bloqueantes del complejo de ataque a la membrana del complemento en aquellos casos de MAT postrasplanterelacionada con el CNI, pero este hecho no está basado en la evidencia ni existen ensayos clínicos que lo soporten. En los casos recidivantes asociados al CNI se debe considerar la terapia con Belatacept suspendiendo el CNI.
1.2. Profilaxis de la recidiva postrasplante del SHUa. Elección del donante
En los trasplantes renales de pacientes con SHUa de donantes vivos emparentados, los donantes deben ser evaluados para excluirlos si se descubre que son portadores de las mutaciones genéticas.
El trasplante renal de donante vivo emparentado en pacientes con SHUa se considera una opción válida siempre y cuando se disponga de eculizumab y se haya identificado una mutación genética en el receptor que no se encuentre en el donante. En estas circunstancias, tanto donante como receptor deberían ser adecuadamente informados de los riesgos y los beneficios.
1.3. Profilaxis de la recidiva postrasplante del SHUa. Actitud en el receptor
La profilaxis con eculizumab desde el día 0 postrasplantees una terapia eficaz en la prevención de la recurrencia de aHUS en pacientes con mutaciones conocidas. Es mandatorio la realización de un estudio genético del complemento a todos los posibles receptores con diagnóstico de SHUa que vayan a recibir un trasplante renal con el fin de establecer el riesgo de recidiva de la enfermedad sobre el injerto.
Dado que la terapia preventiva con eculizumab es muy eficaz para evitar la recurrencia del SHUa postrasplante, se recomienda realizar tratamiento profiláctico en pacientes con riesgo moderado o alto [12] [18] [19] [25]; sin embargo, no se recomienda tratamiento profiláctico en pacientes con riesgo bajo.
Además de las premisas anteriores se debe intentar siempre reducir la carga de daño endotelial considerando otros factores como la valoración de las pruebas cruzadas positivas preoperatorias y / o la presencia de DSA, tratando las infecciones sistémicas ya que pueden actuar como factor desencadenante y por supuesto monitorizando los niveles sanguíneos de CNI evitando el uso de imTOR.
No existen pautas establecidas para la dosificación de eculizumab para prevenir el SHUa y se necesitan más estudios para determinar la dosis óptima y la duración de la terapia preventiva, por lo que, en el momento actual, se recomienda utilizar la misma pauta que la recomendada para el tratamiento sobre el riñón nativo [12] [18] [25]. El eculizumab, medicación que bloquea el complejo de ataque a la membrana (CAM), debe ser iniciado peri-trasplante (Día 0) para prevenir la recurrencia [12] [18] [19] [25]. La decisión de cuándo interrumpir la terapia con eculizumab debe ser individualizada tras considerar antecedentes genéticos y la evolución clínica, teniendo en cuenta que no existe consenso en cuanto a la duración del tratamiento.
Antes del trasplante los pacientes deben ser vacunados frente N. meningitidis y Streptococcus pneumoniae y, además, debido al estado de inmunosupresión continua, se debe instaurar profilaxis antibiótica mientras dure el tratamiento con bloqueo de CAM [26]. A falta de estudios específicos en trasplante renal el ravulizumab, nueva medicación de efectos prolongados frente al CAM podría ser considerada similar al eculizumab.
Además del bloqueo del CAM para evitar la recidiva del SHUa en el injerto, se han considerado otras opciones preventivas como la realización de un trasplante combinado hepático y renal (TCHR) en aquellos pacientes con mutaciones que implican un déficit de regulación del complemento de síntesis hepática (CFH, CFB, C3). Debemos considerar que este sería un tratamiento curativo definitivo para el SUHa y por tanto una opción terapéutica para evitar la recidiva de la enfermedad [27] [28] [29] y dado que en términos de eficacia ambos procedimientos (tratamiento con eculizumab versus TCHR) son similares se debe individualizar en cada paciente cuál es la mejor opción teniendo en cuenta diferentes factores tanto médicos como socio-económicos y disponibilidad de la medicación, pero teniendo en cuenta la comorbilidad del TCHR, la opción eculizumab en nuestro medio es siempre preferible [27] [28] [29] [30]. No se recomienda el trasplante hepático aislado en pacientes con SHUa y riñones nativos funcionantes.
El uso de terapia plasmática (TP) profiláctica junto TR simple se ha utilizado con buenos resultados en términos de prevención de la recurrencia de la enfermedad (en la serie francesa redujo el riesgo de pérdida del injerto); sin embargo, se han reportado casos de recurrencia en pacientes de riesgo, incluso con el uso de TP intensiva. Esta estrategia está limitada por el posible aumento del riesgo de recurrencia con el progresivo espaciamiento de las sesiones de o el impacto sobre la calidad de vida del paciente. Además, la administración de TP a largo plazo no excluiría la recurrencia asociada a las infecciones [31]. En definitiva, las TP, incluyendo la plasmaféresis, son menos efectivas que eculizumab en la prevención de la recidiva y en especial en la prolongación en el tiempo del tratamiento por lo que de forma aislada no debe ser una opción preferencial [27] [28] [29] [30] [31].
En cuanto a la inmunosupresión, se sugiere mantener un régimen basado en inhibidores de calcinerurina con monitorización cuidadosa de dosis, evitando la sobreexposición. Los ImTOR se han asociado de forma independiente con el riesgo de recurrencia. Finalmente, la profilaxis con rituximab en pacientes con anticuerpos anti CFH ha mostrado resultados favorables, si bien, la mitad de los pacientes con anticuerpos tienen evolución favorable sin tratamiento específico.
1.4. ¿Profilaxis o tratamiento anticipado?
¿Cuándo debemos instaurar peroperatoriamente un tratamiento preventivo bloqueando el CAM o por el contrario podemos esperar evolución e instaurarlo precozmente sólo si se inician las manifestaciones clínicas o analíticas?
Pues bien, hoy sabemos que el bloqueo del CAM profiláctico se asocia de forma independiente con un riesgo significativamente reducido de recurrencia y con una supervivencia del injerto significativamente más prolongada que el tratamiento tras recurrencia en pacientes con mutación de alto riesgo identificada [3] [25] [18] [30] [32] [33].
Efectivamente, revisiones sistemáticas indican que el uso preventivo frente al terapéutico del eculizumab en pacientes con riesgo moderado o alto mejora de una forma significativa la supervivencia del injerto disminuyendo la tasa de recidiva tanto inmediata como tardía, consiguiendo una disminución de la pérdida del injerto [18] [25] [30] [32]. Así, la recidiva inmediata (menos de tres meses de evolución del trasplante) es de sólo un 5,3% cuando se instaura preventivamente frente a un 20 % cuando se utiliza terapéuticamente y la supervivencia del injerto renal a los tres meses es del 95% con la instauración preventiva frente a un 67% si se instaura tras la aparición del SHUa.
1.5. Tratamiento de la recidiva
El tratamiento con eculizumab de la recidiva de la enfermedad primaria en el injerto mejora los resultados frente a otras opciones terapéuticas y aunque disminuye el riesgo de diálisis postrasplantey la pérdida del aloinjerto tiene peores resultados que la profilaxis primaria [10] [18] [19] [25] [34]. No existe una pauta de tratamiento definida. Se utiliza habitualmente la misma pauta que en la recurrencia establecida con inicio en el día 0 [25] [34]. La duración del tratamiento no está bien establecida. En profilaxis primaria hay riesgo importante de recidiva de SHUa después de la interrupción de la profilaxis en los trasplantes de alto riesgo y menor en los de riesgo moderado [18] [25] [32] [30]. En ausencia de ensayos clínicos comparativos frente a eculizumab en la recidiva en el trasplante renal de SHUa se asume igual eficacia de ravulizumab que eculizumab [35].
1.6. Suspensión del tratamiento o de la profilaxis ¿Cuál es la duración óptima de la terapia anti-C5?
La suspensión de la terapia anti-C5, a pesar de que en ocasiones es posible, podría asociarse con un alto riesgo de recurrencia de SHUa y posible pérdida del injerto; además de poder producir otras manifestaciones clínicas extra renales que son impredecibles en cuanto a gravedad y momento de aparición. Los datos actuales de suspensión del tratamiento se basan en casos clínicos publicados y análisis retrospectivos y están influidos por la duración limitada del seguimiento informado. En caso de producirse, la suspensión del tratamiento debe ser informada e individualizada según los hallazgos genéticos y la historia clínica.
Como norma general en aquellos pacientes con mutaciones de alto riesgo o con recurrencia en un injerto anterior o, por supuesto, con una recurrencia en curso nunca debería suspenderse la terapia anti-C5 salvo que se hay realizado un trasplante combinado de riñón-hígado para curar definitivamente la enfermedad [19] [24] [33] [34] [36] [37].
En pacientes con menor riesgo, podría ser una estrategia razonable intentar disminuir gradualmente la terapia de bloqueo del CAM después de un período prolongado sin recurrencia [34] [36] [37].
2. RECIDIVA EN EL TRASPLANTE RENAL DE LA GLOMERULOESCLEROSIS SEGMENTARIA Y FOCAL (GESF)
Véase Glomerulosclerosis Segmentaria y Focal. Nefrología al Día
Véase Atlas Histológico de Glomerulosclerosis Segmentaria y Focal. Nefrología al Día
2.1. GESF: Algunos conceptos básicos y definiciones
La GEFS es un síndrome clínico-patológico heterogéneo que da lugar al 40% de los síndromes nefróticos en el adulto y es la etiología más común de fallo renal adquirido en la edad pediátrica tras las causas congénitas y hereditarias. Existen muchos factores implicados en su fisiopatología, pero la diana final es la lesión histológica de los podocitos del glomérulo renal. La etiología es multifactorial, pudiendo ser idiopática, genética o secundaria. En la GESF secundaria, el daño glomerular puede estar asociado a hiperfiltración con o sin reducción de masa renal, infección vírica, drogas, fármacos o toxinas. La expresión clínico-patológica es la excesiva excreción de proteínas junto con la confirmación de la lesión histológica en la biopsia renal que se caracteriza por la presencia de esclerosis en parte (segmentaria) de algunos glomérulos (focal) mediante microscopía óptica.
La clasificación histológica de Columbia de la GESF Columbia incluye 5 tipos: celular, colapsante, hiliar, tip y otras [38] [39]. Teniendo en cuenta que la expresión clínica de la GESF es el síndrome nefrótico y que el objetivo de esta revisión está basado en la recidiva de la enfermedad primaria; es de interés señalar que la mayoría de las GESF que van a ser objeto de nuestro estudio son aquellas primarias e idiopáticas que cursaron con síndrome nefrótico en el riñón nativo y que vuelven a tener esta expresión clínica en el riñón trasplantado ya que las adquiridas de forma secundaria en el riñón nativo, como pueden ser la reducción de masa renal o la obesidad, son entidades que no van a recidivar salvo que se reproduzca la situación inicial. La mitad de los casos que van a recidivar en el riñón trasplantado son resistentes al tratamiento con esteroides y conducen al fracaso del injerto en un periodo medio de 5 años [38] [39].
Aunque el trasplante renal es a priori el mejor tratamiento que se puede ofrecer a un paciente con daño renal terminal por GESF, la posibilidad de recurrencia en el injerto es del 11- 65 % según las distintas publicaciones y con frecuencia tan sólo en horas o días después del trasplante, aumentando hasta 60-80 % en el siguiente trasplante si ha recurrido en uno anterior [38] [39]. La gran variabilidad en el porcentaje de recurrencia inicial del síndrome nefrótico en las diferentes series está en relación con la heterogeneidad etiológica de la GESF; asimismo, existe una gran variación en el tratamiento de la recurrencia post trasplante [39].
2.2. Riesgos de recidiva de GESF en el riñón trasplantado
La recurrencia post trasplante de la GEFS causa la pérdida del injerto hasta en el 50% de los casos [38] [40]. La pérdida del injerto está condicionada por la respuesta inicial al tratamiento, siendo hasta 5 veces mayor si no se consigue, al menos, una respuesta parcial [38] [40] [41] [42] [43].
Son factores asociados al riesgo de recurrencia en el trasplante:
• Las formas no genéticas frente a las formas monogénicas en porcentajes que oscilan entre el 24% versus 0% en la cohorte brasileña y 50 % versus 7% en la cohorte europea [40].
• La sensibilidad inicial a los esteroides frente a la cortico-resistencia inicial (78% vs 39 %)
• Biopsia inicial con cambios mínimos versus GEFS inicial (76% versus 40% incluso llegando a ser del 0% en las formas monogénicas)
• Tiempo hasta la enfermedad renal terminal (menos de 48 meses frente a más de 48 meses)
• Porcentaje de glomeruloesclerosis superior al 55%.
Derivado de las consideraciones anteriores podríamos estratificar el riesgo de recurrencia en tres niveles. según genética, biopsia y respuesta inicial a esteroides:
• RIESGO BAJO: GESF de causa monogénica.
• RIESGO MEDIO: GEFS en riñones nativos con cortico-resistencia precoz.
• RIESGO ALTO: Cambios mínimos en biopsia inicial y/o cortico-resistencia tardía.
2.3. Consideraciones sobre la realización de un estudio genético pretrasplante
En el síndrome nefrótico de origen genético están implicados más de 50 genes con mutaciones únicas o múltiples. La menor edad de la presentación está relacionada con la etiología monogénica, llegando al 85 % de los casos diagnosticados en los tres primeros meses [42] [22] [45]. La causa genética en la GESF con cortico-resistencia inicial a cualquier edad en la infancia es de un 30% [38] [44] [45].
La posibilidad de recurrencia postrasplante si existe una mutación genética es muy baja, exceptuando aquellos con mutación Fin major en homocigosis en el gen NPHS1, en los que puede llegar al 30 % por desarrollo de anticuerpos anti-nefrina [42] [22] [45].
Dada la ausencia de respuesta del síndrome nefrótico de origen genético a los esteroides, no se recomienda hacer estudio genético en pacientes con sensibilidad inicial, aunque posteriormente desarrollen cortico-resistencia; sin embargo, sí se recomienda, antes del trasplante, realizar estudio genético a niños y adultos jóvenes con un curso clínico compatible con afectación genética, para considerar riesgo de recurrencia [46] [47].
En definitiva, son indicaciones de estudio genético [44] [45] [46] [47]:
• Pacientes con síndrome nefrótico infantil o congénito
• Pacientes con incidencia familiar
• Histología de GEFS o esclerosis mesangial difusa
• Presencia de manifestaciones extra renales.
Además, el estudio genético puede ser útil en el pronóstico y cribado de posibles donantes [45] [46] [47].
2.4. Diagnóstico de la recidiva ¿Existen biomarcadores predictivos fiables?
Además de la posible participación de los linfocitos T y B, los estudios de investigación sugieren que en la patogénesis de la GEFS primaria y de su recurrencia postrasplanteexiste relación con uno o varios factores de permeabilidad circulante presentes en el suero de los pacientes. Aunque no está determinada su naturaleza y su implicación patogénica segura, destacan entre los más citados [48] [49] [50] [51] [52] [53]:
• Anti-CD40 y suPAR (receptor de activador de plasminógeno tipo urokinasa soluble). Estos biomarcadores se han encontrado elevados en algunos trabajos en la recurrencia postrasplantey son independientes de la función renal; sin embargo, la mayoría de estas publicaciones no tienen valor estadístico ni son concluyentes.
• CASK (proteín-quinasa dependiente de calcio/calmodulina), que participa en la matriz del citoesqueleto celular uniéndose al CD98.
• CLCF-1: Citoquina similar a cardiotrofina: Estimuladora del linfocito B (familia de IL6). Desestabiliza la actina del citoesqueleto podocitario aumentando la permeabilidad a la albúmina. Anticuerpos contra CLF-1 o sus receptores y el inhibidor JAK/STAT bloquearían esta acción.
• Marcadores moleculares glomerulares y específicos de los podocitos (32 genes) que se activan al exponer el riñón a suero de pacientes con GEFS.
• La Apo A1b en orina se ha descrito como un biomarcador independiente de valores de creatinina y proteinuria con una sensibilidad del 93% y una especificidad del 91 % para discriminar la recurrencia versus la no recurrencia. El valor predictivo es alto (95%) para excluir la recidiva si es negativo antes del trasplante.
• Evaluación de permeabilidad a la seroalbúmina bovina utilizando un dispositivo 3LD.
• Activación de genes podocitarios mediante un test de contacto con suero de pacientes, aumentando la actividad de la luciferasa, muestran una sensibilidad del 80 % y una especificidad del 85 %.
2.5. Diagnóstico de la recidiva: proteinuria y disfunción inicial
Los pacientes que desarrollan una recidiva del síndrome nefrótico presentan habitualmente una proteinuria precoz, casi siempre inmediata, por lo que es aconsejable medir antes del trasplante, si existe función renal residual, la excreción urinaria de proteínas para facilitar la vigilancia postrasplanteen caso de recurrencia (IPNA. Grado A, recomendación fuerte) [38] [54].
Se recomienda, asimismo, vigilar la recurrencia desde el primer día mediante la monitorización del índice proteinuria / creatininuria de forma diaria durante la hospitalización postrasplantey posteriormente; en este sentido, debemos considerar diagnóstico de recurrencia si dicho índice es superior a 1 mg/mg en aquellos pacientes previamente anúricos, o bien, un aumento ≥ 1 mg/mg si la proteinuria estaba presente antes del trasplante [38] [54].
La disfunción precoz del injerto, la ausencia función o la disfunción tubular precoz, deben considerarse como posibles primeros signos de recurrencia (grado C, recomendación débil, según la IPNA) [54].
Obviamente, el dato diagnóstico fundamental de recidiva es la presencia de síndrome nefrótico con proteinuria, hipoalbuminemia y edemas.
2.6. Diagnóstico de la recidiva: valor de la biopsia precoz y utilidad de la microscopía electrónica
Se recomienda realizar una biopsia en caso de recidiva para excluir otros diagnósticos como en casos de proteinuria sub-nefrótica, en las posibles recurrencias tardías y cuando exista una función retrasada del injerto (grado B, recomendación moderada. IPNA); además está indicada en cualquier proteinuria de inicio tardío con objeto de excluir microangiopatía trombótica y rechazo humoral.
Los patrones histológicos de la clasificación de Columbia no predicen la variante de la recurrencia. En la recurrencia precoz los hallazgos pueden ser muy poco o nada relevantes en la microscopía óptica, donde el hallazgo inicial suele ser cambios mínimos glomerulares; sin embargo, en series cortas, en la microscopía electrónica puede observarse desde fases muy precoces un borramiento podocitario que confirmaría la recurrencia, hallazgo que puede ser crítico para tratamientos inmediatos [55]. Los depósitos de C4d glomerulares podrían preceder el desarrollo de GEFS [56].
2.7. Profilaxis de la recurrencia de la GESF en el trasplante renal
No existe evidencia suficiente para recomendar estrategias de intervención para la prevención de la recurrencia en niños ni en adultos sometidos a un primer trasplante de riñón, existiendo trabajos que no encuentran disminución de las recurrencias con ninguno de los tratamientos utilizados. Las prácticas más generalizadas tienen un grado de recomendación débil (grado C, IPNA); entre ellas encontramos:
• Plasmaféresis (3 veces por semana durante 2 semanas, desde una semana antes del trasplante de donante vivo o desde el día siguiente tras el trasplante de donante cadáver, con intercambio de 1,5 volúmenes de plasma) [38] [57] [58] [59].
• Rituximab perioperatorio (antes o inmediatamente post-trasplante, con o sin segunda dosis a la semana del trasplante) [58] [59].
• Inmunoadsorción [38].
• Aféresis de lípidos [38]
2.8. Tratamiento de la recidiva: Dianas terapéuticas y terapias extracorpóreas
Se han establecido como posibles dianas terapéuticas en caso de recidiva las alteraciones de proteínas estructurales glomerulares resultado de mutaciones en genes expresados en los podocitos y hendidura diafragmática: nefrina, NEPH1, actina y podocina, así como integrinas (componentes de la membrana basal glomerular y del complejo adjunto); canales TRPC6 y alteraciones mitocondriales. [60]:
2.9. Estrategias de tratamiento de la recidiva
Existe un acuerdo general de la importancia del diagnóstico y tratamiento precoz pero no existe un acuerdo generalizado ni basado en estudios de diseño prospectivo ni comparativo de las diferentes opciones terapéuticas.
La mayoría de las publicaciones consisten en series cortas sin grupos comparativos en las que se observan unos resultados muy dispares que probablemente están en relación con la gran heterogeneidad etiológica.
Se han utilizado como tratamiento de la GEFS y de su recurrencia post-trasplante: [61] [62] [63] [64] [65].
• Agentes que retiran o neutralizan los posibles factores circulantes: Terapias extracorpóreas (todas ellas acompañadas de tratamiento inmunosupresor);
Recambios plasmáticos: es la práctica más generalizada, aunque con resultados variables. En la mayoría se objetiva remisión completa o parcial de la recidiva en 71 % (95% CI: 66% a 75%), con mayor probabilidad de remisión si el paciente es tratado en las primeras 2 semanas. La mayoría de los casos precisan al menos 8-12 sesiones. Hay casos de remisión tardía: hasta 35 días en las recaídas precoces (primeros 3 meses) y hasta 80 días en las tardías. Se debe considerar suspender tras 40 días sin respuesta.
Inmunoadsorción: resultados parecidos a los recambios plasmáticos
LDL-Aféresis: Es muy utilizada en menores de 21 años. La instauración suele realizarse dos veces por semana durante 3 semanas, seguido de una vez por semana durante 6 semanas. Esta pauta está generalmente asociada a la administración intravenosa semanal de metil- prednisolona de 10 a 20 miligramos por kilogramo de peso con un máximo de 1 gramo.
• Inmunosupresores
Inhibidores de la calcineurina: Aunque tanto tacrolimus como ciclosporina han demostrado una eficacia similar en las series pediátricas la ciclosporina a dosis altas ha sido el fármaco más utilizado [38] [42] [68].
Ac humanizados contra células B:
Rituximab [Anticuerpo monoclonal quimérico murino humanizado] [38] [42] [58], se utilizan de dos a seis dosis de 375 mg/m2 cada 1-2 semanas. Es efectivo hasta un 64% en algunas series.
Ofatumumab [Anticuerpo monoclonal completamente humanizado] [66] [67] Tiene indicación en casos de alergia al rituximab y además algunas series cortas de casos muestran respuesta en apacientes tratados previamente con Rituximab.Se ha utilizado a dosis variables según las diferentes publicaciones:
• 1500 mg/1,73 m2, dos dosis separadas entre 2 y 10 meses [66].
• 300 mg/1,73 m2 seguida de 5 infusiones de 2000 mg/1,73 m2., semanalmente [67].
• Terapias combinadas [38] [42] [68] [69]. Son las más utilizadas, incluyen:
Plasmaféresis + Inmunoglobulinas + Rituximab. Es la más utilizada. Se obtienen respuestas del 87%
Plasmaféresis + Rituximab. Resultados variables con respuestas parciales del 36% y totales del 21%
Ciclosporina de uso intravenoso: (5-8 mg/kg/día en dosis única o en perfusión y posteriormente oral) + plasmaféresis (12 sesiones con un recambio de 1,5 de la volemia) en régimen diario la primera semana y posteriormente a días alternos en las dos siguientes semanas y finalmente una sesión mensual dependiendo de la proteinuria). Con esta pauta se observan emisiones de un 80% de los cuales un 50 % tienen una remisión completa.
Plasmaféresis + Rituximab + esteroides + ciclosporina. Se consigue una remisión completa en adultos 27,8 %, y parcial del 16,4%; sin embargo, hay interrupción del tratamiento por efectos adversos en el 26 % de los pacientes tratados. La supervivencia del paciente a los 6 años es del 90,7% y del injerto del 64,5 %.
• Existen otras terapias empleadas en la recurrencia de la GESF en el riñón trasplantad que se describen en publicaciones de series cortas con resultados variables y en general con grado de recomendación bajo [70] [71] [72] [73]. Así se ha utilizado:
Gel de ACTH, 80 U dos veces por semana, al menos 6 meses (respuesta en 36-50% de los pacientes siendo en el 20% completa). Existe un fracaso del injerto en el 40% de los pacientes [72].
Abatacept, dosis de 10 mg/kg dos dosis separadas 2 semanas 71.
Anti-TNF-alfa
Galactosa; cuya efectividad se basa en el postulado de la neutralización de la actividad de los factores de permeabilidad circulantes al tener alta afinidad por ella. Las dosis empleadas (en GEFS pre- trasplante) son la administración oral de 0,2 g/kg que se disuelven en 15-30 ml de agua dos veces al día [73].
Trasplante de médula ósea
Otras medidas generales, empleadas sin fines curativos y con efecto anti-proteinúrico, son los inhibidores del enzima convertidores de la angiotensina (IECAS) y los bloqueantes del receptor de angiotensina II (ARA-2).
2.10. ¿Hasta cuándo y tras cuántas recidivas se puede mantener el trasplante renal como una opción terapéutica?
El trasplante de DC puede ofrecerse a pacientes con pérdidas de injertos anteriores por recurrencia de GEFS, en particular si la diálisis es difícil o si está asociada a complicaciones y/o baja calidad de vida (IPNA, grado C, recomendación débil).
No se recomienda la repetición de trasplante de donante vivo si ha existido una recurrencia previa.
Es recomendable realizar estudio genético a los posibles donantes de aloinjertos vivos en su evaluación en el marco de SNCR genético (recomendación fuerte), siendo excluido si se encuentra una variante patógena o probablemente patógena en un gen dominante.
2.11. Reflexión final sobre la recurrencia de la GESF
Siendo la GESF un síndrome clínico-patológico heterogéneo necesitamos realizar un análisis más crítico para reducir la confusión existente sobre este sobre utilizado y a veces malentendido diagnóstico descriptivo.
Los estudios realizados están basados, en general, en grupos de pacientes muy heterogéneos; son de corta duración, con pequeños tamaños de muestra e inicio tardío del tratamiento, lo que hace difícil que tengan significación clínica y estadística.
3. HIPEROXALURIA PRIMARIA Y TRASPLANTE RENAL
Véase Hiperoxaluria Primaria. Nefrología al Día
3.1. Introducción
La hiperoxaluria primaria (HOP) es un trastorno del metabolismo del glioxilato de carácter hereditario y transmisión autosómica recesiva que condiciona que el oxalato, no metabolizado en humanos, se deposite en el riñón, formando cálculos renales, y produciendo nefrocalcinosis y finalmente evolucionando hacia la enfermedad renal terminal y al acúmulo sistémico de oxálico (oxalosis). En realidad, la HOP no es una enfermedad primaria del riñón, pero la sobrecarga renal de oxalatos (litiasis y nefrocalcinosis) produce el daño renal progresivo. Cuando falla definitivamente el riñón y no puede eliminar el exceso de oxalatos, estos se acumulan en los tejidos desarrollando oxalosis sistémica. El tratamiento con diálisis no frena el acúmulo de oxalatos, y en caso de trasplante renal, volverá a depositarse en el riñón trasplantado. A la espera de nuevas y esperanzadoras alternativas terapéuticas, actualmente, el trasplante hepatico es el tratamiento de elección.
Se reconocen tres tipos de HOP; todas ellas causadas por defectos enzimáticos hepáticos específicos. En la actualidad el diagnóstico final es genético quedando la biopsia hepática con estudio enzimático funcional reservado para aquellos pacientes con HOP no filiada genéticamente.
La mayoría de las publicaciones se basan en estudios observacionales, series de casos u opiniones de expertos por lo que la calidad de la evidencia es baja
3.2. Hiperoxaluria tipos I, II y III
La HOP1 está relacionada con la alteración del gen AGXT que produce una disfunción de la enzima hepática peroxisomal alanina glioxilato aminotransferasa (AGT) y es la forma más grave. Más del 70% de los pacientes con HP1 desarrolla enfermedad renal terminal, pudiendo suceder incluso con historia aislada de cálculos renales. El acúmulo de oxalato conduce a la insuficiencia renal grave y puede afectar, además, a los huesos, ojos, corazón, arterias y nervios periféricos (oxalosis sistémica).
La HOP2 está producida por la alteración del gen GHRPR que condiciona una disfunción de la enzima citoplásmica glioxilato/hidroxipiruvato reductasa; tiene un curso más benigno que la anterior y no se ha descrito oxalosis infantil. La enfermedad renal terminal ocurre a una edad relativamente tardía y en aproximadamente el 20% de los pacientes.
La HOP3 está relacionada con mutaciones del gen HOGA1 que causan disfunción de la enzima mitocondrial 4-hidroxi-2-oxoglutarato aldolasa. Es más benigna que las anteriores y tan sólo hay algunos casos descritos hasta la fecha de insuficiencia renal y ninguno de enfermedad renal en etapa terminal.
La hiperoxaluria primaria (HOP) debería ser diagnosticada tan pronto como fuera posible para reducir el depósito de oxalato cálcico y el daño renal [75]. No hay evidencia suficiente, aunque algunas series sí lo reflejan, para confirmar que el tratamiento conservador agresivo y precoz puede preservar la función renal independientemente de la función renal basal o la edad al diagnóstico [76]; en cualquier caso, se recomienda en la etapa pre diálisis una alta ingesta de líquidos (más de 3 litros diarios al día / 1,73 m2) para disminuir la concentración tubular de oxalato y disminuir su depósito, con un objetivo de concentración urinaria inferior a 0,4 µmol/L en la orina [75] [97]. (Grado de recomendación 1C).
Se recomienda la utilización de ortofosfato, citrato potásico y/o magnesio para disminuir la precipitación urinaria de oxalato cálcico. [75] [77]. (Grado de recomendación 1C). En pacientes con HOP1 se recomienda realizar una prueba de administración de piridoxina durante tres meses y valorar la respuesta; aproximadamente en el 30 % de los pacientes se consigue una reducción de la secreción de oxalato (hiperoxaluria sensible a piridoxina) [75] [77] [78]. (Grado de recomendación 1C).
3.3. Trasplante renal aislado
• Trasplante renal aislado en HOP 1: Los resultados del trasplante renal aislado en cuanto a supervivencia del injerto son malos y por tanto no se recomienda [79] [80] [81] [82] [93], aunque se podría considerar su realización en casos especiales en los que hay respuesta a la piridoxina [75].
• Trasplante renal aislado en HOP 2. La hiperoxaluria primaria tipo 2 es una enfermedad rara, siendo excepcional la oxalosis en población infantil y mucho más frecuente en la población adulta, donde la morbimortalidad es importante y muy similar al tipo 1 y en la que, aunque el riesgo de recurrencia es desconocido [81] [94], los resultados del trasplante renal aislado son malos [79]. Por el contrario, hay algunos trabajos que sugieren la realización de un trasplante renal aislado, con un grado de recomendación bajo [75] [76], advirtiéndose siempre la posibilidad de oxalosis y fracaso del injerto. Finalmente, y aunque muy discutido por su dudoso papel curativo dado que la actividad del enzima alterado (GR/HPR) está presente también en linfocitos periféricos, médula ósea y fibroblastos [77] se debe considerar la posibilidad de realizar un trasplante combinado hepático y renal combinado, en especial, en aquellos pacientes que presentan un curso de la enfermedad grave y rápidamente progresiva [81] [96].
• Trasplante renal aislado en HOP 3. En los pacientes con HOP-3 con curso evolutivo mucho más benigno con tratamiento conservador no hay estrategias de trasplante establecidas claramente en la actualidad [78].
3.4. Trasplante hepático y renal combinado
El trasplante hepatorrenal combinado, secuencial o simultáneo dependiendo del contexto clínico y del grado de oxalosis sistémica debe ser propuesto como objetivo final para pacientes con enfermedad renal terminal [83] [84] [85].
Los pacientes con HOP-1 y enfermedad renal terminal [estadio V o diálisis] deberían ser trasplantados tan pronto como las condiciones del paciente y el grado de oxalosis lo permitan, ya que no hay tratamiento de reemplazo renal capaz de depurar el oxalato de forma adecuada [85].
La elección entre trasplante combinado o secuencial dependerá del Se recomienda la realización de un transplante combinado hepatorrenal en pacientes con deterioro de la función renal con FG por debajo de 40 ml/min/1,73 m2 y antes de que se produzca el depósito sistémico de oxalato [75] [78] [79].
La elección entre trasplante combinado o secuencial dependerá del grado de afectación de los órganos, del depósito de oxálico, de la experiencia del centro y el estado general del paciente [79]. El trasplante combinado aporta buenos resultados de supervivencia del injerto, pero no superior del paciente debido a la mayor complejidad del procedimiento [79]. Se sugiere realizar el implante de hígado completo antes que un split para evitar complicaciones quirúrgicas [79].
Una acción que permite disminuir las complicaciones asociadas a la liberación de oxálico y su depósito en el injerto renal es la opción secuencial; es decir, realizar primero transporte hepático y posteriormente el renal, realizando el trasplante combinado en el mismo acto cuando el filtrado glomerular se sitúa entre 15 y 29 ml/min/1,73 m2[79].
El trasplante hepatorrenal combinado y el secuencial se pueden realizar en niños con buenos resultados quirúrgicos y de supervivencia a largo plazo; incluso en el grupo con peso inferior a 15 kg [84].
3.5. Trasplante hepático aislado
Aunque controvertida, es la estrategia óptima de trasplante para muchos autores [75], que sugiere la posibilidad de realizar un trasplante hepático aislado anticipado cuando el filtrado glomerular se sitúa en 40 ml/min/1,73 m2.
El trasplante hepático precoz de donantes no heterocigotos con mantenimiento del paciente en diálisis, con objeto de mantener los niveles plasmáticos de oxalato por debajo de 30 μmol/L, es una buena opción terapéutica hasta implantar el injerto renal y en el momento actual puede ser la mejor opción de tratamiento en pacientes con HOP [87].
El trasplante hepático de donante vivo preventivo es una opción posible en algunos pacientes seleccionados con hiperoxaluria primaria tipo I [86], pero no hay acuerdo en determinar cuál es el momento adecuado debido a la evolución variable de los mismos; en este sentido, aquellos pacientes con diagnóstico temprano y mutaciones que asocian disminución de la actividad enzimática y por tanto nefrocalcinosis y disminución temprana del filtrado glomerular, el trasplante hepático preventivo podría realizarse con el filtrado glomerular situado entre 40 y 60 ml/min/1,73 m2 87. Este dato es muy controvertido [81] [82].
3.6. Técnica de depuración extrarrenal pretrasplante
El aclaramiento peritoneal de oxalato es ineficiente, por lo que la modalidad de elección es la hemodiálisis intensiva diaria aislada o asociada a diálisis peritoneal [88] [98]. En cualquier caso, nunca se llega a depurar la producción hepática endógena. El uso exclusivo de diálisis peritoneal no es efectivo para conseguir el control de los niveles de oxalato plasmático por debajo de 30 μmol/L (punto de sobresaturación plasmática) y de esa manera evitar afectación de otros órganos, debiendo combinarse con hemodiálisis diaria [89]. La diálisis debe iniciarse con filtrados entre 20-30 ml/min/1,73 m2 para evitar depósito tisular de oxalato. En cualquier caso, se debe planificar la modalidad depurativa en función de los niveles de oxalato plasmático, oxalato corporal total estimado, edad, tiempo previsto de espera en lista y las necesidades logísticas y sociales [90] [98].
3.7. Cuidados peritrasplante
La nefrectomía de los riñones propios en el momento del trasplante combinado hígado-riñón en pacientes pediátricos con hiperoxaluria primaria tipo I es segura y reduce los depósitos de oxalato [91] [98].
En pacientes con HOP 1 se debe continuar terapia continua de reemplazo renal tras el trasplante en aquellos pacientes con oxalosis para remover el oxalato manteniéndolo con niveles plasmáticos inferiores a 30 μmol/l) [92] [98].
3.8. ¿Los futuros tratamientos basados en bloqueos enzimáticos (Lumasiran) pueden cambiar los esquemas terapéuticos?
Aunque el trasplante hepático preventivo continúa siendo la mejor opción terapéutica para prevenir los depósitos de oxálico en el injerto renal en pacientes con HOP y fallo renal antes de sufrir una oxalosis sistémica, la reciente aprobación en algunos países y los ensayos clínicos todavía abiertos del fármaco Lumasiran podrían modificar al menos en parte las estrategias terapéuticas destinadas a evitar esta complicación.
Lumasiran es un fármaco designado como huérfano, autorizado mediante proceso centralizado, que obtuvo la opinión positiva del Comité de Medicamentos de Uso Humano (CHMP) de la Agencia Reguladora Europea (EMA) en octubre de 2020
Lumasiran (Oxlumo®) es un ácido ribonucleico pequeño de interferencia (ARNip) bicatenario, que reduce los niveles de una enzima, la glicolato oxidasa (GO), al dirigirse al ácido ribonucleico mensajero (ARNm) del gen hidroxiácido oxidasa 1 (HAO1) en los hepatocitos mediante interferencia del ARN. La disminución en los niveles de la enzima GO reduce la cantidad de glioxilato disponible, el cual es un sustrato de la producción de oxalato. Esto se traduce en la reducción de los niveles de oxalato en orina y en plasma, lo que representa la causa subyacente de las manifestaciones de la enfermedad en pacientes con HP-1. Dado que la enzima GO está por encima (upstream) de la AGT deficiente, causante de la HP-1, el mecanismo de acción de lumasiran es independiente de la mutación del gen AGXT subyacente.
Debemos considerar que este tratamiento no va dirigido a corregir el defecto normal del gen, sino que se trata de una estrategia de reducción del sustrato, evitando el desvío metabólico a la síntesis de oxalato enzimático de la AGT.
Lumasiran (Oxlumo®) ha sido autorizado para el tratamiento de la HOP-1 en todos los grupos de edad. Existen tres ensayos clínicos todavía abiertos, de ellos ILLUMINATE A e ILLUMINATE B reducen la concentración urinaria de oxalato y los niveles plasmáticos y la mitad de los pacientes consiguen niveles normales de oxalato con el tratamiento.
El ensayo en desarrollo ILLUMINATE-C pretende establecer la eficacia y seguridad de lumasiran en pacientes con HP-1 con enfermedad renal grave. Los tres ensayos vigentes pretenden con un mayor periodo de seguimiento establecer el efecto del tratamiento, nivel de eficacia y seguridad a largo plazo.
Teniendo en cuenta los limitados resultados disponibles, hasta el momento procedentes de ensayos clínicos aún no finalizados, lumasiran se podría considerar una opción terapéutica en pacientes con HP-1 leve o moderada que no hayan recibido un trasplante y no respondan a los tratamientos habitualmente utilizados en la práctica clínica (hiperhidratación, piridoxina e inhibidores de la cristalización).
En espera de nuevos ensayos clínicos en candidatos a trasplante renal, trasplante hepático aislado y trasplante combinado hepático y renal no podemos concluir en el momento actual su utilidad en estas situaciones.
4. RECIDIVA DE LA AMILOIDOSIS EN EL TRASPLANTE RENAL
Véase Amiloidosis. Nefrología al Día
Véase Atlas de Histología de Amiloidosis. Nefrología al Día
4.1. Amiloidosis: Introducción
Las amiloidosis son un grupo poco común de enfermedades caracterizadas por el depósito extracelular de fibrillas insolubles, que resulta del plegamiento anormal de proteínas. La amiloidosis puede ser localizada o sistémica y puede afectar a cualquier órgano. Los depósitos de amiloide son tinción rojo Congo positivo y muestran una birrefringencia verde manzana cuando se ven bajo luz polarizada. El riñón es el órgano más comúnmente afectado en la amiloidosis sistémica. Los dos tipos más comunes de amiloidosis renal son la amiloidosis derivada de cadenas ligeras (AL) de inmunoglobulina y la amiloidosis reactiva o secundaria (AA); además, hay varias formas hereditarias raras como las derivadas de la transtiretina, entre otras, que también pueden afectar el riñón.
4.2. Amiloidosis y trasplante renal
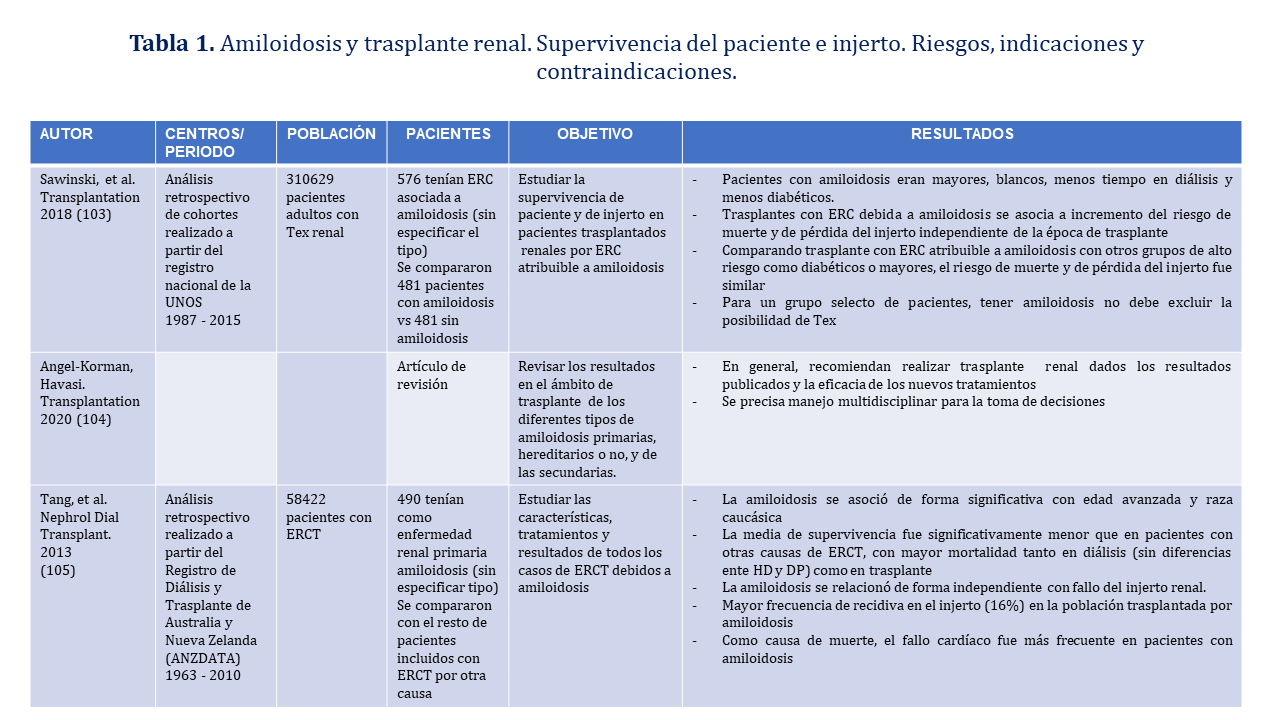
Los pacientes con amiloidosis que reciben un trasplante renal tienen edad más avanzada y predomina porcentualmente la raza caucásica. La enfermedad renal terminal debida a amiloidosis se asocia a un incremento del riesgo de muerte tanto en diálisis como en trasplante, así como de pérdida del injerto renal independiente de la época de trasplante.
En pacientes trasplantados renales con amiloidosis el riesgo de muerte atribuible a la amiloidosis, así como la de pérdida del injerto es similar a otros grupos de alto riesgo como diabéticos o de edad avanzada. La frecuencia de recidiva en el injerto es de un 16%. La causa de muerte más frecuente en pacientes con amiloidosis y trasplante renal es el fallo cardíaco. No se debe excluir la posibilidad de trasplante renal en estos pacientes (recomendación débil), pero la toma de decisiones requiere manejo multidisciplinar. La (Tabla 1) muestra las escasas referencias bibliográficas relacionadas con la recidiva de la amiloidosis en el injerto.
4.3. Amiloidosis AL y trasplante renal
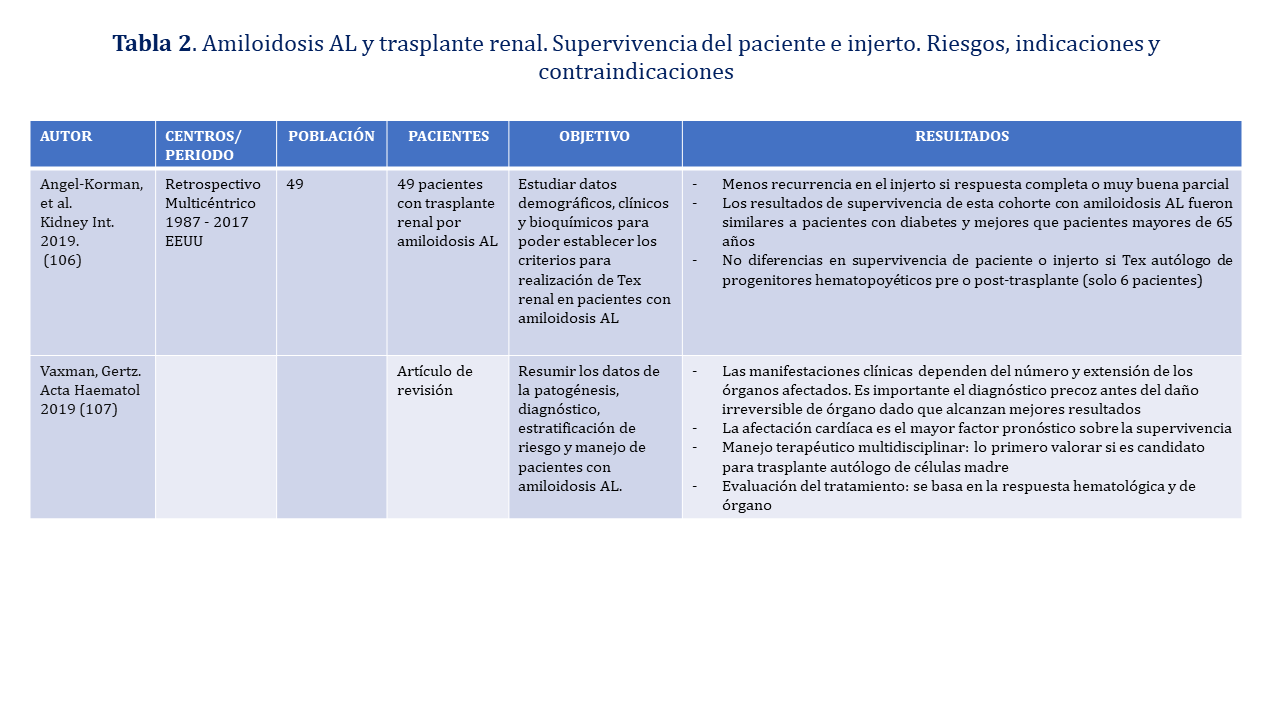
Las manifestaciones clínicas de la amiloidosis AL dependen del número y extensión de los órganos afectados y es importante el diagnóstico precoz. El grado de afectación cardíaca es el factor pronóstico más relevante sobre la supervivencia.
El trasplante renal debe considerarse especialmente para pacientes con amiloidosis AL que hubieran tenido respuesta completa o muy buena previa al tratamiento (Recomendación Débil). Es importante el seguimiento multidisciplinar para la toma de decisiones y el tratamiento (Recomendación Débil). La (Tabla 2) desarrolla la escasa bibliografía que existe al respecto.
4.4. Amiloidosis AA y trasplante renal
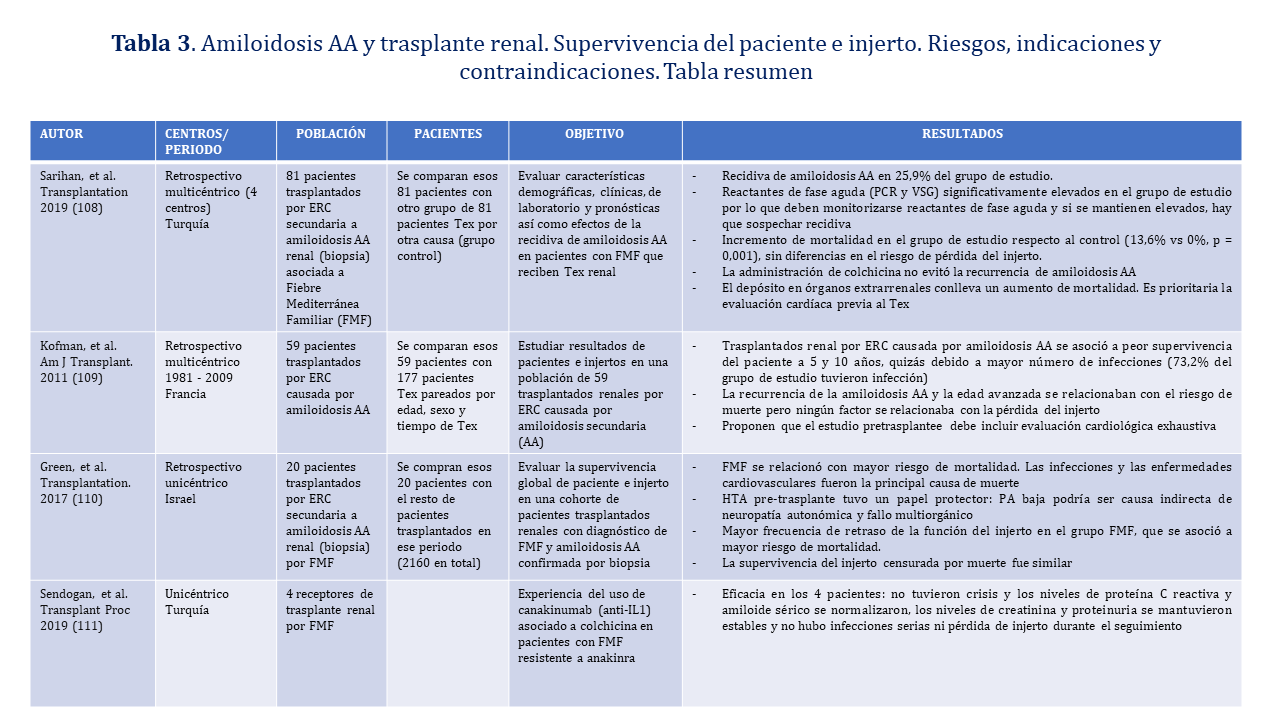
El trasplante renal en pacientes con amiloidosis secundaria a amiloidosis AA se asocia a peor supervivencia del paciente posiblemente por mayor número de infecciones. No parece haber menor supervivencia del injerto censurada por muerte. La recidiva es frecuente si está asociada a fiebre mediterránea familiar (FMF) y se ha relacionado con menor supervivencia del paciente. La recidiva en el injerto es frecuente y la administración de colchicina no parece evitarla
Deben monitorizarse los reactantes de fase aguda como la proteína C reactiva (PCR) y la velocidad de sedimentación (VSG) y si se mantienen elevados, hay que sospechar o descartar recidiva (Recomendación Fuerte). El estudio previo al trasplante debe incluir una evaluación cardiológica exhaustiva (Recomendación Débil). El uso de Canakinumab (anti-IL1) asociado a colchicina está recomendado en pacientes con FMF resistente a Anakinra ya que en el único estudio evaluado los pacientes no presentaron crisis, los niveles PCR y amiloide sérico se normalizaron, los niveles de creatinina y proteinuria se mantuvieron estables y no hubo infecciones serias ni pérdida de injerto durante el seguimiento (Recomendación muy débil debido a que se basa en un estudio con 4 pacientes). La (Tabla 3) resume la bibliografía existente en la recidiva de la amiloidosis AA en el trasplante renal.
4.5. Amiloidosis hereditaria por transtiretina (ATTR)
La afectación renal en ATTR no se correlaciona con edad, duración de la enfermedad o gravedad de la neuropatía, pero sí con más depósitos de amiloide en glomérulo, arteriolas y vasos medianos. La presentación clínica inicial de la neuropatía es variada, lo que retrasa el diagnóstico. El estudio genético permite descartarla y debería realizarse precozmente (Recomendación Muy Débil). La afectación cardíaca debe ser estudiada porque está presente en 50% de los pacientes (Recomendación Muy Débil)
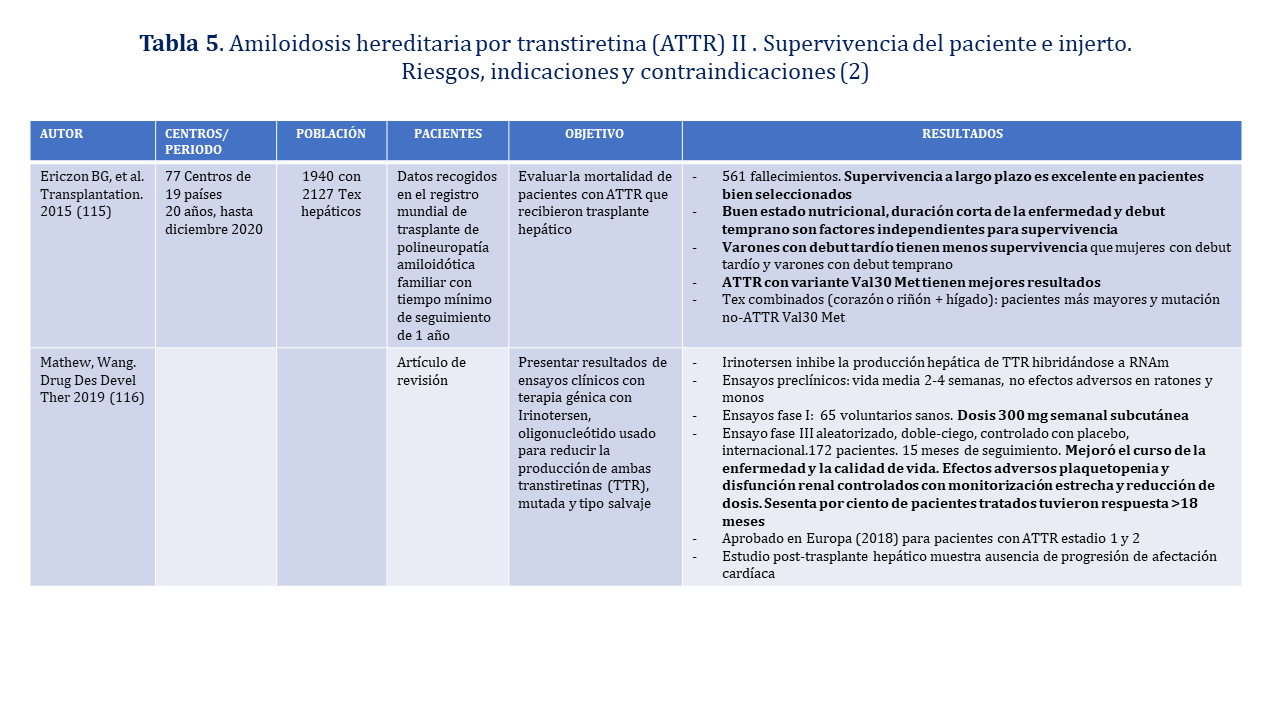
El trasplante hepático es eficaz consiguiendo una supervivencia a largo plazo excelente, en especial, si existe un buen estado nutricional y una duración corta de la enfermedad con debut temprano. Los varones con debut tardío tienen menor supervivencia que las mujeres con debut tardío y los varones con debut temprano. La variante Val30Met tiene mejores resultados; de tal forma que en estos casos se podría recomendar la realización de un trasplante hepático. (Recomendación Débil). Asimismo, el trasplante combinado hepático y renal se debe considerar como una opción terapéutica en algunos casos por evitar la recurrencia (Recomendación Débil/Muy Débil). No está recomendado el uso de hígado de estos pacientes para otros receptores (trasplante dominó) por el riesgo de desarrollar la enfermedad de novo (Recomendación Muy Débil)
Además del trasplante hepático, existen varios tratamientos; entre ellos estabilizadores de TTR y terapias de silenciamiento génico. La mayoría de las pacientes pueden beneficiarse de un tratamiento independientemente del estadio de la enfermedad (Recomendación Muy Débil). La (Tabla 4) y la (Tabla 5) recogen la bibliografía existente de la recidiva en el trasplante renal de la amiloidosis hereditaria por transtiretina.
4.6. Amiloidosis por factor quimiotáctico de leucocitos 2 (ALECT2)
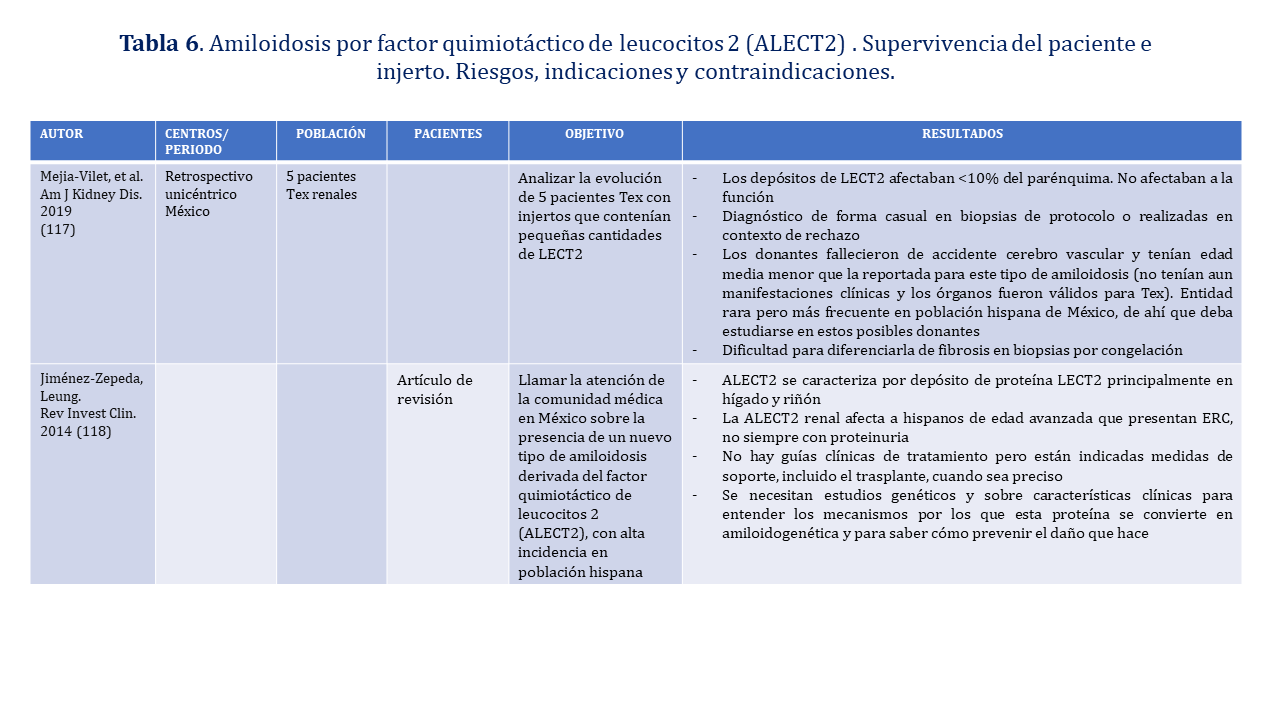
Debemos considerar la posibilidad de que injertos procedentes de donantes mexicanos podrían tener ALECT2 y que es difícil diferenciar los depósitos de LECT2 de la fibrosis en las biopsias por congelación por lo que podría ser conveniente estudiar a este tipo de donantes (Recomendación Muy Débil); en cualquier caso, si los depósitos no son importantes parecen no afectar al funcionamiento del órgano
ALECT2 renal afecta a hispanos de edad avanzada que presentan ERC y no siempre con proteinuria. No hay guías clínicas de tratamiento, pero están indicadas medidas de soporte, incluido el trasplante, cuando sea preciso (Recomendación Muy Débil). La (Tabla 6) muestra la bibliografía existente en el trasplante renal en receptores con ALECT2.
4.7. Otros tipos de amiloidosis
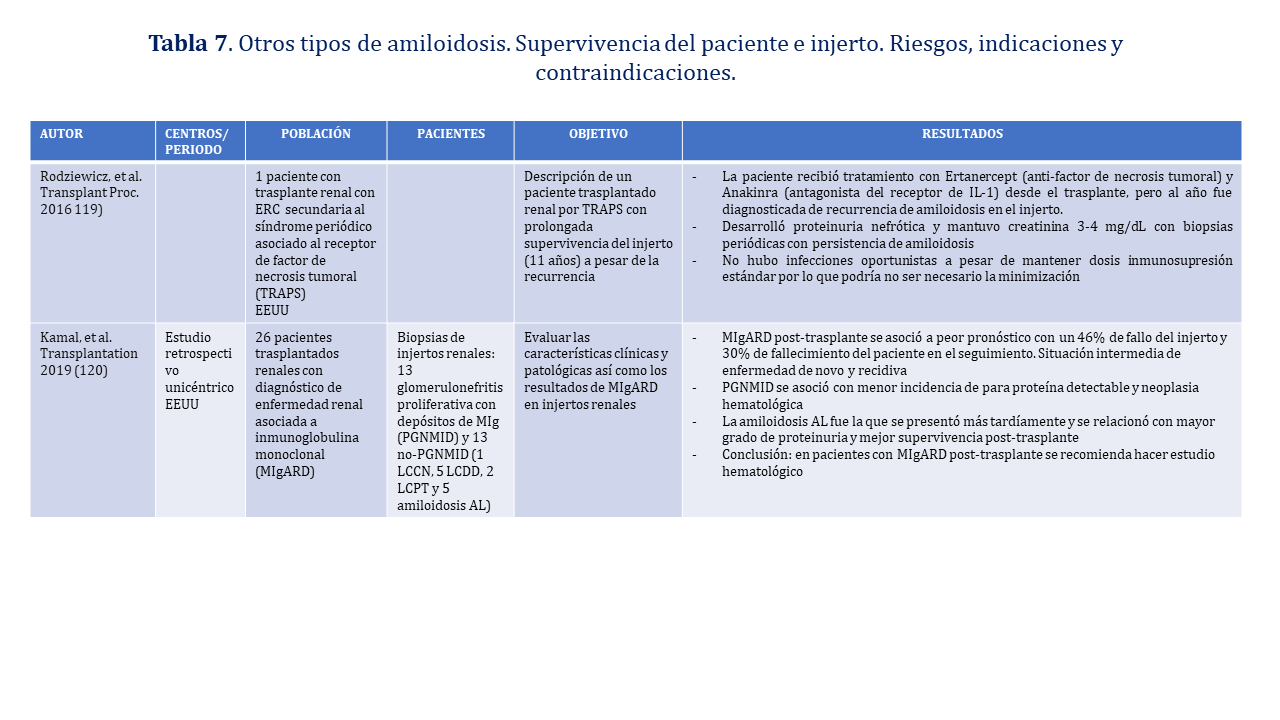
El trasplante renal podría ser una opción en pacientes con síndrome periódico asociado al receptor de factor de necrosis tumoral (TRAPS) por su buena supervivencia a pesar de la recurrencia (Recomendación Muy Débil por basarse en un caso)
En pacientes con diagnóstico de enfermedad renal asociada a inmunoglobulina monoclonal (MIgARD) en los injertos renales se debe hacer estudio hematológico (Recomendación Débil). La (Tabla 7) resume los trabajos publicados en receptores de trasplantes renales con este tipo de amiloidosis.
4.8. Trastornos de células plasmáticas postrasplante renal
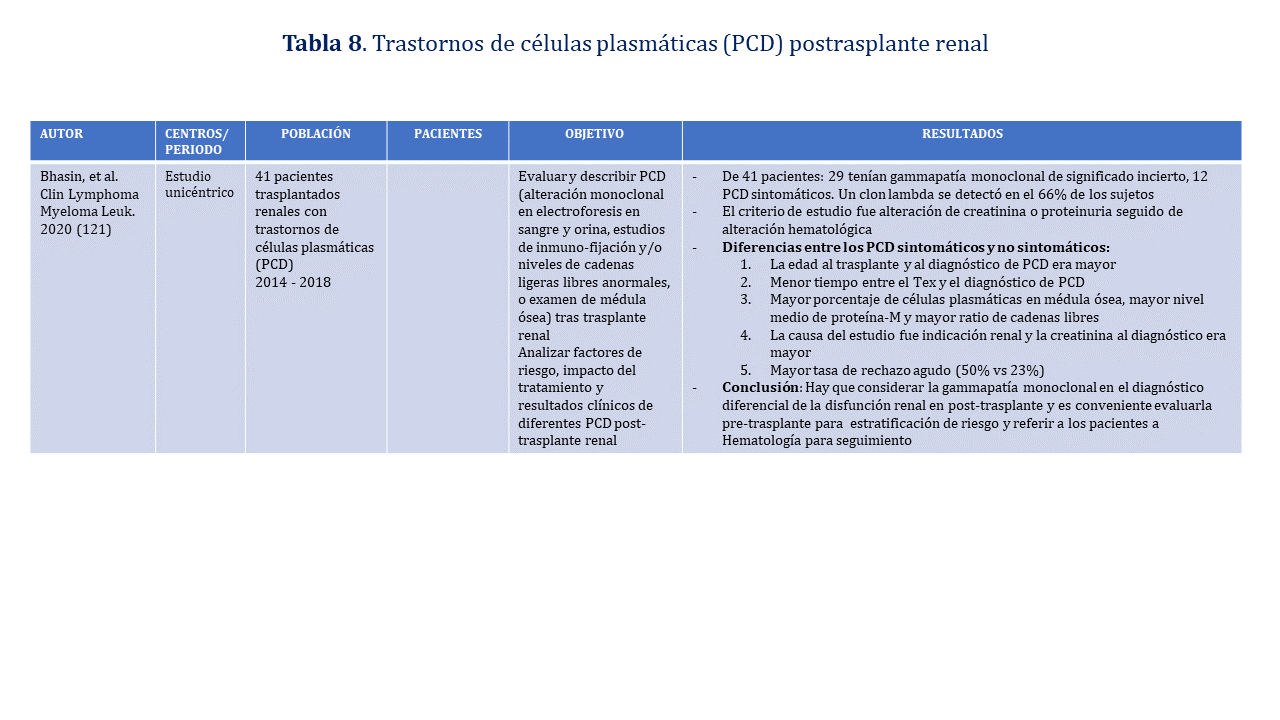
Se debe considerar la gammapatía monoclonal en el diagnóstico diferencial de la disfunción renal postrasplante, y es conveniente, además, su evaluación pretrasplante para realizar la estratificación de riesgo y referir a los pacientes a Hematología para su seguimiento (Recomendación Muy Débil) (Tabla 8).
5. RECIDIVA EN EL TRASPLANTE RENAL DE LAS GLOMERULONEFRITIS FIBRILAR NO AMILOIDE E INMUNOTACTOIDE
5.1. Introducción y conceptos
Estas complejas enfermedades con escasa incidencia, y difícil diagnóstico, tienen además difícil manejo clínico tanto la entidad primaria como su recidiva en el trasplante. La mayoría de las publicaciones suelen ser series de casos por lo que su evidencia es escasa.
La glomerulonefritis fibrilar (GF) es una enfermedad glomerular idiopática caracterizada por fibrillas, Rojo Congo negativas, dispuestas al azar con un diámetro medio de 20 nm. Los depósitos glomerulares están compuestos predominantemente por IgG policlonal y C3 [122] (evidencia moderada).
La glomerulonefritis inmunotactoide (GIT) se define por el depósito glomerular de microtúbulos generalmente más grandes que están compuestos de IgG monoclonal en la mayoría de los casos [122] (evidencia moderada).
Aunque la presentación de la GF y GIT es similar, los pacientes con GIT con más frecuencia presentan disproteinemia, hipocomplementemia y crioglobulinemia oculta [122] (evidencia moderada).
Dadas las diferencias clínicas e inmunopatológicas y sus implicaciones para el manejo del paciente, debe considerarse a la glomerulonefritis fibrilar y a la inmunotactoide como dos entidades diferentes [122] (evidencia moderada).
La edad de presentación varía ampliamente en los pacientes con ambas entidades [123] aunque con predominio en la sexta década de la vida [124] [125].
Los pacientes con GF son preferentemente mujeres (66%) [123] [124] [125] y los pacientes con GIT, varones [123]. Tanto la GF como la GIT son nueve veces más frecuente en caucásicos que en negros [124] [125] (evidencia alta).
Ambas enfermedades se caracterizan por presentar proteinuria en rango nefrótico, hematuria e insuficiencia renal que con frecuencia progresa a enfermedad renal crónica terminal. La GF se suele asociar con trastornos linfoproliferativos subyacentes, enfermedades autoinmunes, disproteinemia, gammapatía monoclonal o crioglobulinemia oculta [124] (evidencia alta).
5.2. Anatomía patológica
El patrón histológico más común es el de glomerulonefritis mesangial (21-78%) seguido de la membranoproliferativo (11%-56% de los casos), membranoso (0-19%) o proliferativo endocapilar (0-15%); la proliferación extracapilar es rara (4-6%). La tinción Rojo Congo es negativa [124][125] (evidencia alta).
La inmunofluorescencia muestra una intensa positividad en los capilares mesangiales y glomerulares de IgG policlonal predominante, normalmente acompañada de C3; cadenas kappa, lambda, y ocasionalmente C1q, IgM y/o IgA (menos común y menos intenso). En un 5% de los casos hay restricción de las de cadenas ligeras, lo que sugiere depósitos de tipo monoclonal. Solo una pequeña minoría (3% -15%) muestran depósitos monotípicos (IgG4) [124][125] (evidencia alta).
La microscopía electrónica muestra depósitos fibrilares de orientación desordenada con un diámetro medio de 20 nm (12-24 nm), presentes en el mesangio y lámina densa de la membrana basal glomerular [124][125]. DNAJB9 se ha confirmado como un excelente biomarcador inmunohistoquímico de la glomerulonefritis fibrilar; con una sensibilidad del 98% y una especificidad del 99% [126] (evidencia alta). La positividad de DNAJB9 se caracteriza por una fuerte tinción extracelular glomerular, mesangial y en las paredes capilares glomerulares, que corresponde a tinción de inmunofluorescencia de IgG e IgG4 [124].
5.3. Tratamiento y Pronóstico
No existe una terapia curativa [124] (evidencia alta) Y aunque no existen ensayos clínicos controlados los inmunosupresores utilizados: esteroides, ciclofosfamida, ciclosporina y micofenolato mofetil, no frenan la progresión [124]. Existen resultados contradictorios con rituximab, obteniendo mejor respuesta con inicio precoz y buena función renal [124] [125].
La prevalencia en enfermedad renal terminal de ambas entidades es de un 0.12% [124] (evidencia alta) y la tasa de mortalidad es del 2 al 38%. La supervivencia en diálisis es comparable a otras causas de enfermedad renal, aunque puede ser inferior en aquellos con GIT [124] [127] (evidencia alta). La GF progresa en un 50% a la enfermedad renal terminal a los 4 años [124] (evidencia alta). Son predictores de progresión: la edad avanzada, la función renal y la proteinuria al diagnóstico y la histología, así el patrón glomerular (membranoproliferativo versus patrón mesangial) y grado de esclerosis glomerular y fibrosis intersticial empeoran el pronóstico.
El trasplante renal parece eficaz y seguro tanto en ambas enfermedades [127].
5.4. Recidiva en el trasplante renal de la glomerulonefritis fibrilar no amiloide
Aunque la tasa de recurrencia de la GF en trasplantes renales no es despreciable: 21% [128]-50% [125]; la enfermedad recurrente tiene un curso relativamente benigno y es posible una supervivencia prolongada del injerto, incluso similar al grupo global de trasplantados renales [123] [125] [128] (Evidencia alta). La recurrencia es silente, habitualmente con función renal estable, mínima proteinuria y sin hematuria [129]. La recurrencia histológica aparece más allá de los 5 años postrasplante [129]. Se ha demostrado la utilidad de la tinción de inmunoperoxidasa de DNAJB9 para el diagnóstico de la recidiva [126] [129] (Evidencia alta).
5.5. Recidiva de glomerulonefritis inmunotactoide
La recurrencia de la GIT puede ser muy frecuente y precoz. La expresión clínica es similar a la enfermedad en riñón nativo, con curso algo más benévolo. El Rituximab podría ser eficaz en el tratamiento de la recurrencia [128] (evidencia baja).
6. RECURRENCIA EN EL TRASPLANTE RENAL DE LA ENFERMEDAD POR DEPÓSITO DE CADENAS LIGERAS
La Enfermedad por depósito de Cadenas Ligeras pertenece al grupo de lesiones asociadas a la gammapatía monoclonal de Significado Renal [130]. Previamente al reconocimiento este hecho, la mayor parte de los pacientes no fueron tratados adecuadamente pretrasplante en el control de la clona celular causante. En estos pacientes, los resultados del trasplante renal fueron muy desfavorables, tanto en cuanto tasas de recurrencia, como en la supervivencia de injerto y paciente [131] [132] [133] [134].
Tras la introducción de tratamientos previos al trasplante y dirigidos frente a la clona monoclonal de las células hematológicas causante de la entidad, los resultados son más favorables [135]. (Recomendación fuerte).
Pese a un adecuado tratamiento de la cepa monoclonal y de la producción de la proteína monoclonal pretrasplante, el riesgo de recurrencia de la enfermedad y de pérdida del injerto es importante y la supervivencia de los pacientes a largo plazo esta reducida [131] [132] [133] [134] [135] (Recomendación fuerte).
El tratamiento de la recurrencia postrasplante puede ser eficaz, pero posiblemente se asocia a tasas elevadas de morbilidad y mortalidad [130] [134] [137] (Recomendación débil).
6.1. Tasa de recurrencia, y supervivencia de injertos y pacientes
La tasa de recurrencia y de supervivencia de injerto y paciente es la siguiente [131] [132] [133] [134] [135]:
• Pacientes no tratados pretrasplante (n=9; seguimiento medio de 60 meses, 35-117): 89% presentaron recurrencia histológica con tiempo medio de seguimiento de 20 meses post trasplante, 67% perdieron el injerto y 44% fallecieron.
• Pacientes tratados pretrasplante (n=10; seguimiento medio de 70 meses): 30% presentaron recurrencia histológica con tiempo medio de seguimiento de 46 meses postrasplante; adicionalmente 20% presentaron recurrencia hematológica; 20% perdieron el injerto y 20% fallecieron.
• El dato más interesante es que en los pacientes tratados y que alcanzan una respuesta completa pretrasplante, no hubo ningún fallecimiento y solo se produjo una pérdida tardía del injerto.
6.2. Tratamiento de la recidiva de la enfermedad por cadenas ligeras en el trasplante renal
En casos aislados, se han utilizado con éxito tanto el tratamiento con Rituximab [130] [131] [132] como con Bortezomib [133], además de otros dirigidos a la clona celular, generalmente en regímenes de tratamiento combinado que no permiten discriminar el beneficio de un fármaco aislado. El tratamiento parece conllevar morbilidad y mortalidad significativa
6.3. Recomendaciones finales
Los pacientes con Enfermedad por depósito de Cadenas Ligeras deben acceder al trasplante renal tras un tratamiento dirigido al control de la clona celular causante de la enfermedad, y preferiblemente habiendo alcanzado criterios de respuesta completa (Recomendación fuerte)
Se recomienda la monitorización periódica de proteína M postrasplante dado que el riesgo de recurrencia de la enfermedad y de pérdida del injerto es importante (Recomendación fuerte)
Se recomienda el tratamiento de la recurrencia postrasplante. La selección del mejor tratamiento debe tener en cuenta la evaluación de su potencial morbilidad y mortalidad (Recomendación débil)