Diagnóstico y tratamiento de la Recidiva de la Glomerulonefrtis membrano-proliferativa por Inmunocomplejo Idiopática y Glomerulopatía C3
Palabras clave
Glomerulonefrtis membrano-proliferativa por Inmunocomplejo Idiopática, Glomerulopatía C3
Irina B. Torres1, Joana Sellarés1, Vanesa Becerra2, Sheila Cabello3, Natividad Calvo4, Roberto Gallego5, Isidoro García-Escribano6, Verónica López7, Manuel Macía8, Anna Manonelles 9, Domingo Marrero 10, Marisa Martín11, Elena Monfa 12, Mónica Pérez 13, Mª Luisa Rodríguez-Ferrero14, Alberto Rodríguez-Benot15, Beatriz Sánchez16, Laura Salanova 17, Sofía Zárraga18
1Hospital Universitario Vall d’Hebrón. Barcelona
2Complejo Hospitalario Universitario Santiago. Santiago de Compostela.
3Hospital Son Espasas. Palma de Mallorca
4Hospital Clínico San Carlos. Madrid
5Hospital Universitario de Gran Canaria. Dr Negrín. Las Palmas de Gran Canaria
6Hospital Universitario Miguel Servet. Zaragoza
7Hospital Regional Universitario de Málaga. Málaga
8Hospital Universitario Nuestra Señora de Candelaria. Santa Cruz de Tenerife
9Hospital Universitario de Bellvitge. Barcelona
10Hospital Universitario de Canarias. Santa Cruz de Tenerife
11Hospital Universitario Arnau de Vilanova. Lleida
12Complejo Asistencial Universitario de León. León
13Fundación Puigvert. Barcelona
14Hospital General Universitario Gregorio Marañón. Madrid
15Hospital Universitario Reina Sofía. Córdoba
16Hospital Universitario Fundación Alcorcón. Madrid
17Hospital Universitario de La Princesa. Madrid
18Hospital Universitario de Cruces. Barakaldo
La recidiva de la GN se asocia con una disminución de la supervivencia del injerto con un riesgo de pérdida del mismo de alrededor del 50% entre los receptores que presentaron enfermedad glomerular recurrente. La glomerulonefritis recurrente es la cuarta causa de pérdida del injerto después del rechazo agudo, el rechazo crónico y la muerte con injerto funcionante. La tasa de pérdida del aloinjerto notificadas y atribuidas a la recurrencia de la enfermedad varían entre el 7% y el 55% a nivel internacional en relación al tiempo de seguimiento.
Los datos del registro ANZDATA han reportado que la supervivencia del injerto de los pacientes con GNMP recurrente presentaron peores resultados en comparación con otros tipos de GN, siendo la supervivencia del injerto a los 5 años del 30% para los receptores con GNMP recurrente en comparación con el 57%, 58% y 59% de los receptores con FSGS, Nefropatía IgA y nefropatía membranosa respectivamente [1].
Clasificación de la Gomerulonefritis membranoproliferativa (GNMP)
La Glomerulonefritis membranoproliferativa, también conocida como glomerulonefritis mesangiocapilar, es un patrón de lesión glomerular observado en biopsias renales, con cambios característicos al microscopio óptico caracterizados por hipercelularidad mesangial, proliferación endocapilar y reduplicación de la membrana basal glomerular (MBG) [2].
Desde 2011 se ha propuesto una clasificación basada en los hallazgos de la inmunofluorescencia [3] [4] que divide a la GNMP en 1. Glomerulopatía C3 (C3G), caracterizado por depósito glomerular dominante de C3 (al menos dos órdenes de intensidad más fuerte que cualquier otro reactivo inmunitario) y mínimo o ningún depósito de inmunoglobulina (Ig) y 2. GNMP asociada a inmunocomplejos (GNMP-IC) con depósito glomerular de complemento e Ig.
En base a la microscopía electrónica, la C3G puede clasificarse adicionalmente como enfermedad de depósito denso (DDD) caracterizada por depósitos altamente electrodensos en la MBG, y glomerulonefritis C3 (C3GN) con depósitos mesangiales, subendoteliales, subepiteliales e intramembranosos, pero sin los típicos depósitos electrodensos de DDD.
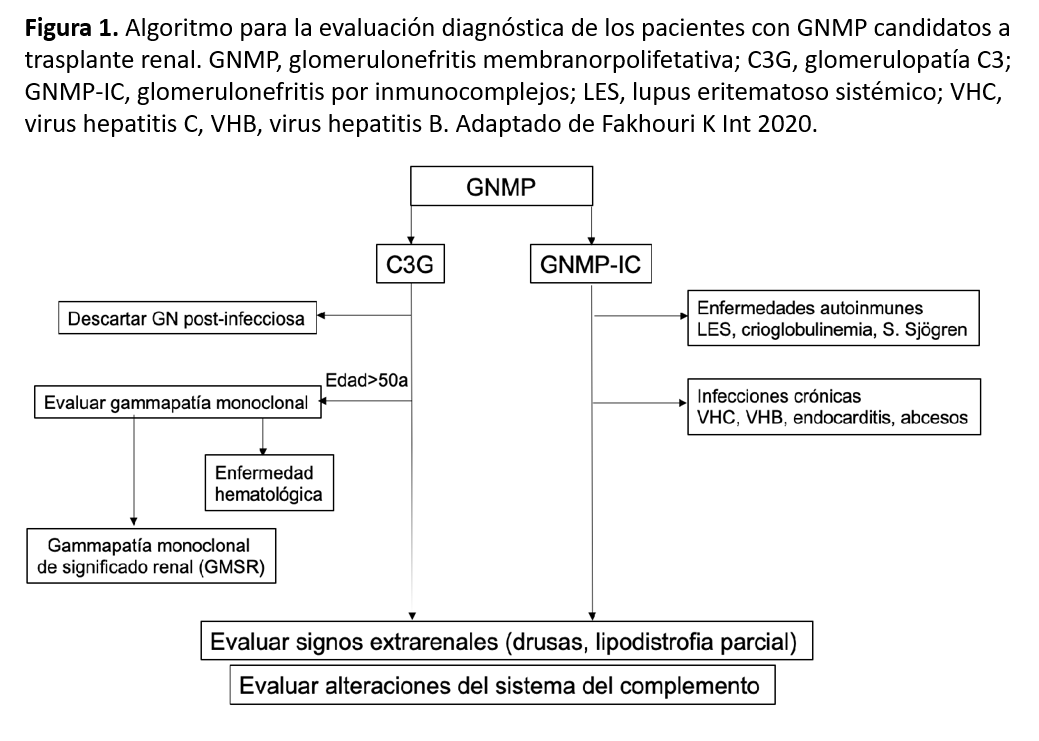
Se ha propuesto un algoritmo de evaluación clínica detallada que permitiría identificar la causa subyacente de estas dos entidades (C3G y GNMP-IC). Las GN asociadas a infecciones y las discrasias de células sanguíneas deberían ser descartadas en pacientes con C3G, mientras que enfermedades autoinmunes, infecciones crónicas, cirrosis hepática y anemia falciforme deberían ser descartadas en pacientes con GNMP-IC [5].
Las gammapatías monoclonales pueden estar asociadas tanto a C3G como a GNMP-IC y deben descartarse especialmente en adultos [6].
Cuando se ha descartado las infecciones crónicas, las enfermedades autoinmunes, la enfermedad renal asociada a paraproteínas y la causa subyacente no ha sido identificado, la C3G y la GNMP-IC se consideran primarias o idiopáticas. Ambas, son entidades infrecuentes, con una prevalencia estimada de 1.2 a 1.6 por millón de habitantes en Europa. El cuadro clínico tiene un espectro de presentación variable, desde hematuria microscópica asintomática y/o proteinuria, hasta síndrome nefrítico o síndrome nefrótico e insuficiencia renal con evolución a un mal pronóstico. Los factores pronósticos más importantes, observados en adultos como en niños, son el síndrome nefrótico al debut de la enfermedad y la presencia de glomeruloesclerosis y semilunas en la biopsia renal [7]. El riesgo de ERCT es similar para C3G y GNMP-IC (4%-41% vs 9%-41%) con un elevado riesgo de recurrencia en el injerto. La incidencia de recurrencia en el post trasplante renal ha sido reportada en pacientes con C3G (60-86%)(8)(9)(10), DDD (55 a 86%) [8] [9] y GNMP-IC (42 a 53%) [8] [9] [11] y se asocia a un elevado índice de pérdida del injerto (34-43% en GNMP-IC y 67–70% en C3G).
Estudios complementarios para inclusión en lista de espera de Trasplante renal en pacientes con GNMP.
En pacientes con diagnóstico histológico de C3G o GNMP-IC idiopática es recomendable el estudio de complemento y evaluación de proteinograma antes de su inclusión en lista de espera de trasplante renal. Las razones para realizar un estudio exhaustivo y evaluar la posibilidad de una gammapatía monoclonal asociada a la C3G, recae en la necesidad de evaluar los factores de riesgo de recidiva, las posibilidades de tratamiento durante el postrasplante y establecer un pronóstico. Se ha demostrado una incidencia entre el 59 y el 65% de gammapatía monoclonal en pacientes mayores de 50 años con C3G [5].
A continuación, se describen los estudios dirigidos a la evaluación del complemento:
1- Evaluación bioquímica de la vía alternativa del complemento.
• Niveles de C3 y C4, niveles AH50 y CH50.
• Niveles de sC5b-9, CFH, CFB, C5
2. Estudio de autoanticuerpos dirigidos a las proteínas activadoras o reguladoras del complemento
• C3Nef, Ac. anti-FH, Ac Anti-FB y C5Nef.
3. Estudio de variantes en los genes que codifican proteínas que controlan la activación de la C3 convertasa (25% de los casos de C3G)
En la (Figura 1) se propone un algoritmo para la evaluación diagnóstica de los pacientes con GNMP candidatos a trasplante renal.
Limitaciones del estudio del complemento
Un estudio normal del complemento no descarta C3G o GNMP-IC clínica y patológicamente activos. La interacción de los autoanticuerpos con el sistema del complemento está bien documentada in vitro, pero la patogenicidad de estos autoanticuerpos no está bien definida en la clínica.
Los títulos de C3Nef pueden ser variables a lo largo del tiempo y pueden volverse negativos después del inicio de diálisis y no se correlacionan con la evolución clínica de la enfermedad. Los anticuerpos anti-Factor H son detectados en menos del 5% de pacientes con C3G. No se han descrito biomarcadores del sistema de complemento que puedan predecir el pronóstico de C3G y GNMP-Ig. Finalmente, las variantes genéticas de las proteínas reguladoras del complemento se detectan en una minoría de pacientes con C3G y GNMP y en general, el conductor genético no es predominante en la patogenia de estas enfermedades [5].
Factores de riesgo asociados a la recidiva de la GNMP
En estudios retrospectivos se han identificado factores asociados a la recurrencia de la enfermedad que incluyen niveles bajos de C3 al momento del trasplante, la presencia de glomerulonefritis con proliferación extracapilar en riñón nativo, la presencia de una proteína monoclonal, el donante genéticamente relacionado y el trasplante preventivo [12] [9] [13].
La recidiva en el trasplante renal de C3G y GNMP-Ig ocurre a pesar del tratamiento inmunosupresor lo que va en contra del efecto de los agentes inmunosupresores sobre el conductor primario de la C3G y GNMP-Ig. Esto también implica que las opciones terapéuticas sean más limitadas en trasplante renal comparado a pacientes con enfermedad en riñón nativo.
No todas las recurrencias de C3G y GNMP-Ig son clínicamente relevantes y necesariamente conducen a pérdida del injerto, particularmente aquellas diagnosticadas en biopsias de protocolo [9]. Además, C3G y GNMP-Ig pueden coexistir en biopsias de injerto con otras causas de disfunción, principalmente rechazo humoral crónico y microangiopatía trombótica [8] [10].
La utilidad clínica de las biopsias de injerto renal en pacientes trasplantados con C3G y GNMP-Ig es incierta ya que, si bien puede ayudar al diagnóstico de recurrencia en un estadio temprano, puede conducir a un sobre tratamiento de las recurrencias subclínicas cuando en realidad no existen datos que soporten un tratamiento eficaz [5].
Tratamiento
La monitorización postrasplante para poder implementar un tratamiento es necesaria para mejorar el pronóstico clínico. Múltiples modalidades de tratamiento han sido propuestas para C3G en riñón nativo, incluyendo micofenolato mofetil, corticoides, eculizumab, rituximab, inhibidores de calcineurina (ICN), ciclofosfamida e incluso manejo conservador [14] [15] [16]. La recidiva de C3G y GNMP-IC en trasplante renal ocurre a pesar de realizar tratamiento inmunosupresor que incluye MMF pero también inhibidores de mTOR o ICN. Esto implica que el efecto del tratamiento inmunosupresor no es eficaz sobre la causa que conduce a la patología y que las opciones terapéuticas son más limitadas [5]. Actualmente, no hay suficiente evidencia sobre los resultados del tratamiento de C3G entre los receptores de trasplante renal.
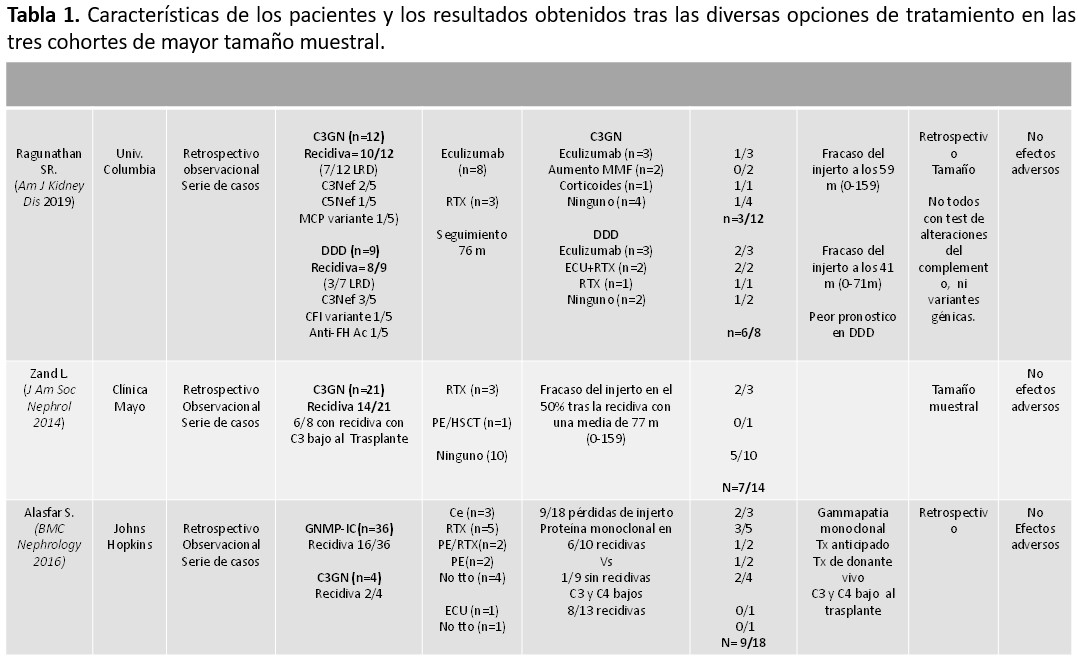
En un metaanálisis que incluyó 7 estudios de cohortes y 5 series de casos para un total de 121 pacientes se observó que los pacientes tratados con eculizumab presentaron una menor tasa de pérdida del injerto (33%) que los tratados con recambios plasmáticos (42%) o rituximab (81%) [17]. Debe tenerse en cuenta que los pacientes tratados son los que tienen un peor pronóstico, y así el grupo de pacientes no tratados tuvo una tasa de pérdida del injerto del 40%. Se ha sugerido que los niveles de sC5b9 circulantes pueden ser un marcador de respuesta al tratamiento con Eculizumab, aunque esto requiere de futuros estudios para su validación [18].
En la (Tabla 1) se presentan las características de los pacientes y los resultados obtenidos tras las diversas opciones de tratamiento en las tres cohortes de mayor tamaño muestral.
Los ensayos clínicos de Fase 2 con Iptacopan (inhibidor de Factor B de la vía alternativa del complemento) mostraron una normalización y estabilidad de los niveles de C3 y una reducción significativa de la proteinuria. En la cohorte de pacientes trasplantados renales se observó una disminución del depósito de C3 en las biopsias de injerto realizadas durante del seguimiento [19]. En la actualidad, se encuentra en fase de reclutamiento un ensayo clínico en Fase 3 (NCT04817618) aleatorizado, doble ciego y controlado con placebo para evaluar la eficacia y seguridad de este tratamiento en la C3G.
De manera similar, Pegcetacoplan, inhibidor del componente C3 del complemento y su fragmento de activación C3b ha demostrado en un ensayo clínico Fase II una reducción de la proteinuria y una estabilidad de la función renal a las 48 semanas [20].
Esto ha conducido a que en la actualidad se encuentren en fase de reclutamiento un ensayo clínico en Fase III (NCT 05067127) prospectivo, aletaorizado, doble ciego y controlado por placebo para evaluar la eficacia y seguridad de este tratamiento en la C3G y la GNMP-IC
Recomendaciones
1. En los pacientes candidatos a trasplante con ERC secundaria a GNMP-IC deben descartarse causas secundarias y debería reevaluarse la biopsia renal para identificar potenciales casos de C3G.
2. En los pacientes con diagnóstico de GNMP-IC primario y C3G se debe realizar el estudio de la vía alternativa del complemento para caracterizar el riesgo de recidiva y posibles tratamientos.
3. Se debe informar a los pacientes sobre el riesgo de recidiva.
4. En pacientes con variantes genéticas o sin causa filiada de C3G debería evitarse el trasplante de donante vivo relacionado y/o evaluar al potencial donante.
5. No hay datos suficientes sobre la eficacia del tratamiento para hacer recomendaciones generales. Sin embargo, identificar subgrupos de pacientes en función de la etiología de la C3G y GNMP-IC puede permitir una mejor predicció de la respuesta al tratamiento.
6. El tratamiento con Eculizumab ha demostrado una menor tasa de pérdida del injerto en comparación con los recambios plasmáticos y rituximab.
7. Si la presentación de la recidiva es con síndrome nefrótico y/o insuficiencia renal rápidamente progresiva recomendamos inicio de tratamiento con Eculizumab y su mantenimiento en caso de respuesta favorable.