Diagnóstico y Tratamiento de la Recidiva de la Nefropatía Membranosa y de la Nefropatía Lúpica
Irina B. Torres1, Joana Sellarés1, Vanesa Becerra2, Sheila Cabello3, Natividad Calvo4, Roberto Gallego5, Isidoro García-Escribano6, Verónica López7, Manuel Macía8, Anna Manonelles 9, Domingo Marrero 10, Marisa Martín11, Elena Monfa 12, Mónica Pérez 13, Mª Luisa Rodríguez-Ferrero14, Alberto Rodríguez-Benot15, Beatriz Sánchez16, Laura Salanova 17, Sofía Zárraga18
1Hospital Universitario Vall d’Hebrón. Barcelona
2Complejo Hospitalario Universitario Santiago. Santiago de Compostela.
3Hospital Son Espasas. Palma de Mallorca
4Hospital Clínico San Carlos. Madrid
5Hospital Universitario de Gran Canaria. Dr Negrín. Las Palmas de Gran Canaria
6Hospital Universitario Miguel Servet. Zaragoza
7Hospital Regional Universitario de Málaga. Málaga
8Hospital Universitario Nuestra Señora de Candelaria. Santa Cruz de Tenerife
9Hospital Universitario de Bellvitge. Barcelona
10Hospital Universitario de Canarias. Santa Cruz de Tenerife
11Hospital Universitario Arnau de Vilanova. Lleida
12Complejo Asistencial Universitario de León. León
13Fundación Puigvert. Barcelona
14Hospital General Universitario Gregorio Marañón. Madrid
15Hospital Universitario Reina Sofía. Córdoba
16Hospital Universitario Fundación Alcorcón. Madrid
17Hospital Universitario de La Princesa. Madrid
18Hospital Universitario de Cruces. Barakaldo
DIAGNÓSTICO Y TRATAMIENTO DE LA RECIDIVA DE LA NEFROPATÍA MEMBRANOSA
Introducción
La nefropatía membranosa (NM) es una de las causas más frecuentes de síndrome nefrótico en el adulto, siendo la mayoría de ellas primarias (80%) y el resto secundarias a causas sistémicas (como infecciones, tumores o fármacos).
Las NM primarias están causadas por autoanticuerpos dirigidos contra diferentes antígenos podocitarios. Se conoce que entre el 70-80% de las NM primarias están mediadas por anticuerpos anti-PLA2R [1], mientras que aproximadamente un 16% presentan anticuerpos contra el antígeno NELL-1 [2] y un 3-5% de casos presentan anticuerpos contra otro antígeno podocitario, THSD7A[3]. Sin tratamiento o en ausencia de respuesta al mismo, la NM progresará a una enfermedad renal terminal en un 50% de los casos a los 10-15 años de evolución [4].
En el injerto se presentará como una NM recurrente o como una NM de novo, aunque existen casos excepcionales de transmisión donante-receptor[5]. Las tasas de recurrencia descritas varían ampliamente en función del estudio analizado, con rangos de entre el 7% y el 54%, siendo más frecuente en aquellos trabajos en los que se realizan biopsias de seguimiento [6] [7] [8] [9]. En ausencia de un programa de biopsias de protocolo, la recurrencia aparecerá entre el primer y el tercer año después del trasplante, pudiendo afectar a la supervivencia del injerto a largo plazo [10] [11] [12].
Fisiopatología y presentación clínica de la nefropatía membranosa
La NM se define por la presencia de depósitos subepiteliales en forma de inmunocomplejos, que con la ayuda de la activación del complemento producirán una alteración estructural del podocito y sus diafragmas de hendidura, provocando el desarrollo de proteinuria [13] [14]. La aparición de la NM en el injerto requiere un diagnóstico diferencial entre NM recurrente o de novo. Si bien es cierto que en ambas entidades se produce mismo daño en forma de depósitos por inmunocomplejos subepiteliales, existen diferencias tanto en el mecanismo inmunológico patogénico que las produce, como en las características histológicas y su presentación clínica [15].
La NM recurrente generalmente es secundaria a autoanticuerpos anti-PLA2R [16] y en la mayoría de los casos la IgG4 es la subclase dominante en los depósitos evidenciados en la membrana basal glomerular mediante inmunofluorescencia o inmunohistoquímica (igual que en la NM primaria en riñón nativo) [17].
La etiología en la NM de novo es desconocida y está asociada a factores de riesgo tales como las infecciones (hepatitis B o C [18] [19] [20]), el cáncer, infarto renal [21], uropatía obstructiva [22] o terapias anti-VEGF [23], siendo en su gran mayoría antiPLA2R negativo [16] [24]. Se ha descrito la aparición de NM de novo asociada a rechazo humoral, cuyo origen implicaría la existencia de un mecanismo aloinmune mediado por anticuerpos donante-específico [25] [26]. Generalmente IgG1 es la subclase dominante en los depósitos [27] y desde el punto de vista histológico, la proliferación mesangial leve y la distribución focal de los depósitos subepiteliales en lugar de difusa, nos orientará a su diagnóstico [28] [29].
La presentación clínica de ambas entidades es diversa y puede ser desde asintomática hasta un síndrome nefrótico. En la NM recurrente se han descrito dos picos de incidencia, uno típicamente temprano entre los primeros 6-12 meses después del trasplante, y otro de aparición tardía, generalmente a partir del quinto año del trasplante [7] [30]. La recurrencia temprana se produce debido al depósito de autoanticuerpos ya presentes en el momento del trasplante [31], y generalmente se diagnostica mediante una biopsia de protocolo en pacientes asintomáticos [7] [8]. La recurrencia tardía se produce por una producción nueva de autoanticuerpos en el post-trasplante, coincidiendo cuando la intensidad de la inmunosupresión es menor o tras un desencadenante (“second hit”), como por ejemplo puede ser una infección. Se diagnostica por la aparición y aumento progresivo de la proteinuria, que evoluciona muchas veces a un síndrome nefrótico [31]. La NM de novo aparece de forma tardía, generalmente a partir del año del trasplante [25].
Factores asociados a la recidiva de la nefropatía membranosa
El factor de riesgo más importante descrito asociado a la NM recurrente es la presencia de anticuerpos anti-PLA2R circulantes antes del trasplante renal [32]. Los pacientes candidatos a un trasplante renal con anticuerpos anti-PLA2R positivos tienen entre un 60-76% de riesgo mayor de recidiva sobre el injerto renal que los pacientes con títulos bajos o negativos (28-30%) [30] [33] [34] [35]. Estos estudios muestran valores predictivos positivos elevados para el diagnóstico de NM recurrente [34], y algunos autores incluso establecen el punto de corte de anti-PLA2R que mejor predice la recidiva con elevada sensibilidad y especificidad [36] [35]. No obstante, también existe algún trabajo donde la asociación de anticuerpos anti-PLA2R circulantes y la NM recurrente es más débil [24], [33], discrepancia posiblemente atribuible a las diferencias en la intensidad del tratamiento inmunosupresor, habiendo en estos últimos estudios una mayor de proporción de pacientes con tratamiento inducción en el momento del trasplante, pudiendo interferir directamente en la producción de autoanticuerpos y su determinación [34].
Otros factores de riesgo asociados a la recidiva de la NM incluyen la elevada proteinuria antes del trasplante [30] [36] y la existencia de polimorfismos de riesgo en el sistema HLA [35].
Antes del descubrimiento de los anticuerpos anti-PLA2R, el trasplante renal de donante vivo emparentado en pacientes con NM primaria se consideraba un factor de riesgo de recidiva en el injerto [37]. No obstante, evidencia reciente en estudios de registro demuestra como la supervivencia del injerto es mayor en pacientes que reciben un injerto de donante vivo (emparentado o no) comparado con los que reciben un injerto de donante cadáver [12] y no existen diferencias entre los diferentes tipos de donante y el índice de recurrencia de la NM [38] por lo que el trasplante renal de donante vivo es el tratamiento de elección en estos pacientes.
Tratamiento de la recidiva de la nefropatía membranosa
La evidencia con respecto al tratamiento específico de la NM recurrente es limitada y está basada principalmente en series de casos y estudios retrospectivos de pequeño tamaño muestral. No existe evidencia que el tratamiento inmunosupresor con corticoides, inhibidores de la calcineurina o agentes anti-proliferativos tengan un efecto protector para la recidiva de la NM, y tampoco hay evidencia que modificando el tratamiento inmunosupresor de mantenimiento se pueda reducir el riesgo, aunque existen trabajos que sugieren que el tratamiento de inducción podría inhibir la producción de anti-PLA2R de forma temporal [7], [30] . A pesar de que los inhibidores de la calcineurina han demostrado ser efectivos para el tratamiento de la NM primaria[39], [40], no parecen alterar la historia natural de la NM recurrente en el injerto renal [7] [41]. Existen casos aislados con respuesta a tratamiento con corticoides y ciclofosfamida [10].
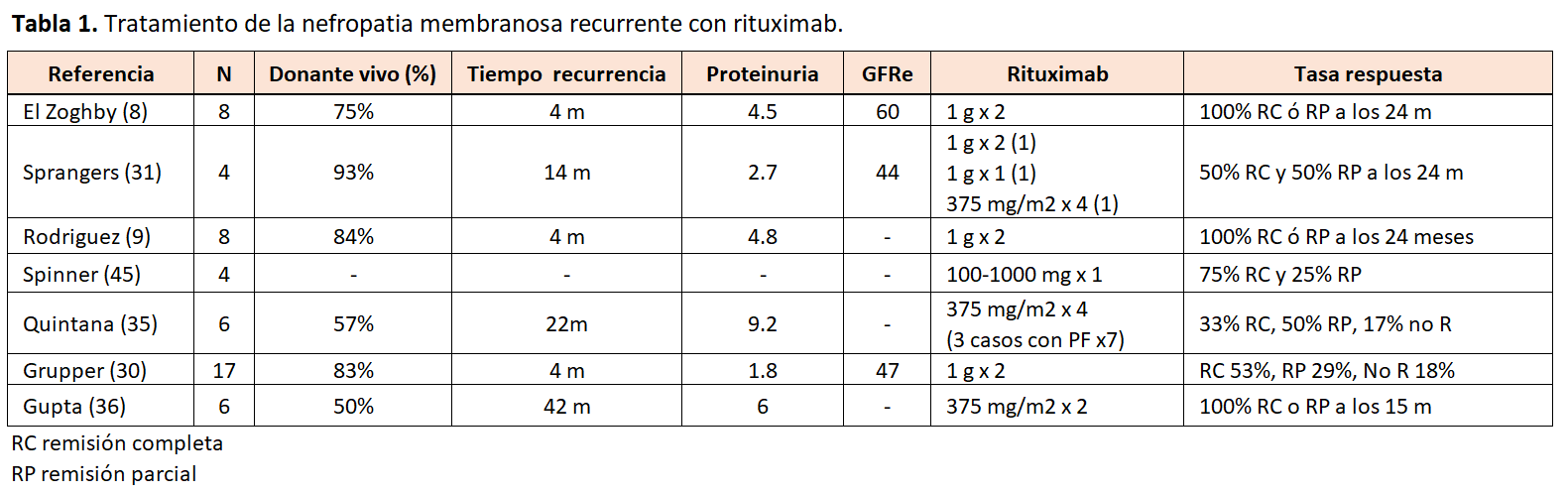
El uso de rituximab en la recidiva NM se fundamenta en la evidencia existente para el tratamiento de la NM primaria en riñón nativo [42] [43] [44]. Desde que en el año 2002 se publicara por primera vez la remisión de una NM primaria tras recibir tratamiento con rituximab, varios estudios han reportado resultados satisfactorios. La remisión completa ocurre en el 15-20% de los casos y la remisión parcial en 35-40%. La respuesta clínica tras la administración de rituximab está directamente relacionada con la reducción de los títulos de anticuerpos anti-PLA2R. Teniendo en cuenta que los cambios en la detección de anti-PLA2R circulantes se producen meses antes de que se obtenga una respuesta clínica (disminución de la proteinuria), la monitorización de los anticuerpos anti-PLA2R tras el tratamiento nos indicará si podemos esperar remisión clínica de la enfermedad. Los estudios con rituximab y recidiva de NM son de cohortes retrospectivos y con un número de casos pequeños, y reportan unas tasas de remisión completa y parcial de la enfermedad elevadas (Tabla 1) [8] [30] [31] [35] [36] [45].
RECOMENDACIONES
• Se recomienda investigar en los pacientes con una NM primaria si ésta está asociada a anticuerpos anti-PLA2R mediante el estudio de anticuerpos circulantes y el depósito de los mismos en la biopsia para estimar el riesgo de recidiva después del trasplante renal. (evidencia alta) El riesgo se considerará:
1. Elevado (50%) : pacientes con NM asociada a anticuerpos anti-PLA2R circulantes persistentemente positivos.
2. Intermedio (30%): pacientes con NM sin anticuerpos anti-PLA2R circulantes y sin depósito de anti-PLA2R en la biopsia.
3. Bajo (10%): pacientes con NM sin anticuerpos anti-PLA2R circulantes en el momento del trasplante (negativización) y con depósito de anti-PLA2R en la biopsia.
- Se recomienda realizar tratamiento inmunosupresor en los pacientes con anticuerpos circulantes anti-PLA2R antes del acceso al trasplante y evitar activar el trasplante renal hasta conseguir una respuesta inmunológica mantenida. (evidencia moderada)
• Se recomienda realizar la medición de anticuerpos anti-PLA2R circulantes mediante técnicas de ELISA e IFI, considerando positivos pacientes con valores > 50 U/mL y de alto riesgo pacientes con valores > 150 U/mL. (evidencia baja)
• Se recomienda monitorizar los niveles de anticuerpos anti-PLA2R en los pacientes en lista de espera y cada 3-6 meses después del trasplante. (evidencia baja)
• El diagnóstico de la NM recurrente/de novo debe realizarse mediante una biopsia del injerto, que debe indicarse cuando la proteinuria sea > 1 g/día. (evidencia alta)
• Los pacientes con NM recurrente/de novo deberán recibir tratamiento de soporte con inhibidores del sistema renina angiotensina y considerar la adición de fármacos inhibidores de SGLT2. (evidencia moderada)
• Los pacientes con NM recurrente con proteinurias > 1g/d deberán ser considerados para tratamiento inmunosupresor adicional. Se recomienda iniciar tratamiento con rituximab (dos dosis de 1 gr separados por 2 semanas), y esperar respuesta hasta 4 meses después de la administración del tratamiento, tras lo cual si no se produce una respuesta satisfactoria se deberá valorar iniciar tratamiento con ciclofosfamida y prednisona. (evidencia baja)
DIAGNÓSTICO Y TRATAMIENTO DE LA RECIDIVA DE LA NEFROPATÍA LÚPICA
Introducción
El lupus eritematoso sistémico (LES) es una enfermedad autoinmune que puede afectar a cualquier órgano o tejido y se caracteriza por la producción de autoanticuerpos contra una gran variedad de antígenos, entre los que se encuentran el ADN, ARN, las histonas y otros componentes nucleares. La nefritis lúpica (NL) ocurre aproximadamente en el 50% de los pacientes con LES[46], y a pesar de la mejora en el manejo de estos pacientes, entre un 10-30% progresaran a una enfermedad renal crónica terminal[47] El tratamiento de elección de estos pacientes es el trasplante renal ya que ofrece resultados comparables con pacientes con enfermedad renal de otras etiologías[48].
Nefritis lúpica y resultados tras un trasplante renal
La incidencia de la nefritis lúpica recurrente (NLR) reportada en la literatura es variable, siendo muy baja en algunos estudios (2-3%)[49], [50], y más frecuente (11-50%) en otros, especialmente en aquellos centros donde se realizan biopsias de seguimiento, y cuando se realiza inmunofluorescencia y microscopía electrónica [51] [52] [53] [54]. La recidiva se desarrolla más frecuentemente en pacientes más jóvenes, de sexo femenino y de raza negra 50] [51]. Puede aparecer en cualquier momento de la evolución del trasplante renal, incluyendo en el primer mes después del trasplante [55], aunque la mayor parte de los casos ocurren durante los primeros diez años de seguimiento [50].
La actividad lúpica antes del trasplante no se asocia con una peor supervivencia del injerto [56] [57]. Los pacientes con enfermedad renal terminal secundaria a una NL que reciben un trasplante renal tienen una supervivencia del injerto y una tasa se rechazo comparable con pacientes con enfermedad renal terminal secundaria a otras etiologías; raramente desarrollan una NLR grave y el riesgo absoluto de pérdida del injerto renal es bajo [50] [51] [58] [59] [60] [61] [62] [63]. No obstante, los pacientes con historia de síndrome antifosfolípido tienen más eventos trombóticos y peor supervivencia del injerto en algunos estudios [64] [65].
Presentación clínica y diagnóstico de la nefropatía lúpica recurrente
La NLR se debe considerar en el diagnóstico diferencial de la disfunción del injerto renal en pacientes trasplantados con LES. Ésta se presenta generalmente como una entidad relativamente benigna, con aparición de leve proteinuria y microhematuria, y raramente se presenta con manifestaciones sistémicas acompañantes como artritis o lesiones cutáneas [52] [66].
La presencia de marcadores serológicos lúpicos positivos después del trasplante no necesariamente nos orienta hacia la presencia de una NLR [53] [65] [67]. Para el diagnóstico de la NLR será necesario realizar una biopsia del injerto en la que no podrán faltar las técnicas de inmunofluorescencia y microscopía electrónica, no siempre realizadas de rutina [68]. Aunque todos los patrones histológicos de NL pueden recidivar en el injerto, el patrón hallado más frecuentemente es la nefropatía lúpica mesangial (clase I y II) [51] [53] [67], generalmente en biopsias de protocolo. En cambio, en biopsias por indicación clínica presentaran con más frecuencia un patrón proliferativo difuso [51]. La inmunofluorescencia de la biopsia del injerto generalmente mostrará positividad para IgG, IgM, C1q and C3, con depósitos subendoteliales y mesangiales por microscopía electrónica [51] [53].
Tratamiento de la nefropatía lúpica recurrente
La evidencia con respecto al tratamiento de la específico de la NLR es limitada y está basada en estudios retrospectivos, por lo que el nivel de evidencia es bajo. Las principales recomendaciones en cuanto a su tratamiento se basan en la evidencia existente para el tratamiento de la NL en riñón nativo. La inmunosupresión recomendada para estos pacientes no difiere de los protocolos estándares. La azatiopirina, el micofenolato mofetil, y los inhibidores de la calcineurina han sido utilizados para el tratamiento de la NL [51] [66]. En los casos de NL resistente se ha utilizado rituximab o ciclofosfamida, con unas tasas de respuesta aceptables [69] [70] [71]. La NLR presenta una buena respuesta a pulsos de esteroides y a dosis elevadas de MMF [72] y esto es consistente con el hecho de que la mayoría de los casos de NLR son benignos.
RECOMENDACIONES
• En los receptores con una NL como enfermedad primaria se recomienda mantener triple terapia (tacrolimus + micofenolato mofetil + esteroides) como tratamiento inmunosupresor de mantenimiento (evidencia baja).
• El tratamiento de la NLR con insuficiencia renal rápidamente progresiva y síndrome nefrótico, se realizará según la clasificación histológica será equivalente al indicado en los casos de NL diagnosticados en riñón nativo (evidencia baja).
• La evidencia existente para el uso de riituximab o ciclofosfamida en la LN resistente podría extrapolarse para su uso en casos de NLR resistente, siendo preferible el rituximab por su perfil de seguridad (evidencia baja).
• En los casos de NLR con patrón hidrológico de microangiopatía trombótica se recomienda realizar tratamiento con fármacos inhibidores de la activación del complemento (evidencia baja).