Biosimilares en nefrología
Palabras clave
Biosimilares estimulantes eritropoyesis, epoetin alfa, epoetin z, HX575, SB309
Las empresas farmacéuticas dirigen gran parte de su investigación y producción hacia los medicamentos biológicos. En general, poseen una elevada especificidad, actuando sobre dianas terapéuticas bien definidas que requieren procesos de desarrollo y producción más complejos en comparación con medicamentos de síntesis química o tradicionales.
Se utilizan en el tratamiento de muchas enfermedades y representan aproximadamente el 30% del mercado farmacéutico mundial. El uso de fármacos biológicos en pacientes con cáncer, enfermedades inmunitarias, anemia renal y en otros procesos, ha dado lugar a avances significativos en el cuidado de estos pacientes [1].
Los biosimilares son medicamentos biológicos que contienen una versión del principio activo del producto biológico original (producto de referencia) al que se ha demostrado que es equivalente, garantizando la misma eficacia, seguridad y calidad que los biológicos originales y cuyas ventajas económicas contribuyen a la sostenibilidad de los sistemas de salud [2].
Tras la inicial aparición en medicina [3], la llegada de los biosimilares al área de nefrología tuvo un rechazo inicial motivado por una complicación coincidente en el tiempo, que fue la aparición de anticuerpos anti-eritropoyetina en algunos pacientes que recibieron eritropoyetina alfa original y desarrollaron un cuadro de aplasia pura de células rojas [4] [5]. El proceso de producción de los biológicos es un determinante importante de la potencial inmunogenicidad del producto final y eso depende de varias circunstancias como la naturaleza de la proteína (endógena o no endógena), la presencia de impurezas, la formulación, la vía de administración, la dosis y el régimen, el tipo de enfermedad y la medicación concomitante [2].
En el presente artículo resumimos los conceptos más importantes sobre los biosimilares en el área de nefrología.
Medicamentos biológicos versus medicamentos de síntesis química
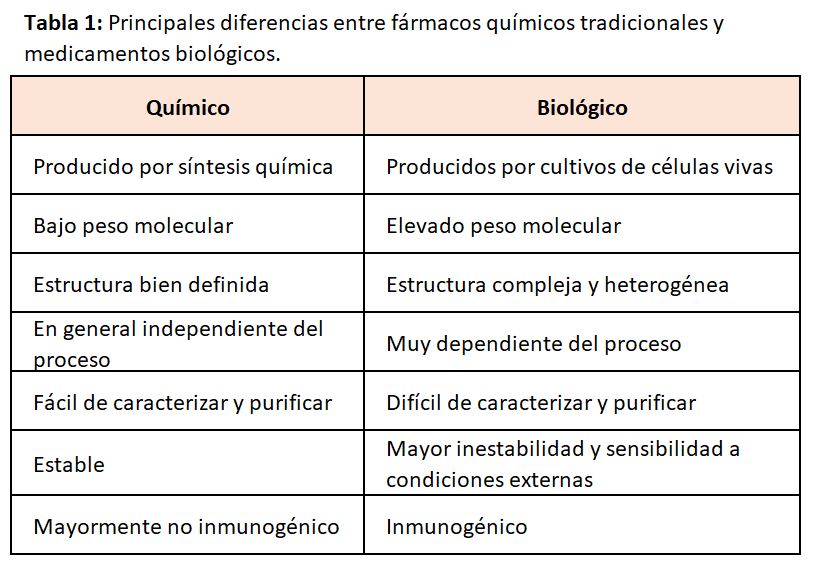
Los medicamentos biológicos son aquellos cuyo principio activo está producido por un organismo vivo o se deriva de un organismo vivo por métodos de ADN recombinante y/o expresión génica controlada. Estos productos son polipéptidos, glicoproteínas y ácidos nucleicos y sus características moleculares son mucho más complejas que los medicamentos de síntesis química.
Las diferencias entre medicamentos de síntesis química y biológicos están expresadas en la (Tabla 1) y son las siguientes:
Los medicamentos de síntesis química son de bajo peso molecular, producidos por métodos bien controlados y reacciones químicas altamente reproducibles. Son moléculas con una estructura química pequeña, bien definida y estable, que puede ser completamente caracterizado por métodos analíticos. No son inmunogénicos.
Los medicamento biológicos son macromoléculas de elevado peso molecular, producidos por organismos vivos, los cuales son variables por naturaleza. Por ello, pueden presentar de forma inherente un cierto grado de pequeña variabilidad («microheterogeneidad»). Además su producción está influenciada por ciertas variables, como el tipo de sistema de expresión, por ejemplo bacterias, levaduras, y células de mamífero, las condiciones de crecimiento, el proceso de purificación, la formulación real y las condiciones durante el almacenamiento y transporte.
Las modificaciones postranslacionales que ocurren durante la síntesis celular, como glicosilación, fosforilación, sulfatación, metilación, acetilación e hidroxilación, pueden afectar la actividad biológica y dan como resultado la microheterogeneidad molecular intrínseca mencionada. Teóricamente, se puede calcular que estas modificaciones pueden resultar en más de un millón de variantes relacionadas con el producto. Dicha variabilidad estructural es sustancial y puede ser muy sutil, siendo minuciosamente controlada por las técnicas analíticas y biotecnológicas más avanzadas para caracterizar el producto final [2].
Además, los biológicos son bastante sensibles a las condiciones "externas". Ello puede afectar la integridad y estabilidad del producto y condicionar diversos grados de desnaturalización de péptidos, agregación, oxidación y degradación. Esto no afecta tanto a los fármacos no biológicos tradicionales porque son mucho más pequeños, pueden controlarse mejor y son más predecibles por naturaleza.
Otra importante diferencia es que los medicamentos biológicos son potencialmente inmunogénicos. A este respecto, es importante señalar que las sutiles diferencias estructurales, por ejemplo como consecuencia de pequeñas diferencias en el número y tipo de variantes del producto, pueden afectar significativamente al potencial inmunogénico del fármaco. Además, ciertas impurezas relacionadas con el producto o el proceso pueden provocar también respuesta inmunológica.
Los medicamentos biológicos están consolidados en la práctica clínica y, en muchos casos, son indispensables para el tratamiento de enfermedades crónicas y graves, como la diabetes, la anemia renal, las enfermedades autoinmunitarias y el cáncer. La calidad de todos los medicamentos (biológicos y no biológicos) aprobados por la EMA (European Medical Agency) está rigurosamente probada. Para los medicamentos biológicos, este control incluye el estudio de sus propiedades fisicoquímicas específicas, actividad biológica, pureza, esterilidad y estabilidad, con el fin de garantizar que se cumplen todas las normas exigidas antes de proceder a la comercialización de los lotes.
Biosimilares
La palabra “similar” significa: “que tiene semejanza o analogía con algo” pero que no es exactamente lo mismo. Al terminar las patentes de los primeros biológicos aprobados, es posible "copiar" y comercializar las sustancias biológicas por otras empresas de biotecnología y, al igual que ocurre con los genéricos, reducir el costo para los pacientes y los sistemas sanitarios. Pero, como hemos comentado, los biológicos son producidos por células vivas y, dada su complejidad intrínseca, no hay dos líneas celulares desarrolladas de forma independiente que puedan considerarse idénticas y, por tanto, no se pueden copiar por completo. Esto es reconocido por las autoridades reguladoras europeas y ha dado lugar al establecimiento del término "biosimilar" en reconocimiento del hecho de que los productos son similares al producto original. Por tanto, un biosimilar (o medicamento biológico similar) es un medicamento biológico que contiene una versión del principio activo de un producto biológico original (producto de referencia), al que se ha demostrado que es equivalente [2].
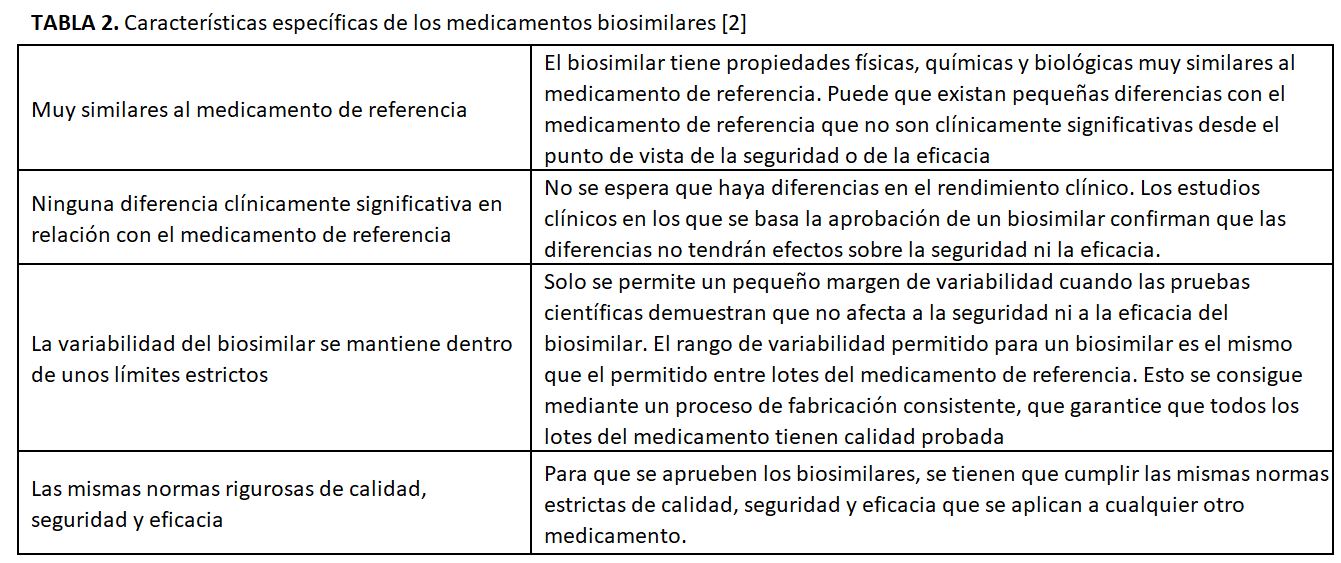
Las características de los biosimilares según la EMA [2] se explican en la (Tabla 2).
Genéricos versus biosimilares
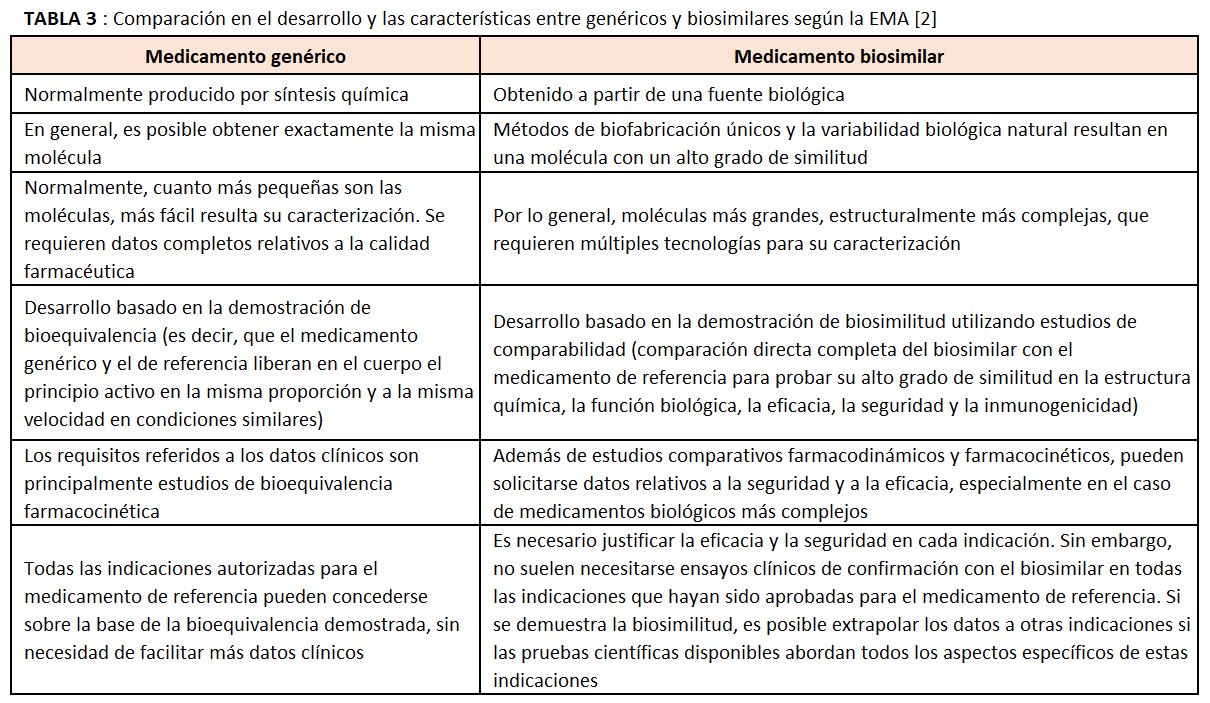
Ya hemos comentado la enorme complejidad que tiene un biosimilar en comparación a un fármaco químico tradicional. Estos pueden “copiarse” en genéricos con una identidad muy precisa porque son de síntesis química y de bajo peso molecular. Los genéricos se autorizan por bioequivalencia y en los biosimilares, además de estudios comparativos farmacodinámicos y farmacocinéticos, pueden solicitarse datos relativos a la seguridad y a la eficacia, especialmente en el caso de medicamentos biológicos más complejos.
La EMA compara el desarrollo y las características entre genéricos y biosimilares en la (Tabla 3).
Historia de los biosimilares
El primer medicamento biosimilar autorizado por la EMA en abril de 2006 fue la hormona de crecimiento humana recombinante (somatotropina). El medicamento de referencia, desarrollado por Pfizer se autorizó originalmente en la UE en 1988 [3].
La EMA fue aprobando posteriormente biosimilares en varias áreas terapéuticas, continuando por varios análogos de eritropoyetina, agentes antineoplásicos y biosimilares de la hormona foliculo estimulante (FSH). Las decisiones de la EMA son válidas en todos los países de la UE. Cada país de la UE está autorizado a negociar el precio del biosimilar de forma independiente, pero no puede tomar decisiones de autorización de comercialización independientemente de los veredictos de la EMA.
Hoy en día, los biosimilares forman parte de las eficaces terapias biológicas disponibles en la UE y presentan las garantías adecuadas para proteger la seguridad de los pacientes. La EMA no regula la intercambiabilidad, el cambio ni la sustitución de un medicamento de referencia por su biosimilar. Estos son competencia de los estados miembros de la UE. Durante los últimos diez años, el sistema de supervisión de la UE relacionado con cuestiones de seguridad no ha identificado ninguna diferencia relevante en cuanto a la naturaleza, gravedad o frecuencia de los efectos adversos entre los biosimilares y sus medicamentos de referencia.
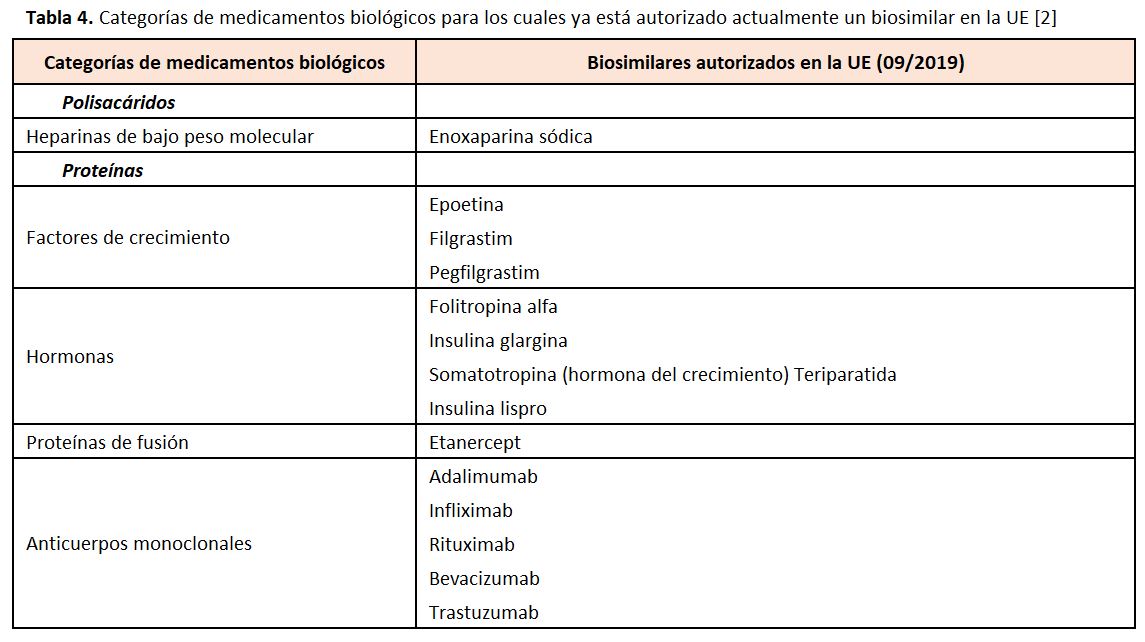
En la (Tabla 4) pueden observarse las categorías de medicamentos biológicos para los cuales ya está autorizado actualmente un biosimilar en la UE.
Preocupación inicial de la nefrología acerca de los biosimilares
En nefrología fuimos inicialmente muy críticos con la llegada de los biosimilares de epoetina a nuestra especialidad. Y todo fue condicionado principalmente por la aparición de la aplasia pura de células rojas (APCR) [4] [5]. Se trataba de un trastorno hematológico poco común caracterizado por anemia normocrómica normocítica grave, progresiva y de aparición repentina; reticulocitopenia y una ausencia sorprendente, casi completa, de células precursoras de eritroides en la médula ósea. Eran casos raros, en los que los anticuerpos generados contra eritropoyetina exógena provocaban reacciones de hipersensibilidad, con efecto neutralizante y desarrollaban una APCR. Desde 1998 fue creciendo el número de casos de APCR asociada con anticuerpos anti-EPO. Entre las causas sugeridas encontramos la eliminación en 1998 de la seroalbúmina humana de la formulación de eritropoyetina alfa preparada en Puerto Rico y distribuida fuera de USA, la administración subcutánea y problemas con el almacenaje y la manipulación. La administración subcutánea del medicamento de referencia epoetina en pacientes con ERC fue contraindicada en la Unión Europea entre 2002 y 2006 por los informes de APCR. Ello aumentó nuestra resistencia a la entrada de biosimilares que por sus características de fabricación en determinados laboratorios del mundo pudieran tener una seguridad no tan confirmada.
Todo esto influyó en los estudios realizados con un biosimilar de epoetina al que luego nos referiremos llamado HX575 (Sandoz) porque no se podían realizar estudios comparativos por vía subcutánea de HX575 y la epoetina alfa de referencia. Posteriormente el uso subcutáneo del medicamento de referencia fue reautorizado, permitiendo que tal estudio se pudiera finalmente realizar. Sin embargo, dos pacientes desarrollaron APCR después de la administración subcutánea de HX575 en este ensayo [6]. El tema quedó resuelto tras la introducción de jeringas con bajo contenido de tungsteno, ya que los estudios demostraron un exceso de tungsteno en dos lotes de cilindros en jeringas precargadas [7] [8].
Los problemas que inicialmente planteamos en relación con los biosimilares de epoetina, se referían a variabilidad, calidad y seguridad [9]. Sin embargo, las preocupaciones iniciales de que los biosimilares podían ser muy variables y / o de calidad inferior, en comparación con el medicamento de referencia, no estaban justificadas. Ya hemos visto que un pequeño grado de variabilidad es común con cualquier medicamento biológico, ya sea un medicamento de referencia o un biosimilar, y que los lotes nunca son idénticos entre sí. Las autoridades reguladoras aseguran que cualquier cambio no tenga efectos adversos sobre la calidad, eficacia y seguridad clínica. Como veremos más adelante los estudios comparativos clínicos de biosimilares de epoetina demuestran que los productos comparados eran de alta calidad.
Como ocurre con cualquier medicamento biológico, una preocupación clave de seguridad para los biosimilares era la inmunogenicidad, aspecto que como hemos comentado, los nefrólogos estábamos muy sensibilizados por la APCR. No obstante, se requieren datos de seguridad humana para la aprobación de la EMA de todos biosimilares, incluidas epoetinas biosimilares, con al menos 12 meses de resultados de inmunogenicidad comparativa, utilizando un ensayo validado y altamente sensible para la detección de anticuerpos anti-eritropoyetina [10].
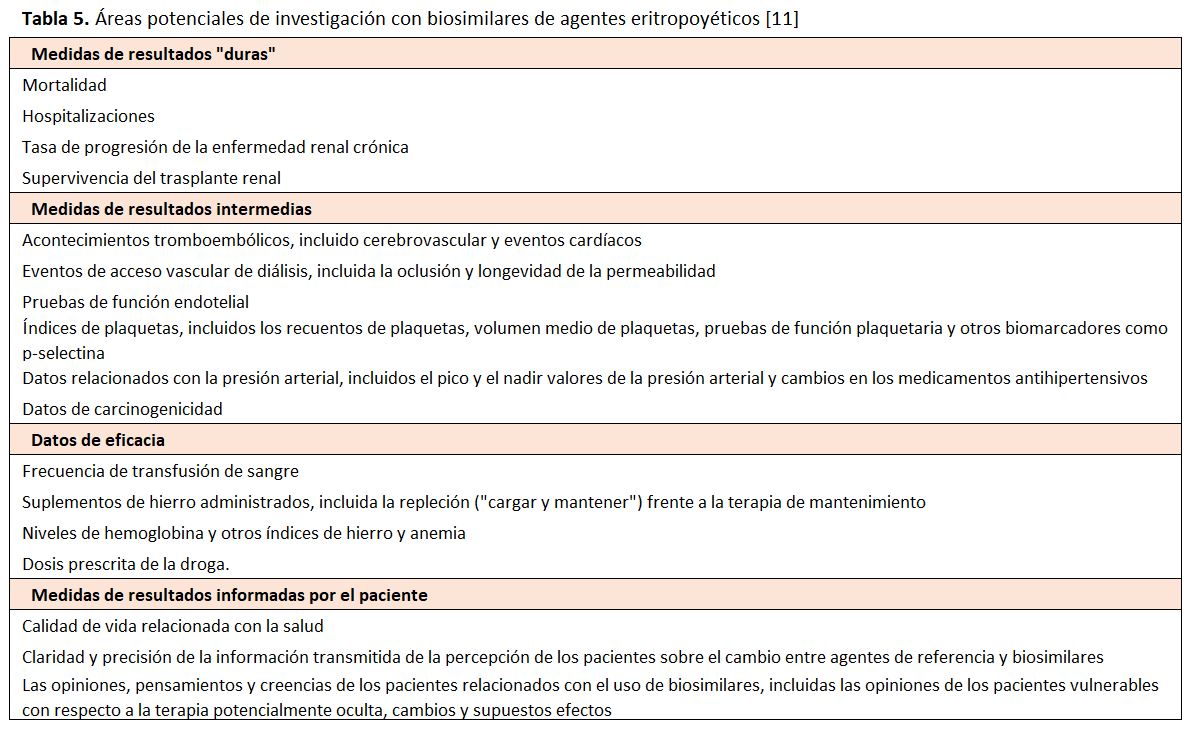
La National Kidney Foundation (NKF), debido a la relativa falta de conocimiento sobre los biosimilares y una falta de confianza percibida por la comunidad nefrológica con respecto a su seguridad y eficacia, llevó a cabo un simposio, Introducción de la terapéutica biosimilar en la práctica nefrológica en los Estados Unidos, en septiembre de 2015 [11]. De ello destacamos en la (Tabla 5) las áreas potenciales de investigación con biosimilares de agentes eritropoyéticos.
El desarrollo y la autorización de los medicamentos biosimilares en la Unión Europea
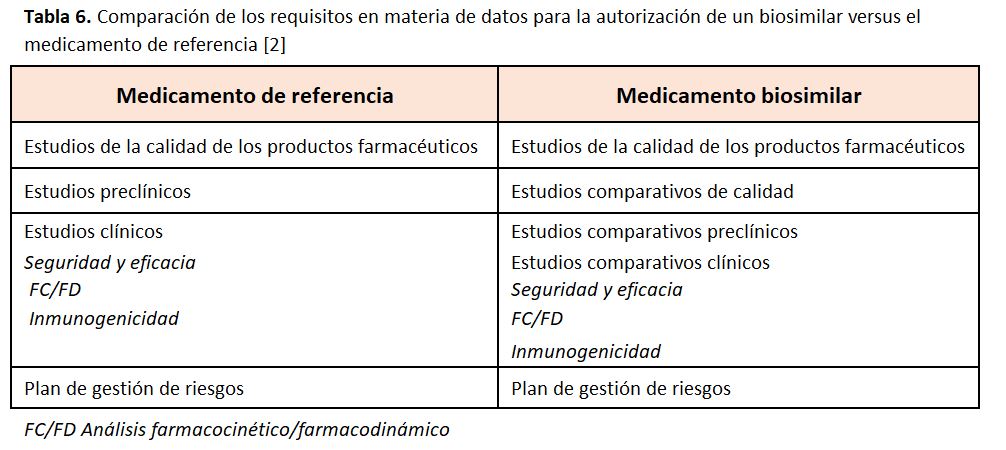
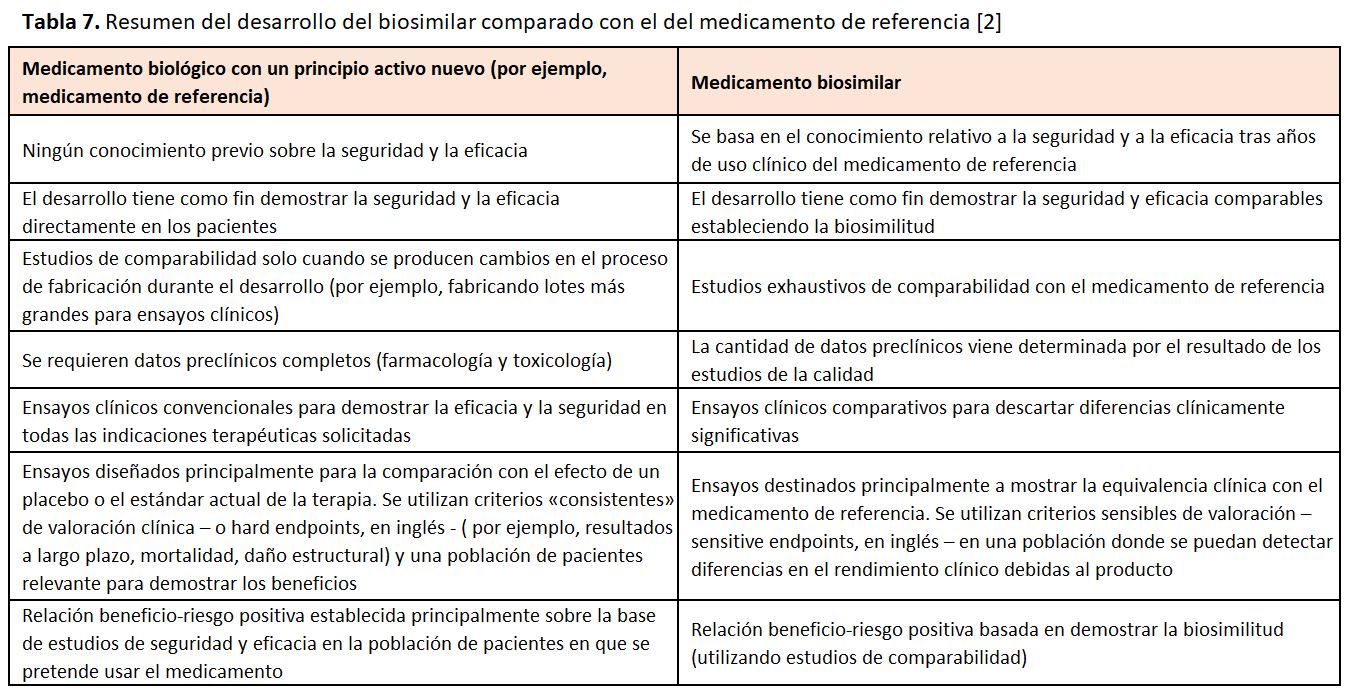
La EMA [2] autoriza los medicamentos cuando los estudios sobre su eficacia, calidad y seguridad farmacéutica demuestran de forma convincente que las ventajas del medicamento superan los riesgos que pueda presentar (es decir un riesgo beneficio positivo). Para cualquier medicamento biológico con un principio activo nuevo, la relación positiva riesgo-beneficio se determina principalmente sobre la base de los datos relativos a la seguridad y a la eficacia, obtenidos a partir de la realización de ensayos esenciales en humanos (Tabla 6), fundamentados en sólidos estudios de la calidad farmacéutica y en datos de estudios preclínicos. En el caso de los biosimilares, la relación riesgo/beneficio positiva se basa en demostrar la biosimilitud, es decir, que el principio activo es muy similar al del medicamento de referencia. Esto se consigue realizando exhaustivos estudios de comparabilidad con el medicamento de referencia (Tabla 7).
Estos estudios de comparabilidad vienen definidos por la EMA [2] en tres pasos escalonados.
• Paso 1: Estudios comparativos de la calidad.
Los estudios in vitro comparan la estructura proteica y la función biológica utilizando técnicas sensibles capaces de detectar diferencias mínimas con relevancia clínica entre el biosimilar y su medicamento de referencia. Estos estudios son mucho más sensibles que los ensayos clínicos para la detección de diferencias, ya que suele existir variabilidad entre los sujetos humanos que participan en los ensayos. Si se detectan diferencias que puedan afectar a la seguridad clínica, a la eficacia o a la inmunogenicidad, sería necesario realizar más estudios (por ejemplo, estudios comparativos clínicos o preclínicos, pasos 2 y 3).
• Paso 2: Estudios preclínicos comparativos.
Estos estudios incluyen estudios farmacodinámicos in vitro que analizan la unión y la activación (o inhibición) de las dianas fisiológicas y los efectos fisiológicos inmediatos en las células. Solo se efectúan estudios farmacodinámicos in vivo (modelos animales) si no existe un modelo adecuado in vitro. Únicamente se requieren estudios toxicológicos in vivo en determinados casos, por ejemplo cuando el biosimilar es producido en un nuevo tipo de célula u organismo, o cuando la formulación incluye nuevos excipientes que no se han utilizado previamente.
• Paso 3: Estudios clínicos comparativos.
El objetivo de los estudios en humanos no es demostrar la seguridad y la eficacia en los pacientes, ya que estos parámetros ya han sido establecidos para el medicamento de referencia. Los ensayos clínicos están diseñados para confirmar la biosimilitud y para abordar cualquier cuestión que quedase pendiente de los estudios analíticos o funcionales realizados previamente.
Inmunogenicidad
La inmunogenicidad siempre se estudia en las medicinas biológicas. Esto se debe a la capacidad intrínseca de las proteínas y otros medicamentos biológicos para causar una respuesta inmune no deseada que, en raros casos, podría causar una reacción adversa grave (p. ej. anafilaxia o hipersensibilidad retardada) o reducción en la eficacia.
La EMA, la OMS y la FDA recomiendan las pruebas de inmunogenicidad clínica comparativas en una población de estudio adecuadamente sensible (es decir, la población de pacientes en la que los productos biológicos del estudio tienen más probabilidades de provocar una respuesta inmunitaria) como criterio clave para la evaluación regulatoria de la biosimilitud.
Los datos de inmunogenicidad necesarios para la aprobación incluyen incidencia, título y persistencia de anticuerpos contra la medicina biológica (ADA), ensayos de neutralización (porque los anticuerpos neutralizantes pueden reducir el efecto del medicamento), evaluación del impacto clínico y medidas para gestionar el riesgo potencial de inmunogenicidad (p. ej. seguimiento especial de reacciones adversas mediadas por el sistema inmunitario reacciones o uso de medicación concomitante para mitigar las reacciones a la infusión) [12].
La inmunogenicidad puede verse afectada por las características del producto (cambios en la estructura de la proteína que pueden ocurrir durante un almacenamiento inadecuado o transporte, o las proteínas podrían formar agregados) y también por factores relacionados con el tratamiento (el riesgo puede variar con vía subcutánea versus intravenosa o con tratamiento continuo versus intermitente) o por factores relacionados con el paciente o su enfermedad (por ejemplo, edad, genética y estado inmunológico o tratamientos concomitantes).
Intercambiabilidad
La intercambiabilidad hace referencia a la posibilidad de intercambiar un medicamento por otro que se espera que tenga el mismo efecto clínico. Esto podría significar cambiar un producto de referencia por un biosimilar (o viceversa) o reemplazar un biosimilar por otro.
Cuando la EMA lleva a cabo la revisión científica de un biosimilar, las evaluaciones no incluyen recomendaciones sobre si el biosimilar es intercambiable con el medicamento de referencia ni, por lo tanto, sobre si el medicamento de referencia se puede cambiar o sustituir por el biosimilar. La decisión sobre si permitir el uso intercambiable y la sustitución del medicamento biológico de referencia por el biosimilar se toma a nivel nacional [2].
El Ministerio de Sanidad en España ha publicado la actualización del plan de acción para fomentar la utilización de los medicamentos reguladores del mercado en el Sistema Nacional de Salud: medicamentos biosimilares y medicamentos genéricos, acordado durante la Comisión Permanente de Farmacia celebrada el pasado 24 de septiembre de 2019 [13]. En lo que respecta a la intercambiabilidad refiere exactamente: “En relación a la intercambiabilidad, son cada vez más las evidencias que avalan la intercambiabilidad [14] [15] [16] entre el medicamento de referencia y su biosimilar. Dadas las características y el proceso de aprobación de cualquier medicamento biosimilar en Europa, algunas agencias reguladoras europeas (holandesa, finlandesa, escocesa, irlandesa y alemana) han realizado posicionamientos nacionales sobre la intercambiabilidad de los biosimilares [17]. Consideran que debido a la alta similitud que existe entre el medicamento de referencia y el biosimilar no existe razón para que el sistema inmune reaccione de forma diferente ante un intercambio entre el medicamento de referencia y el biosimilar y por ello cualquier intercambio entre ellos puede considerarse seguro. Estudios como el NOR-SWITCH y su extensión a largo plazo [18] avalan esta situación. Esta aproximación está en línea con el posicionamiento de sociedades científicas, agencias u organismos evaluadores europeos [19].
Biosimilares de aplicación en nefrología
Básicamente la nefrología se ha introducido en el mundo de los biosimilares a través de los agentes estimulantes de la eritropoyesis (AEE), aunque recientemente se han aprobado otros biosimilares de rituximab para diferentes indicaciones.
Biosimilares de agentes estimulantes de la eritropoyesis
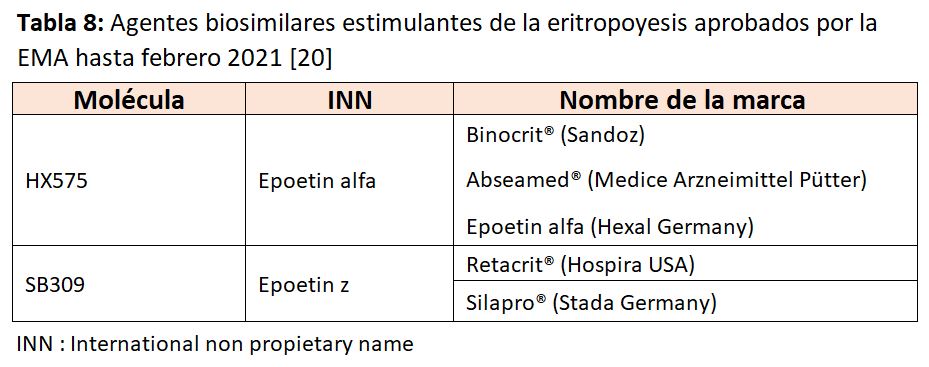
En la (Tabla 8) pueden observarse los biosimilares AEE autorizados por la EMA hasta febrero 2021 [20].
Estudios en fase 1
Se han realizado varios estudios de fase 1 con HX575 (epoetina alfa) [21] y SB309 (epoetina zeta) [22] y todos han mostrado perfiles similares a los del medicamento de referencia.
Estudios clínicos
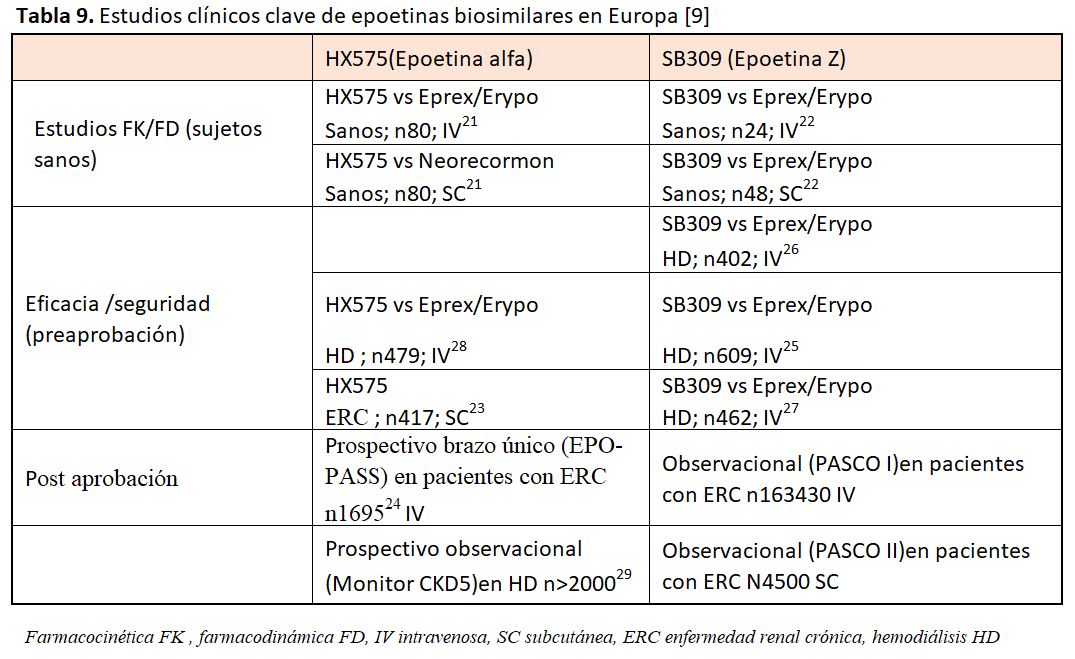
En la (Tabla 9) pueden observarse los estudios clínicos clave de biosimilares de epoetinas en Europa [9].
La epoetina-alfa humana recombinante HX575 (Sandoz Pharmaceuticals GmbH / Hexal AG, Holzkirchen, Alemania) es el primer AEE biosimilar con autorización de comercialización en Europa. Se realizó un estudio de mantenimiento de fase 3 frente al medicamento de referencia IV en pacientes adultos en diálisis y se demostró la equivalencia terapéutica con una diferencia entre los grupos de 0,08 g/dl (IC del 95%: 0,17 a 0,34). El perfil de seguridad a largo plazo de HX575 fue similar al de la epoetina alfa de referencia. Ningún paciente desarrolló anticuerpos neutralizantes anti-eritropoyetina [29]. En otro estudio abierto de un solo brazo de SC HX575 en 417 pacientes en prediálisis y diálisis, HX575 subcutáneo fue eficaz en el manejo de la anemia, independientemente de si habían sido tratados previamente con epoetinas, sin signos clínicos de inmunogenicidad o hipersensibilidad [23].
En cuanto al SB309 (epoetina zeta) dos ensayos aleatorizados de fase 3 compararon la eficacia de SB309 IV y la epoetina alfa de referencia IV en pacientes con anemia inducida por ERC y se demostró la equivalencia terapéutica y seguridad en ambos estudios [25] [26]. Ningún paciente desarrolló anticuerpos neutralizantes anti-eritropoyetina. Después de recibir la autorización para la administración intravenosa, un ensayo aleatorizado posterior a la autorización previa a la comercialización evaluó la equivalencia terapéutica de SC SB309 y la epoetina alfa de referencia [27]. Este estudio mostró equivalencia terapéutica en el mantenimiento de los niveles de Hb objetivo y en los perfiles de seguridad.
Estudios postautorización
Los estudios postautorización tienen como objetivo detectar efectos secundarios de baja frecuencia y la eficacia a largo plazo, que no pueden detectarse en los ensayos. El estudio EPO-PASS de HX575 IV participaron más de 1700 pacientes con anemia renal. El período de estudio cubrió 770 pacientes-año. El perfil de efectos adversos observado estuvo en línea con las expectativas para esta población de pacientes. Ningún sujeto desarrolló anticuerpos anti-epoetina. Los niveles medios de Hb se mantuvieron eficazmente entre 11,2 y 11,3 g/dl después de la conversión de un amplio espectro de tratamientos previos al estudio con AEE con dosis medias estables de HX575 IV. La proporción de pacientes dentro del rango objetivo de Hb aumentó del 57,5% al inicio del estudio al 66,8% al final del mismo [24].
Se han comunicado resultados de seguridad del estudio PASCO I con IV SB309 en 1634 pacientes con anemia renal durante un período de observación del estudio de 1 año. La frecuencia de efectos adversos de especial interés fue comparable con los datos de otros productos de epoetina existentes. No se informó que ningún paciente tuviera reacciones anafilactoides, angioedema, anticuerpos neutralizantes de eritropoyetina o APCR [30].
Un estudio comparó los efectos de la epoetina de referencia con tres biosimilares en 583 pacientes con ERC. No hubo diferencias estadísticamente significativas entre el medicamento de referencia y los biosimilares en la dosis dispensada, y se encontró que la eficacia y seguridad de los biosimilares de epoetina eran equivalentes a las del medicamento de referencia [31]. En otro estudio observacional poblacional de 8.161 pacientes con ERC, no se encontraron diferencias entre el medicamento de referencia y los biosimilares con respecto al riesgo de mortalidad por todas las causas, transfusión de sangre, eventos cardiovasculares mayores y discrasia sanguínea [30].
En conjunto, estos datos brindan evidencia de efectividad y aseguran que no ha habido señales de seguridad inesperadas con el uso en el mundo real de epoetinas biosimilares autorizados por la EMA.
Rituximab
El rituximab es un anticuerpo monoclonal quimérico contra la proteína CD20, que se encuentra principalmente en la superficie de las células B del sistema inmunológico. El rituximab destruye las células B y, por lo tanto, se usa para tratar enfermedades que se caracterizan por un número excesivo de células B, células B hiperactivas o células B disfuncionales. Esto incluye muchos linfomas, leucemias, rechazo de trasplantes y trastornos autoinmunes.
El producto original, Rituximab de Roche, fue aprobado por la Administración de Drogas y Alimentos de los Estados Unidos (FDA) en noviembre de 1997 y por EMA en junio de 1998.
La molécula rituximab (tanto el medicamento de referencia como sus biosimilares) posee autorización para linfoma no Hodgkin, artritis reumatoide, pénfigo vulgar, granulomatosis de Wegener y PAN microscópica. No tiene licencia para su uso en trasplantes renales pero se usa ampliamente en trasplantes con grupos sanguíneos incompatibles ABO. Es un tratamiento eficaz para el trastorno linfoproliferativo postrasplante y también se utiliza tanto en el trasplante renal incompatible con anticuerpos HLA como en el tratamiento del rechazo agudo. La evidencia reciente sugiere que rituximab puede prevenir el desarrollo de rechazo crónico mediado por anticuerpos. Es probable que los mecanismos subyacentes a sus efectos se relacionen tanto con los efectos a largo plazo sobre el desarrollo de las células plasmáticas como con el impacto sobre la modulación de las células T de las células B.
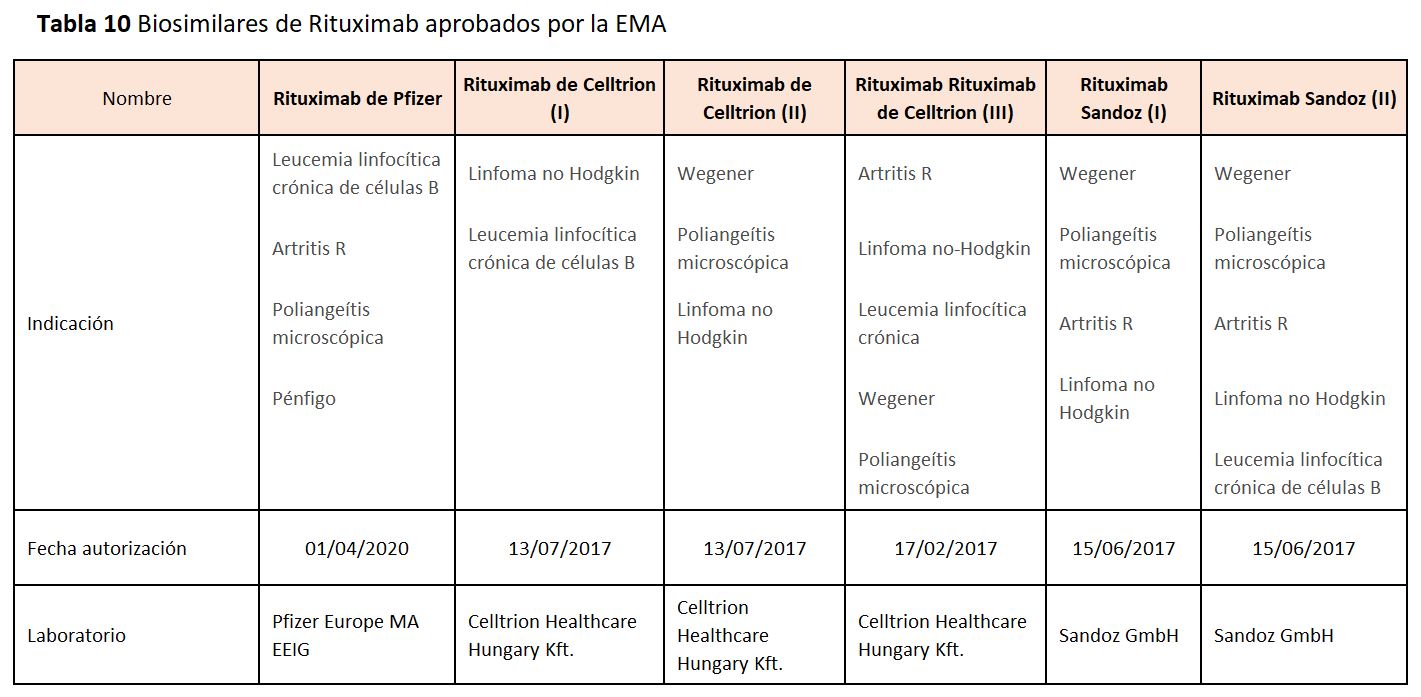
Los biosimilares de rituximab aprobados por la EMA pueden observarse en la (Tabla 10). Celltrion recibió la aprobación de la CE para su biosimilar de rituximab (CT-P10) en febrero de 2017. Sandoz, la división de Novartis, recibió la aprobación de la CE para su biosimilar de rituximab (GP2013) el 19 de junio de 2018 .
Eculizumab
Eculizumab es un anticuerpo monoclonal humanizado que es un inhibidor terminal del complemento. Se utiliza para tratar a personas con hemoglobinuria paroxística nocturna (HPN), para quienes mejora la calidad de vida pero no parece afectar el riesgo de muerte. También está indicado para el tratamiento del síndrome urémico hemolítico atípico (SHUa), una enfermedad que afecta principalmente a la función renal, para inhibir la microangiopatía trombótica mediada por el complemento.
El producto original eculisumab, elaborado por Alexion Pharmaceuticals, fue aprobado por la EMA para el tratamiento de la HPN el 20 de junio de 2007 y el 24 de noviembre de 2011 para el tratamiento del SHUa.
Las patentes de eculizumab expiraron en los EE. UU. el 16 de marzo de 2021 y en Europa el 1 de mayo de 2020. No hay de momento autorizado por la EMA ningún biosimilar.
Basilisimax (sin biosimilar aprobado en la EMA)
Es un anticuerpo monoclonal quimérico de ratón-humano contra la cadena α (CD25) del receptor de IL-2 de las células T. Es un agente inmunosupresor que se usa para prevenir el rechazo inmediato del trasplante en personas que reciben trasplantes de riñón, en combinación con otros agentes.
El producto original, Basiliximab de Novartis, fue aprobado por la EMA el 9 de octubre de 1998
Las patentes del producto original, Basiliximab expiraron en Europa en abril de 2013. Hasta donde sabemos, no hay un biosimilar de basiliximab en desarrollo para su próxima aprobación
Conclusiones
• Un agente “biosimilar” es muy similar al producto biológico de referencia original a pesar de diferencias menores en componentes clínicamente inactivos y sin diferencias clínicamente significativas en términos de seguridad, pureza y potencia.
• Como los medicamentos biológicos son producidos por organismos vivos, son por naturaleza heterogéneos y no se pueden hacer copias idénticas, a diferencia de las versiones genéricas de los medicamentos de molécula pequeña.
• Los biosimilares propuestos son sometidos a un riguroso proceso de evaluación para demostrar un alto grado de similitud estructural y funcional con el biológico de referencia. Una vez confirmado, se lleva a cabo un proceso de comparación gradual con el agente de referencia con respecto a los ensayos con animales, la farmacocinética / farmacodinamia, la inmunogenicidad y la eficacia y seguridad en humanos.
• La entrada de los biosimilares en nefrología coincidió con el aumento de casos de APCR con un producto de eritropoyetina alfa original por desarrollo de anticuerpos neutralizantes anti EPO. Ello condicionó una respuesta inicial poco favorable por la dificultad del proceso de fabricación biológica de estos productos.
• La experiencia con biosimilares de AEE aprobados por la EMA ha sido favorable en términos de seguridad, eficacia y ahorro de costos.
• Estudios post-comercialización de biosimilares de epoetina aprobados por la EMA han demostrado asimismo seguridad y eficacia.
• El rituximab es el único biosimilar no AEE relacionado con nefrología aprobado por la EMA hasta febrero 2021.