La enfermedad renal crónica (ERC) es un importante problema de salud pública y un factor de riesgo independiente de morbilidad y mortalidad cardiovascular (CV) [1]. Tanto las personas con ERC como con enfermedad cardiovascular (ECV) comparten muchos factores de riesgo comunes como edad avanzada, hipertensión, dislipidemia, y diabetes mellitus, responsables de disfunción endotelial, inflamación sistémica, activación neuro-hormonal y respuestas hemodinámicas anormales. No obstante, la carga adicional de ECV que se observa en la ERC, sugiere la existencia de otros factores de riesgo exclusivamente renales, como uremia y sus toxinas circulantes asociadas, anemia, sobrecarga de volumen, anomalías del metabolismo óseo mineral, proteinuria, desnutrición, estrés oxidativo e inflamación, que afectan a la calcificación vascular y valvular, y rigidez arterial [2] [3]. Las tasas de Eventos Adversos Cardíacos Mayores (MACE), definidos como una combinación de ataque cardíaco no fatal, accidente cerebrovascular (ACV) no fatal y muerte CV, aumentan drásticamente con el avance de la ERC, aun a pesar de que los tratamientos actuales basados en guías incluyen terapia antiplaquetaria e intervenciones coronarias percutáneas (ICP) [4] [5] [6] [7].
La ERC se asocia con anomalías en la función plaquetaria, que pueden vincularse con el aumento observado de complicaciones tanto trombóticas como hemorrágicas. La terapia antiplaquetaria puede reducir el riesgo trombótico, pero a expensas de una alteración de la hemostasia [8]. Las alteraciones fisiopatológicas y el aumento de mediadores procoagulantes y proinflamatorios que favorecen la hipercoagulabilidad en pacientes con ERC [9], hace que éstos tengan un mayor riesgo de sufrir eventos CV trombóticos, como Infarto de Miocardio (IM) o ACV isquémico [2] [4] [10] [11] [12]. Al mismo tiempo, la ERC también se asocia con un mayor riesgo de hemorragia como resultado de una función plaquetaria alterada. Ya en formas leves de ERC se observa un mayor riesgo de hemorragia, que aumenta en proporción a la disminución de la tasa estimada de filtrado glomerular (TFGe) y al aumento de la excreción urinaria de albumina, alcanzando un elevado riesgo en personas con ERC avanzada, por ejemplo, aquellas que reciben diálisis, en las que las complicaciones hemorrágicas asociadas al procedimiento de ICP, gastrointestinales e intracraneales son hasta diez veces mayor que el de la población general [13] [14] [15] [16]. Además, el sangrado constituye per se un predictor independiente de resultados CV adversos, incluida la mortalidad [17] [18] 19].
El ácido acetilsalicílico (AAS) inhibe de forma irreversible la ciclooxigenasa que interviene en la síntesis de precursores de tromboxanos y constituye la base del tratamiento antiplaquetario en la práctica diaria. Tradicionalmente, el AAS se ha recomendado para la prevención primaria y secundaria de las ECV en población general y en grupos de alto riesgo, como los pacientes con ERC. Los pacientes con ERC tienen un mayor riesgo de ECV en comparación con la población general, por lo que la prevención primaria de eventos de ECV en esta población es una estrategia clave para mejorar su atención clínica [20]. Los estudios de AAS en dosis bajas fijas para la prevención primaria en pacientes con ERC han proporcionado resultados contradictorios. En 2018 se publicaron los resultados de tres ensayos clínicos sobre prevención primaria con aspirina. Los ensayos ASCEND y ARRIVE analizaron el uso de aspirina para la prevención primaria de ECV en personas con diabetes y con riesgo CV moderado, respectivamente. Por su parte, el ensayo ASPREE investigó el papel de la aspirina en pacientes de edad avanzada. En una revisión sistemática de Zheng et al [21] sobre un total de 13 ensayos (incluidos los tres ensayos principales) que asignaron al azar a 164.225 participantes con un seguimiento total de 1.050.511 pacientes-año, el uso de aspirina se asoció con reducciones significativas en el resultado CV compuesto (una combinación de mortalidad CV, IM no mortal y ACV no mortal) en comparación con placebo (HR: 0,89; IC 95%, 0,84-0,95. En contra, el uso de aspirina se asoció con un mayor riesgo de eventos hemorrágicos mayores (HR: 1,43; IC95%, 1,30- 1,56). Tras la publicación de estos resultados, la guía ACC/AHA de 2019 sobre la prevención primaria de ECV [22] sugiere que no se debe usar AAS en dosis bajas para la prevención primaria en pacientes de edad ≥ 70 años, o en personas que tienen un mayor riesgo de hemorragia (la guía identifica la ERC, TFGe de 15 a 59 ml/min/1,73 m2 con o sin albuminuria, como un riesgo más alto). A nivel europeo, la guía ESC 2021 sobre prevención de ECV [23] recomienda abstenerse en el uso de AAS como prevención primaria en personas con riesgo CV bajo/moderado debido al mayor riesgo de hemorragia mayor.
En relación a la ERC, los datos publicados reflejan resultados contradictorios. Así, un reciente metanálisis sobre prevención primaria de ECV en pacientes con ERC, que incluía 7.852 pacientes, de los cuales 3.935 recibieron aspirina, no encontró una reducción estadísticamente significativa de eventos CV, mortalidad por todas las causas, o ACV, debido al tratamiento con aspirina, si bien el riesgo de hemorragia grave se incrementó aproximadamente en un 50 % (HR: 1,53; IC 95 %,: 1,13–2,05; P = 0,01, I2 = 0 %) y las hemorragias menores los eventos se duplicaron con creces (HR: 2,64; IC 95 %: 1,64–4,23; P < 0,01, I2 = 0 %), por lo que concluía que la aspirina no se puede recomendar de forma rutinaria para la prevención primaria de ECV en personas con ERC, ya que no hay evidencia de su beneficio, pero existe un mayor riesgo de hemorragia [24]. Por su parte, los resultados del ensayo clínico aleatorizado TIPS-3 parecen apoyar la hipótesis de una prevención CV primaria eficaz con aspirina en la ERC [25]. Un reciente estudio post hoc del TIPS-3, realizó un análisis de subgrupos (983 participantes TFGe con <60 ml/min/1.73 m2 y 4.729 con TFGe ≥ 60 ml/min/1,73 m2), respalda la hipótesis de que la aspirina puede ser un tratamiento eficaz para reducir los eventos CV en personas con ERC. Aunque la comparación de grupos TFGe <60 o 60, no llegó a reflejar significación estadística (p = 0,14), cuando se agrupó toda la cohorte según los terciles de TFGe, el grupo tercil más bajo (TFGe <70 ml/min/1,73 m2, reflejó una reducción proporcional del riesgo de enfermedad CV del 38 % con el tratamiento con aspirina. No se detectó exceso en el riesgo de hemorragia, y las tasas de eventos adversos fueron bajas [26]. En otra reciente revisión sistemática y metanálisis se evaluó el efecto protector CV de la aspirina en pacientes con ERC. En total se incluyeron 35.640 participantes, con un seguimiento medio de 46,8 meses. Los datos combinados mostraron que la aspirina no tuvo un efecto preventivo significativo sobre los eventos de CV (RR = 1,03; IC del 95 %, 0,84-1,27). Sin embargo, la mortalidad CV se redujo significativamente en el grupo de aspirina (RR = 0,74; IC del 95 %, 0,58-0,95). Además, el uso de aspirina no aumentó el riesgo de hemorragias mayores ni de eventos renales, pero sí aumentó significativamente los eventos hemorrágicos menores (RR = 2,11; IC del 95 %, 1,30-3,44) [27]. Actualmente nos encontramos a la espera de conocer los resultados del ensayo Aspirin To Target Arterial Events in Chronic Kidney Disease (ATTACK, NCT03796156) [28], cuyo informe está previsto para 2025. Será el primer ensayo que pruebe los posibles beneficios para la prevención primaria de los resultados CV y los riesgos hemorrágicos en la ERC.
En lo que se refiere a prevención secundaria, existe amplia evidencia de que el uso de AAS a dosis bajas (75 a 100 mg/día) reduce el riesgo de eventos CV en pacientes con ECV preexistente y que, en general, los beneficios superan los riesgos de hemorragia grave, principal complicación de la terapia. Diversos metanálisis de la Antithrombotic Trialists Collaboration (ATC), reconocían un efecto protector del tratamiento antiplaquetario (principalmente con aspirina) en la mayoría de los tipos de pacientes con mayor riesgo de sufrir eventos vasculares oclusivos, entre otros, aquellos con IM, ACV isquémico, angina inestable o estable, IM previo y enfermedad arterial periférica (EAP) [29] [30] [31] 32]. En la ya citada revisión sistemática y metanálisis de Zheng et al [21], se evaluó un total de 9 estudios realizados con posterioridad al año 2000 [33] [34] [35] [36] [37] [38] [38] [40] [41] [42], comprendiendo 113.140 participantes, constató que el uso de aspirina respecto a ausencia de cualquier otro tratamiento se asociaba con reducciones en el resultado cardiovascular compuesto (HR, 0,90 [95% IC, 0,83-0,98]), ACV total (HR, 0,89 [95% IC, 0,83-0,98]) y ACV isquémico (HR, 0,80 [95 % IC, 0,74-0,86]), sin diferencias significativas en la mortalidad CV y por todas las causas ni en el IM. Sin embargo, el uso de AAS se asoció con un mayor riesgo de hemorragia mayor (HR, 1,39 [IC 95%, 1,26-1,53]), hemorragia intracraneal (HR, 1,34 [IC 95%, 1,13-1,60]) y hemorragia gastrointestinal importante (HR, 1,48[ 95%IC, 1,28-1,71]). Actualmente, las principales guías internacionales recomiendan esta pauta [22] [23]. Por el contrario, un reciente estudio observacional que incluía 3.664 participantes con ERC concluía que el uso de aspirina no se asociaba con una reducción de eventos de CV primarios o secundarios o hemorragias graves [43], y un análisis de subgrupos que incluyó 14.662 pacientes de la cohorte ADAPTABLE [44], de los cuales 2.648 (18%) tenían ERC no encontró beneficio en el uso de aspirina en la prevención secundaria de ECV [45].
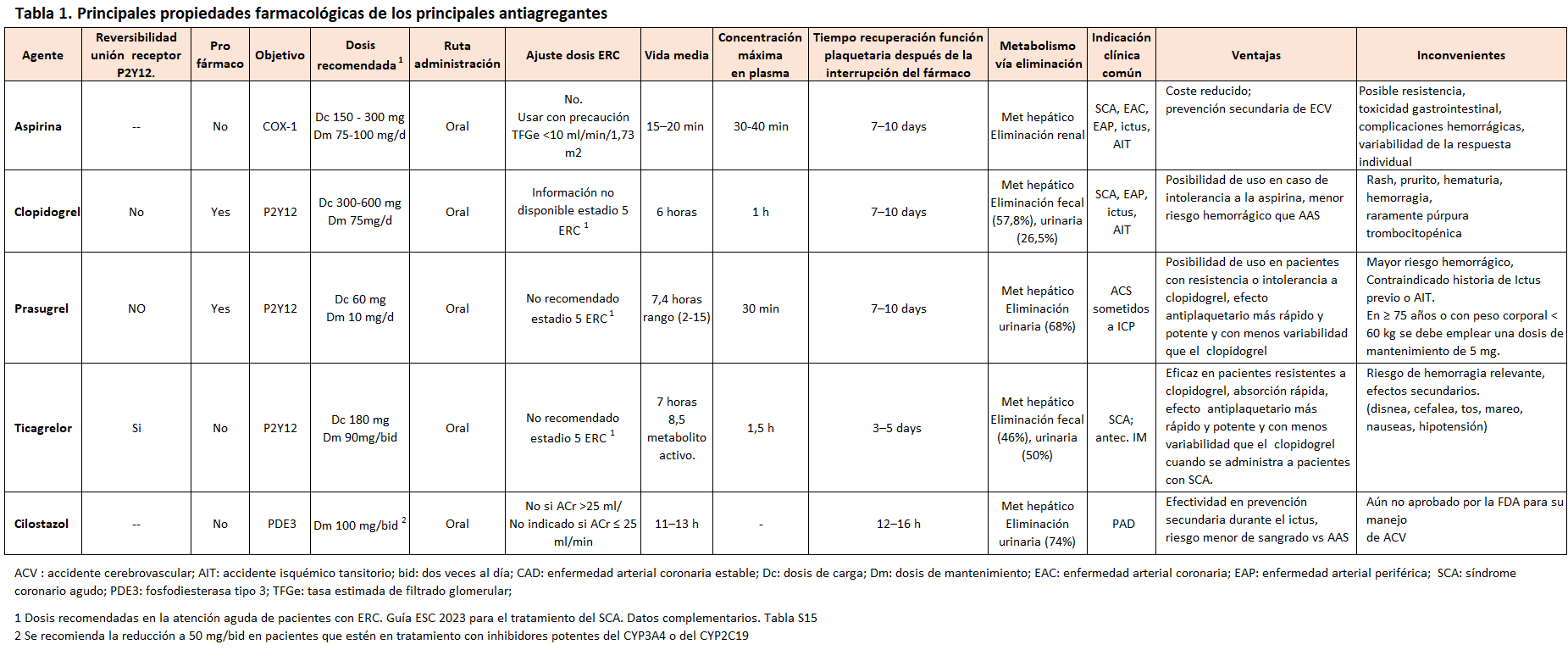
Clopidogrel es una tienopiridina de segunda generación que inhibe selectiva e irreversiblemente el receptor purinérgico de ADP P2Y12 y la posterior activación plaquetaria mediada por ADP. Clopidogrel tienen un inicio de acción prolongado, lo que requiere dosis de carga para alcanzar rápidamente la eficacia [46]. Se encuentra indicado para la prevención secundaria de acontecimientos aterotrombóticos de episodios vasculares isquémicos en pacientes de riesgo con ictus isquémico previo, IM o EAP. En combinación con AAS, clopidogrel se encuentra indicado en pacientes con Síndrome Coronario Agudo (SCA) sin elevación del segmento ST (SCASEST), incluyendo pacientes a los que se le ha colocado un stent después de una ICP, e IM con elevación del segmento ST candidatos a terapia trombolítica. Igualmente, en combinación con AAS, se encuentra indicado en la prevención de Ataque Isquémico Transitorio (AIT) y ACV isquémico menor (NIHSS2 ≤ 3) dentro de las 24 horas posteriores al AIT o ACV isquémico. La guía ESC 2021 sobre prevención de ECV, considera el clopidogrel (75 mg/d) como alternativa a la aspirina en prevención secundaria en caso de intolerancia a la aspirina [23].
Durante más de dos décadas, el clopidogrel ha sido estudiado en múltiples ensayos clínicos. Los resultados de grandes ensayos clínicos han demostrado un beneficio general del clopidogrel sobre la aspirina en la prevención de eventos isquémicos vasculares (IM, ACV, muerte vascular) en pacientes con antecedentes de enfermedad aterosclerótica sintomática. Los ensayos CAPRIE, CURE, CREDO y COMMIT [47] [48] [49] [50] [51], avalaron su uso en pacientes con SCASEST y tras una ICP. Los ensayos CLARITY Y PCI-CLARITY establecieron el papel del clopidogrel en pacientes con SCA agudo con elevación del segmento ST (SCACEST) [52] [53]. Existen varios inconvenientes en el uso de clopidogrel en el SCA. Su eficacia se ve limitada por la lenta y variable transformación del profármaco en metabolito activo (inicio de acción de 3 a 8 h). Igualmente posee una alta variabilidad interindividual en la inhibición plaquetaria, así como un incremento del riesgo de sangrado y un mayor riesgo de trombosis de stent e IM [54). Un reciente metanálisis evaluó la eficacia y seguridad de la monoterapia con clopidogrel frente a aspirina en la población post-ICP tras completar la Terapia Antiplaquetaria Dual (TAPD), concluye indicando que, en comparación con aspirina, el clopidogrel se asoció con reducciones en los MACE y los ACV (isquémicos y hemorrágicos), sin observar diferencias significativas en la mortalidad, hemorragia mayor, IM y revascularización repetida entre los grupos [55].
En relación a la ERC, diversos estudios de pequeño tamaño proporcionan un mensaje consistente de efectos antiplaquetarios atenuados y una menor respuesta al clopidogrel en pacientes con ERC [56] [57] [58]. Al mismo tiempo, los pacientes con ERC tienen una mayor reactividad plaquetaria durante el tratamiento que la población general, lo que se correlaciona con eventos trombóticos y muerte CV en aquellos sometidos a ICP [58] [59] [60].
Prasugrel es una tienopiridina de tercera generación que inhibe de forma irreversible la agregación y la activación plaquetaria a través de la unión de su metabolito activo a la clase P2Y12 de los receptores ADP. Prasugrel, en comparación con el clopidogrel, es más potente, de inicio más rápido, tiene una generación más eficiente de su metabolito activo y una inhibición más consistente de la agregación plaquetaria. Administrado de forma conjunta con AAS, prasugrel está indicado para la prevención de eventos aterotrombóticos en pacientes adultos con SCA (angina inestable, IM sin o con elevación del segmento ST o ICP). El prasugrel se utiliza a menudo en pacientes con resistencia al clopidogrel o en aquellos que no pueden tolerar el clopidogrel como agente de primera línea. Su principal efecto adverso es el sangrado. En el ensayo TRITON-TIMI 38 [61] prasugrel vs. clopidogrel, redujo significativamente la tasa del criterio de valoración principal de eficacia (una combinación de muerte CV, IM no mortal o ACV no mortal): 9,9 % frente a 12,1 %; HR 0,81; IC 95 % 0,73–0,90; P <0,001, si bien el tratamiento con prasugrel también se asoció con un incremento en la hemorragia mayor, aunque aun así resultó más favorable que clopidogrel (Razón de riesgo, 0,87; 95 % IC, de 0,79 a 0,95; p=0,004).
En lo que se refiere a pacientes con ERC, los informes sobre eficacia de prasugrel parecen reflejar una ausencia o pequeña superioridad frente a clopidogrel, mientras que en lo referente a seguridad parece constatarse un aumento del sangrado. Así, en análisis de subgrupos de los ensayos TRITON-TIMI 38 [61] y TRILOGY-ACS [62], prasugrel reflejó efectos más favorables que clopidogrel, aunque en ninguno de los casos de alcanzó significación estadística. Un informe del estudio PROMETHEUS [63] comparó los resultados clínicos de prasugrel vs. clopidogrel en una cohorte de ICP con SCA estratificada por el estadio de la ERC. La cohorte total incluyó 19.832 pacientes, 28,3% con y 71,7% sin ERC. Al año, las tasas no ajustadas de MACE fueron menores con prasugrel vs. clopidogrel tanto en pacientes con ERC (18,3% vs. 26,5%; p < 0,001) como sin ERC (10,9% vs. 17,9%; p < 0,001), aunque las asociaciones se atenuaron después de la estratificación de la propensión. De manera similar, las diferencias no ajustadas en el sangrado a 1 año con prasugrel vs. clopidogrel (6,0% vs. 7,4%; p = 0,18 en pacientes con ERC; 2,6% vs. 3,5%; p = 0,008 en pacientes sin ERC) no fueron significativas después del ajuste por propensión [63]. En otro estudio retrospectivo reciente sobre datos del USRDS (Sistema de Datos Renales de Estados Unidos) concluyó que, específicamente para pacientes con ERC en diálisis, tras la implantación de stents liberadores de fármacos (SLF), el prasugrel o el ticagrelor no ofrecen un beneficio significativo sobre el clopidogrel en términos de resultado CV, mientras que se asocian con una tendencia hacia un mayor riesgo de hemorragia [64].
El ticagrelor, una ciclopentil-triazolo-pirimidina, es un inhibidor oral reversible de tercera generación que actúa directamente sobre el receptor P2Y12. Se absorbe rápidamente, alcanzando concentraciones plasmáticas máximas a las 1,5 h tras su administración, lo que le proporciona posibles ventajas ante las tienopiridinas, como un efecto antiplaquetario más rápido y potente y con menos variabilidad que el clopidogrel. Otra ventaja es que su excreción es mayoritariamente a través de la bilis y las heces, por lo que no hay necesidad de reducir las dosis en pacientes con insuficiencia renal [65].
La evidencia clínica de la eficacia y seguridad de ticagrelor se deriva de dos ensayos: el estudio PLATO [66], que compara ticagrelor con clopidogrel, ambos administrados en combinación con AAS y con otro tratamiento de referencia en pacientes con SCA y el estudio PEGASUS TIMI-54 [67] que compara ticagrelor vs. AAS en pacientes que habían tenido un IM entre 1 y 3 años antes. En el ensayo PLATO, ticagrelor redujo significativamente la incidencia del criterio de valoración principal, compuesto por muerte CV, IM no mortal o ACV no mortal (9.8% vs. 11.7%, HR 0.84; 95% CI, 0.77 - 0.92; P<0.001), sin diferencias significativas en las tasas de hemorragia mayor (11,6% vs. 11,2%; P = 0,43) [66]. En el ensayo PEGASUS TIMI-54 el tratamiento con ticagrelor (90 mg dos veces al día o bien 60 mg dos veces al día) combinado con una dosis baja de AAS (75-150 mg), comparado con tratamiento único con AAS, redujo significativamente el riesgo de muerte CV, IM o ACV, aunque aumentó el riesgo de hemorragia mayor.
En lo que se refiere a la eficacia y seguridad de ticagrelor en la ERC, los datos existentes resultan contradictorios. En un análisis de subgrupos del ensayo PLATO, sobre 15.202 pacientes de los que se disponía de información sobre creatinina sérica al ingreso, de los cuales 3.237 tenían un aclaramiento de creatinina < 60 mL/min, y sólo 214 pacientes tenían un aclaramiento calculado <30 ml/min, ticagrelor produjo una mayor reducción del riesgo del criterio de valoración principal en pacientes con aclaramiento de creatinina reducido en comparación con pacientes con función renal normal (Cr>60 ml/min) (HR 0,77; IC del 95 %: 0,65 a 0,90 frente a HR 0,90; IC del 95 %: 0,79 a 1,02), aunque no se alcanzó significación estadística. Los pacientes con ERC tratados con ticagrelor no tuvieron un mayor riesgo relativo de hemorragias mayores en comparación con los pacientes sin ERC [68]. En un metanálisis sobre datos de tres análisis de subgrupos de ensayos clínicos aleatorios y dos estudios observacionales prospectivos (n=31.234) que comparó prasugrel y ticagrelor con clopidogrel en pacientes con ERC con SCA, se dedujo que entre los pacientes tratados mediante ICP, pareció haber un beneficio con ticagrelor, aunque el número de pacientes con un aclaramiento de creatinina inferior a 45 ml/min fue limitado [69]. En una reciente revisión sistemática y metanálisis, en la que 2.456 participantes con ERC fueron asignados a ticagrelor y 13.208 participantes con ERC fueron asignados a clopidogrel, mostró que la tasa de MACE no difirieron significativamente entre ambos tratamientos. Sin embargo, ticagrelor se asoció con un sangrado BARC significativamente mayor [70]. Respecto a pacientes en diálisis, en un estudio retrospectivo sobre 1.067 pacientes con SCA y ERC, incluida la enfermedad renal terminal (ERT), que se sometieron a la implantación de un SLF de nueva generación, se compararon los resultados de los pacientes tratados con TAPD basada en ticagrelor (n=449) y aquellos tratados con TAPD basado en clopidogrel (n=618). Los resultados reflejaron que los eventos isquémicos y hemorrágicos de los pacientes con SCA y ERC variaron según el estadio de la ERC. Así, los pacientes con ERT mostraron las mayores tasas de MACE y hemorragia (p <0,001). No hubo diferencias en la tasa de MACE entre los grupos de tratamiento, aunque si se observó una tendencia no significativa hacia un aumento de la tasa de hemorragia en el grupo TAPD basado en ticagrelor (p = 0,079). Entre los pacientes con ERC en estadio 3/4, el grupo TAPD basado en ticagrelor mostró una tasa MACCE reducida (3,6 % frente a 8,7 %, HR = 0,41, IC 95 % = 0,19-0,86, P = 0,018) y una tasa de hemorragia similar (5,1% frente a 3,2%, HR = 1,61, IC del 95% = 0,70-3,71, P = 0,267), en comparación con los del grupo TAPD basado en clopidogrel [71]. Igualmente, una reciente revisión sistemática sobre pacientes en diálisis con SCA (agudo o crónico) no observó diferencias significativas en los resultados de eficacia o seguridad entre ticagrelor y clopidogrel [72]. Un estudio retrospectivo sobre pacientes en diálisis crónica (1.915 pacientes en el grupo de clopidogrel y 270 pacientes en el grupo de ticagrelor), concluía que en comparación con clopidogrel, ticagrelor se asociaba con mayores riesgo de MACE, muerte, muerte cardíaca y riesgo de hemorragia mayor dentro de los 12 meses en pacientes con SCA en diálisis [73], lo que viene a concordar con otra revisión sistemática señala que ticagrelor, en comparación con clopidogrel, se asocia con un riesgo significativamente mayor de MACE, muerte por todas las causas y eventos hemorrágicos importantes, sugiriendo que clopidogrel puede ser una mejor opción para personas con SCA sometidos a diálisis debido a su menor riesgo de MACE, muerte por todas las causas y eventos hemorrágicos importantes en comparación con ticagrelor [74].
En la actualidad, nos encontramos a la espera de los resultados del ensayo clínico TROUPER, que evaluara la eficacia y seguridad del ticagrelor vs. clopidogrel en pacientes con ERC, en estadios 3b, 4 y 5 o en hemodiálisis crónica sometidos a ICP. El criterio de valoración principal será la tasa de MACE, incluida muerte, IM, revascularización urgente y ACV, al año de seguimiento. También se registrarán los sangrados. Se espera que sus datos puedan ayudar a decidir la terapia óptima en esta población y actualizar las pautas [54].
Los inhibidores de GP IIb/IIIa disponibles incluyen abciximab, eptifibatida y tirofiban. Los ensayos clínicos no han demostrado un beneficio adicional de la administración de inhibidores de GP IIb/IIIa en pacientes con SCA, aunque si un incremento de episodios hemorrágicos cuando se utilizaron estos agentes. Esto ha determinado que las vigentes guías europeas señalan que su uso sólo puede considerarse en situaciones específicas de “rescate” en caso de evidencia angiográfica de un trombo grande, reflujo lento o nulo y otras complicaciones trombóticas en pacientes con IM con elevación del segmento ST sometidos a ICP o en pacientes con SCASEST sometidos a ICP de alto riesgo sin tratamiento previo con antagonistas orales del receptor P2Y12 [75] [76].
El cilostazol es inhibidor reversible de la fosfodiesterasa tipo III (PDE3), y a diferencia de otros agentes antiplaquetarios, no sólo inhibe la función plaquetaria, sino que también mejora la función de las células endoteliales, por lo que su uso puede resultar pertinente en pacientes con ERC [77]. El cilostazol no precisa ajuste de la dosis en pacientes con un aclaramiento de creatinina >25 ml/min, encontrándose contraindicado en pacientes con un aclaramiento de creatinina ≤ 25 ml/min [78]. Este agente antiplaquetario se utiliza principalmente para la claudicación intermitente en pacientes con EAP. Además, varios ensayos controlados [79] [80] sugirieron que, en comparación con la aspirina, el cilostazol se asocia con un número significativamente menor de ACV hemorrágicos, el criterio de valoración combinado de ACV, IM y muerte vascular y eventos hemorrágicos totales, con un sangrado gastrointestinal menor cuando se usa para la prevención secundaria del ictus, por lo que en ausencia de evidencia contraria y aparentemente con menor riesgo de hemorragia, podría ser razonable extender esta terapia a la población en diálisis.
Varios metanálisis y pequeños estudios observacionales han constatado que la terapia con cilostazol aumentó las distancias máximas y las distancias recorridas sin dolor en pacientes con EAP [81], así como con reducciones en la reestenosis angiográfica binaria y en la repetición de la revascularización, sin aumento en el riesgo de trombosis del stent o hemorragia [82]. La eficacia del cilostazol en pacientes con ERC se ha analizado en diversos estudios de pequeño tamaño. Así, un estudio retrospectivo sobre 217 pacientes en HD con EAP asintomática, se observaron tasas más bajas de ECV y mortalidad por todas las causas en los usuarios de dosis bajas de cilostazol, aunque no se informaron resultados de seguridad [83]. En un estudio retrospectivo sobre 595 pacientes en HD sometidos a terapia endovascular para un diagnóstico clínico de EAP el tratamiento con cilostazol se asoció a mayores tasas de supervivencia libre de eventos CV y ausencia de ACV a 10 años que en el grupo de control no tratado con cilostazol [84].
La antiagregación plaquetaria es un componente importante del tratamiento de todos los pacientes que presentan SCA, y a pesar de que los pacientes con ERC representan entre el 20 y el 40% de los pacientes ingresados por SCA, definir el delicado equilibrio entre seguridad y eficacia del tratamiento antiplaquetario óptimo aún es incierto y está sujeto a un debate continuo [69]. La elección específica y la combinación de la terapia, el momento de su inicio y la duración del tratamiento dependen de diversos factores intrínsecos del paciente y del tipo de procedimiento. En todo caso, las decisiones de tratamiento deben tomarse sopesando los beneficios del tratamiento antitrombótico frente al riesgo de hemorragia.
Los fármacos antiplaquetarios desempeñan un papel clave en la fase aguda del tratamiento del SCA. Basado en los resultados de los ensayos PLATO y TRITON-TIMI 38, se recomienda la TAPD, que incluye AAS y un potente inhibidor del receptor P2Y12 (prasugrel o ticagrelor), como estrategia predeterminada para pacientes con SCA. Debido a su menor inhibición plaquetaria y mayor variabilidad, el clopidogrel sólo debe usarse cuando prasugrel o ticagrelor se encuentren contraindicados por su mayor riesgo hemorrágico, o en pacientes de edad avanzada (p. ej., ≥70 años). La TAPD, es el estándar de atención para la prevención secundaria en pacientes con SCA después de una ICP con implante de SLF para reducir la trombosis del stent y el fracaso de la lesión diana. Sin embargo, este beneficio está intrínsecamente asociado con un mayor riesgo de hemorragia, por lo que, en pacientes con alto riesgo de hemorragia gastrointestinal se recomienda un inhibidor de la bomba de protones en combinación con TAPD [85] [86]. Los inhibidores potentes de P2Y12, prasugrel y ticagrelor, han demostrado más eficaces en términos de reducción de eventos isquémicos y también menos seguros en términos de eventos hemorrágicos que clopidogrel. En este contexto, se han desarrollado nuevas estrategias para lograr un equilibrio entre los riesgos individuales de trombosis y hemorragia mediante la modulación de la duración del TAPD (tratamiento corto o prolongado) y la composición (clopidogrel o un potente inhibidor de P2Y12). Se debe considerar prasugrel con preferencia a ticagrelor para pacientes sin antecedentes de ictus (ya sea isquémico o hemorrágico), con SCA que proceden a ICP [87] [88]. En pacientes con EAP crónica sintomática, la aspirina se prescribe comúnmente como tratamiento antiplaquetario único a largo plazo, aunque también se puede prescribir clopidogrel. El cilostazol también está aprobado para el tratamiento de pacientes con claudicación intermitente en ausencia de necrosis tisular o dolor en reposo. Se puede prescribir aspirina asociada a TAPD con clopidogrel durante un máximo de 90 días en pacientes con ACV reciente (dentro de los 30 días) o AIT atribuible a estenosis grave (70-99%) de una arteria intracraneal principal. Más allá del TAPD, se puede prescribir aspirina para la prevención secundaria a largo plazo del ACV y el AIT [76]. La TAPD basada en inhibidores de P2Y12 se han utilizado ampliamente como una alternativa a la aspirina en la práctica clínica para la prevención secundaria del ACV. Un reciente metanálisis comparó la eficacia y seguridad de los inhibidores de P2Y12 vs. aspirina para la prevención del ACV en pacientes con ACV o AIT previo. Los resultados del estudio sugieren que los inhibidores de P2Y12 son más efectivos que la aspirina para prevenir el ACV isquémico recurrente entre pacientes con ACV isquémico a pesar de la ausencia de cualquier efecto sobre un nuevo ACV isquémico o hemorrágico, un nuevo evento vascular clínico, muerte por cualquier causa, y eventos hemorrágicos mayores o menores [89].
Las guías europeas actuales recomiendan para la mayoría de los pacientes sometidos a ICP con implante de SLF un período de TAPD de seis meses con aspirina y clopidogrel si la presentación clínica es un síndrome coronario crónico y 12 meses con aspirina y ticagrelor o prasugrel si es un SCA [75] [90]. Dado que el riesgo de trombosis del stent se manifiesta ordinariamente dentro de los primeros 30 días posteriores a la ICP, y que el riesgo de hemorragia asociado con la TAPD permanece relativamente constante durante toda la duración del tratamiento, se han formulado diversas propuestas sobre duraciones cortas de la TAPD. Diversos ensayos que compararon diferentes duraciones de TAPD generalmente no han mostrado un exceso de eventos isquémicos con TAPD más cortos [91] [92]. Se ha demostrado que las duraciones muy cortas (de 1 a 3 meses) de TAPD seguidas de monoterapia con inhibidores de P2Y12 reducen los eventos hemorrágicos sin aumentar los eventos CV en comparación con las duraciones estándar de TAPD después de una ICP. Sin embargo, la incidencia de eventos hemorrágicos mayores dentro del período obligatorio de TAPD de 1 mes después de la ICP sigue siendo alta en la práctica clínica real, particularmente en pacientes con SCA o alto riesgo hemorrágico [93] [94]. Al mismo tiempo, revisiones sistemáticas recientes constatan que un régimen TAPD abreviado de 1 o 3 meses podría proporcionar un mejor perfil riesgo-beneficio, asociándose con menor hemorragia y mortalidad CV, sin aumentar los eventos isquémicos, en comparación con un régimen TAPD ≥ 6 meses [93] [95].
En relación a la ERC, una reciente revisión sistemática y metanálisis sobre estudios evaluó los resultados clínicos de 5 regímenes de terapia antiplaquetaria: (doble dosis de carga en TAPD basada en clopidogrel, doble dosis de mantenimiento en TAPD basada en clopidogrel, TAPD basado en ticagrelor, TAPD basado en prasugrel y triple terapia antiplaquetaria con cilostazol) sobre la dosis estándar de TAPD basada en clopidogrel en pacientes con insuficiencia renal. La intervención redujo sustancialmente la incidencia de mortalidad por todas las causas (RR 0,67; p = 0,003), resultados cardíacos adversos importantes (RR 0,79; p < 0,00001) e IM (RR 0,28; p = 0,00007) sin hemorragia importante (RR 1,14; p = 0,33) en pacientes con ERC, pero no se observaron diferencias significativas con la mortalidad CV y la trombosis del stent. El análisis de subgrupos reveló un riesgo de hemorragia sustancialmente elevado en pacientes con ERC grave o en hemodiálisis (RR 1,68; p = 0,002), concluyendo que las intervenciones evaluadas mejoraban considerablemente los resultados clínicos en pacientes con ERC, si bien una dosis estándar de terapia antiplaquetaria basada en clopidogrel es favorable en pacientes con ERC grave [96]. El régimen óptimo de la TAPD tras una ICP en la ERC plantea un desafío debido al aumento de las tendencias al sangrado y la coagulación. Un análisis de subgrupos del Canadian Observational Antiplatelet Study (COAPT), que compara el tipo y la duración de TAPD y los resultados asociados entre pacientes con y sin ERC (TFGe < 60 ml/min /1,73 m2) constató que la ERC se asoció con MACE tanto en pacientes que tomaban prasugrel/ticagrelor (p = 0,017) como en aquellos que tomaban clopidogrel (p < 0,001) (p para heterogeneidad = 0,70) así como con un aumento del sangrado sólo entre los pacientes que recibieron prasugrel/ticagrelor (p = 0,007), pero no entre los que recibieron clopidogrel (p = 0,64) (p para heterogeneidad = 0,036) [97]. Metanálisis recientes que evalúan la eficacia y seguridad del TAPD de larga vs. corta duración en pacientes con ERC después de una ICP, señalan que la monoterapia con inhibidores de P2Y 12 después de un ciclo acortado de TAPD (1 a 3 meses) parece estar asociada con un riesgo similar de eventos isquémicos y un menor riesgo de eventos hemorrágicos en comparación con TAPD de 12 meses [98] [99] [100].
En 2022 se publicó una amplia revisión Cochrane en la que se incluyeron 113 estudios con 51.959 participantes con ERC. Sus resultados indican que, con niveles de certeza baja o moderada, los agentes antiplaquetarios vs. placebo o ningún tratamiento, probablemente reducen el IM, tienen efectos inciertos sobre el ACV mortal o no mortal y pueden tener poco o ningún efecto sobre la muerte por cualquier causa, y que probablemente aumenta las hemorragias graves y menores en personas con ERC y en personas tratadas con hemodiálisis HD. Por otro lado, los efectos del tratamiento de los agentes antiplaquetarios sobre el ACV, la muerte CV, la ERC, la pérdida del injerto de un trasplante renal, el rechazo del trasplante, el aclaramiento de creatinina, la proteinuria, el fallo del acceso vascular, los problemas CV y la hospitalización son inciertos [101].
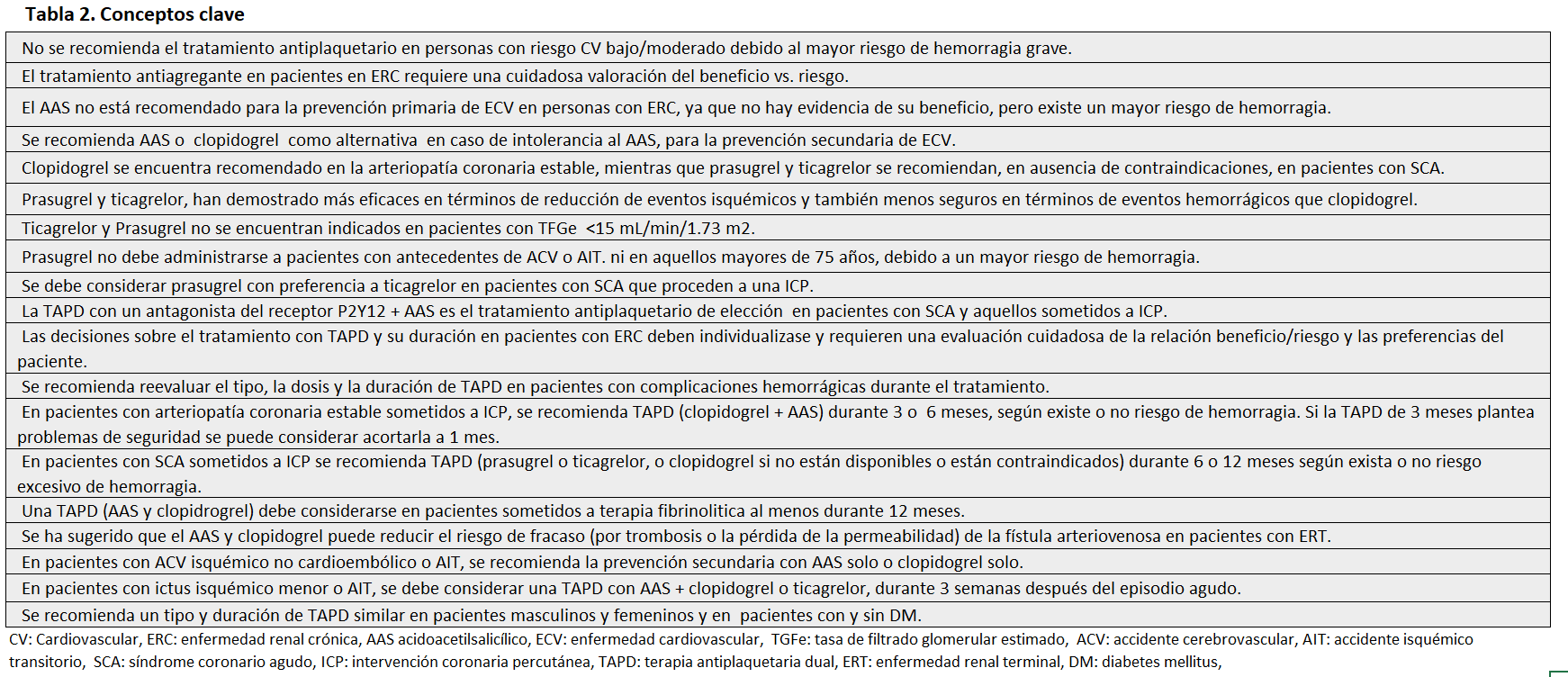
La experiencia actual respecto al tratamiento antiplaquetario en la ERC se basa principalmente en análisis post hoc de los principales ensayos clínicos. En los que los pacientes con ERC, principalmente en estadios 4-5 o HD, a menudo, han estado excluidos o subrepresentados, por lo que la evidencia en esta subpoblación, en general resulta de escasa calidad. Por ello, la estrategia de tratamiento antiagregante en pacientes con ERC debe individualizarse en función del riesgo-beneficio, así como en las preferencias individuales de cada paciente, su función cognitiva y esperanza de vida. El tratamiento antiplaquetario en pacientes en ERC, en general no difiere del establecido para población general, salvo las peculiaridades derivadas del elevado riesgo hemorrágico de estos pacientes. La (Tabla 2) muestra un resumen de conceptos clave y principales recomendaciones recogidas en las guías internacionales vigentes [23] [32] [76] [90] [102] [103], bien de forma expresa o deducidas de las establecidas para población general, sobre tratamiento antiplaquetario para pacientes con ERC.
La evolución y el perfeccionamiento de las terapias antiplaquetarias constituyen un área de investigación en constante desarrollo que intenta adaptarse de manera continua a las demandas clínicas emergentes suscitadas en diversos ensayos clínicos. A pesar del amplio arsenal terapéutico disponible, la evidencia sobre eficacia y seguridad del tratamiento antiagregante en pacientes con ERC es débil. La experiencia actual con el tratamiento antiplaquetario en la ERC se basa predominantemente en análisis post hoc de grandes registros con poco poder estadístico, en los que los pacientes con estadio ≥ 4 de ERC a menudo están escasamente representados o incluso excluidos. Por ello, y dado que la prevalencia de eventos sigue siendo notablemente elevada, el tratamiento antiagregante en pacientes en ERC requiere una cuidadosa valoración del beneficio vs. riesgo en estos pacientes. Al mismo tiempo subsiste la necesidad de explorar nuevos enfoques terapéuticos.
Referencias bibliográficas
1
.
Chronic Kidney Disease Prognosis Consortium; Matsushita K, van der Velde M, Astor BC, Woodward M, Levey AS, de Jong PE, Coresh J, Gansevoort RT. Association of estimated glomerular filtration rate and albuminuria with all-cause and cardiovascular mortality in general population cohorts: a collaborative meta-analysis. Lancet. 2010 Jun 12;375(9731):2073-81. doi: 10.1016/S0140-6736(10)60674-5. Epub 2010 May 17. PMID: 20483451; PMCID: PMC3993088.
http://www.ncbi.nlm.nih.gov/pubmed/?term=PMID%3A+20483451%3B+PMCID%3A+PMC3993088
2
.
Shlipak MG, Fried LF, Cushman M, Manolio TA, Peterson D, Stehman-Breen C, Bleyer A, Newman A, Siscovick D, Psaty B. Cardiovascular mortality risk in chronic kidney disease: comparison of traditional and novel risk factors. JAMA. 2005 Apr 13;293(14):1737-45. doi: 10.1001/jama.293.14.1737. PMID: 15827312.
http://www.ncbi.nlm.nih.gov/pubmed/?term=PMID%3A+15827312
5
.
Best PJ, Lennon R, Ting HH, Bell MR, Rihal CS, Holmes DR, Berger PB. The impact of renal insufficiency on clinical outcomes in patients undergoing percutaneous coronary interventions. J Am Coll Cardiol. 2002 Apr 3;39(7):1113-9. doi: 10.1016/s0735-1097(02)01745-x. PMID: 11923033.
http://www.ncbi.nlm.nih.gov/pubmed/?term=PMID%3A+11923033
7
.
Levey AS, Beto JA, Coronado BE, Eknoyan G, Foley RN, Kasiske BL, Klag MJ, Mailloux LU, Manske CL, Meyer KB, Parfrey PS, Pfeffer MA, Wenger NK, Wilson PW, Wright JT Jr. Controlling the epidemic of cardiovascular disease in chronic renal disease: what do we know? What do we need to learn? Where do we go from here? National Kidney Foundation Task Force on Cardiovascular Disease. Am J Kidney Dis. 1998 Nov;32(5):853-906. doi: 10.1016/s0272-6386(98)70145-3. PMID: 9820460.
http://www.ncbi.nlm.nih.gov/pubmed/?term=PMID%3A+9820460
9
.
Gomez-Fernández P, Martín Santana A, Arjona Barrionuevo JD. Oral anticoagulation in chronic kidney disease with atrial fibrillation. Nefrologia (Engl Ed). 2021 Mar-Apr;41(2):137-153. doi: 10.1016/j.nefroe.2021.04.005. Epub 2021 May 10. PMID: 36165375.
http://www.ncbi.nlm.nih.gov/pubmed/?term=PMID%3A+36165375
10
.
Fox CS, Matsushita K, Woodward M, Bilo HJ, Chalmers J, Heerspink HJ, Lee BJ, Perkins RM, Rossing P, Sairenchi T, Tonelli M, Vassalotti JA, Yamagishi K, Coresh J, de Jong PE, Wen CP, Nelson RG; Chronic Kidney Disease Prognosis Consortium. Associations of kidney disease measures with mortality and end-stage renal disease in individuals with and without diabetes: a meta-analysis. Lancet. 2012 Nov 10;380(9854):1662-73. doi: 10.1016/S0140-6736(12)61350-6. Epub 2012 Sep 24. Erratum in: Lancet. 2013 Feb 2;381(9864):374. PMID: 23013602; PMCID: PMC3771350.
http://www.ncbi.nlm.nih.gov/pubmed/?term=PMID%3A+23013602%3B+PMCID%3A+PMC3771350
12
.
Mahmoodi BK, Matsushita K, Woodward M, Blankestijn PJ, Cirillo M, Ohkubo T, Rossing P, Sarnak MJ, Stengel B, Yamagishi K, Yamashita K, Zhang L, Coresh J, de Jong PE, Astor BC; Chronic Kidney Disease Prognosis Consortium. Associations of kidney disease measures with mortality and end-stage renal disease in individuals with and without hypertension: a meta-analysis. Lancet. 2012 Nov 10;380(9854):1649-61. doi: 10.1016/S0140-6736(12)61272-0. Epub 2012 Sep 24. Erratum in: Lancet. 2012 Nov 10;380(9854):1648. PMID: 23013600; PMCID: PMC3993095.
http://www.ncbi.nlm.nih.gov/pubmed/?term=PMID%3A+23013600%3B+PMCID%3A+PMC3993095
15
.
Moal V, Brunet P, Dou L, Morange S, Sampol J, Berland Y. Impaired expression of glycoproteins on resting and stimulated platelets in uraemic patients. Nephrol Dial Transplant. 2003 Sep;18(9):1834-41. doi: 10.1093/ndt/gfg185. PMID: 12937232.
http://www.ncbi.nlm.nih.gov/pubmed/?term=PMID%3A+12937232
16
.
Kaw D, Malhotra D. Platelet dysfunction and end-stage renal disease. Semin Dial. 2006 Jul-Aug;19(4):317-22. doi: 10.1111/j.1525-139X.2006.00179.x. PMID: 16893410.
17
.
Rao SV, O''''Grady K, Pieper KS, Granger CB, Newby LK, Van de Werf F, Mahaffey KW, Califf RM, Harrington RA. Impact of bleeding severity on clinical outcomes among patients with acute coronary syndromes. Am J Cardiol. 2005 Nov 1;96(9):1200-6. doi: 10.1016/j.amjcard.2005.06.056. Epub 2005 Sep 12. PMID: 16253582.
http://www.ncbi.nlm.nih.gov/pubmed/?term=PMID%3A+16253582
18
.
Mehran R, Pocock SJ, Stone GW, Clayton TC, Dangas GD, Feit F, Manoukian SV, Nikolsky E, Lansky AJ, Kirtane A, White HD, Colombo A, Ware JH, Moses JW, Ohman EM. Associations of major bleeding and myocardial infarction with the incidence and timing of mortality in patients presenting with non-ST-elevation acute coronary syndromes: a risk model from the ACUITY trial. Eur Heart J. 2009 Jun;30(12):1457-66. doi: 10.1093/eurheartj/ehp110. Epub 2009 Apr 7. PMID: 19351691; PMCID: PMC2695951.
http://www.ncbi.nlm.nih.gov/pubmed/?term=PMID%3A+19351691%3B+PMCID%3A+PMC2695951
19
.
Eikelboom JW, Mehta SR, Anand SS, Xie C, Fox KA, Yusuf S. Adverse impact of bleeding on prognosis in patients with acute coronary syndromes. Circulation. 2006 Aug 22;114(8):774-82. doi: 10.1161/CIRCULATIONAHA.106.612812. Epub 2006 Aug 14. PMID: 16908769.
http://www.ncbi.nlm.nih.gov/pubmed/?term=PMID%3A+16908769
22
.
Arnett DK, Blumenthal RS, Albert MA, Buroker AB, Goldberger ZD, Hahn EJ, Himmelfarb CD, Khera A, Lloyd-Jones D, McEvoy JW, Michos ED, Miedema MD, Muñoz D, Smith SC Jr, Virani SS, Williams KA Sr, Yeboah J, Ziaeian B. 2019 ACC/AHA Guideline on the Primary Prevention of Cardiovascular Disease: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines. Circulation. 2019 Sep 10;140(11):e596-e646. doi: 10.1161/CIR.0000000000000678. Epub 2019 Mar 17. Erratum in: Circulation. 2019 Sep 10;140(11):e649-e650. Erratum in: Circulation. 2020 Jan 28;141(4):e60. Erratum in: Circulation. 2020 Apr 21;141(16):e774. PMID: 30879355; PMCID: PMC7734661.
http://www.ncbi.nlm.nih.gov/pubmed/?term=PMID%3A+30879355%3B+PMCID%3A+PMC7734661
23
.
Visseren FLJ, Mach F, Smulders YM, Carballo D, Koskinas KC, Bäck M, Benetos A, Biffi A, Boavida JM, Capodanno D, Cosyns B, Crawford C, Davos CH, Desormais I, Di Angelantonio E, Franco OH, Halvorsen S, Hobbs FDR, Hollander M, Jankowska EA, Michal M, Sacco S, Sattar N, Tokgozoglu L, Tonstad S, Tsioufis KP, van Dis I, van Gelder IC, Wanner C, Williams B; ESC National Cardiac Societies; ESC Scientific Document Group. 2021 ESC Guidelines on cardiovascular disease prevention in clinical practice. Eur Heart J. 2021 Sep 7;42(34):3227-3337. doi: 10.1093/eurheartj/ehab484. Erratum in: Eur Heart J. 2022 Nov 7;43(42):4468. PMID: 34458905.
http://www.ncbi.nlm.nih.gov/pubmed/?term=PMID%3A+34458905
24
.
Pallikadavath S, Ashton L, Brunskill NJ, Burton JO, Gray LJ, Major RW. Aspirin for the primary prevention of cardiovascular disease in individuals with chronic kidney disease: a systematic review and meta-analysis. Eur J Prev Cardiol. 2022 Feb 3;28(17):1953-1960. doi: 10.1093/eurjpc/zwab132. PMID: 34448849.
http://www.ncbi.nlm.nih.gov/pubmed/?term=PMID%3A+34448849
25
.
Yusuf S, Joseph P, Dans A, Gao P, Teo K, Xavier D, López-Jaramillo P, Yusoff K, Santoso A, Gamra H, Talukder S, Christou C, Girish P, Yeates K, Xavier F, Dagenais G, Rocha C, McCready T, Tyrwhitt J, Bosch J, Pais P; International Polycap Study 3 Investigators. Polypill with or without Aspirin in Persons without Cardiovascular Disease. N Engl J Med. 2021 Jan 21;384(3):216-228. doi: 10.1056/NEJMoa2028220. Epub 2020 Nov 13. PMID: 33186492; PMCID: PMC7116860.
http://www.ncbi.nlm.nih.gov/pubmed/?term=PMID%3A+33186492%3B+PMCID%3A+PMC7116860
26
.
Mann JFE, Joseph P, Gao P, Pais P, Tyrwhitt J, Xavier D, Dans T, Jaramillo PL, Gamra H, Yusuf S; TIPS-3 investigators. Effects of aspirin on cardiovascular outcomes in patients with chronic kidney disease. Kidney Int. 2023 Feb;103(2):403-410. doi: 10.1016/j.kint.2022.09.023. Epub 2022 Oct 27. PMID: 36341885.
http://www.ncbi.nlm.nih.gov/pubmed/?term=PMID%3A+36341885
27
.
Chen T, Deng Y, Gong R. Cardiovascular Protection of Aspirin in Chronic Kidney Disease Patients: An Updated Systematic Review and Meta-Analysis. Curr Vasc Pharmacol. 2023 May 30. doi: 10.2174/1570161121666230530154647. Epub ahead of print. PMID: 37259222.
http://www.ncbi.nlm.nih.gov/pubmed/?term=PMID%3A+37259222
28
.
Gallagher H, Dumbleton J, Maishman T, Whitehead A, Moore MV, Fuat A, Fitzmaurice D, Henderson RA, Lord J, Griffith KE, Stevens P, Taal MW, Stevenson D, Fraser SD, Lown M, Hawkey CJ, Roderick PJ. Aspirin to target arterial events in chronic kidney disease (ATTACK): study protocol for a multicentre, prospective, randomised, open-label, blinded endpoint, parallel group trial of low-dose aspirin vs. standard care for the primary prevention of cardiovascular disease in people with chronic kidney disease. Trials. 2022 Apr 21;23(1):331. doi: 10.1186/s13063-022-06132-z. PMID: 35449015; PMCID: PMC9021558.
http://www.ncbi.nlm.nih.gov/pubmed/?term=PMID%3A+35449015%3B+PMCID%3A+PMC9021558
30
.
Collaborative overview of randomised trials of antiplatelet therapy--I: Prevention of death, myocardial infarction, and stroke by prolonged antiplatelet therapy in various categories of patients. Antiplatelet Trialists'''' Collaboration. BMJ. 1994 Jan 8;308(6921):81-106. Erratum in: BMJ 1994 Jun 11;308(6943):1540. PMID: 8298418; PMCID: PMC2539220.
http://www.ncbi.nlm.nih.gov/pubmed/?term=PMID%3A+8298418%3B+PMCID%3A+PMC2539220
31
.
Antithrombotic Trialists'''' Collaboration. Collaborative meta-analysis of randomised trials of antiplatelet therapy for prevention of death, myocardial infarction, and stroke in high risk patients. BMJ. 2002 Jan 12;324(7329):71-86. doi: 10.1136/bmj.324.7329.71. Erratum in: BMJ 2002 Jan 19;324(7330):141. PMID: 11786451; PMCID: PMC64503.
http://www.ncbi.nlm.nih.gov/pubmed/?term=PMID%3A+11786451%3B+PMCID%3A+PMC64503
32
.
Antithrombotic Trialists'''' (ATT) Collaboration; Baigent C, Blackwell L, Collins R, Emberson J, Godwin J, Peto R, Buring J, Hennekens C, Kearney P, Meade T, Patrono C, Roncaglioni MC, Zanchetti A. Aspirin in the primary and secondary prevention of vascular disease: collaborative meta-analysis of individual participant data from randomised trials. Lancet. 2009 May 30;373(9678):1849-60. doi: 10.1016/S0140-6736(09)60503-1. PMID: 19482214; PMCID: PMC2715005.
http://www.ncbi.nlm.nih.gov/pubmed/?term=PMID%3A+19482214%3B+PMCID%3A+PMC2715005
33
.
Rothwell PM, Fowkes FG, Belch JF, Ogawa H, Warlow CP, Meade TW. Effect of daily aspirin on long-term risk of death due to cancer: analysis of individual patient data from randomised trials. Lancet. 2011 Jan 1;377(9759):31-41. doi: 10.1016/S0140-6736(10)62110-1. Epub 2010 Dec 6. PMID: 21144578.
http://www.ncbi.nlm.nih.gov/pubmed/?term=PMID%3A+21144578
34
.
Ridker PM, Cook NR, Lee IM, Gordon D, Gaziano JM, Manson JE, Hennekens CH, Buring JE. A randomized trial of low-dose aspirin in the primary prevention of cardiovascular disease in women. N Engl J Med. 2005 Mar 31;352(13):1293-304. doi: 10.1056/NEJMoa050613. Epub 2005 Mar 7. PMID: 15753114.
http://www.ncbi.nlm.nih.gov/pubmed/?term=PMID%3A+15753114
35
.
Ogawa H, Nakayama M, Morimoto T, Uemura S, Kanauchi M, Doi N, Jinnouchi H, Sugiyama S, Saito Y; Japanese Primary Prevention of Atherosclerosis With Aspirin for Diabetes (JPAD) Trial Investigators. Low-dose aspirin for primary prevention of atherosclerotic events in patients with type 2 diabetes: a randomized controlled trial. JAMA. 2008 Nov 12;300(18):2134-41. doi: 10.1001/jama.2008.623. Epub 2008 Nov 9. Erratum in: JAMA. 2009 May 13;301(18):1882. Erratum in: JAMA. 2012 Nov 14;308(18):1861. PMID: 18997198.
http://www.ncbi.nlm.nih.gov/pubmed/?term=PMID%3A+18997198
36
.
McNeil JJ, Wolfe R, Woods RL, Tonkin AM, Donnan GA, Nelson MR, Reid CM, Lockery JE, Kirpach B, Storey E, Shah RC, Williamson JD, Margolis KL, Ernst ME, Abhayaratna WP, Stocks N, Fitzgerald SM, Orchard SG, Trevaks RE, Beilin LJ, Johnston CI, Ryan J, Radziszewska B, Jelinek M, Malik M, Eaton CB, Brauer D, Cloud G, Wood EM, Mahady SE, Satterfield S, Grimm R, Murray AM; ASPREE Investigator Group. Effect of Aspirin on Cardiovascular Events and Bleeding in the Healthy Elderly. N Engl J Med. 2018 Oct 18;379(16):1509-1518. doi: 10.1056/NEJMoa1805819. Epub 2018 Sep 16. PMID: 30221597; PMCID: PMC6289056.
http://www.ncbi.nlm.nih.gov/pubmed/?term=PMID%3A+30221597%3B+PMCID%3A+PMC6289056
37
.
Ikeda Y, Shimada K, Teramoto T, Uchiyama S, Yamazaki T, Oikawa S, Sugawara M, Ando K, Murata M, Yokoyama K, Ishizuka N. Low-dose aspirin for primary prevention of cardiovascular events in Japanese patients 60 years or older with atherosclerotic risk factors: a randomized clinical trial. JAMA. 2014 Dec 17;312(23):2510-20. doi: 10.1001/jama.2014.15690. PMID: 25401325.
http://www.ncbi.nlm.nih.gov/pubmed/?term=PMID%3A+25401325
38
.
Gaziano JM, Brotons C, Coppolecchia R, Cricelli C, Darius H, Gorelick PB, Howard G, Pearson TA, Rothwell PM, Ruilope LM, Tendera M, Tognoni G; ARRIVE Executive Committee. Use of aspirin to reduce risk of initial vascular events in patients at moderate risk of cardiovascular disease (ARRIVE): a randomised, double-blind, placebo-controlled trial. Lancet. 2018 Sep 22;392(10152):1036-1046. doi: 10.1016/S0140-6736(18)31924-X. Epub 2018 Aug 26. PMID: 30158069; PMCID: PMC7255888..
http://www.ncbi.nlm.nih.gov/pubmed/?term=
39
.
Fowkes FG, Price JF, Stewart MC, Butcher I, Leng GC, Pell AC, Sandercock PA, Fox KA, Lowe GD, Murray GD; Aspirin for Asymptomatic Atherosclerosis Trialists. Aspirin for prevention of cardiovascular events in a general population screened for a low ankle brachial index: a randomized controlled trial. JAMA. 2010 Mar 3;303(9):841-8. doi: 10.1001/jama.2010.221. PMID: 20197530.
http://www.ncbi.nlm.nih.gov/pubmed/?term=PMID%3A+20197530
40
.
de Gaetano G; Collaborative Group of the Primary Prevention Project. Low-dose aspirin and vitamin E in people at cardiovascular risk: a randomised trial in general practice. Collaborative Group of the Primary Prevention Project. Lancet. 2001 Jan 13;357(9250):89-95. doi: 10.1016/s0140-6736(00)03539-x. Erratum in: Lancet 2001 Apr 7;357(9262):1134. PMID: 11197445.
http://www.ncbi.nlm.nih.gov/pubmed/?term=PMID%3A+11197445
41
.
ASCEND Study Collaborative Group; Bowman L, Mafham M, Wallendszus K, Stevens W, Buck G, Barton J, Murphy K, Aung T, Haynes R, Cox J, Murawska A, Young A, Lay M, Chen F, Sammons E, Waters E, Adler A, Bodansky J, Farmer A, McPherson R, Neil A, Simpson D, Peto R, Baigent C, Collins R, Parish S, Armitage J. Effects of Aspirin for Primary Prevention in Persons with Diabetes Mellitus. N Engl J Med. 2018 Oct 18;379(16):1529-1539. doi: 10.1056/NEJMoa1804988. Epub 2018 Aug 26. PMID: 30146931.
http://www.ncbi.nlm.nih.gov/pubmed/?term=PMID%3A+30146931
42
.
Belch J, MacCuish A, Campbell I, Cobbe S, Taylor R, Prescott R, Lee R, Bancroft J, MacEwan S, Shepherd J, Macfarlane P, Morris A, Jung R, Kelly C, Connacher A, Peden N, Jamieson A, Matthews D, Leese G, McKnight J, O''''Brien I, Semple C, Petrie J, Gordon D, Pringle S, MacWalter R; Prevention of Progression of Arterial Disease and Diabetes Study Group; Diabetes Registry Group; Royal College of Physicians Edinburgh. The prevention of progression of arterial disease and diabetes (POPADAD) trial: factorial randomised placebo controlled trial of aspirin and antioxidants in patients with diabetes and asymptomatic peripheral arterial disease. BMJ. 2008 Oct 16;337:a1840. doi: 10.1136/bmj.a1840. PMID: 18927173; PMCID: PMC2658865.
http://www.ncbi.nlm.nih.gov/pubmed/?term=PMID%3A+18927173%3B+PMCID%3A+PMC2658865
43
.
Taliercio JJ, Nakhoul G, Mehdi A, Yang W, Sha D, Schold JD, Kasner S, Weir M, Hassanein M, Navaneethan SD, Krishnan G, Kanthety R, Go AS, Deo R, Lora CM, Jaar BG, Chen TK, Chen J, He J, Rahman M; CRIC study Investigators. Aspirin for Primary and Secondary Prevention of Mortality, Cardiovascular Disease, and Kidney Failure in the Chronic Renal Insufficiency Cohort (CRIC) Study. Kidney Med. 2022 Oct 4;4(11):100547. doi: 10.1016/j.xkme.2022.100547. PMID: 36339663; PMCID: PMC9630782.
http://www.ncbi.nlm.nih.gov/pubmed/?term=PMID%3A+36339663%3B+PMCID%3A+PMC9630782
44
.
Marquis-Gravel G, Roe MT, Robertson HR, Harrington RA, Pencina MJ, Berdan LG, Hammill BG, Faulkner M, Muñoz D, Fonarow GC, Nallamothu BK, Fintel DJ, Ford DE, Zhou L, Daugherty SE, Nauman E, Kraschnewski J, Ahmad FS, Benziger CP, Haynes K, Merritt JG, Metkus T, Kripalani S, Gupta K, Shah RC, McClay JC, Re RN, Geary C, Lampert BC, Bradley SM, Jain SK, Seifein H, Whittle J, Roger VL, Effron MB, Alvarado G, Goldberg YH, VanWormer JL, Girotra S, Farrehi P, McTigue KM, Rothman R, Hernandez AF, Jones WS. Rationale and Design of the Aspirin Dosing-A Patient-Centric Trial Assessing Benefits and Long-term Effectiveness (ADAPTABLE) Trial. JAMA Cardiol. 2020 May 1;5(5):598-607. doi: 10.1001/jamacardio.2020.0116. PMID: 32186653.
http://www.ncbi.nlm.nih.gov/pubmed/?term=PMID%3A+32186653
45
.
Gupta K, Mehta H, Kim H, Stebbins A, Wruck LM, Muñoz D, Effron MB, Anderson RD, Pepine CJ, Jain SK, Girotra S, DeWalt DA, Whittle J, Benziger CP, Farrehi P, Zhou L, Knowlton KU, Polonsky TS, Bradley SM, Harrington RA, Rothman RL, Jones WS, Hernandez AF. Comparison of the effectiveness and safety of 2 aspirin doses in secondary prevention of cardiovascular outcomes in patients with chronic kidney disease: A subgroup analysis of ADAPTABLE. Am Heart J. 2023 Oct;264:31-39. doi: 10.1016/j.ahj.2023.06.001. Epub 2023 Jun 7. PMID: 37290700.
http://www.ncbi.nlm.nih.gov/pubmed/?term=PMID%3A+37290700
47
.
Mehta SR, Yusuf S, Peters RJ, Bertrand ME, Lewis BS, Natarajan MK, Malmberg K, Rupprecht H, Zhao F, Chrolavicius S, Copland I, Fox KA; Clopidogrel in Unstable angina to prevent Recurrent Events trial (CURE) Investigators. Effects of pretreatment with clopidogrel and aspirin followed by long-term therapy in patients undergoing percutaneous coronary intervention: the PCI-CURE study. Lancet. 2001 Aug 18;358(9281):527-33. doi: 10.1016/s0140-6736(01)05701-4. PMID: 11520521.
http://www.ncbi.nlm.nih.gov/pubmed/?term=PMID%3A+11520521
48
.
Chen ZM, Jiang LX, Chen YP, Xie JX, Pan HC, Peto R, Collins R, Liu LS; COMMIT (ClOpidogrel and Metoprolol in Myocardial Infarction Trial) collaborative group. Addition of clopidogrel to aspirin in 45,852 patients with acute myocardial infarction: randomised placebo-controlled trial. Lancet. 2005 Nov 5;366(9497):1607-21. doi: 10.1016/S0140-6736(05)67660-X. PMID: 16271642.
http://www.ncbi.nlm.nih.gov/pubmed/?term=PMID%3A+16271642
49
.
Steinhubl SR, Berger PB, Mann JT 3rd, Fry ET, DeLago A, Wilmer C, Topol EJ; CREDO Investigators. Clopidogrel for the Reduction of Events During Observation. Early and sustained dual oral antiplatelet therapy following percutaneous coronary intervention: a randomized controlled trial. JAMA. 2002 Nov 20;288(19):2411-20. doi: 10.1001/jama.288.19.2411. Erratum in: JAMA. 2003 Feb 26;289(8):987. PMID: 12435254.
http://www.ncbi.nlm.nih.gov/pubmed/?term=PMID%3A+12435254
50
.
CAPRIE Steering Committee. A randomised, blinded, trial of clopidogrel versus aspirin in patients at risk of ischaemic events (CAPRIE). CAPRIE Steering Committee. Lancet. 1996 Nov 16;348(9038):1329-39. doi: 10.1016/s0140-6736(96)09457-3. PMID: 8918275.
http://www.ncbi.nlm.nih.gov/pubmed/?term=PMID%3A+8918275
51
.
Yusuf S, Zhao F, Mehta SR, Chrolavicius S, Tognoni G, Fox KK; Clopidogrel in Unstable Angina to Prevent Recurrent Events Trial Investigators. Effects of clopidogrel in addition to aspirin in patients with acute coronary syndromes without ST-segment elevation. N Engl J Med. 2001 Aug 16;345(7):494-502. doi: 10.1056/NEJMoa010746. Erratum in: N Engl J Med 2001 Dec 6;345(23):1716. Erratum in: N Engl J Med 2001 Nov 15;345(20):1506. PMID: 11519503.
http://www.ncbi.nlm.nih.gov/pubmed/?term=PMID%3A+11519503
53
.
Sabatine MS, Cannon CP, Gibson CM, López-Sendón JL, Montalescot G, Theroux P, Claeys MJ, Cools F, Hill KA, Skene AM, McCabe CH, Braunwald E; CLARITY-TIMI 28 Investigators. Addition of clopidogrel to aspirin and fibrinolytic therapy for myocardial infarction with ST-segment elevation. N Engl J Med. 2005 Mar 24;352(12):1179-89. doi: 10.1056/NEJMoa050522. Epub 2005 Mar 9. PMID: 15758000.
http://www.ncbi.nlm.nih.gov/pubmed/?term=PMID%3A+15758000
54
.
Laine M, Lemesle G, Burtey S, Cayla G, Range G, Quaino G, Canault M, Pankert M, Paganelli F, Puymirat E, Bonello L. TicagRelor Or Clopidogrel in severe or terminal chronic kidney patients Undergoing PERcutaneous coronary intervention for acute coronary syndrome: The TROUPER trial. Am Heart J. 2020 Jul;225:19-26. doi: 10.1016/j.ahj.2020.04.013. Epub 2020 Apr 30. PMID: 32473355.
http://www.ncbi.nlm.nih.gov/pubmed/?term=PMID%3A+32473355
55
.
Tan BE, Wong PY, Baibhav B, Thakkar S, Azhar AZ, Rao M, Cheung JW. Clopidogrel Vs Aspirin Monotherapy Following Dual Antiplatelet Therapy After Percutaneous Coronary Intervention: A Systematic Review and Meta-analysis. Curr Probl Cardiol. 2023 Aug;48(8):101174. doi: 10.1016/j.cpcardiol.2022.101174. Epub 2022 Mar 24. PMID: 35341798.
http://www.ncbi.nlm.nih.gov/pubmed/?term=PMID%3A+35341798
56
.
Park SH, Kim W, Park CS, Kang WY, Hwang SH, Kim W. A comparison of clopidogrel responsiveness in patients with versus without chronic renal failure. Am J Cardiol. 2009 Nov 1;104(9):1292-5. doi: 10.1016/j.amjcard.2009.06.049. PMID: 19840579.
http://www.ncbi.nlm.nih.gov/pubmed/?term=PMID%3A+19840579
57
.
Muller C, Caillard S, Jesel L, El Ghannudi S, Ohlmann P, Sauleau E, Hannedouche T, Gachet C, Moulin B, Morel O. Association of estimated GFR with platelet inhibition in patients treated with clopidogrel. Am J Kidney Dis. 2012 Jun;59(6):777-85. doi: 10.1053/j.ajkd.2011.12.027. Epub 2012 Mar 15. PMID: 22425260.
http://www.ncbi.nlm.nih.gov/pubmed/?term=PMID%3A+22425260
58
.
Angiolillo DJ, Bernardo E, Capodanno D, Vivas D, Sabaté M, Ferreiro JL, Ueno M, Jimenez-Quevedo P, Alfonso F, Bass TA, Macaya C, Fernandez-Ortiz A. Impact of chronic kidney disease on platelet function profiles in diabetes mellitus patients with coronary artery disease taking dual antiplatelet therapy. J Am Coll Cardiol. 2010 Mar 16;55(11):1139-46. doi: 10.1016/j.jacc.2009.10.043. PMID: 20223369.
http://www.ncbi.nlm.nih.gov/pubmed/?term=PMID%3A+20223369
59
.
Barragan P, Bouvier JL, Roquebert PO, Macaluso G, Commeau P, Comet B, Lafont A, Camoin L, Walter U, Eigenthaler M. Resistance to thienopyridines: clinical detection of coronary stent thrombosis by monitoring of vasodilator-stimulated phosphoprotein phosphorylation. Catheter Cardiovasc Interv. 2003 Jul;59(3):295-302. doi: 10.1002/ccd.10497. PMID: 12822144.
http://www.ncbi.nlm.nih.gov/pubmed/?term=PMID%3A+12822144
60
.
Wu Y, Song Y, Pan Y, Gong Y, Zhou Y. High on-clopidogrel platelet reactivity and chronic kidney disease: a meta-analysis of literature studies. Scand Cardiovasc J. 2019 Apr;53(2):55-61. doi: 10.1080/14017431.2019.1598571. Epub 2019 Apr 29. PMID: 30909763.
http://www.ncbi.nlm.nih.gov/pubmed/?term=PMID%3A+30909763
61
.
Wiviott SD, Braunwald E, McCabe CH, Montalescot G, Ruzyllo W, Gottlieb S, Neumann FJ, Ardissino D, De Servi S, Murphy SA, Riesmeyer J, Weerakkody G, Gibson CM, Antman EM; TRITON-TIMI 38 Investigators. Prasugrel versus clopidogrel in patients with acute coronary syndromes. N Engl J Med. 2007 Nov 15;357(20):2001-15. doi: 10.1056/NEJMoa0706482. Epub 2007 Nov 4. PMID: 17982182.
http://www.ncbi.nlm.nih.gov/pubmed/?term=PMID%3A+17982182
62
.
Melloni C, Cornel JH, Hafley G, Neely ML, Clemmensen P, Zamoryakhin D, Prabhakaran D, White HD, Fox KA, Ohman EM, Armstrong PW, Roe MT. Impact of chronic kidney disease on long-term ischemic and bleeding outcomes in medically managed patients with acute coronary syndromes: Insights from the TRILOGY ACS Trial. Eur Heart J Acute Cardiovasc Care. 2016 Oct;5(6):443-454. doi: 10.1177/2048872615598631. Epub 2015 Jul 30. PMID: 26228448.
http://www.ncbi.nlm.nih.gov/pubmed/?term=PMID%3A+26228448
63
.
Baber U, Chandrasekhar J, Sartori S, Aquino M, Kini AS, Kapadia S, Weintraub W, Muhlestein JB, Vogel B, Faggioni M, Farhan S, Weiss S, Strauss C, Toma C, DeFranco A, Baker BA, Keller S, Effron MB, Henry TD, Rao S, Pocock S, Dangas G, Mehran R. Associations Between Chronic Kidney Disease and Outcomes With Use of Prasugrel Versus Clopidogrel in Patients With Acute Coronary Syndrome Undergoing Percutaneous Coronary Intervention: A Report From the PROMETHEUS Study. JACC Cardiovasc Interv. 2017 Oct 23;10(20):2017-2025. doi: 10.1016/j.jcin.2017.02.047. Epub 2017 Aug 2. PMID: 28780028.
http://www.ncbi.nlm.nih.gov/pubmed/?term=PMID%3A+28780028
66
.
Wallentin L, Becker RC, Budaj A, Cannon CP, Emanuelsson H, Held C, Horrow J, Husted S, James S, Katus H, Mahaffey KW, Scirica BM, Skene A, Steg PG, Storey RF, Harrington RA; PLATO Investigators; Freij A, Thorsén M. Ticagrelor versus clopidogrel in patients with acute coronary syndromes. N Engl J Med. 2009 Sep 10;361(11):1045-57. doi: 10.1056/NEJMoa0904327. Epub 2009 Aug 30. PMID: 19717846.
http://www.ncbi.nlm.nih.gov/pubmed/?term=PMID%3A+19717846
67
.
Bonaca MP, Bhatt DL, Cohen M, Steg PG, Storey RF, Jensen EC, Magnani G, Bansilal S, Fish MP, Im K, Bengtsson O, Oude Ophuis T, Budaj A, Theroux P, Ruda M, Hamm C, Goto S, Spinar J, Nicolau JC, Kiss RG, Murphy SA, Wiviott SD, Held P, Braunwald E, Sabatine MS; PEGASUS-TIMI 54 Steering Committee and Investigators. Long-term use of ticagrelor in patients with prior myocardial infarction. N Engl J Med. 2015 May 7;372(19):1791-800. doi: 10.1056/NEJMoa1500857. Epub 2015 Mar 14. PMID: 25773268.
http://www.ncbi.nlm.nih.gov/pubmed/?term=PMID%3A+25773268
68
.
James S, Budaj A, Aylward P, Buck KK, Cannon CP, Cornel JH, Harrington RA, Horrow J, Katus H, Keltai M, Lewis BS, Parikh K, Storey RF, Szummer K, Wojdyla D, Wallentin L. Ticagrelor versus clopidogrel in acute coronary syndromes in relation to renal function: results from the Platelet Inhibition and Patient Outcomes (PLATO) trial. Circulation. 2010 Sep 14;122(11):1056-67. doi: 10.1161/CIRCULATIONAHA.109.933796. Epub 2010 Aug 30. PMID: 20805430.
http://www.ncbi.nlm.nih.gov/pubmed/?term=PMID%3A+20805430
69
.
Bonello L, Laine M, Lemesle G, Puymirat E, Dabry T, Thuny F, Paganelli F, Aradi D, Frere C, Burtey S, Sibbing D, Mancini J. Meta-Analysis of Potent P2Y12-ADP Receptor Antagonist Therapy Compared to Clopidogrel Therapy in Acute Coronary Syndrome Patients with Chronic Kidney Disease. Thromb Haemost. 2018 Oct;118(10):1839-1846. doi: 10.1055/s-0038-1669426. Epub 2018 Sep 20. PMID: 30235475.
http://www.ncbi.nlm.nih.gov/pubmed/?term=PMID%3A+30235475
70
.
Guo Y, Ge P, Li Z, Xiao J, Xie L. Ticagrelor or Clopidogrel as Antiplatelet Agents in Patients with Chronic Kidney Disease and Cardiovascular Disease: A Meta-analysis. Am J Cardiovasc Drugs. 2023 Sep;23(5):533-546. doi: 10.1007/s40256-023-00600-w. Epub 2023 Aug 2. Erratum in: Am J Cardiovasc Drugs. 2023 Aug 18;: PMID: 37530990.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2023+Aug+18%3B%3A+PMID%3A+37530990
71
.
Roh JW, Lee SJ, Kim BK, Hong SJ, Kim HY, Ahn CM, Cho DK, Kim JS, Ko YG, Choi D, Hong MK, Jang Y. Ticagrelor vs. Clopidogrel in Acute Coronary Syndrome Patients With Chronic Kidney Disease After New-Generation Drug-Eluting Stent Implantation. Front Cardiovasc Med. 2022 Jan 10;8:707722. doi: 10.3389/fcvm.2021.707722. PMID: 35083294; PMCID: PMC8785207.
http://www.ncbi.nlm.nih.gov/pubmed/?term=PMID%3A+35083294%3B+PMCID%3A+PMC8785207
73
.
Li YS, Wang SH, Hwang SJ, Yang YH, Hsieh KP. Comparison of effectiveness and safety between ticagrelor and clopidogrel in patients with acute coronary syndrome and on dialysis in Taiwan. Br J Clin Pharmacol. 2022 Jan;88(1):145-154. doi: 10.1111/bcp.14935. Epub 2021 Jun 22. PMID: 34080719.
http://www.ncbi.nlm.nih.gov/pubmed/?term=PMID%3A+34080719
75
.
Neumann FJ, Sousa-Uva M, Ahlsson A, Alfonso F, Banning AP, Benedetto U, Byrne RA, Collet JP, Falk V, Head SJ, Jüni P, Kastrati A, Koller A, Kristensen SD, Niebauer J, Richter DJ, Seferovic PM, Sibbing D, Stefanini GG, Windecker S, Yadav R, Zembala MO; ESC Scientific Document Group. 2018 ESC/EACTS Guidelines on myocardial revascularization. Eur Heart J. 2019 Jan 7;40(2):87-165. doi: 10.1093/eurheartj/ehy394. Erratum in: Eur Heart J. 2019 Oct 1;40(37):3096. PMID: 30165437.
http://www.ncbi.nlm.nih.gov/pubmed/?term=PMID%3A+30165437
76
.
Byrne RA, Rossello X, Coughlan JJ, Barbato E, Berry C, Chieffo A, Claeys MJ, Dan GA, Dweck MR, Galbraith M, Gilard M, Hinterbuchner L, Jankowska EA, Jüni P, Kimura T, Kunadian V, Leosdottir M, Lorusso R, Pedretti RFE, Rigopoulos AG, Rubini Gimenez M, Thiele H, Vranckx P, Wassmann S, Wenger NK, Ibanez B; ESC Scientific Document Group. 2023 ESC Guidelines for the management of acute coronary syndromes. Eur Heart J Acute Cardiovasc Care. 2023 Sep 22:zuad107. doi: 10.1093/ehjacc/zuad107. Epub ahead of print. PMID: 37740496.
http://www.ncbi.nlm.nih.gov/pubmed/?term=PMID%3A+37740496
77
.
Goto S. Cilostazol: potential mechanism of action for antithrombotic effects accompanied by a low rate of bleeding. Atheroscler Suppl. 2005 Dec 15;6(4):3-11. doi: 10.1016/j.atherosclerosissup.2005.09.002. Epub 2005 Nov 4. PMID: 16275169.
http://www.ncbi.nlm.nih.gov/pubmed/?term=PMID%3A+16275169
79
.
Shinohara Y, Katayama Y, Uchiyama S, Yamaguchi T, Handa S, Matsuoka K, Ohashi Y, Tanahashi N, Yamamoto H, Genka C, Kitagawa Y, Kusuoka H, Nishimaru K, Tsushima M, Koretsune Y, Sawada T, Hamada C; CSPS 2 group. Cilostazol for prevention of secondary stroke (CSPS 2): an aspirin-controlled, double-blind, randomised non-inferiority trial. Lancet Neurol. 2010 Oct;9(10):959-68. doi: 10.1016/S1474-4422(10)70198-8. Epub 2010 Sep 15. PMID: 20833591.
http://www.ncbi.nlm.nih.gov/pubmed/?term=PMID%3A+20833591
80
.
Huang Y, Cheng Y, Wu J, Li Y, Xu E, Hong Z, Li Z, Zhang W, Ding M, Gao X, Fan D, Zeng J, Wong K, Lu C, Xiao J, Yao C; Cilostazol versus Aspirin for Secondary Ischaemic Stroke Prevention cooperation investigators. Cilostazol as an alternative to aspirin after ischaemic stroke: a randomised, double-blind, pilot study. Lancet Neurol. 2008 Jun;7(6):494-9. doi: 10.1016/S1474-4422(08)70094-2. Epub 2008 May 2. Erratum in: Lancet Neurol. 2008 Aug;7(8):675. PMID: 18456558.
http://www.ncbi.nlm.nih.gov/pubmed/?term=PMID%3A+18456558
81
.
Thompson PD, Zimet R, Forbes WP, Zhang P. Meta-analysis of results from eight randomized, placebo-controlled trials on the effect of cilostazol on patients with intermittent claudication. Am J Cardiol. 2002 Dec 15;90(12):1314-9. doi: 10.1016/s0002-9149(02)02869-2. PMID: 12480040.
http://www.ncbi.nlm.nih.gov/pubmed/?term=PMID%3A+12480040
82
.
Biondi-Zoccai GG, Lotrionte M, Anselmino M, Moretti C, Agostoni P, Testa L, Abbate A, Cosgrave J, Laudito A, Trevi GP, Sheiban I. Systematic review and meta-analysis of randomized clinical trials appraising the impact of cilostazol after percutaneous coronary intervention. Am Heart J. 2008 Jun;155(6):1081-9. doi: 10.1016/j.ahj.2007.12.024. Epub 2008 Feb 19. PMID: 18513523.
http://www.ncbi.nlm.nih.gov/pubmed/?term=PMID%3A+18513523
84
.
Ishii H, Aoyama T, Takahashi H, Kumada Y, Kamoi D, Sakakibara T, Umemoto N, Suzuki S, Tanaka A, Ito Y, Murohara T. Treatment with cilostazol improves clinical outcome after endovascular therapy in hemodialysis patients with peripheral artery disease. J Cardiol. 2016 Feb;67(2):199-204. doi: 10.1016/j.jjcc.2015.05.003. Epub 2015 Jun 11. PMID: 26074442.
http://www.ncbi.nlm.nih.gov/pubmed/?term=PMID%3A+26074442
85
.
Gargiulo G, Costa F, Ariotti S, Biscaglia S, Campo G, Esposito G, Leonardi S, Vranckx P, Windecker S, Valgimigli M. Impact of proton pump inhibitors on clinical outcomes in patients treated with a 6- or 24-month dual-antiplatelet therapy duration: Insights from the PROlonging Dual-antiplatelet treatment after Grading stent-induced Intimal hyperplasia studY trial. Am Heart J. 2016 Apr;174:95-102. doi: 10.1016/j.ahj.2016.01.015. Epub 2016 Jan 25. PMID: 26995375.
http://www.ncbi.nlm.nih.gov/pubmed/?term=PMID%3A+26995375
86
.
Bhatt DL, Cryer BL, Contant CF, Cohen M, Lanas A, Schnitzer TJ, Shook TL, Lapuerta P, Goldsmith MA, Laine L, Scirica BM, Murphy SA, Cannon CP; COGENT Investigators. Clopidogrel with or without omeprazole in coronary artery disease. N Engl J Med. 2010 Nov 11;363(20):1909-17. doi: 10.1056/NEJMoa1007964. Epub 2010 Oct 6. PMID: 20925534.
http://www.ncbi.nlm.nih.gov/pubmed/?term=PMID%3A+20925534
87
.
Coughlan JJ, Aytekin A, Lahu S, Ndrepepa G, Menichelli M, Mayer K, Wöhrle J, Bernlochner I, Gewalt S, Witzenbichler B, Hochholzer W, Sibbing D, Cassese S, Angiolillo DJ, Hemetsberger R, Valina C, Müller A, Kufner S, Liebetrau C, Xhepa E, Hapfelmeier A, Sager HB, Joner M, Fusaro M, Richardt G, Laugwitz KL, Neumann FJ, Schunkert H, Schüpke S, Kastrati A. Ticagrelor or Prasugrel for Patients With Acute Coronary Syndrome Treated With Percutaneous Coronary Intervention: A Prespecified Subgroup Analysis of a Randomized Clinical Trial. JAMA Cardiol. 2021 Oct 1;6(10):1121-1129. doi: 10.1001/jamacardio.2021.2228. PMID: 34190967; PMCID: PMC8246339.
http://www.ncbi.nlm.nih.gov/pubmed/?term=PMID%3A+34190967%3B+PMCID%3A+PMC8246339
88
.
Schüpke S, Neumann FJ, Menichelli M, Mayer K, Bernlochner I, Wöhrle J, Richardt G, Liebetrau C, Witzenbichler B, Antoniucci D, Akin I, Bott-Flügel L, Fischer M, Landmesser U, Katus HA, Sibbing D, Seyfarth M, Janisch M, Boncompagni D, Hilz R, Rottbauer W, Okrojek R, Möllmann H, Hochholzer W, Migliorini A, Cassese S, Mollo P, Xhepa E, Kufner S, Strehle A, Leggewie S, Allali A, Ndrepepa G, Schühlen H, Angiolillo DJ, Hamm CW, Hapfelmeier A, Tölg R, Trenk D, Schunkert H, Laugwitz KL, Kastrati A; ISAR-REACT 5 Trial Investigators. Ticagrelor or Prasugrel in Patients with Acute Coronary Syndromes. N Engl J Med. 2019 Oct 17;381(16):1524-1534. doi: 10.1056/NEJMoa1908973. Epub 2019 Sep 1. PMID: 31475799.
http://www.ncbi.nlm.nih.gov/pubmed/?term=PMID%3A+31475799
89
.
Zhang K, Wang Y, Liu T, Niu X. Comparison of Aspirin and P2Y12 Inhibitors for Secondary Prevention of Ischaemic Stroke: A Systematic Review and Meta-analysis. Curr Rev Clin Exp Pharmacol. 2023;18(3):270-283. doi: 10.2174/2772432817666220526162144. PMID: 35619249.
http://www.ncbi.nlm.nih.gov/pubmed/?term=PMID%3A+35619249
90
.
Valgimigli M, Bueno H, Byrne RA, Collet JP, Costa F, Jeppsson A, Jüni P, Kastrati A, Kolh P, Mauri L, Montalescot G, Neumann FJ, Petricevic M, Roffi M, Steg PG, Windecker S, Zamorano JL, Levine GN; ESC Scientific Document Group; ESC Committee for Practice Guidelines (CPG); ESC National Cardiac Societies. 2017 ESC focused update on dual antiplatelet therapy in coronary artery disease developed in collaboration with EACTS: The Task Force for dual antiplatelet therapy in coronary artery disease of the European Society of Cardiology (ESC) and of the European Association for Cardio-Thoracic Surgery (EACTS). Eur Heart J. 2018 Jan 14;39(3):213-260. doi: 10.1093/eurheartj/ehx419. PMID: 28886622.
http://www.ncbi.nlm.nih.gov/pubmed/?term=PMID%3A+28886622
93
.
Rout A, Sharma A, Ikram S, Garg A. Short-term dual antiplatelet therapy for 1-3 months after percutaneous coronary intervention using drug eluting stents: A systematic review and meta-analysis of randomized clinical trials. Catheter Cardiovasc Interv. 2022 Dec 9. doi: 10.1002/ccd.30521. Epub ahead of print. PMID: 36490229.
http://www.ncbi.nlm.nih.gov/pubmed/?term=PMID%3A+36490229
94
.
Natsuaki M, Morimoto T, Shiomi H, Kadota K, Tada T, Takeji Y, Matsumura-Nakano Y, Yoshikawa Y, Watanabe H, Yamamoto K, Imada K, Domei T, Yamaji K, Kaneda K, Taniguchi R, Ehara N, Nawada R, Toyofuku M, Shinoda E, Suwa S, Tamura T, Inada T, Matsuda M, Aoyama T, Sato Y, Furukawa Y, Ando K, Nakagawa Y, Kimura T; CREDO-Kyoto PCI/CABG Registry Cohort-3 Investigators. Effects of Acute Coronary Syndrome and Stable Coronary Artery Disease on Bleeding and Ischemic Risk After Percutaneous Coronary Intervention. Circ J. 2021 Oct 25;85(11):1928-1941. doi: 10.1253/circj.CJ-21-0016. Epub 2021 Apr 27. PMID: 33907052.
http://www.ncbi.nlm.nih.gov/pubmed/?term=PMID%3A+33907052
95
.
Costa F, Montalto C, Branca M, Hong SJ, Watanabe H, Franzone A, Vranckx P, Hahn JY, Gwon HC, Feres F, Jang Y, De Luca G, Kedhi E, Cao D, Steg PG, Bhatt DL, Stone GW, Micari A, Windecker S, Kimura T, Hong MK, Mehran R, Valgimigli M. Dual antiplatelet therapy duration after percutaneous coronary intervention in high bleeding risk: a meta-analysis of randomized trials. Eur Heart J. 2023 Mar 14;44(11):954-968. doi: 10.1093/eurheartj/ehac706. PMID: 36477292.
http://www.ncbi.nlm.nih.gov/pubmed/?term=PMID%3A+36477292
97
.
Graham CA, Tan MK, Chew DP, Gale CP, Fox KAA, Bagai A, Henderson MA, Quraishi AUR, Déry JP, Cheema AN, Fisher H, Brieger D, Lutchmedial SR, Lavi S, Wong BYL, Cieza T, Mehta SR, Brass N, Goodman SG, Yan AT. Use and outcomes of dual antiplatelet therapy for acute coronary syndrome in patients with chronic kidney disease: insights from the Canadian Observational Antiplatelet Study (COAPT). Heart Vessels. 2022 Aug;37(8):1291-1298. doi: 10.1007/s00380-022-02029-8. Epub 2022 Jan 28. PMID: 35089380.
http://www.ncbi.nlm.nih.gov/pubmed/?term=PMID%3A+35089380
98
.
Zhang J, Li H, Wang S. Clinical Outcomes of Prolonged Antiplatelet Therapy after Percutaneous Coronary Intervention in Chronic Kidney Disease Patients: A Systematic Review and Meta-Analysis. Blood Purif. 2023;52(3):255-263. doi: 10.1159/000527566. Epub 2022 Dec 6. PMID: 36473448.
http://www.ncbi.nlm.nih.gov/pubmed/?term=PMID%3A+36473448
99
.
Yu Y, Pan D, Bai R, Luo J, Tan Y, Duan W, Shi D. P2y12 inhibitor monotherapy after 1-3 months dual antiplatelet therapy in patients with coronary artery disease and chronic kidney disease undergoing percutaneous coronary intervention: a meta-analysis of randomized controlled trials. Front Cardiovasc Med. 2023 Jul 6;10:1197161. doi: 10.3389/fcvm.2023.1197161. PMID: 37485257; PMCID: PMC10357506.
http://www.ncbi.nlm.nih.gov/pubmed/?term=PMID%3A+37485257%3B+PMCID%3A+PMC10357506
100
.
Festa MC, Rasasingam S, Sharma A, Mavrakanas TA. Early Discontinuation of Aspirin Among Patients with Chronic Kidney Disease Undergoing Percutaneous Coronary Intervention with a Drug-Eluting Stent: A Meta-Analysis. Kidney360. 2023 Sep 1;4(9):e1245-e1256. doi: 10.34067/KID.0000000000000223. Epub 2023 Aug 1. PMID: 37768893; PMCID: PMC10547225.
http://www.ncbi.nlm.nih.gov/pubmed/?term=PMID%3A+37768893%3B+PMCID%3A+PMC10547225
102
.
Levine GN, Bates ER, Bittl JA, Brindis RG, Fihn SD, Fleisher LA, Granger CB, Lange RA, Mack MJ, Mauri L, Mehran R, Mukherjee D, Newby LK, O''''Gara PT, Sabatine MS, Smith PK, Smith SC Jr. 2016 ACC/AHA Guideline Focused Update on Duration of Dual Antiplatelet Therapy in Patients With Coronary Artery Disease: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines. J Am Coll Cardiol. 2016 Sep 6;68(10):1082-115. doi: 10.1016/j.jacc.2016.03.513. Epub 2016 Mar 29. PMID: 27036918.
http://www.ncbi.nlm.nih.gov/pubmed/?term=PMID%3A+27036918
103
.
Kleindorfer DO, Towfighi A, Chaturvedi S, Cockroft KM, Gutierrez J, Lombardi-Hill D, Kamel H, Kernan WN, Kittner SJ, Leira EC, Lennon O, Meschia JF, Nguyen TN, Pollak PM, Santangeli P, Sharrief AZ, Smith SC Jr, Turan TN, Williams LS. 2021 Guideline for the Prevention of Stroke in Patients With Stroke and Transient Ischemic Attack: A Guideline From the American Heart Association/American Stroke Association. Stroke. 2021 Jul;52(7):e364-e467. doi: 10.1161/STR.0000000000000375. Epub 2021 May 24. Erratum in: Stroke. 2021 Jul;52(7):e483-e484. PMID: 34024117.
http://www.ncbi.nlm.nih.gov/pubmed/?term=PMID%3A+34024117