Trastornos del metabolismo ácido-base
ÍNDICE
- Fisiología del equilibrio ácido-base. Clasificación de las alteraciones del equilibrio ácido-base
- ¿De qué trastorno se trata?
- ¿Es adecuada la respuesta secundaria? Tampones. Sistema CO2/HCO3- y mecanismos de compensación
- Tampones, sistema CO2/HCO3- y excreción renal de ácidos
- Respuestas secundarias
- Gasometría arterial o venosa en la interpretación de los trastornos ácido-base
- Acidosis metabólica con hiato aniónico aumentado
- Tratamiento
- Consideraciones específicas
- Cetoacidosis diabética
- Acidosis láctica
- Acidosis láctica en el paciente oncológico
- Acidosis metabólica secundaria a intoxicación por alcoholes (metanol, etilenglicol, propilenglicol, isopropanolol, dietilenglicol)
- Acidosis láctica por paracetamol
- Acidosis metabólica con hiato aniónico normal
- Tratamiento
- Consideraciones específicas
- Acidosis metabólica por pérdidas gastrointestinales
- Acidosis por pérdidas renales de bicarbonato:
- Acidosis tubular renal proximal y distal (tipos II y I)
- Acidosis tubular tipo IV
- Acidosis en la enfermedad renal crónica
- Acidosis hiperclorémica por suero salino fisiológico
- Alcalosis metabólica
- Etiología
- Respuestas secundarias a la alcalosis metabólica
- Manifestaciones clínicas
- Tratamiento
- Alteraciones del equilibrio ácido-base de origen respiratorio
- Acidosis respiratoria
- Manifestaciones clínicas
- Diagnóstico y tratamiento
- Acidosis respiratoria
- Alcalosis respiratoria
- Manifestaciones clínicas
- Diagnóstico y tratamiento
- Trastornos mixtos
FISIOLOGÍA DEL EQUILIBRIO ÁCIDO-BASE. CLASIFICACIÓN DE LAS ALTERACIONES DEL EQUILIBRIO ÁCIDO-BASE
Existen varias aproximaciones para la evaluación y clasificación de las alteraciones del equilibrio ácido-base. La propuesta fisicoquímica es la más reciente y se basa en la diferencia de iones fuertes, en la concentración total de ácidos débiles plasmáticos y en la presión parcial de anhídrido carbónico arterial (pCO2). De gran aceptación entre anestesiólogos e intensivistas, es un abordaje más complejo al precisar más determinaciones bioquímicas. En este capítulo se utilizará la aproximación fisiológica, basada en el pH, la pCO2 y el bicarbonato plasmático, que creemos que es la más sencilla, rigurosa y práctica para clasificar y tratar de forma sistemática las alteraciones del equilibrio ácido-base [1]. Una tercera aproximación es la basada en la cuantificación del cambio en el estatus ácido-base aportado directamente por la gasometría, en lo que se conoce como exceso de bases [2].
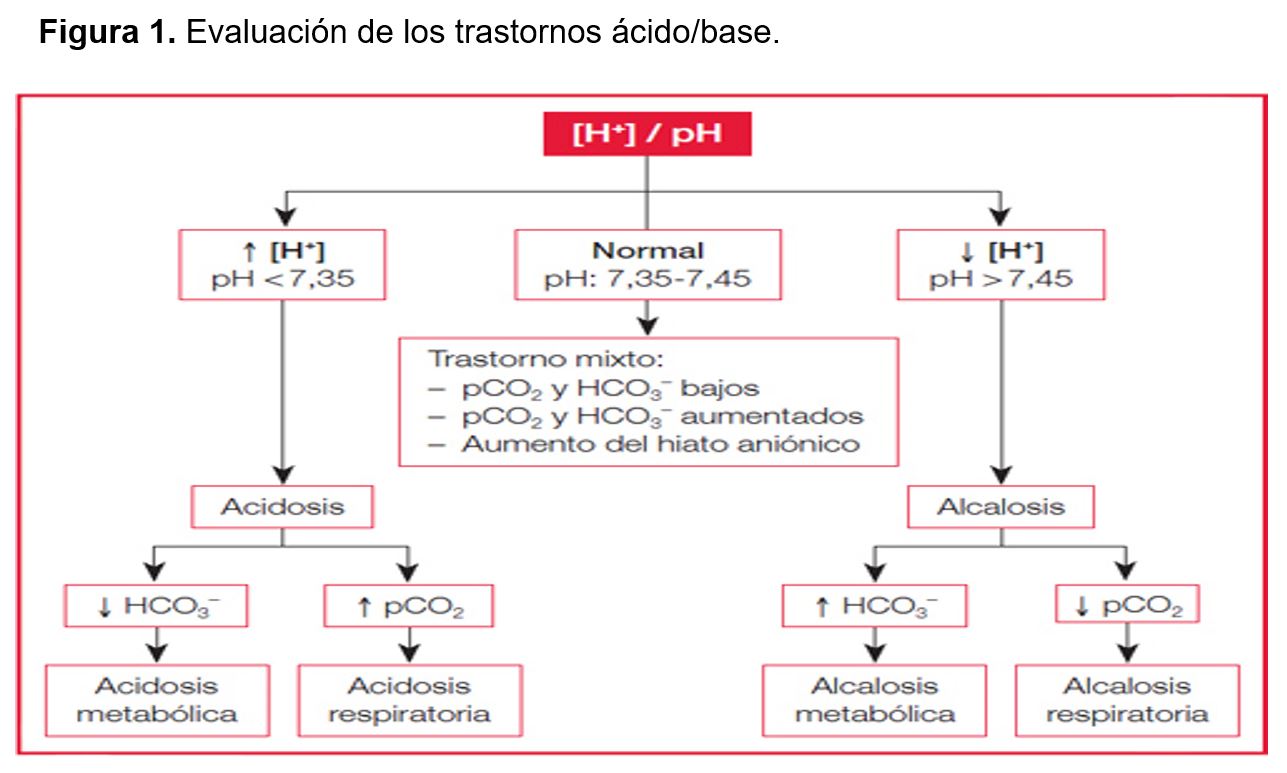
Ante cualquier trastorno ácido-base se debe responder a tres preguntas [3]:
¿Es adecuada la respuesta secundaria (compensación)?
¿Cuál es la causa del trastorno?
Para ello se utilizan 4 parámetros básicos:
1. La concentración plasmática de H+. Indica la gravedad del trastorno. En la práctica se mide como pH (pH = -log[H+]). Rango normal: 7,35-7,45, que equivale a una [H+] de aproximadamente 40 ± 5 nMol/l.
2. La pCO2. Indica la respuesta respiratoria. Valores de referencia: 35-45 mmHg. Se consideran valores críticos: >70 mmHg o < 18 mm Hg. La pCO2 no puede bajar más de 8-12 mmHg. El esfuerzo ventilatorio para conseguir esta pCO2 tan baja producirá en poco tiempo fatiga respiratoria.
3. La concentración plasmática de bicarbonato (HCO3-) o CO2 total. Indica el estado de los sistemas tampón. Valores de referencia de HCO3-: 21-29 mEq/l (mEq/l = mmol/l) Se consideran valores críticos: < 8 y > 40 mEq/l.
4. El hiato aniónico (anión gap). Orienta el diagnostico diferencial. Diferencia entre las principales cargas positivas (cationes) y negativas (aniones) del plasma (ecuación 1). Rango normal: 12 ± 4 mEq/l (si el laboratorio usa electrodos selectivos, el rango de normalidad es 6 ± 3 mEq/l).
Ecuación 1. Hiato aniónico = [Na+] - ([Cl-] + [HCO3-])
¿De qué trastorno se trata?
Los parámetros anteriores, y siguiendo este orden: pH, pCO2, HCO3- e hiato aniónico, nos permitirán reconocer el tipo de trastorno ácido-base de acuerdo con el algoritmo de la (Figura 1).
Aproximadamente tres cuartas partes del valor del hiato aniónico corresponden a la albúmina sérica, que es un anión, por lo que en la valoración del hiato aniónico se debe tener en cuenta si existe hipoalbuminemia (por cada g/dl de descenso en la albúmina sérica, el hiato aniónico disminuye en 2,5 mEq/l), así como otras circunstancias que se recogen en la (Tabla 1) [4].
Las acidosis metabólicas se dividen en función del valor del hiato aniónico (puede calcularse en el siguiente enlace o corregido a la albuminemia en este enlace). Esta clasificación nos permite orientar el diagnóstico etiológico de la acidosis y también el tratamiento.
Acidosis con hiato aniónico aumentado: predomina la ganancia de ácido, ya sea endógeno o exógeno. Son las acidosis normoclorémicas. El hiato aniónico aumenta porque hay más aniones (ácidos acumulados), que no se miden por el hiato aniónico y que tienen que compensarse con los cationes (Na+).
Acidosis con hiato aniónico normal: predomina la pérdida de bicarbonato, ya sea renal o gastrointestinal. Se denominan acidosis hiperclorémicas. El hiato aniónico se mantiene normal porque en la etiología se ha perdido un anión que sí entra en la fórmula del hiato (bicarbonato). El anión cloro aumenta para compensar la pérdida de bicarbonato y mantener la electroneutralidad del plasma.
El hiato aniónico tiene importantes implicaciones terapéuticas. Así, en las acidosis con hiato aniónico aumentado, el objetivo es eliminar el ácido acumulado, la mayoría de las veces favoreciendo su metabolismo (por ejemplo, dando insulina en las cetoacidosis, oxigenando en la acidosis láctica por hipoxia), lo que permitirá regenerar el bicarbonato que está tamponando el exceso de ácido. En las acidosis con hiato aniónico normal, sin embargo, el objetivo del tratamiento es reponer el anión que se ha perdido mediante la administración de bicarbonato.
¿Es adecuada la respuesta secundaria? Tampones. Sistema CO2/HCO3- y mecanismos de compensación
Tampones, sistema CO2/HCO3-y excreción renal de ácidos
El equilibrio ácido-base del organismo es posible merced a la interrelación de tres sistemas: tampones intracelulares y extracelulares, que amortiguan en minutos los cambios agudos del equilibrio ácido-base; la compensación respiratoria, íntimamente asociada al sistema anterior, que se inicia en minutos y se completa en horas, y la excreción renal del exceso de ácidos, que lleva más tiempo.
La capacidad tampón total del organismo es de unos 1.000 mmol (40% en el espacio extracelular y 60% en el intracelular). En el medio extracelular, el principal tampón es el par CO2/HCO3-, capaz de asumir en minutos gran parte de la carga ácida mediante la eliminación alveolar del CO2 resultante del efecto tampón, según la ecuación 2: H+ + HCO3- ↔ H2CO3 ↔ H2O + CO2 (Figura 2).
Los tampones intracelulares son, por orden de importancia, el anillo imidazólico del aminoácido histidina, el par HCO3-/CO2 y el par H2PO4- / HPO42-
La excreción renal del exceso de ácidos es la que permite regular finalmente el equilibrio ácido-base. La participación renal puede resumirse en: reabsorber todo el HCO3- filtrado (para evitar perder bases); regenerar nuevo HCO3- (excretando H+) que compense el consumido en forma de acidez titulable (fundamentalmente fosfatos) y amoniuria (NH4+); y la eliminación del HCO3- generado en exceso y de los aniones orgánicos no metabolizables. La excreción de fosfato tiene un límite que depende del fosfato filtrado, pero la capacidad renal de generar amonio y excretarlo como NH4+ es regulable e ilimitada. La producción de amonio estimulada por la acidosis mantenida alcanza su máximo entre los tres y los siete días [5].
Respuestas secundarias
Son los mecanismos de compensación ácido-base ya mencionados, que deben ser adecuados y proporcionados al trastorno ácido-base. Las ecuaciones 2 y 3 ilustran las características del sistema tampón de bicarbonato, expresadas matemáticamente en la ecuación de equilibrio.
Ecuación 3. Ecuación de equilibrio del sistema o de Henderson
[H+] = 23,9 x (pCO2 / HCO3-) = Pulmón / Riñón
Recordar: si se pretende calcular el pH obteniendo el logaritmo, la concentración debe expresarse en nanomoles (10-9M) (Calculadora “online” en este enlace)
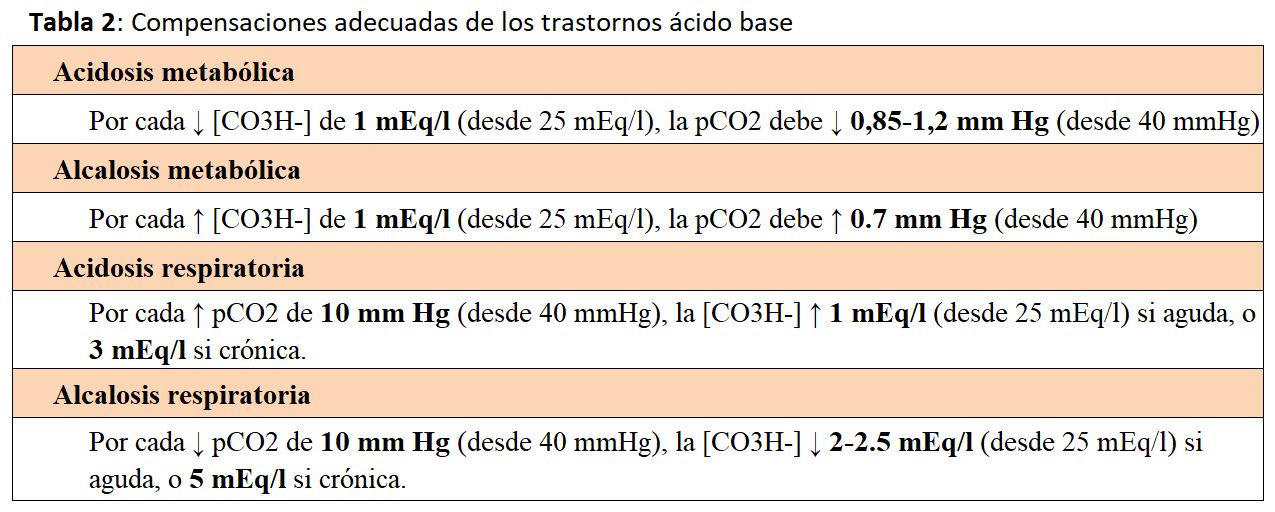
Existen múltiples compensaciones en los trastornos ácido-base metabólicos y respiratorios, y entre éstos y la concentración de potasio plasmático [K]p. Es muy importante evaluar si las respuestas secundarias son proporcionadas, ya que una compensación inadecuada implica un factor de gravedad adicional al trastorno. Las principales respuestas secundarias se recogen en la (Tabla 2) y de forma simplificada son las siguientes [5] [6]:
En la acidosis metabólica: por cada mmol/l de descenso del HCO3- debe bajar 1 mmHg la pCO2.
En la alcalosis metabólica: por cada mmol/l de aumento de HCO3- debe subir 0,7 mmHg la pCO2.
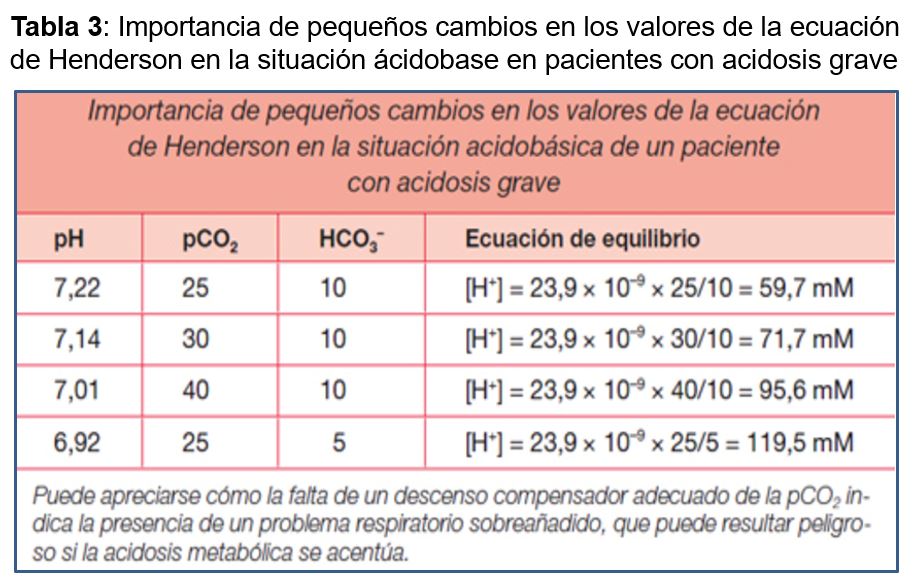
En la (Tabla 3) se observa un ejemplo de cómo en rangos críticos de pCO2 y bicarbonato, pequeños cambios en la compensación pueden inducir importantes modificaciones del pH.
Las respuestas secundarias no normalizan el equilibrio ácido-base. Así, si ante una acidosis metabólica desciende la pCO2 más de lo esperado y se normaliza el pH, se trata de un trastorno mixto del equilibrio ácido-base: acidosis metabólica con alcalosis respiratoria. Los trastornos mixtos son muy frecuentes en la práctica clínica y se ponen de manifiesto determinando si la respuesta secundaria es adecuada o no.
En cuanto a las compensaciones del potasio, por cada 0,1 unidades que aumenta el pH plasmático, la [K+]p disminuye en 0,6 mmol/l, y viceversa. Así, por ejemplo, valores normales de potasio en caso de acidosis indican la existencia de hipopotasemia subyacente, que podría pasar inadvertida (Ver trastornos del potasio) [7] En las acidosis metabólicas orgánicas (cetoacidosis diabética, acidosis láctica, entre otras), este efecto no es tan llamativo ya que los aniones orgánicos son transportados de forma electroneutra al interior celular por el cotransportador de ácidos monocarboxílicos (MCT) y no aumentan el gradiente eléctrico transcelular. El déficit de potasio que suele observarse en estos trastornos se debe a pérdidas renales de potasio, por ejemplo, en la cetoacidosis diabética, y puede agravarse por la introducción de potasio en la célula mediante la activación de la bomba Na+K+ATPasa como consecuencia del tratamiento con insulina (en la cetoacidosis diabética) o con agonistas beta (en la acidosis láctica) [3].
No sólo es importante si la respuesta secundaria es adecuada, sino también los parámetros en sí mismos. Así, en las acidosis metabólicas, cifras de HCO3- inferiores a 5 mmol/l indican que la capacidad de tamponamiento se está agotando. Del mismo modo, valores extremadamente bajos (<15 mmHg) de pCO2 ponen de manifiesto que la capacidad respiratoria compensadora está alcanzando su límite, y que de progresar el trastorno puede sobrevenir un grado letal de acidosis.
Gasometría arterial o venosa en la interpretación de los trastornos ácido-base
Las interpretaciones del equilibrio ácido-base se basan en la gasometría arterial. Sin embargo, esta es una prueba dolorosa y con más riesgo de complicaciones que la gasometría venosa que es la más utilizada hoy en día. Los datos obtenidos por la gasometría venosa no son siempre intercambiables con los de la gasometría arterial (Tabla 4) [8]
- El pH y el HCO3- son muy similares, con mínimas variaciones en función de si la extracción venosa es de una vena central o periférica.
- La pCO2 siempre es mayor en la muestra venosa y, además, con mucha dispersión en función del grado de perfusión tisular, por lo que no siempre es útil la pCO2 venosa para estimar la gravedad y la compensación ante un trastorno ácido-base. Si hay dudas en este sentido habrá que realizar una gasometría arterial.
- La pCO2 de venas braquiales o de la vena femoral refleja muy bien el sistema tampón tisular. Es por ello por lo que en situaciones de hipoperfusión tisular la pCO2 aumenta mucho, lo que disminuye la capacidad tampón del bicarbonato favoreciendo la acidosis intracelular. Esta situación no la detecta la pCO2 de una gasometría arterial.
- La sangre capilar (dedo o lóbulo de la oreja) refleja de forma precisa la pCO2 y el pH comparado con la gasometría arterial
ACIDOSIS METABÓLICA CON HIATO ANIÓNICO AUMENTADO
La acidosis metabólica con hiato aniónico o anión gap (en inglés) aumentado se originan, en términos generales, por un incremento de la carga de ácidos, bien por aporte exógeno (intoxicaciones por alcoholes como el metanol o etilenglicol) o más frecuentemente por alteraciones metabólicas que inducen la producción endógena de ácidos, como en la cetoacidosis diabética o la acidosis láctica, que son las dos causas más frecuentes de acidosis metabólica. La tasa de producción de H+ condiciona la gravedad de la acidosis, que es máxima en la acidosis láctica por hipoxia (hasta 72 mmol/min en la anoxia completa) [9].
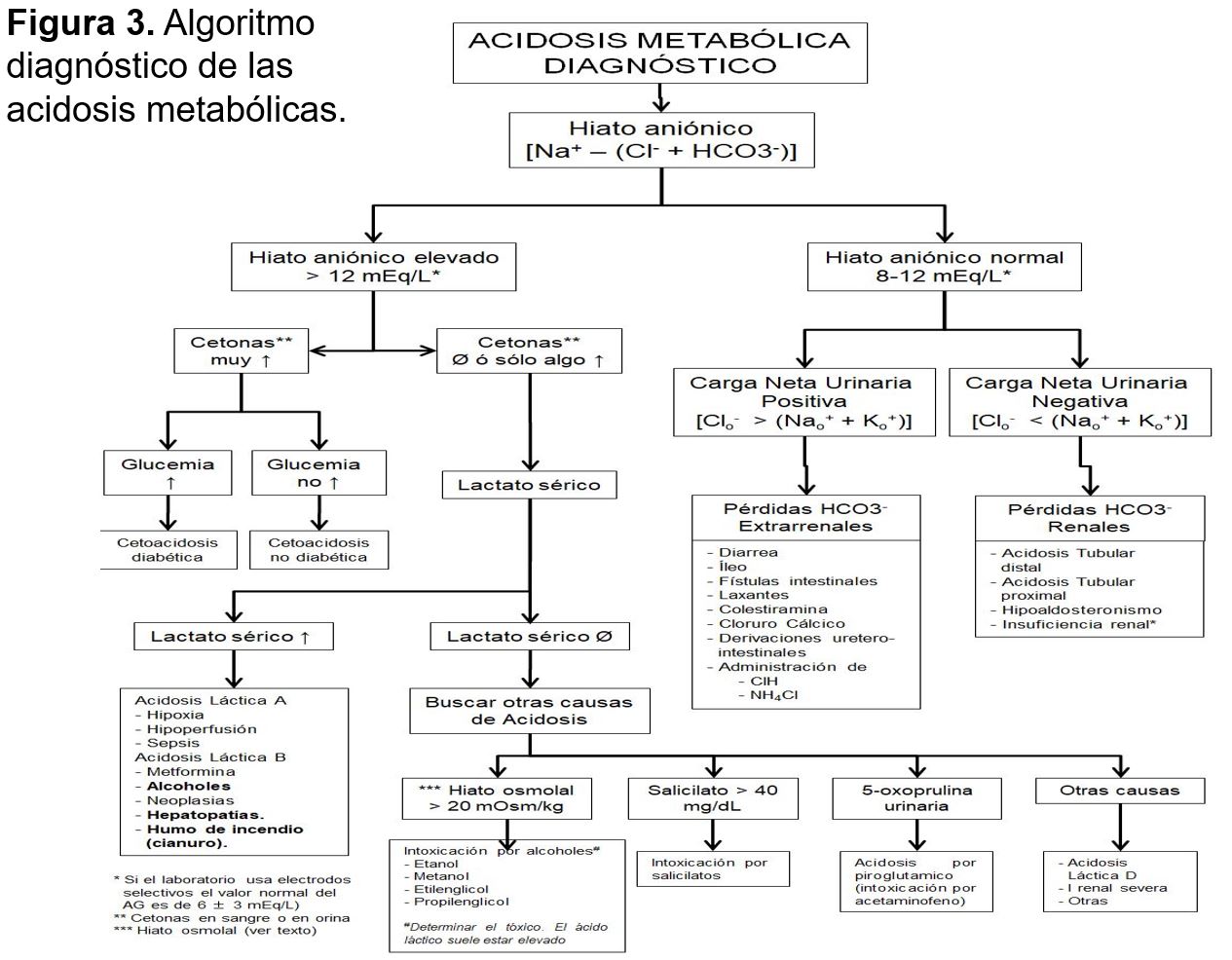
Las principales causas de acidosis metabólica y su abordaje diagnóstico se recogen en la (Figura 3) [9] [10].
La sintomatología de la acidosis metabólica, independientemente del hiato aniónico va a depender de la gravedad de la acidosis y del tiempo de evolución, e implica cambios en la función pulmonar, cardiovascular y musculoesquelética. El aumento de la ventilación se traduce en hiperpnea, bien por taquipnea o, más frecuentemente, por batipnea o su combinación.
La acidemia grave favorece una menor contractilidad cardiaca, la respuesta a catecolaminas y la aparición de arritmias ventriculares fatales.
La acidosis metabólica crónica como la de las acidosis tubulares renales o la enfermedad renal crónica favorece problemas esqueléticos por la liberación de fosfato y calcio del hueso para tamponar el exceso de ácido. Contribuye, además, en los niños, a un crecimiento inadecuado [5].
Tratamiento
Para planificar un tratamiento adecuado, y como en cualquier trastorno ácido-base, es fundamental identificar las respuestas secundarias (mecanismos de compensación), si éstas son adecuadas o no, y si existen otros trastornos ácido-base (trastornos mixtos) o electrolíticos asociados.
En las acidosis metabólicas, el aspecto clave del tratamiento reside en bloquear la fuente de producción de ácido (p. ej., aportando insulina en la cetoacidosis diabética), teniendo en cuenta siempre las compensaciones que existan, la tasa de producción de ácido y su causa (las acidosis lácticas por hipoxia o por intoxicación por alcoholes son más graves por su rápida evolución). Especial precaución a la hora de planificar el tratamiento merece la detección de hipopotasemia, ya que implica un déficit de potasio grave [8] (Ver trastornos del potasio).
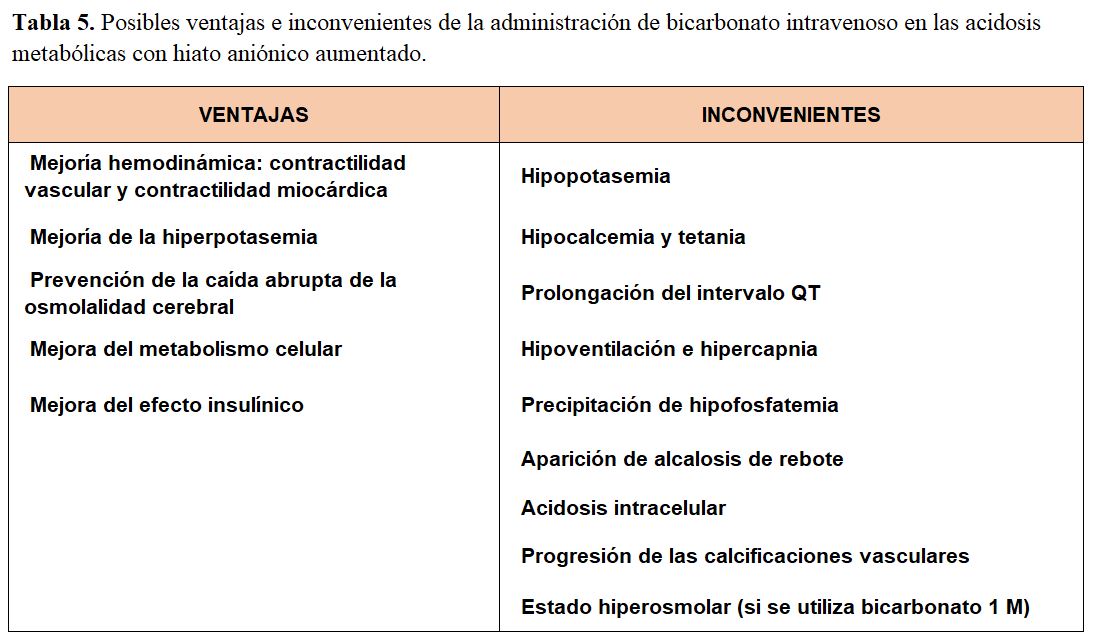
La reposición de bicarbonato intravenoso en las acidosis agudas con hiato aniónico elevado debe ser muy cautelosa, aplicada sólo en determinadas circunstancias (p. ej., hiperpotasemia extrema, descensos potencialmente mortales de pH), y siempre valorando los riesgos y beneficios (Tabla 5). No se ha demostrado de forma consistente ningún beneficio del tratamiento con bicarbonato en la cetoacidosis diabética, en la acidosis láctica, en el shock séptico, en la acidosis metabólica intraoperatoria, ni en el paro cardiaco. De hecho, en las guías de soporte vital avanzado se ha eliminado el tratamiento con bicarbonato dada la ausencia de beneficios en la supervivencia, excepto en casos de hiperpotasemia o en la toxicidad por antidepresivos tricíclicos [11] Sin embargo, un ensayo clínico reciente sugiere que el paciente en unidades de cuidados intensivos con acidosis metabólica grave junto a insuficiencia renal aguda podría beneficiarse de la administración de bicarbonato [12]. Si se decide utilizar bicarbonato, el único objetivo es ganar tiempo hasta que los mecanismos homeostáticos consigan incrementar el pH a través de la producción de HCO3-. Por ello, el bicarbonato sérico diana en los cálculos de reposición nunca será un bicarbonato normal, sino un valor de seguridad: 8-12 mEq/l, de acuerdo con la ecuación 4 [13] [14]. La administración de bicarbonato genera CO2 (Ecuación 2), por lo que siempre debe de garantizarse que no hay insuficiencia ni acidosis respiratoria, ya que se agravaría la acidosis.
Ecuación 4. Cálculo de la reposición de bicarbonato
Déficit de bicarbonato = ΔHCO3- x 0,5* x peso corporal
ΔHCO3- ≤ bicarbonato diana - [HCO3-]p
* En las acidosis extremas ([HCO3-] = 5 mEq/l) o con tasa de producción de ácido muy elevada (como en la hipoxia, sustituir el valor de 0,5 por 0,8).
Otras consideraciones que hay que tener en cuenta son:
Los aniones no medidos, en el hiato aniónico, proporcionan una estimación bastante aproximada de la capacidad de generación de bicarbonato (bicarbonato potencial), una vez controlada la situación generadora de acidosis.
Otros métodos para la corrección de la acidosis son la hemodiálisis, la aspiración de contenido gástrico, la administración de pentagastrina y la ventilación mecánica [9] [15]
Consideraciones específicas
Cetoacidosis diabética
Se caracteriza por hiperglucemia, acidosis metabólica, cetonuria y aumento en los cuerpos cetónicos corporales. Representa la complicación metabólica aguda más grave de la diabetes mellitus. No es una complicación exclusiva de la diabetes mellitus tipo 1. En Estados Unidos una de cada tres hospitalizaciones por cetoacidosis diabética es en diabéticos tipo 2 [16].
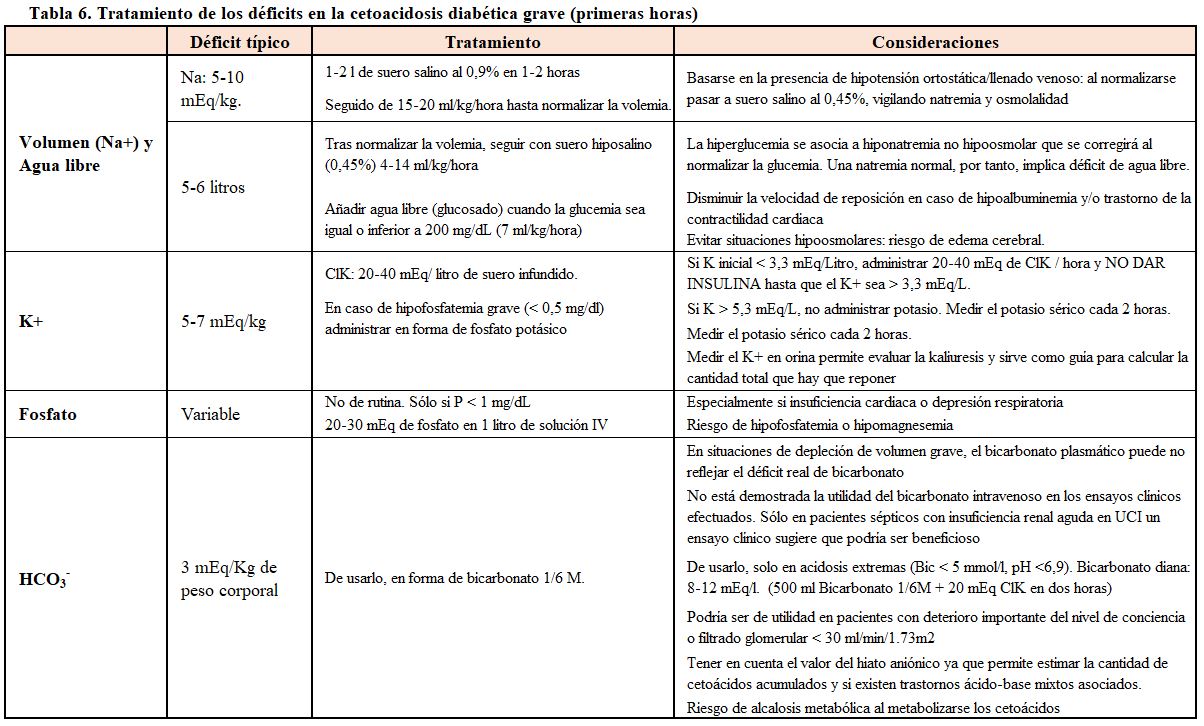
A la problemática de la acidosis debida al acúmulo de cetoácidos por el déficit de insulina, se agrega el déficit de agua, el de volumen circulante, la coexistencia de acidosis láctica y el déficit de potasio, que depende, a su vez, de la duración y magnitud de la poliuria secundaria al mal control glucémico, y del grado de reposición de las pérdidas.
El plan general de tratamiento debe incluir, por lo tanto:
- Insulina para frenar la producción de H+.
- Reexpansión del volumen extracelular.
- Corrección del posible déficit de potasio.
La decisión de administrar o no bicarbonato debe ser valorada con detenimiento, teniendo en cuenta los argumentos expuestos previamente (Tabla 5) [17]. Los déficits estimados y su tratamiento se resumen en la (Tabla 6).
Los fármacos inhibidores del cotransportador de sodio-glucosa tipo 2 (iSGLT2) pueden producir cetoacidosis diabética tanto en diabéticos tipo 1 (4-6%) como en diabéticos tipo 2 (incidencia comunicada 0,16-0,76 casos por 1.000 pacientes/año). Se trata de una cetoacidosis con glucemias habitualmente inferiores a 250 mg/dl, si bien la clínica es la habitual de la cetoacidosis diabética (náuseas, vómitos, dolor abdominal, anorexia, confusión, somnolencia, entre otros). Como factores precipitantes se han descrito cualquier enfermedad aguda intercurrente que produzca inanición, el ayuno periquirúrgico, la deshidratación, los cambios dietéticos abruptos (dietas pobres en hidratos de carbono), la ingesta excesiva de alcohol y el embarazo. La patogenia incluye el descenso en la producción de insulina, el estímulo directo para liberar glucagón por el páncreas, el aumento en la cetogénesis hepática y el descenso en el aclaramiento de acetoacetato y beta-hidroxibutirato por el riñón.
El diagnóstico debe sospecharse en todo diabético tratado con iSGLT2 que presente clínica sugerente de cetoacidosis diabética, aunque la glucemia no esté muy elevada, acidosis metabólica con hiato aniónico elevado y cetonemia y/o cetonuria, teniendo en cuenta que las tiras de orina no son útiles para el diagnóstico ya que no detectan el cetoácido hidroxibutirato que es el predominante en estos casos [18]
El tratamiento es el de cualquier cetoacidosis diabética
Acidosis láctica
Hay dos enantiómeros del lactato (anión del ácido láctico): L y D lactato. La mayoría de las acidosis que se ven en la práctica clínica son las acidosis por acúmulo de L-lactato. Las bases fisiopatológicas se revisan en profundidad en este trabajo reciente de Kamel Ks et al [18] Se define la acidosis láctica como cifras de lactato sérico > 2 mmol/l junto a pH < 7,35 y pCO2 inferior o igual a 42 mm Hg. Es un marcador de mayor riesgo de mortalidad en la mayoría de los escenarios clínicos. Clásicamente, las acidosis lácticas se clasifican en dos tipos principales.
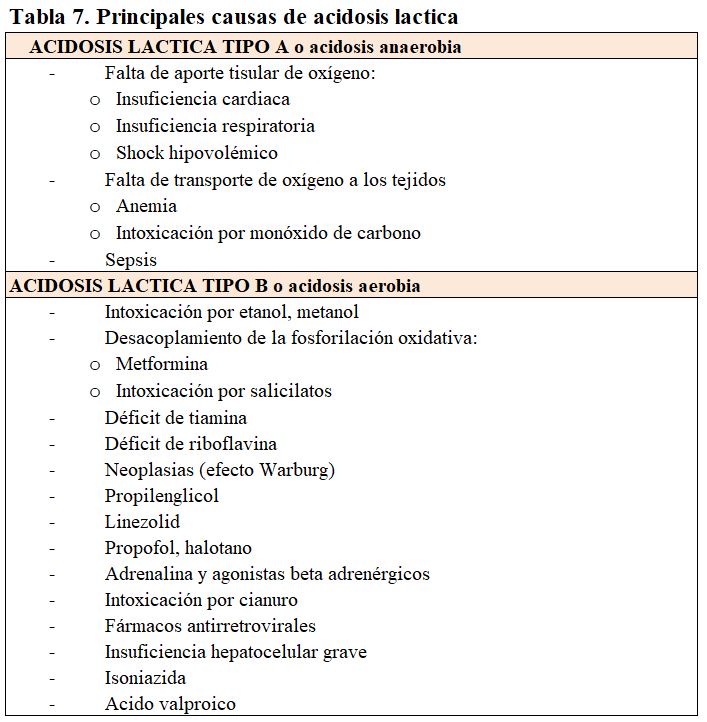
Tipo A o acidosis anaerobia: debida a hipoxia y exceso de formación de ácido láctico La hipoxia estimula la glicolisis anaerobia que va a generar piruvato que terminará metabolizándose en ácido láctico. La mayoría de los casos de acidosis láctica corresponden a este tipo. Puede producirse por falta de aporte de oxígeno (enfermedad pulmonar o cardíaca), falta de transporte de oxígeno a los tejidos (anemia) o exceso de demanda/bloqueo de la respiración tisular (isquemia, hipoperfusión tisular). Es una acidosis grave, dado que la velocidad de producción de ácidos suele ser muy elevada. El tratamiento consiste en aumentar el aporte tisular de oxígeno.
Tipo B o acidosis aerobia: debida a la disminución del metabolismo hepático del ácido láctico en ausencia de hipoxia. Puede deberse a insuficiencia hepatocelular grave o a interferencia con el metabolismo hepático. En otras ocasiones se produce por grandes masas tumorales. Otras causas de acidosis B láctica son el déficit de tiamina, el ejercicio extremo, la intoxicación por etanol y fármacos como la adrenalina y la metformina [5] [9] [15] [19] (Tabla 7).
La acidosis láctica secundaria al tratamiento con metformina es poco frecuente (0,03-0,12 casos/1.000 pacientes-año), aunque de elevada mortalidad. Se produce por el bloqueo en la conversión de lactato y alanina a piruvato por la metformina. La metformina se elimina mediante secreción tubular, por lo que sus niveles plasmáticos pueden aumentar por alteración de la función renal. En la práctica clínica la asociación entre acidosis metabólica y metformina puede aparecer en tres escenarios: Por sobredosis de metformina (habitualmente de buen pronóstico). Asociación casual en la que hay una circunstancia que condiciona una acidosis láctica (shock, insuficiencia cardiaca o hepática). Acidosis láctica de otra causa junto a insuficiencia renal aguda que conduce a la acumulación de metformina que agrava a su vez la acidosis láctica. Las dos últimas situaciones son de elevada mortalidad (40-50%). El tratamiento es el de la enfermedad de base y suspender la administración de metformina, medidas de soporte, bicarbonato y medidas de depuración extrarrenal en las acidosis muy graves [20]. Las recomendaciones actuales de las guías sugieren que deben realizarse tratamientos de depuración extrarrenal (preferentemente hemodiálisis intermitente) si: lactato > 20 mmol/l, pH < 7.0, shock, falta de respuesta con medidas de soporte convencionales y descenso en el nivel de conciencia. Debe mantenerse hasta que el lactato sea inferior a 3 mmol/l y el pH > 7,35 [21].
Acidosis láctica en el paciente oncológico: La acidosis más frecuente es una acidosis láctica tipo A por hipoxia y/o sepsis. Sin embargo, puede aparecer una acidosis láctica tipo B consecuencia del peculiar metabolismo de la propia masa tumoral que condiciona una liberación de ácido láctico que puede ser tan masiva que sobrepasa la capacidad de metabolismo hepático del exceso de ácido láctico. Se asocia especialmente a neoplasias hematológicas, fundamentalmente linfomas, en las que la masa tumoral es de gran tamaño y/o la tasa de proliferación tumoral es muy rápida. Si esta situación se asocia, además, a una insuficiencia hepática, la acidosis láctica será todavía más grave. También se ha descrito en tumores sólidos (13% de los casos), fundamentalmente neoplasias pulmonares y cáncer de mama. [22]. La producción tumoral de ácido láctico es lo que se conoce como el “Efecto Warsburg”, y es que las células neoplásicas tienden a convertir la glucosa en lactato, independientemente de la situación aerobia o no del medio, a diferencia de las células no neoplásicas, que en condiciones de oxigenación adecuada metabolizarán la glucosa a piruvato [23]. Esta glicolisis anaerobia como vía preferente de las células neoplásicas es la causa de la acidificación peritumoral que se observa en la mayoría de las neoplasias. Este medio ácido favorece el remodelado de la matriz extracelular y, por tanto, la invasión local y la angiogénesis tumoral, así como la quimioresistencia, el dolor óseo, e incluso la invasión tumoral a distancia (metástasis) [24] El mejor conocimiento de los complejos mecanismos que promueven la acidificación tumoral se está utilizando para diseñar estrategias que interfieran con estos sistemas y puedan disminuir la proliferación tumoral, o mejorar la sensibilidad a determinados quimioterápicos [25] El pronóstico es desfavorable a corto plazo, con una mortalidad del 80% o mayor en horas/días. El único tratamiento eficaz es disminuir la masa tumoral mediante quimioterapia y, mientras ésta hace efecto, aportar tratamiento de soporte que pasa por hemodiálisis para mantener el equilibrio ácido-base, o la administración de tiamina, que podría ser útil al favorecer la conversión a acetilcoencima A del piruvato, y no a lactato, si bien las comunicaciones en este sentido son anecdóticas. El bicarbonato parenteral puede traducirse en un aumento paradójico del lactato y, en cualquier caso, no va a afectar a la producción elevada de ácido láctico por parte del tumor [26]
Acidosis metabólica secundaria a intoxicación por alcoholes (metanol, etilenglicol, propilenglicol, isopropanol, dietilenglicol)
Son acidosis graves que se caracterizan por hiperosmolalidad y acidosis metabólica con hiato aniónico aumentado. El retraso en el diagnóstico aumenta el riesgo de daño orgánico irreversible y de muerte. La clínica depende del tipo de alcohol ingerido y del tiempo de evolución. Para el diagnóstico el dato de mayor utilidad, además de la medida directa del tóxico, es el cálculo del hiato osmolal: la diferencia entre la osmolalidad medida por el osmómetro y la calculada por la ecuación 5:
Ecuación 5:
Osmolalidad calculada = 2 × [Na+]p + [glucosa] (mg/dl) /18 + [BUN] (mg/dl) /2,8
*Si en vez de BUN (nitrógeno ureico) se usa UREA (BUN=urea/2,14), LA ECUACIÓN SERÍA
Osmolalidad calculada = 2 × [Na+]p + [glucosa] (mg/dl) /18 + [UREA] (mg/dl) /5,6
Un hiato osmolal > 20 mOsm/l implica la existencia de un osmol no medido y no detectado por los autoanalizadores habituales, habitualmente alcoholes. Hiatos osmolales inferiores pueden aparecer en otras circunstancias, como en la cetoacidosis, la acidosis láctica, la insuficiencia renal y la hiponatremia en pacientes críticos. Una utilidad adicional del hiato osmolal es que permite estimar aproximadamente la cantidad de tóxico ingerido. Sin embargo, un hiato osmolal normal no excluye intoxicación por alcoholes, ya que a medida que pasan las horas tras la ingesta, el alcohol se metaboliza, disminuyendo el hiato osmolal y aumentando el hiato aniónico. Puede existir acidosis láctica asociada, especialmente en la intoxicación por propilenglicol y por metanol.
Las intoxicaciones por alcoholes son graves y precisan un tratamiento agresivo y precoz que incluye el lavado gástrico (poco eficaz), bicarbonato que favorece la excreción urinaria del alcohol, administración de etanol o fomepizol (que compiten con la enzima alcohol deshidrogenasa para evitar que se acumulen metabolitos tóxicos) y hemodiálisis para eliminar el tóxico [27].
Acidosis metabólica por paracetamol
Otra causa de acidosis metabólica con anión gap elevado, se debe al uso de analgésicos, en concreto la acidosis por ácido piroglutámico por paracetamol. En este caso el láctico es normal y la clave diagnóstica se obtiene de la anamnesis (consumo de dosis altas y prolongadas en el tiempo de paracetamol), y el hallazgo de un gap urinario positivo por la eliminación urinaria del anión 5-oxoprolina. Como factores de riesgo de esta acidosis se recogen: sexo femenino, tratamiento prolongado con paracetamol, abuso de alcohol, enfermedad hepática, malnutrición, embarazo, enfermedad renal, sepsis, y uso de otros fármacos que interfieren en el ciclo del ácido glutámico, como la flucoxacilina, la vigabatrina y la netilmicina [28] La fisiopatología se recoge gráficamente en la (Figura 4) y se justifica por el descenso de glutatión asociado a la ingesta de paracetamol, lo que favorece el metabolismo del ácido glutámico a 5 oxoprolina (ácido piroglutámico). El tratamiento se basa en suspender el paracetamol, bicarbonato y la administración de acetilcisteína que favorece la normalización de los niveles de glutatión y el restablecimiento del metabolismo del ácido glutámico.
ACIDOSIS METABÓLICA CON HIATO ANIÓNICO NORMAL
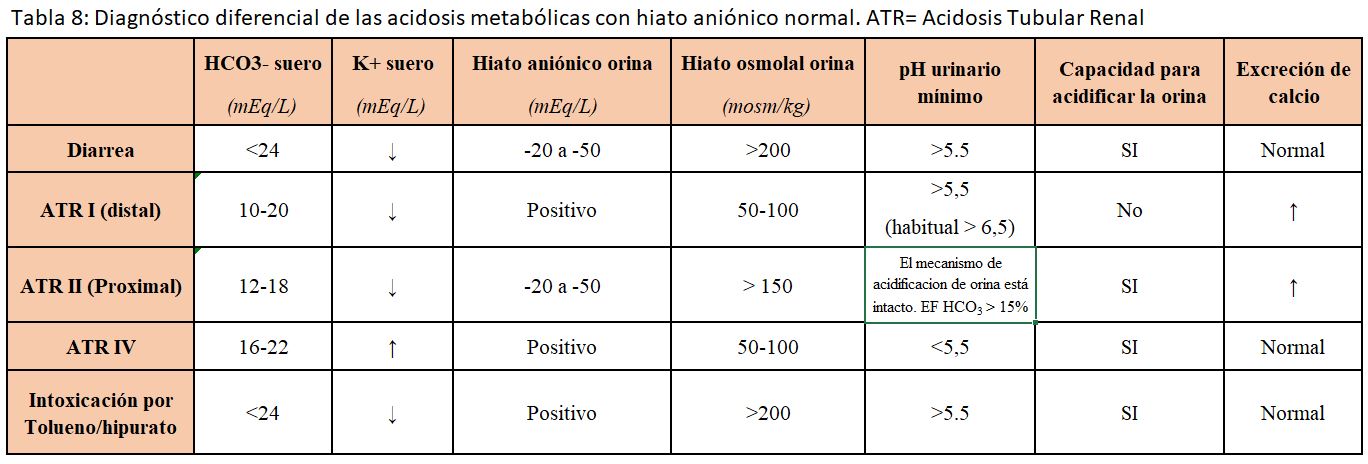
El mecanismo primario es el descenso de la concentración plasmática de bicarbonato que se acompaña de una elevación proporcional de las cifras de cloro plasmático. Este descenso del bicarbonato puede deberse a causas extrarrenales (habitualmente por pérdidas gastrointestinales) o a causas renales (Figura 3) y (Tabla 8) Las características bioquímicas de las distintas causas de este tipo de acidosis se recogen en la (Tabla 8). La determinación del hiato aniónico urinario permite la mayoría de las veces distinguir entre el origen extrarrenal o renal de la acidosis metabólica (Figura 3) [29] [30] [10].
Hiato aniónico urinario: (Calculadora online en este enlace)
Si Clo- > (Nao+ + Ko+): existe un catión acompañante, habitualmente el NH4+, lo que indica que el mecanismo de acidificación está intacto y que la causa de la acidosis es extrarrenal (habitualmente gastrointestinal).
Si Clo- < (Nao+ + Ko+): no hay excreción de NH4+, por lo que el origen es renal. Una excepción es la presencia de otro anión no medido, por ejemplo, el beta-hidroxibutirato.
Otras determinaciones como el hiato osmolal en la orina, el pH urinario y la capacidad para acidificar la orina son de utilidad en el diagnóstico diferencial de estas acidosis metabólicas (Tabla 8).
Tratamiento
El tratamiento con bicarbonato es menos restrictivo que en las acidosis metabólicas con hiato aniónico aumentado. Se utiliza si el pH es < 7,20, con el objetivo de aumentar el pH hasta esta cifra.
Si se decide utilizar terapia alcalinizante, el bicarbonato sódico es el agente de elección. Los precursores de bicarbonato como el lactato y el acetato requieren que la función hepática sea correcta, además de cierto tiempo para producir bicarbonato.
La pauta de tratamiento con bicarbonato es la de la ecuación 4. Debe administrarse en las primeras 24 horas la mitad de la dosis calculada, asumiendo que es una estimación que obliga a una monitorización frecuente con gasometrías. Pasadas las primeras 24 horas, se volverá a calcular el déficit de bicarbonato y se seguirá corrigiendo la concentración de manera parcial, evitando la corrección total rápida porque la hiperventilación secundaria a la acidosis puede persistir unas horas después de la corrección, y producir una alcalosis respiratoria, que puede causar más problemas que la acidosis inicial [14] [15].
Consideraciones específicas
Acidosis metabólica por pérdidas gastrointestinales
La diarrea grave produce acidosis hiperclorémica y deshidratación. En casos extremos, el colapso circulatorio o el ayuno prolongado pueden añadir un componente de acidosis láctica por hipoperfusión tisular o por cetoácidos en el caso del ayuno, aumentando el hiato aniónico, al que contribuye el aumento en la albuminemia por la contracción del volumen extracelular. Suele existir un déficit grave de potasio que puede no ponerse de manifiesto hasta que no se corrige la acidosis.
Los pacientes con abuso crónico de laxantes presentan depleción crónica del volumen extracelular junto con hipopotasemia. Estos enfermos generalmente sufren acidosis metabólica, pero en el caso (no infrecuente) de que también tomen diuréticos, puede observarse alcalosis metabólica asociada. La determinación seriada de los electrolitos en orina es muy útil para el diagnóstico [31].
El tratamiento de la acidosis metabólica por pérdidas gastrointestinales consiste en la administración de suero salino fisiológico y potasio, añadiendo bicarbonato 1/6 M intravenoso en las acidosis agudas y pH < 7,2 o, en caso de acidosis crónica, bicarbonato oral si el bicarbonato plasmático es inferior a 22 mmol/l.
Acidosis por pérdidas renales de bicarbonato
Acidosis tubular renal proximal y distal (tipos II y I)
Las acidosis tubulares se detallan en otro capítulo de Nefrología al Día (Véase Pruebas de Función Tubular - Tubulopatías).
El tratamiento de las acidosis tubulares renales consiste en la administración de bicarbonato en forma de bicarbonato sódico o citrato potásico; la diferencia principal es que en la acidosis proximal (tipo II), la dosis debe ser más alta (aproximadamente 3 mEq/kg/día), mientras que en la acidosis distal (tipo I) la dosis es menor (aproximadamente 1 mEq/kg/día). Se recomienda que al menos una parte del aporte de bicarbonato se realice como sal potásica, para prevenir la hipopotasemia. Recientemente se ha comercializado la molécula ADV7103 (citrato potásico y carbonato ácido de potasio de liberación prolongada) para mejorar la adherencia y el control metabólico en la acidosis tubular distal (tipo I) [32]. También se aconseja limitar las comidas ricas en proteína animal (generadoras de ácidos) y aumentar las comidas que generan bases (frutas y verduras) [33].
Acidosis tubular tipo IV
Se trata de la forma de acidosis cuya incidencia ha aumentado más en las últimas décadas. Se debe a un defecto en la producción o acción de la aldosterona. Como hipoaldosteronismo hiporreninémico, se asocia con frecuencia a diabetes mellitus, edad avanzada, nefropatías intersticiales, uropatía obstructiva, trasplante renal y la administración de determinados fármacos (antiinflamatorios no esteroideos, bloqueantes del eje renina-angiotensina, heparina y ciclosporina, entre otros). Puede manifestarse o agravarse en presencia de insuficiencia renal.
Cursa con acidosis metabólica hiperclorémica e hiperpotasemia, así como con déficit en la excreción renal de amonio, aunque el pH urinario se mantiene inferior a 5,5. Puede aparecer un cuadro clínico similar en la insuficiencia suprarrenal primaria con hipoaldosteronismo, o con el empleo de diuréticos ahorradores de potasio [33].
La hiperpotasemia se trata con diuréticos y quelantes intestinales de potasio. Las dietas ricas en bases (verduras), mejoran la acidemia por su aporte en bases. Aumentan el aporte de glutamato que estimula la producción renal de amonio y ésta, a su vez, mejora la acidosis. El efecto beneficioso sobre la acidosis favorece la redistribución intracelular del potasio. Otros efectos potencialmente beneficiosos para la hiperpotasemia y descritos por las dietas ricas en bases serían el aumento en la sensibilidad de la insulina y la prevención del estreñimiento [34]
No debe restringirse el aporte de sal, a fin de mejorar la llegada de sodio al túbulo distal, y que pueda intercambiarse por potasio. En los casos de hipoaldosteronismo puede ser necesario administrar fludrocortisona en dosis de 0,1-0,2 mg/día (Ver trastornos del potasio).
Acidosis en la enfermedad renal crónica
La incapacidad renal para excretar amonio y ácidos orgánicos conduce a una acidosis metabólica que generalmente se manifiesta con filtrados glomerulares inferiores a 20 ml/min. La acidosis es a menudo de tipo mixto, con hiato aniónico moderadamente elevado.
Es conveniente tratar la acidosis renal, que conduciría a la larga a la desmineralización ósea. El tratamiento debe iniciarse cuando las cifras de bicarbonato plasmático desciendan por debajo de 20 mEq/l. Se utiliza bicarbonato sódico en dosis bajas (1 mEq/kg/día, o incluso menos). En los niños la acidosis debe corregirse agresivamente para facilitar el crecimiento óseo normal [35] (Véase Enfermedad Renal Crónica).
Varios ensayos clínicos muestran cómo la utilización de bicarbonato oral o las dietas ricas en frutas y vegetales, con el objetivo de conseguir una concentración de bicarbonato plasmático de 22-26 mmol/l, disminuye la progresión de la enfermedad renal crónica, en cualquiera de sus estadios, sin que se observen efectos perjudiciales por la expansión de volumen asociada al tratamiento. De especial interés son las dietas basadas en plantas (frutas y vegetales), por sus potenciales efectos beneficiosos adicionales (antioxidantes, antihipertensivos, menor calcificación vascular) sobre el riesgo cardiovascular [36].
Hay otros ensayos clínicos más amplios en marcha para confirmar estos hallazgos, si bien la evidencia actual apoya la necesidad de corregir la acidosis metabólica de la enfermedad renal.
Actualmente hay un nuevo fármaco que se está ensayando en la acidosis de la enfermedad renal crónica: el veverimer (TRC101) es un polímero alcalino que actúa en el tracto gastrointestinal uniéndose selectivamente a los hidrogeniones, aumentando el bicarbonato plasmático sin aportar sodio (a diferencia del bicarbonato sódico). Los ensayos clínicos realizados muestran su eficacia y su buena tolerancia a largo plazo, si bien todavía no está aprobado por las agencias reguladoras [37].
Acidosis hiperclorémica por suero salino fisiológico
El suero salino 0,9% es hiperclorémico en relación con el plasma, por lo que la administración de grandes volúmenes puede favorecer la aparición de acidosis metabólica hiperclorémica. Algunos estudios han asociado esta acidosis a un mayor riesgo de insuficiencia renal aguda, por lo que se han propuesto soluciones tamponadas o balanceadas (Ringer-lactato o Plasma-Lyte) como alternativas. Sin embargo, un metaanálisis reciente no ha demostrado superioridad de las soluciones balanceadas frente al salino en términos de mortalidad o de fracaso renal agudo. [38]
Parece razonable individualizar el fluido a administrar en función de las características del paciente. En líneas generales el suero salino es de elección como fluido de resucitación, dado que es la solución más barata. Sin embargo, en el contexto de acidosis hiperclorémicas o si se van a necesitar grandes volúmenes de cristaloides puede ser aconsejable utilizar soluciones más balanceadas.
ALCALOSIS METABÓLICA
Se define como una elevación primaria de la concentración plasmática de bicarbonato (Figura 1). A pesar de ser un trastorno frecuente (el 50% de las alteraciones del equilibrio ácido-base en pacientes hospitalizados son alcalosis metabólica y es el trastorno más frecuente en las unidades de cuidados intensivos), no suele ser valorada clínicamente, aunque se asocia en sus valores extremos con una importante morbimortalidad (80% con pH > 7,65). Independientemente del mecanismo generador, para que la alcalosis metabólica persista y trascienda clínicamente es necesario que estén alterados los mecanismos renales que controlan la excreción de bicarbonato. En la mayoría de las ocasiones la alcalosis metabólica se acompañará de un déficit de cloro y de potasio, así como de contracción del volumen extracelular [39] [40].
Etiología
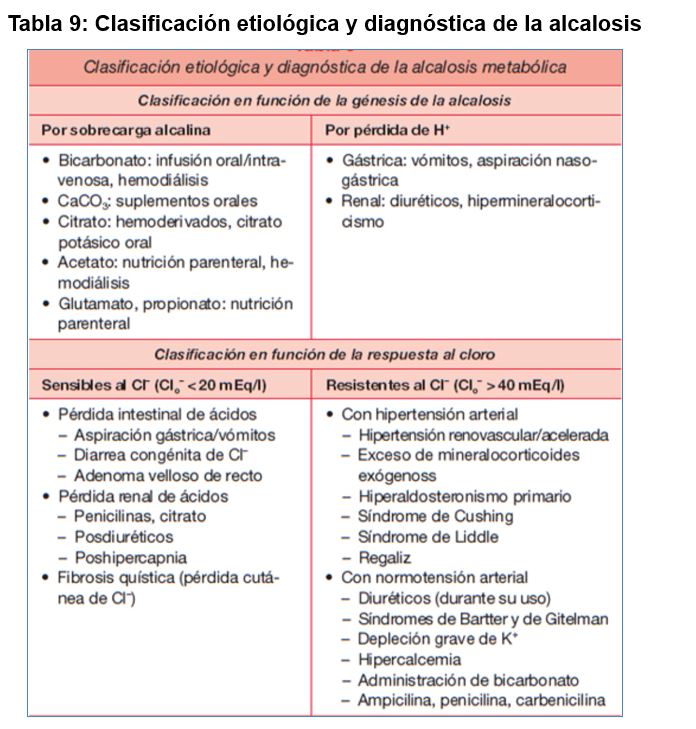
Toda alcalosis metabólica se genera por exceso de aporte de bases, o bien por pérdida de hidrogeniones (Tabla 9) Para que se mantenga en el tiempo debe existir una alteración en la regulación renal que impida al riñón deshacerse del exceso de bicarbonato plasmático y que básicamente son: la depleción del Cl- y/o K+, la contracción de volumen circulante eficaz, el exceso de actividad mineralocorticoide (hiperaldosteronismo) o la insuficiencia renal grave.
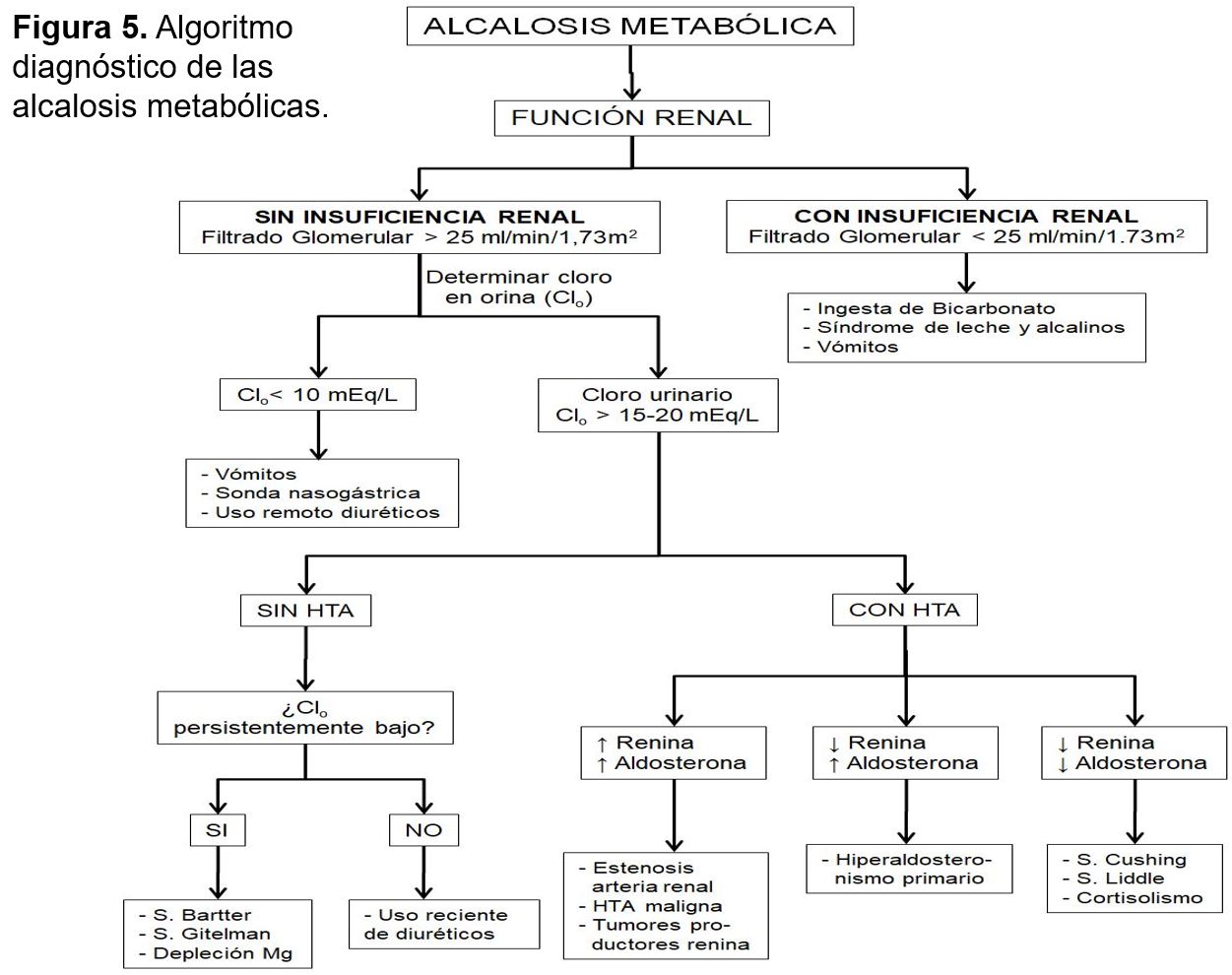
En la (Tabla 9) se enumeran las causas más frecuentes de alcalosis metabólica, clasificadas en función de la génesis de la alcalosis, o de su respuesta terapéutica al tratamiento con sales de cloro. También se recogen en el algoritmo diagnóstico de la (Figura 5) [10].
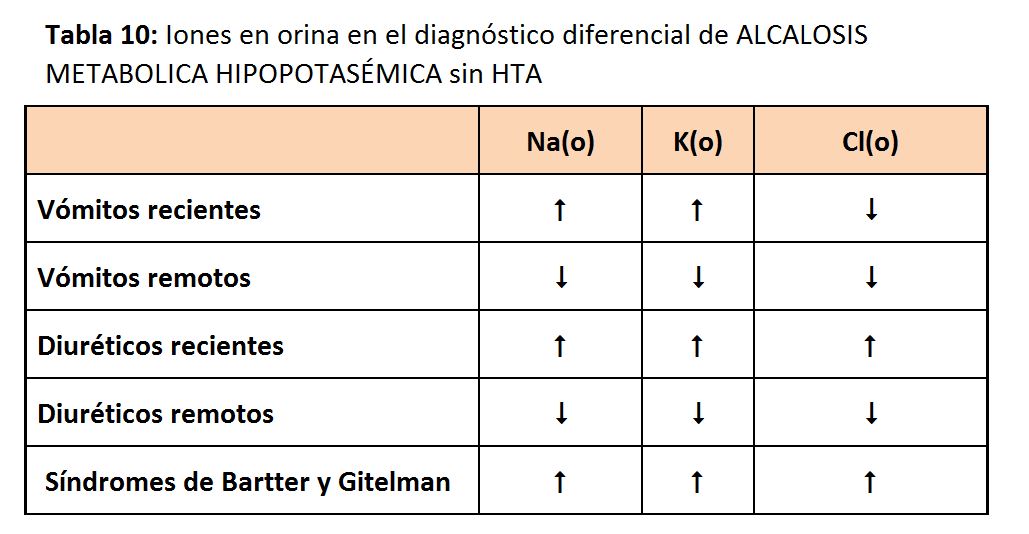
Los vómitos y la aspiración gástrica son, junto a los diuréticos, las causas más frecuentes de alcalosis metabólica. La hipopotasemia acompañante no se debe a pérdidas digestivas de potasio sino al aumento de su eliminación urinaria por el hiperaldosteronismo 2º a la depleción de volumen. En estos casos, la concentración de cloro urinario (y no la de sodio que acompaña obligadamente al bicarbonato urinario) refleja la volemia efectiva [41]. La depleción de volumen extracelular que inducen tanto los diuréticos como las pérdidas de jugo gástrico aumenta la secreción de aldosterona, que estimula la reabsorción tubular distal de sodio, con secreción de K e H+, que generan una orina paradójicamente ácida.
Los síndromes de Bartter y de Gitelman son dos tubulopatías hereditarias autosómicas recesivas que cursan con alcalosis hipopotasémica que se tratan con detalle en el capítulo de tubulopatías. Las manifestaciones clínicas del síndrome de Bartter son superponibles a las del uso crónico de diuréticos del asa, mientras que las del síndrome de Gitelman son parecidas a las del efecto crónico de las tiazidas. Estas entidades se deben a una anomalía congénita del transporte de Cl- en el asa de Henle (cotransporte de Na+/K+/2Cl-) y en el túbulo distal (cotransporte de Na+/Cl-), respectivamente. Sólo pueden compensarse parcialmente con suplementos de potasio y de magnesio [42].
Los electrolitos en orina pueden ser de gran utilidad para el diagnóstico diferencial de las principales causas de alcalosis metabólica, tal y como se recoge en la (Tabla 10). A veces es difícil distinguir una tubulopatía del uso subrepticio de diuréticos. En estos casos, la determinación de diuréticos en orina, o la medida repetida de los iones en orina (en la ingesta crónica de diuréticos los iones en orina no estarán elevados de forma persistente, sólo tras la toma de los diuréticos) permitirá distinguir dichas situaciones.
Respuestas secundarias a la alcalosis metabólica
Al igual que ocurría en la acidosis metabólica, las respuestas secundarias incluyen [4]:
- Tamponamiento físicoquímico en los espacios intracelular y extracelular, mediado por sistemas amortiguadores no bicarbonatados. La capacidad amortiguadora de bases del espacio extracelular es aproximadamente el doble que la del espacio intracelular.
- Retención respiratoria de CO2. Por cada miliequivalente por litro de incremento en el bicarbonato, se produce una retención de CO2 de aproximadamente 0,7 mmHg.
- Compensación renal. Se produce aumentando la excreción renal de bicarbonato. Esta función corresponde predominantemente al túbulo proximal y requiere una expansión adecuada del volumen extracelular, de modo que en situación de euvolemia y con función renal normal es virtualmente imposible aumentar la concentración de bicarbonato plasmático más de 2 o 3 mEq/l por encima de su valor normal, ya que el riñón eliminará este exceso de bicarbonato, La secreción tubular distal de HCO3- se debe a la actividad del intercambio Cl-/HCO3- en las células intercaladas tipo beta del túbulo colector. La pérdida grave de Cl-, inhibiría este intercambio, impidiendo la secreción de bicarbonato, con lo que se mantendría la alcalosis. La depleción de potasio o la contracción del espacio extracelular también impiden que se excrete bicarbonato en la orina, al estimular la amoniogénesis renal y la excreción de amonio. Por último, el hiperaldosteronismo secundario a la contracción del espacio extracelular estimula la secreción tubular de K+ e H+, lo que produce una orina ácida que agrava o mantiene la alcalosis.
Manifestaciones clínicas
Los síntomas de la alcalosis metabólica son difíciles de diferenciar de los de la depleción de volumen o de la hipopotasemia acompañante. En la alcalemia grave no compensada predomina la apatía, la confusión, la irritabilidad neuromuscular (calambres, debilidad, tetania) y las arritmias cardíacas.
Es de señalar que en los casos de alcalemia grave (HCO3- > 40 mEq/l) suele encontrarse una elevación moderada del hiato aniónico. En casi un 50% de los casos se debe a lactato, y el resto es debido a concentración de las proteínas séricas, que además se vuelven más aniónicas a causa de la alcalemia [4]
Tratamiento
Incluye el de la causa subyacente y la corrección de los déficits existentes (volumen, cloro y potasio) con lo que se consigue aumentar la excreción renal de bicarbonato que está disminuida, además de la insuficiencia renal si existe [40].
- Tratar la causa subyacente a la alcalosis metabólica. Control de los vómitos. En los pacientes con aspiración nasogástrica el uso de inhibidores de la bomba de protones permitirá reducir el contenido ácido de la secreción gástrica y, por tanto, disminuir la pérdida de HCl. Deben suspenderse los diuréticos o reducirse la dosis en función de lo que posibilite la situación clínica del paciente.
- Corregir los déficits existentes. En las alcalosis sensibles al cloro, que suelen cursar con hipovolemia, (habitualmente consecuencia de pérdidas de cloro gastrointestinales o a la administración de diuréticos), la base del tratamiento consiste en aportar cloro en forma de suero salino hasta expandir el espacio extracelular, lo que permitirá disminuir la reabsorción renal de sodio secundaria a la hipovolemia (favoreciendo la eliminación de bicarbonato sódico) y aumentando el aporte renal distal de cloro que permitirá estimular la secreción de bicarbonato en el túbulo colector cortical renal.
El déficit de potasio favorece la retención de bicarbonato en el túbulo proximal renal y la generación tubular distal de bicarbonato al activar la bomba H-K-ATP-asa del túbulo colector que intercambia K por hidrogeniones. Por tanto, la corrección del déficit de potasio es un elemento clave en el tratamiento de la alcalosis metabólica. La reposición debe hacerse con cloruro potásico, ya sea oral o parenteral. Deben evitarse otras sales orales de potasio ya que suelen ser de citrato o acetato que se metabolizan a bicarbonato.
Algunas situaciones concretas que merecen consideraciones terapéuticas específicas (Tabla 11):
- Alcalosis metabólica resistentes al cloro. Incluye los hiperaldosteronismos y los estados edematosos. En los estados edematosos refractarios (cor-pulmonale, insuficiencia cardiaca, cirrosis y síndrome nefrótico), la alcalosis metabólica suele ser secundaria al tratamiento crónico con diuréticos. El tratamiento con suero salino está contraindicado, ya que agravaría el estado edematoso y no mejoraría la excreción renal de bicarbonato, dada la avidez renal de reabsorción de sodio en segmentos tubulares proximales. La utilización de diuréticos ahorradores de potasio (amiloride, espironolactona, eplerenona) resultan de utilidad. También puede considerarse el uso de acetazolamida en dosis de 250-375 mg una o dos veces al día, ya que aumenta la excreción renal de bicarbonato al inhibir la anhidrasa carbónica. Debe monitorizarse el potasio sérico dado que es un fármaco que induce kaliuresis.
- Insuficiencia renal avanzada con alcalosis metabólica grave. El tratamiento de elección será la diálisis ya que permite restaurar rápidamente el equilibrio ácido-base.
- Alcalosis extrema (bicarbonato > 55 mmol/l y/o pH > 7,60) puede ser necesario asociar HCl o NH4Cl (Tabla 11). En estos casos el exceso de bicarbonato puede calcularse con la fórmula de la ecuación 6. Este exceso de bicarbonato (en mEq) es el que se tendrá que administrar en forma de HCl o NH4Cl para conseguir el bicarbonato objetivo, teniendo en cuenta que se trata de una estimación y de que el valor del HCO3- deseado debe ser un valor de seguridad (35-40 mmol/l). La monitorización gasométrica debe de hacerse con mucha frecuencia (cada dos horas)
Ecuación 6: Cálculo del exceso de bicarbonato
Exceso de bicarbonato = 0,6 x peso corporal x Descenso deseado en el HCO3- (Hombres)
Exceso de bicarbonato = 0,5 x peso corporal x Descenso deseado en el HCO3- (Mujeres)
Descenso deseado en el HCO3- = HCO3- plasmático -HCO3- objetivo
ALTERACIONES DEL EQUILIBRIO ÁCIDO-BASE DE ORIGEN RESPIRATORIO
Diariamente el metabolismo oxidativo genera 12.000-15.000 mmol/l de CO2, que pasan al plasma en forma de ácido carbónico y que finalmente serán eliminados por la ventilación alveolar. Los principales estímulos de la respiración son el CO2 y, en menor medida, la pO2, especialmente con pO2 arteriales inferiores a 50 mmHg. Las alteraciones en la ventilación alveolar influyen notablemente en el equilibrio ácido-base intracelular y extracelular, así como en la capacidad de tamponamiento ante las acidosis metabólicas [3] [5] [43].
Acidosis respiratoria
Se considera acidosis respiratoria la reducción del pH sanguíneo secundaria a una retención primaria de CO2. Implica siempre una alteración de la ventilación alveolar. Sus principales causas se recogen en la (Tabla 12).
Ante una acidosis respiratoria, se desencadenan dos respuestas secundarias [43]:
- Tamponamiento intracelular (hemoglobina y proteínas). Constituye la única protección frente a la hipercapnia aguda, ya que el bicarbonato no puede tamponar el ácido carbónico. Esta respuesta se completa en 10-15 minutos tras el aumento de la pCO2. En la hipercapnia aguda el bicarbonato plasmático aumenta en 1 mEq/l por cada 10 mmHg de aumento en la pCO2.
- Respuesta renal. Es de relevancia en la hipercapnia crónica, ya que tarda 3-4 días y consiste en el incremento en la excreción urinaria de amonio, acidez titulable y pérdida de cloro, con el consiguiente aumento en la reabsorción de bicarbonato, que aumenta en 3-4 mEq/l por cada 10 mmHg de aumento de la pCO2.
Manifestaciones clínicas
Las manifestaciones clínicas que se asocian a la hipercapnia consisten en cefalea, confusión, irritabilidad, ansiedad, asterixis, somnolencia, disminución de la conciencia, mioclonías y convulsiones. En el sistema cardiovascular disminuye la contractilidad miocárdica y las resistencias vasculares sistémicas. La gravedad de los síntomas se correlaciona más con la rapidez de la instauración que con el grado de hipercapnia.
La acidosis respiratoria aumenta ligeramente el calcio iónico y favorece la redistribución extracelular de potasio, si bien la hiperkalemia acompañante es leve.
Diagnóstico y tratamiento
El diagnóstico es sencillo por los valores de la gasometría, que en estos casos debe ser arterial (la pCO2 de la gasometría venosa refleja la pCO2 tisular y, por tanto, el estado metabólico y/o circulatorio, mientras que la pCO2 de la gasometría arterial refleja la función ventilatoria pulmonar), mostrando pCO2 elevada (>45 mmHg) junto a descenso en el pH (15-20 mmHg) . La determinación del gradiente alveoloarterial de oxígeno permitirá distinguir si la causa de acidosis respiratoria es una enfermedad pulmonar intrínseca (el gradiente será > 20 mm Hg) o si la hipoventilación es de origen central o se debe a la alteración de la pared torácica o de los músculos inspiratorios (el gradiente en este caso será normal).
Ecuación 7: Gradiente alveoloarterial de oxígeno. (Calculadora online en este enlace)
G(A-a) O2 = [PIO2 - (1,25 × pCO2)] - pO2
PiO2 (pO2 en aire inspirado) = FiO2 × (presión atmosférica - presión de vapor de agua) = 0,21 x (760 - 47) = 150 mmHg
Valores normales: 5-10 mmHg en menores de 30 años; 15-20 mmHg en mayores de 30 años.
El abordaje terapéutico se basa en aumentar la ventilación alveolar eficaz tratando la causa subyacente. Aumentar únicamente el aporte de oxígeno puede favorecer aún más la depresión del centro respiratorio, por lo que debe adjuntarse a otras medidas específicas (farmacoterapia broncodilatadora, ventilación mecánica no invasiva o invasiva, entre otras). La corrección de la hipercapnia puede producir alcalosis metabólica que responde bien a la expansión con suero salino. Si está contraindicado el salino por coexistir un estado edematoso, la administración de acetazolamida puede ser de utilidad al favorecer la bicarbonaturia [44].
El uso de bicarbonato no se aconseja en la acidosis respiratoria, ya que se metabolizaría en CO2 empeorando la acidemia, ya que la ventilación alveolar está comprometida. Sin embargo, recientemente se ha planteado la posible utilidad del tratamiento con bicarbonato en la acidosis grave mixta (acidosis respiratoria y acidosis metabólica) o en la hipercapnia permisiva del paciente en ventilación mecánica con el objetivo de disminuir las deletéreas consecuencias de la acidemia grave. Sin embargo, no hay estudios controlados que confirmen los beneficios de esta aproximación terapéutica, que en cualquier caso no debe plantearse en la acidosis respiratoria simple [45].
ALCALOSIS RESPIRATORIA
Es el trastorno ácido-base que aparece ante cualquier proceso que reduzca la pCO2 arterial, como consecuencia de hiperventilación alveolar. De forma compensadora disminuirá el bicarbonato plasmático (Tabla 2). Es el trastorno ácido-base más frecuente. Sus principales causas se recogen en la (Tabla 13).
Ante una alcalosis respiratoria se desencadenan dos respuestas secundarias [3] [5] [43]:
- Tamponamiento intracelular. La hemoglobina, los fosfatos y las proteínas liberan hidrogeniones [H+] que se unen al HCO3- para forma H2CO3. Esta respuesta en la alcalosis aguda consigue disminuir 2 mEq/l de HCO3- por cada 10 mmHg que desciende la pCO2.
- Respuesta renal. Es relevante en la alcalosis respiratoria crónica, ya que la respuesta, que tarda 3-4 días en producirse, consiste en la disminución en la reabsorción proximal de bicarbonato y la excreción urinaria de amonio y acidez titulable. Como consecuencia, el bicarbonato disminuye 4 mEq/l por cada 10 mmHg que desciende la pCO2.
Manifestaciones clínicas
En caso de alcalosis respiratoria se observa taquipnea, aumento en la excitabilidad del sistema nervioso, parestesias, espasmos carpopedales y taquiarritmias.
Diagnóstico y tratamiento
El diagnóstico es sencillo por los valores de la gasometría arterial. Siempre habrá una causa subyacente que debe estudiarse y tratarse. Si se asocia a acidosis metabólica (como en la sepsis), la pCO2 será inferior a la esperada para el grado de acidosis (ver trastornos mixtos). El gradiente alveolo-arterial de oxígeno también es de utilidad en caso de sospecha de enfermedad pulmonar intrínseca (Ecuación 7) Deben medirse, además, los electrolitos sodio, potasio, calcio y magnesio que pueden estar alterados y condicionar la planificación terapéutica.
El tratamiento es el de la causa subyacente, siendo de utilidad en las formas psicógenas o en las graves sin hipoxia, el uso de ansiolíticos o respirar en un sistema cerrado para aumentar la pCO2 del aire inspirado.
TRASTORNOS MIXTOS
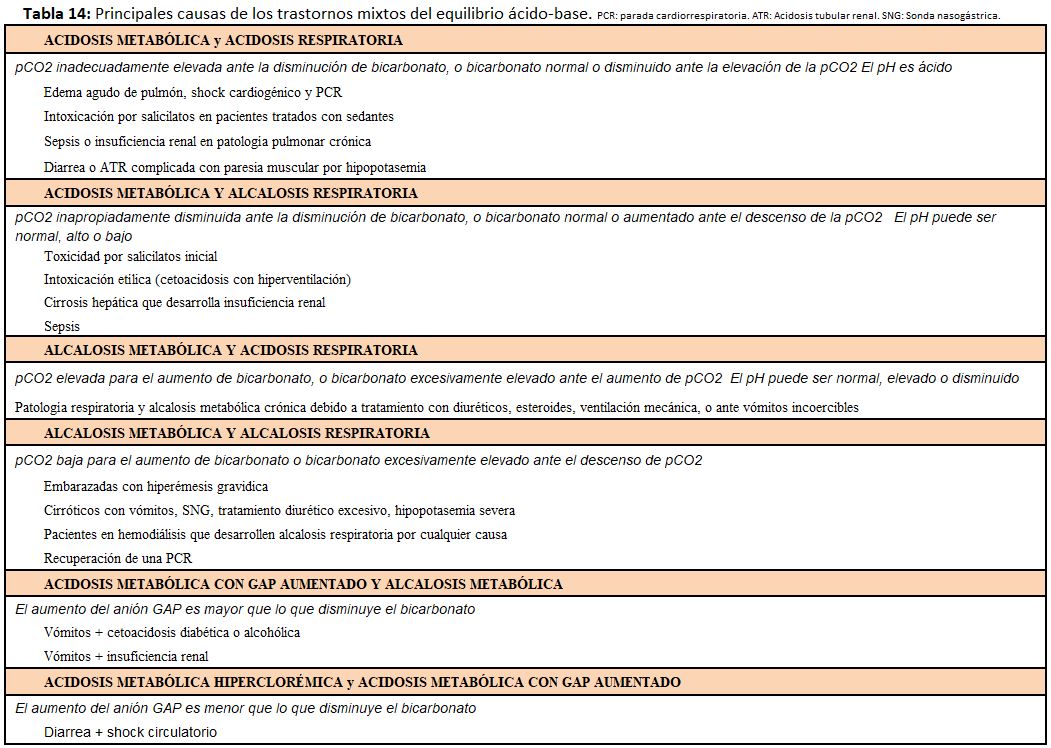
Las alteraciones en la concentración de bicarbonato o de pCO2 se acompañan de una respuesta compensadora en el otro elemento (Tabla 2). Si la compensación es adecuada o no permitirá detectar si existe un segundo o tercer trastorno asociado, en lo que constituyen los trastornos mixtos que son muy frecuentes en la práctica clínica y que implican una mayor gravedad (Tabla 14).
Para detectar los trastornos mixtos debe tenerse en cuenta que una compensación nunca conseguirá normalizar el pH. La lectura sistemática de la gasometría y del anión gap permite distinguir fácilmente la existencia o no de un trastorno mixto [10].
Las principales causas de los trastornos mixtos del equilibrio ácido-base se recogen en la (Tabla 14).
Su tratamiento y la prioridad de las actuaciones a seguir dependerá de la causa y del trastorno ácidobase predominante, teniendo siempre en cuenta las alteraciones electrolíticas asociadas.