Trastornos del Agua. Disnatremias
Palabras clave
Hiponatremia, hipernatremia, agua, vasopresina, ADH
ÍNDICE
FUNDAMENTOS FISIOLÓGICOS DEL EQUILIBRIO HIDRICO
Distribución del agua a través de las membranas celulares
Distribución del agua corporal
Regulación del volumen celular
Mecanismos reguladores del balance de agua
1. Sensores
2. Sed
3. ADH
4. Excreción renal de agua
CUANTIFICACION DE LA EXCRECIÓN RENAL DE AGUA
Aclaramiento de agua libre (CH2O)
Aclaramiento de agua libre de electrolitos (CH2Oe)
HIPONATREMIA
Etiología
1. Hiponatremia con osmolalidad plasmática aumentada o normal
2. Hiponatremia con osmolalidad plasmática disminuida
a) Hipervolemia
b) Hipovolemia
c) Normovolemia
Clínica
Diagnóstico
Tratamiento
• Factores relevantes antes de iniciar el tratamiento
• Tratamiento de la hiponatremia
HIPERNATREMIA
Etiología
Diagnóstico
Clínica
Tratamiento
• Principios generales
• Cálculo del déficit de agua
• Tratamiento de la DIC
• Tratamiento de la DIN
• Tratamiento de la sobrecarga de sodio
Las disnatremias son trastornos frecuentes asociados a una importante comorbilidad, en especial si no se reconocen de forma precoz, y cuyo tratamiento debe realizarse cuidadosamente por los riesgos que conlleva una corrección inadecuada.
Tanto la hipo como la hipernatremia son reflejo de alteraciones en la regulación del agua y no del sodio (Na). Así, la premisa fundamental para manejar correctamente las alteraciones de la concentración plasmática de sodio ([Na]) es recordar que la [Na] es un reflejo de la osmolalidad (Osm) del líquido extracelular y que la osmolalidad indica cambios en el agua, mientras que la cantidad total de sodio determina el agua total del líquido extracelular y produce cambios en el volumen, cuyo mantenimiento es esencial para que la perfusión tisular sea adecuada. Por tanto, las disnatremias son trastornos del agua independientes de la cantidad total de sodio. La (Tabla 1) recoge las diferencias entre la fisiología del sodio y el agua.
FUNDAMENTOS FISIOLÓGICOS DEL EQUILIBRIO HIDRICO
DISTRIBUCIÓN DEL AGUA A TRAVÉS DE LAS MEMBRANAS CELULARES
Las fuerzas osmóticas gobiernan la distribución del agua en el organismo. El agua cruza la membrana celular a través de las acuaporinas (AQP) o canales de agua para que las osmolalidades, que es el número de partículas de soluto por volumen de solvente, sean idénticas en el líquido intracelular (LIC) y extracelular (LEC).
Osm (mOsm/l) = Na+ x2 + glucosa/18 + urea/5,6 (Calculadora SEN)
Para pasar a mmol/l, la glucosa y urea (valores en mg/dl) se dividen entre 18 y 5,6, respectivamente. Si se utiliza el NUS (nitrógeno ureico en sangre): NUS (mOsm/l) = urea/2,14.
La osmolalidad depende fundamentalmente de las partículas localizadas en cada espacio: el principal osmol del LEC es el Na+ junto con sus aniones acompañantes (Cl- y HCO3-), mientras que el K+ lo es en el LIC. La electroneutralidad del LIC se mantiene con moléculas orgánicas de fosfato, que son muy grandes y tienen poco poder osmótico; aunque otras moléculas orgánicas, que varían según el órgano, sí contribuyen a la presión osmótica intracelular. Además, existen otras partículas, como la urea o el alcohol, que cruzan rápidamente la membrana, igualando su concentración en el LIC y LEC, y no inducen movimientos de agua. Son osmoles inefectivos y de ahí la diferencia entre osmolalidad y tonicidad, siendo la tonicidad la fracción de la osmolalidad producida por solutos efectivos, esto es, por solutos que no atraviesan la membrana plasmática de forma pasiva (ej. sodio, glucosa, manitol, etc.).
Tonicidad = Na+ x 2 + glucosa/18
En circunstancias normales, el contenido de agua corporal se mantiene en un margen estrecho, ajustando la excreción urinaria a los cambios dietéticos. Si se añade Na+ sin agua al LEC, aumentará su osmolalidad y saldrá agua de las células a favor del gradiente osmótico. El efecto final es un aumento de la osmolalidad en los dos compartimentos sin que cambie el volumen de agua total. Si por el contrario se aporta agua sin electrolitos, la osmolalidad del LEC disminuirá y pasará agua a la célula. En este caso el agua total aumentará y originará la expansión y dilución de ambos espacios. Finalmente, si lo que se añade es un líquido isotónico, no se producirán cambios en la osmolalidad y no habrá movimiento de agua a través de las membranas, aunque sí aumentará el volumen extracelular.
DISTRIBUCIÓN DEL AGUA CORPORAL
El agua es el componente más abundante del cuerpo y constituye del 45 al 75% de su peso. Esta gran variación depende de la cantidad de tejido adiposo. Mientras que el músculo esquelético tiene más del 75% de agua, el tejido adiposo contiene menos del 10%, por eso el porcentaje de peso corporal representado por agua variará en proporción inversa al contenido de grasa del organismo.
Se considera que el agua corporal total constituye alrededor del 60% del peso corporal en hombres sanos y del 50% en mujeres sanas. Sin embargo, el porcentaje puede ser menor en las personas obesas o mayor en las extraordinariamente delgadas. En ambos sexos el porcentaje de peso corporal representado por agua disminuye con los años, tendencia que puede atribuirse al aumento del tejido adiposo.
Con estas premisas y aunque la distribución del agua es algo más compleja, en la práctica clínica se usa una clasificación simplificada. Por lo común se dice que 2/3 del agua constituyen el agua intracelular y 1/3 el agua extracelular. De este último tercio, la quinta parte está en el plasma y el resto constituye el intersticio (Tabla 2).
REGULACIÓN DEL VOLUMEN CELULAR
El número de osmoles efectivos de cada compartimento es lo que determina su volumen, ya que estas moléculas atraen agua por ósmosis. La osmolalidad del LEC, dependiente de la concentración de la [Na], y la osmolalidad del LIC, dependiente de la concentración de potasio ([K]), son equivalentes, adaptándose las células a los cambios osmóticos. Un aumento brusco de la osmolalidad plasmática saca agua del LIC al LEC y la célula pierde volumen. Si por el contrario la osmolalidad plasmática desciende, entra agua y la célula gana volumen. Cuando el descenso de osmolalidad plasmática es más lento, la célula se adapta sacando osmoles efectivos para disminuir su volumen, proceso que dura unas 24 h y que a las 48 h consigue disminuir el volumen celular. Con ello se modifica la composición celular, dado que se pierden electrolitos (K+ y sus aniones acompañantes), además de solutos orgánicos diversos. Este último mecanismo es esencial para mantener el volumen celular en el sistema nervioso central y, evitar así, el edema o la deshidratación neuronal que condicionan los síntomas neurológicos que acompañan a las disnatremias. Además, la adaptación también explica por qué es necesario corregir los trastornos crónicos lentamente, pues en el caso de la hiponatremia, por ejemplo, la célula no es capaz de ganar los osmolitos orgánicos perdidos rápidamente y esto puede producir una desmielinización osmótica.
MECANISMOS REGULADORES DEL BALANCE DE AGUA
El metabolismo del agua se regula con el objetivo de mantener constante la osmolalidad (en plasma es de 280 a 295 mOsm/kg en condiciones normales), que será igual en el espacio intra y extracelular, manteniendo así la distribución relativa de agua en los distintos compartimentos y el volumen celular.
1. Sensores
Los osmoreceptores situados en las células de los núcleos supraóptico y paraventricular del hipotálamo detectan pequeñas variaciones del 1 al 2% en la osmolalidad plasmática, lo que pone en marcha los mecanismos necesarios para devolverla al valor normal actuando sobre el centro de la sed (que regulará la ingesta de agua) y sobre la liberación de la hormona antidiurética o vasopresina (ADH).
2. Sed
La hipertonicidad es el estímulo más importante para la sed y se produce con un cambio del 2 al 3% de la osmolalidad, que suele situarse en 290 a 295 mOsm/kg de agua. La hipovolemia, hipotensión y angiotensina II también estimulan la sed. Hay que recordar que existen otros factores independientes del balance de agua que pueden favorecer una alta ingesta de líquido, como la sequedad de boca, los hábitos personales, condiciones psíquicas y aspectos culturales.
3. ADH
La ADH [6] tiene un papel determinante en la concentración de la orina. Es un péptido de nueve aminoácidos sintetizado y secretado en el hipotálamo, tiene una vida media de 15 a 20 minutos y es metabolizado en el hígado y el riñón. En caso de hiperosmolalidad, su secreción disminuye la eliminación renal de agua. En caso de hiposmolalidad, cesa su liberación y aumenta la eliminación renal de agua libre.
La ADH también es estimulada por otros factores: disminución del volumen eficaz circulante (VEC), náuseas, estrés, dolor, temperatura, fármacos y mediadores hormonales. Este hecho explica la aparición de hiponatremia en enfermedades que cursan con una disminución de la volemia real (hiponatremia hipovolémica) o con hipervolemia, pero en el seno de un volumen circulante eficaz disminuido (como ocurre en la insuficiencia cardiaca o en la hepatopatía crónica descompensada). Se precisa un descenso del VEC del 7% en adultos para aumentar la concentración de ADH en plasma; y hasta de un 10 al 15% para doblarla. Es necesario un descenso mayor para que el estímulo del barorreceptor que estimula la ADH supere la inhibición que induce la hipotonicidad.
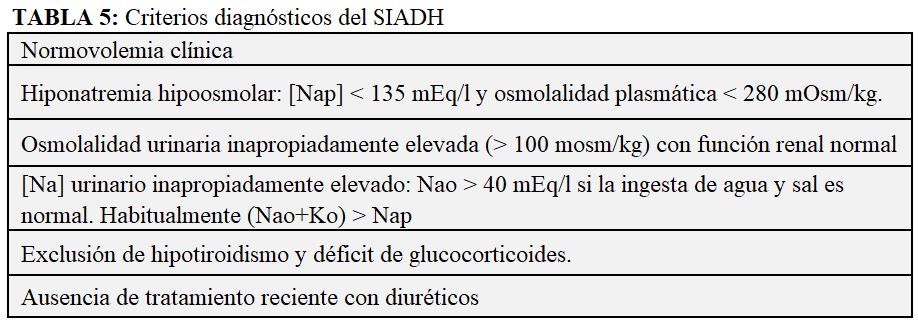
Para realizar su acción, la ADH se une a receptores específicos en la membrana basolateral de las células principales de los túbulos colectores corticales y medulares (V2) (Figura 1). Su unión activa las proteínas G, que inician una cascada (cAMP, PKA) que da como resultado: 1) en la membrana apical, la fosforilación y acumulación de AQP2 y el transportador de urea A1 (UT-A1); 2) en la membrana basolateral, de AQP3 y UT-A3. Gracias a este proceso, en las células principales aumenta la permeabilidad al agua y también a la urea, que juega un papel fundamental en la reabsorción, al aumentar la osmolalidad del líquido intersticial medular [7].
El efecto de la ADH conlleva una disminución del flujo urinario y un aumento de la osmolalidad urinaria. De este modo, dependiendo de su acción, la osmolalidad urinaria oscilará entre 50 (no hay ADH) a 1200 mOsm/l (máxima ADH). Si un adulto sano elimina 900 mOsm de solutos al día, el volumen de orina puede variar entre 18 l (máxima dilución: 900/50) a 0,75 l (máxima concentración: 900/1200).
4. Excreción renal de agua
Para excretar agua, es decir, producir una orina diluida, deben darse tres condiciones:
1. Que llegue volumen suficiente al túbulo distal. Esto depende del filtrado glomerular (FG) y del volumen reabsorbido en túbulo proximal. En situaciones de bajo VEC disminuye el FG y aumenta la reabsorción, por lo que llega un escaso volumen al túbulo distal, lo que facilita la aparición de hiponatremia incluso en ausencia de ADH.
2. Que se haya generado un volumen libre de electrolitos gracias a la reabsorción de Na+ y Cl- en el asa ascendente gruesa de Henle y en el túbulo distal, segmentos de la nefrona que son impermeables al agua.
3. Que no exista ADH.
Algunos autores añaden la condición de que haya una reabsorción de agua independiente de ADH, llamada permeabilidad residual de agua, cuyo mecanismo no se ha esclarecido, pero dependería de la diferencia de presión osmótica entre la luz y el intersticio y de la contracción de la pelvis renal [2].
Si, por el contrario, lo que se necesita es reabsorber agua, el riñón debe concentrar la orina y para ello debe:
- Conservar toda el agua, insertando AQP2 en respuesta al estímulo de la ADH.
- Excretar la carga filtrada de Na+ y Cl-.
- Estar intacto el mecanismo contracorriente y la hipertonicidad medular renal.
CUANTIFICACION DE LA EXCRECIÓN RENAL DE AGUA
Se considera que la orina tiene dos componentes: el osmolar, que es el volumen que se necesita para eliminar solutos con una concentración igual a la sérica, y el agua libre, que es el volumen de agua que hace que la orina sea hiper/iso/hipotónica.
La osmolaridad plasmática es la concentración molar del conjunto de moléculas osmóticamente activas en un litro de plasma. La osmolalidad es lo mismo, pero referido a 1 kg de agua. En el plasma, estos conceptos son diferentes, debido a la presencia de moléculas grandes (proteínas y lípidos sobre todo), que son poco activas osmóticamente pero ocupan el 7% del litro y hacen que la cantidad de agua disminuya al 93%. En el laboratorio, los osmómetros miden la osmolalidad, puesto que emplean el descenso crioscópico del plasma para su determinación. Por tanto, si se quiere calcular la osmolaridad, hay que multiplicar la osmolalidad medida por 0,93. En la práctica, ambos términos se utilizan de forma indistinta, puesto que la diferencia suele ser pequeña, pero son conceptos diferentes.
ACLARAMIENTO DE AGUA LIBRE
Para medir la cantidad de agua libre de solutos que el riñón puede excretar por unidad de tiempo se utiliza el aclaramiento de agua libre (CH2O), donde V es el volumen de orina. La orina es hipotónica si la osmolalidad urinaria es menor a la plasmática, isotónica si es igual e hipertónica si la urinaria es mayor.
CH2O = V [1 - osm (o) / osm (p)] (Calculadora SEN)
Ej. Osm (p) 280 mOsm/kg, osm (o) 140 mOsm/kg : V = 8 l. El CH2O es 4 l/día. Esta eliminación es la adecuada tras una sobrecarga de agua e inapropiada si se debe a un déficit de ADH o a una resistencia a su efecto.
ACLARAMIENTO DE AGUA LIBRE DE ELECTROLITOS (CH2Oe)
Este concepto se basa en que moléculas como la urea, que constituyen una parte importante de la osmolalidad urinaria, no son relevantes para la eliminación de agua porque no generan gradiente osmótico. Se calcula de la siguiente manera:
CH2Oe = V [1 - ([Na] urinario + [K] urinario / [Na] plasmático) (Calculadora SEN)
El CH2Oe es especialmente útil en casos de síndrome de secreción inadecuada de hormona antidiurética (SIADH) o natriuresis cerebral, cuando la osmolalidad urinaria puede confundir. A este aspecto técnico se añade el práctico: si [Na + K]o [Na]p, se está reabsorbiendo agua libre.
Ej. Paciente con ligera hipovolemia, osm (p) 280 mOsm/kg, osm (o) 560 mOsm/kg, V = 1 l. El CH20 es -1 l, es decir, no hay pérdida de agua libre. Sin embargo, sus iones son: [Na]p 142 mEq/l, [Na]o 6 mEq/l, [K]o 30 mEq/l; luego el CH2Oe es 0,7 l, lo que quiere decir que realmente esta orina conduce a una pérdida de agua libre y a una mayor tendencia a la hipernatremia.
HIPONATREMIA
La hiponatremia ([Na] < 135 mEq/l) es una situación bastante frecuente en pacientes hospitalizados, con una incidencia y prevalencia en adultos del 1 y 2,5%, respectivamente, siendo algo menor en niños, y hasta del 15-30% de los hospitalizados, dependiendo de la patología clínica. Es un factor de mal pronóstico y un factor predictivo independiente de mortalidad en cualquier patología, como insuficiencia cardiaca o hepatopatía avanzada, entre otros.
Hay que enfatizar que hiponatremia no es un diagnóstico, sino el resultado de que existe una ganancia de agua libre por una dificultad para excretarla a causa de una serie de patologías. Así, desde el punto de vista fisiopatológico, para el desarrollo de hiponatremia con hiposmolalidad se precisa de un aporte de agua libre, ya sea oral o parenteral, y de una capacidad renal limitada para excretarla. La hiponatremia puede ser la primera manifestación de una patología grave, por lo que siempre hay que buscar la etiología.
La limitación de la capacidad renal de excreción puede tener varias causas: a) disminución del filtrado glomerular; b) aumento de la reabsorción proximal (disminuyendo en ambos casos el aporte de líquido a los segmentos dilutores de la nefrona) [8]; c) reducción del transporte de Na/Cl en el asa de Henle o en el túbulo contorneado distal (limita la formación de un líquido tubular diluido); d) un estímulo en la producción de ADH (lo más frecuente), que hace permeable el túbulo colector y no permite eliminar una orina diluida en situaciones de hiposmolalidad sérica.
Además de estas bases fisiopatológicas, resaltar que desde la perspectiva clínica hay dos elementos esenciales: es necesario identificar situaciones que precisan tratamiento urgente y llevar a cabo un tratamiento adecuado para evitar las complicaciones que implica una corrección excesiva.
ETIOLOGÍA
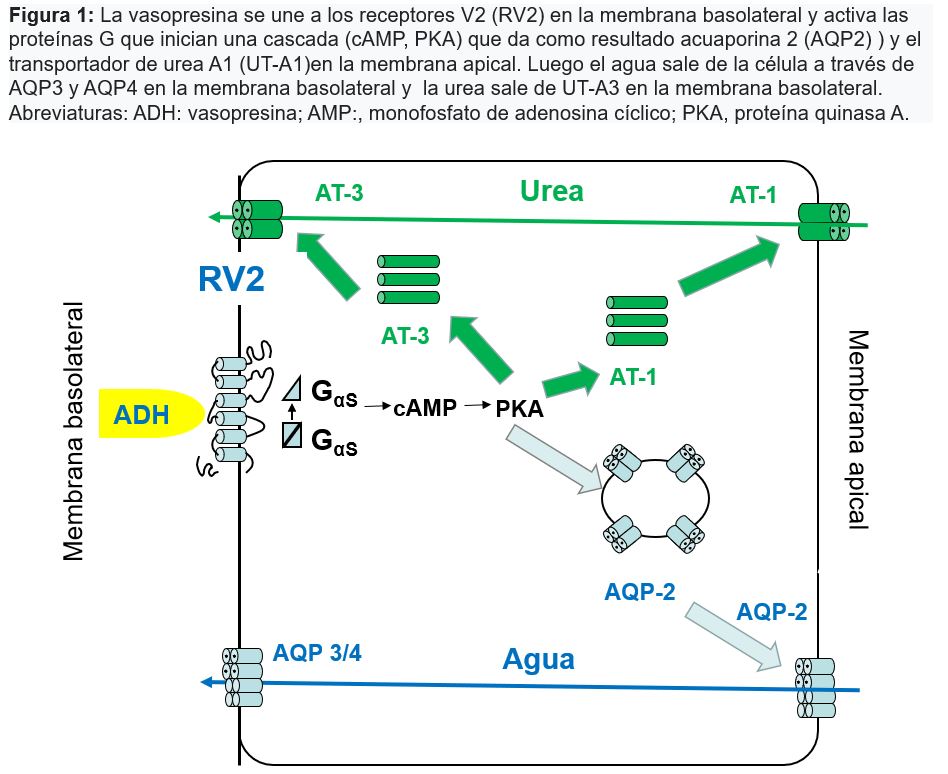
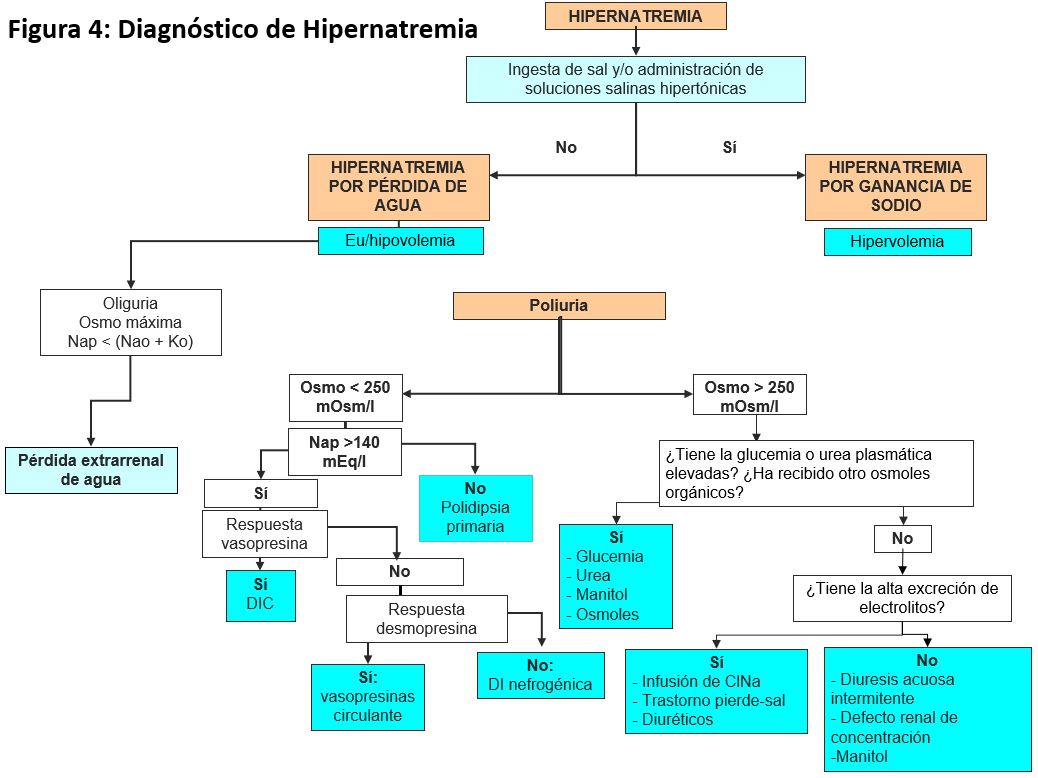
La (Tabla 3) y la (Figura 2) recogen las causas habituales de hiponatremia.
1. Hiponatremia con osmolalidad plasmática aumentada o normal
Hiponatremia e hiposmolalidad suelen coexistir, pero no siempre. La hiponatremia con osmolalidad plasmática elevada se produce cuando se añade al espacio vascular una sustancia que no entra en las células, por ejemplo, glucosa o manitol. Se calcula que, por cada incremento de 100 mg de glucemia por encima de 100 mg/dl, el sodio plasmático disminuye 1,6 mg/dl (Calculadora SEN). Otras sustancias que causan este efecto son glicina y maltosa.
La osmolalidad plasmática puede permanecer normal en hiperlipemias o hiperproteinemias graves, donde una mayor proporción relativa del volumen plasmático es ocupada por los lípidos o las proteínas.
2. Hiponatremia con osmolalidad plasmática disminuida: hipervolemia
En esta situación existe un aumento del sodio corporal total, pero con mayor elevación del agua corporal total, como ocurre en la insuficiencia cardiaca, cirrosis y enfermedades renales. La retención de agua e hiponatremia pueden aparecer cuando el FG es muy bajo, aunque la excreción de agua libre suele mantenerse hasta que la enfermedad renal se encuentra muy avanzada, de modo que aparece hiponatremia cuando también hay un aumento del aporte de agua [9].
a) Hipovolemia
La hipovolemia real o efectiva desencadena una secreción de ADH volumen-dependiente para aumentar la perfusión y restaurar la normovolemia. Se observa en general una orina concentrada con una [Na] urinaria variable según el origen de la pérdida. Se resaltan dos causas de este grupo por su frecuencia y peculiaridad.
Diuréticos
El 73% de las hiponatremias por diuréticos [10] [11], según algunas revisiones, se deben solo a tiazidas, el 20% a tiazidas en combinación con fármacos ahorradores de potasio y el 8% a furosemida. La hiponatremia puede aparecer en pacientes que reciben tiazidas y se han descrito unos criterios para decir si es inducida por estas:
- Euvolemia por valoración clínica
- Mejoría tras el cese del tratamiento con tiazidas (en 3 mEq/l en un día o 5 mEq/l en dos días)
- Sin mejoría significativa antes de dejar las tiazidas (a menos que se trate específicamente, por ejemplo, con solución salina al 3%, urea o un vaptán)
- Sin recurrencia después de la resolución en ausencia de una tiazida
A la vista de estos criterios, solo puede establecerse el diagnóstico retrospectivamente [12].
La hiponatremia puede aparecer en menos de dos semanas a meses o años tras el inicio, según distintos estudios, por lo que es difícil hacer una recomendación sobre cuándo realizar un control electrolítico tras el inicio del fármaco. Se trata sobre todo de mujeres mayores de 75 años con función renal normal que reciben otros tratamientos que pueden provocar hiponatremia. Aunque en este tipo de hiponatremia siempre se ha supuesto que existía un aumento de ADH, esta suele ser normal o baja. Fisiopatológicamente existe evidencia de ingesta excesiva de líquidos, pérdida e inactivación osmótica de cationes y alteración en la excreción de agua, por lo que se pueden encontrar diferentes mecanismos según los pacientes y ello explica la variabilidad en la presentación clínica [13]. En la actualidad se sabe que la predisposición genética es un factor y que están implicadas variantes en el transportador de prostaglandina E2 (PGT, codificado por el gen SLCOA1), que aumentarían la permeabilidad al agua. Por tanto, la hipótesis es que hay un efecto combinado entre la acción de la tiazida, que impide la generación de agua libre, y un aumento de la permeabilidad al agua de origen genético. La menor capacidad de excretar agua libre se debe a múltiples mecanismos: menor filtrado con menor flujo distal, menor carga de solutos (urea), inhibición de NCC y aumento de permeabilidad al agua (en comparación con la permeabilidad al agua residual), mediada por ADH o prostaglandinas y tal vez por las propias tiazidas. Su conjunción induce hiponatremia, que puede ser grave.
Síndrome pierde sal
Se trata de una hiponatremia hipovolémica de origen neurológico que se produce en pacientes con una lesión cerebral, en los que una natriuresis importante provoca un descenso en el VEC y estimula la liberación de ADH, lo que finalmente genera una hiponatremia hipoosmolar [14] [15] [16]. Su diagnóstico diferencial con el SIADH ha mejorado analizando la excreción fraccionada de ácido úrico, además de la respuesta a la expansión con suero salino. En este síndrome, la excreción fraccionada de ácido úrico es mayor del 11% y no se corrige tras la normalización de la natremia. Es importante distinguir el SIADH de este síndrome, ya que el enfoque terapéutico es distinto: mientras el síndrome pierde-sal cerebral se trata con suero salino para rellenar el VEC, en el SIADH debe de restringirse el aporte de líquidos.
b) Normovolemia
SIADH
Es una de las causas más frecuentes de hiponatremia (se estima que del 20-35% de hiponatremias hospitalarias) [17] [18]. Se caracteriza por una liberación de ADH no debida a los estímulos normales (hiperosmolalidad o hipovolemia), que impide la excreción de agua a la vez que la eliminación de sodio es normal, lo que produce una hiponatremia hipoosmolar normovolémica.
Las causas del SIADH son múltiples y se resumen en la (Tabla 4). Las más frecuentes son los fármacos, especialmente los inhibidores de la recaptación de la serotonina, y las neoplasias, sobre todo pulmonares. La hiponatremia en pacientes con cáncer se asocia con una supervivencia inferior, una menor respuesta a la quimioterapia, peor estado general, mayor hospitalización y un coste sanitario superior. Su frecuencia es variable, depende del rango que se utilice para definirla y del grupo de pacientes estudiado, pero distintos trabajos la sitúan entre el 4-47%.
En el paciente oncológico, las causas más frecuentes de hiponatremia son el SIADH y la depleción de volumen, aunque son factores importantes el aporte excesivo de líquidos (en la premedicación) y el estímulo de ADH por otros motivos, como el dolor o las náuseas, motivos que no hay que olvidar en el diagnóstico diferencial. Puede haber una producción ectópica de ADH por parte del tumor, siendo el más frecuente el tumor pulmonar de células pequeñas, asociándose su aparición con múltiples tipos. La segunda causa de SIADH son los fármacos, habiendo múltiples capaces de inducirlo, aunque en muchos el mecanismo no está aclarado [19] [20].
Se considera que el SIADH por activación del gen V2 se produce a causa de una rara mutación ligada al cromosoma X, por lo que la mayoría de los casos acontece en varones, si bien se han descrito también en mujeres con episodios de hiponatremia, sintomáticas o asintomáticas. Aunque la historia familiar es importante, las manifestaciones pueden variar o aparecen en una variante de novo [21].
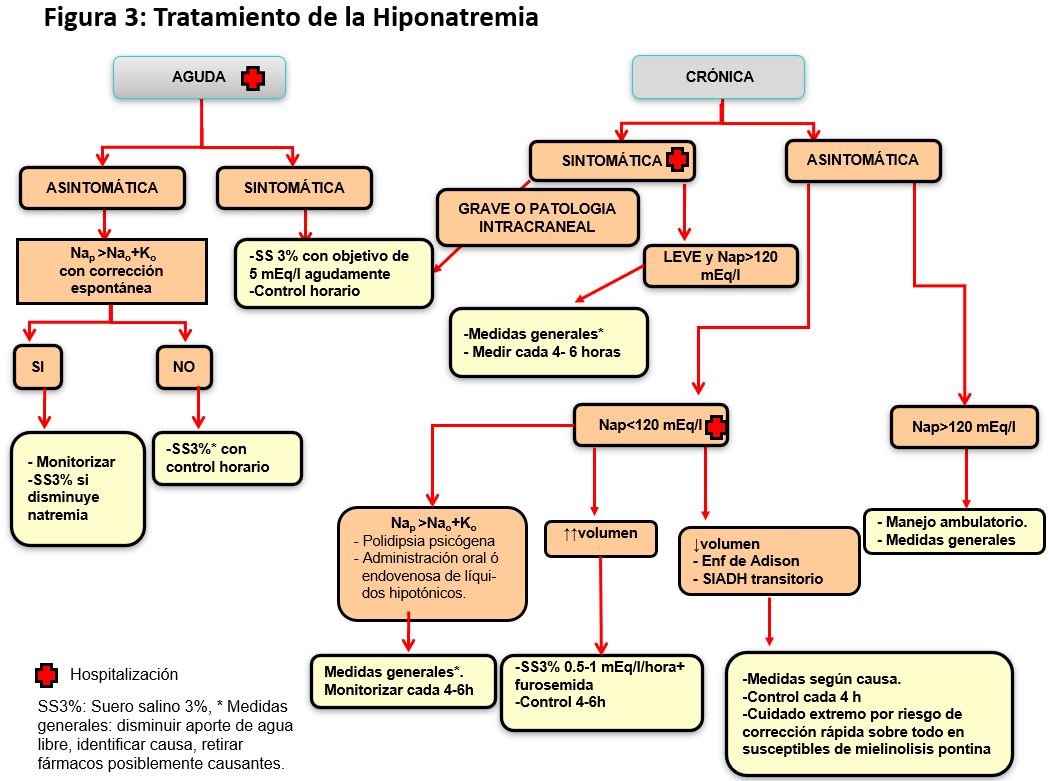
El SIADH es un diagnóstico de exclusión y precisa confirmar una situación de normovolemia. No puede establecerse un diagnóstico de SIADH en situaciones de hipovolemia real o hipovolemia efectiva hasta que no se normalice la volemia y, por tanto, el aporte de agua y solutos a segmentos distales de la nefrona. Una vez confirmada la normovolemia, también deben excluirse alteraciones endocrinas (hipotiroidismo y déficit de glucocorticoides, que incluye la enfermedad de Addison y el déficit de ACTH en los pacientes neuroquirúrgicos), así como las causas fisiológicas de liberación no osmótica de ADH, ya comentadas y muy importantes en pacientes quirúrgicos (ansiedad, dolor, náuseas y vómitos). Los criterios diagnósticos se detallan en la (Tabla 5). Reseñar que la osmolalidad urinaria no tiene por qué ser superior a la plasmática, sino superior a la máxima capacidad de dilución urinaria (< 100 mOsm/kg).
La comparación entre las concentraciones de sodio y potasio en orina y sodio en plasma resulta una prueba sencilla y útil tanto para el diagnóstico como, sobre todo, para evaluar la respuesta al tratamiento. En el SIADH, la suma de sodio y potasio en orina suele ser mayor que el sodio en plasma.
Reset osmostat
La hiponatremia por reset osmostat constituye actualmente una patología en la que el umbral de osmolalidad plasmática normal está alterado: el punto de ajuste para la liberación de vasopresina se reduce, lo que significa que hay vasopresina cuando la osmolalidad plasmática es más baja de lo normal (< 280 mOsm/kg) y debería estar suprimida. Clásicamente se conoce como SIADH tipo C y su etiología es desconocida, aunque se ha asociado a tuberculosis, alcoholismo, embarazo, polidipsia psicógena, psicosis y carcinomas, entre otros. Se sospecha en pacientes que tienen hiponatremia asintomática, de moderada a leve, que es estable a pesar de la variación en la ingesta de sodio y agua y que no responde al tratamiento.
Intentar corregir la concentración de sodio aumenta la osmolalidad plasmática, lo que desencadena la secreción de vasopresina. Puede persistir largos períodos y a veces se resuelve espontáneamente o tras la corrección del proceso subyacente. La fracción de excreción de úrico normal (4-11%) apoya el diagnóstico. Sin embargo, el diagnóstico solo se puede hacer de manera definitiva mediante la realización de una prueba de carga de agua, que debe realizarse con extrema cautela, dado que puede empeorar la hiponatremia. Consiste en una carga de agua oral (10-15 ml/kg) para suprimir la secreción de vasopresina y, si hay reset, los pacientes excretan más del 80% de la carga de agua en 4 h [22].
Polidipsia
En estos sujetos la capacidad de excretar agua es normal, apareciendo hiponatremias importantes si ingieren más de 10-15 l/día o si la ingesta es muy rápida [23]. Suele darse en pacientes psiquiátricos, a veces con ingestas más bajas si la medicación antipsicótica interfiere en la capacidad renal de excretar agua libre.
Otro grupo susceptible lo componen las personas malnutridas o los bebedores de cerveza, en los que hay una ingesta importante de líquido hipotónico con un aporte de solutos insuficiente que limita la capacidad de excretar agua libre. Una dieta normal resulta en la excreción renal diaria de 600-900 mOsm de solutos. Si por malnutrición o falta de aporte se limitan los solutos excretables a 200 mOsm/día, estos se tienen que excretar como mucho en 4 l de agua (la máxima capacidad dilutora renal es de 50 mOsm/l). Ingestas o aportes superiores se traducirán inevitablemente en retención de agua libre, ya que no habrá osmoles suficientes con los que eliminar ese aporte de agua.
Consumo de éxtasis
Las fenetilaminas sintéticas se encuentran entre las drogas recreativas más consumidas y cada vez se comunican más casos. El mecanismo por el que inducen hiponatremia es un aumento de la secreción de ADH (por su relación con un estímulo serotoninérgico), un aumento de la ingesta de agua por polidipsia y la sudoración excesiva, que puede inducir pérdida de sodio por el sudor. Hay casos graves en los que la hiponatremia puede inducir edema cerebral y la muerte [24].
Hiponatremia asociada al ejercicio físico
Se ha descrito mucho últimamente la aparición de hiponatremia asociada al ejercicio, aunque su frecuencia no está bien establecida y es aun más raro que sea sintomática [25] [26]. La explicación fisiopatológica radica en una ingesta elevada de líquidos unida a una ADH estimulada, que impide la eliminación del exceso de la carga de agua por el riñón. Los factores de riesgo son: alta ingesta de agua o de bebidas hipotónicas, ganancia de peso durante el ejercicio, inexperiencia o entrenamiento inadecuado, duración del ejercicio > 4 h, IMC alto o bajo, bajo ritmo y acceso fácil a la bebida. Se ha visto que es más frecuente en mujeres y es dudosa su asociación con la ingesta de antiinflamatorios no esteroideos. Se han desarrollado recomendaciones y guías para una reposición de líquido adecuada en los deportistas que evite su aparición.
Hiponatremia postquirúrgica
La cirugía produce una situación transitoria de antidiuresis y antiacuaresis secundaria a múltiples factores, siendo los más relevantes: 1) la liberación no osmótica de ADH, secundaria al dolor, náuseas o ansiedad generada por el proceso quirúrgico; y 2) el fenómeno de desalinación resultante de la activación de los circuitos natriuréticos por la expansión resultante de la administración de grandes volúmenes de suero, que se traduce en la excreción de una orina hipertónica y un balance positivo de agua [27]. A esta situación de antidiuresis, en el período postoperatorio se suma la administración habitual de grandes cantidades de soluciones hipotónicas intravenosas, lo cual aumenta el riesgo de desarrollo de hiponatremia aguda y potencialmente grave.
Los colectivos de mayor riesgo son las mujeres menstruantes, los ancianos, los pacientes malnutridos o con importante comorbilidad y los sometidos a neurocirugía. La prevención se basa en evitar la administración de fluidos hipotónicos, en dar solo la cantidad suficiente de suero salino para mantener la estabilidad hemodinámica y en monitorizar los electrolitos en sangre y en orina en la población en riesgo.
CLÍNICA
La mayoría de los pacientes hiponatrémicos están asintomáticos y la aparición de los síntomas, fundamentalmente neurológicos por el edema cerebral, depende de la gravedad y de la velocidad de instauración de la hiponatremia. A estos síntomas se añaden los de la enfermedad causal. Los pacientes con más riesgo de edema cerebral se recogen en la (Tabla 6).
Clásicamente se considera que los síntomas están en relación con la natremia (Tabla 7), pero se sabe que con natremias de 128 mEq/l pueden aparecer incluso convulsiones si la hiponatremia es aguda, especialmente en el postoperatorio, de modo que la velocidad de instauración condiciona más la sintomatología que el grado de descenso. Es importante identificar si existen datos clínicos sugerentes de encefalopatía hiponatrémica, porque constituye una emergencia médica y debe tratarse con suero salino hipertónico, aunque puede ser difícil saber si los síntomas se deben a la hiponatremia o a la enfermedad de base del paciente.
La corrección inapropiadamente rápida de una hiponatremia crónica puede llevar a la mielinolisis pontina o desmielinización osmótica, complicación muy grave, consecuencia de la deshidratación celular secundaria al nuevo ambiente osmolar, más hipertónico respecto al intracelular cerebral que no ha tenido tiempo de captar nuevos osmoles orgánicos. A los 2 ó 3 días pueden aparecer cambios en el comportamiento, parálisis de pares craneales, tetraparesia progresiva subaguda, parálisis pseudobulbar, ataxia, movimientos extrapiramidales, convulsiones, parálisis respiratoria, alteraciones de la conciencia y, en muchos casos, la muerte. Por ello resulta crucial la corrección controlada de las hiponatremias crónicas. La resonancia magnética (RM) en T2 muestra imágenes hiperintensas pontinas y extrapontinas, que pueden no aparecer hasta dos semanas después del inicio de los síntomas, por lo que una RM normal no excluye su diagnóstico. Los pacientes de alto riesgo de mielinolisis se describen en la (Tabla 6).
Además de estos síntomas clínicos, es fundamental recordar que la hiponatremia se ha asociado a un aumento de la mortalidad, la estancia hospitalaria, las caídas, las fracturas óseas y a un deterioro de la calidad de vida [28] [29].
DIAGNÓSTICO
La eliminación urinaria de sodio, la osmolalidad en orina y la estimación del agua corporal total y de la volemia intravascular son elementos esenciales para conocer el mecanismo etiológico de la hiponatremia (Figura 1). Para su diagnóstico es aconsejable que se realicen a la vez las determinaciones de sodio, potasio y osmolalidad en sangre y orina, así como la evaluación de la volemia. También conviene seguir siempre un esquema diagnóstico que obligue a pensar en todas las posibilidades bajo un criterio fisiopatológico.
1º Determinar si existe un estado hipoosmolar. Para ello hay que medir la osmolalidad plasmática, aunque con los datos clínicos y la glucemia es suficiente en la mayoría de los casos.
2º Determinar si se está excretando una orina diluida o no: CH2Oe. Si hay ganancia de agua libre: respuesta patológica que implica que existe un exceso de ADH. Si hay pérdida de agua libre: respuesta normal.
3º Determinar clínicamente el VEC y el volumen del LEC.
• VEC disminuido: 1) LEC contraído: pérdidas extrarrenales o renales; 2) LEC normal o aumentado: síndromes edematosos.
• VEC normal: sospechar SIADH, descartar hipotirodismo.
• VEC aumentado: insuficiencia cardiaca, hepatopatía, síndrome nefrótico...
TRATAMIENTO
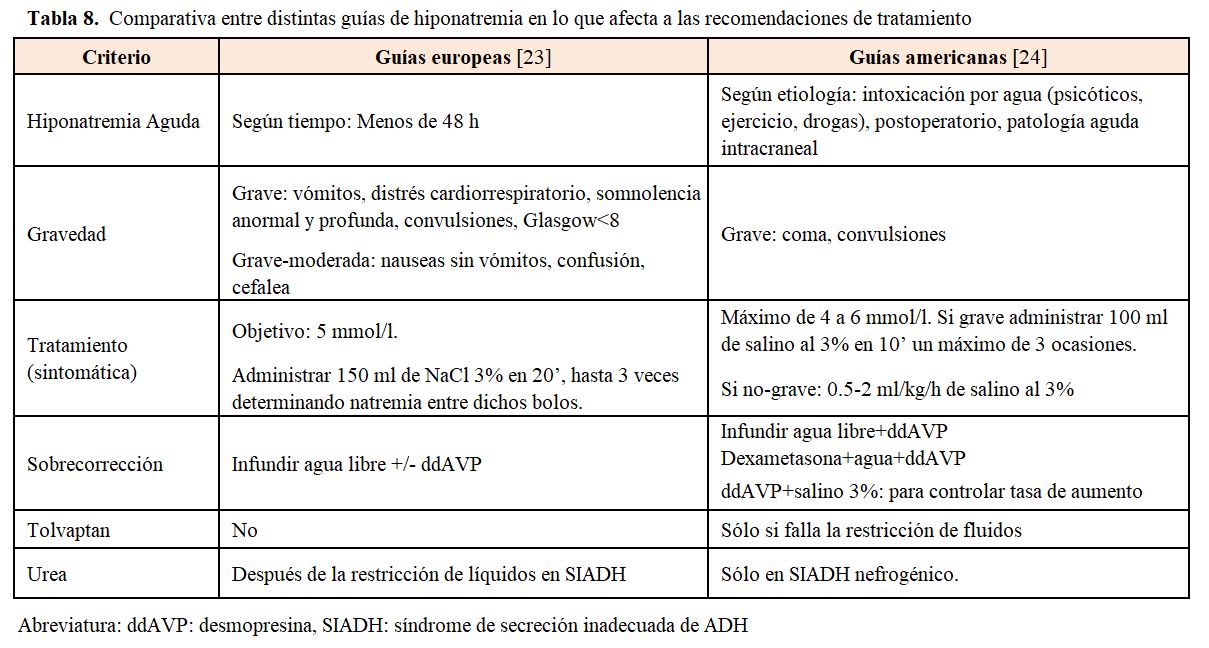
Es fundamental identificar las situaciones que por su gravedad precisan un tratamiento rápido, pero también establecer los límites de corrección para evitar las complicaciones que pueden derivar de una corrección excesivamente rápida. En la (Tabla 8) se pueden observar las diferencias que existen entre las dos principales guías de práctica clínica en el tratamiento de la hiponatremia [30] [31]. Las diferencias entre ambas han generado gran controversia y distintas posibilidades de tratamiento [32] [33].
Factores relevantes antes de iniciar el tratamiento
En el tratamiento de la hiponatremia es fundamental tener en cuenta las siguientes premisas básicas:
- ¿La hiponatremia se acompaña de sintomatología neurológica? Si es así, se trata de una emergencia médica y debe tratarse precozmente con suero salino hipertónico.
- ¿La hiponatremia es aguda o crónica? Es importante para establecer la velocidad de corrección, ya que en las hiponatremias crónicas hay mayor riesgo de desmielinización osmótica si la corrección es demasiado rápida.
Aunque el criterio de aguda vs crónica suele estar basado en el tiempo de duración de la hiponatremia (mayor o menor a las 48 h), puede ser difícil distinguirlas o tratarse de una hiponatremia crónica agudizada. Así, resulta útil valorar la causa probable de la hiponatremia, además del tiempo, que es el criterio diferenciador fundamental que se utiliza en las guías americanas. Si no está claro el tiempo que ha tardado en generarse, hay que considerar que se trata de una hiponatremia crónica y la corrección debe hacerse lentamente para permitir al encéfalo recuperar los osmoles que se han perdido con anterioridad.
- ¿Existe riesgo de una corrección rápida? Las hiponatremias con más posibilidades de corrección rápida son las causadas por depleción de volumen, estímulos no osmóticos de la ADH (dolor, náuseas), déficit de cortisol, hipoxemia, potomanía, desnutrición o fármacos (desmopresina, inhibidores de la recaptación de serotonina, tiazidas). En estas situaciones, una vez corregida la causa (la hipovolemia, el déficit de cortisol o retirado el fármaco), se produce una diuresis acuosa y los pacientes tienen una orina con dilución máxima, lo que lleva a una sobrecorrección que es necesario prevenir, sobre todo en las hiponatremias crónicas y con más riesgo de mielinolisis.
Por estas razones, es fundamental mantener una vigilancia frecuente de la concentración plasmática de sodio y de la diuresis. La fórmula más habitual, Adrogue Madias, puede ser útil en momentos iniciales, pero puede inducir una corrección mayor de la calculada [34] [35].
Tratamiento de la hiponatremia
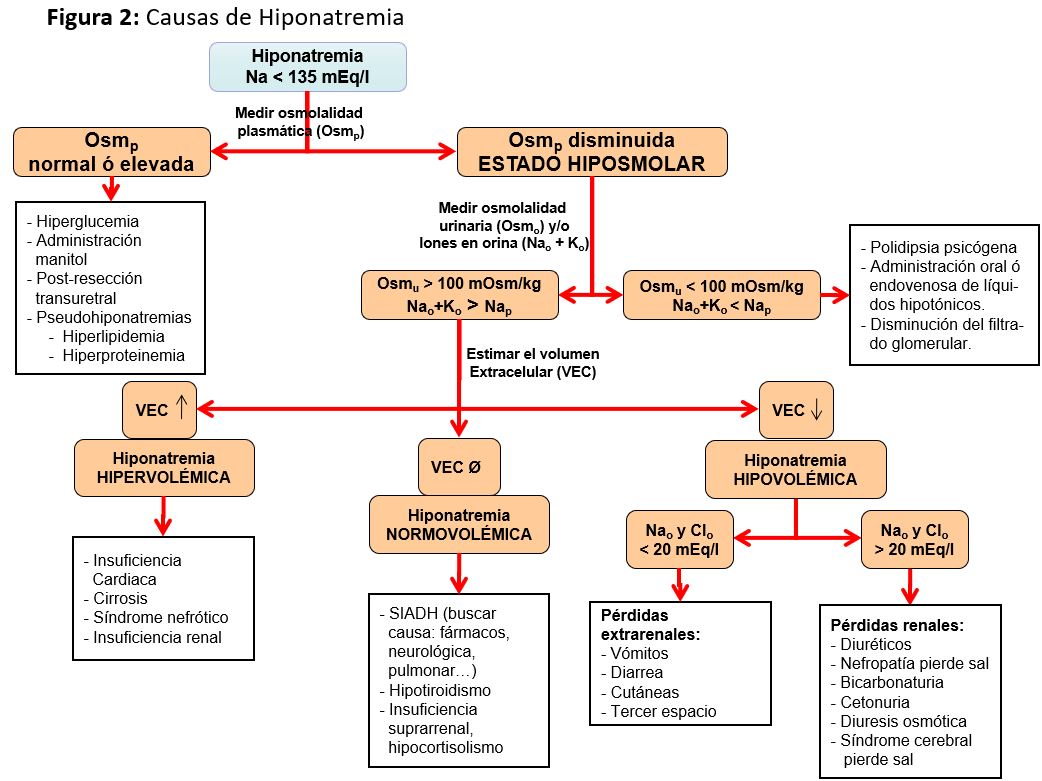
Ante una hiponatremia se deben evitar los fluidos hipotónicos y, en función de los síntomas, administrar el tratamiento más adecuado (Figura 3):
- Hiponatremia sintomática. Siempre hay que utilizar soluciones hipertónicas y ambas guías coinciden en utilizar NaCl al 3% en bolo en formas de presentación de mayor gravedad aunque con diferentes pautas. El objetivo es un aumento rápido de la natremia, entre 4 a 6 mEq/l, para revertir el edema cerebral, sin que sea necesario alcanzar concentraciones normales. Las tasas de infusión podrían ser de 4-6 ml/kg/h en casos muy graves y de 1-2 ml/kg/h en menos graves. Si coexiste una situación edematosa o si la osmolalidad urinaria es > 350 mOsm/kg, clásicamente se ha considerado que pueden asociarse diuréticos del asa (furosemida 1 mg/kg/4-6 h), aunque un estudio reciente, randomizado y controlado, muestra que no se consigue mayor mejoría y sí más eventos adversos [36]. En general, el tratamiento agudo de una hiponatremia sintomática grave debe interrumpirse cuando se resuelven los síntomas y se alcanza una corrección total de 5 mEq/l.
Hay que tener en cuenta estas consideraciones:
• Si tras aumentar la natremia 5 mEq/l persiste la sintomatología neurológica, se debe sospechar otra causa subyacente de los síntomas.
• Poco después de una convulsión, la natremia obtenida de una vena periférica puede ser superior a la real (hasta en 10 mEql/l), ya que las células musculares habrán aumentado temporalmente su osmolalidad intracelular, captando agua del espacio extracelular.
• Si la hiponatremia es aguda, la corrección puede ser rápida y llegar hasta la normalización.
• Recordar que el ClK aportado tiene un efecto similar al ClNa, debido a que, cuando existe hipopotasemia, salen iones K+ de la célula y se intercambian por Na+. Cuando se remplaza el K+, se produce dicho intercambio de nuevo, saliendo Na+ de la célula al LEC.
• Si la hiponatremia se considera crónica, la corrección máxima debe ser cuidadosa. Las guías americanas valoran la corrección en función del riesgo de mielinolisis; así, el primer día, en pacientes de alto riesgo de mielinolisis, se aconseja una corrección máxima de 8 mEq/l/día y hasta 12 mEq/l en pacientes de menor riesgo, sin sobrepasar los 18 mEq/l en 48 h. En cambio, las guías europeas no separan por riesgo sino que recomiendan evitar un aumento máximo de la natremia, de 10 mEq/l durante las primeras 24 h y de 8 mmol/l durante periodos de 24 h a partir de entonces.
• Si la corrección es mayor a la esperada, ambas guías coinciden en que deben iniciarse medidas para evitar la elevación, basándose en estudios animales en los que disminuir la natremia puede prevenir la mielinolisis [37]. Esto se logra deteniendo la infusión de suero hipertónico e iniciando infusiones de 3 ml/kg de glucosado al 5%, con o sin 2-4 mcg de desmopresina. También en las guías americanas se propone combinar desmopresina de forma preventiva en los pacientes con riesgo de corrección rápida con hiponatremia crónica.
Insistir en que de estas recomendaciones se deduce que la concentración plasmática de sodio y los iones en orina deben vigilarse a intervalos frecuentes, preferiblemente cada 2 h o al menos cada 4 h, durante las fases activas del tratamiento inicial, con el objeto de mantener la corrección dentro de esos límites. La segunda conclusión es que el sodio deseado no es el normal, sino el que nos lleve a una corrección segura.
- Hiponatremia asintomática. No constituye una urgencia terapéutica y el tratamiento debe efectuarse en función de la etiología de la hiponatremia. Además, hay que tener en cuenta que el ritmo de corrección debe ser muy lento, para dar tiempo a que el cerebro se adapte al aumento de la osmolalidad y evitar la mielinolisis pontina, siguiendo las medidas ya comentadas.
Además de estos criterios, existen tratamientos específicos dependiendo de la causa de la hiponatremia.
- Hiponatremia hipovolémica. El objetivo es restaurar la volemia con suero salino isotónico al 0,9%.
- Hiponatremia hipervolémica. En caso de disminución del VEC e hipervolemia (cardiopatía, síndrome nefrótico, cirrosis), está indicada la restricción de agua a una cantidad inferior a la de las pérdidas insensibles más la diuresis. Debe valorarse en cada caso la adición de un diurético de asa, espironolactona y/o inhibidores de la enzima convertidora de la angiotensina y, de forma muy controlada, puede ser útil el tratamiento puntual con bolos de suero salino hipertónico. En pacientes cirróticos, la infusión de albúmina se ha asociado con la mejoría de la hiponatremia y se reserva el suero hipertónico para casos muy graves o sintomáticos.
Por último, los vaptanes pueden ser eficaces, teniendo en cuenta que en España no está autorizada esta indicación de uso. Hay que resaltar que no se han mostrado eficaces en cirróticos, sin haber mostrado mejoría en supervivencia u otras complicaciones, además de la preocupación por su posible hepatotoxicidad, de forma que su uso no se recomienda de forma generalizada [38].
- Hiponatremia euvolémica. Habitualmente se produce por SIADH, cuyo tratamiento es el de la causa que lo haya originado. En caso de no corregirse, el tratamiento crónico se basa en la restricción de líquidos. Debe recordarse que: 1) la restricción afecta a todos los líquidos y no solamente al agua; 2) el grado de restricción depende de la diuresis más las pérdidas insensibles; 3) suelen ser necesarios varios días antes de que se modifique la osmolalidad plasmática; y 4) no debe restringirse el sodio. Como puntos prácticos, no olvidar que deben suspenderse siempre todos aquellos fármacos que puedan asociarse a SIADH (Tabla 4) y que, además de aportar sal, el aporte de proteínas mediante suplementos hiperproteicos también induce un aumento de la eliminación de urea en orina, lo cual puede ser útil.
El tratamiento inicial, por tanto, es la restricción hídrica y el aumento del aporte de solutos (dieta con sal, dieta hiperproteica). Una dieta occidental suele tener unos 700 mOsm en una persona de 70 kg. Si se asume que en un paciente con SIADH la osmolalidad urinaria no puede ser inferior a 500 mOsm/kg H2O, esa carga osmolar permite eliminar 1,4 l/día. Por tanto, si la ingesta es mayor a este volumen, la natremia disminuye. Esto puede estimarse mediante la comparación de los cationes en plasma y orina. Así, si el cociente [Na (o)] + [K (o)] / [Na (p)] es > 1, no hay eliminación de agua libre de electrolitos y es muy poco probable que la restricción de agua sea eficaz. Igualmente una osm (o) > 500 mOsm/kg también predice una pobre respuesta.
La intervención farmacológica se reserva para los casos refractarios. La demeclociclina y el litio son fármacos que se recogen en las diferentes guías, pero cuyo uso no está recomendado hoy día. Actualmente se ha propuesto el uso de urea (soluto que induce diuresis osmótica), que es efectiva a dosis de 0,25 a 0,50 g/kg/día. Hoy en día hay disponibles formulaciones comerciales que mejoran su sabor y facilitan su uso terapéutico [35]. También una combinación de diuréticos del asa a dosis bajas y cloruro de sodio oral son una opción de tratamiento.
Aparte a todos estos elementos clásicos, en el momento actual puede plantearse el tratamiento con los inhibidores de V2, llamados vaptanes [40] [41]. En España, el único vaptán autorizado hasta la fecha para el tratamiento de la hiponatremia asociada al SIADH es el tolvaptán, no estando autorizado su uso en la hiponatremia hipervolémica por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS). Estos fármacos son antagonistas selectivos del receptor V2, provocan un aumento de la acuaresis, reducción de la osmolalidad urinaria y aumento de la natremia. Si se usa, se recomienda iniciar el tratamiento en el ámbito hospitalario con una dosis de 15 mg/día y liberalizar la restricción hídrica, observando la respuesta. El objetivo es ir aumentando progresivamente la dosis según la respuesta acuarética, hasta un máximo de 60 mg/día, ya que el efecto es dosis-dependiente. Si aumenta la natremia demasiado rápido, se debe suspender o disminuir la dosis, aumentar el aporte hídrico e incluso administrar desmopresina (si hay poliuria y la osm (o) < 200 mOsm/kg). Un metanálisis reciente muestra que el riesgo de hipernatremia correctamente utilizado es bajo, pero mayor en pacientes que tienen tratamiento diurético [42]. Además de la corrección rápida de la natremia, otras reacciones adversas recogidas como frecuentes en la ficha técnica incluyen sed, polaquiuria, poliuria, deshidratación e hipotensión ortostática y en su uso continuado pueden aparecer cambios en las enzimas hepáticas. Esto, unido a su elevado coste económico, hace que, en el momento actual, las guías europeas no recomienden su uso y las americanas lo hagan solo en pacientes refractarios a otros tratamientos tras valorar pros y contras, aconsejando determinaciones de las enzimas hepáticas periódicamente. Por tanto, las indicaciones de este fármaco serían sobre todo el SIADH refractario que no responde a las medidas habituales.
El reconocimiento de que la hiponatremia leve asintomática (126-134 mmol/l) se asocia a trastornos cognitivos, inestabilidad de la marcha y una mayor incidencia de caídas, fracturas y osteoporosis [43] plantea la cuestión de si la hiponatremia leve debe tratarse de forma activa. En caso de que haya una causa tratable, como la hiponatremia asociada a fármacos, debe intentarse sustituir el fármaco implicado por otro. En otros casos debe insistirse en las medidas de restricción hídrica con el objetivo de normalizar la natremia.
Para finalizar, destacar un estudio randomizado, controlado y a doble ciego que utilizó empaglifozina en pacientes con SIADH, encontrando que es un fármaco eficaz, aunque algunos pacientes presentaron deterioro de la función renal. Se trata de un fármaco cuyo espacio en el tratamiento está por demostrar [44].
HIPERNATREMIA
La hipernatremia (> 145 mEq/l) es un trastorno menos frecuente que la hiponatremia y tampoco un diagnóstico en sí mismo, sino un hallazgo de laboratorio que obliga a investigar la causa que lo produce. Dado que la concentración plasmática de sodio viene dada por el cociente entre la cantidad de sodio y el agua extracelular, la hipernatremia puede ser el resultado de una pérdida de agua o de una retención de sodio. La pérdida de agua es la causa más frecuente, sobre todo si se produce fuera del hospital, mientras que en la adquirida en el hospital puede sumarse un balance positivo de sodio debido a la administración de soluciones intravenosas.
Cuando se produce una pequeña elevación de la natremia, el aumento de osmolalidad es detectado por los osmorreceptores hipotalámicos, que envían mensajes tanto al centro de la sed como al centro regulador de la producción y liberación de ADH. La respuesta es una combinación de aumento de la sed y una menor producción de orina, que es más concentrada, para devolver la concentración plasmática de sodio a la normalidad [45]. Aunque ambos mecanismos son básicos, la sed es primordial, pues incluso la máxima secreción de ADH puede no lograr retener el agua suficiente para compensar las pérdidas si no se aumenta el aporte de agua. Un ejemplo son los pacientes con diabetes insípida central (DIC) sin secreción de ADH, que pueden tener diuresis de 10 a 15 l/día, o los pacientes con poliquistosis renal autosómica dominante tratados con dosis altas de tolvaptán, con diuresis superiores a 4-6 l/día. Ambos, sin embargo, no desarrollan hipernatremia gracias al mecanismo de la sed. El balance se mantiene porque la ingesta de agua se eleva para igualar las pérdidas. Así, la hipernatremia por pérdida de agua ocurre solo en pacientes con hipodipsia o, más comúnmente, en adultos con alteración del estado mental o sin acceso al agua y en los lactantes.
ETIOLOGÍA
Dependiendo del volumen de LEC, la hipernatremia se presenta con hipovolemia por pérdidas renales o extrarrenales (más frecuente), con hipervolemia (a causa de un aporte excesivo de sustancias hipertónicas, como ingesta de agua de mar) o con normovolemia (como la diabetes insípida, DI) (Tabla 9) [46] [47].
Disminución de la ingesta de agua
Solo aparece en pacientes con hipodipsia o en aquellos que por cualquier motivo no tienen acceso al agua. De hecho, una concentración plasmática de sodio superior a 150 mmol/l no se ve prácticamente en adultos conscientes con un mecanismo normal de la sed y acceso libre al agua.
Rara vez el defecto cardinal es una respuesta anómala de los receptores de la sed con defectos variables en la ADH, lo que se conoce como diabetes insípida adípsica. En personas ancianas existe hipodipsia en ausencia de lesiones hipotalámicas, sin conocerse claramente cuál es la causa.
Pérdidas extrarrenales agua
Las patologías que aumentan las pérdidas, como fiebre, infecciones respiratorias, quemaduras o exposición a altas temperaturas, predisponen al desarrollo de hipernatremia. Las pérdidas gastrointestinales pueden provocar efectos diferentes, dependiendo de su origen.
Diabetes insípida
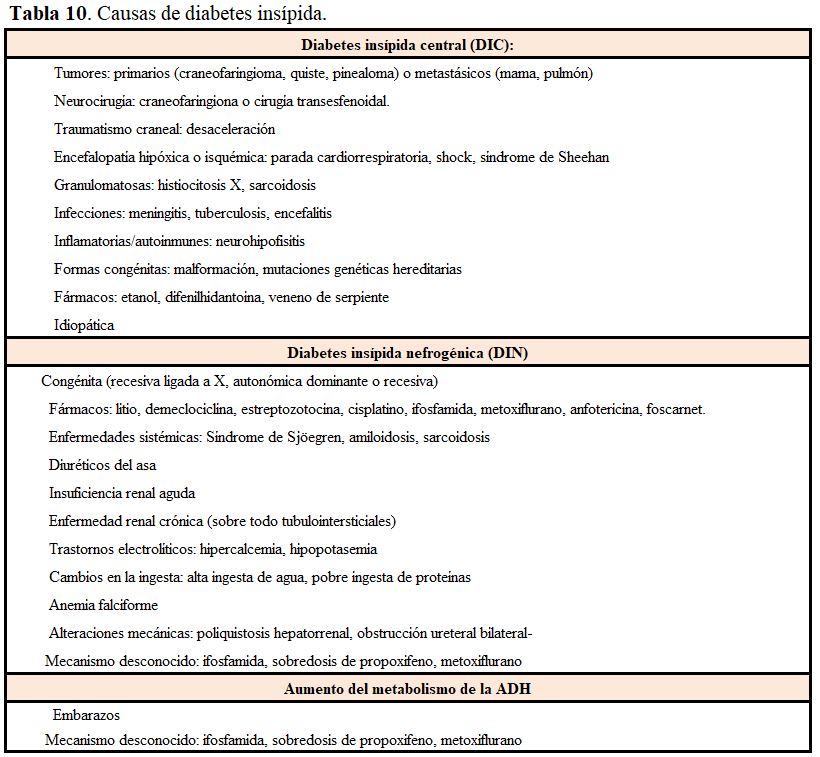
Es un síndrome clínico caracterizado por la excreción de grandes volúmenes de orina diluida (poliuria) consecuencia de un defecto en la acción de la ADH, bien por un fallo completo o parcial de la secreción de ADH (central, DIC) o por una alteración en la respuesta renal (nefrogénica, DIN). Más raramente existe una degradación de la ADH circulante por vasopresinasa. Como resultado, la reabsorción renal de agua disminuye y se produce una orina muy diluida (de 3 a 20 l/día), si bien la mayoría de estos pacientes mantiene el balance de agua porque el mecanismo de la sed se mantiene intacto. Las causas de DI se recogen en la (Tabla 10).
Merece la pena hacer un comentario sobre dos formas raras. La primera son las formas genéticas, sobre las que hay varias publicaciones. Se trata de una patología producida por mutaciones en los genes que codifican el receptor V2 o el canal AQP2, produciendo una disminución de la función. La mayoría está ligada a X. Las mujeres heterocigotas pueden tener diferentes presentaciones y grados de poliuria. Un 10% tiene herencia autosómica dominante (1%) o recesiva (9%) [48] [49]. La otra forma es la DI gestacional, que se produce en 2-6/100.000 embarazos. Debido al aumento excesivo de actividad de vasopresinasa, expresada por los trofoblastos placentarios, se degrada la ADH y se induce DI, la cual se desarrolla típicamente en el tercer trimestre y se resuelve 4-6 semanas después del parto. El riesgo de DI gestacional es mayor en mujeres con enfermedad hepática, posiblemente porque la vasopresinasa es metabolizada por el hígado. Hay que distinguir este cuadro de una DI central que se ponga de manifiesto durante el embarazo o una DI nefrogénica, ya que puede existir una deficiencia leve de ADH que se desenmascare durante el embarazo y valorar el papel que el aumento de la producción de prostaglandinas puede tener para disminuir la acción de la ADH. No obstante, la DI gestacional puede permanecer sin diagnosticar, ya que la poliuria es considerada normal en el embarazo [50].
Una de las formas frecuentes de DI nefrogénica adquirida es la producida por litio, apareciendo aproximadamente en el 12% de los tratados con este fármaco durante más de 15 años, llegando al 19 y 50% si se considera solo poliuria o un trastorno para concentrar la orina. Puede ser irreversible si el tratamiento es prolongado [51] [52].
Diuresis osmótica
Hace referencia a un aumento de las pérdidas urinarias de agua producidas por la presencia en la luz tubular de solutos no reabsorbibles, lo que origina una disminución dilucional de la concentración de Na+ y K+. Esta pérdida de agua aumenta la concentración plasmática de sodio, a no ser que exista un aumento en la ingesta de agua.
La glucosuria por diabetes mellitus mal controlada es la causa más común de diuresis osmótica, aunque un problema similar puede aparecer en pacientes alimentados con dietas muy ricas en proteínas o tras infusiones prolongadas de manitol.
Sobrecarga de sodio
Es una causa rara y se ha descrito en lactantes a los que se dan dietas muy ricas en sodio o bicarbonato y en adultos con soluciones hipertónicas, como: a) bicarbonato sódico 1M en la resucitación cardiopulmonar, hiperpotasemia o acidosis metabólicas; b) cloruro sódico al 3% intraamniótico en abortos terapéuticos o intravenoso en el tratamiento de la hipertensión intracraneal, entre otros [53].
DIAGNÓSTICO
La hipernatremia aparece en lactantes o adultos con disminución del nivel de conciencia (Figura 4). Si un paciente alerta está hipernatrémico hay que pensar en una lesión hipotalámica en el centro de la sed o en algún trastorno psiquiátrico. Aunque la historia puede ser útil (poliuria, polidipsia, diabetes mellitus), los síntomas neurológicos por hiperosmolalidad o por una patología central subyacente pueden limitar la información que se obtiene en el momento de la presentación.
Para el diagnóstico lo ideal es seguir una sistemática, valorando:
1ª ¿Cómo está el volumen extracelular? Distingue los casos por ganancia neta de sodio de los de pérdida neta de agua.
2ª ¿Cuál es la respuesta renal a la hipernatremia? Valorar mediante la diuresis y la concentración urinaria. La capacidad de concentración urinaria es normal en pacientes con una sobrecarga de sodio en los que, además, hay oliguria si se debe a pérdidas insensibles o hipodipsia primaria sin DI central. En estas condiciones, la osmolalidad urinaria debe ser mayor de 800 mOsm/kg H2O.
La poliuria se define arbitrariamente como un volumen urinario superior a 2,5-3 l/día e indica que el origen de la hipernatremia es una pérdida de agua de origen renal. Se puede encontrar una diuresis acuosa (osmolalidad urinaria baja) u osmótica (osmolalidad urinaria alta). La diuresis acuosa se encuentra en pacientes con una DI central o DI nefrogénica severa, con una orina hipoosmótica respecto al plasma (osmolalidad urinaria < 300 mOsm/kg H2O y densidad < 1010). Si hay poliuria con una osmolalidad urinaria inferior a 300 mOsm/kg H2O, se trata de una diuresis osmótica.
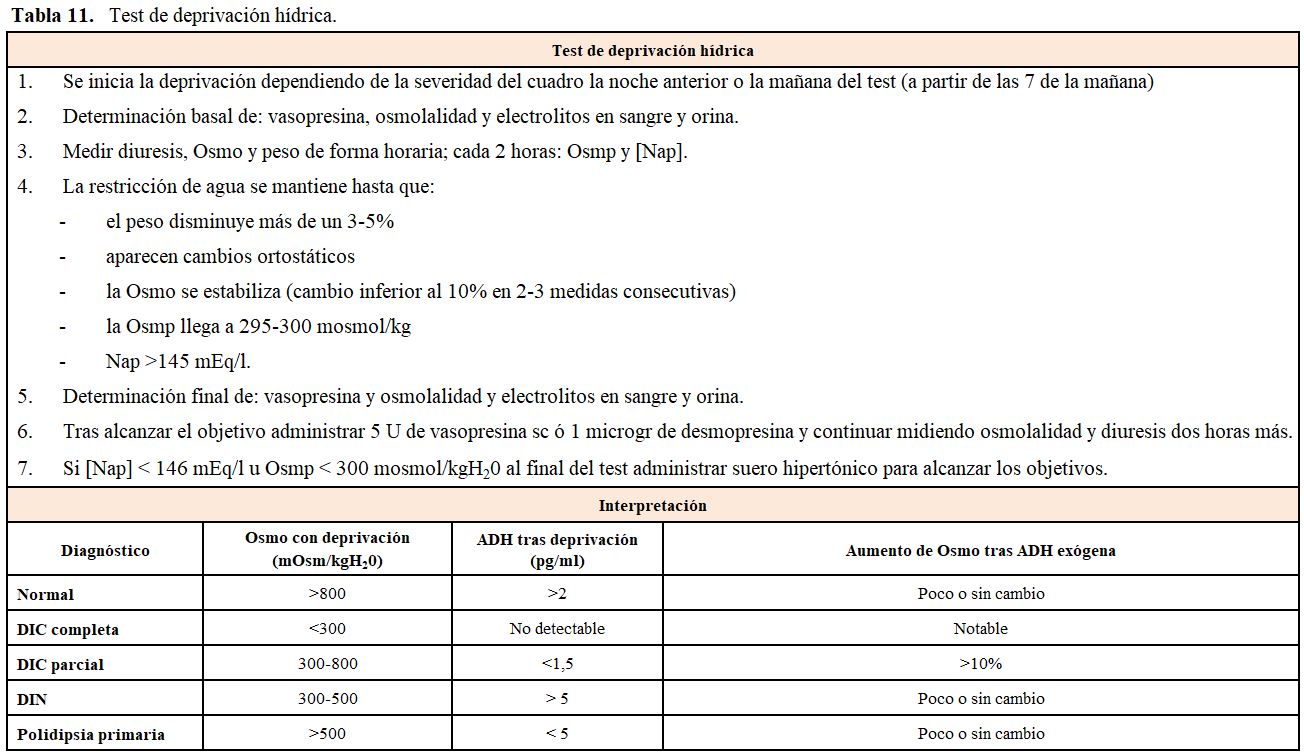
Aunque el diagnóstico de las poliurias se realiza clásicamente mediante un test de restricción hídrica (Tabla 11) y estas dos patologías se diferencian mediante la administración de ADH, la precisión diagnóstica es del 70% [55]. Durante la síntesis de ADH, la arginina-vasopresina se divide en copeptina y neurofisina-2. La copeptina no tiene función biológica y su vida media es más larga, lo que la convierte en una mejor medida de la secreción de vasopresina. Un primer estudio definió que la determinación de copeptina tenía casi 100% de sensibilidad y especificidad diagnóstica [56], pero un trabajo posterior ha encontrado que la medición de copeptina tras la infusión de salino hipertónico es lo más útil para estudiar cualquier causa de poliuria, teniendo en cuenta el riesgo que hay de empeorar la hipernatremia [57]. Trabajos recientes aportan puntos de corte determinando que una copeptina basal menor de 2,6 pmol/l es diagnóstica de DI central, mientras que concentraciones superiores a 21,4 pmol/l son diagnósticas de DI nefrogénica. Si las concentraciones son indeterminadas hay que valorar la infusión de solución salina hipertónica, donde un valor superior a 4,9 pmol/l sugiere una polidipsia [54].
Solo añadir que la historia clínica y los datos de laboratorio son fundamentales para el diagnóstico etiológico, pudiendo identificar la presencia de hiperglucemia, dieta hiperproteica, administración de manitol u otra sustancia que puede inducir diuresis osmótica. En casos dudosos se puede medir la concentración urinaria de sodio, glucosa o urea para identificar el tipo de sustancia que se está excretando.
CLÍNICA
Los síntomas son fundamentalmente neurológicos y se relacionan con la deshidratación celular. Los primeros en aparecer son letargia, debilidad e irritabilidad, que pueden progresar a convulsiones, coma y muerte en casos severos. Puede darse fiebre, náuseas, vómitos y, por supuesto, sed intensa. Los mecanismos de adaptación descritos hacen que los pacientes con hipernatremia crónica puedan encontrarse relativamente asintomáticos a pesar de concentraciones plasmáticas de sodio de hasta 170-180 mmol/l, relacionándose la gravedad de los síntomas, como ocurría con la hiponatremia, más con la velocidad de instauración.
Otros síntomas que pueden existir son los de una enfermedad neurológica subyacente, signos de expansión o depleción de volumen. En los pacientes con DI existe típicamente poliuria, nicturia y polidipsia. La poliuria depende de la gravedad del defecto de concentración, la necesidad de excreción de solutos y la volemia, lo que constituye el fundamento de indicar como tratamiento la restricción de sal y el uso de diuréticos en pacientes con DI.
TRATAMIENTO
Principios generales
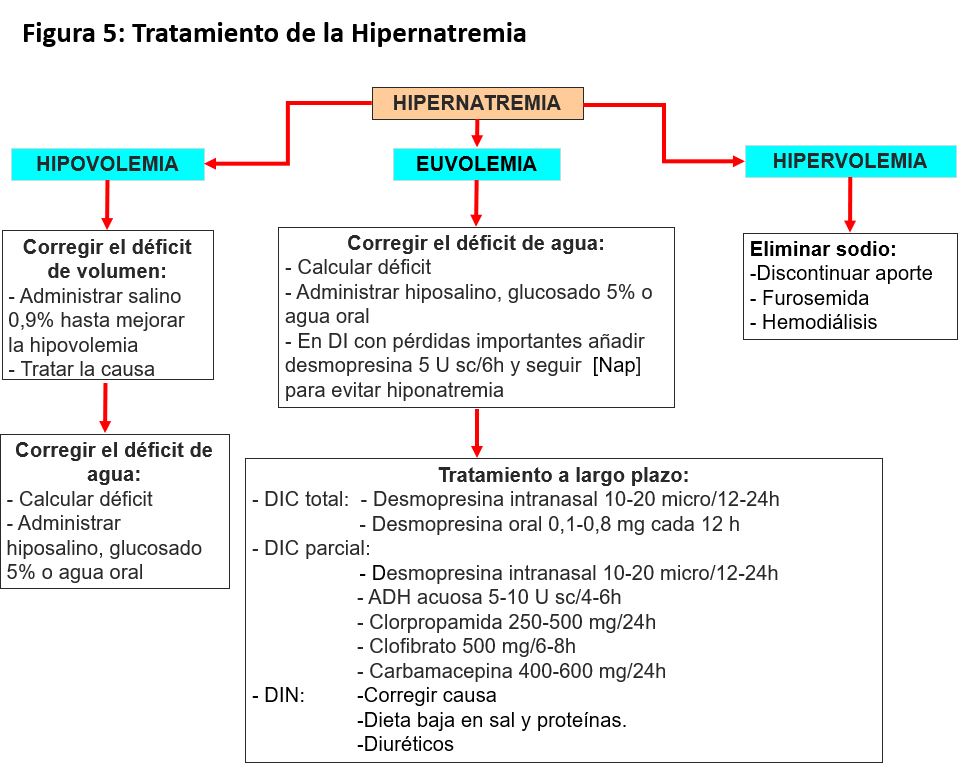
La premisa básica para corregir el trastorno es reconocer si se trata de una hipernatremia aguda, donde hay riesgo de hemorragia cerebral y la corrección debe ser rápida, o una crónica, donde por el contrario la corrección rápida puede producir edema cerebral, convulsiones, daño neurológico permanente e incluso la muerte. Además, es fundamental tener en cuenta que el tratamiento no es el mismo en todas las hipernatremias, ya que dependerá de si la causa es un déficit de agua o el balance positivo de Na (Figura 5).
Para disminuir el riesgo se aconseja corregir la concentración plasmática de sodio lentamente, a no ser que existan síntomas de hipernatremia. El descenso máximo debe ser de 0,5 mmol/l/h y algunos autores establecen un descenso máximo de 8 mmol/l al día. En casos graves (> 170 mmol/l), no se debe bajar la natremia a menos de 150 mmol/l en las primeras 48-72 h.
Cálculo del déficit de agua
La corrección gradual del problema requiere el cálculo previo del déficit de agua, que se estima mediante la siguiente fórmula:
Déficit de agua = 0,6 x peso (kg) x ([Na (p)] - 140)/140 (0,5 en mujeres)
Siempre hay que tener en cuenta que esta fórmula es orientativa, no tiene en cuenta las pérdidas isoosmóticas que han ocurrido, que hay que valorar en su contexto clínico. Por eso es fundamental la monitorización frecuente de las concentraciones plasmática y urinaria de sodio para ajustar la reposición.
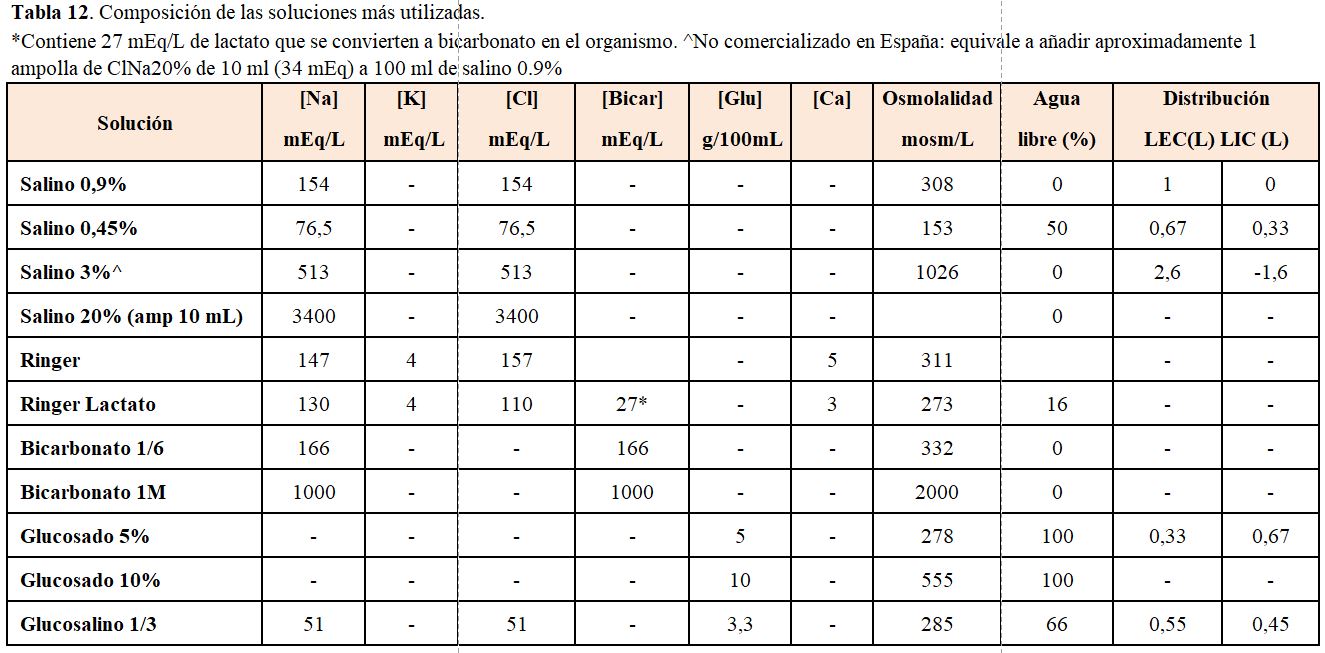
Para reponer las pérdidas se pueden usar distintos fluidos (Tabla 12):
1. Agua libre oral o intravenosa. No administrar glucosado al 5% a más de 300 ml/h por riesgo de hiperglucemia y de poliuria osmótica. Se indica en pacientes con hipernatremia por pérdida pura de agua (DI).
2. Suero salino hipotónico. Se administra cuando también existe una pérdida de sodio (vómitos, diarrea, diuréticos).
3. Suero salino fisiológico. Se prescribe cuando el paciente está inicialmente hipotenso. En esta situación se debe mejorar inicialmente la perfusión tisular, teniendo en cuenta que el suero es hipoosmótico respecto al plasma del paciente hipernatrémico.
4. Se debe tener en cuenta la contribución del potasio al calcular la tonicidad del fluido que se administra. Así, el salino hipotónico con 40 mEq de ClK aumenta su osmolalidad.
Como norma general las hipernatremias con poliuria se reponen con agua libre, mientras que las hipernatremias con oliguria se reponen con suero hiposalino o salino.
Tratamiento de la DI central
El tratamiento más adecuado es el aporte de ADH exógena [58]. La desmopresina es una sustancia sintética análoga a la ADH que existe en forma oral, nasal y parenteral, en dosis de 1-4 mcg y parenteral a 100-400 mcg. El máximo riesgo de esta es que, una vez suministrada, tiene una acción no-suprimible de la ADH, con riesgo de hiponatremia y retención de agua si los pacientes continúan con la alta ingesta de agua. Puede evitarse permitiendo períodos regulares en los que haya un aclaramiento de agua libre, retrasando una dosis de desmopresina una vez a la semana, evitando la toma hasta haber acuaresis o suspendiendo una dosis. La diferente respuesta entre los pacientes requiere una titulación individual para controlar los síntomas y minimizar el riesgo de disnatremia [59].
Para ayudar a controlar la poliuria son útiles la restricción proteica, mantener una situación de depleción moderada de volumen con una dieta baja en sal, el uso de tiazidas o los fármacos que aumentan el efecto o la secreción de ADH, como clorpropamida, clofibrato, carbamacepina o AINEs.
Tratamiento de la DI nefrogénica
Los fármacos como la desmopresina u otros que dependen de la acción de la ADH son ineficaces. En el momento actual, para la DI nefrogénica hereditaria se busca restaurar la expresión del receptor mediante chaperonas, aumentar su activación intracelular [60] o usar activadores directos de la proteinquinasa, que media la acción vasopresina-AQ2 [61].
La principal forma de tratamiento es el uso de tiazidas con una dieta pobre en sodio y proteínas, como se ha descrito antes. El amiloride tiene una indicación específica en la toxicidad por litio, ya que impide su entrada en la célula. Múltiples artículos presentan fármacos que podrían tener un papel en la DI nefrogénica inducida por litio, como tamoxifeno, aliskiren, atorvastatina o acetazolamida, cuya eficacia se está estudiando, sin que existan datos concluyentes. Sobre la acetazolamida, un estudio en animales mostró que era muy eficaz para prevenir el desarrollo de DI nefrogénica [62]; más tarde, en un trabajo del mismo grupo, en pacientes con DI nefrogénica establecida, la acetazolamida disminuyó la poliuria al disminuir el filtrado glomerular, pero sin modificar la concentración urinaria, así que los autores recomendaban mucha cautela y más estudios antes de generalizar su uso [63].
Tratamiento de la sobrecarga de sodio
Si se ha producido por una ingesta excesiva y todavía es posible, poner sonda nasogástrica y reducir la absorción sería la primera medida. Posteriormente es necesario eliminar la carga de sodio. Cuando la función renal es normal se excreta en la orina, y se puede inducir la natriuresis con diuréticos o si hay fracaso renal puede precisar hemodiálisis. Al mismo tiempo se puede disminuir la natremia con sueros hipotónicos.