Trasplante Pancreas Riñón
Miembros del grupo de trabajo
Marta Artamendi Larrañagab, Sonia Cillero Regoc, Teresa García Álvarezd, Thais López Albae, Miguel Ángel Muñoz Cepedaf, Mª Dolores Navarro Cabellog, Pilar Pascual Núñezh, Emilio Rodrigo Calabriai, Mª Isabel Sáez Caleroj, Asunción Sancho Calabuigk, Mª Luisa Suárez Fernándezl, Betty Chamuon Huaconm, Cristina Medrano Villarroyan, Castillo Erasoñ, Marina González de Riverao, Román Hernández Gallegop, Jordi Espi Reigq
bHospital San Pedro de Logroño. cHospital Universitario de A Coruña. dHospital Puerta del Mar.
eHospital Universitario Parc Taulì de Sabadell. fHospital Virgen de la Salud de Toledo. gHospital Reina Sofía de Córdoba.
hHospital Clínico Universitario de Valladolid. iHospital Universitario Marqués de Valdecilla. jHospital de Burgos.
kHospital Universitario Dr. Peset de Valencia.
lHospital Central de Asturias.
mHospital del Mar de Barcelona.
nHospital Universitario Miguel Servet de Zaragoza.
ñHospital Joan XXIII de Tarragona.
oHospital Fundación Jiménez Díaz de Madrid.
pHospital Universitario de Badajoz.
qHospital de la Fe de Valencia.
ÍNDICE
1. Introducción
2. Justificación y resultados
2.1. Impacto y resultados del trasplante simultáneo de páncreas-riñón.
2.2. Impacto y resultados del trasplante de páncreas después del trasplante renal.
2.3. Resultados del trasplante SPK y PAK frente al trasplante de islotes pancreáticos SIK/IAK.
2.4. Efectos del trasplante de páncreas sobre la retinopatía diabética, el sistema cardiovascular, la neuropatía y el riñón.
3. Selección del donante, de receptores y seguimiento post trasplante en los receptores de trasplante páncreas-riñón.
3.1. Selección de donantes.
3.2. Selección del receptor y seguimiento postrasplante.
4. Seguimiento postrasplante e inmunosupresión
4.1. Profilaxis postoperatoria en el trasplante de páncreas riñón
4.2. Inmunosupresión en el trasplante páncreas-riñón
ABREVIATURAS
ADS: anticuerpos donante específicos DBD: donantes en muerte encefálica
DCD: donantes después de muerte cardiaca DDKA: trasplante renal aislado de donante cadáver DM: diabetes mellitus
ERCT: enfermedad renal crónica terminal
FEVI: fracción de eyección del ventrículo izquierdo imTOR: inhibidores de mTOR
IPTN: registro internacional de trasplante de páncreas KTA: trasplante renal aislado
LDKA: trasplante renal aislado de donante vivo MACE: eventos adversos cardiovasculares mayores PAK: trasplante de páncreas tras renal
PADK: trasplante de páncreas tras trasplante renal de donante cadáver PALK: trasplante de páncreas tras trasplante renal de donante vivo
P-BPAR: rechazo agudo comprobado por biopsia PTA: trasplante de páncreas aislado
SPK: trasplante simultáneo páncreas-riñón
SPKL: trasplante simultáneo de páncreas con donante de vivo TRDV: trasplante renal de donante vivo
TRS: terapia renal sustitutiva
1. INTRODUCCIÓN
La DM se ha convertido a lo largo de los últimos años en un problema mundial de salud pública. En la actualidad, alrededor de 463 millones de adultos de entre 20 y 79 años tienen diabetes. Esto representa el 9.3% de la población mundial en este grupo de edad. Se prevé que la cantidad total aumente a 578 millones (10.2%) para 2030 y a 700 millones (10.9%) para 2045. Se calcula que la DM se asocia con el 11.3% de los fallecimientos a nivel mundial por todas las causas posibles entre las personas de entre 20 y 79 años.
La nefropatía diabética es la primera causa de inicio de TRS por enfermedad renal crónica avanzada en la mayoría de los países occidentales. Aunque el riesgo de enfermedad renal crónica avanzada es mayor en la diabetes mellitus DM tipo 1, la alta prevalencia de pacientes con DM tipo 2, hace que ésta contribuya a un mayor porcentaje de pacientes con enfermedad renal crónica avanzada por nefropatía diabética. Para la mayoría, el trasplante renal será la mejor opción, y un grupo seleccionado se podrá beneficiar de las ventajas de un trasplante de páncreas. En la actualidad, no existe ninguna forma ni pauta de administración de insulina que permita obtener un control glicémico tan correcto como el observado con el trasplante de páncreas.
La disminución de las complicaciones quirúrgicas tras la mejoría de la técnica, así como de los episodios de rechazo agudo con la introducción de nuevos y más potentes inmunosupresores, ha permitido reducir la elevada morbimortalidad que inicialmente se asociaba a este trasplante combinado.
El trasplante SPK y el PTA aislado pueden mejorar la salud a largo plazo, la supervivencia del paciente y la calidad de vida de los receptores. Además, el trasplante preventivo SPK, en comparación con el trasplante SPK realizado en pacientes en programa de diálisis, parece estar asociado con mejores resultados. El tiempo en diálisis tiene implicaciones negativas en los receptores de trasplante SPK.
El PAK aumenta el riesgo de mortalidad sólo en el período inicial postrasplante, pero se asocia con una mejor esperanza de vida a partir de entonces.
El trasplante de páncreas, también, puede mejorar el curso de las complicaciones crónicas de la diabetes, dependiendo de su gravedad. Por tanto, las ventajas del trasplante de páncreas parecen superar claramente las posibles desventajas.
El objetivo de este documento de consenso es revisar la evidencia científica existente en relación con el trasplante de páncreas en sus diferentes modalidades: resultados, beneficios sobre las complicaciones crónicas de la DM, criterios de selección de donantes y receptores, así como seguimiento de los pacientes trasplantados y principales pautas de inmunosupresión empleadas.
2. JUSTIFICACIÓN Y RESULTADOS
2.1. IMPACTO Y RESULTADOS DEL TRASPLANTE SPK.
a) Receptores con DM tipo 1.
La supervivencia a 5 años de los pacientes con trasplante SPK ha aumentado de manera significativa del 63% (1984-1985) a casi el 90% (2008-2009) a los 10 años [1].
En pacientes con DM tipo 1 y ERCT, de forma general, la supervivencia de los pacientes e injertos renales fue mayor para el trasplante SPK que para el trasplante KTA [2].
Los estudios no muestran un beneficio en la supervivencia del paciente con trasplante SPK frente al trasplante LDKA (SPK = LDKA > DDKA) en los primeros 10 años. Se precisan más de 10 años para mejorar la supervivencia de los pacientes con trasplante SPK [3] [4]. A partir de los 10 años del trasplante, la supervivencia del receptor de trasplante SPK es superior a la de los receptores de trasplante LDKA y DDKA (SPK> LDKA > DDKA) y la supervivencia del injerto renal (análisis univariante) en los receptores de trasplante SPK similar a la de los receptores de trasplante LDKA (SPK = LDKA) aunque superior a la de los receptores de trasplante DDKA [3] [4].
Los pacientes con TRS previa al trasplante SPK tienen peor supervivencia que aquellos que reciben un trasplante SPK en prediálisis. De ahí la importancia de la derivación precoz de los posibles candidatos a trasplante SPK [5]. Se ha observado mejor supervivencia en los receptores de trasplante preventivo SPK que de trasplante DDKA preventivo a los 6 años, pero sin diferencias entre la supervivencia de los pacientes con trasplante PALK, LDKA y SPK preventivo [4] [5] [6].En el grupo de trasplantados SPK, se observaron diferencias con mejor supervivencia del injerto renal en el grupo con trasplante SPK preventivo respecto a los otros grupos con TRS [5].
En el grupo de trasplantados SPK, se observaron diferencias con mejor s supervivencia del injerto renal en el grupo con trasplante SPK preventivo respecto a los otros grupos con TRS [5].
El tiempo de permanencia en diálisis tiene un impacto negativo en los resultados en cualquiera de las modalidades [5].
EVIDENCIAS
En pacientes con DM 1 el trasplante SPK mejora la calidad de vida y la supervivencia a largo plazo en comparación con el tratamiento médico actual para los pacientes en lista de espera y en comparación con otras opciones de trasplante (2B) [7].
En pacientes seleccionados, el trasplante SPK mejora a largo plazo la supervivencia, función del injerto renal y calidad de vida en comparación con los receptores de trasplante DDKA (2C) [7].
El trasplante LDKA, por sí solo, logra supervivencia similar al trasplante SPK a mediano plazo, pero el trasplante SPK ha mejorado su supervivencia a largo plazo (2C) [7].
Existe evidencia indirecta de que el trasplante SPK preventivo mejora la longevidad y la calidad de vida en pacientes con DM tipo 1 (OPINIÓN) [7].
El trasplante preventivo SPK se asocia con mejores resultados en comparación con el trasplante SPK realizado en pacientes sometidos a diálisis (2B) [7].
Existen datos muy limitados, pero parece que el trasplante SPK Y LDKA preventivo proporcionan excelentes resultados a largo plazo en pacientes con DM 1 (OPINIÓN) [7].
Evidencias indirectas indican que el SPK preventivo es superior en términos de calidad de vida y longevidad en comparación con el trasplante DDKA en pacientes con DM 1 (OPINIÓN) [7].
La recomendación del grupo PROMETEO es que el trasplante LDKA debe ser una alternativa al trasplante SPK en caso de largos tiempos de espera previstos (tiempo en diálisis superior a 1 año) y en personas que no cumplen criterios para trasplante SPK.
La recomendación del grupo PROMETEO es priorizar el trasplante SPK como primera opción en pacientes con DM tipo 1 y ERC en prediálisis frente al trasplante LDKA. CALIDAD DE EVIDENCIA BAJA. RECOMENDACIÓN FUERTE
b) Receptores con DM tipo 2.
Las definiciones de DM tipo 2 fueron muy variables, en las diferentes publicaciones existentes: basadas en la presencia del péptido C, ausencia de criterios de DM tipo 1, criterios ADA, criterios OMS (1999), Guidelines for the prevention and control of type 2 diabetes in China (2013), o bien, no fue definida [8].
Las tasas de supervivencia combinadas a 1, 3 y 5 años de pacientes con DM tipo 2 y ERCT después del trasplante SPK fueron del 98 %, 95 % y 91 % respectivamente [8].
Los resultados de supervivencia de los receptores y de los injertos fueron comparables entre los trasplantados SPK y KTA en el trabajo publicado por Fu Y et al [9] pero el trasplante SPK produjo resultados metabólicos y función renal superiores. Sin embargo, en otro estudio estimaron que para los pacientes con DM tipo 2, el trasplante SPK tuvo una ventaja de supervivencia en comparación con el trasplante KTA [8].
El trasplante LKDA proporciona mayor supervivencia del paciente, del injerto y del injerto censurado por muerte frente al trasplante SPK en pacientes con DM tipo 2, que aumentó hasta los 5 años. La supervivencia del injerto renal y del paciente al año fue similar en los pacientes con trasplante SPK y DDKA, pero a los 5 años la supervivencia es superior en los pacientes con trasplante SPK frente a los pacientes con trasplante DDKA [10].
Se pueden obtener buenos resultados de supervivencia del paciente con trasplante SPK en pacientes seleccionados con DM tipo 2 (Edad < 55-60 años, IMC < 30 kg/m2, terapia con insulina > 10 años, péptido C < 3 ng/mL), pero el trasplante de páncreas adicional no proporciona ninguna ventaja en la supervivencia del paciente o del injerto en comparación con el trasplante DDKA al año o el trasplante LKDA a los 5 años; los resultados fueron superiores con el trasplante LDKA. El efecto de la euglucemia sobre la supervivencia puede no ser evidente hasta transcurridos más de 5 años [10].
EVIDENCIAS
En receptores con DM tipo 2, evidencias indirectas indican que el trasplante SPK mejora la calidad de vida y la supervivencia en pacientes seleccionados (Edad < 55-60 años, IMC < 30 kg/m2, terapia con insulina > 10 años, péptido C < 3 ng/mL), en comparación con pacientes que permanecen en diálisis (OPINIÓN) [7].
La evidencia indirecta sugiere que en pacientes seleccionados con DM tipo 2, la normoglucemia tras el trasplante ofrece ventajas adicionales en comparación con el trasplante
LDKA (OPINIÓN), y aumenta la calidad de vida y supervivencia del trasplante comparado con el trasplante DDKA (2B) [7].
c) Receptores con DM tipo 1 frente a receptores con DM tipo 2.
Los autores comunican que en los registros americanos el 5,8% de los trasplantes SPK se realizaron en pacientes con DM tipo 2. Solo el 2% de los candidatos a trasplante renal y DM tipo 2 recibieron un trasplante SPK durante la “ERA 2009-2015”. Este dato denota, una tendencia general a limitar el trasplante SPK en los pacientes con DM tipo 2. Las tasas de supervivencia del paciente, y de los injertos pancreático y renal han mejorado a lo largo de las décadas [11].
Los resultados de supervivencia de pacientes con DM tipo 2 fueron comparables a los de pacientes con DM tipo 1 [8].
Sería necesario establecer un criterio uniforme de los subconjuntos de pacientes con DM tipo 2 que se beneficiarán del trasplante SPK y estándares de diagnóstico definidos de las complicaciones relacionadas con el trasplante SPK. La definición de fallo del injerto pancreático en este registro se definió como “necesidad de insulina postrasplante”, sin analizar la resistencia periférica en estos pacientes. Todo ello hace cuestionable la indicación del trasplante SPK en DM tipo 2 [11].
EVIDENCIAS
No hay evidencia para priorizar la asignación del trasplante SPK a pacientes con DM tipo 1 frente a pacientes con DM tipo 2 (2B) [7].
2.2. IMPACTO DEL TRASPLANTE PAK Y RESULTADOS
a) Receptores con DM tipo 1.
La supervivencia del paciente a los 5 años ha aumentado por encima del 90% en los receptores de trasplante SPK, PAK y PTA. A los 10 años, se han encontrado diferencias con mejor supervivencia para los pacientes con trasplante PTA, seguido de los pacientes con trasplante SPK y PAK [1].
Se ha demostrado que los pacientes en lista de espera presentan mayor mortalidad frente a los pacientes que son trasplantados de páncreas (trasplante SPK, PAK y PTA) [12], (SPK y PAK) [13]. El riesgo de mortalidad aumenta cuando el paciente está en lista de espera más de un año. Los pacientes en lista de espera de trasplante SPK y PAK mostraron una supervivencia global similar. La causa de muerte más frecuente en los pacientes en lista de espera fue la cardiovascular y en el grupo trasplantado las complicaciones infecciosas [12] [13].
En los diferentes estudios publicados, no hubo asociación entre el tipo de trasplante y la mortalidad entre las siguientes modalidades de trasplante preventivo: SPK, LDKA, DDKA y PALK, pero el riesgo de mortalidad fue superior en los pacientes con trasplante DDKA preventivo frente a los pacientes con trasplante PALK y SPK preventivo [5].
Se ha observado una mejor supervivencia del paciente al año con el trasplante PALK frente al trasplante SPK, posteriormente no se observaron diferencias en las tasas de mortalidad de los pacientes con trasplante SPK frente a los pacientes con trasplante PALK [14], ni trasplante PADK [15].
La mejor supervivencia del injerto renal a corto y largo plazo se observó en los pacientes que recibieron un trasplante PALK. La supervivencia del páncreas a los 10 años fue superior en los pacientes con trasplante PALK frente a los pacientes con trasplante PADK.
Los pacientes retrasplantados de páncreas presentaron menor fallo del injerto renal y censurado por muerte frente a los pacientes con trasplante SPK con fallo del injerto pancreático no retrasplantados, sin diferencias en la supervivencia [16].
Los trasplantados PALK tuvieron una mayor supervivencia renal y del paciente en comparación con los trasplantados de LDKA (a los 8 años). El injerto renal no se vio afectado negativamente por el trasplante de páncreas [17]. Tampoco se encontraron diferencias en la supervivencia del injerto renal entre los pacientes trasplantados PALK y LDKA de forma preventiva. Pero hubo menor supervivencia renal en trasplantados DDKA y SPK de forma preventiva que si se realiza trasplante PALK o LDKA preventivo [5].
Las tasas de supervivencia del injerto de páncreas a los 5 y 10 años se estiman: 73% y 56% en SPK; 64% y 38% en PAK; 53% y 36% en PTA [1]. Se ha registrado menor supervivencia del páncreas en pacientes con trasplante PALK a 5 años frente a trasplantados SPK [14], con mayores tasas de rechazo agudo frente a pacientes con trasplante PADK o SPK [15].
El TRDV permite aumentar el número de trasplantes renales y minimizar los tiempos de espera. Por tanto, en los pacientes con DM tipo 1 con un potencial donante de vivo, debemos considerar la opción del TRDV seguido de trasplante de páncreas, si los tiempos de espera para trasplante SPK son muy prolongados [14].
EVIDENCIAS
A los 90 días, el trasplante PAK se asocia con un mayor riesgo de mortalidad (en comparación con permanecer en la lista de espera, debido a complicaciones quirúrgicas) que persiste hasta el primer año. Después del primer año, el trasplante de PAK se asocia con una menor mortalidad (2B) [7].
La evidencia disponible en pacientes con DM tipo 1 no puede determinar si el trasplante de PAK prolonga la esperanza de vida pero mejora claramente la calidad de vida debido a una función renal superior, supervivencia del injerto y mejor control metabólico (2B) [7].
La evidencia disponible en pacientes con DM 1 no puede determinar si el trasplante PALK (2B) o PADK (OPINIÓN) prolonga la esperanza de vida, pero sí mejora la calidad de vida debido a una función renal superior, supervivencia del injerto y mejor control metabólico en comparación con continuar con el tratamiento médico de la DM [7].
b) Receptores con DM tipo 2.
La mayoría de los estudios realizados en pacientes con DM tipo 2 y trasplante de páncreas se refieren a pacientes con trasplante SPK.
El trasplante PAK y PTA es también una opción en pacientes con DM tipo 2 y ERCT, con buenos resultados de supervivencia del paciente e injerto pancreático [11].
En el trabajo publicado por Wiseman AC, et al en el 2012, se constató que la supervivencia renal y del paciente fueron superiores con el trasplante LKDA frente al trasplante SPK, mientras que la supervivencia del paciente y del injerto renal fue superior con el trasplante SPK frente a los pacientes con trasplante DDKA, a los 5 años [10].
EVIDENCIAS
Según la evidencia disponible, el trasplante PAK tras LDKA o DDKA en pacientes con DM tipo 2 seleccionados (Edad < 55-60 años, IMC < 30 kg/m2, terapia con insulina > 10 años, péptido C < 3 ng/mL) es factible. Más datos son necesario antes de sacar conclusiones sobre el impacto en la esperanza o la calidad de vida (OPINIÓN) [7].
La recomendación del grupo PROMETEO es dado que el efecto de la euglucemia sobre la supervivencia del injerto o del paciente puede no ser evidente hasta transcurridos más de 5 años, en aquellos pacientes con DM tipo 2 que reciben previamente un trasplante, sobre todo trasplante LKDA, o trasplante DDKA, podría valorarse la opción de trasplante PAK. CALIDAD DE EVIDENCIA BAJA, OPINIÓN.
2.3. RESULTADOS DEL TRASPLANTE SPK Y PAK FRENTE AL TRASPLANTE DE ISLOTES PANCREÁTICOS SIK/IAK
Varios factores determinan el tipo de trasplante: tipo de DM, inestabilidad glucémica, grado de obesidad, requerimientos de insulina y comorbilidades.
El trasplante de islotes pancreáticos aporta ventajas: bajo riesgo quirúrgico, bajo riesgo de trombosis de la vena porta (< 5%) y de sangrado (< 10%). Pero tiene sus limitaciones: necesidad de más de una infusión (2 o 3), se precisa más de un donante con mayor riesgo de sensibilización secundaria [18].
Los pacientes con trasplante SPK/PAK presentan más complicaciones quirúrgicas que obligan a la realización de relaparotomía [19].
La supervivencia del receptor a los 10 años fue mayor en el grupo de pacientes con trasplante SPK/PAK frente al grupo de pacientes con trasplante SIK/IAK, sin diferencias en la tasa de fallo del injerto renal [18, 19]. En ambos grupos se constató mejoría de HbA1c, pero mayor independencia de insulina a los 5 años en el grupo de trasplantados SPK/PAK (75%) frente al grupo SIK/IAK (9.3%) [18, 19]
EVIDENCIAS
Debido a la falta de evidencia, no se pueden sacar conclusiones (OPINIÓN) [7].
2.4. EFECTOS DEL TRASPLANTE DE PÁNCREAS SOBRE LA RETINOPATÍA DIABÉTICA, EL SISTEMA CARDIOVASCULAR, LA ENFERMEDAD VASCULAR PERIFÉRICA, NEUROPATÍA DIABÉTICA Y NEFROPATÍA DIABÉTICA.
a) Retinopatía diabética.
Se ha constatado que los pacientes con trasplante PTA tienen una evolución más favorable frente el grupo control de pacientes con DM tipo 1 no trasplantados. En los estudios publicados, hubo mejoría sobre todo en el grupo de retinopatía diabética-no proliferativa y estabilización en el grupo de retinopatía diabética proliferativa [20].
b) Sistema cardiovascular.
Se ha demostrado mejoría en la FEVI tras el trasplante de páncreas, en la masa del ventrículo izquierdo, en el índice de masa del ventrículo izquierdo, el grosor de la pared posterior y en la onda E/A [21] [22].
c) Enfermedad vascular periférica
Los pacientes con DM tipo 1 en ERCA deberían ser evaluados precozmente como candidatos para trasplante SPK, tan pronto como avance el deterioro de la función renal, ya que son factores de riesgo de amputación: el tiempo previo al trasplante en TRS y los antecedentes de amputación [23].
En la publicación de Sucher R, et al, los pacientes con trasplante KTA tenían mayor prevalencia de factores de riesgo ateroescleróticos (presión arterial sistólica, presión arterial diastólica, coronariopatía, hipertrigliceridemia) post-trasplante que los trasplantados SPK, que tuvieron menos complicaciones vasculares periféricas postrasplante que el grupo de pacientes con trasplante renal aislado [24].
d) Neuropatía diabética
Tras el trasplante SPK, PAK, PTA se ha observado mejoría en los índices de conducción nerviosa motora y sensorial frente a los controles donde existió un empeoramiento. El efecto observado fue leve-moderado, probablemente debido al daño estructural previo. Se sugiere que el efecto del trasplante de páncreas puede ser mayor en fases tempranas de afectación neuropática [25].
El trasplante SPK mejora los síntomas de polineuropatía (dolor, parestesias, rampas) y aumenta las velocidades de conducción nerviosa, pero sin cambios en los signos clínicos de déficits sensoriales, fuerza muscular y reflejos tendinosos. Tras la pérdida del injerto pancreático no hubo cambios en las velocidades de conducción nerviosa durante el primer año, pero si, descenso significativo en la velocidad de conducción nerviosa posterior [26].
e) Nefropatía diabética.
El trasplante de páncreas puede revertir las lesiones de la nefropatía diabética (grosor de la membrana basal glomerular y tubular, volumen fraccional mesangial), pero la reversión requiere más de cinco años de normoglucemia [27].
EVIDENCIAS
El trasplante exitoso SPK o PAT puede contribuir a la estabilización o mejoría de la retinopatía diabética dependiendo de la etapa de la retinopatía (2B) [7].
El trasplante de SPK tiene efectos beneficiosos sobre el sistema CV, incluida una menor tasa de muerte CV en comparación con la diálisis o el trasplante KTA (2B) [7].
Las amputaciones de EEII previas al trasplante SPK pueden ser un factor de riesgo para presentar peores resultados tras el trasplante (2C) [7].
El trasplante de SPK tiene efectos beneficiosos en pacientes con neuropatía de leve a moderada (2B) y el trasplante PTA mejora el curso de la neuropatía (2C) [7].
El trasplante SPK previene el desarrollo o la aparición de nefropatía diabética en el injerto renal (2B) y el trasplante PTA mejora la evolución de la nefropatía diabética (OPINIÓN) [7].
3. SELECCIÓN DEL DONANTE, DE RECEPTORES Y SEGUMIENTO POST TRASPLANTE EN LOS RECEPTORES DE TRASPLANTE PÁNCREAS-RIÑÓN.
3.1. SELECCIÓN DEL DONANTE
3.1.1. IMC superior a 30 Kg/m2 y edad DBD mayor de 40 años.
Los órganos de DCE mayores de 50 años pueden usarse con resultados similares a los de los órganos de donantes estándar, lo que muestra potencial para reducir la escasez de órganos y los tiempos de espera [28].
La edad avanzada de los donantes e IMC superior a 30 kg/m2 en receptores de trasplante SPK se asocian a mayor riesgo de complicaciones quirúrgicas: fallo de injerto renal y pancreático y mayor riesgo de muerte del paciente [29].
Los factores del receptor, como la discordancia en el IMC entre el donante y el receptor influyen sobre la supervivencia del injerto [30].
En el contexto de DBD, no se debe considerar la edad del donante superior a 40 años una contraindicación absoluta o relativa para el trasplante de páncreas si el donante es apto [7].
3.1.2. Asistolia
La DCD controlada no es una contraindicación para el trasplante de pancreas [7] [31] [32].
3.1.3. Tiempo de isquemia fría
La minimización de los tiempos de isquemia (menos de 12 h) se asocia con resultados superiores [7] [33] [34].
EVIDENCIAS
Se pueden utilizar donantes adecuadamente seleccionados con un IMC > 30 kg/m2 para tr [asplante de páncreas (2B) [7].
La minimización de los tiempos de isquemia (menos de 12 h) se asocia con resultados superiores pero los resultados siguen siendo aceptables hasta 24 h (1B) [7] [33] [34].
La DCD controlada no es una contraindicación para el trasplante de páncreas. Deben evitarse acumulación de otros factores de riesgo y tiempos de isquemia prolongados (1B) [7].
3.2. SELECCIÓN DEL RECEPTOR Y SEGUIMIENTO POST-TRASPLANTE
3.2.1. Edad del receptor.
En pacientes seleccionados, los resultados del trasplante SPK son similares en receptores jóvenes y mayores. La supervivencia de los receptores de trasplante de páncreas mayores de 55 años es aceptable. Puede existir menos rechazo. El mayor problema en estos pacientes es la patología cardiovascular no reconocida. La selección del paciente, tras un estudio riguroso, es de crucial importancia para que los resultados a largo plazo del trasplante de páncreas sean buenos.
La edad cronológica, por sí sola, no debe excluir a un paciente como candidato a trasplante de páncreas [35] [36].
EVIDENCIAS
No hay evidencia para priorizar el injerto según la edad del receptor (2B) [7].
La recomendación del grupo PROMETEO es que a la hora de realizar trasplante SPK en receptores mayores de 55 años, deberíamos NO priorizar a estos pacientes como candidatos a trasplante frente a receptores jóvenes en lista de espera de un trasplante DDKA. CALIDAD BAJA. OPINIÓN.
3.2.2. Criterio de inclusión para trasplante SPK.
El trasplante de páncreas es la mejor solución para el tratamiento de la DM y volver a la situación de normoglucemia al restaurar las células beta productoras de insulina [37].
La obesidad, las enfermedades cardiovasculares, la enfermedad vascular periférica, el tabaquismo y la fragilidad son algunas de las condiciones que deben abordarse antes de incluir a un paciente en lista de espera de trasplante [18].
Los receptores de trasplante con antecedentes de DM son, por definición, pacientes de “alto riesgo” para el trasplante. Deben intensificarse los estudios pretrasplante haciendo énfasis en la esfera cardiovascular: ECG, ETT, SPECT y/o ECO-dobutamina. Según los hallazgos valorar la necesidad de coronariografía o TAC coronario como alternativa al cateterismo; además de Angiotac, para descartar arteriopatía periférica y eco Doppler carotídeo si existen antecedente de ACV [36]. Se debe considerar ampliar el límite de edad en los receptores sin complicaciones cardiovasculares [36].
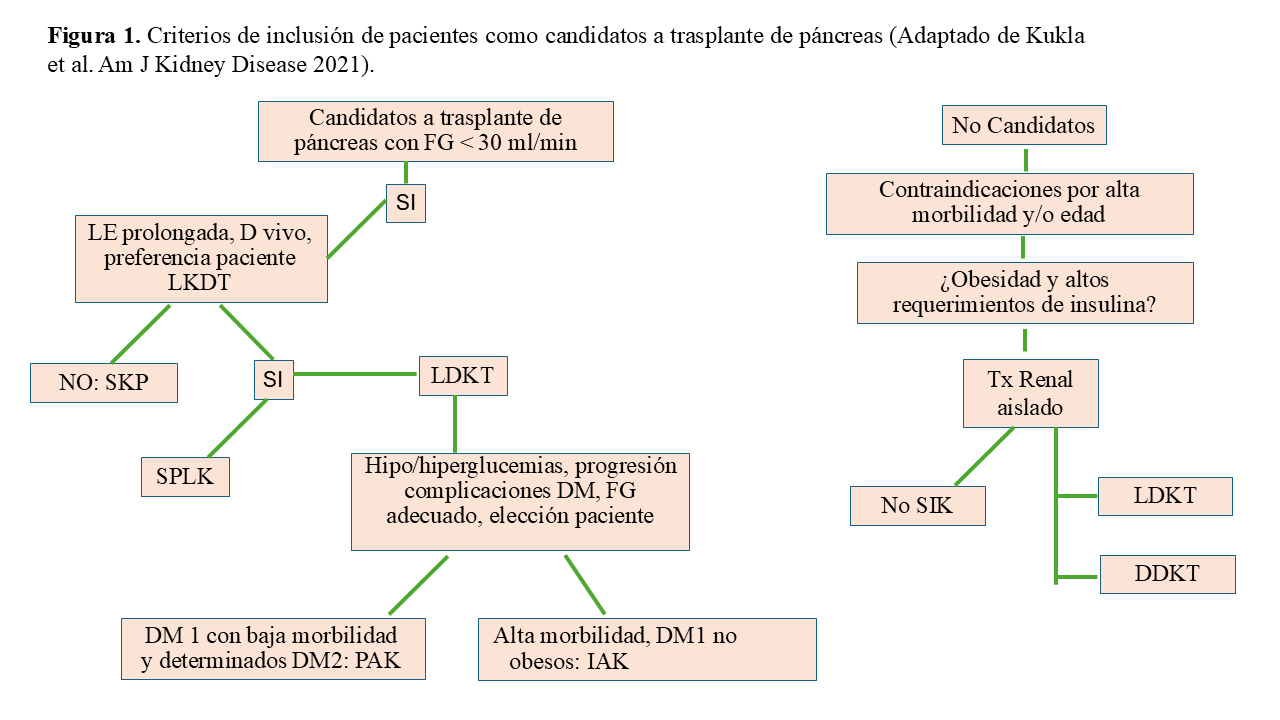
Los autores plantean el trasplante SPK como alternativa al tratamiento de pacientes que se etiquetan inicialmente de DM tipo 2, pero que son insulinodependientes (Edad < 55-60 años, IMC < 30 kg/m2, terapia con insulina > 10 años, péptido C < 3 ng/mL), y se podrían considerar como un grupo similar a los pacientes con DM tipo 1 [38] (Figura 1).
EVIDENCIAS
En pacientes seleccionados, los resultados del trasplante SPK son similares en receptores más jóvenes, y más ancianos. No hay evidencia para priorizar la asignación del injerto según la edad del receptor (2B) [7].
3.2.3. Compatibilidades HLA.
En los estudios publicados, no hubo diferencias en la supervivencia del paciente y del injerto renal entre los receptores 0MM DDKA y los receptores con trasplante LDKA y SPK con
MM. Por lo tanto, los pacientes con DM tipo 1 que esperan un trasplante SPK pueden considerar aceptar un 0MMDDK si hay una oferta disponible [39].
EVIDENCIAS
No se ha demostrado que la existencia de incompatibilidades HLA influya en la supervivencia del paciente o del injerto, pero sí en la aparición de rechazo agudo (2C) [7] [39] [40]. Reducir las incompatibilidades HLA B Y DR se asocia con menos rechazo agudo (2C) [7] [40].
3.2.4. Seguimiento postrasplante.
La biopsia de páncreas es fundamental para diagnosticar y tratar con precisión el rechazo del páncreas. No se aconseja usar la biopsia del injerto renal para diagnosticar el rechazo pancreático en receptores de trasplantes SPK [41].
Realizar una biopsia de páncreas además de la biopsia renal proporciona información útil que puede tener un impacto importante en el manejo del paciente [42].
La falta de concordancia entre la biopsia renal y de páncreas, las discrepancias en el grado y tipo de rechazo, respaldan la justificación de las biopsias de páncreas [43] [44].
Los ADS ayudan a monitorizar el riesgo de rechazo, junto a otros parámetros sanguíneos (lipasa, péptido C, HbA1c..), La frecuencia con que se determinan los ADS depende del riesgo inmunológico [41].
La detección oportuna de ADS mediante exámenes periódicos y el tratamiento temprano del rechazo del páncreas puede, en última instancia, mejorar los resultados del injerto [45] [46].
Las pruebas de imagen (recomiendan TAC con contraste) son importantes para el diagnóstico diferencial y monitorizar el tamaño del injerto dando una idea de la cronicidad que puede tener [41].
La medición de dd-cfDNA mediante un simple análisis de sangre no invasivo podría incorporarse a la práctica clínica para ayudar a informar del manejo del injerto en pacientes con trasplante SPK [47].
EVIDENCIAS
El uso de la biopsia de protocolo del páncreas en los trasplantes SPK, PAK o PTA puede ayudar a la vigilancia en los receptores de trasplante de páncreas. El uso de la biopsia de vigilancia sigue siendo específico del centro. La combinación con determinación de ADS es aconsejable. CALIDAD BAJA. OPINIÓN [7].
La aparición de ADS en receptores de trasplantes de páncreas se asocia con mayores tasas de rechazo y fracaso de los injertos en pacientes con trasplante de páncreas (SPK, PTA, PAK), afectando potencialmente a la supervivencia (2C) [7] [45] [46].
En consecuencia, la monitorización de los ADS tras el trasplante de páncreas es recomendable (SPK, PTA, PAK) (2C) [7] [45] [46].
3.2.5. Monitorización de la recurrencia autoinmune en pacientes con trasplante de páncreas.
La recurrencia de la DM tipo 1 no es infrecuente (7.6%), a pesar de la inmunosupresión. La identificación de los factores de riesgo de recurrencia (ausencia inducción, seroconversión, Ac frente al transportador 8 del Zn, receptor HLA DR3, parejas D/R que compartían HLA DR3/DR4) puede ser útil en la clínica y favorecer nuevos avances terapéuticos [48].
Son herramientas para evaluar la recurrencia:
· Autoanticuerpos: anticuerpos anti-insulina, anticuerpos anti-tirosina fosfatasa de membrana (Ac anti IA2), Anticuerpos anti-descarboxilasa ácido glutámico (Ac anti GAD). Periodicidad anual.
· Biopsias de páncreas [48] [49]. Puede utilizarse para establecer el diagnóstico de recurrencia autoinmune de la diabetes en pacientes con anticuerpos en aumento y/o deterioro de la función pancreática.
· Células T autorreactivas con fenotipo células memoria en sangre periférica/ nodos linfáticos, injerto pancreático [48].
EVIDENCIAS
La realización de biopsias de protocolo sin alteraciones analíticas o sospecha clínica de recurrencia, depende del protocolo específico del centro (2C) [7].
4. SEGUIMIENTO POST-TRASPLANTE DE LOS RECEPTORES DE TRASPLANTE DE PÁNCREAS E INMUNOSUPRESIÓN.
4.1. PROFILAXIS POSTOPERATORIA EN EL TRASPLANTE DE PÁNCREAS- RIÑÓN.
4.1.1. Profilaxis antitrombótica.
Una de las causas más frecuentes de pérdida del trasplante pancreático (más frecuente en el caso de trasplante PTA) es la trombosis del injerto, con una frecuencia entre 10-20% [50]. Debido a la falta de evidencia de alta calidad, no está claro si existe alguna terapia que reduzca la tasa de trombosis temprana del injerto en cualquier tipo de trasplante de órgano sólido. La heparina no fraccionada puede aumentar el riesgo de hemorragia grave en los receptores de trasplantes renales; sin embargo, esto se basa en evidencia de certeza baja [51]. No se han llevado a cabo ensayos randomizados analizando los riesgos y beneficios de uso de la profilaxis antitrombótica en el trasplante de páncreas [51].
EVIDENCIAS
Los expertos recomiendan que todos los trasplantes de páncreas reciban profilaxis antitrombótica por protocolo, aunque no hay evidencia para definir qué profilaxis debe usarse ni si es más recomendable anticoagular o antiagregar (OPINIÓN) [7].
4.1.2. Profilaxis antiviral.
Los receptores de trasplante de páncreas tienen un riesgo elevado de infección por CMV, fundamentalmente, por el uso de inducción con antilinfocitarios, y por el tratamiento de mantenimiento con esteroides [7].
La profilaxis frente a CMV es efectiva para limitar la enfermedad por CMV en los trasplantados de páncreas [7].
CMV QNAT es el método de laboratorio preferido para la vigilancia del CMV y guiar la terapia anticipada. El diagnóstico de la mayoría de las enfermedades por CMV de órganos debe confirmarse mediante histopatología.
No se han llevado a cabo estudios específicos comparando profilaxis frente a terapia anticipada en el trasplante de páncreas. En un estudio retrospectivo de pacientes con trasplante SPK la profilaxis durante 3 meses se asoció con menor enfermedad por CMV que la terapia anticipada (7% vs. 23%) [52]. Se debe administrar profilaxis antiviral con valganciclovir o ganciclovir i.v en los pacientes que reciben anticuerpos depletores de linfocitos [53].
La recomendación sobre la duración de la profilaxis (3 o 6 meses) se ha basado en estudios realizados en trasplantados renales, ya que no se han realizado estudios comparativos de duración en trasplantados de páncreas [53].
EVIDENCIAS
Las recomendaciones de expertos prefieren la profilaxis a la terapia anticipada en la mayoría de los pacientes con trasplante SPK (2B) [7] [53].
En Donante +/Receptor – o Receptor +: Se prefiere la profilaxis antiviral con valganciclovir (preferido) o ganciclovir iv a la terapia anticipada. Duración: 3¿6 meses (2A) [7]. La terapia anticipada es una opción si se realiza monitorización mediante CMV QNAT semanal durante 12 semanas después del trasplante PTA o SPK, y si se alcanza un umbral positivo para CMV, tratar con (a) valganciclovir 900 mg v.o /12 h (preferido), o (b) ganciclovir i.v 5 mg/kg/12 h, hasta negativización.
4.1.3. Profilaxis antimicótica y antimicrobiana en los receptores de trasplante SPK.
Las infecciones (bacterianas, fúngicas y víricas) representan una causa frecuente de morbilidad y mortalidad en los pacientes que reciben un trasplante de páncreas, principalmente el primer año [54].
El riesgo de infección es mayor dentro de los primeros 1 a 3 meses después del trasplante de páncreas, pero no parece diferir según el tipo de trasplante: SPK, PAK o PTA [55].
Las infecciones bacterianas y fúngicas disminuyen la supervivencia del injerto y del paciente.
EVIDENCIAS
Se recomienda la profilaxis antimicrobiana (1B) [7] y antimicótica (NO GRADUACIÓN) [7], según el protocolo del centro, en receptores de trasplante de páncreas, aunque no se dispone de información específica de su eficacia [54].
4.2. INMUNOSUPRESIÓN EN EL TRASPLANTE DE PÁNCREAS-RIÑÓN.
4.2.1. Pautas de inducción y complicaciones de las mismas.
La terapia de inducción se utiliza en la mayoría de los programas de trasplante de páncreas (80-90%). La pauta de inducción más utilizada es la que incluye agentes antilinfocitarios (70%) [56] [57] [58]. La inducción con fármacos antilinfocitarios se asocia a menor incidencia de rechazo agudo frente a los fármacos no antilinfocitarios [57] [58], permiten minimizar los esteroides e incluso su retirada, pero a expensas de mayor incidencia de leucopenia e infección por CMV (16- 46% agentes antilinfocitarios vs 7% no antilinfocitarios) [56], sin aumentar la incidencia de neoplasias, u otras enfermedades infecciosas [58]. Ambas terapias de inducción se asocian con excelente supervivencia del paciente y del injerto a largo plazo [58].
EVIDENCIAS
La terapia de inducción está asociada con mejor pronóstico inmunológico frente a la no realización de tratamiento de inducción (IB) [7].
La inducción con anticuerpos antilinfocitarios, frente a terapias que no incluyen inducción, se asocia con mayores tasas y gravedad de las infecciones postrasplante tempranas que no dan lugar a resultados clínicos inferiores (2B) [7].
En receptores de bajo riesgo inmunológico (PRA < 10%) no hay clara evidencia de que la terapia de inducción frente a la ausencia de inducción se asocie con mejor pronóstico inmunológico (2C) [7].
No se conoce con precisión el efecto a largo plazo del tratamiento de inducción sobre el riesgo de desarrollar neoplasias en el trasplante de páncreas (2B) [7].
La recomendación del grupo PROMETEO es que puede utilizarse en la inducción de los receptores de trasplante SPK tanto anticuerpos anti CD25 como anticuerpos depletores de linfocitos T, dada la ausencia de diferencias en la supervivencia, pero el tratamiento con anticuerpos depletores de linfocitos T se asocia con menos tasas de rechazo agudo. Calidad de la evidencia baja. Recomendación Fuerte.
4.2.2. Utilización de esteroides en el trasplante SPK.
A pesar de los potenciales efectos adversos de los corticoesteroides, la mayoría de los centros continúa usándolos, en los protocolos de inmunosupresión de mantenimiento (70%) de los receptores de trasplante de páncreas [59]. No obstante, hay una tendencia a usar con menos frecuencia la terapia de mantenimiento con esteroides a lo largo de los años [60].
Actualmente, no hay evidencia suficiente sobre los beneficios y daños de la retirada de esteroides en el trasplante de páncreas en los tres ensayos clínicos aleatorizados (144 pacientes) identificados. Los resultados mostraron resultados inciertos en cuanto al riesgo a corto plazo de rechazo, mortalidad o supervivencia del injerto en estrategias de ahorro de esteroides, en un número muy pequeño de pacientes, durante un corto período de seguimiento. En general, los datos fueron escasos, por lo que no es posible sacar conclusiones firmes. Además, los hallazgos de 13 estudios observacionales, generalmente, coinciden con la evidencia encontrada en los ensayos clínicos aleatorizados [61].
El tratamiento de mantenimiento con esteroides se asoció a una mayor incidencia de infecciones postquirúrgicas (abscesos, infección local), pero sin impacto en la supervivencia del paciente ni del injerto en trasplantados de páncreas, tras corrección por múltiples factores. Por tanto, los autores no recomiendan el uso de esteroides de mantenimiento en estos pacientes [60]. En el metaanálisis realizado, que incluye estudios de cohortes y un ensayo clínico randomizado, se observó que la retirada de esteroides tenía beneficios para mejorar la HbA1c y
la presión arterial y para reducir el riesgo de infecciones incluyendo el CMV [61].
EVIDENCIAS
La evidencia disponible no demuestra que evitar los esteroides o la retirada precoz se asocie con peor pronóstico inmunológico en comparación con una política de esteroides en el mantenimiento (1B) [7].
La retirada de esteroides frente al mantenimiento a largo plazo se asocia a mejoría en el perfil metabólico (1C) [7].
La recomendación del grupo PROMETEO es que las pautas de inmunosupresión en los receptores de trasplante SPK, en los que se retiran o evitan los corticoides, tienen efectos beneficiosos en el perfil metabólico, al mantener la secreción de insulina pancreática, con menos riesgo de infecciones. Calidad moderada. Recomendación Fuerte.
En pacientes seleccionados (bajo riesgo inmunológico, inducción con anticuerpos depletores de linfocitos, no episodios previos de RA, primeros trasplantes…) retirar los esteroides, dentro de los 6 primeros meses, es una opción que no implica peor pronóstico inmunológico. Calidad de evidencia baja-moderada. Recomendación fuerte.
4.2.3. Utilización de micofenolato mofetil frente a azatioprina en receptores de trasplante SPK.
Al comparar el empleo de azatioprina frente al micofenolato mofetil, no se observaron diferencias con respecto a las tasas de supervivencia del paciente y del injerto, 6 meses después del trasplante de páncreas, en los estudios publicados. El uso de micofenolato en receptores de trasplante de páncreas se asoció con una menor incidencia y gravedad de rechazo comprobado por biopsia, lo que requirió menos tratamiento antilinfocitario, aunque con más efectos adversos gastrointestinales [62].
Las tendencias para la mayoría de los parámetros de eficacia: menos rechazo agudo, menos rechazo agudo o muerte, menos rechazo agudo, pérdida del injerto o muerte, favorecieron al micofenolato frente a la azatioprina, y el tiempo hasta el rechazo del aloinjerto renal o hasta el fracaso del tratamiento fue estadísticamente significativo mayor para el micofenolato mofetil. El uso de micofenolato mofetil en el tratamiento de los receptores de trasplante SPK es un avance útil [63].
EVIDENCIAS
El uso de formulaciones de micofenolato mejora los resultados inmunológicos de los pacientes con trasplante de páncreas en comparación con la azatioprina (1B) [7].
La evidencia indirecta y los datos retrospectivos muestran que el micofenolato de mofetilo está asociado con tasas más altas de efectos secundarios gastrointestinales que la azatioprina (OPINIÓN) [7].
4.2.4. Papel de los imTOR en los pacientes con trasplante SPK.
Sageshima J, et al. evaluó a receptores de trasplante SPK con inducción dual (timoglobulina/basiliximab) y tacrólimus en dosis bajas más corticosteroides. Se compararon pacientes que recibieron everólimus frente a pacientes que recibieron micofenolato. La supervivencia a corto plazo del paciente y del injerto en receptores de trasplante SPK y la función del injerto de los pacientes tratados con everólimus fue comparable a la de los pacientes tratados con micofenolato mofetil [64]. Los pacientes que recibieron everólimus tuvieron menos episodios de rechazo agudo y menos efectos secundarios en comparación con los pacientes que recibieron micofenolato mofetil [64].
El uso de imTOR, como parte de la inmunosupresión después del trasplante PAK o SPK, se asoció con una mayor supervivencia del aloinjerto a largo plazo, y del paciente hasta el décimo año post-trasplante en el trabajo publicado por Siskind et al. donde se comparó a los pacientes que recibían imTOR frente a los que no [65].
La tasa de supervivencia del páncreas censurada por muerte del receptor a los 5 años fue mejor en el grupo de sirólimus, con menor tasa de episodios de rechazo agudo o severidad del mismo, sin encontrar diferencias a largo plazo en la supervivencia del páncreas entre los pacientes tratados con sirólimus frente a MMF asociado a tacrólimus [66] [67].
El tratamiento con sirólimus ofrece una desventaja, la formación más frecuente de hernias incisionales en el primer año post trasplante, pero que podrían evitarse si se retrasara su inicio [67].
El sirólimus es un fármaco eficaz y bien tolerado en el trasplante SPK, cuando se combina con tacrólimus en dosis media y se retiran los esteroides de forma precoz [67].
La sustitución de tacrólimus por sirólimus (con inducción con timoglobulina y manteniendo MMF y esteroides) a partir del tercer mes ha demostrado supervivencia de los injertos renales y pancreáticos similares entre ambos grupos de pacientes, tasas similares de rechazo, con una tasa muy elevada de retirada de sirólimus por efectos adversos y con una mayor frecuencia de aparición de DSA al año postrasplante [68].
EVIDENCIAS
El uso de imTOR frente a micofenolato, como inmunosupresores primarios, en el trasplante de páncreas se asocia con efectos secundarios específicos y mal tolerados (1B) [7].
En el contexto de datos contradictorios, no hay una respuesta clara sobre si el uso de imTOR frente a micofenolato está asociado con ventajas inmunológicas en los receptores de trasplante de páncreas (NO GRADUACIÓN) [7].
La inmunosupresión con imTOR no está asociada con una ventaja inmunológica en comparación con el empleo de anticalcineurínicos en los receptores de trasplante de páncreas (2C) [7]. Datos preliminares sugieren que el uso de imTOR frente a anticalcineurínicos podría estar asociado con mayor formación de ADS en receptores de trasplante de páncreas (2B) [7].
La recomendación del grupo PROMETEO es que podría valorarse el empleo de imTOR en el trasplante SPK como inmunosupresión primaria en sustitución de MMF una vez hayan transcurrido los tres primeros meses del trasplante. Calidad de evidencia baja-moderada. Recomendación Fuerte.
4.2.5. Pautas de inmunosupresión de mantenimiento en el trasplante SPK.
Según los datos del registro americano, la mayoría de los trasplantes de páncreas reciben tratamiento de mantenimiento con tacrólimus y micofenolato (90%), previa inducción con anticuerpos antilinfocitarios, y hasta en un 70% corticoides [59].
Los anticalcineurínicos continúan siendo el tratamiento inmunosupresor de primera línea, utilizándose con más frecuencia tacrólimus que ciclosporina [69].
En un estudio prospectivo randomizado, tacrólimus fue más eficaz que ciclosporina para prevenir el rechazo moderado o grave de riñón o páncreas después del trasplante SPK. También proporcionó una supervivencia superior del injerto pancreático y redujo el riesgo de trombosis del páncreas [70].
Los datos limitados con tacrólimus combinados con sirólimus revelan resultados excelentes, mientras que los intentos iniciales de evitar o minimizar los inhibidores de la calcineurina son menos prometedores [57].
EVIDENCIAS
El uso de tacrólimus es frecuente en el trasplante de páncreas, ya que logra mejores resultados inmunológicos en comparación con la ciclosporina (1C) [7].
La recomendación del grupo PROMETEO sobre la inmunosupresión de mantenimiento es: utilización inicial de corticoides, con retirada precoz de los mismos (si no existe riesgo inmunológico aumentado, dentro de los 6 primeros meses), asociado a un anticalcineurínico y micofenolato o introducción tardía de imTOR (a partir del tercer mes). CALIDAD MODERADA. RECOMENDACIÓN FUERTE.
4.2.6. Tratamiento del rechazo agudo en los receptores de trasplante SPK.
La incidencia acumulada de rechazo agudo en el trasplante de páncreas con inducción y triple terapia con tacrólimus, micofenolato y corticoides es del 15% al primer año, 27% el quinto año y 29% el décimo año, siendo más frecuentes en los receptores de trasplante PTA y en los trasplantes PAK [71].
El rechazo agudo del páncreas aumenta el riesgo de pérdida parcial o completa de la función del injerto pancreático. El momento en que se observa el rechazo agudo puede influir en el fracaso posterior del injerto [71].
El rechazo agudo celular de páncreas grado I, generalmente, puede tratarse exitosamente con esteroides, mientras que el rechazo grado II y III debe tratarse con esteroides más anticuerpos antilinfocitarios [73].
El rechazo agudo mediado por anticuerpos aparece hasta en un 10% de los trasplantes de páncreas a lo largo del primer año, siendo más frecuente en el trasplante PAK frente al trasplante SPK [72].
El tratamiento habitual del rechazo mediado por anticuerpos del injerto pancreático se ha extrapolado del trasplante renal, realizándose habitualmente con inmunoglobulinas i.v, plasmaféresis ± rituximab, aunque no se han llevado a cabo estudios específicos para evaluar su eficacia [73].
EVIDENCIAS
No hay evidencia para recomendar cuál es el mejor tratamiento de los episodios recurrentes de rechazo. Debe tratarse de forma individualizada, aunque se sugiere utilizar agentes antilinfocitarios (NO GRADUACIÓN) [7].