Nutrición en la Enfermedad Renal Crónica old
Palabras clave
Nutrición, Desnutrición, Sobrepeso, Déficit energético proteico, Ingesta proteica, carga ácida, ingesta de fósforo, potasio, Nutrición en hemodiálisis, manejo nutricional, nutrición en ERCA, dieta hipoproteica
ÍNDICE
INTRODUCCIÓN
Como parte de las medidas higiénico-dietéticas, el asesoramiento nutricional debe ser la primera recomendación al paciente. Los cuidados dietéticos siempre se han considerado importantes en la enfermedad renal crónica (ERC), tanto como medida renoprotectora antiproteinúrica en la etapa prediálisis; como para prevenir el sobrepeso y la desnutrición en todos los estadios, especialmente esta última en los pacientes en diálisis. La primera premisa es garantizar un adecuado soporte calórico, proteico y mineral. Nunca el precio a pagar por una dieta presuntamente adecuada, debe ser una nutrición insuficiente. Las recomendaciones de nutrientes deben adecuarse al peso ideal -no real- y corregirse para el gasto energético y la actividad física del paciente.
Dicho esto, conviene adelantar la siguiente reflexión: Clásicamente las restricciones dietéticas impuestas al paciente en diálisis son muy severas, y en buena medida se han trasladado al paciente en estadios más precoces. En realidad estas dietas han demostrado sutiles beneficios, pero no un impacto determinante sobre la supervivencia. La dieta del paciente renal puede ser peligrosamente restrictiva, si se basa en la disminución importante en la ingesta de proteínas como medida renoprotectora, baja en fósforo y calcio; pero al mismo tiempo se limita la ingesta de sodio, y de verduras y frutas por el temor al potasio . Estamos ante unas recomendaciones difíciles de conciliar, que pueden conducir de forma equívoca a una dieta menos saludable, perdiendose el efecto beneficioso de vitaminas, minerales y fibra. Asimismo, tanto los ayunos prolongados que inducen insulinopenia, acidosis e hiperkalemia; como la restricción de comer durante la diálisis -momento que suele cursar con ansiedad y apetito-, puede resultar más perjudicial que beneficioso . A todo esto, debemos añadir que el riesgo de sobrecarga de volumen en pacientes con ERC avanzada (ERCA) estadio 4 (E4) y estadio 5 (E5) no en diálisis, principalmente en pacientes cardiópatas, ha llevado a contener la ingesta líquida, en una población que naturalmente mantiene un alto flujo urinario.
De ahí que en la presente revisión y apoyándonos en datos previos , animemos a evitar modelos dietéticos estrictos, e individualizar una relajación juiciosa de las recomendaciones, en un mundo en el cual los placeres culinarios tienen un fuerte impacto en la calidad de vida.
HIDRATACIÓN
La hidratación en la ERCA se trata en formato extenso en otro apartado [1] [2] [3] [4] [5]. Para el pacientes en diálisis se recomienda tomar tanto líquido como elimine con la orina en ese periodo, más 500-750 cc adicionales [6] (Tabla 1). En términos del peso del paciente, la ganancia interdialítica no debería exceder del 4-5% de su peso seco [7]. En DP el balance líquido es contínuo, pero la capacidad de ultrafiltración peritoneal es limitada, por lo que se recomienda una restricción líquida moderada y ajustada a los balances peritoneales [8]. Véase Hidratación en la Enfermedad Renal Crónica
INGESTA SALINA
La limitación de la ingesta salina es una indicación clásica, tanto en pacientes con ERCA, como en tratamiento renal sustitutivo [9] [10] [11] estando incluso relacionada con la progresión acelerada del daño renal [12]. Es importante para prevenir la retención hidrosalina, coadyuvante en el control de la tensión arterial, e incluso reduce la proteinuria y facilita el efecto de los bloqueantes del eje renina-angiotensina [13] [14] [15] [16] [17].
Debemos considerar como muy importante, el poder verificar objetivamente la ingesta salina para favorecer la adherencia a esta prescripción. El método más asequible para vigilar la ingesta salina es la eliminación urinaria de sodio y debemos hacer hincapié en la importancia de medir el sodio urinario durante las revisiones habituales en consulta. Ahora bien, ¿es útil el sodio urinario como indicador de la ingesta de sal? No es fácil encontrar respuesta en la literatura, y la información debe buscarse en los libros clásicos de fisiología humana. En condiciones normales, la excreción fecal de sodio es inferior al 0,5% del contenido intestinal del ion, gracias a su rápida y efectiva absorción por la mucosa intestinal. Por lo tanto, si consideramos que casi la totalidad del sodio ingerido es absorbido por el intestino, tenemos que la eliminación urinaria de sodio es un buen reflejo de la ingesta de sal. Aunque existe siempre el riesgo de una inadecuada recolección de orina de 24 horas, varios estudios han destacado que es el método más práctico para verificar la ingesta de sal [18] [19] [20] [21] [22].
Las Guías KDIGO [10] para enfermos con ERC se limitan a recomendar una ingesta de sodio < 2 gr/día, es decir < 5 gr de sal. Estas recomendaciones son las propuestas para la población general por la OMS (http://www.euro.who.int/en/who-we-are/governance/regional-committee-for-europe/past-sessions/sixty-first-session/documentation/working-documents/wd12-action-plan-for-implementation-of-the-european-strategy-for-the-prevention-and-control-of-noncommunicable-diseases-20122016). Las nuevas KDOQI de 2020 sitúan la ingesta máxima diaria de Na en 2,3 gr (6 gr de sal, 100 mEq) [23]. Sin embargo, la ingesta habitual de sal en la población general es de 9-12 gr/día, incluso mayor en muchas regiones; y que se corresponden con una eliminación urinaria de Na de 160-200 mEq/día o más [22]. Conseguir una ingesta salina de 6 gr al día (80-100 mEq de sodio/día), es una opción posibilista, pero muy difícil de alcanzar cuando nos fijamos en la eliminación urinaria de Na, incluso en pacientes adherentes.
BALANCE ENERGÉTICO Y MANEJO DEL SÍNDROME METABÓLICO
En buena parte va dirigido a modificar los hábitos de vida. Además de recomendar la abstinencia de los hábitos tóxicos y la actividad física acorde; prevenir el déficit nutricional y el control del sobrepeso deben ser pautas prioritarias. Esta última cada día cobra más relevancia para prevenir la progresión del síndrome metabólico, que tiene lugar en una proporción importante de pacientes con ERC.
El gasto energético en pacientes con ERCA o en diálisis, estables, es semejante a sujetos normales, y por lo tanto, también lo son sus requerimientos calóricos, o sea, 30-35 Kcal/kg ideal/día aproximadamente [6] [24] [25] [26] [27].
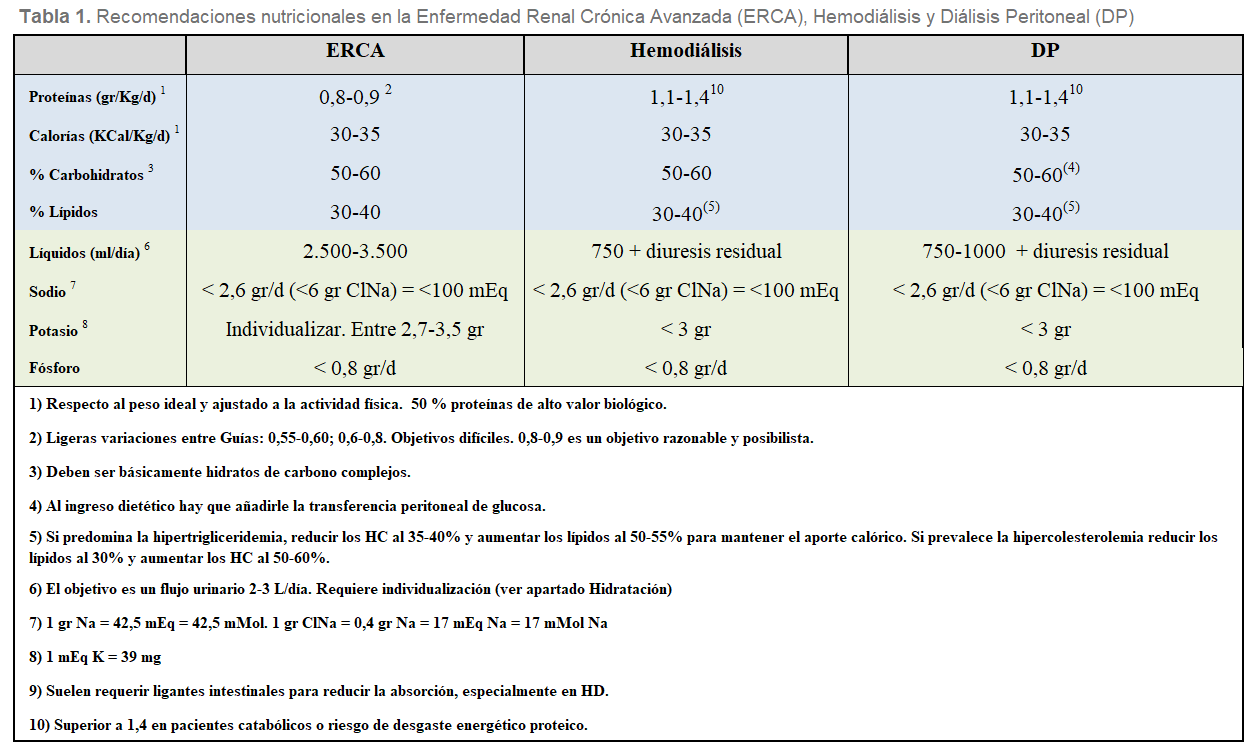
En líneas generales, el 50-60 % de las calorías debe ser en forma de carbohidratos (HC), es decir unos 275 gr (1.100 Kcal); preferiblemente complejos, de absorción lenta, para disminuir la síntesis de triglicéridos y mejorar la tolerancia a la glucosa. El 30-40 % restante, unos 100 gr (700 Kcal), se aportan en forma de ácidos grasos de predominio no saturado. Se recomienda mantener la siguiente proporción: Saturados <7%; poliinsaturados hasta 10% y monoinsaturados hasta 20% [28]. Estos nutrientes deben adecuarse conforme el estado lipídico e hidrocarbonado del paciente. En la (Tabla 1) y en la (Figura 1) se representan de forma esquemática las recomendaciones generales básicas del reparto de nutrientes y calorías para paciente con ERC E4-5 y en diálisis.
La obesidad debe ser combatida de forma activa (IMC< 30 Kg/m2) como medida reno y cardio protectora, para prevenir el síndrome metabólico; como también para considerar la inclusión en lista de espera de trasplante renal. La pérdida de peso, debe realizarse bajo control del especialista en nutrición. De forma general, y a modo orientativo, se sugiere una restricción calórica diaria de 250-500 Kcal.
INGESTA PROTEICA
Las recomendaciones de ingesta proteica varían en función del estadio del paciente. En la ERCA se recomienda una restricción moderada de la ingesta de proteínas; en paciente en diálisis, las ingestas deben ser mayores para compensar el carácter catabólico de la técnica (Véase Enfermedad renal crónica).
Restricción de proteínas en la ERCA
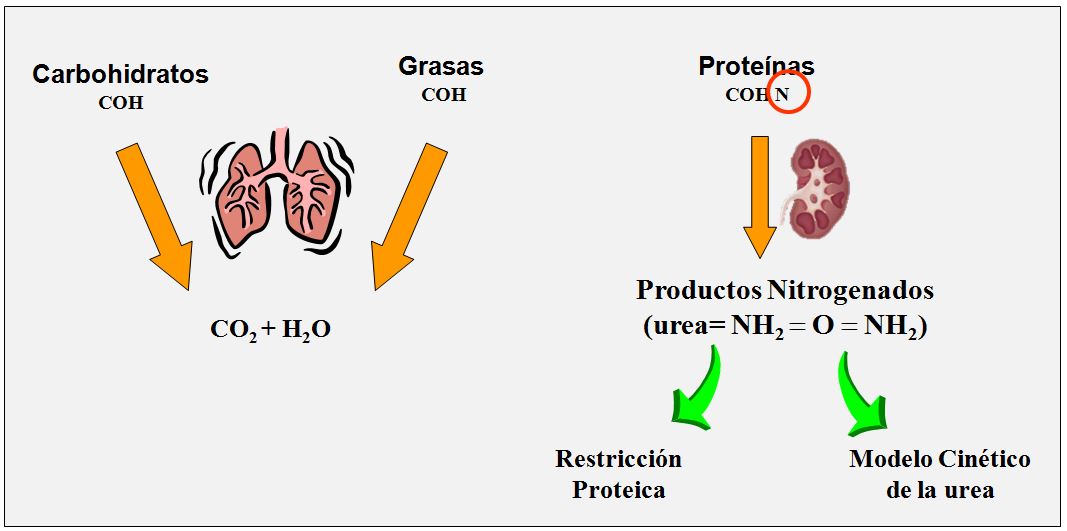
El riñón es la vía natural de eliminación de los productos nitrogenados. Se basa en que, a diferencia de azucares y grasas cuyo producto final es H2O y CO2, el producto final del metabolismo proteico es el nitrógeno, que se elimina principalmente por vía renal, en forma de urea (Figura 2). Con la progresión de la insuficiencia renal estos productos nitrogenados (junto a fosfatos, sulfatos y ácidos orgánicos) se acumulan en proporción a la perdida de la función renal [29]. Esto no solamente dio origen al principio de restricción de proteínas, sino también al modelo cinético de la urea para establecer la dosis de diálisis. De hecho la restricción proteica ha prevalecido durante décadas (desde 1918) y ha sido la piedra angular del tratamiento cuando no existía la diálisis.
Numerosos trabajos experimentales han demostrado los efectos renoprotectores de la reducción de la ingesta proteica, como también el efecto sinérgico que tiene con reducción de la ingesta salina, junto al uso de los bloqueantes del eje renina-angiotensina [30].
En el ámbito clínico, se dispone de abundante información a los trabajos publicados a favor de los beneficios de la restricción proteica en la uremia, aunque la inmensa mayoría han sido retrospectivos o no controlados y por lo tanto con escaso nivel de evidencia. Sin embargo, el ensayo clínico prospectivo y randomizado de Klahr S y col [31], junto a posteriores subanálisis [32] [33], y tres meta-análisis [34] [35] [36] han demostrado de forma convincente las ventajas renoprotectoras -aunque modestas- de la restricción proteica [35]. Se estima que la dieta hipoproteica retrasa la progresión de la ERC en aproximadamente 0,5 mL/min/año. Este concepto no sería aplicable a los pacientes con poliquistosis renal, muy dudoso en nefropatías no proteinúricas; pero especialmente beneficioso en la nefropatía diabética [34].
Los mecanismos antiproteinúricos propuestos son de dos tipos: 1) hemodinámicos, por reducción de la hiperfiltración [30]; y 2) metabólicos, reduciendo la generación de citoquinas y activando genes implicados en producción de matriz mesangial [34]. En el terreno experimental, está demostrado que los efectos adversos de una elevada ingesta proteica guardan relación con el incremento del filtrado glomerular, la hipertrofia glomerular y la proteinuria, o la preservación de la autoregulación [37] [38]. En la (Tabla 2) se muestran los potenciales efectos beneficiosos de la restricción proteína de forma global [39].
La OMS determinó que la ingesta proteica mínima para mantener un balance proteico equilibrado es de 0,6 gr/kg/día. En general, las recomendaciones de ingesta proteica en la población general son de 0,6-0,8 gr/kg/día, y así se han trasladado al paciente con ERCA [40]. Las Guías KDOQI 2020 [23] ajustan la recomendación de ingesta proteica a 0,55-0,60 gr/Kg/día. Sin embargo, en el terreno práctico estas dietas son bastante restrictivas para nuestros hábitos nutricionales. Una dieta de 0,8-0,9 gr/kg peso ideal/día resulta una propuesta razonable y posibilista en pacientes con ERCA [7] [36] [41] [42] [43] [44] (Tabla 1) y (Figura 1).
El empleo de los ceto e hidroxianálogos -que deberían combinarse con una dieta de 20-30 gr de proteínas- han demostrado beneficios adicionales en algunas publicaciones [44]. Sin embargo, son virtualmente impracticables en pacientes con sensación subjetiva de bienestar y apetito, y no se ha consolidado su recomendación [24] [26] [43] [44] [45].
Los beneficios renoprotectores de la restricción proteica son objeto de debate desde el trabajo de Klahr S y col (1994) [31] y han sido recientemente revisados por Combe Ch et al [46]. Estos potenciales beneficios, aunque discretos, han sido reconocidos en todas las Guías de práctica clínica [46].
Un amplia estudio revisión de variada intervención dietética en la ERC, señala efectos beneficiosos de la restricción proteica en el mejor control de la TA, filtrado glomerular y LDL colesterol; aunque sus efectos son modestos [47].
Otra revisión también basada en Cochrane, destaca que la muy baja ingesta proteica comparado con baja ingesta proteica, puede reducir el número de pacientes que inician tratamiento renal sustitutivo, pero también la evidencia fue moderada, y la adherencia a esta dieta es francamente baja y afecta la calidad de vida de los pacientes [48].
Ambos estudios concluyen en la necesidad de ensayos clínicos a gran escala para verificar definitivamente la eficacia de esta intervención dietética en el enfermo renal.
Nuestra opinión es mantener una moderada restricción proteica, adaptada a los hábitos del paciente, evitando implementarla en enfermos con gran comorbilidad, riesgo de malnutrición y limitada expectativa de vida.
Asimismo, la dieta vegana, puede ser bien aceptada por estos paciente y puede recomendarse aplicarse con cautela en enfermos con estos hábitos nutricionales o que lo soliciten [49].
Recomendaciones en diálisis
Dado el carácter catabólico de la técnica, las recomendaciones de ingesta proteica en el paciente en diálisis, son algo más elevadas que en la población general. Las guías de práctica clínica coinciden que los requerimientos proteicos del paciente en HD son de 1,1-1,2 gr/kg de peso ideal/día, hasta 1,4 según las series; y en DP ligeramente mayores, 1,2-1,5 gr/kg de peso ideal/día, con un 50% de proteínas de elevado valor biológico [10] [30] [50] [51] [52] [53] (Tabla 1) y (Figura 1). Estas sugerencias varían sutilmente en las distintas Guías, incluso en editoriales de los mismos autores, aunque siempre es recomendable superar los 1,4 gr/kg de peso ideal/día en pacientes catabólicos o con signos de desgaste energético proteico [30] [54].
INGESTA DE FÓSFORO
Se considera que el balance de fósforo (P) en un adulto normal se consigue con una dieta de P de 800-1.600 mg/día. De forma global, en pacientes con ERCA la ingesta de P recomendada no debería superar los 800 mg/día [7] [55] [56]. Los aportes de P están muy relacionados con la ingesta proteica, existiendo una correlación muy estrecha entre la ingesta de P y de proteínas, como así también en la eliminación urinaria de nitrógeno y P [57] [58]. En pacientes con ERCA, donde la ingesta proteica recomendada es de 0,8-0,9 gr/kg/día o incluso menor, ésta se corresponde con una ingesta de 800-900 mg de P [59]. Por ello, es difícil la restricción del fósforo sin una restricción de la ingesta proteica, en particular de origen animal.
Este problema se hace presente en el paciente en diálisis, donde una ingesta de proteínas de 1,1-1,4 gr/kg peso ideal/día se acompaña, normalmente, de una ingesta de P de aproximadamente de 1.000 mg o incluso mayor. Una dieta de 1.200 mg P al día debe considerarse como inapropiadamente elevada [60].
En este sentido, el objetivo debe ser conseguir el nivel de P más bajo posible en la dieta, asegurando una ingesta proteica adecuada. Las guías K/DIGO del metabolismo mineral [10] [55] [56] recomiendan un aporte de P de 10 a 12 mg de fósforo por gramo de proteína. Este cociente obtenido de un cuestionario de ingestas, fue estudiado por Noori N et al [57], quienes hallaron una asociación directa entre este cociente y la supervivencia. Los autores destacaron que un cociente superior a 16 mg P/gr proteína incrementaba un 30% el riesgo de mortalidad en pacientes en HD.
En la tabla 2 del artículo de Kalantar-Zadeh K et al [30] destaca que la ingesta de P debe ser inferior a 800 mg/día en todos los estadios. Este es un objetivo muy complicado de alcanzar en el paciente en diálisis; con mayores necesidades proteicas. Si atendemos los trabajos de Noori N. et al [57], deberíamos procurar que la ingesta de P no sea superior a 12 mg de P/gr de proteínas. Con ello, para una dieta de 1,2 gr/Kg/día de proteínas, aún con las clásicas recomendaciones para el P, la ingesta se mantendrá en 800-1000 mg/día, ello sin contar los aditivos. De ahí que el uso de captores de P será muy frecuente, en pacientes con adecuado aporte proteico.
Una adherencia razonable a esta restricción de P, se consigue con una restricción de proteínas animales, haciendo especial hincapié en la reducción de lácteos. Es destacable que el P orgánico se absorbe un 50%, y que la proporción absorbida es mayor en las proteínas de origen animal que vegetal [57] [60] [61]. Asimismo, el contenido de P es mayor en los lácteos que en los restantes nutrientes. De forma orientativa, digamos que los lácteos proporcionan ±20 mg P/gr proteínas, las carnes y legumbres: 10-15 mg P/gr proteína y algo menos los pescados y mariscos [57] [60]. Recientemente se han publicado unas tablas de cociente P/proteínas de utilidad para la población española, que aunque no incluye los aditivos de los alimentos, es de enorme utilidad para conocer los alimentos con menor contenido de P, respecto a la cantidad de proteínas [62]. Estas tablas nos pueden ayudar a elegir productos con un bajo ratio P/proteínas (< de 15 digamos).
Otra fuente importante de P es el elevado contenido en los aditivos, tales como las conservas, congelados y bebidas gaseosas [66]. Las carnes precocinadas, curadas o con aditivos son una fuente importante de P y Na. Además el P contenido en los aditivos se absorbe en un 90 % y pueden aumentar la ingesta de fósforo entre 0.5-1 gr/día [63]. La restricción de alimentos ricos en aditivos puede tener un claro efecto favorable en el control de la hiperfosforemia [63]. En la (Tabla 3) se muestran una serie de recomendaciones adicionales para optimizar el control del P.
INGESTA DE CALCIO
Los requerimientos de calcio (Ca) en un adulto sano se han establecido entre 800 y 1.000 mg/día. En la ERC la absorción intestinal de Ca disminuye como consecuencia del déficit de calcitriol. Por lo tanto, se han postulado requerimientos algo mayores, aproximadamente de 1.200-1.600 mg/día. Las Guías de práctica clínica han recomendado que la suma de todas las entradas de Ca elemento debería ser de 1.000-1.500 mg/día, tolerando hasta 2.000 mg/día [7]. Sin embargo, estas cifras conllevan, en general, una elevada entrada de proteínas y de P. Asimismo, existen evidencias de que los suplementos de Ca se asocian a un incremento de las calcificaciones vasculares tanto en la población general [64] como en el paciente en diálisis [65], relacionando esta última con la ingesta de captores cálcicos. Por todo ello, progresivamente se han ido reduciendo las recomendaciones de ingesta cálcica o de la administración de suplementos.
En este sentido, en la ERCA la restricción proteica, especialmente de lácteos, ha contribuido a controlar la ingesta de P. Una ingesta proteica estándar para un enfermo ERCA, de 50-60 gr de proteínas, conlleva un aporte de Ca de 400-800 mg, aparentemente subóptimo. Sin embargo, la tendencia actual ante el riesgo de calcificaciones vasculares, es optimizar los aportes de proteínas y P de forma prioritaria. Los suplementos de Ca deben individualizarse en función de los parámetros bioquímicos (Ca, PTH) y el riesgo de calcificación vascular. Trabajos más recientes sugieren una ingesta de Ca elemento de 800-1.000 mg/día [30] [66].
En el paciente en diálisis, una dieta de 1,1-1,2 gr/Kg/día de proteínas contiene entre 600 y 1.000 mg de Ca elemento, en función de la cantidad de lácteos ingeridos. La absorción intestinal de Ca es baja, en torno al 15-30 % y depende en gran medida de la disponibilidad de vitamina D. Los ajustes en la concentración de Ca en el líquido de diálisis y los suplementos orales contribuyen en estos enfermos a optimizar el balance de Ca. Aunque siempre se recomienda individualizar, las guías KDIGO del metabolismo mineral [55] sugieren de forma general, el empleo de una concentración de 5 mg/dl de Ca en el líquido de diálisis.
INGESTA DE POTASIO
Las recomendaciones para el adulto sano son 4.700 mg/dia (120 mEq/día) [67] siendo considerados requerimientos mínimos 1.600-2.000 mg (44-51 mEq). Recordemos que 39 mg = 1 mmol = 1 mEq.
La hiperpotasemia (K>5,5 mEq/L) es una complicación seria en los pacientes en diálisis. Se estima que representa el 3-5% de las muertes en diálisis, y una de cada cuatro emergencias en HD [68] [69]. En pacientes con ERCA y diuresis elevada, el desarrollo de hiperpotasemia es raro. Sin embargo, cifras elevadas de K pueden constatarse en casos de bloqueo por IECA/ARA, empleo de betabloqueantes, acidosis [70] [71], y especialmente en aquellos tratados con diuréticos antialdosterónicos [72]. Además de las complicaciones agudas con alto riesgo de muerte, la hiperpotasemia conlleva otras circunstancias adversas como son: limitación del uso de fármacos renoprotectores, el uso abusivo de captores intestinales de K, o incluso la suspensión de intervenciones quirúrgicas ante un incremento de K por ayuno pre quirófano.
La transgresión dietética es la causa más divulgada y la restricción de alimentos ricos en K la recomendación sobre la que se hace mayor hincapié (http://www.uptodate.com/contents/low-potassium-diet-beyond-the-basics), tanto por parte de los nefrólogos como por los nutricionistas. Se considera inconveniente sobrepasar una ingesta diaria de 3,0 gr/día, es decir unos 75 mEq en pacientes en diálisis.
Sin embargo, el ayuno es una causa poco atendida de hiperpotasemia. Ni las Guías de práctica clínica, ni los tratados de electrolitos, ni el tratado electrónico UPTODATE prestan atención a esta circunstancia. Fue en pacientes diabéticos que desarrollaban insulinopenia, la primera vez que se advirtió del riesgo de hiperpotasemia con el ayuno [73]. Posteriormente, dos estudios metabólicos demostraron el desarrollo de hiperpotasemia tras ayuno en pacientes en hemodiálisis [74] [75]. Es bien conocido que la insulinopenia y la acidosis metabólica, dos situaciones que se dan en caso de ayuno, contribuyen al desarrollo de hiperpotasemia.
CARGA ÁCIDA Y ACIDOSIS
Datos recientes en la literatura hacen hincapié en el control de la carga ácida proveniente de la dieta. La producción de ácidos no volátiles de generación endógena, deriva principalmente de la ingesta de proteínas y fósforo. Por otra parte, la producción alcalina proviene de aniones orgánicos como el citrato y el acetato, que están naturalmente ligados a cationes minerales como el potasio y que se encuentran primariamente en los vegetales y frutas. La diferencia entre ambos produce la carga ácida, que normalmente se elimina por vía renal como amonio y acidez titulable [76]. La carga ácida de una dieta estándar es 1 mEq/kg/día y se estima de forma indirecta desde la ingesta de nutrientes o la eliminación urinaria de cationes y aniones.
En la ERC, con la reducción de la masa nefronal se desarrollan mecanismos adaptativos como es el aumento de la amoniogenesis por nefrona y el aumento de la excreción distal de ácido mediado por el SRAA y endotelina-1, produciendo daño renal [76] [77] [78]. Asimismo, una elevada carga acida produce acidosis subclínica a pesar de bicarbonatemia normal.
Existe sostenida información en la literatura de la acidosis metabólica como factor de riesgo de progresión de ERC [79] [80] [81] [82]. De hecho las Guías KDIGO [10] [55] recomiendan dar suplementos orales de bicarbonato en caso que la concentración sérica sea inferior a 22 mmol/L. Las nuevas Guías KDOQI recomiendan mantenerlo entre 22 y 25 mEq/L [23].
En este sentido, se postula que la manipulación de la producción endógena de ácidos a través de la dieta puede ser una estrategia adicional para disminuir la excreción ácida renal. La carga ácida esta entonces determinada por el balance de los alimentos que inducen ácido (carnes, huevos, lácteos, cereales) y aquellos que inducen alcali (frutas y vegetales) [76] [83] [84]. Una mayor ingesta de frutas y vegetales puede contribuir a reducir la carga ácida sin la necesidad de una excesiva restricción proteica y aporte de bicarbonato [85] [86] [87] [88] [89].
Para el estudio de la carga ácida se han desarrollado ecuaciones basadas en la encuesta dietética o en la eliminación urinaria de moléculas y electrolitos [76] [83] [84] [86] [87] [88] [89] [90]. Scialla JJ y col [89] evaluaron la carga endógena de ácidos en base a la determinación de N y K urinario, como indicadores indirectos de la ingesta proteica y de la carga alcalina, respectivamente. La ecuación empleada fue la siguiente (mEq/día): -10.2+54.5 (ingesta proteica (gr/día)/ingesta de K (mEq/día) [83]. Los autores concluyeron que una mayor producción endógena de ácido (4º cuartil vs 1º cuartil) se asociaba a más rápido deterioro renal, a una tasa de 1,0 mL/min/año.
Sin embargo, los límites de la liberación de verduras y frutas no se ha establecido. Goraya C. et al [86] [87] estudiaron una población de pacientes con filtrado glomerular entre 15 y 29 mL/min, con niveles séricos de bicarbonato < 22 mEq/L, no diabéticos, que recibieran IECA/ARA más furosemida, y niveles de K < 4,4 mEq/L. Los pacientes recibieron durante 1 año: Bicarbonato 1 mEq/K/día (n=35) o recomendaciones libre de frutas y vegetales (n=36) con objeto de reducir la carga ácida un 50%, sin que se especifiquen cantidades de alimentos. Ambos grupos mejoraron igualmente la acidosis, los niveles de K sérico fueron semejantes en los dos grupos, con mejor control de la tensión arterial en el grupo “frutas y vegetales”. La carga ácida se redujo de 62 a 40 mEq/día y los niveles de K se mantuvieron estables en torno a 4,1 mEq/L.
Obviamente, una limitación importante es el riesgo de hiperpotasemia. Si bien en el estudio AASK [88] [89] no se documentó este evento de forma llamativa, el estudio no incluyó pacientes con fallo renal avanzado ni diabéticos. Este riesgo, lógicamente, aumenta en caso de pacientes ERCA, diabéticos y con empleo de fármacos bloqueantes del eje de la renina.
Queda claro que actualmente no hay estudios clínicos que determinen la seguridad y los beneficios de una dieta basada en una baja carga ácida. Por ello, no se puede garantizar la seguridad de una dieta más libre en verduras y frutas en pacientes con ERCA, pero si podríamos afirmar que su uso juicioso y bajo vigilancia, evitando además los ayunos prolongados, puede ser una medida adicional, nutricionalmente saludable y renoprotectora [86] [88] [89] [91].
Véase Parámetros Urinarios en ERCA
QUE LES DECIMOS QUE COMAN
Como premisa inicial en la dieta del paciente renal, debemos partir inicialmente del concepto de “dieta saludable”. Es un concepto amplio, que tiene como partida las recomendaciones poblacionales dietéticas para la salud. Pero, a esto, debemos aplicar ajustes para el paciente renal, con matices para en cada uno de los estadios que se encuentre.
Podemos resumir la información disponible en dos excelente revisiones sistemáticas, donde se estudia el efecto de las dietas saludables y su impacto sobre la salud renal. El primero fue realizado en pacientes sin enfermedad renal [92], que explora el dearrollo de ERC y albuminuria, principalmente. El segundo estudio, en pacientes con ERC [93] explora la mortalidad y el desarrollo de ERT. Muy brevemente, ambos estudios coinciden en que las recomendaciones dietéticas conocidas como "saludables", tienen efectos renoprotectores, incluso favorables sobre la mortalidad en el paciente con daño renal. De forma general estas recomendaciones los cumple lo que ya es bien conocido como Dieta Mediterranea.
Básicamente: Restricción o limitación salina, grasas saturadas, carnes rojas, productos azucarados, alimentos y bebidas procesadas. Favorecer la ingesta de lácteos bajos en grasas, más verduras y frutas, cereales y legumbres, todos ricos en fibra, frutos secos y pescado preferiblemente blancos.
Como veremos ha continuación, estas recomendaciones son bienvenidas para el paciente renal, pero necesitan importantes ajustes, especialmente para pacientes con ERCA o en tratamiento renal sustitutivo.
Estructuralmente la dieta conviene dividirla por grupos de nutrientes:
Proteínas animales; lácteos; farináceos (pan, cereales y pastas); tubérculos, hortalizas y legumbres; frutas.
El sentido común marca las normas de una dieta completa y equilibrada, apoyándonos en recomendaciones sencillas. Cuatro comidas al día, balanceada en cuanto a los principios inmediatos (hidratos de carbono, grasas y proteínas) (Figura 1). El paciente puede dividir y combinar las raciones en todas las comidas, conforme a sus apetencias. La idea es dar una dieta relativamente libre y apetitosa y evitar ayunos prolongados.
A continuación se realizan unas recomendaciones dietéticas sencillas que deben complementarse con el apoyo de profesionales de la nutrición.
Hidratación
En pacientes ERCA: Véanse los temas Hidratación y Parámetros Urinarios
Los conceptos clave los resumimos a continuación:
1.- En pacientes con ERCA la capacidad de generar alto volumen de orina se conserva hasta etapas avanzadas de la enfermedad.
2.- La ingesta de agua, más allá de la necesaria para eliminar la carga osmótica, puede ayudar a preservar la función renal. Alcanzar una diuresis de 2-3 litros al día, o incluso mayor, es una propuesta razonable y adecuada.
3.- La alta ingesta líquida a base principalmente de agua simple es lo recomendable, evitando los productos líquidos ricos en azúcares.
4.- Esta recomendación debe aplicarse con cautela e individualizarse:
4.1.- No es aplicable a pacientes con síndrome cardiorrenal, con riesgo de retención hidrosalina e insuficiencia cardiaca congestiva.
4.2.- La ingesta forzada puede exceder la capacidad dilutoria renal e inducir hiponatremia.
5.- Medidas de control complementarias (en prevención de los efectos adversos mencionados):
5.1.- Medición periódica de la diuresis de 24 hs por parte del paciente y control del peso.
5.2.- Vigilancia sistemática de la osmolalidad urinaria y del sodio en sangre y orina en las consultas.
6.- Deben observarse las medidas para prevenir la deshidratación, circunstancia más frecuente en épocas estivales y en pacientes añosos, que son la población mayoritaria en consultas ERCA.
7.- Debe hacerse hincapié en el autocontrol de la medicación reduciendo o suspendiendo transitoriamente los diuréticos y bloqueantes del eje renina-angiotensina-aldosterona, ante circunstancias de riesgo de deshidratación.
En pacientes en diálisis
En términos del peso del paciente, la ganancia interdialítica no debería exceder del 4-5% de su peso seco. En DP se recomienda una restricción líquida moderada y ajustada a los balances peritoneales.
Ingesta salina
No sobrepasar los 6 gr de sal, o sea 2,3 gramos de Na.
En pacientes ERCA el Na urinario no debería sobrepasar los 100 mEq/día (100-120 mEq/día puede considerarse un objetivo posibilista y razonable) (Véase Parámetros Urinarios).
No sazonar los alimentos y evitar los que contienen sal en exceso: productos enlatados no dulces, embutidos, vísceras animales, pescados secos, salazones, ahumados, quesos con sal, caldos y sopas prefabricados, y alimentos congelados que lleven sal en su preparación.
Balance energético: Hidratos de carbono y lípidos. Dieta saludable
Hidratos de carbono principalmente en forma de carbohidratos complejos que derivan de los almidones y prevalecen en vegetales, cereales y tubérculos; en lugar de azúcares simples como la sacarosa, que no deben sobrepasar el 10% del aporte calórico total de la dieta. Lípidos mejor mono y poliinsaturados: empleo de aceites-grasas vegetales o aceites de pescado (ricos en omega-3). Se resumen en la (Figura 1).
Mejor guisar (hervir) o asar (plancha, parrilla) que freir (satura las grasas).
Aplicar lo que conocemos como hábitos dietéticos favorables para la prevención del síndrome metabólico en la población general [95].
El difícil equilibrio dietético
Basándonos en los comentarios previos, es importante mantener un equilibrio entre la producción de ácidos (proteínas animales, lácteos, cereales) y bases (verduras y frutas). Una mayor ingesta de frutas y vegetales, y menor de cereales, puede contribuir a reducir la carga ácida, evitando o atenuando el uso de bicarbonato sódico [76] (Véase Parámetros Urinarios)
En ERCA este objetivo puede alcanzarse con una dieta de 50-55 gr proteínas (proteínas animales, lácteos y farináceos), es decir 0,8-0,9 gr/kg/día para un sujeto de 60-70 kg; complementado con una ingesta de K (tubérculos, hortalizas y frutas), entre 2,7-4,0 gr/día, unos 70-100 mEq. Estas recomendaciones tendrán por objeto que la carga ácida no supere los 55 mEq/día.
Este objetivo es más difícil de lograr en el paciente en diálisis, donde la dieta debe ser superior a 1,1 gr/Kg/día de 70-85 gr de proteínas para pacientes de 60-70 kg, y además el riesgo de hiperK obliga a limitar la ingesta de verduras y frutas. Por ello es muy difcícil reducir la carga ácida por debajo de 1 mEq/Kg/día.
Debe hacerse especial hincapié en las proteínas de alto valor biológico (50% de las proteínas) = carne, pollo, huevos o pescado.
Se requiere un ajuste adicional, especialmente en lácteos, para no superar una ingesta de P de 800 mg/día.
Los farináceos (pan, cereales, pastas) son un complemento energético y proteico importante. Sin embargo, tienen proteínas de bajo valor biológico, conllevan una carga ácida intermedia y tienen un contenido nada despreciable de P y K, especialmente los integrales. Su empleo no debe ir en detrimento de las hortalizas y tubérculos.
Las clásicas restricciones en el grupo de verduras y frutas por el riesgo de hiperK, ha derivado en el consumo de una dieta globalmente de elevada carga ácida y más aterogénica. Por lo tanto su uso juicioso y bajo vigilancia puede ser una medida adicional, nutricionalmente saludable y renoprotectora.
Para prevenir la hiperpotasemia, además de las clásicas medidas dietéticas, la recomendación de evitar el ayuno prolongado no debería faltar en ninguna Guía. No es recomendable el uso sistemático de las resinas de intercambio (inducen estreñimiento). Resulta interesante la sugerencia de Allon M y col [74] respecto de infundir glucosa-insulina a pacientes proclives a hiperK y dejados en ayunas en preparación para un procedimiento diagnóstico o quirúrgico.
La doble cocción de las verduras y tuberculos, o dejarlos un tiempo en remojo es una opción adicional, pero priva a los alimentos de sus componentes vitamínicos. Las patatas de alto contenido potásico, amplio consumo en nuestro medio se beneficia de una cocción simple consiguiéndose una reducción en el contenido de K de al menos el 50% [89].
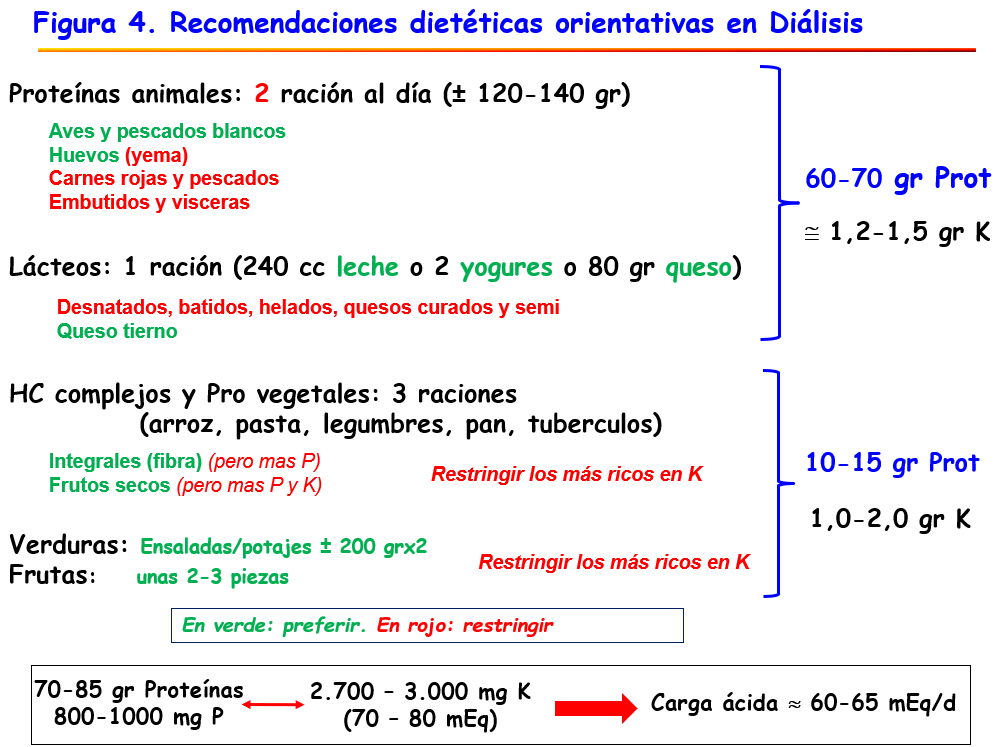
Estas recomendaciones generales se ilustran en la (Figura 3) para el paciente con ERCA y en la (Figura 4) para el paciente en diálisis.
Fibras
La fibra es un componente vegetal que contiene polisacáridos y lignina, resistente a la hidrólisis de las enzimas digestivas humanas. Tiene un papel fundamental en el peristaltismo intestinal y en el mantenimiento de la microflora del colon.
Las dietas ricas en fibras con alto porcentaje vegetal, son saludables tanto en la población general como en el enfermo con fallo renal, y apoya las recomendaciones a favor de reducir la carga ácida. Asimismo, este refuerzo dietético mejora el peristaltismo intestinal, muy importante en pacientes en general mayores y sedentarios; reduciendo además la producción de productos urémicos [30] [94].
Son productos especialmente ricos en fibras las legumbres, cereales integrales, frutos secos y semillas, frutas y hortalizas. Es decir una dieta predominantemente vegetariana.
Prebióticos, Probióticos, Simbióticos
Véase Microbiota intestinal en la enfermedad renal crónica Nefrología 2016
La disbiosis (disbacteriosis) es el desbalance del equilibrio microbiano de la microbiota normal, debido a cambios en su funcionamiento o actividades metabólicas.
En la ERC existe una disbiosis de la microflora intestinal [95]. Factores como la uremia, tipo de dieta, ferroterapia oral, o antibióticos, pueden alterar el microbioma intestinal. Asimismo, la disbiosis o disbacteriosis intestinal afecta a entidades relacionadas con la ERC, como la diabetes, hipertensión arterial u obesidad.
La microflora intestinal genera toxinas urémicas que son absorbidas y se acumulan en la ERC, las cuales se asocian con un aumento del estrés oxidativo y la inflamación. También existe un aumento de la permeabilidad de la barrera intestinal que permite el paso a la circulación sistémica de endotoxinas y otros productos bacterianos que agravan el estado inflamatorio de la ERC.
Las lactobacterias son habitantes saprófitos del intestino, productoras de ácido láctico, que inhiben el crecimiento de bacterias patógenas. Son las denominadas bacterias amistosas.
Los alimentos y productos probióticos comerciales, son ricos en lactobacterias. En los alimentos, están presentes principalmente en el yogur, queso y otros lácteos.
En resumen, una dieta más vegetariana, y más rica en fibra, junto al uso de probióticos abre una alternativa en el tratamiento de la disbiosis intestinal asociada a la ERC, y puede jugar un papel en el enlentecimiento de la progresión de la ERC. Aunque no existen evidencias consistentes, estas pautas siempre suponen un soporte adicional saludable para esta población, si no hay contraindicaciones, y se ajusta a los criterios dietéticos del paciente renal con ERC o en diálisis.
Recomendaciones prácticas y vigilancia de la dieta
En la (Tabla 1) se describen las recomendaciones en términos absolutos, que deben trasladarse a los productos en formato de dieta. En la (Figura 3) se exponen las dietas aconsejadas en la ERCA E4-5 y en la (Figura 4) las dietas aconsejadas para el paciente en diálisis, en formato simplificado y divididas por grupos de nutrientes.
En el paciente en diálisis el logro de los objetivos nutricionales es más complicado, ya que se trata no solo de alcanzar los requerimientos proteicos (>1,1 hasta 1,4 gr/Kg peso ideal/día, en función del catabolismno deberíamos ser excesivamente restrictivos.o), sino de evitar al mismo tiempo la sobrecarga de fósforo y limitar la carga ácida procurando no superar los 60-65 mEq/día. En este sentido la ingesta de K no debería superar los 3 gr; aunque bajo vigilancia y evitando los ayunos prolongados, no deberíamos ser excesvamente restrictivos.
Además de las encuestas dietéticas, para el caso de pacientes con ERCA, la determinación periódica de parámetros como el Na, Nitrógeno, P, K en orina de 24 horas (Véase Parámetros Urinarios), proporcionan información fiable de la adherencia a la dieta y hábitos nutricionales de nuestros pacientes.
La adherencia a la dieta hipoproteica podemos estimarla de forma muy práctica a través de las pérdidas nitrogenadas en orina (asumiendo que el paciente se encuentra en balance proteico: ingesta=pérdidas) aplicando la ecuación descrita por Maroni BJ y col [86] [96] (Tabla 4). En hemodiálisis se estima a partir de la generación de urea en el período interdiálisis [26] [97] y en diálisis peritoneal a través de la determinación de nitrógeno en el efluente peritoneal, más el nitrógeno urinario si es el caso [98] [99] (Tabla 4).
Como hemos mencionado previamente, la determinación de Na en orina de 24 hs es un indicador fiable de la ingesta salina en pacientes con ERCA [20] [22].
A nivel más experimental la determinación urinaria de P, su excreción fraccional y la reabsorción tubular de fosfato, proporcionan información adicional sobre el manejo del P en ERCA [100] (Véase Parámetros Urinarios).
Más recientemente, varias ecuaciones empleando iones en orina han demostrado utilidad en la estimación de la carga alcalina o ácida de las dietas [76] [83] [84] (Véase Parámetros Urinarios).
Como podemos ver, los parámetros urinarios aportan información sensible y de utilidad para la práctica clínica habitual; y dan idea de los hábitos dietéticos de los pacientes y del seguimiento a nuestras recomendaciones.
Comer en diálisis
Dar de comer al paciente durante la sesión de hemodiálisis es objeto de debate, aunque en la mayoría de los centros se les proporcionan alimentos. Esto se debe a que mejora la sensación de bienestar del paciente con apetito, y aporta un suplemento nutricional supervisado. Por contra, el mayor riesgo de hipotensión postprandial, molestias digestivas, aspiración... son limitaciones a tener en cuenta. A falta de información controlada, aportar comidas o suplementos durante la diálisis, parece tener más ventajas que inconvenientes, es una estrategia amigable al enfermo, y con bajo riesgo de complicaciones en pacientes sin contraindicaciones [54].
SUPLEMENTOS NUTRICIONALES
Pueden ser enterales (orales o por sonda naso-enteral) o parenterales (diarios o intradiálisis); una amplia revisión encontramos en la Guías nutrición en el paciente en diálisis [7] [24] [101] [102] [103]. Mientras sea posible debe utilizarse la vía oral, que mantiene la funcionalidad intestinal, actúa como barrera inmunológica, y aportar un efecto anabólico sostenido [104].
De forma orientativa –opinion de los autores y aportes bibliográficos- los suplementos nutricionales deben considerarse ante las siguientes situaciones, e individualizar la prescripción [40]:
Anorexia, baja ingesta de alimentos, acompañada de perdida involuntaria del 5% del peso no edematoso en 3 meses o del 10% en 6 meses; con descenso de la albúmina < 3,8 g/dL y prealbúmina < 28 mg/dL.
En caso de hipoalbuminemia severa (<3,2 gr/dL) asociada a evidencias de desgaste energético-proteico, debería pasarse una opción es pasar a la nutrición nasoenteral nocturna o a la nutrición parenteral, según aconsejen las circunstancias individuales.
Suplementos enterales (orales o con sonda): son útiles en fases de recuperación de eventos catabólicos, o en pacientes con anorexia, especialmente en ancianos con problemas de masticación, ya que son líquidos o semilíquidos. Los aportes de proteínas deben ir acompañados de adecuados suplementos energéticos. Se deben escoger aquellos cuya proporción calórico-proteica sea aproximadamente 150 KCal por gramo de Nitrógeno (gr de proteína/6,25). Otra alternativa son los suplementos orales específicos y de administración supervisada durante las sesiones de HD. Estas pautas han demostrado beneficios en los parámetros nutricionales [104], y su indicación también debe ser individualizada. Los suplementos con aminoácidos esenciales no parecen tener indicación actualmente. Ikizler TA et al [40]] sugieren la siguiente pauta para suplementos orales: 2-3 veces por día, preferiblemente una hora después de las comidas, y durante las sesiones de HD. Estos suplementos deberían aportar el complemento de calorías y proteínas necesarios, para alcanzar las recomendaciones energético-proteicas necesarias para el paciente.
Suplementos parenterales intradiálisis o totales: ante evidencias de desgaste energético proteico, si no hay tolerancia a suplementos orales y la ingesta calórica diaria oral o vía enteral no supera el 50% de las necesidades, estaría indicada la nutrición parenteral. Los suplementos parenterales en diálisis requieren el uso de bombas de infusión y la vigilancia de los niveles de glucemia. Se pueden añadir en un volumen razonable, unas 2.400 Kcal y 0,7 gr de aminoácidos/Kg por semana. La dosis de glucosa no debe superar la administración de 5 mg/Kg/min. En cualquier caso, los resultados de la nutrición parenteral intradiálisis ofrecen resultados no concluyentes, por lo que no su empleo debe individualizarse, pero no generalizar su recomendación [105] [106].
Nuestra opinión, es que ante un enfermo desnutrido, que habitualmente está hospitalizado y con algún proceso patológico intercurrente, debe emplearse una nutrición parenteral completa. En estos casos, el empleo de diálisis diaria es necesario para depurar eficazmente la generación de nitrógeno que se produce tras una aportación completa de aminoácidos (> 1 gr/Kg/día), y la sobrecarga de volumen (1 ml por cada Kcal) que acompaña a un aporte calórico de 30-35 Kcal/kg/día. Para el aporte calórico no proteico habitualmente se administra un 60-70 % como hidratos de carbono y 30-40% de lípidos. Debe tenerse en cuenta el ajuste de los suplementos de potasio y fósforo acorde.
En general, la mayoría de estos estudios han demostrado beneficios en parámetros bioquímicos subrogados, pero no en términos de supervivencia [40].
Agentes anabólicos: el uso de agentes anabólicos es un aspecto bien revisado en las Guías europeas [9], donde se destaca el bajo nivel de evidencia de su indicación. Presentan frecuentes efectos secundarios (hirsutismo, alteraciones del perfil lipídico y de los test hepáticos entre otros) y podrían ser considerados solamente en pacientes con marcada desnutrición, administrándose por períodos de 3-6 meses [40]. Otras Guías no los mencionan.
Estudios preliminares demuestran que hormonas anabólicas como la GH (growth hormone) o la IGF-1 (insulin-like growth factor) pueden ser eficaces en enfermos urémicos desnutridos, cuando se administra conjuntamente con la nutrición parenteral. Aunque las perspectivas son prometedoras, su indicación está en fase de investigación clínica.