Nefropatía Lúpica. Lupus Eritematoso Sistémico
INTRODUCCIÓN
El lupus eritematoso sistémico (LES) es el prototipo de enfermedad autoinmune sistémica, caracterizada por exacerbaciones y remisiones clínicas que comprometen diversos órganos y tejidos, y que afectan la calidad y la expectativa de vida. Es más frecuente en las mujeres de edad fértil, en negros, mestizos y asiáticos [1]. En su patogenia intervienen factores genéticos, cromosómicos y medioambientales que producen una desregulación del sistema inmunitario, con pérdida de la tolerancia inmune y formación de diversos autoanticuerpos [1][2]. Esto condiciona inflamación crónica, así como daño celular y tisular progresivo. La afectación renal por el LES se conoce como nefritis lúpica (NL) y constituye la afectación orgánica grave más frecuente, dado que hasta el 60% de los pacientes con LES pueden llegar a tener NL durante el curso de su vida. En años recientes, se ha producido un avance importante en la comprensión de los mecanismos patogénicos del LES y la NL, así como en la progresión de la enfermedad renal. Esto ha permitido el desarrollo de nuevos fármacos biológicos dirigidos a bloquear dianas específicas de la respuesta inmunitaria y del daño renal y a la realización de ensayos clínicos controlados de alta calidad que han confirmado su eficacia. La publicación reciente de nuevas guías de práctica clínica y documentos de consenso han incorporado todos estos importantes avances en la práctica clínica con nuevas recomendaciones en el abordaje diagnóstico y terapéutico [3][4][5]. Por todo ello, consideramos pertinente hacer una actualización apropiada y rigurosa del enfoque diagnóstico, del seguimiento y de las nuevas opciones de tratamiento en el paciente con NL. En esta revisión, además de los puntos señalados, también incluimos algunas situaciones especiales de la NL, como la enfermedad refractaria, la enfermedad recidivante, la presencia de microangiopatía trombótica (MAT) y el embarazo, finalizando con el tratamiento no inmunosupresor y las medidas dirigidas a mejorar el daño crónico y los efectos adversos del tratamiento.
PARTE 1
Epidemiología
La incidencia y prevalencia de LES y de NL varían según la población estudiada y los criterios diagnósticos utilizados. El LES es más prevalente en mujeres en edad reproductiva (relación mujer/hombre 6,1-13,3:1). La incidencia varía de 1 a 8,7 casos/100000 personas-año y la prevalencia de 8 a 180 casos/100 000 personas [6][7], pero esta puede ser mayor en algunas partes de América del Norte [8]. En pacientes no seleccionados con LES, aproximadamente 25-50% tienen signos o síntomas de enfermedad renal al inicio del LES y hasta un 60 % de los pacientes adultos con LES desarrollan clínica renal durante el curso de la enfermedad [9][10][11][12][13]. Los estudios de cohorte muestran una mayor frecuencia de NL en hombre que en mujeres con LES (relación hombre/mujer 1,1 a 1,7/1), sin variación por grupo étnico [14][15][16][17]. La NL también es más prevalente si el LES se inicia en la edad joven (50-82%) que en la adulta (34-53%) [18][19] y varía según el origen étnico, siendo mayor la probabilidad de desarrollar NL en afroamericanos, en hispanos o mestizos y en asiáticos que en individuos caucásicos [20][21][22][23][24][25]. En general, los pacientes con LES de menor edad, sexo masculino y etnia africana, asiática o hispana tienen mayor probabilidad de desarrollar NL [20][24][25].
Patogénesis
El LES es una enfermedad autoinmune crónica en cuya patogénesis están implicados factores genéticos, cromosómicos y medioambientales, que favorecen la desregulación del sistema inmunitario innato y adaptativo, con activación y proliferación de células T, B, plasmocitos, producción de citocinas inflamatorias y activación del complemento. La consecuencia final es la perdida de la tolerancia inmune, el desarrollo de autoanticuerpos patogénicos y la inflamación sistémica y local [1] [2]. A nivel renal, los complejos inmunes, la activación local del complemento, el reclutamiento de leucocitos y la señalización de citocinas intrarrenales contribuyen a la lesión glomerular y tubulointersticial [26].
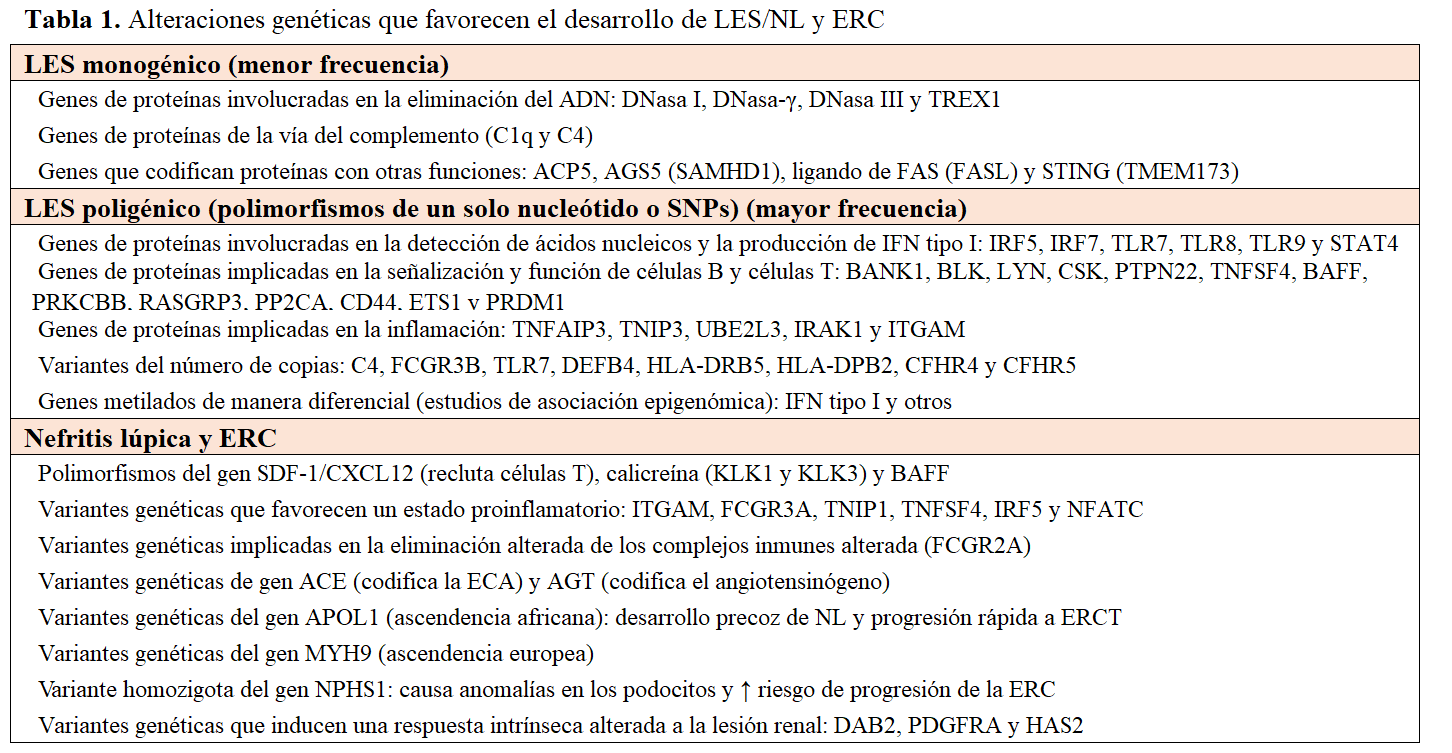
La base genética del LES muestra una heredabilidad de 43,9% y un riesgo relativo en familiares de primer grado de 5,9%3 [1]. La mayoría de los casos tienen origen poligénico, aunque los casos de inicio temprano pueden ser monogénicos o familiares, con genes implicados en la eliminación del ADN y la vía del complemento [27][29][30]. Los estudios de asociación del genoma completo (GWAS) han identificado más de 100 genes asociados con el LES y han encontrado polimorfismos de un solo nucleótido en genes que codifican proteínas involucradas en la detección de ácidos nucleicos, en la producción de interferón tipo I, en la señalización y función de las células B y T y en la inflamación. También se han identificado variantes genéticas que predisponen al daño renal en el LES (proliferación mesangial y compromiso de la integridad y estabilidad de la membrana basal glomerular [26][31][32]. Puede darse la coexistencia de pacientes con NL y que presentan alteraciones genéticas que favorecen la progresión de la ERC, independientemente de la actividad de la NL, como las variantes del gen APOL1 o del gen MYH9 (Tabla 1).
El predominio del LES en las mujeres parece relacionarse con el número doble de genes en el cromosoma X, especialmente el gen TLR7, implicado en la respuesta inmunitaria innata asociado con el LES que explicaría la hiperactividad de los leucocitos en las mujeres [33][34].
Factores medioambientales como el tabaquismo, productos industriales, pesticidas, medicamentos hormonales, la luz ultravioleta, infecciones y más recientemente, la disbiosis intestinal, pueden contribuir a la pérdida de la tolerancia inmunológica y el desarrollo de autoinmunidad [35][36][37][38][39][40][41][42][43][44][45].
Todos los factores mencionados producen la activación continua de la inmunidad innata que favorece la proliferación de células B autoreactivas y la señalización persistente del interferón tipo I (IFN-I). La señalización del IFN-I es detectable en sangre periférica cuando existe actividad sistémica y renal [46] y parece ser clave en las formas proliferativas de NL, pero no en las formas membranosas, sugiriendo una patogénesis diferente entre las clases histológicas [47]. La abundancia de neutrófilos también indica actividad de la NL [48].
La hiperactivación y proliferación de células B autoreactivas son claves en la autoinmunidad del LES y la NL, ya que producen anticuerpos anti-ADN y otros anticuerpos antinucleares. Un factor clave es el exceso del factor activador de células B soluble (BAFF o BLyS), que además de favorecer la supervivencia de las células B autorreactivas, induce la formación de órganos linfoides terciarios en el tejido renal [49]. Belimumab (un inhibidor del BAFF) ha demostrado su beneficio clínico en pacientes con LES y NL (ver tratamiento).
Las células T también son esenciales en la patogénesis del LES y la NL, ya que ayudan a las células B a producir autoanticuerpos y producen varias citocinas inflamatorias que inducen daño sistémico y renal, como las células Th productoras de IL-17 y las células Th foliculares que activan las células B del centro germinal [50][51].
Diversos autoanticuerpos nefritogénicos producen complejos inmunes in situ y se asocian a las clases histológicas [52][53][54][55][56]. Los anticuerpos antifosfolípidos pueden producir MAT renal [57], mientras que los ANCAs pueden relacionarse a una NL con semilunas (crescéntica), promoviendo la presencia de neutrófilos, daño microvascular glomerular e hiperplasia de células parietales [58][59]. Los depósitos epimembranosos de exostosina 1 y 2 son antígenos presentes en la NL clase V (membranosa), aunque no se han detectado anticuerpos circulantes [60].
Las células T de memoria de larga duración y las células plasmáticas de vida larga residentes en la médula ósea podrían estar implicadas en la autoinmunidad crónica, la refractariedad al tratamiento convencional y las recaídas [61]. En concordancia con ello, se han utilizado tratamientos dirigidos a las células plasmáticas como los inhibidores de proteasoma, inhibidores del CD38 y el trasplante de médula ósea (TMO), con resultados inicialmente alentadores, aunque no exentos de riesgos en el caso del TMO [62][63][64][65][66].
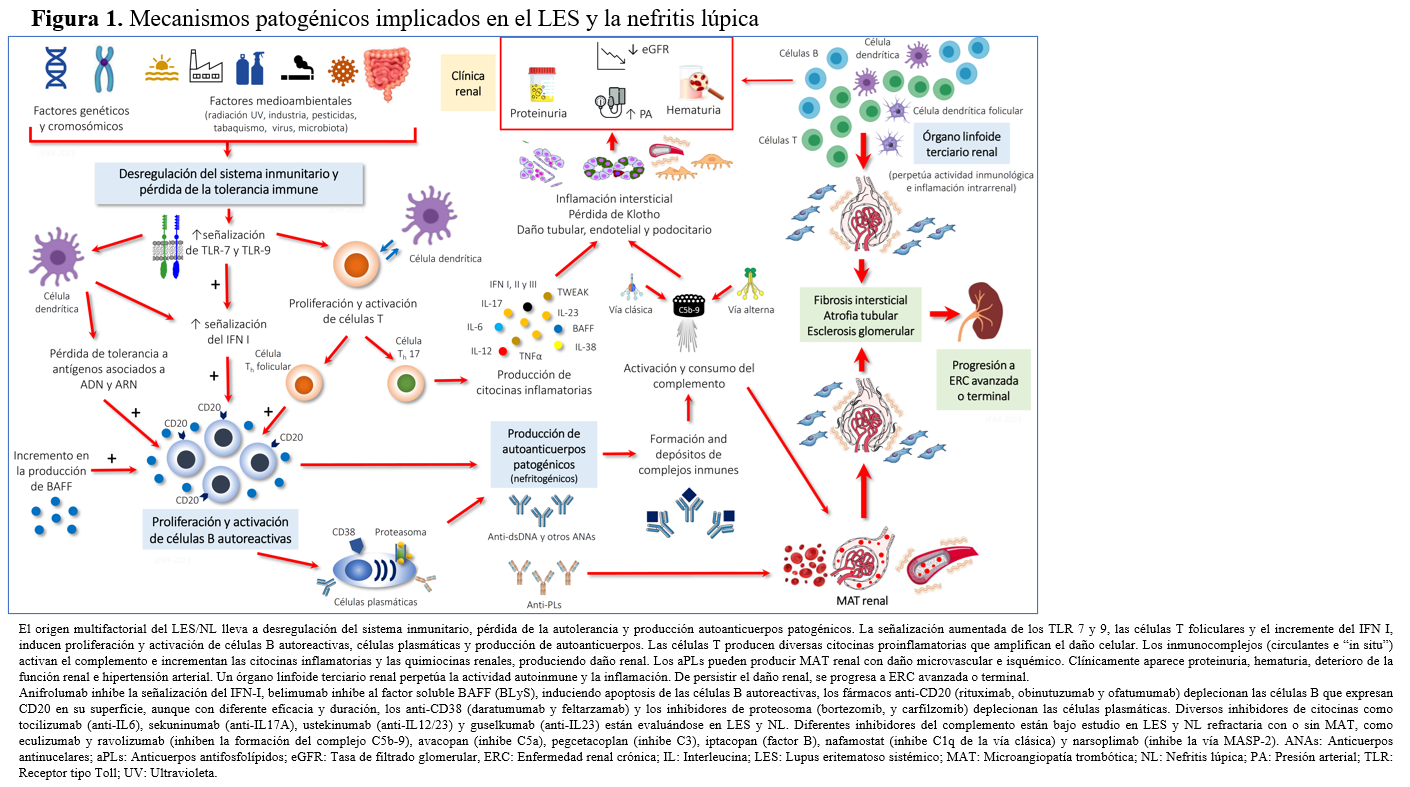
Las proteínas del complemento están involucradas en la patogenia de la NL. Su disminución en la circulación y el depósito y/o activación de la vía clásica del complemento intrarrenal están asociados con NL y sirven como biomarcadores de diagnóstico [67][68][69][70], pero la vía alterna también puede estar implicada en su desarrollo [71]. Así, el eculizumab, un inhibidor de la formación del complejo final C5b-9, es una alternativa de tratamiento en algunos casos de NL refractaria, con o sin MAT asociada [72][73]. Por ello, nuevos ensayos clínicos están evaluando la eficacia de diversos inhibidores del complemento. Por último, las nuevas técnicas de transcriptómica están investigando activamente los mecanismos de daño intrarrenal en la NL, intentando buscar nuevos biomarcadores de actividad y de pronóstico [1]. La (Figura 1) muestra una representación esquemática de los mecanismos patogénicos implicados en el desarrollo de LES y de la NL.
Factores de progresión y de pronóstico en la nefritis lúpica
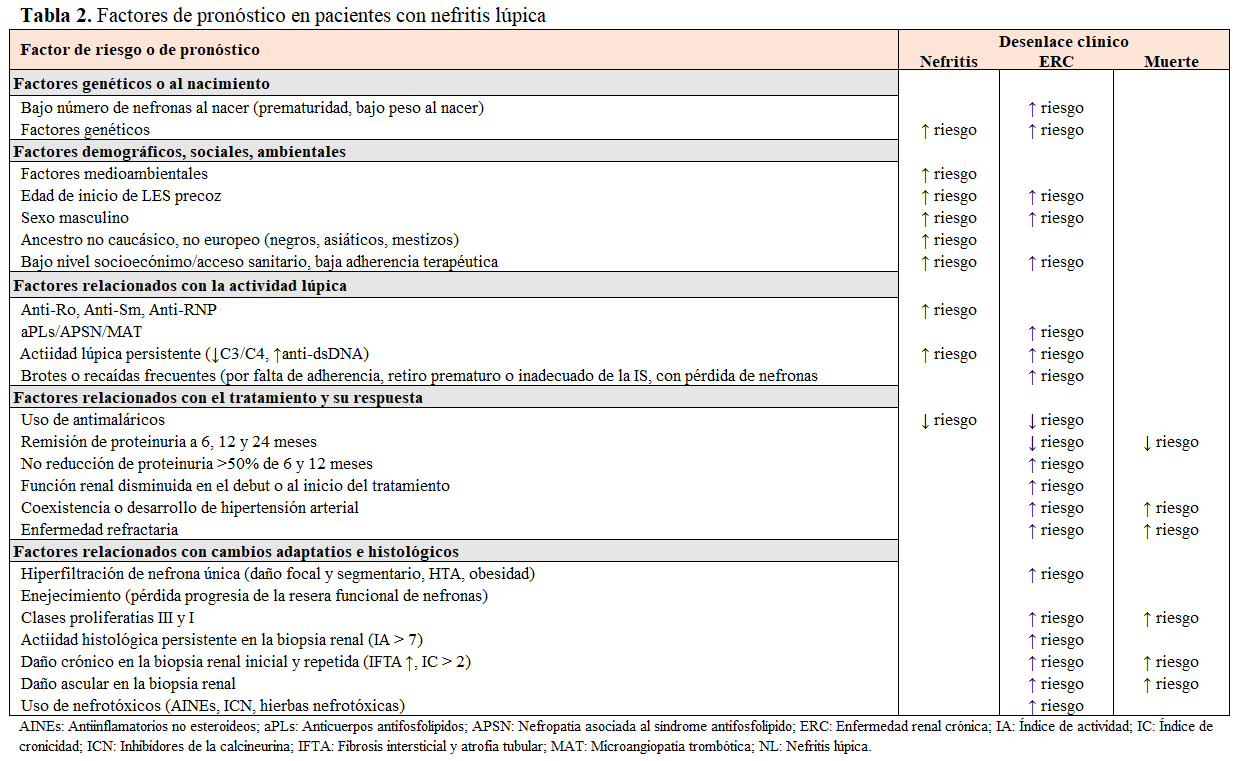
Existen diversos factores implicados en la progresión y el pronóstico de la NL, como los relacionados a la propia ERC (peso al nacer, número de nefronas) [74][75], a la base genética (APOL1, MYH9) [76][77], a la actividad inmunológica persistente (hipocomplementemia, tipo de autoanticuerpos nefritogénicos) [1][2][53], al tipo de daño renal (clase histológica, índices de actividad y cronicidad) [78-80] y factores relacionados con el tratamiento (tipo de inmunosupresores, duración, adherencia y respuesta al tratamiento, recaídas, tratamiento nefroprotector, etc.) [81][82][83]. Estos se muestran resumidamente en la (Tabla 2).
Diagnóstico del LES y de nefritis lúpica
El LES es una enfermedad autoinmune crónica y heterogénea, con diversas manifestaciones orgánicas. El diagnóstico está basado en signos y síntomas característicos que forman parte de los criterios de clasificación EULAR/ACR de 2019 [84].
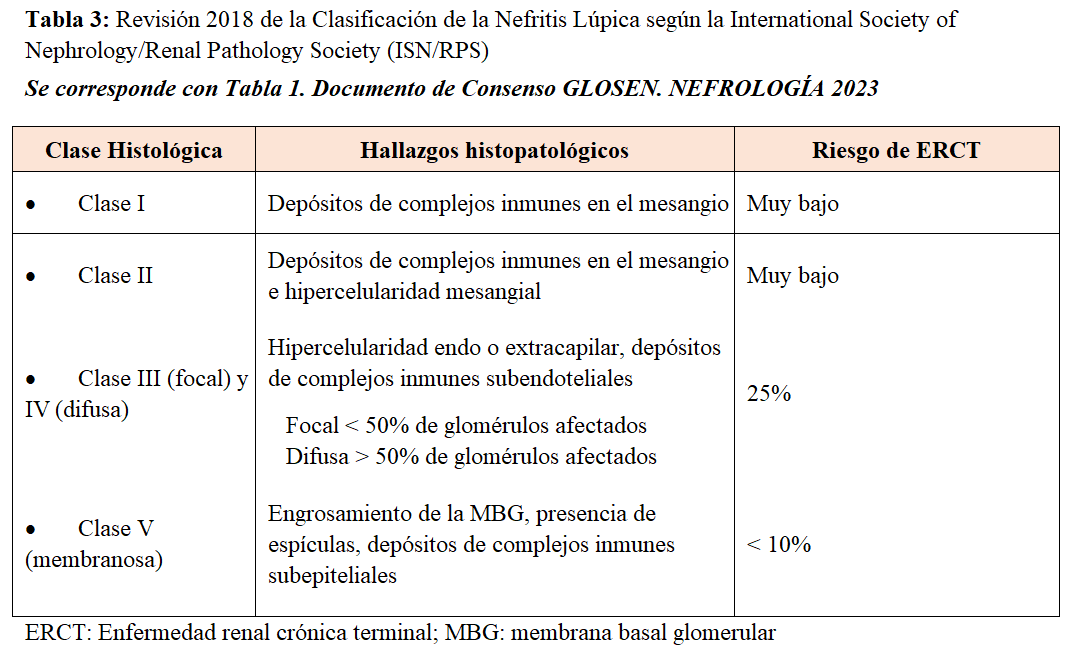
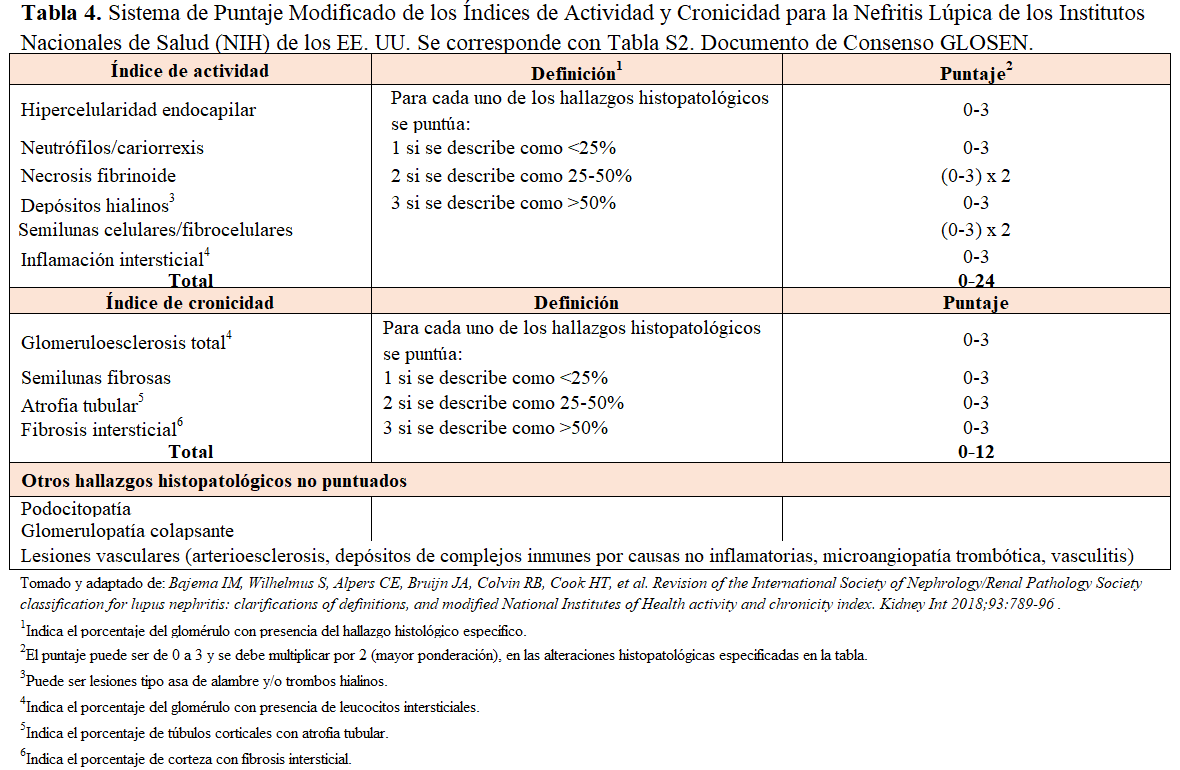
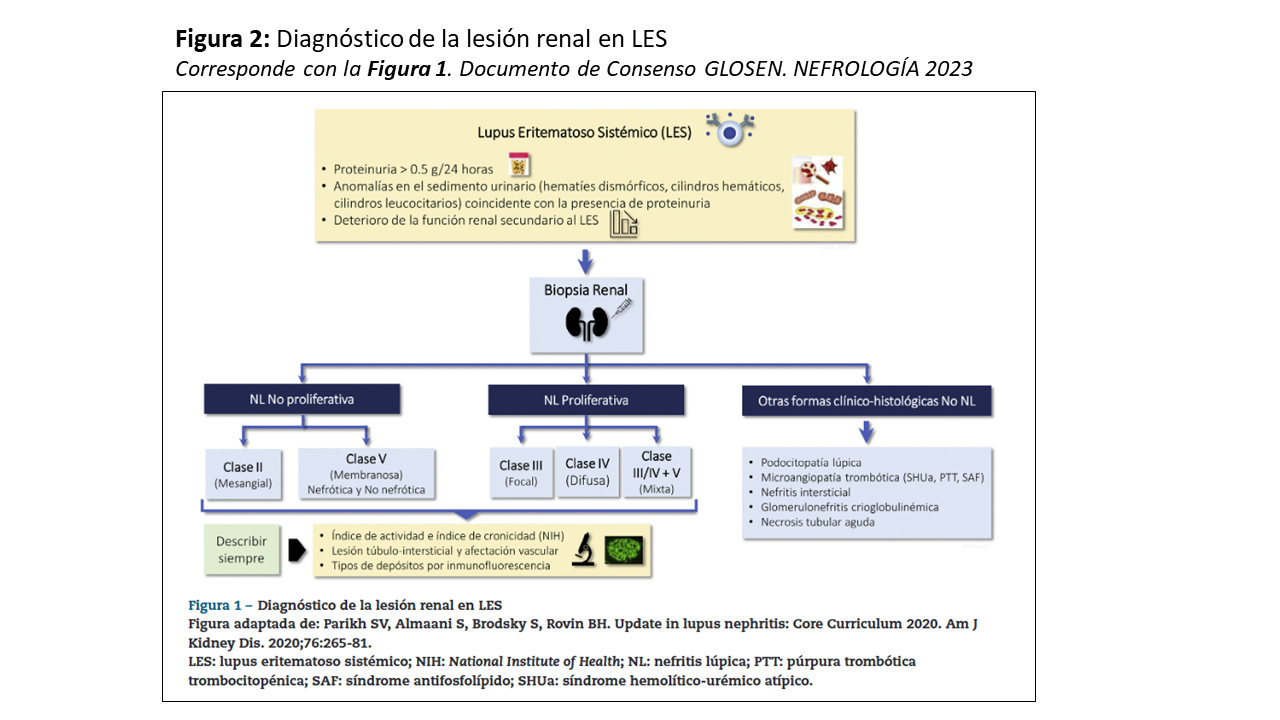
La NL es un tipo de glomerulonefritis producida por el depósito de inmunocomplejos en un paciente con LES. Se caracteriza por la aparición de proteinuria en grado variable (40-100% de los casos), alteraciones en el sedimento urinario (hematuria hasta en el 80%), deterioro de la función renal (40-80%) y en algunos casos, desarrollo de hipertensión arterial (15-50%) [85]. Se requiere la biopsia renal para hacer un diagnóstico preciso según la última clasificación histológica de la International Society of Nephrology/Renal Pathology Society (ISN/RPS) [86] (Tabla 3) y (Tabla 4). Esto permite identificar la clase histológica, establecer el pronóstico y planificar el tratamiento más apropiado.
Papel de la biopsia renal en la nefritis lúpica
a) Biopsia inicial
Con fines diagnósticos, se recomienda realizar la biopsia renal en todo paciente con LES que presente: proteinuria > 0.5 g/24-horas (o un cociente proteína/creatinina en orina >0.5 g/g), sedimento activo (hematuria, leucocituria o cilindruria) y/o un deterioro inexplicado de la función renal. Cuando no existe proteinuria, siempre debe descartarse causas de afectación renal distintas al LES [1][87][88] (Figura 2).
El estudio histológico requiere la intervención de un nefropatólogo experto y realizar microscopia óptica e inmunofluorescencia (IF), pero también se recomienda realizar microscopia electrónica (ME) para detectar formas atípicas de afectación renal en el LES [1]. Es importante remarcar que las lesiones histológicas pueden cambiar en el tiempo, de manera espontánea o inducidas por el tratamiento, pero también puede haber más de una clase histológica presente. En la biopsia renal inicial se deben valorar diversos parámetros de actividad y de cronicidad a nivel glomerular, así como el compromiso túbulointersticial y vascular (Tabla 4). A pesar de que la clasificación histológica de la NL es “glomerulocéntrica”, las lesiones túbulointersticiales y vasculares tiene una importancia clave en el pronóstico de la NL [80][89][90]. También es posible detectar lesiones que no se consideran dentro de la clasificación ISN/RPS, como la podocitopatía, la invaginación podocitaria, la microangiopatía trombótica (MAT), la vasculitis y la nefritis tubulointersticial aguda [91][92].
La podocitopatía lúpica (PL) es una manifestación infrecuente del LES (<1% de los casos). Se presenta con síndrome nefrótico y con glomérulos normales o lesiones de glomeruloesclerosis focal y segmentaria, con o sin proliferación mesangial. La IF no detecta depósitos subepiteliales o subendoteliales y la ME evidencia borramiento difuso de los procesos podocitarios [91]. Su evolución clínica es similar a la enfermedad de cambios mínimos y la glomeruloesclerosis focal y segmentaria primaria y se presume que su mecanismo patogénico es diferente al de una GN por complejos inmunes.
La glomerulopatía por invaginación podocitaria (PIG del inglés “podocytic infolding glomerulopathy”) es una lesión podocítica rara, que se ha descrito en población principalmente asiática y más recientemente europea. Se caracteriza por la invaginación de la membrana celular de los podocitos hacia la membrana basal glomerular, siendo la presencia de microesferas y/o microtúbulos en la ME el hallazgo característico. Puede coexistir en el paciente con LES/NL y en otras enfermedades autoinmunes. Se desconoce su patogenia y sus características clínicas, pero las formas de presentación con proteinuria nefrótica pueden responder a los corticoides [92][93][94][95][96].
b) Biopsia repetida
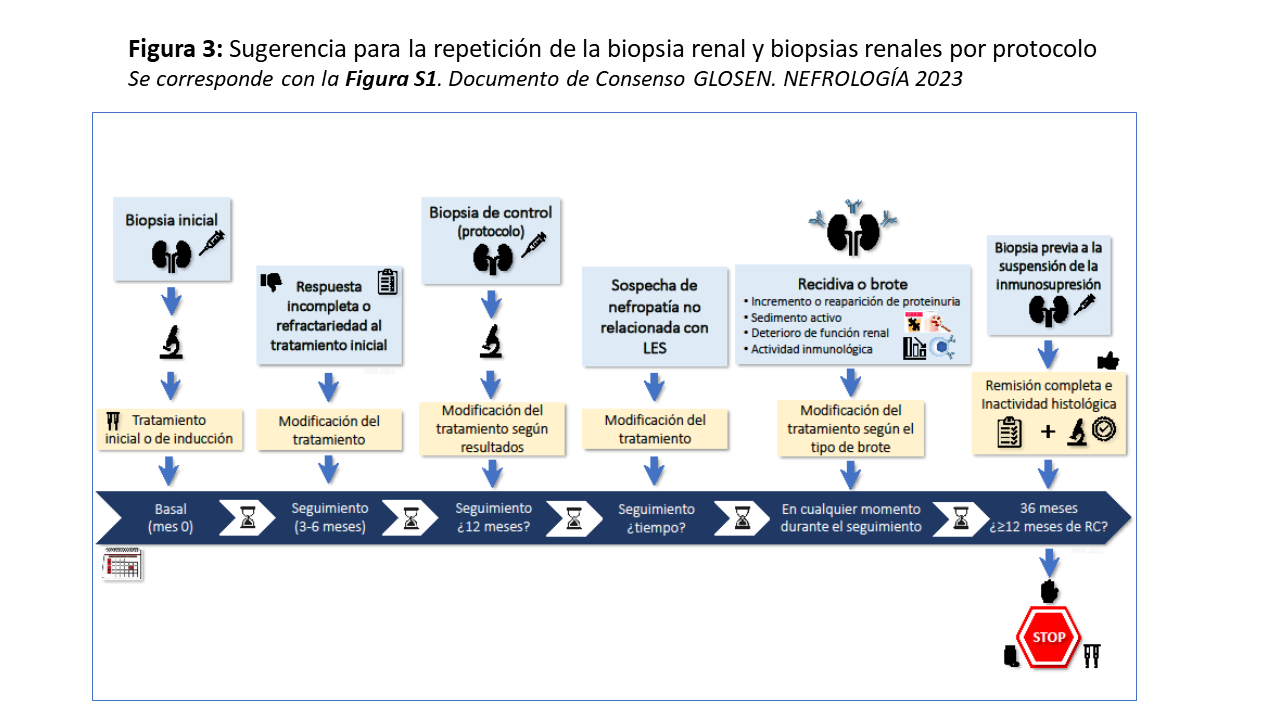
Aunque no existe acuerdo general sobre cuando repetir la biopsia renal en la NL, se puede considerar en los casos refractarios al tratamiento, cuando requerimos determinar si la proteinuria o el deterioro renal persistente se deben a lesiones activas o crónicas, en casos de recaídas frecuentes o cuando se sospecha una nefropatía no relacionada con el LES [5][97][98][99][100]. La biopsia repetida por protocolo es más controvertida. Existe discrepancia entre la respuesta clínica y la histológica, pues se ha documentado actividad histológica entre un 20-50% de casos de NL en remisión clínica entre 6-8 meses postratamiento. De manera similar, se ha reportado que entre el 40-60% de los pacientes con proteinuria persistente >0.5 g/24-horas, presentan remisión histológica [100]. La biopsia por protocolo podría ayudar a decidir la retirada del tratamiento inmunosupresor, sobre todo si se descarta la presencia de actividad histológica o esta es muy baja (<2) [97][98][99][101][102] (Figura 3). En este sentido, el ensayo en curso ReBioLup evaluará prospectivamente si la modificación del tratamiento inmunosupresor basado en los hallazgos de una biopsia renal de protocolo a los 12 meses de iniciado el tratamiento guía mejor las modificaciones de tratamiento que si se basara sólo en parámetros clínicos y serológicos (www.rebiolup.com).
Manifestaciones clínicas y de laboratorio
En todos los pacientes con NL es fundamental la identificación, valoración y seguimiento de las manifestaciones clínicas extrarrenales. Para ello se suele utilizar sistemas estandarizados y validados de actividad del LES como el SLEDAI (Systemic Lupus Erythematosus Disease Activity Index) [10][85][103][104].
La NL representa una de las complicaciones más graves y frecuentes del LES [104][105][106], por lo que su diagnóstico precoz es clave en el manejo de la enfermedad. Puede tener un inicio asintomático [85], por lo que se recomienda una determinación periódica de sangre y orina para valorar función renal (creatinina sérica y filtrado glomerular), la presencia de proteinuria y/o albuminuria y las alteraciones del sedimento urinario. Debe prestarse especial atención a la aparición reciente de edemas y/o hipertensión arterial. Actualmente, la proteinuria en orina de 24-horas y los cocientes urinarios de albúmina/creatinina y proteínas/creatinina se utilizan más frecuentemente que la tira reactiva. La detección de albuminuria le da un valor añadido por su relación directa con el riesgo cardiovascular. Esto es relevante, dado que los pacientes con LES presentan una prevalencia y un desarrollo más acelerado de complicaciones ateroscleróticas [107][108], aún en situaciones de remisión clínica. La periodicidad de estas determinaciones debe de ajustarse a la situación clínica de los pacientes, pero deberían de ser más frecuentes (al menos 1-2 veces al año) en pacientes con mayor propensión de desarrollar NL (inicio precoz del LES, población no caucásica, clínica extrarrenal y actividad serológica persistente) [10][22][85][104][105][106][108]. En los pacientes diagnosticados de NL, la proteinuria, el sedimento urinario y el filtrado glomerular son los parámetros más relevantes para valorar la eficacia del tratamiento y la evolución de la enfermedad, siendo la proteinuria el marcador pronóstico más importante [109][110][111][112].
Aunque en general existe correlación entre la gravedad y tipo de NL y sus manifestaciones analíticas (Tabla 5), también puede haber cierta discrepancia clínico-histológica [113]. Existen factores independientes de la actividad lúpica que pueden influir en los parámetros renales que deben de ser descartados, especialmente la variación del peso corporal y los cambios en las dosis y tipo de fármacos antiproteinúricos y/o antihipertensivos, que impactan directamente en los niveles de proteinuria (Tabla 6).
Respecto a los marcadores serológicos, los anticuerpos anti-dsDNA son utilizados como criterio diagnóstico de LES y para el seguimiento de la actividad lúpica. En la NL son más frecuentes en las clases proliferativas (III y IV) que en las clases no proliferativas (clase I, II y V) [114]. La variación de sus niveles en el tiempo y no valores aislados permiten evaluar mejor la respuesta al tratamiento y detectar precozmente una posible recidiva renal. Los anticuerpos anti-C1q también son útiles para el diagnóstico y seguimiento de la NL [115], especialmente para las formas proliferativas. Sus niveles suelen disminuir postratamiento [114]. Los cambios paralelos en los niveles de anti-dsDNA y anti-C1q predicen mejor el riesgo de recidiva que los cambios aislados [114] [115] [116]. La disminución de los niveles séricos de los componentes del complemento C3 y C4 son marcadores clásicos de diagnóstico y monitorización de actividad inmunológica en el LES, pero su correlación con la actividad de la NL es imprecisa y subóptima [117]. En general, la determinación conjunta de anti-dsDNA, anti-C1q y C3/C4 tienen mejor especificidad que sensibilidad para identificar una posible recaída renal, de tal manera que ante valores normales, es muy improbable el brote renal [118].
La NL con anticuerpos antifosfolípidos o con síndrome antifosfolípido tiene peor pronóstico [119], por lo que es recomendable realizar la determinación del anticoagulante lúpico y de anticuerpos antifosfolípidos en el suero (anticuerpos anticardiolipina y anti-beta2 glicoproteína 1). Las formas proliferativas de NL con necrosis fibrinoide, actividad lúpica intensa y deterioro de la función renal basal pueden tener asociada la presencia de anticuerpos anti-citoplasma del neutrófilo (ANCA), lo que implica un peor pronóstico [120].
El biomarcador ideal en LES que identifique de manera sensible y específica el riesgo de desarrollar NL, de recaída renal, de progresión, o de respuesta al tratamiento no existe. Es posible que en el futuro lo logremos con un panel de biomarcadores que incluya parámetros clínicos, serológicos, urinarios, histológicos y aquellos desarrollados por técnicas de genómica, proteómica y metabolómica, en un abordaje de “medicina de precisión” [121].
Definiciones de los objetivos de tratamiento y de las recaídas
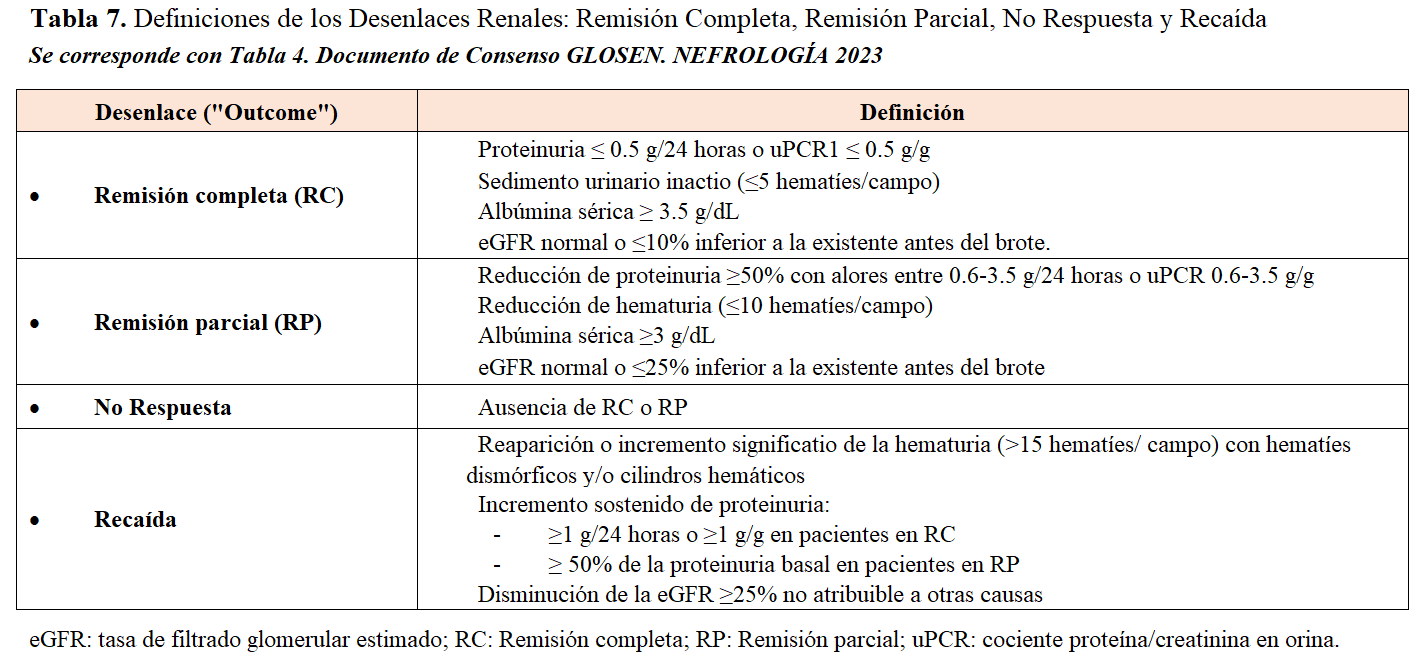
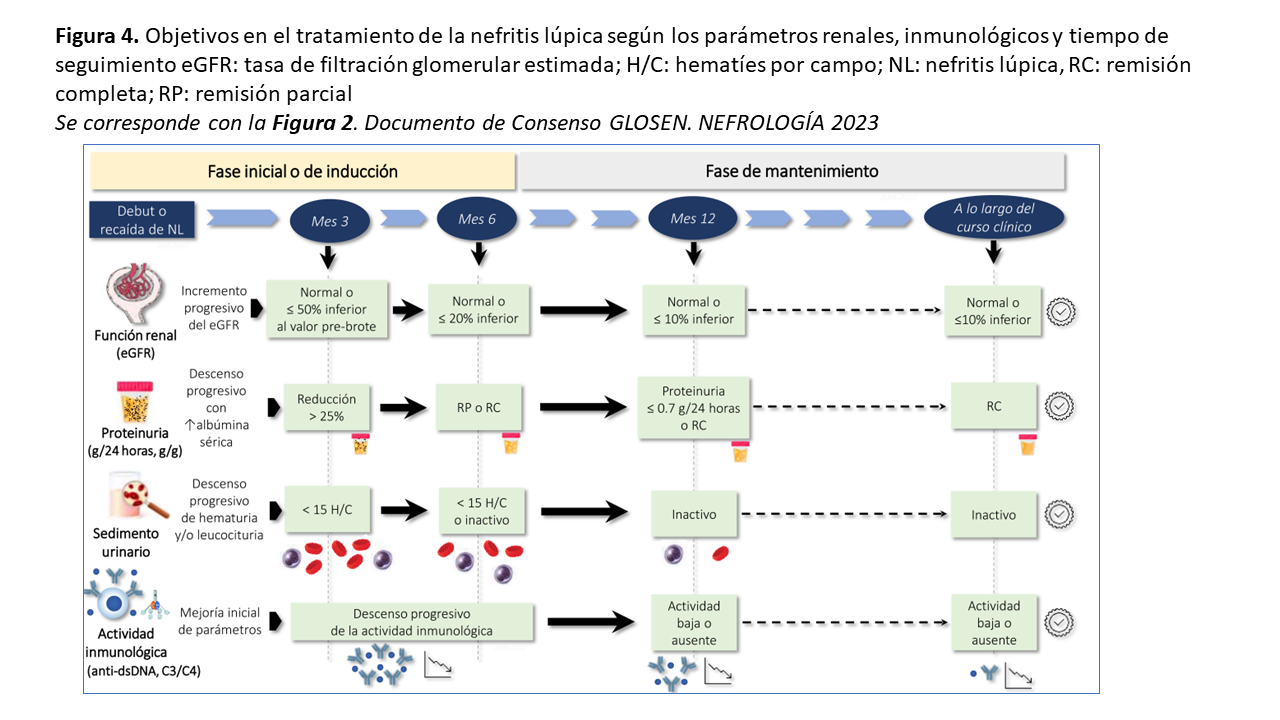
Los objetivos fundamentales tras el tratamiento administrado en los pacientes con NL son alcanzar la remisión completa (RC) o la remisión parcial (RP) (Tabla 7). Esto implica la mejoría de la proteinuria y la recuperación de la función renal si el debut fue con fracaso o insuficiencia renal aguda [4] [5] [111] [122]. Si bien la mayoría de las guías clínicas no incluyen al sedimento urinario dentro de las definiciones de respuesta renal, la hematuria en especial puede ser un marcador sensible de actividad clínica y de utilidad en pacientes con recaídas previas y con proteinuria residual asociada a lesiones crónicas. El objetivo deseable en todos los casos es alcanzar la RC lo más rápidamente posible, dado que la supervivencia renal a largo plazo es significativamente mayor que los casos que alcanzan RP (Figura 4) (Tabla 7).
El tiempo trascurrido hasta la obtención de una RC o RP también es un marcador pronóstico importante. Así, la reducción de proteinuria basal >50% a los 6 meses se asocia a una mejor supervivencia renal [123] y un nivel de proteinuria <0.7 g/24 horas a los 12 meses predice de manera fiable y a largo plazo, la probabilidad de llegar o no a ERC terminal [109] [110]. La monitorización periódica de los parámetros clínicos y analíticos es clave en el seguimiento del paciente, pero los márgenes de tiempo necesarios para alcanzar los objetivos terapéuticos deben ajustarse a la situación previa del paciente y a la gravedad de cada brote de NL [111] [124] [125]. En pacientes que debutan con formas clínicas graves, estos límites de tiempo pueden extenderse, pero siempre que se observe una tendencia positiva hacia la mejoría progresiva de los parámetros clínicos y analíticos.
Entre el 10 y el 50% de los pacientes con NL presentan recaídas, siendo más frecuentes en los pacientes con RP que con RC [82][126][127]. El riesgo de recaída es mayor en los primeros años tras el debut de la NL, especialmente al reducir o suspender el tratamiento inmunosupresor, pero las recaídas se pueden presentar incluso tras años de inactividad clínica. Los controles periódicos son claves para detectar precozmente las recaídas.
Existe controversia en la definición exacta de recaída [3][4][128][129], pero generalmente supone la reaparición o incremento de la proteinuria, de la hematuria y en los casos más graves, deterioro de la función renal sin otra causa que la explique (Tabla 7). Siempre deben descartarse causas ajenas a la actividad lúpica si el deterioro de la función renal no se acompaña de cambios en la proteinuria, el sedimento urinario o la actividad serológica (Tabla 6). En los pacientes con proteinuria residual y lesiones crónicas, especialmente si sólo han alcanzado RP o han tenido recaídas previas frecuentes, el diagnóstico de recaída es más difícil y en esos casos, la repetición de la biopsia renal puede ser de ayuda para valorar la presencia y el grado de actividad histológica.
PARTE 2
Tratamiento de inicio de la nefritis lúpica.
Como se comentaba anteriormente, el tratamiento de la NL debe de ajustarse a los hallazgos de la biopsia renal, según la clase de NL y la presencia de lesiones de actividad y/o cronicidad.
El tratamiento consiste en la mayoría de los casos en fármacos inmunosupresores. No obstante, existe acuerdo general en que todos los pacientes, independientemente de la clase histológica, deben de recibir un fármaco antimalárico, siendo la hidroxicloroquina (HCQ) el más usado. Aunque no existen apenas estudios prospectivos, la HCQ ha demostrado su eficacia en pacientes con LES en numerosos estudios observacionales en los que se observó su capacidad para disminuir la actividad lúpica, evitar los rebrotes e incrementar la supervivencia de los enfermos; se ha observado también su efecto favorable en las complicaciones vasculares y óseas de los pacientes con LES [130][131][132][133]. En cuanto a la NL, la HCQ reduce el riego de recaídas y mejora en general el pronóstico renal [134][135][136][137][138].
La HCQ es bien tolerada en general, aunque puede inducir cambios pigmentarios en la mácula. Por tanto, es esencial la realización de controles oftalmológicos, al inicio del tratamiento y posteriormente anuales. La dosis máxima recomendada es de 4-5 mg/kg/día hasta un máximo de 400 mg/día. En pacientes con ERC estadios 4-5 no se debe sobrepasar la dosis de 200 mg/día. Puede producir también alteraciones cardíacas, miopatía y neuropatía periférica [139][140][141].
Tratamiento de las clases I y II
Las NL tipo I y II son consideradas formas leves de afectación renal del LES con buen pronóstico. No existen estudios controlados acerca de las mejores opciones terapéuticas, pero se acepta que en la mayoría de los casos el tratamiento debe de ser conservador, sin emplear inmunosupresores [142]. No obstante, debe de tenerse siempre en cuenta la posibilidad de cambios clínicos e histológicos a formas más agresivas de NL (clases III/IV). En todos los casos se debe de emplear HCQ y medidas cardioprotectoras generales (dieta, evitar tabaquismo y sobrepeso, vigilancia periódica de tensión arterial y dislipemia). Por otra parte, las manifestaciones extrarrenales lúpicas deberán ser tratadas siguiendo las guías específicas.
Mientras que en la clase I no suelen detectarse anomalías analíticas, en la clase II es frecuente la microhematuria y la proteinuria, generalmente de escasa cuantía. En ausencia de estudios específicos enfocados a estas clases de NL, se acepta que los pacientes con proteinuria <1g/24h sean tratados de forma conservadora, fundamentalmente con fármacos antiproteinúricos. El bloqueo del sistema renina-angiotensina con IECA o ARA-II juega un papel predominante en estos casos, por su efecto antiproteinúrico, antihipertensivo y potencialmente antiinflamatorio [142][143].
El manejo es más difícil en los casos de NL clase II que presentan proteinuria > 1g/24 h a pesar de tratamiento con IECA/ARA-II. La adición de inhibidores del co-trasportador sodio-glucosa tipo 2 (SGLT2) puede reducir más la proteinuria, pero es recomendable en estos casos revisar la biopsia renal para confirmar que se trata de una Clase II ó, si ha trascurrido bastante tiempo desde la misma, plantearse una nueva biopsia para descartar cambio a formas más graves de NL [98]. Pero si se confirma el diagnóstico de NL clase II y la proteinuria persiste en valores >1 g/24h a pesar del abordaje conservador, es razonable prescribir un ciclo de tratamiento inmunosupresor, sobre todo si existe microhematuria de origen glomerular acompañando la proteinuria. Se han publicado pocos trabajos sobre este tipo de casos, pero se ha descrito un efecto favorable de ciclos cortos de corticoides acompañados o no de micofenolato mofetil (MMF) o análogos del ácido micofenólico (MPAA), de unos 6-12 meses de duración y seguidos de una retirada gradual de estos fármacos [144][145].
Podocitopatía Lúpica
La patogenia de la podocitopatía lúpica, una forma infrecuente de NL, no está aclarada. Su presentación clínica es muy similar a la de las lesiones mínimas, es decir un síndrome nefrótico completo de instauración generalmente brusca. Al igual que en esta entidad, la mayoría de los casos presentan una rápida respuesta a los corticoides, con desaparición completa de la proteinuria. No obstante, son frecuentes las recaídas y de nuevo como en las lesiones mínimas, puede existir córticodependencia [146][147][148][149]. Por todo ello, el tratamiento recomendado es similar al de las lesiones mínimas, con corticoides como fármacos de primera línea e inhibidores de calcineurina en los casos córticorresistentes. En caso de recaídas frecuentes o córticodependencia el MMF/MPAA, los inhibidores de calcineurina o el rituximab son efectivos en muchos casos.
Tratamiento de las Clases III/ IV ± V.
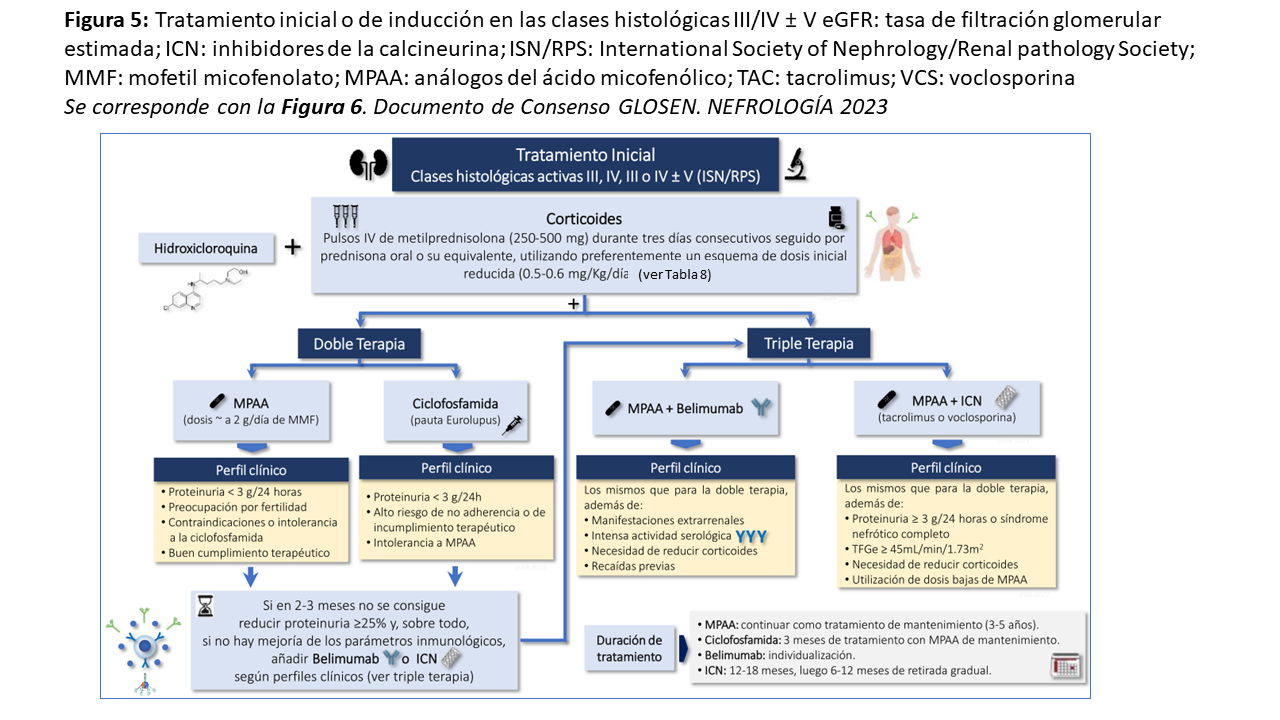
Tanto la clase III como la IV pueden ser puras o presentar manifestaciones histológicas características de la clase V (principalmente depósitos de inmunocomplejos subepiteliales). En la (Figura 5) se presenta un algoritmo terapéutico para estas clases de NL, las más frecuentes y graves.
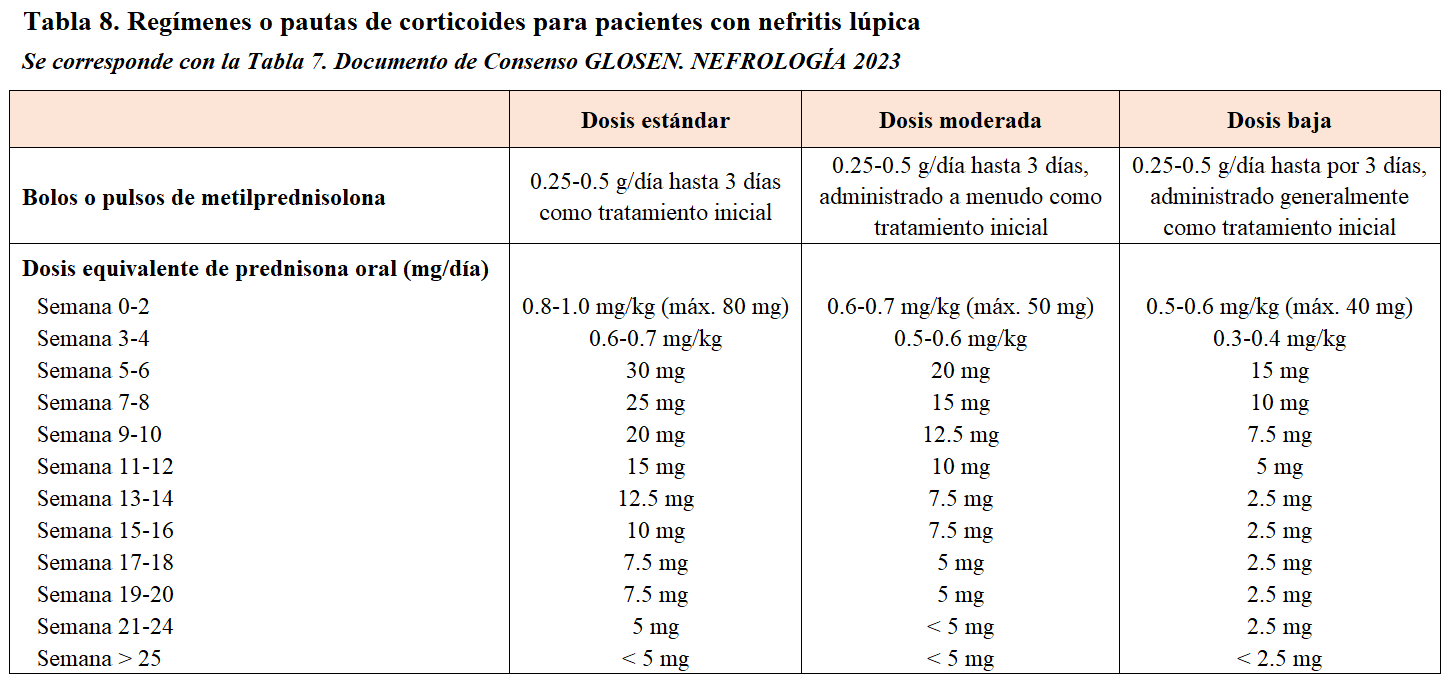
Además de la HCQ, el tratamiento recomendado consiste en corticoides junto a otro inmunosupresor. Los corticoides son fármacos de probada eficacia en la NL y deben de administrarse en todo paciente con clases III/IV ± V salvo contraindicaciones evidentes [139][150]. La pauta de administración ha evolucionado en los últimos años hacia una preferencia por dosis elevadas en los primeros días y una rápida disminución hacia dosis bajas de mantenimiento. La mayoría de las guías clínicas recomienda bolos intravenosos de metilprednisolona (250-500 mg/día) durante tres días consecutivos, para conseguir una rápida reversión de las lesiones inflamatorias características de estas clases histológicas. En los últimos estudios, estos bolos van seguidos de pautas de prednisona oral en dosis menores a las tradicionales (Tabla 8). Con ellas se consiguen beneficios similares a las dosis tradicionales y con una menor dosis acumulada [3][4][151].
Como acompañantes de los corticoides, MMF/MPAA ó ciclofosfamida son los fármacos preferentemente usados. MMF/MPAA han demostrado una eficacia similar [152][153] o incluso superior a la ciclofosfamida [154], junto con una mejor tolerancia y menos complicaciones a corto y largo plazo. Por este motivo, MMF/MPAA son el tipo de inmunosupresor más frecuentemente usado en las NL clases III/ IV ± V [3][4]. Sin embargo, la ciclofosfamida continúa teniendo un lugar importante en el tratamiento [155][156][157][158][159][160], sobre todo en pacientes con un incumplimiento terapéutico reiterado. Dado que los corticoides y MMF/MPAA se administran por vía oral, un número significativo de pacientes no toma las dosis prescritas de estos fármacos o las toman de forma discontinua. Diversos estudios han mostrado que la falta de un seguimiento continuo del tratamiento es una de las principales causas de mala evolución final de las NL graves. La ventaja de la ciclofosfamida en estas situaciones es su administración intravenosa hospitalaria, con lo que se asegura la recepción del fármaco por el paciente.
Existen pautas de administración oral de ciclofosfamida en la NL, pero se prefieren los bolos intravenosos, dado que han demostrado una eficacia similar y la dosis acumulada es menor con ellos. Dentro de las pautas de administración intravenosa, la conocida como “pauta Eurolupus” (6 bolos de 500 mg de ciclofosfamida cada 15 das, lo que equivale a una dosis total de 3 gramos) es la más utilizada hoy en día. El estudio Eurolupus demostró que esta pauta es de similar eficacia a la pauta tradicional de bolos intravenosos mensuales con dosis más altas de ciclofosfamida [155][158]. Aunque en el estudio Eurolupus se usó la azatioprina como fármaco de mantenimiento tras los bolos de ciclofosfamida, actualmente se prefiere MMF/MPAA.
Otros tipos de fármacos han demostrado recientemente su eficacia en las NL clases III/ IV ± V cuando se añaden a los corticoides y a MMF/MPAA ó ciclofosfamida. Uno de ellos son los inhibidores de calcineurina. Tanto la ciclosporina como el tacrolimus han demostrado a lo largo de las últimas décadas su potencial inmunosupresor y, de hecho, continúan siendo, particularmente el tacrolimus, la base de la terapia antirrechazo en los trasplantes de órganos sólidos [161][162][163]. Además, los anticalcineurínicos poseen una especial propiedad que los hace muy atractivos en perfiles determinados de NL: un potente efecto antiproteinúrico, en gran medida independiente del efecto inmunosupresor, y que se debe a su efecto estabilizador sobre el citoplasma de los podocitos [161][162][163]. Con tacrolimus existe evidencia retrospectiva y prospectiva sobre su eficacia como tratamiento de inducción de la NL [164][165]. Estudios realizados en China han demostrado que la así llamada “multi-target therapy”, consistente en una triple terapia con corticoides+MMF+Tacrolimus, lograba un número de remisiones completas significativamente mayor que el tratamiento con corticoides+ciclofosfamida intravenosa [166][167]. Más recientemente, la introducción de voclosporina ha representado un importante avance en este terreno. La voclosporina es un análogo de la ciclosporina con modificaciones en su estructura que le confieren mayor efectividad, menos efectos secundarios y la posibilidad de administrar dosis fijas sin realización de niveles. En los estudios prospectivos AURA-LN y AURORA-1 [168][169], la adición de voclosporina a los corticoides+MMF indujo un porcentaje de remisiones completas significativamente mayor que el tratamiento con corticoides+MMF+placebo y sin un mayor número de efectos adversos. Seguimientos a más largo plazo sugieren que la voclosporina no causa nefrotoxicidad a diferencia del tacrolimus ó ciclosporina cuando se administran prolongadamente y a dosis elevadas, aunque se requieren estudios a más largo plazo.
El belimumab es un anticuerpo monoclonal anti-BLYS, un factor estimulante de la proliferación de linfocitos B [170] [171]. Su eficacia para disminuir las manifestaciones extrarenales del LES, así como su actividad inmunológica, habían sido demostradas previamente [172][173][174]. El estudio BLISS-LN demostró que la adición de belimumab a los corticoides+otro fármaco inmunosupresor (ciclofosfamida o MMF) inducía un significativo mayor número de remisiones que el placebo [175]. Este efecto beneficioso del belimumab no se observó en los subgrupos con proteinuria significativa, pacientes de raza negra o que habían recibido ciclofosfamida. Análisis posteriores del estudio BLISS-LN mostraron que el belimumab prevenía además la aparición de recaídas y enlentecía la pérdida de función renal [176].
Como se muestra en la (Figura 5) este arsenal terapéutico de que disponemos hoy en día debería de administrarse en función del perfil del paciente. Los corticoides junto a MMF/MPAA serían el tratamiento de elección en la mayoría de los pacientes, salvo en aquellos con un acusado perfil de incumplimiento terapéutico en los que la ciclofosfamida (en pauta Eurolupus) sería preferible a MMF/MPAA. Si al cabo de 2-3 meses de tratamiento no se consigue mejoría (sobre todo una reducción de proteinuria de al menos un 25%) es aconsejable añadir belimumab (sobre todo si persisten manifestaciones extrarenales con intensa actividad serológica) o un anticalcineurínico (sobre todo si persiste proteinuria significativa). No obstante, es necesario destacar que en los estudios recientes se está comparando triple con doble terapia inmunosupresora desde un inicio, generalmente corticoides+MMF+ICN o belimumab versus corticoides+MMF+placebo [168][169][175]. Dado que la eficacia de la triple terapia es superior y sin una tasa de efectos secundarios mayor, parece razonable iniciar triple terapia inmunosupresora en determinados perfiles clínicos: corticoides + MMF/MPAA + anticalcineurínicos en casos con proteinuria > 3 g/día o síndrome nefrótico completo, ó corticoides + MMF/MPAA +belimumab en casos con intensa actividad serológica, hipocomplementemia marcada y manifestaciones lúpicas extrarenales.
Tratamiento inicial de la Clase V (Nefropatía Membranosa)
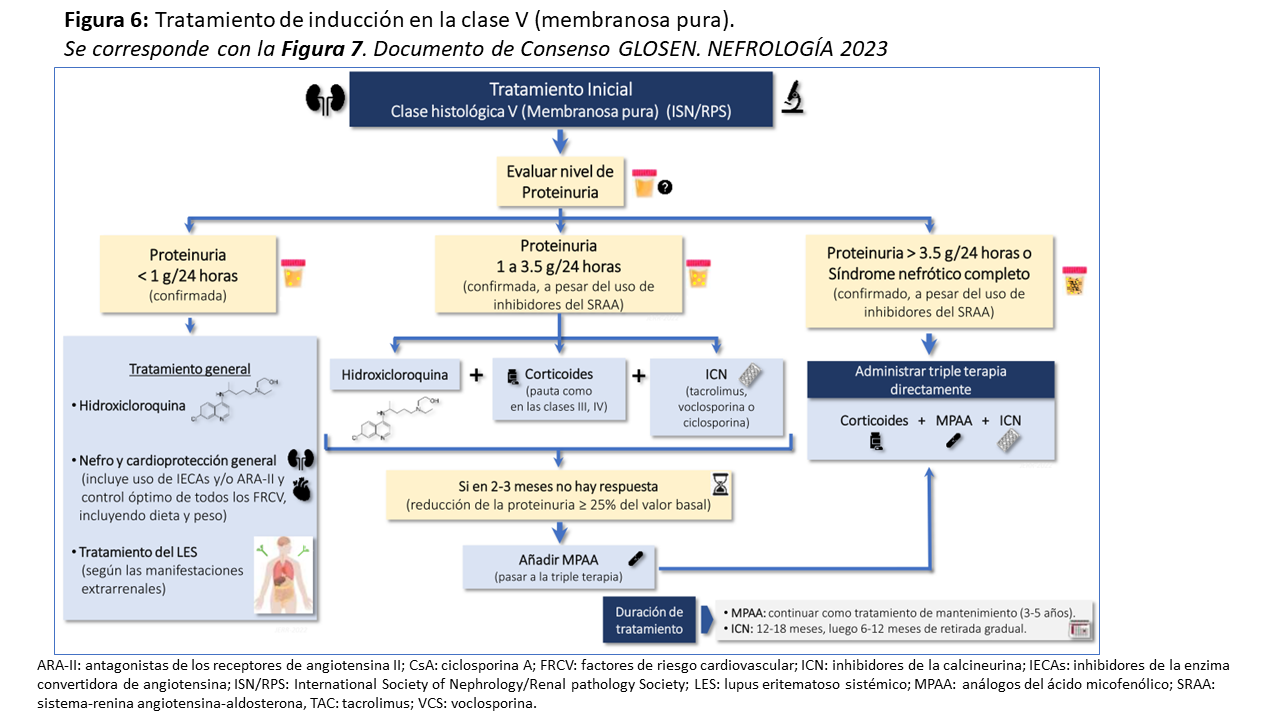
La clase V se presenta entre el 15-20% de todos los pacientes con NL y frecuentemente con síndrome nefrótico [85]. En esos casos la indicación de tratamiento inmunosupresor es clara y se recomienda desde el inicio la triple terapia con corticoides, ICN (tacrolimus, voclosporina, ciclosporina) y MPAA [3][4][5][177]. Sin embargo, la inmunosupresión en pacientes con proteinuria no nefrótica (1-3.5 g/24h) es más controvertido, pudiendo considerarse la inmunosupresión si la proteinuria persiste > 1 g/24h a pesar del bloqueo optimizado del SRAA [177][178]. En estos casos se puede administrar doble terapia con corticoides e ICN (tacrolimus, voclosporina, ciclosporina). Si tras 3-4 meses de tratamiento no se ha obtenido una reducción de la proteinuria de al menos un 25%, y especialmente cuando coexiste actividad inmunológica persistente, puede añadirse MPAA. En pacientes con proteinuria <1 g/24h, no se recomienda iniciar tratamiento inmunosupresor, pero es mandatorio el uso de HCQ, nefroprotección y tratamiento del LES según las manifestaciones extrarrenales [3][4][5][177] (Figura 6).
PARTE 3
Tratamiento de mantenimiento
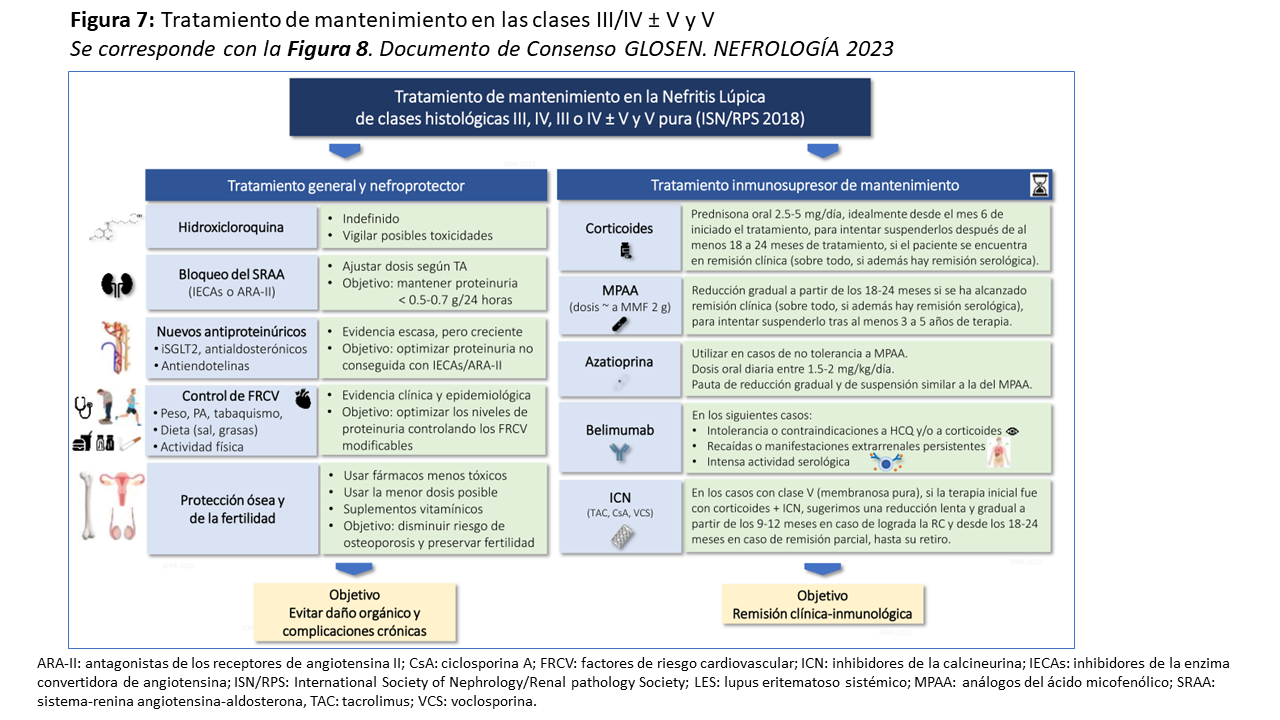
Los objetivos durante la terapia de mantenimiento son mantener la remisión clínica y serológica a largo plazo con el menor número y la menor dosis efectiva posible de inmunosupresores, evitando la aparición de recaídas y el daño orgánico acumulativo por la enfermedad y por el tratamiento administrado. En ese sentido, los regímenes basados en una dosis reducida de corticoides (2,5-5 mg/d) han demostrado una eficacia similar a los basados en dosis más altas, con una menor tasa de efectos secundarios [172] [175]. Así, una vez alcanzada la remisión clínica y serológica, se recomienda la suspensión de los corticoides después de 18-24 meses de tratamiento, especialmente en pacientes en tratamiento con HCQ u otro agente inmunosupresor [5] [177].
No se recomienda ciclofosfamida intravenosa como terapia de mantenimiento debido al riesgo de eventos adversos graves relacionados con una dosis acumulada excesiva. MPAA o azatioprina han demostrado una mayor eficacia con una menor tasa de efectos secundarios [179], siendo el MMF superior a la azatioprina en la prevención de recaídas post-remisión [180]. La azatioprina (1,5-2 mg/Kg/día) es una alternativa eficaz en pacientes que no toleran los MPAA.
En pacientes que alcancen la remisión clínica y serológica con MPAA o con azatioprina, se recomienda una reducción progresiva y lenta de la dosis después de 18-24 meses de tratamiento y la duración total del tratamiento debe ser de al menos 3-5 años [3][4][5].
Para pacientes con recaídas frecuentes, intolerancia o contraindicaciones a la HCQ o manifestaciones extrarrenales persistentes, belimumab es una alternativa válida, dado que reduce el riesgo de recaídas [175][176].
El régimen óptimo de mantenimiento en la NL clase V no está bien establecido dado la escasez de ensayos clínicos. Ciclosporina puede tener una eficacia clínica incluso mayor que la ciclofosfamida o los corticoides a 12 meses, pero el riesgo de recaídas es mayor [181]. Este riesgo parece ser similar cuando se compara con la azatioprina [182]. Tacrolimus y MPAA tienen una eficacia similar como terapia de mantenimiento [165]. En cualquier caso, en pacientes con NL clase V que hayan alcanzado la remisión clínica tras el tratamiento inicial con ICN y corticoides, se sugiere una duración del tratamiento entre 12 a 18 meses, seguidos de una disminución gradual de la dosis de los ICN durante 6 a 12 meses si alcanzaron RC o de 12 a 18 meses si los pacientes alcanzaron RP y persisten con proteinuria significativa [177].
El tratamiento no inmunosupresor (Figura 7) es clave durante la fase de mantenimiento, debiendo enfatizarse estilos de vida saludables (ejercicio físico regular, evitar el sobrepeso y el tabaquismo) y el control de todos los factores de riesgo cardiovascular [183][184]. El uso de HCQ debe mantenerse para reducir el riesgo de recaídas [135][136) y mejorar el pronóstico renal [131][132].
El tratamiento con bloqueadores del SRAA y la restricción de sal son fundamentales para el control óptimo de la presión arterial y de la proteinuria [185]. Los inhibidores del cotransportador de sodio-glucosa-2 (SGLT2i) y los bloqueadores de los receptores de aldosterona y endotelina [186][187][188][189] son opciones lógicas para optimizar los niveles de proteinuria y el riesgo cardiovascular. Aunque la evidencia específica de su beneficio en pacientes con NL aún es escasa, datos preliminares sugieren un importante efecto antiproteinúrico en pacientes con NL, particularmente en aquellos con RP [190][191]. La (Figura 7) os muestra lo comentado de manera esquemática.
Prevención y tratamiento de las recaídas
Aunque no existen estudios concluyentes, aproximadamente un 20-30% de los pacientes con NL presentan recaídas. Aunque son más frecuentes en los primeros años de evolución, sobre todo tras suspender el tratamiento inmunosupresor, pueden presentarse tras muchos años de inactividad del LES. El tratamiento de las recaídas debería de ajustarse a las recomendaciones apuntadas en la (Figura 8) según el perfil clínico de la recaída. Las recaídas tienen un gran impacto sobre la evolución a largo plazo, puesto que empeoran la reserva de nefronas funcionantes y la mayoría de los casos que finalmente evolucionan a ERC terminal son aquellos que han presentado al menos una recaída.
Un aspecto fundamental para la prevención de recaídas es el cumplimiento terapéutico estricto. El tratamiento indefinido con HCQ es importante en este sentido, pues se ha comprobado un menor riesgo de recaídas con su administración prolongada [134][135][136]. Tras lograr remisión de la recaída, es aconsejable mantener MPAA como mantenimiento (o azatioprina en caso de intolerancia a MPAA) por un período de tiempo muy prolongado, más allá de los 3-5 años que se recomiendan tras el primer brote de la NL. Incluso puede ser recomendable mantener dosis relativamente bajas de MPAA de manera indefinida en aquellos casos con recaídas repetidas.
El belimumab ha demostrado en análisis post-hoc del estudio BLISS-LN disminuir la incidencia de recaídas [176], por lo que es otro agente terapéutico interesante para pacientes con recaidas, particularmente en aquellos que no toleran la HCQ.
Aunque no es necesaria la biopsia renal en cada caso de recaída, ésta puede estar indicada en casos con una presentación clínica muy diferente a la del primer brote. En los casos con recaídas repetidas, es frecuente la presencia de proteinuria mantenida y deterioro de función renal. Una nueva biopsia puede ofrecer información crucial acerca de si la proteinuria y el deterioro de función renal se deben a NL activa o a lesiones de cronicidad.
PARTE 4
Situaciones especiales en el paciente con nefritis lúpica
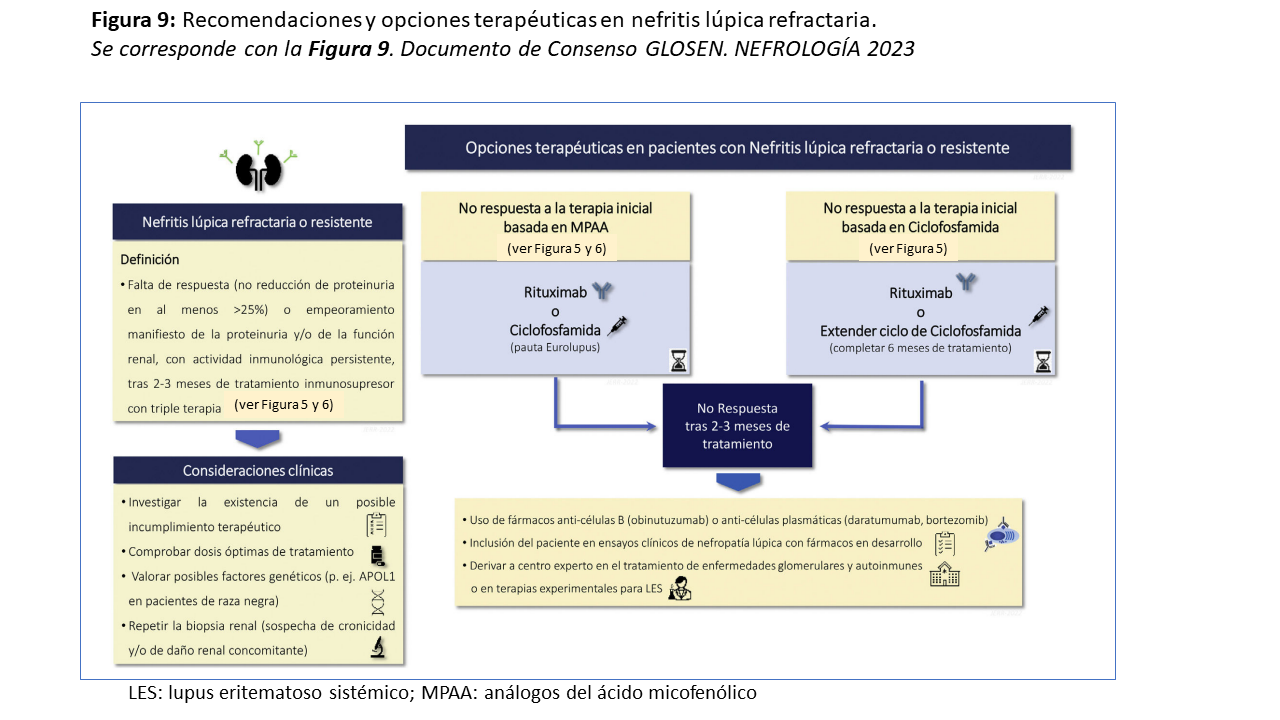
Nefritis lúpica refractaria
Hasta el 20-30% de los pacientes con NL pueden ser refractarios al tratamiento inicial [192]. Aunque no existe un acuerdo general sobre la definición de NL refractaria [193][194], la tendencia actual es considerar la enfermedad refractaria en caso de no respuesta al menos a dos esquemas diferentes de tratamiento inmunosupresor o tras 3 meses de tratamiento inmunosupresor basado en la triple terapia [177]. En cualquier caso, es fundamental descartar previamente un posible incumplimiento terapéutico, dosis subóptimas de tratamiento, factores genéticos que influyan en la respuesta y la presencia de lesiones crónicas, especialmente en pacientes con brotes previos de NL [97][98][99][195].
En pacientes cuyo tratamiento inicial se basó en MPAA, puede añadirse rituximab o cambiar MPAA por ciclofosfamida (pauta Eurolupus). Si el tratamiento inicial fue con ciclofosfamida, se puede añadir rituximab o extender los pulsos de ciclofosfamida hasta completar 6 meses de tratamiento. Aunque rituximab no ha demostrado superioridad como terapia adicional a MPAA+corticosteroides en pacientes nuevos [196], varios estudios observacionales que incluyen pacientes de diversos grupos étnicos han demostrado que rituximab puede ser utilizado eficazmente como terapia de rescate en NL refractaria [197][198][199][200][201][202].
Los pacientes que no responden a la terapia con rituximab o ciclofosfamida prolongada podrían beneficiarse de las nuevas terapias anti-CD20 (obinutuzumab) o anticélulas plasmáticas (bortezomib, daratumumab) [203] [204] [205]. La terapia celular con células CAR-T podría ser una alternativa para pacientes con NL refractaria a varias líneas de tratamiento [206] [207]. En estos pacientes es recomendable lograr su inclusión en los ensayos clínicos en curso que están evaluando nuevas terapias (Figura 9).
Microangiopatía trombótica
Los pacientes con NL, sobre todo los casos con clases III/ IV ± V pueden presentar lesiones de MAT en la biopsia renal y en algunos casos se acompañan de las características repercusiones hematológicas de MAT (anemia hemolítica microangiopática y trombocitopenia, con esquistocitos y LDH elevada). La causa de MAT asociada a NL es variable: por una parte, el depósito de inmunocomplejos en las paredes vasculares puede inducir un daño endotelial lo suficientemente grave como para desencadenar una MAT. En estos casos, el tratamiento debe de consistir fundamentalmente en los inmunosupresores recomendados para la NL. No obstante, algunos pacientes desarrollan autoanticuerpos contra ADAMTS-13, un enzima que previene la agregación de multímeros de von Willebrand. En estos casos, la patogenia es por tanto similar a la de la púrpura trombótica trombocitopénica (PTT), entidad en la que se requiere una actividad de ADAMTS-13 inferior al 5-10% de la normalidad para establecer el diagnóstico [208]. La determinación de ADAMTS-13 es por tanto necesaria en todo paciente con NL y lesiones de MAT en la biopsia renal o MAT hematológica. Si no es posible su determinación, el score PLASMIC ha demostrado su validez en diversos estudios [209]. Cuando se comprueba una actividad de ADAMTS-13 anormalmente baja, la adición de plasmaféresis al tratamiento inmunosupresor puede ser eficaz para resolver la MAT más rápidamente
Hasta un 30-40% de pacientes con LES pueden presentar anticuerpos antifosfolípidos, y un número significativo de ellos pueden desarrollar un síndrome antifosfolípido (SAF) [209][210][211][212][213][214][215]. En el SAF, además de la predisposición a las trombosis venosas e incluso arteriales, pueden observarse lesiones renales muy similares a las de la MAT [215][216]. La inmunosupresión no es efectiva para tratar o prevenir las lesiones vasculares del SAF, siendo el tratamiento anticoagulante permanente la opción obligada en pacientes con SAF y lesiones renales [217][218].
Se han empleado bloqueantes del complemento (eculizumab) en pacientes con NL y MAT de presentación agresiva (fallo renal agudo, MAT hematológica y afectación de otros órganos) con resultados variables [72][73][219][220][221][222][223][224][225]. Se necesitan estudios prospectivos controlados para determinar si el bloqueo del complemento puede ofrecer beneficios adicionales al tratamiento inmunosupresor en este tipo de casos.
Nefritis lúpica y embarazo
Las pacientes con NL tienen un riesgo más elevado de presentar preeclampsia, prematuridad y otras complicaciones materno-fetales durante el embarazo [226][227][228]. Además, existe el riesgo de una recaída de la NL o bien, la aparición de esta durante el embarazo en pacientes con LES. Por todo ello, el embarazo debe de ser cuidadosamente planificado y controlado en unidades de embarazo de alto riesgo, con la colaboración continuada del nefrólogo.
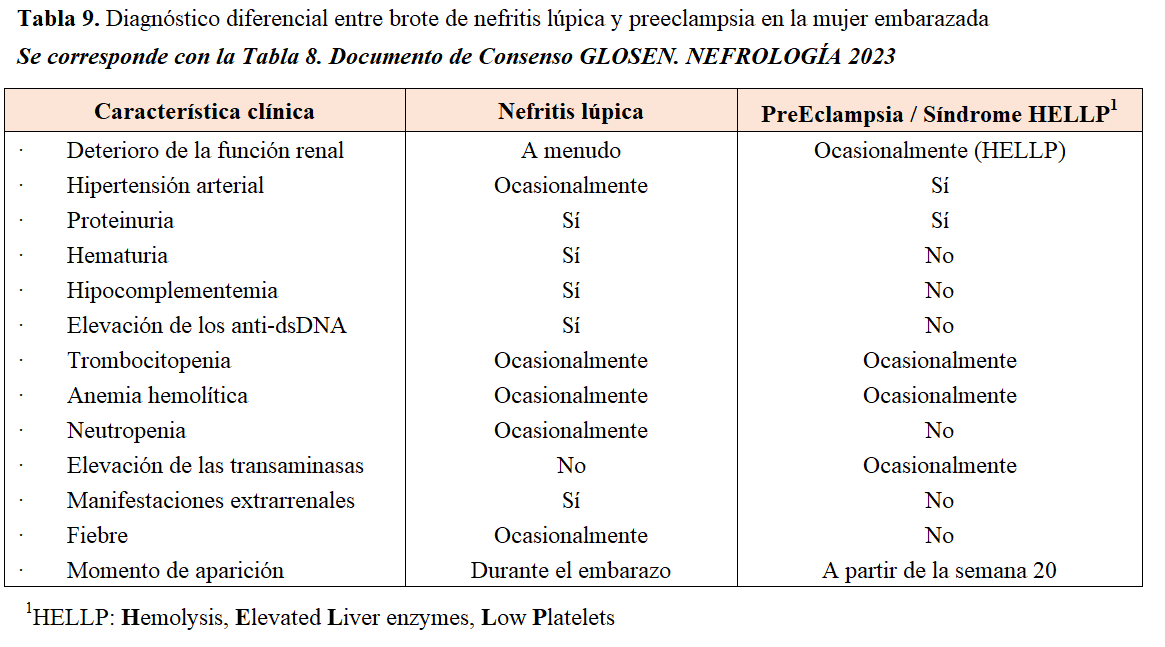
Los criterios para diagnosticar NL durante el embarazo son los mismos que fuera del mismo. Puede presentarse en cualquier momento del embarazo, pero su aparición en el último trimestre plantea el problema de su diagnóstico diferencial con la preeclampsia, dado que ambas entidades comparten síntomas y datos analíticos (hipertensión, proteinuria). En la (Tabla 9) se resumen aspectos importantes para la diferenciación entre NL y otras complicaciones del embarazo, En los casos dudosos o cuando la situación clínica lo aconseje, se puede realizar biopsia renal siempre que no existan contraindicaciones [229][230].
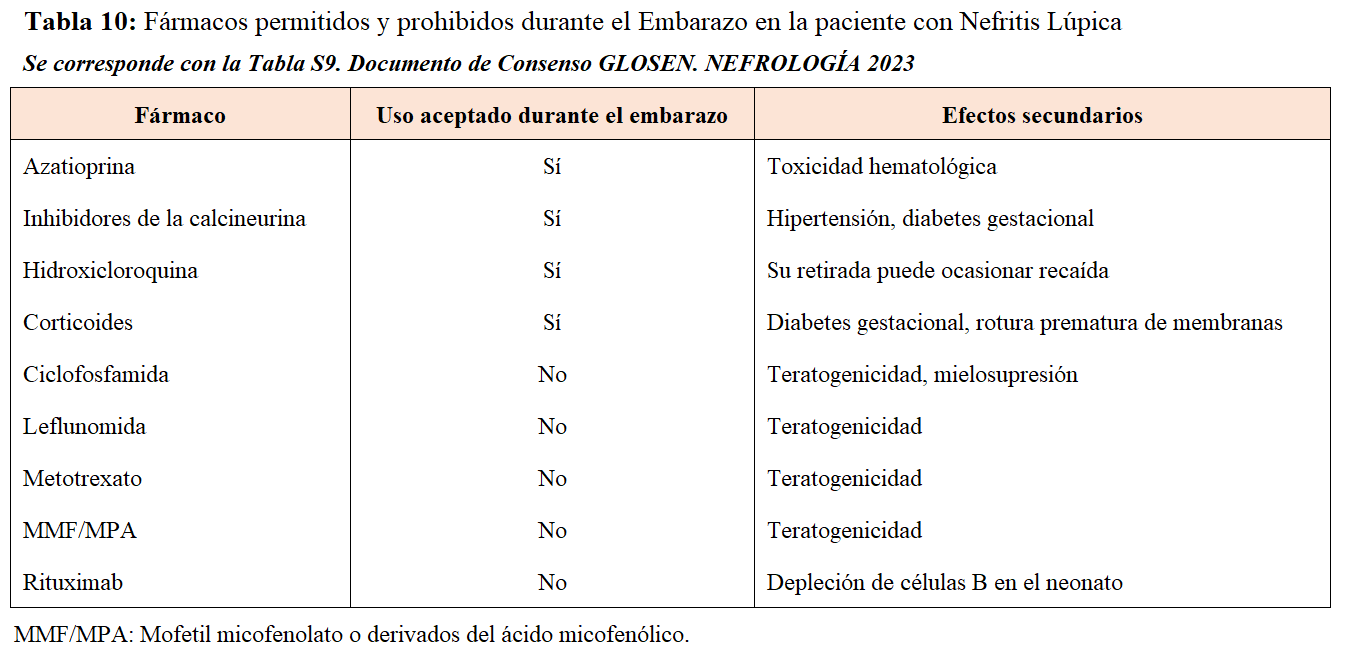
Por el riesgo de recidiva de la NL y la aparición de preeclampsia en el último trimestre, se recomienda mantener el tratamiento con HCQ y la toma de dosis bajas de ácido acetilsalicílico (100 mg/día) [4]. Cuando se requiere la toma de inmunosupresores durante el embarazo, bien por el riesgo de recaída de la NL o por diagnosticarse un nuevo brote, los esteroides a dosis bajas, la azatioprina y los ICN son las opciones indicadas, dado que es fundamental evitar todo fármaco con potencial teratogénico. En la (Tabla 10) se resumen los fármacos permitidos y prohibidos durante el embarazo.
PARTE 5
Medidas terapéuticas no inmunosupresoras
Las medidas dietéticas y un estilo de vida saludable son cruciales para el buen manejo del paciente con LES, sobre todo en las fases de mantenimiento. Una dieta equilibrada mediterránea, el ejercicio físico regular y el evitar obesidad, tabaquismo o consumo de otros tóxicos tienen un gran impacto en el pronóstico a largo plazo [231][232]. Es importante destacar que los pacientes con LES tienen un riesgo muy elevado de desarrollar arteriosclerosis precoz y complicaciones cardiovasculares graves, debido por una parte a la inflamación sostenida asociada al LES y por otra, a los efectos secundarios de los tratamientos, principalmente las dosis acumuladas de esteroides. El control adecuado de tensión arterial y de la dislipemia, frecuente en los pacientes con NL, son importantes para prevenir eventos cardiovasculares [185][186][187][233].
La cuantía de la proteinuria durante el seguimiento a largo plazo es el mejor predictor de una buena ó mala evolución renal. Se ha demostrado que una proteinuria inferior a 0.7 g/día durante el seguimiento es un excelente predictor de estabilidad renal [234][235]. Por ello, además del tratamiento inmunosupresor que precise el paciente, es fundamental el uso adecuado de fármacos no inmunosupresores renoprotectores y antiproteinúricos, muchos de los cuales tienen además un potente afecto antihipertensivo. Los bloqueantes del SRAA, cuyas dosis deben de ajustarse a los objetivos de tensión arterial y proteinuria, continúan siendo el eje fundamental de este tipo de tratamiento [185]. Aunque no existen estudios específicamente dedicados a la NL, los inhibidores del cotransportador sodio-glucosa 2 del túbulo proximal (SGLT2) han demostrado un gran impacto en la reducción del riesgo cardiovascular y renal tanto en la nefropatía diabética como en muy diversas nefropatías crónicas [186], poseyendo además un notable efecto antihipertensivo y antiproteinúrico.
Prevención del daño crónico y de los efectos adversos del tratamiento
Los objetivos en el tratamiento de pacientes con NL van más allá de la remisión renal. El LES es una enfermedad inflamatoria crónica y autoinmune que afecta a diferentes órganos y sistemas. La disfunción inmunitaria y la aterosclerosis acelerada son condiciones asociadas con el LES y la NL [3][84][107][108]. Todo ello, sumado al desarrollo de una ERC progresiva, con persistencia de la proteinuria y del deterioro de la función renal y los efectos adversos asociados al tratamiento, tienen un impacto clínico significativo en el desarrollo de complicaciones agudas y crónicas. Así, los pacientes con NL tienen una mayor susceptibilidad a desarrollar infecciones y neoplasias, eventos cardiovasculares, alteraciones metabólicas, afectación del sistema osteo-musculoesquelético, daños cutáneo y ocular e infertilidad, afectando la calidad y la esperanza de vida [236]. Por ello, la prevención y el tratamiento adecuado de todas estas complicaciones dentro de un enfoque holístico y multidisciplinar, es fundamental.
PARTE 6
Nuevos fármacos en el tratamiento de la nefritis lúpica
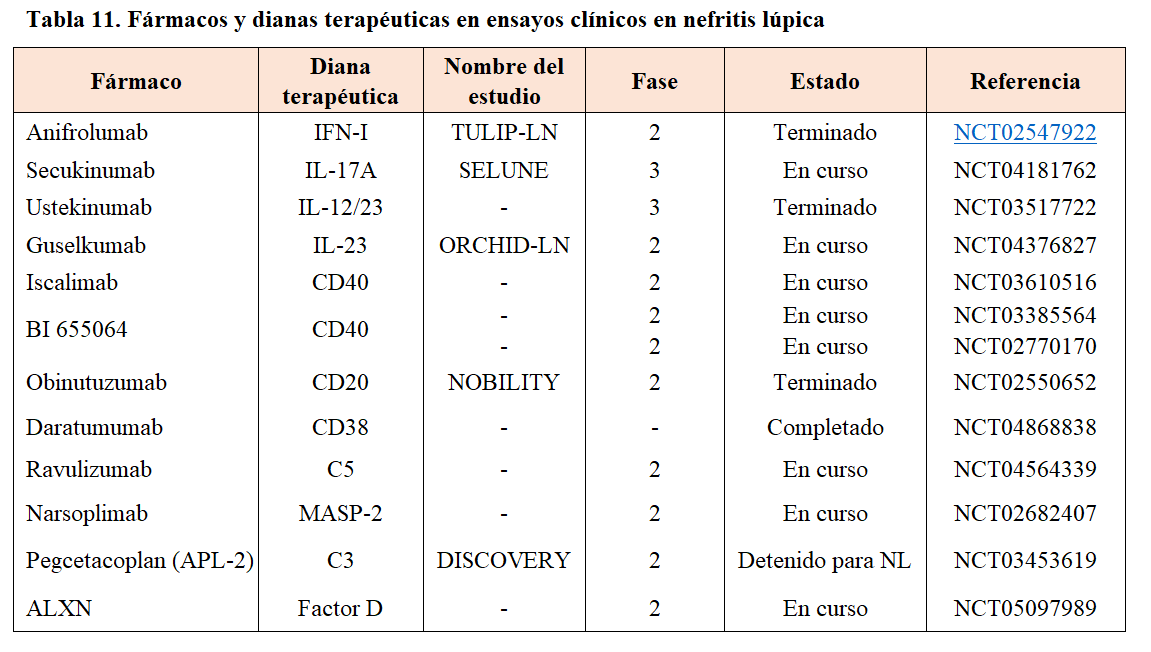
A pesar de los avances diagnósticos y terapéuticos, la progresión de la NL a fases avanzadas de ERC con necesidad de recibir terapias de sustitución renal, así como el daño orgánico acumulado debido a los efectos adversos de los tratamientos convencionales, aún constituyen un problema clínico importante en los pacientes con NL.
La investigación básica, los modelos animales experimentales y el uso de técnicas genómicas y proteómicas nos han permitido comprender mejor la patogénesis del LES y la NL [1][2] y nos está llevando a desarrollar en un tiempo relativamente corto nuevos y mejores fármacos biológicos dirigidos a bloquear o inhibir dianas celulares y moleculares específicas de la respuesta inmunitaria a nivel sistémico y renal, como la población de células T, B y plasmocitos, la co-estimulación inmunológica célula B-célula T, la señalización del interferón, de los receptores tipo Toll y de quinasas intracelulares, el efecto de citocinas inflamatorias y la activación del sistema del complemento a diferentes niveles (Figura 1). Aunque el desarrollo de esta terapia emergente se encuentra en curso, ya hay evidencia para alguna de ellas de su eficacia clínica en la NL. La (Tabla 11) muestra de manera resumida las características de esta terapia emergente, así como los ensayos clínicos en curso.