Enfermedades Sistémicas y Riñón. Vasculitis
Palabras clave
Vasculitis, kawasaki, ANCA, Wegener, pequeño vaso, churg strauss, shoenlein henoch, goodpasture, crioglobulinemia, esclerosis sistémica, artritis reumatoide, sjogren, sarcoidosis, síndrome antifosfolípido
INTRODUCCIÓN Y NOMENCLATURA
Las vasculitis son un conjunto de enfermedades que se caracterizan por la presencia de un infiltrado inflamatorio leucocitario en la pared de los vasos con daño en las estructuras murales. Cada entidad puede afectar a vasos de diferente tamaño, tipo y localización.
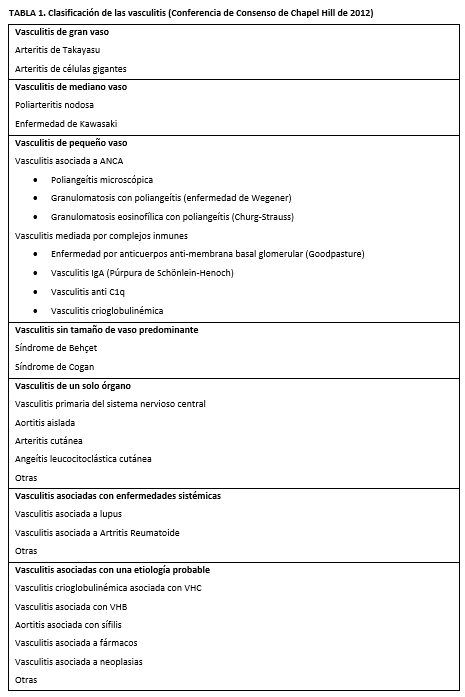
La clasificación más aceptada es la propuesta en la Conferencia Internacional de Consenso de Chapel Hill, revisada en 2012, que se basa principalmente en el tamaño de los vasos afectados (Tabla 1) [1]. Únicamente las vasculitis con afectación de pequeño vaso producen afectación renal glomerular que histológicamente se manifiesta bajo la forma de glomerulonefritis pauci-inmune necrotizante focal con proliferación extracapilar.
La afectación renal en las vasculitis de grandes y medianos vasos es infrecuente, habiéndose descrito lesiones de arterias renales con estenosis, oclusiones o degeneración aneurismática de las mismas. Ello puede determinar cuadros de hipertensión vasculorrenal o fenómenos isquémico-trombóticos.
TIPOS DE VASCULITIS
Podemos diferenciar los siguientes tipos, atendiendo al tamaño del vaso afectado:
• Vasculitis de gran vaso
• Vasculitis de mediano vaso
• Vasculitis de pequeño vaso
• Vasculitis sin tamaño de vaso predominante
Asimismo, se han descrito otros tipos de vasculitis como las que producen afectación de un único órgano, independientemente del tamaño del vaso; vasculitis asociadas con enfermedades sistémicas, como el lupus o la artritis reumatoide; y vasculitis asociadas con una etiología probable (Tabla 1) [1].
VASCULITIS DE GRAN VASO
• Arteritis de Takayasu
Afecta la aorta y ramas principales. La enfermedad se inicia habitualmente antes de los 30 años.
• Arteritis de células gigantes o arteritis de la temporal
Afecta predominantemente la aorta y ramas principales, con preferencia por ramas de la carótida. El inicio de la enfermedad es más tardío, con un incremento de la incidencia a partir de la séptima década de la vida.
VASCULITIS DE MEDIANO VASO
• Poliarteritis nodosa (PAN)
Es una vasculitis necrotizante que compromete arterias de mediano y pequeño calibre, siendo típica la formación de microaneurismas en los vasos afectados. Es más frecuente en varones con un pico de incidencia en la sexta década de la vida [2].
La mayor parte de los casos son idiopáticos, aunque se ha asociado a infecciones por VHB, VHC y algún tipo de desorden linfoproliferativo como la tricoleucemia [3].
Dentro de las manifestaciones clínicas destacan síntomas generales (astenia, fiebre, pérdida de peso…) junto con afectación sistémica [4]:
- Cutánea: son frecuentes los nódulos cutáneos, la púrpura palpable, las úlceras y la livedo reticularis.
- Neurológica: la mononeuritis múltiple con afectación sensitivo motora es uno de los hallazgos más característicos de la PAN, siendo menos frecuentes las lesiones del SNC.
- Gastrointestinal: la clínica digestiva es frecuente, desde episodios autolimitados de dolor abdominal hasta cuadros de hemorragia digestiva o perforación intestinal.
- Renal: se evidencia afectación clínica en más de la mitad de los pacientes. La enfermedad vasculorrenal constituye la entidad más frecuente, con un espectro que abarca desde cuadros de hipertensión vasculorrenal hasta nefropatía isquémica. También se han descrito infartos renales o hematomas perirrenales por rotura de microaneurismas arteriales. La afectación glomerular es excepcional en este tipo de vasculitis.
- Muscular: la debilidad muscular y las mialgias son comunes en la PAN.
El diagnóstico de sospecha se basará en los datos clínicos mencionados. No existen test de laboratorios diagnósticos, siendo negativos los anticuerpos frente al citoplasma de neutrófilos (ANCA) [3][4]. Precisamente este dato junto con la ausencia de afectación glomerular y pulmonar son elementos que permiten diferenciar la PAN de las vasculitis de pequeño vaso. El diagnóstico debería ser confirmado mediante biopsia de un órgano afectado, siendo la arteriografía renal o mesentérica una alternativa al evidenciarse múltiples aneurismas e irregulares estenosis en los vasos afectados. De hecho, ante la sospecha de PAN no debe llevarse a cabo una biopsia renal hasta no haberse demostrado la ausencia de aneurismas mediante técnicas de imagen, dado el elevado riesgo de sangrado en esta población.
En lo referente al tratamiento, se debe tener en cuenta la severidad de la enfermedad, los órganos afectados y la existencia o no de enfermedades asociadas con la PAN, especialmente hepatitis virales, cuyo tratamiento en prioritario en esta población [5]. Todo ello dificulta la existencia de datos clínicos homogéneos en la literatura. Atendiendo a la severidad podemos diferenciar:
- Afectación leve: prednisona a dosis iniciales de 1 mg/kg/día durante 4 semanas, seguido de pauta descendente según respuesta. En casos refractarios al tratamiento se puede añadir azatioprina (AZA), metotrexate o micofenolato mofetil (MMF).
- Afectación moderada-severa: glucocorticoides (orales o intravenosos, dependiendo de la severidad y riesgo vital) asociados con ciclofosfamida (CFA) oral o intravenosa. En la fase de mantenimiento se sustituiría la CFA por AZA, metotrexate o MMF. Recientemente se han descrito tratamientos alternativos con terapias biológicas como rituximab (RTX), anti-TNF alfa o bloqueo de IL-6 con tozilizumab como opción terapéutica en pacientes con PAN refractaria [6].
El control tensional resulta prioritario, siendo los bloqueantes del sistema renina angiotensina los fármacos de elección, debiendo realizarse estrecho control de la función renal ante la posible existencia de estenosis a nivel de las arterias renales.
• Enfermedad de Kawasaki
Es una vasculitis, descrita predominantemente en niños, que implica arterias medianas y pequeñas. Se acompaña de afectación ganglionar y mucocutánea, pudiendo verse asimismo lesionadas las arterias coronarias. Se han descrito muy pocos casos en adultos, siendo la afectación renal excepcional [7].
VASCULITIS DE PEQUEÑO VASO
Estas vasculitis son las que más frecuentemente pueden ocasionar afectación renal y se discutirán de forma independiente en un apartado independiente. Dentro de estas se pueden diferenciar las siguientes entidades [1]:
• Vasculitis asociada a ANCA (VAA)
• Vasculitis de pequeño vaso mediada por complejos inmunes
VASCULITIS SIN TAMAÑO DE VASO PREDOMINANTE
Se engloban aquí un grupo de vasculitis donde no existe un único y predominante tamaño de vaso afectado. Dentro de estas se incluyen el síndrome de Behçet o el síndrome de Cogan, no siendo frecuente la lesión renal.
VASCULITIS DE UN SOLO ÓRGANO
Se han descrito vasculitis con afectación de un solo órgano, independientemente del tamaño del vaso lesionado, destacando entre estas la denominada vasculitis primaria del sistema nervioso central.
VASCULITIS ASOCIADAS CON ENFERMEDADES SISTÉMICAS
Pacientes con criterios de lupus eritematoso sistémico, artritis reumatoide y otras enfermedades reumáticas pueden presentar vasculitis, siendo lo más frecuente la afectación de arterias musculares pequeñas, arteriolas y vénulas.
VASCULITIS ASOCIADAD CON UNA ETIOLOGÍA PROBABLE
Algunas vasculitis se relacionan con etiologías específicas, tales como fármacos, procesos infecciosos, hematológicos o neoplásicos.
VASCULITIS DE PEQUEÑO VASO
Este tipo de vasculitis son las que más frecuentemente producen afectación renal. Se deben diferenciar las vasculitis asociadas a ANCA (VAA) y las mediadas por complejos inmunes.
Antes de analizar detenidamente las vasculitis de pequeño vaso repasaremos brevemente el espectro clínico de los ANCA, elemento fundamental en este tipo de vasculitis.
ESPECTRO CLÍNICO DE LOS ANCA
Los ANCA son anticuerpos dirigidos contra antígenos del citoplasma de neutrófilos, encontrándose implicados directamente en la patogenia de un amplio grupo de vasculitis de pequeño vaso. Estos anticuerpos pueden detectarse en suero mediante 2 técnicas complementarias:
• Inmunofluorescencia indirecta: discrimina el patrón perinuclear (p-ANCA) del citoplasmático (c-ANCA).
• ELISA: detecta los anticuerpos dirigidos frente a mieloperoxidasa (MPO) de los dirigidos frente a la proteinasa 3 (PR3).
La mayoría de los p-ANCA son anti-MPO y la mayoría de los c-ANCA son anti-PR3. Se debe recordar que estos anticuerpos no son exclusivos de las vasculitis de pequeño vaso y pueden aparecer en otras entidades (lupus, artritis reumatoide, endocarditis, infección VIH, colangitis esclerosante primaria…). Recientemente, se han descrito VAA en el contexto de infecciones por SARS-CoV-2 o tras la administración de sus vacunas de mRNA [8]. Sin embargo, el grado de causalidad entre el virus o su inmunización y las vasculitis es desconocido [9].
A continuación, estudiaremos los 2 tipos de vasculitis de pequeño vaso: vasculitis asociada a ANCA y las mediadas por complejos inmunes.
VASCULITIS ASOCIADA A ANCA (VAA)
GENERALIDADES
Las VAA producen una glomerulonefritis necrotizante focal y segmentaria sin evidencia de depósitos de inmunoglobulinas en el glomérulo (pauci-inmunes), siendo característica la positividad para ANCA en suero.
Aunque no existe un cuadro clínico típico, la presentación más frecuente incluye síntomas generales, artralgias, síntomas respiratorios y alteraciones urinarias con insuficiencia renal. Habitualmente estos síntomas se desarrollan lentamente en un periodo de semanas, aunque existen casos de instauración más rápida.
La afectación renal se manifiesta de forma variable, desde cuadros de hematuria asintomática hasta el desarrollo de un síndrome nefrítico con insuficiencia renal rápidamente progresiva oligoanúrica con hipertensión arterial, edemas, microhematuria y un grado variable de proteinuria, habitualmente subnefrótica.
Dentro de las manifestaciones extrarrenales, los síntomas generales son los más frecuentes, incluyendo astenia, fiebre, anorexia y pérdida de peso. La sintomatología respiratoria puede englobar tanto la vía superior como la inferior. La afectación pulmonar es frecuente, desde cuadros de tos leve hasta severas hemorragias alveolares con compromiso vital, ocasionando un síndrome renopulmonar hasta en el 10 % de los pacientes [10].
Otras manifestaciones que deben tenerse en cuenta son lesiones cutáneas (púrpura, livedo reticulares o nódulos), articulares, neurológicas (mononeuritis múltiple, neuropatía sensorial, oftalmoplejia…), digestivas, cardiacas (pericarditis, miocarditis…) y realmente a nivel de cualquier órgano de la economía.
En la actualidad existe un test rápido de vasculitis que puede permitir un diagnóstico precoz en un plazo menor de 24 horas. Teniendo en cuenta que el valor predictivo positivo de los ANCA para el diagnóstico de vasculitis, en presencia de un cuadro clínico compatible, alcanza el 99 % [11], su positividad debe de indicar un tratamiento precoz. No obstante, existe un 10 % aproximadamente de pacientes con hallazgos clínicos e histológicos de VAA que presentan ANCA persistentemente negativos (“vasculitis ANCA negativo”), debiendo tratarse como las formas con positividad para estos.
La biopsia renal aporta el diagnóstico de certeza. Sin embargo, la realización de este procedimiento no debe retrasar el inicio del tratamiento si existe una alta sospecha basada en la clínica y la positividad de los ANCA, tal y como se mencionó anteriormente.
Se han descrito diferentes variantes histológicas de acuerdo con los hallazgos de la microscopía óptica que contribuye a la predicción del pronóstico renal [12]. La clasificación identifica 4 categorías de lesión glomerular:
- Focal: por lo menos del 50 % de los glomérulos son normales.
- Crescéntica: por lo menos 50 % de los glomérulos tienen semilunas celulares o fibróticas.
- Esclerótica: por lo menos 50 % de los glomérulos están globalmente esclerosados.
- Mixta: si no puede ser englobado en ninguna de las categorías anteriores.
Dentro de las VAA se han descrito 3 entidades que presentan diferencias clínicas e histológicas [1]:
- Poliangeítis microscópica
- Granulomatosis con poliangeítis (Wegener)
- Granulomatosis eosinofílica con poliangeítis (Churg-Strauss)
Asimismo, debe considerarse la vasculitis limitada al riñón que, como su nombre indica, únicamente presenta afectación renal indistinguible de la producida por la poliangeítis microscópica o la granulomatosis con poliangeítis.
Poliangeítis microscópica (PAM)
Es una vasculitis necrotizante que afecta primariamente a capilares, vénulas o arteriolas. También pueden afectarse arterias de pequeño y mediano tamaño. Es más frecuentes en personas ancianas, aunque se han descrito en todas las edades, estando igualmente afectados ambos sexos. La afectación renal es muy frecuente (80 – 90 %). Los ANCA suelen ser p-ANCA (anti-MPO), encontrándose presentes en más del 90 % de los casos.
Granulomatosis con poliangeítis (enfermedad de Wegener) (GPA)
Es una vasculitis que típicamente produce inflamación granulomatosa del tracto respiratorio superior e inferior, así como una afectación glomerular necrotizante pauci-inmune. Las manifestaciones clínicas son semejantes a las de la PAM, siendo más frecuente la sintomatología de oído, nariz y garganta en los pacientes con GPA que en la PAM (90 % vs 35 %). Sinusitis, otitis media, rinorrea o pérdida de audición son algunos de los síntomas descritos en estos pacientes. Cuadros más severos como la destrucción del cartílago o del hueso, produciendo deformidades como la “nariz en silla de montar”, son más típicas de los pacientes con GPA. A nivel pulmonar se puede evidenciar tos, disnea o hemoptisis. Los hallazgos radiológicos son variables, siendo característicos los infiltrados cavitados bilaterales.
Los ANCA suelen ser c-ANCA (anti-PR3), encontrándose presentes en más del 80 % de los casos.
Granulomatosis eosinofílica con poliangeítis (Churg-Strauss)
Es una vasculitis necrotizante eosinofílica granulomatosa, asociada frecuentemente con rinitis alérgica, asma y eosinofilia en sangre periférica. La afectación más frecuente es pulmonar, pudiendo aparecer tanto la rinitis alérgica como el asma años antes del diagnóstico de la vasculitis. Constituye la VAA con menor incidencia de afectación renal (20-40 %). A diferencia de la PAM y de la GPA aparece en edades más tempranas, entre la 4ª y la 5ª década de la vida.
Los ANCA se encuentran presentes en un 30-50 % de los casos, habitualmente son estos los pacientes con afectación glomerular y son típicamente anti-MPO [13].
TRATAMIENTO DE LAS VAA
El tratamiento debe instaurarse con la mayor precocidad posible para reducir la mortalidad y evitar lesiones irreversibles. El tratamiento se divide en una fase de inducción (3 – 6 meses) dirigida a inducir la remisión y una fase de mantenimiento, dirigida a consolidar la remisión y evitar las recaídas.
Antes de revisar los diferentes tratamientos indicados en las VAA, debemos considerar una serie de definiciones, recomendadas por la EULAR y la ERA-EDTA, para valorar la respuesta al tratamiento [14]:
• Enfermedad activa: existencia de signos o síntomas atribuibles a la enfermedad activa en cualquier órgano. Para valorar la actividad de la enfermedad existen diferentes métodos como el Birmingham Vasculitis Activity Score (BVAS) que ha sido aplicado a pacientes tanto con PAM como GPA.
• Remisión de la enfermedad: ausencia de manifestaciones de vasculitis, incluyendo la actividad de la glomerulonefritis.
• Recaída o brote: actividad incrementada de la enfermedad después de un período de remisión completa o parcial. Cuando pone en peligro la vida del paciente se define como recaída o brote grave.
• Enfermedad refractaria o resistente: persistencia o aparición de manifestaciones sistémicas de vasculitis, mientras se está recibiendo tratamiento inmunosupresor equivalente a la terapia inmunosupresora inicial. Se trata de una enfermedad progresiva que no responde a la terapia inmunosupresora convencional.
Consideraciones generales del tratamiento de las VAA
Se recomienda realizar profilaxis contra infecciones oportunistas con trimetoprim-sulfametoxazol (160 mg/800 mg tres veces por semana) en todos los pacientes que están recibiendo terapia inmunosupresora. Este fármaco ha demostrado reducir la tasa de infecciones, no quedando claramente establecido su papel en la reducción de la tasa de recaídas [15]. Asimismo, se deberán seguir los protocolos de cada centro para prevención de infecciones.
Debe señalarse que los títulos de ANCA no deben condicionar el tratamiento [16].
A continuación, revisaremos las 2 fases de tratamiento de las VAA.
Tratamiento de inducción
Se realizará doble terapia inmunosupresora con glucocorticoides asociados con ciclofosfamida (CFA) o con rituximab (RTX) [14][16]. Durante años se ha considerado la CFA como tratamiento de primera línea, siendo el RTX su alternativa, sin embargo, recientes estudios han mostrado una eficacia comparable con un perfil diferente pero no superior de efectos adversos [17].
Glucocorticoides
Los corticoides se administrarán inicialmente en bolos intravenosos (250-1000 mg/día de metil-prednisolona durante 3 días) seguidos de prednisona oral (1 mg/kg/día, hasta un máximo de 80 mg/día), recomendándose una disminución progresiva con dosis reducidas de corticoides, siempre ajustadas a la respuesta clínica [16].
Ciclofosfamida:
La CFA se utiliza en el tratamiento de las vasculitis desde hace décadas, con elevada tasa de remisiones, aunque significativos efectos adversos (cistitis hemorrágica, infertilidad, riesgo de infecciones…). La CFA se puede administrar tanto por vía oral como en pulsos intravenosos, los cuales han demostrado similar eficacia, menor dosis acumulada y menos efectos secundarios [18].
Las dosis de CFA oral recomendadas son 1,5-2 mg/kg/día, ajustada a la función renal y series hematológicas, y para la CFA intravenosa se recomiendan bolos mensuales de 0,5-1 gramo/m2 de superficie corporal.
Debe mencionarse que la resistencia al tratamiento con CFA es infrecuente lo que obliga a replantearse el diagnóstico.
Rituximab:
Fundamentalmente son 2 los estudios randomizados (RAVE y RITUXVAS) que han demostrado que la terapia con RTX, asociada con glucocorticoides, es tan eficaz como el tratamiento con CFA [19][20]. RTX se administra por vía intravenosa, a dosis de 375 mg/m2 x 4 semanas o dos dosis de 1000 mg separadas 15 días.
Papel de la plasmaféresis:
Existe acuerdo en la asociación de plasmaféresis al tratamiento en los pacientes con presencia concomitante de anticuerpos anti-MBG, recomendándose igualmente en los pacientes con hemorragia alveolar, existiendo más dudas sobre su papel en los casos de rápido deterioro de la función renal, reservándose a los pacientes con datos de inflamación activa en la biopsia sin esclerosis [14][16][21].
Se recomienda la realización de 6 – 10 sesiones de plasmaféresis en las primeras 2 semanas tras el diagnóstico, con un volumen de reemplazamiento plasmático mínimo de 60 mL/Kg con plasma fresco congelado en casos de hemorragia alveolar y soluciones de albúmina en el resto de las situaciones clínicas.
Finalmente, en pacientes que, tras 3 meses de tratamiento de inducción, permanecen dependientes de terapia de depuración extrarrenal y no tengan manifestaciones extrarrenales, se recomienda suspender el tratamiento. En estos casos se debe valorar la realización de biopsia o rebiopsia renal previa a la suspensión de la inmunosupresión.
Terapias alternativas:
Se han utilizado tratamientos con glucocorticoides en combinación con CFA y RTX, siendo sus resultados controvertidos. Otra alternativa ha sido la utilización de avacopan (inhibidor del receptor de C5a) como adyuvante de la terapia de inducción para disminuir la dosis de esteroides, siendo escasa la experiencia hasta la actualidad [22].
Tratamiento de mantenimiento
Una vez conseguida la remisión completa se iniciará el tratamiento de mantenimiento dirigido a evitar recaídas, debiendo mantenerse un tiempo entre 12 – 24 meses. La dosis de glucocorticoides se disminuirá de forma progresiva, para disminuir su toxicidad. Los fármacos más utilizados en esta fase son: RTX, AZA, RTX, metotrexate y micofenolato mofetil [16][17].
Clásicamente se ha considerado la AZA (1,5-2 mg/kg/día) como el tratamiento oral de mantenimiento de primera línea [23]. Más recientemente, RTX ha pasado a ocupar este lugar en base a los datos procedentes del estudio MAINRITSAN, tanto a corto como a largo plazo [24]. En este estudio, se administraron dos dosis de 500 mg de RTX separadas 2 semanas al inicio del tratamiento de mantenimiento y posteriormente los meses 6, 12 y 18. Sin embargo, una gran variedad de regímenes terapéuticos con RTX se han descrito no estando clara cuál es la mejor opción.
Metotrexate, ajustado a función renal, sería otra opción terapéutica, siendo su principal limitación que no debería ser utilizado en pacientes con FG menor de 60 ml/min, lo que condiciona considerablemente su uso [23].
Finalmente, MMF (1 gramo/12 horas por vía oral, con ajuste de niveles séricos) podría ser otra alternativa en pacientes con contraindicación o intolerancia a los tratamientos anteriormente mencionados [25].
La duración del tratamiento de mantenimiento debe individualizarse en función de las condiciones clínicas de cada paciente. En aquellos que hayan sido incluidos en programa de diálisis, sin manifestaciones extrarrenales, no se recomienda tratamiento de mantenimiento.
TRATAMIENTO DE LAS RECAÍDAS
En general, ante una recaída grave el manejo terapéutico debe de ser igual al manejo terapéutico de inducción inicial. En el estudio RAVE, RTX ha demostrado ser superior a CFA induciendo la remisión en pacientes con recaídas [20].
Si la recaída se produce durante la fase de mantenimiento se recomienda cambiar el fármaco que el paciente estaba recibiendo en ese momento.
TRATAMIENTO DE LOS CASOS REFRACTARIOS
En estos casos se recomienda modificar el tratamiento inicial. En pacientes en los que no se alcanza la remisión, se puede considerar la plasmaféresis y asociar terapia con inmunoglobulina intravenosa [16].
VASCULITIS DE PEQUEÑO VASO MEDIADA POR COMPLEJOS INMUNES
Estas vasculitis presentan depósitos de inmunoglobulinas y/o complemento en las paredes de los vasos, principalmente de pequeño tamaño. Podemos diferenciar las siguientes entidades [1]:
- Enfermedad por anticuerpos anti-membrana basal glomerular (anti-MBG)
- Vasculitis IgA (Púrpura de Schönlein – Henoch)
- Vasculitis anti C1q
- Vasculitis crioglobulinémica
ENFERMEDAD POR ANTICUERPOS ANTI-MBG (ENFERMEDAD DE GOODPASTURE)
Generalidades
Es una vasculitis de pequeño vaso determinada por anticuerpos circulantes dirigidos contra un antígeno intrínseco de la MBG, principalmente la cadena alfa-3 del colágeno tipo IV y menos frecuentemente contra las cadenas alfa-4 y alfa-5 [26]. La afectación renal determina una glomerulonefritis rápidamente progresiva con necrosis y proliferación extracapilar [27]. Se utilizan frecuentemente de forma indistinta los términos síndrome y enfermedad de Goodpasture. Sin embargo, de forma general se habla de síndrome de Goodpasture a la asociación de glomerulonefritis y hemorragia alveolar, independientemente de la patogenia, reservándose el término enfermedad de Goodpasture cuando ello se debe a anticuerpos anti-MBG.
La mayoría de los casos son idiopáticos, aunque se ha relacionado con algunos factores como el tabaco, infecciones respiratorias o inhalación de cocaína o hidrocarburos [27].
Clínica y diagnóstico
La presentación clínica es semejante a otros tipos de glomerulonefritis rápidamente progresiva, encontrándose hemorragia pulmonar en 40 – 60 % de los pacientes, debido a la expresión de cadenas alfa-3 de colágeno tipo IV en los alveolos [26]. Los síntomas generales, propios de otras vasculitis, no son frecuentes en la enfermedad por anticuerpos anti-MBG, salvo en aquellos pacientes que presentan asimismo ANCA positivos. En personas jóvenes se suele presentar como enfermedad de Goodpasture, mientras que en pacientes mayores es más frecuente la afectación glomerular aislada [28].
El diagnóstico de enfermedad de Goodpasture se realiza ante este cuadro clínico con la presencia de anticuerpos anti-MBG, confirmándose mediante biopsia renal que demostrará una glomerulonefritis proliferativa extracapilar con un depósito lineal característico de IgG a lo largo de la MBG y ocasionalmente en la membrana de túbulos distales [27]. Este patrón de inmunofluorescencia es también observado en la nefropatía diabética y en la glomerulonefritis fibrilar.
Tratamiento
El tratamiento debe instaurarse de forma precoz, ante la sospecha clínica en presencia de anticuerpos anti-MBG y sin esperar la confirmación histológica, especialmente en cuadros con hemorragia alveolar [27] [28]. El tratamiento de elección es la plasmaféresis, para eliminar los anticuerpos circulantes y mediadores inflamatorios, que se realizará con plasma fresco congelado en casos de hemorragia alveolar [29].
Junto con la plasmaféresis se iniciará inmunosupresión con corticosteroides (bolos de metil-prednisolona seguidos de prednisona oral a dosis de 1 mg/kg/día) y CFA oral (2 mg/kg/día, ajustada a función renal) para minimizar la formación de nuevos anticuerpos.
Existen escasos datos referentes al tratamiento de casos de enfermedad de Goodpasture refractaria, utilizándose en algunos casos MMF o RTX, sin que la evidencia existente hasta el momento permita hacer recomendaciones sobre estos fármacos [29].
La duración del tratamiento vendrá determinada por la clínica y negativización de los anticuerpos anti-MBG que se monitorizarán periódicamente.
Pronóstico
El pronóstico sin tratamiento es muy malo, con rápida progresión de la patología renal y elevada mortalidad [30][31]. La respuesta al tratamiento depende del grado de insuficiencia renal al diagnóstico, siendo fundamental el inicio precoz del mismo. Las recidivas son infrecuentes, siendo más comunes en pacientes con ANCA positivos y fumadores.
VASCULITIS IgA (PÚRPURA DE SCHÖNLEIN – HENOCH)
Generalidades
Se caracteriza por el depósito de complejos inmunes que contienen IgA. Es la vasculitis sistémica más frecuente en la población infantil (3 – 15 años), aunque también afecta a adultos, en los que tiene peor pronóstico, con predominio en el sexo masculino [32]. Los cuadros de vasculitis IgA raramente ocurren durante los meses de verano y es que la mitad de estos episodios están precedidos de infecciones respiratorias del tracto superior, más frecuentes durante el resto del año [33].
Clínica y diagnóstico
La tétrada característica incluye las siguientes manifestaciones clínicas [33][34]:
• Púrpura palpable no trombocitopénica de predominio en extremidades inferiores que se corresponde con una vasculitis leucocitoclástica con depósitos de IgA en la inmunofluorescencia.
• Artralgias o artritis transitoria o migratoria y no deformante.
• Manifestaciones digestivas (dolor abdominal cólico, diarrea y sangrado gastrointestinal).
• Afectación renal (20 – 55 %): la hematuria microscópica es la manifestación más frecuente, pudiendo acompañarse de proteinuria en grado variable. Puede desarrollarse insuficiencia renal progresiva en 10 – 15 % de los casos, especialmente en adultos. El patrón histológico más frecuente es el de una glomerulonefritis proliferativa mesangial con depósitos de IgA, superponible al de la nefropatía mesangial IgA.
Tratamiento
La mayor parte de los episodios se resuelven de forma espontánea con evolución benigna. En lo referente a la afectación renal las recomendaciones son las mismas que para el manejo de la nefropatía IgA [35]. En los casos más severos (proteinuria > 1 gramo/día, síndrome nefrótico, insuficiencia renal o proliferación extracapilar en la biopsia renal) se recomienda tratamiento con esteroides. En los pacientes que respondan al tratamiento se reducirán de forma progresiva. En aquellos en los que no se obtenga respuesta se valorará tratamiento inmunosupresor con CFA o MMF, siendo muy limitada la experiencia con cada terapia [36]. Por último, hay que mencionar que existen escasos estudios con RTX en adultos diagnosticados de vasculitis IgA, siendo los resultados satisfactorios hasta el momento [37].
VASCULITIS ANTI-C1q
Es una infrecuente vasculitis asociada con urticaria e hipocomplementemia. Se pueden observar manifestaciones articulares, pulmonares, oculares y renales [38].
La afectación renal se caracteriza por hematuria y un grado variable de proteinuria e insuficiencia renal, habiéndose descrito muy diferentes patrones histológicos (glomerulonefritis proliferativa, vasculitis necrotizante, proliferación extracapilar, glomerulonefritis membranoproliferativa e incluso nefritis tubulointersticial).
La presencia de anticuerpos anti-C1q es uno de los hallazgos más característicos.
VASCULITIS CRIOGLOBULINÉMICA O CRIOGLOBULINEMIA
Generalidades
Se caracteriza por el depósito de crioglobulinas, que son inmunoglobulinas y componentes del sistema del complemento que precipitan en frío. El síndrome inflamatorio clínico determinado por estas se conoce como crioglobulinemia. Habitualmente se producen manifestaciones cutáneas, articulares, neurológicas y renales.
Clásicamente se diferencian 3 tipos, de acuerdo con su tipo inmunológico (clasificación de Brouet) [39]:
- Tipo I (5-25 %): crioglobulinas monoclonales IgM o IgG
- Tipo II (40-60 %): crioglobulinas mixtas con componente monoclonal (generalmente IgM) y un componente policlonal (generalmente IgG)
- Tipo III (40-50 %): crioglobulinas policlonales
La crioglobulinemia tipo I es la que con mayor frecuencia se encuentra en desórdenes linfoproliferativos, tales como la macroglobulinemia de Waldestrom y el mieloma múltiple.
Los tipos mixtos (II y III) se encuentran en pacientes con infecciones persistentes, especialmente por el virus de la hepatitis C (VHC) y menos frecuentemente por el VHB, Epstein-Barr o virus de inmunodeficiencia humano (VIH), así como enfermedades autoinmunes.
Clínica
Los pacientes con crioglobulinemia tipo I se encuentran frecuentemente asintomáticos. Pueden presentar sintomatología relacionada con fenómenos de hiperviscosidad dando lugar a cuadros isquémicos y/o trombóticos.
Por su parte, las crioglobulinemias mixtas presentan habitualmente manifestaciones clínicas más floridas a las que se puede añadir las producidas por la enfermedad de base.
La clásica “triada de Meltzer” de púrpura, artralgias y debilidad es evidenciada únicamente en 25 -30 % de los pacientes. Las manifestaciones clínicas más frecuentes son [40]:
• Síntomas generales: fundamentalmente astenia y debilidad.
• Lesiones cutáneas: están presentes en casi todos los pacientes y frecuentemente son las manifestaciones más precoces. El estudio histológico revela una vasculitis leucocitoclástica. Las lesiones más características son la púrpura palpable, lesiones isquémicas, úlceras y fenómeno de Raynaud.
• Musculoesqueléticas: las artralgias y mialgias son frecuentes, no siendo común la artritis.
• La neuropatía periférica se ha descrito hasta en el 80 % de pacientes con crioglobulinemias mixtas, siendo más infrecuente en el tipo
• La afectación renal se ha descrito en un 20 – 60 % de los pacientes. La presentación clínica es variable, siendo la hematuria microscópica con proteinuria variable las manifestaciones más frecuentes. Debe señalarse que un elevado porcentaje de pacientes presenta también HTA. El patrón histológico más frecuente se corresponde con una glomerulonefritis membranoproliferativa con los siguientes datos específicos de crioglobulinemia [41]:
- Trombos intraluminales compuestos por crioglobulinas en la microscopía óptica.
- Depósitos difusos de IgM en asas capilares evidenciados en la inmunofluorescencia.
- Depósitos subendoteliales con un patrón de “huella dactilar” en la microscopía electrónica.
• Respiratorias: habitualmente la afectación pulmonar es subclínica, pero se han descrito casos severos incluso con hemorragia alveolar.
• Otras manifestaciones más infrecuentes pero severas son la vasculitis del SNC, hemorragia gastrointestinal o la afectación cardiaca.
Los hallazgos de laboratorio más característicos son, además de la presencia de crioglobulinas, positividad del factor reumatoide e hipocomplementemia, típicamente con niveles bajos de C4.
Tratamiento
Tenemos que diferenciar el tratamiento de la enfermedad de base del propio tratamiento de la crioglobulinemia, debiendo el primero preceder al segundo. Así, por ejemplo, los pacientes con VHC deben recibir tratamiento con antivirales de acción directa de acuerdo con las indicaciones y esquemas terapéuticos establecidos por cada centro.
Tratamiento de la crioglobulinemia
Indicaciones
• Glomerulonefritis con insuficiencia renal progresiva y/o síndrome nefrótico resistente a tratamiento estándar.
• Lesiones isquémicas digitales
• Afectación visceral severa (gastrointestinal, neurológica, pulmonar, cardiaca...)
Inmunosupresores
En la actualidad se considera que RTX es el fármaco de elección por su perfil de seguridad, especialmente en los pacientes con crioglobulinemia mixta asociada a VHC, aunque debe tenerse presente que ningún estudio ha demostrado superioridad sobre CFA [42][43]. Debe tenerse especial precaución o evitarse en pacientes con infección activa o pasada por VHB.
Respecto a los esteroides su uso es controvertido, al existir un riesgo incrementado de replicación viral, especialmente por VHB. En situaciones de compromiso vital se recomienda iniciar bolos de metil-prednisolona junto con el tratamiento inmunosupresor. Se debe realizar una rápida reducción de la dosis.
La CFA por vía oral (2 mg/kg/día, ajustada a función renal) debe reservarse para situaciones de “riesgo vital” en las que no se pueda o deba utilizar RTX, o cuando no exista respuesta a este tratamiento. La CFA se asocia a un riesgo incrementado de replicación viral [42]. Por último, se ha utilizado MMF o AZA como alternativa a la CFA, siendo escasa la experiencia clínica [44].
Plasmaféresis
Presenta las siguientes indicaciones, siempre junto con tratamiento inmunosupresor [42]:
- Síndrome de hiperviscosidad
- Afectación visceral severa:
- Hemorragia alveolar
- Sistema nervioso central
- Gastrointestinal
- Glomerulonefritis rápidamente progresiva
- Vasculitis cutánea severa refractaria
Se puede utilizar albúmina para el recambio plasmático, recomendándose calentar antes del tratamiento para evitar la precipitación de crioglobulinas. El número de sesiones se debe individualizar atendiendo a la evolución clínica.
Por último, se debe mencionar que la monitorización de la respuesta al tratamiento debe ser clínica. La monitorización del crioglobulinas (criocrito) no ha demostrado clara utilidad.
Pronóstico
Dependerá de la enfermedad de base, de los órganos afectados y de la severidad de las manifestaciones clínicas, asociándose a mal pronóstico la existencia de hemorragia pulmonar, vasculitis intestinal y afectación del SNC [45].
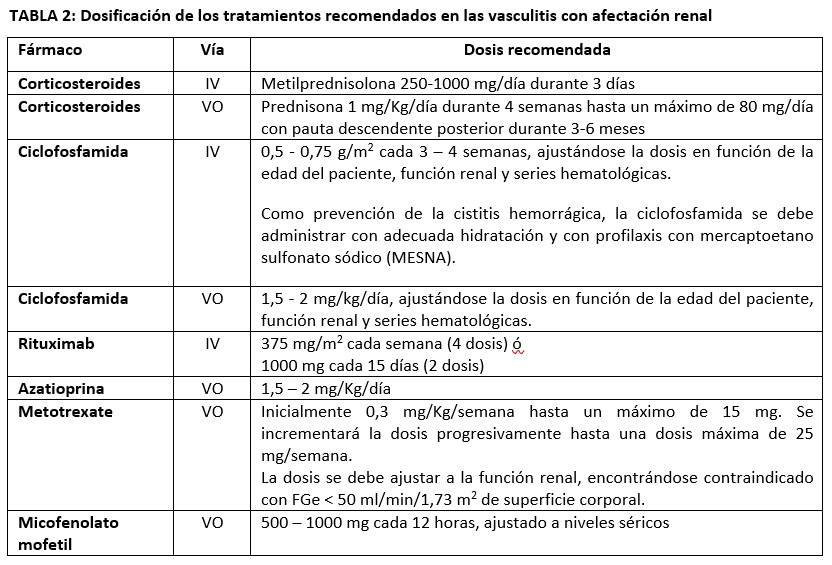
En la (Tabla 2) se resume la dosificación de los tratamientos recomendados en las vasculitis con afectación renal.
ESCLEROSIS SISTÉMICA
GENERALIDADES
La esclerosis sistémica (ES) es una enfermedad autoinmune producida por una alteración generalizada del tejido conectivo que conduce a un depósito excesivo de proteínas de la matriz extracelular y una alteración de la microcirculación con oclusión de las luces vasculares, afectando de forma predominante a la piel, el aparato digestivo, el riñón, el pulmón y el corazón.
Es más frecuente en mujeres (relación de 3 a 1) y el inicio de la enfermedad puede darse a cualquier edad, con predominio en la quinta década de la vida. Los pacientes afroamericanos suelen presentar un debut más temprano de la enfermedad y fenotipos más graves de la misma (mayor frecuencia de fibrosis pulmonar y crisis renales esclerodérmicas) [46].
La etiología de la enfermedad es desconocida, aunque se sabe que hay una alteración a nivel endotelial, del tejido conectivo y de la inmunidad celular y humoral. Se produce una alteración en la producción de citoquinas, muchas liberadas por los linfocitos T, junto con una desregulación de los genes que sintetizan el colágeno lo que provoca un aumento del crecimiento y la diferenciación celular de los fibroblastos que sintetizan un exceso de componentes de la matriz extracelular. Además, hay una alteración en el equilibrio entre las sustancias vasodilatadoras (descenso de prostaciclinas y óxido nítrico) y vasoconstrictoras (aumento de endotelina-1) con un predominio de la vasoconstricción vascular. El descenso del óxido nítrico además favorece el vasoespasmo, la agregación plaquetaria, la regulación de las moléculas de adhesión y aumenta el espesor de la pared vascular.
Se distinguen dos tipos de ES en función de la localización de la afectación cutánea, una forma difusa (EScd) cuando hay afectación del tronco y/o de las regiones proximales de las extremidades y una forma limitada (EScl) cuando la afectación cutánea se limita a regiones distales de las extremidades [47]. También existen casos de ES y síndrome de solapamiento, presentando manifestaciones de otras enfermedades autoinmunes.
MANIFESTACIONES CLÍNICAS
• Vasculares: el fenómeno de Raynaud aparece en el 90-95% de los casos y suele ser el síntoma inicial. Su localización más frecuente son los dedos de las manos, aunque también puede presentarse en otras localizaciones como pies, labios, orejas y lengua.
• Cutáneas: se presentan en el 95% de los pacientes con ES. Suele iniciarse con edema cutáneo que evoluciona a induración y atrofia, con aparición de esclerodactilia, úlceras cutáneas, calcinosis subcutánea y telangiectasias.
• Osteomusculares: la afectación articular aparece entre el 45-90% de los casos. Se caracteriza por rigidez matutina, artralgias de las pequeñas articulaciones de las manos, rodillas y tobillos. Es muy característica la resorción de los penachos de las falanges distales (acroosteólisis) y la afectación muscular puede presentarse en forma de mialgias y debilidad de extremidades de predominio proximal.
• Digestivas: son las más frecuentes tras las cutáneas. El esófago es la porción más afectada (80-90% de los casos) produciéndose disfagia a sólidos y pirosis, si bien cualquier parte del tracto gastrointestinal puede verse afectada. Además, aparece disminución del peristaltismo gástrico, náuseas, vómitos, anorexia, sobrecrecimiento bacteriano que puede conllevar malabsorción, peudoobstrucción intestinal y más raramente megacolon, neumatosis quística y vólvulos. La afectación hepática es poco frecuente.
• Pulmonar (70%): actualmente se considera la primera causa de muerte. Se distinguen dos formas de afectación, la enfermedad pulmonar intersticial difusa (EPID) que se presenta con mayor frecuencia en la EScd y la hipertensión pulmonar que con mayor frecuencia se presenta de forma aislada asociada a la EScl.
• Cardíaca: Las manifestaciones pueden ser primarias (arritmias, miocardiopatía, pericarditis) o secundarias a la afectación pulmonar.
• Renales: la afectación renal es un indicador de mal pronóstico. Su frecuencia se encuentra alrededor del 45%, silente en muchos casos. La proteinuria es el signo más frecuente, generalmente sin alcanzar rango nefrótico, además de microhematuria, hipertensión arterial y disminución del filtrado glomerular.
La afectación renal puede estar asociada a los propios fármacos utilizados en el tratamiento de la enfermedad (AINES, diuréticos, ciclosporina, D-penicilamina), superposición con otras conectivopatías, hipovolemia, malabsorción y la propia hipertensión.
Se han descrito casos de glomerulonefritis pauci-inmune, que se manifiesta con una insuficiencia renal rápidamente progresiva con hematuria microscópica y p-ANCA positivos. En estos casos el tratamiento requerirá el uso de terapia inmunosupresora al igual que en las vasculitis de pequeño vaso [48].
Una de las formas más graves de afectación renal es la crisis renal esclerodérmica (CRE).
CRISIS RENAL ESCLERODÉRMICA
La CRE es una complicación grave pero poco frecuente, que afecta entre un 5-10% de los pacientes con ES, principalmente en las formas de EScd. Suele aparecer en los primeros 5 años tras el diagnóstico de la enfermedad.
La patogenia de la CRE es desconocida. La lesión inicial afecta al endotelio de los vasos interlobulares, de las arterias arcuatas y de los capilares glomerulares, produciéndose un engrosamiento y proliferación de la íntima en “capas de cebolla’’, así como una agregación plaquetaria y una liberación de factores de crecimiento derivados de las plaquetas. Esto provoca una disminución de la perfusión renal que sumado a una vasoconstricción episódica condiciona una hiperplasia del aparato yuxtaglomerular y un aumento de la liberación de la renina [49].
Se consideran factores predictivos o de mayor riesgo de aparición de CRE:
- Forma difusa de la enfermedad.
- Rápida progresión de la afectación cutánea.
- Evolución de la enfermedad inferior a 4 años.
- Presencia de anticuerpos anti-ARN pol III.
- Anemia de reciente aparición.
- Afectación cardíaca en forma de derrame pericárdico o insuficiencia cardíaca congestiva.
- Toma de altas dosis de corticoides [50].
La forma de presentación más habitual es una hipertensión arterial maligna, anemia hemolítica microangiopática, trombopenia, insuficiencia renal aguda, proteinuria y/o microhematuria. Paradójicamente los pacientes con crisis esclerodérmica normotensos (aproximadamente un 10% de los casos) presentan peor pronóstico renal y mayor mortalidad [51].
Estas CRE deben diferenciarse de otras formas de microangiopatía trombótica.
Los anticuerpos antinucleares son positivos en el 90% de los casos, especialmente los anticuerpos anti-SCL70 (muy específicos de la enfermedad), anti-ARN polimerasa y antirribonucleoproteína (anti-RNP). Los anticuerpos anticentrómero, sin embargo, parecen ser protectores en las crisis esclerodérmicas renales.
En el síndrome CREST (asociación de calcinosis cutánea, fenómeno de Raynaud, esclerodactilia, afectación esofágica y teleangiectasias) los anticuerpos anticentrómero son bastante específicos y suele haber poca afectación renal.
La CRE ha sido durante años la primera causa del fallecimiento de los pacientes con ES. Es una de las complicaciones más graves de la enfermedad, aunque su pronóstico ha mejorado discretamente desde la introducción de los inhibidores de la enzima convertidora de la angiotensina (IECA) [49].
El tratamiento fundamental de la CRE consiste en el control agresivo de la presión arterial con bloqueantes del sistema renina angiotensina, si es necesario en combinación con otros tipos de antihipertensivos, con objetivo de controlar las cifras de tensión arterial a niveles previos dentro de las primeras 72h, lo que ha mejorado la supervivencia. No se recomiendan los betabloqueantes por el efecto negativo sobre la circulación periférica. En aquellos pacientes con contraindicación para el empleo de IECAs es preferible optar por un antagonista del receptor de la angiotensina II (ARA-2), aunque se desconoce si son igual de efectivos que este grupo de fármacos.
En lo referente al pronóstico renal, debe mencionarse que un 20-50% de los pacientes con CRE progresan a enfermedad renal terminal con necesidad de diálisis, aunque en algunos casos la función renal puede mejorar al cabo de varios meses. Factores de mal pronóstico a este respecto son el presentar creatinina sérica >3 mg/dL al diagnóstico, el sexo masculino, un retraso en el diagnóstico y el inicio de tratamiento antihipertensivo agresivo, un inadecuado control tensional, la presencia de insuficiencia cardiaca congestiva concomitante, la CRE normotensiva o la presencia de ciertos hallazgos histopatológicos en biopsia renal (necrosis fibrinoide a nivel arteriolar, severidad de colapso isquémico glomerular o grados avanzados de atrofia tubular y fibrosis intersticial) [51].
A pesar de que la supervivencia ha mejorado con el uso de bloqueantes del sistema renina angiotensina, no se ha demostrado su papel en la prevención y los pacientes con esclerodermia tienen aún una elevada mortalidad que se relaciona con una mayor afectación sistémica. El éxito del tratamiento se basa en la precocidad del mismo, debiendo señalarse que ningún nuevo enfoque terapéutico ha mostrado en los últimos años suficiente eficacia en el tratamiento de las CRE más allá de las medidas ya comentadas [49][52][53].
El tratamiento de las manifestaciones extrarrenales de la esclerodermia como la hipertensión pulmonar y el síndrome de Raynaud ha mejorado con el uso de fármacos con efecto vasodilatador como el bosentan (antagonista del receptor de la endotelina), inhibidores de la fosfodiesterasa 5 y los análogos de las prostaglandinas (epoprostenol, treprostinil, iloprost).
Para el tratamiento de la enfermedad intersticial pulmonar, la afectación activa cutánea y la miositis se utilizan inmunosupresores tales como ciclofosfamida, micofenolato, azatioprina, metotrexate y ocasionalmente anti-TNF-α [48][54].
ARTRITIS REUMATOIDE
GENERALIDADES
La artritis reumatoide (AR) es una enfermedad inflamatoria crónica que afecta predominantemente a las articulaciones periféricas (preferentemente articulaciones de pequeño tamaño) de forma simétrica y que se caracteriza por una inflamación de la membrana sinovial que conduce a una destrucción del cartílago, erosiones óseas y deformidades articulares.
Aunque la membrana sinovial es el foco principal de lesión, también se producen cambios sistémicos que afectan al sistema inmune y afectación extraarticular consecuencia del proceso inflamatorio crónico.
La AR afecta al 0,5% de los adultos en nuestro país. Puede ocurrir a cualquier edad, aunque suele ser más frecuente entre la cuarta y la sexta década de la vida y con predominio del sexo femenino (3:1).
Su etiología es desconocida, aunque podría existir una predisposición genética con un modelo de herencia poligénico (incidencia aumentada entre familiares de primer grado, gemelos monocigóticos y elevada asociación con determinados HLA, siendo la relación con la región del HLA-DRB1 la más estudiada) sobre la que se añade la influencia de factores ambientales (tóxicos, como el tabaco, y más frecuentemente infecciones) que actuarían como desencadenantes de la enfermedad.
MANIFESTACIONES SISTÉMICAS
Las manifestaciones extraarticulares aparecen en aproximadamente el 50% de los pacientes, siendo más frecuentes en aquellos con títulos elevados de factor reumatoide. Estas manifestaciones incluyen astenia, pérdida de peso, afectación cutánea (úlceras, nódulos subcutáneos y atrofia), ocular (escleritis, queratoconjuntivitis seca, cataratas), pleuropulmonar (enfermedad pulmonar intersticial, blonquiolitis obliterante, nódulos pulmonares e hipertensión pulmonar), cardíaca (miocarditis, pericarditis y aumento del riesgo de enfermedad cardiovascular), hepática (aumento de enzimas hepáticas, asociación con colangitis biliar primaria), neurológica (por compresión de los nervios periféricos por la sinovitis o las deformidades articulares, siendo excepcional la afectación del SNC), ósea (osteoporosis), hematológica y renal.
La afectación renal es relativamente frecuente y clínicamente significativa porque empeora el curso y la mortalidad de la enfermedad primaria. Puede ser debida a la propia enfermedad o mucho más frecuentemente relacionada con su tratamiento, debido a la toxicidad de fármacos como los AINEs, sales de oro, penicilamina, ciclosporina o anti TNF-¿.
El daño renal observado en pacientes con AR que se han sometido a biopsia renal incluye una amplia variedad de entidades y patrones histológicos con afectación tanto glomerular como tubulointersticial. Las más frecuentes son la nefropatía membranosa, glomerulonefritis membranoproliferativa (mediada por inmunocomplejos, habitualmente no asociada a un deterioro importante de la función renal), enfermedad de cambios mínimos, nefropatía IgA, nefropatía por analgésicos y nefritis intersticial [55][56]. Otra patología que debe tenerse en cuenta es la amiloidosis AA, con importante implicación pronóstica, cursando habitualmente con proteinuria, en ocasiones en rango nefrótico, e insuficiencia renal, tal y como se comentará en el capítulo correspondiente. Esta entidad afecta la supervivencia, aumenta la morbilidad y es la principal causa de enfermedad terminal renal en pacientes con AR y nefropatía. También ha sido descrita en pacientes con AR tratados con anti-TNF alfa lesiones glomerulares relacionadas con este tratamiento [57].
Por último, mencionaremos la vasculitis reumatoide que suele manifestarse en fases de actividad de la enfermedad y suelen coexistir con datos de vasculitis a otros niveles. Los ANCA pueden ser positivos y se suele acompañar de hipocomplementemia. En estos casos las manifestaciones a nivel renal y el tratamiento son similares a los de las vasculitis de pequeño vaso [55].
TRATAMIENTO
En el tratamiento actual de la AR se incluyen analgésicos y AINEs cuya misión es disminuir la inflamación y el dolor, pero no alteran el curso de la enfermedad por lo que se usan siempre acompañando a otros fármacos. También se utilizan corticoides con un efecto antiinflamatorio acompañados de fármacos modificadores de la enfermedad (FAME) que se ha demostrado que frenan o retrasan la progresión de la enfermedad.
El tratamiento con estos fármacos debe iniciarse tan pronto se diagnostica la enfermedad. Entre estos podemos diferenciar los FAME tradicionales (metotrexate, leflunomida, sulfasalazina, hidroxicloroquina, sales de oro y D-penicilamina) y los biológicos (anti-TNF, rituximab, tocilizumab, abatacept…) [58]. El tratamiento inicial de 1ª línea recomendado consiste en el empleo de metotrexate y un ciclo corto de 3 meses de corticoides [58]. Inmunosupresores como azatioprina, ciclofosfamida o ciclosporina se reservan a pacientes que no responden al tratamiento o que presentan manifestaciones extraarticulares como el daño renal.
En el caso de los pacientes con afectación renal hay que evitar el uso de AINEs. Si la afectación renal es producida por la propia enfermedad se recomienda el tratamiento intensivo de la misma para minimizar el proceso inflamatorio y si el daño está en relación con el uso de fármacos intentar modificar el tratamiento y utilizar fármacos que produzcan la mínima toxicidad a nivel renal [59].
SÍNDROME DE SJÖGREN
GENERALIDADES
El síndrome de Sjögren (SS) es una enfermedad autoinmune crónica de progresión lenta y etiología desconocida [60]. Es posible que exista una susceptibilidad individual (debida a factores genéticos, hormonales e inmunológicos) que junto con la interacción de factores externos (posiblemente infecciones virales) contribuyan a la aparición y el mantenimiento de la enfermedad [61].
En la mayoría de los casos, la enfermedad afecta a las glándulas exocrinas (manifestaciones glandulares) produciéndose una respuesta inflamatoria ante la infiltración linfoplasmocitaria, autoanticuerpos y mediadores de la inflamación.
El síntoma característico es la sequedad de mucosas, fundamentalmente oral (xerostomía) y ocular (xeroftalmia) pero puede haber manifestaciones extraglandulares afectando a diversos órganos (enfermedad pulmonar intersticial grave, vasculitis cutánea, neuropatía periférica, complicaciones hematológicas y afectación renal) [61].
Se considera primario si aparece de forma aislada, y secundario si se asocia a otra enfermedad autoinmune.
El SS afecta predominantemente a mujeres (9:1), entre los 40 y 60 años. La prevalencia varía entre el 0,5 y el 4% de la población adulta. La afectación renal es poco frecuente, en torno al 5% de los pacientes, aunque en algunas series se describen incidencias muy superiores.
Los pacientes con SS presentan un amplio espectro de marcadores analíticos, de los cuales los anticuerpos antinucleares (ANA) son los más frecuentemente detectados, anti-Ro / SS-A es el más específico y las crioglobulinas e hipocomplementemia son los principales marcadores pronósticos.
Los anticuerpos anti-Ro / SS-A y anti-La / SS-B también se asocian con la actividad sistémica global, especialmente anti-Ro / SS-A, cuya positividad en el momento del diagnóstico se correlaciona con mayor actividad a nivel articular, cutánea y renal [62].
AFECTACIÓN RENAL
Se encuentra en aproximadamente un 5% de los pacientes con SS primario [63]. La afectación renal es consecuencia de dos procesos fisiopatológicos distintos:
• Enfermedad epitelial con infiltración linfocítica predominantemente mononuclear que da lugar a nefritis tubulointersticial.
• Enfermedad no epitelial mediada por inmunocomplejos que da lugar a glomerulopatía [60].
La nefritis tubulointersticial crónica es la manifestación renal más frecuente, caracterizada en la histología por un infiltrado tubulointersticial de linfocitos (mayoritariamente CD4+, con menor presencia de CD8+) y células plasmáticas, a veces con formación de granulomas, y produciendo en fases avanzadas fibrosis y atrofia tubular. Se manifiesta con insuficiencia renal, leves alteraciones del sedimento y defectos en la función tubular (ATR tipo 1 hasta en el 25% de los pacientes junto con nefrolitiasis de fosfato cálcico, síndrome de Fanconi, diabetes insípida nefrogénica e hipopotasemia), pero puede llegar a evolucionar a enfermedad renal crónica terminal.
La afectación glomerular es rara y tiende a ser tardía en el curso de la enfermedad. Las entidades más comunes son la glomerulonefritis membranoproliferativa (frecuentemente asociada a crioglobulinemia) y la nefropatía membranosa, aunque también se han descrito casos de nefropatía de cambios mínimos, hialinosis focal y segmentaria, mesangial IgA, glomerulonefritis fibrilar y glomerulonefritis pauciinmunes ANCA positivas [63]. Están producidas por el depósito de complejos inmunes, que a menudo son crioglobulinas las cuales podrían jugar un papel patogénico en otras manifestaciones clínicas como la neuropatía periférica y la púrpura.
No existe un tratamiento específico claramente establecido en los pacientes con SS y afectación renal. En los casos descritos se emplean corticoides en monoterapia (inicialmente a dosis de 1mg/kg con máximo 60mg/día, con posterior descenso progresivo de la dosis) o en combinación con otro agente inmunosupresor que suele ser ciclofosfamida. Otros regímenes que incluyen azatioprina, micofenolato, ciclosporina o rituximab se pueden administrar de acuerdo con la clínica, las características histológicas, la gravedad de la enfermedad y las comorbilidades del paciente [60][63].
El tratamiento temprano de la enfermedad con terapia inmunosupresora parece mejorar o retrasar la progresión de la enfermedad renal [61].
SARCOIDOSIS
GENERALIDADES
La sarcoidosis es una enfermedad sistémica de etiología desconocida que se caracteriza por la presencia de granulomas no caseificantes en los órganos afectados. Más del 90 % de los pacientes presentan afectación pulmonar, determinante en su mayor parte de la morbimortalidad de esta enfermedad.
Es habitualmente diagnosticada entre los 20 y los 60 años, en la mitad de los pacientes en fase asintomática, incidentalmente tras la realización de un estudio radiológico torácico. La presentación más característica asocia alguna de las siguientes alteraciones: adenopatías hiliares bilaterales, opacidades reticulares pulmonares y/o manifestaciones cutáneas, articulares u oculares [64].
MANIFESTACIONES RENALES
Hasta un 30 % de los pacientes diagnosticados de sarcoidosis presentan manifestaciones clínicas extrapulmonares. La incidencia y prevalencia de la afectación renal es desconocida, variando ampliamente según los estudios entre un 10 y un 50% de afectación [65].
Las principales manifestaciones renales relacionadas con la sarcoidosis son [66]:
• Hipercalcemia e hipercalciuria (nefrocalcinosis, nefrolitiasis)
• Nefritis túbulointersticial granulomatosa o no granulomatosa
• Afectación glomerular
• Uropatía obstructiva
HIPERCALCEMIA E HIPERCALCIURIA
Son las manifestaciones más frecuentes. Están mediadas por la síntesis de calcitriol por las células mononucleares activadas, principalmente macrófagos, en los granulomas, debido a un aumento en la producción y activación del enzima 1-alfa-hidroxilasa [67]. Como consecuencia de ello se produce hiperabsorción del calcio de la dieta y aumento de su eliminación, determinando hipercalcemia (2-20 % de los casos) y/o hipercalciuria (40 %). Puede ocasionar el desarrollo de nefrolitiasis (siendo su composición principal de oxalato cálcico, y en menos ocasiones de fosfato cálcico), nefrocalcinosis e insuficiencia renal aguda o crónica.
NEFRITIS TÚBULOINTERSTICIAL GRANULOMATOSA O NO GRANULOMATOSA
La nefritis intersticial granulomatosa no caseificante constituye la lesión a nivel renal más característica de la sarcoidosis, afectando a aproximadamente un 20% de los pacientes con sarcoidosis. En ocasiones cursa de forma silente por lo que pasa desapercibida.
La nefritis intersticial puede producir piuria estéril, leve proteinuria de origen tubular y diferente grado de insuficiencia renal. La mayor parte de estos pacientes presentan manifestaciones clínicas evidentes de sarcoidosis en otros órganos lo que facilita el diagnóstico. La biopsia renal muestra un infiltrado intersticial mononuclear, granulomas no caseificantes (que pueden no encontrarse presentes) y daño tubular, encontrándose en cuadros crónicos lesiones de fibrosis intersticial. Debe tenerse en cuenta que estos hallazgos por sí solos son sugestivos, pero no diagnósticos, pudiendo encontrarse lesiones granulomatosas semejantes en reacciones a drogas, infecciones por micobacterias o GPA.
AFECTACIÓN GLOMERULAR
Ocasionalmente se han descrito diferentes tipos de glomerulonefritis en pacientes con sarcoidosis. El mecanismo de daño glomerular es desconocido y la relación entre estas entidades no ha sido demostrada de forma definitiva.
Se han descrito pacientes con nefropatía IgA, nefropatía membranosa, membranoproliferativa, extracapilar (incluyendo casos de glomerulonefritis asociada a ANCAs positivos), focal y segmentaria, entre otras, siendo la clínica superponible a la de las glomerulopatías primarias [66]. De forma similar a otras enfermedades inflamatorias crónicas, existen casos descritos de amiloidosis AA en pacientes con sarcoidosis [68].
UROPATÍA OBSTRUCTIVA
La uropatía obstructiva es infrecuente en la sarcoidosis. Esta puede producirse por litiasis, afectación ureteral por la propia enfermedad, compresión ganglionar o fibrosis retroperitoneal. Esta última puede acompañarse en ocasiones de compromiso de la arteria renal determinando hipertensión arterial.
TRATAMIENTO
Podemos diferenciar el tratamiento de cada una de las manifestaciones renales de la sarcoidosis [69]:
• La hipercalcemia responde bien a dosis bajas de corticosteroides al disminuir la actividad inflamatoria de la enfermedad y con ello la síntesis de calcitriol.
• La nefritis intersticial granulomatosa precisa dosis más elevadas de glucocorticoides (prednisona 1 mg/kg/día (máximo 80 mg/día) durante 6 – 12 semanas, en función de la respuesta clínica), seguido de un lento descenso los siguientes meses. Se debe valorar el riesgo-beneficio del tratamiento inmunosupresor según los hallazgos de la biopsia renal. Otras opciones de tratamiento inmunosupresor serían la azatioprina, el micofenolato o combinaciones de los anteriores, pudiendo también emplear anti-TNF-alfa [70].
• En las glomerulopatías asociadas con la sarcoidosis, la administración de glucocorticoides parece también mejorar la función renal. El tratamiento dependerá de la causa, siendo el mismo en pacientes con o sin sarcoidosis.
• Respecto a la uropatía obstructiva deberá realizarse tratamiento individualizado dependiendo de la causa. De manera puntual, la uropatía obstructiva puede responder al tratamiento con un ciclo de corticoides.
SÍNDROME ANTIFOSFOLÍPIDO
GENERALIDADES
El síndrome antifosfolípido (SAF) es una enfermedad sistémica autoinmune definida por eventos trombóticos y/o obstétricos en pacientes con anticuerpos antifosfolípido (anti-PL) de forma persistente [71]. Puede ser primario o asociado a otras patologías autoinmunes sistémicas como el LES (SAF secundario).
Los anti-PL son un grupo heterogéneo de anticuerpos dirigidos contra fosfolípidos o contra proteínas unidas a fosfolípidos. El antígeno principal de los anti-PL es la β2-glicoproteína 1 (β2GPI), proteína plasmática que se une con avidez a fosfolípidos de la superficie celular [72]. Los test principales para el diagnóstico de SAF son el anticoagulante lúpico, los anticuerpos anticardiolipina (ACL) y los anti-β2GPI. La correlación con la clínica depende tanto del test empleado (el anticoagulante lúpico se correlaciona mejor con los eventos clínicos que los ACL y anti-β2GPI), como del título de anticuerpos, y del tipo de anticuerpo (IgG más relacionado con eventos clínicos que IgM, mientras que los anti-PL IgA son infrecuentes y de significado clínico desconocido) [73].
La presencia de anti-PL de forma transitoria no es infrecuente, y no siempre es clínicamente significativo.
MANIFESTACIONES CLÍNICAS
El SAF trombótico se caracteriza por trombosis venosas, arteriales y microvasculares, y en ocasiones puede presentarse con trombosis de múltiples órganos (SAF catastrófico). Las trombosis arteriales más frecuentes se manifiestan con ictus y accidentes isquémicos transitorios, mientras que las trombosis venosas se suelen presentar en el sistema venoso profundo de miembros inferiores, como tromboembolismo pulmonar o ambos [74].
El SAF obstétrico se caracteriza por pérdida fetal a partir de la 10ª semana de gestación, abortos precoces recurrentes, crecimiento intrauterino retardado o preeclampsia grave.
Las principales manifestaciones no trombóticas en pacientes con anti-PL incluyen cardiopatías valvulares (engrosamiento valvular, nódulos, vegetaciones), livedo reticularis y úlceras vasculares, la nefropatía asociada a anti-PL, anemia hemolítica (autoinmune o microangiopática), trombocitopenia generalmente moderada (50 000-150 000/mm3), disfunción cognitiva y alteraciones de la sustancia blanca subcortical.
El SAF catastrófico ocurre en 1% de pacientes con SAF y condiciona una elevada mortalidad. Requiere para su diagnóstico la afectación de al menos 3 órganos en menos de una semana, con microtrombosis en al menos uno de los órganos, y anti-PL persistente [75].
PATOLOGÍA RENAL ASOCIADA AL SAF
Se ha descrito entre un 2 y un 25% de prevalencia de afectación renal en pacientes con síndrome antifosfolípido primario [76]. Podemos diferenciar la afectación renal en lesiones vasculares y parenquimatosas, entendidas como nefropatía asociada a anti-PL.
LESIONES VASCULARES
En el síndrome antifosfolípido se puede producir una oclusión de todos los vasos renales (arterias, venas, capilares). Las trombosis de arteria y vena renales en el SAF son menos frecuentes que otras trombosis de grandes vasos [77]. La estenosis de la arteria se presenta con hipertensión arterial severa y/o resistente y de forma característica presentan estenosis bien definidas en el tercio proximal de la arteria renal, hallazgo infrecuente en las lesiones ateroescleróticas o por displasia fibrosa [78].
NEFROPATÍA ASOCIADA A ANTICUERPOS ANTIFOSFOLÍPIDO
Se han descrito varios grados de microangiopatía trombótica, lesiones proliferativas glomerulares (sin depósitos de inmunoglobulinas ni complemento en la inmunofluorescencia), fibrosis de vasos intrarrenales, y modificaciones isquémicas del parénquima renal (isquemia cortical e infartos del parénquima, isquemia glomerular, fibrosis intersticial, atrofia tubular).
El curso clínico varía desde casos indolentes hasta fracasos renales agudos devastadores e irreversibles. Puede presentarse como una enfermedad renal lentamente progresiva con hipertensión arterial, diferentes grados de proteinuria (generalmente < 1.5 g/día), microhematuria y/o insuficiencia renal progresiva, o puede debutar de forma aguda, generalmente en el contexto de una microangiopatía trombótica que da lugar a un rápido deterioro de función renal con grados variables de hematuria y proteinuria [79]. La mayoría de SAF catastróficos tienen afectación renal microangiopática. Otra forma rara de presentación aguda es la anuria por necrosis cortical.
TRATAMIENTO
El tratamiento se basa en bloqueantes del sistema renina angiotensina y, en pacientes con SAF y manifestaciones clínicas, la anticoagulación (con preferencia por el empleo de antagonistas de la vitamina K como el acenocumarol [80]. El impacto de la anticoagulación en la nefropatía no está claro. Se ha propuesto inhibidores de mTOR como terapia de rescate en nefropatías progresivas a pesar de la anticoagulación, especialmente en pacientes con nefritis lúpica asociada y en el trasplante renal, pero ha de tenerse en cuenta que en general existe proteinuria y los inhibidores de mTOR pueden empeorar la proteinuria y las lesiones glomerulares. En caso de existir lesiones de MAT, la primera línea de tratamiento incluye el recambio plasmático asociado a la anticoagulación, y se podría considerar el uso de eculizumab, siendo otra opción a valorar el tratamiento con rituximab [74][81].
En el caso de SAF catastrófico, si bien existe escasa evidencia al respecto, el tratamiento recomendado es la triple terapia consistente en anticoagulación, corticoides y recambio plasmático con plasma sólo o en combinación con albúmina (grado de evidencia 2C) o inmunoglobulina intravenosa [82].