Implantación Ecoguiada de Catéteres Tunelizados para Hemodiálisis
INTRODUCCIÓN
Las guías de práctica clínica aconsejan utilizar una fistula arterio-venosa (FAV) frente a un catéter venoso central tunelizado (CVCT) como acceso vascular para hemodiálisis ya que estos presentan más riesgo de infección, trombosis y lesión de las grandes venas centrales, resultando su uso en un incremento de la morbi-mortalidad [1] [2]. Sin embargo, la utilización de CVCT continúa siendo elevada. Así, según el informe de 2019 del US Renal Data System, el 80,1% de los pacientes que iniciaron hemodiálisis en 2017 en EEUU lo hicieron mediante un CVCT y la prevalencia en 2018 era del 19,5% [3], situándose ésta en España en un 29% [2].
De hecho, aunque la FAV es la primera opción de acceso vascular, existen situaciones en las que esto no es posible o está contraindicada su realización, ocupando los CVCT un papel importante [4]. Estas situaciones son: expectativa de vida inferior a 6 meses, cardiopatía, arteriopatía o ausencia de capital venoso que imposibilite o contraindique su realización. La utilización de un CVCT también está indicada en pacientes en lista de espera de un trasplante renal de donante vivo, en espera de maduración de una FAV, en pacientes que previamente eligieron diálisis peritoneal en espera de utilización del catéter peritoneal o por deseo expreso del paciente [1] [2].
Este artículo revisa los diferentes tipos de CVCT, la metodología de su implantación y las complicaciones derivadas de su uso.
TIPOS DE CATÉTERES TUNELIZADOS PARA HEMODIÁLISIS
Existe un amplia disponibilidad de modelos de catéteres, aunque ninguno reúne las características de lo que se vendría a llamar el “catéter ideal” [1] [2]. Estas se resumen en la (Tabla 1).
Los CVCT se clasifican en base a diferentes criterios: el diseño de su punta, la presencia o ausencia de orificios laterales, el diseño de su luz y el material del cual están compuestos [5].
Diseño de la punta
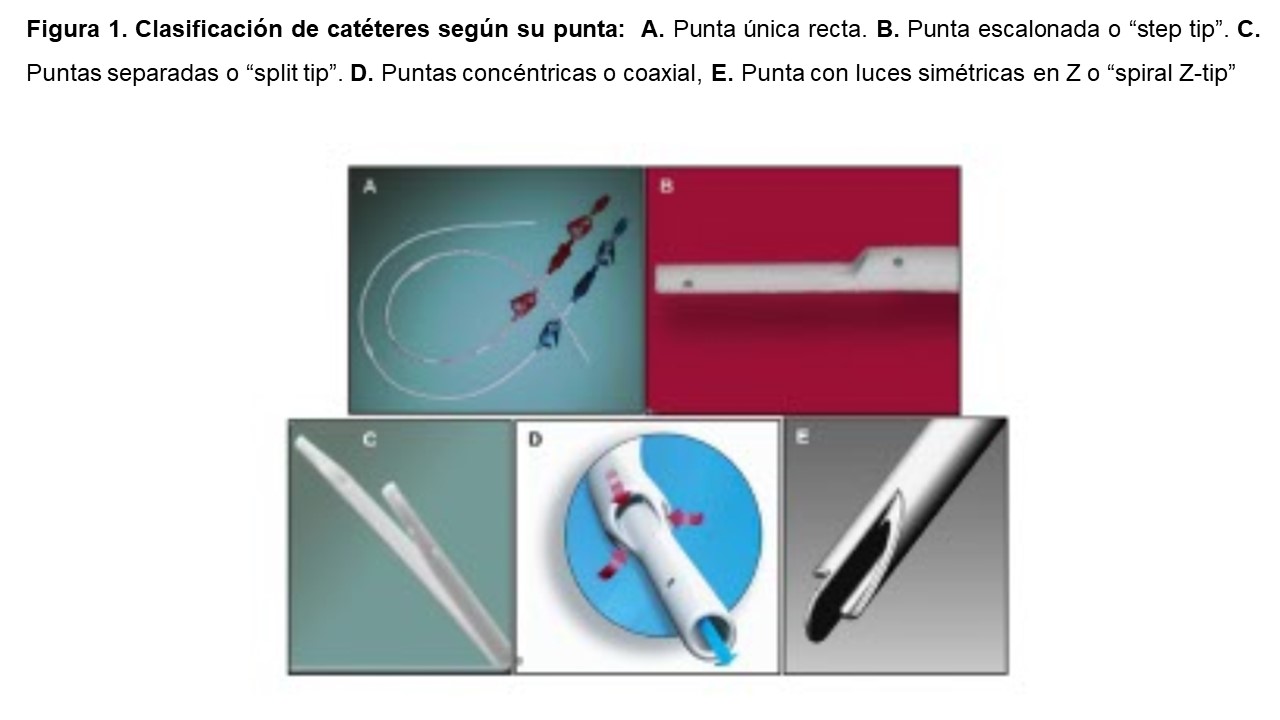
Según el diseño de la punta, los CVCT se clasifican en catéteres con punta única recta, con punta escalonada o “step tip”, con puntas separadas o “split tip”, coaxial y con punta con luces simétricas en Z o “spiral Z-tip” [6] [7] (Figura 1).
1) Punta única recta es el que presenta el catéter Canaud® y Tesio®. Formado por dos catéteres independientes de una sola luz con punta recta. Ofrece la ventaja de obtener flujos sanguíneos elevados y baja recirculación, y la desventaja de precisar una inserción y tunelización dobles [8].
2) Punta escalonada o step tip. Es un catéter de doble luz en el cual los orificios de entrada y salida del flujo sanguíneo se disponen de forma escalonada separados por una distancia de 2,5 cm. Ejemplos de este son Perm-cath®, Mahurkar® y Hickman®. Los catéteres que presentan un diseño con punta escalonada se dividen a su vez en tres subtipos según el ángulo que forman el eje longitudinal del catéter y el corte del orificio arterial [6] (Figura 2). La diferente disposición del ángulo tiene implicaciones en el rendimiento y supervivencia del catéter. Así, aquellos con un diseño en ángulo agudo del orificio arterial, como el catéter Duraflow®, presentan una menor predisposición a la formación de trombos en la luz arterial que los que se disponen en ángulo recto u obtuso, ya que evita el estancamiento de la sangre y la oclusión cuando el catéter se encuentra cerca de la pared del vaso o se apoya en ésta [6] [7].
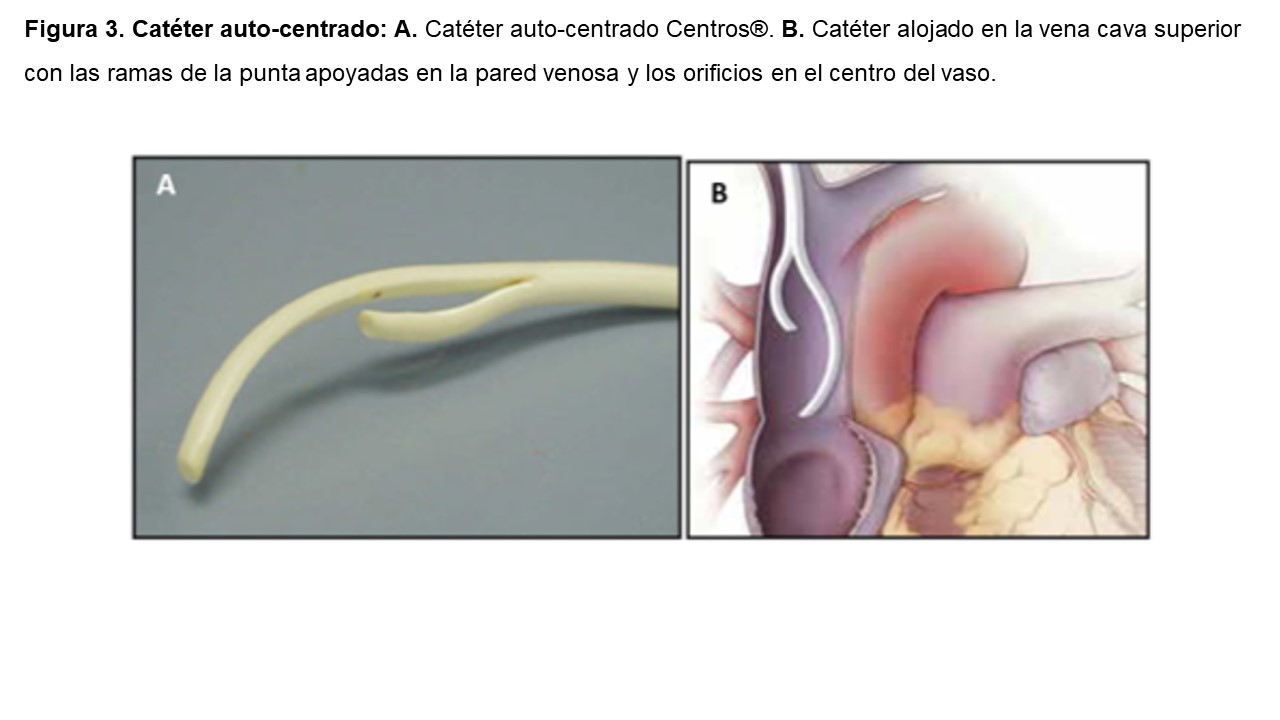
3) Puntas separadas o split tip [6], cuyo objetivo principal es disminuir la recirculación y a la vez alcanzar flujos elevados. Ejemplos son los catéteres Ash-Split®, Cannon II Plus® y Hemosplit®. Dentro de este tipo se encuentra un subtipo en el que cada punta forma una curva con la convexidad dispuesta lateralmente de manera que los orificios arterial y venoso quedan colocados de forma obligada en el centro de la luz del vaso, impidiendo que se apoyen en su pared. Es el caso del catéter auto-centrado Centros®. Para obtener este resultado es necesario que las puntas del catéter queden alojadas en la vena cava superior [6] (Figura 3).
4) Coaxial o con puntas concéntricas [6] [7], como los catéteres Hemostream® y Free-Flow®. Está compuesto por dos cilindros de diferente calibre dispuestos de forma concéntrica, alojándose el de menor sección y mayor longitud en el de mayor sección y menor longitud. La entrada del flujo de sangre se produce por el cilindro externo y el retorno por el interno. La particularidad de este catéter es que ambas luces poseen una sección de 360º y además la luz arterial se encuentra dividida en tres secciones [7].
5) Luces simétricas en Z o “spiral Z-tip”. Ejemplo de este es el Palindrome®. Presenta la ventaja de ofrecer flujos sanguíneos elevados con baja tasa de recirculación, aunque se utilice con ramas invertidas, y permitir la colocación de la punta en la vena cava superior [6] [7].
Presencia o ausencia de orificios laterales
El segundo criterio utilizado en la clasificación de los CVCT es la presencia o ausencia de orificios laterales. El objetivo de estos es disminuir la resistencia al flujo sanguíneo y aumentarlo. Sin embargo, se ha demostrado que su presencia incrementa la resistencia al flujo fundamentalmente en el lado arterial, no existiendo en el contexto clínico diferencias entre catéteres con orificios laterales y sin ellos [9].
Por otro lado, los CVCT con orificios laterales presentan una mayor tasa de formación de coágulos, infección y bacteriemia relacionada con el catéter, que disminuye su supervivencia. Que la presencia de orificios laterales genere la formación de coágulos se atribuye a tres factores: crea un espacio muerto relativo que promueve la formación del coágulo, facilita la salida del sellado con anticoagulante y predispone a la adherencia del coagulo al borde del orificio por su estructura irregular, demostrada por microscopía de barrido, fundamentalmente en aquellos realizados con sacabocados y no con láser [9].
Diseño de la luz del catéter
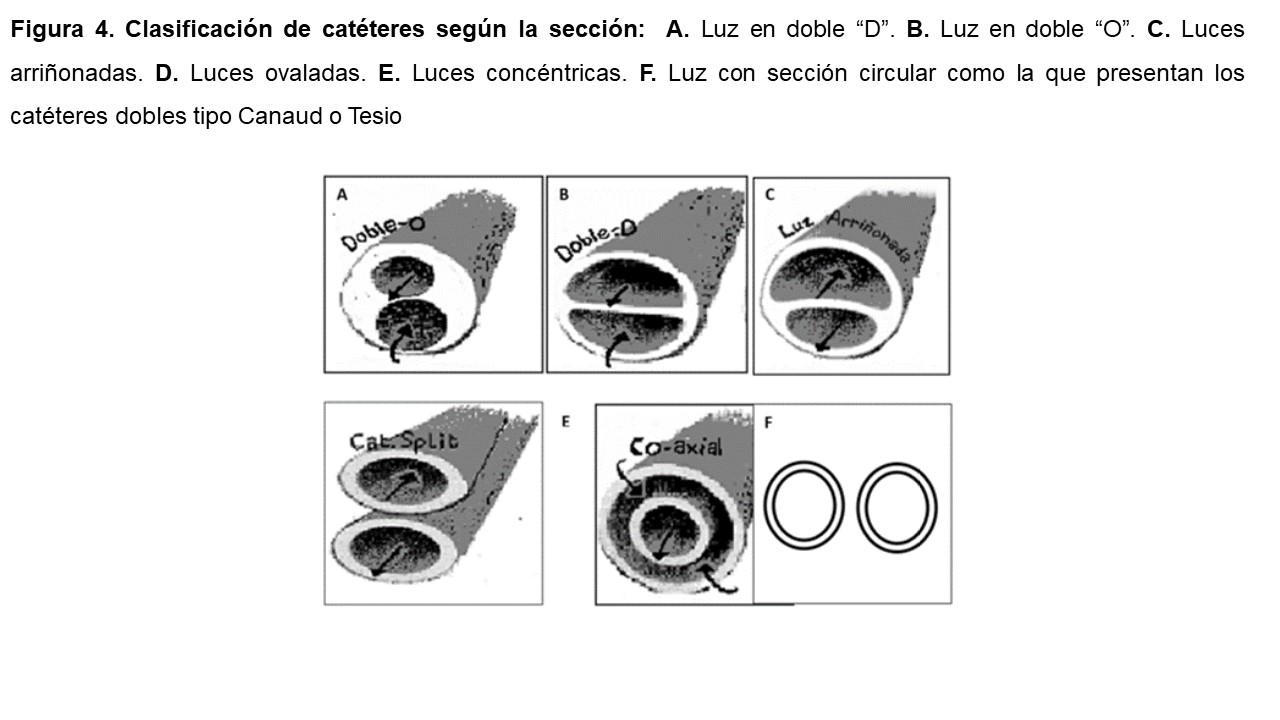
El tercer criterio utilizado de clasificación es la sección de la luz del catéter. Según éste se clasifican en catéteres con luz en doble “D”, doble “O”, luces arriñonadas, luces ovaladas, concéntricas en los catéteres coaxiales, y con sección circular como la que presentan los catéteres dobles tipo Canaud o Tesio [6] [8] [10] (Figura 4).
Existen escasas diferencias en el flujo proporcionado por cada uno de ellos, que depende, basado en la ley de Poiseuille, del radio de la sección [11]. Para proporcionar un flujo suficiente los catéteres de una luz deben tener al menos un diámetro de 10F y los de doble luz al menos de 14F. No obstante, este diámetro informa del calibre externo del catéter y lo realmente importante es el diámetro interno, dependiendo este último del grosor de su pared.
Composición del material del catéter
El cuarto criterio utilizado en la clasificación es la composición del catéter, la cual influye en sus prestaciones, supervivencia, trombogenicidad y mayor o menor riesgo de infecciones. El material más recomendable es el poliuretano y sus derivados bio-flex o carbotano, Estos aportan más solidez y elasticidad que la silicona y confieren un mayor diámetro interno. Los CVCT de carbotano son más resistentes a agentes químicos como alcoholes, yodo o agua oxigenada, lo que incrementa su supervivencia [10]. Además, presentan menor adherencia bacteriana [12].
FACTORES QUE CONDICIONAN LA SUPERVIVENCIA DEL CATÉTER
Trombosis
El principal determinante de la supervivencia de un CVCT es la formación de un trombo adherido a su punta o bloqueando su luz, provocando la disfunción, la infección y la formación de vainas de fibrina. Por ello, algunos diseños incorporan agentes antitrombóticos en su pared. Existen al menos dos catéteres que han incorporado heparina a su superficie como son el Spire Biomedical® y Tal Palindrome®. La heparina adherida a su superficie reduce la activación de la trombina e inhibe la proliferación de células musculares lisas [7]. Un estudio retrospectivo mostró que los CVCT recubiertos con heparina presentaban flujos ligeramente más elevados a los 3, 60 y 90 días [13]. En el caso del catéter Palindrome® su superficie se encuentra recubierta por un capa de óxido de polietileno con polímeros cargados negativamente que repelen las células sanguíneas, evitando la adhesión a su superficie. Además, la heparina unida covalentemente a la capa de óxido de polietileno inhibe la coagulación. Algunos ensayos clínicos han demostrado que otros dispositivos compuestos por este tipo de superficie, disminuyen la activación plaquetaria, del complemento y los granulocitos [7]. Aunque este tipo de materiales han demostrado su efectividad en catéteres no tunelizados, los cuales son utilizados por un período de tiempo limitado, no existe evidencia que justifique su uso en CVCT cuyo periodo de utilización es más largo y tienen un mayor coste [1] [2] [14].
Infección bacteriana
Otro factor que limita la supervivencia del catéter es su colonización bacteriana y el riesgo de bacteriemia, siendo este siete veces mayor en pacientes con catéter que en portadores de FAV.
La incorporación de iones de plata a la superficie externa del catéter o un manguito impregnado en plata no ha mejorado los resultados comparado con catéteres convencionales, siendo ineficaces o perdiendo su capacidad antimicrobiana transcurridas 48 horas [15] [16] [17].
Otra estrategia para limitar la infección del catéter ha sido la fabricación de catéteres recubiertos con rifampicina y minociclina en su superficie interna y externa. Algunos ensayos clínicos aleatorizados controlados han demostrado una reducción de la colonización bacteriana y bacteriemia relacionada con el catéter en catéteres no tunelizados impregnados con rifampicina y minociclina [18] [19], pero se desconoce si estos resultados serían aplicables a CVCT, debido a su periodo de utilización más largo y a la posible aparición de resistencias.
IMPLANTACIÓN DE UN CVCT
El vaso ideal para la implantación de un CVCT es la vena yugular interna derecha por su sencillo abordaje y presentar menos complicaciones. Otras localizaciones incluyen la yugular interna izquierda, ambas femorales comunes, ambas subclavias, yugulares externas, la vena cava inferior o las venas suprahepáticas [1] [2] [20].
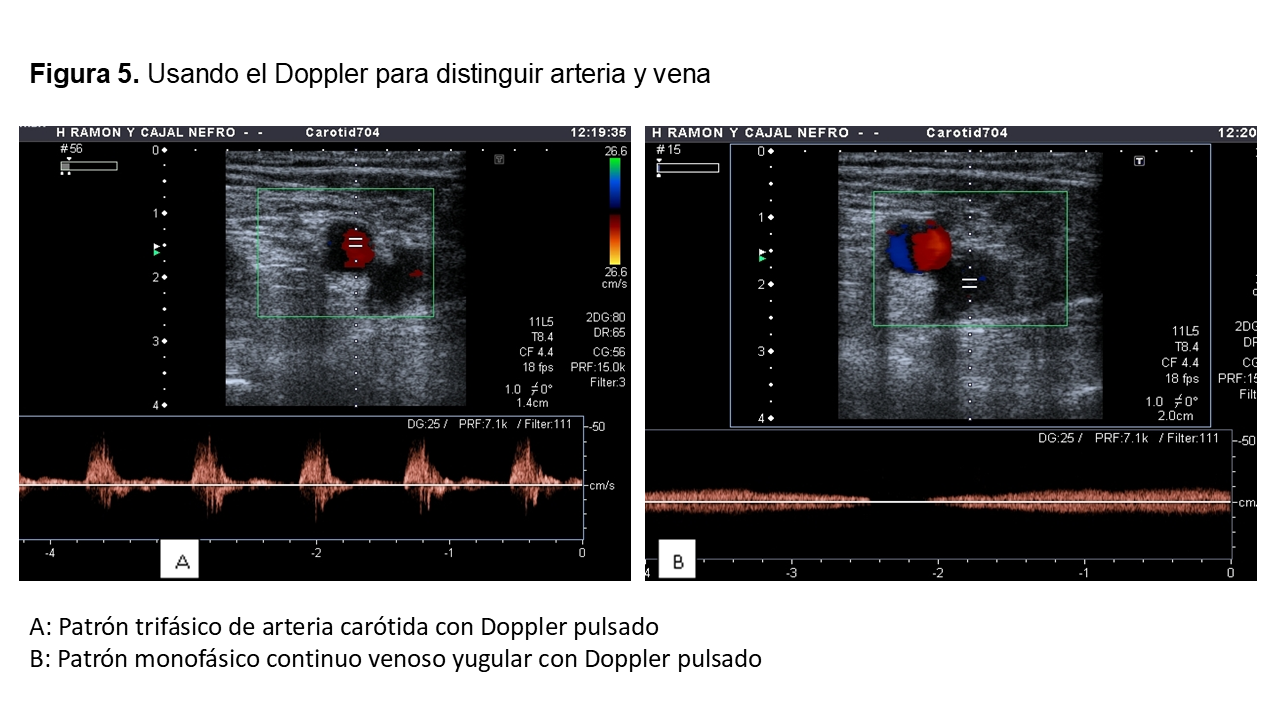
Las guías clínicas recomiendan que la canalización venosa sea ecoguiada [1] [2] (Figura 5) (Figura 6) (Figura 7).
El abordaje de ambas venas yugulares se realiza a través del triángulo de Sedillot, formado por el borde externo del fascículo esternal del músculo esternocleidomastoideo, el borde interno del fascículo clavicular y la clavícula. Ambas venas yugulares internas cruzan el triángulo de Sedillot desde su ángulo superior hasta su base. La localización de éstas mediante ecografía en el citado triángulo permitirá su canalización. A diferencia de la implantación del catéter en la vena yugular interna derecha, la implantación en la yugular interna izquierda aumenta el riesgo de lesiones traumáticas ya que el catéter se ve obligado a realizar una curva en la unión de la vena yugular con la innominada izquierda y otra en la unión de ésta con la vena cava superior.
La vena femoral cruza el ligamento inguinal en su tercio medio para introducirse en el triángulo de Scarpa. Su canalización es sencilla bien mediante palpación de la arteria femoral, situándose la vena en posición medial a la arteria, o bien guiada por ecografía.
La utilización de la ecografía para la canalización de las venas subclavias queda limitada por la interposición de la clavícula, siendo preciso utilizar marcas topográficas. La punción debe realizarse en el borde inferior de la clavícula donde se unen sus tercios medio y externo, dirigiendo la aguja hacia la fosita supraesternal una vez introducida por debajo de la clavícula.
Procedimiento de implantación de CVCT en vena yugular interna
1) Implantación anterógrada
Para la canalización de las venas yugulares internas nos situaremos detrás de la cabeza del paciente, que estará colocada en ligera rotación hacia el lado contrario al vaso a canalizar y con el brazo en aducción. Para la canalización de la vena y la introducción de la guía metálica es recomendable utilizar un set de micropunción compuesto por una aguja fina (21G), un conjunto introductor coaxial formado por una doble vaina de plástico introducida una dentro de otra con un calibre de 3F la interna y de 5F la externa, y una microguía. Tras la canalización del vaso se introducirá la microguía en la aguja y se controlará su correcta posición mediante radioscopia. La utilización del set de micropunción como primer paso disminuye el riesgo traumático sobre la arteria carótida en caso de punción inintencionada.
Una vez comprobada la correcta localización de la microguía se realizará una ampliación del punto de punción con bisturí hasta unos 7-10 mm. En una segunda maniobra se procederá a la introducción de la guía metálica de mayor calibre contenida en el kit del catéter. Para ello, una vez extraída la aguja, se hará progresar a través de la microguía el conjunto introductor coaxial del set de micropunción. A continuación, se extraerá simultáneamente la microguía y la vaina de menor calibre del introductor, introduciendo a través de la de mayor calibre, la guía metálica del kit del catéter.
Es aconsejable la monitorización para detectar la aparición de arritmias provocadas por el estímulo de la guía sobre las vías de conducción auriculares y así poder modificar la posición de la guia hasta la desaparición de la arritmia. El riesgo de aparición disminuye si se hace avanzar la guía hasta la vena cava inferior.
Tras la canalización de la vena yugular se procederá a la realización del túnel subcutáneo. Antes de iniciar la tunelización se simulará la posición definitiva del catéter mediante la colocación de este sobre la superficie del paciente. Se situará el extremo intravascular unos 2 o 3 cm por debajo del ángulo de Louis, que indica la unión entre la cava superior y la aurícula derecha, con lo que nos aseguraremos que el extremo intravascular queda situado en la aurícula derecha. El recorrido subcutáneo del catéter desde el punto de entrada de la guía metálica hasta su salida al exterior se dibujará en la piel con un rotulador dérmico estéril, trazando una curva lo más abierta posible para evitar la angulación excesiva del catéter. De la misma manera se elegirá la situación del manguito de dacron, que también se marcará, debiendo quedar situado a unos 2 o 3 cm del orificio de salida. A continuación, se procederá a anestesiar el trayecto del túnel subcutáneo. El tunelizador es maleable para poder curvarlo y adaptarlo a la curva del túnel. Para la realización del orificio de salida del catéter se utilizará un “punch” de biopsia dérmica de un calibre similar al del catéter que permitirá que la piel lo abrace sin necesidad de puntos de sutura.
Antes de realizar el túnel subcutáneo se ensamblará el tunelizador con el catéter introduciendo el extremo romo estriado del tunelizador en el orificio de la punta del catéter, cubriendo esta unión con el capuchón integrado en el tunelizador.
El túnel subcutáneo se realizará siguiendo el trayecto dibujado previamente en la piel. La maniobra se iniciará introduciendo el extremo puntiagudo libre del tunelizador por el orificio de salida realizado con el “punch” en el extremo lateral del trayecto del túnel hasta hacerlo salir por el extremo más medial del trayecto, el cual coincide con el orificio de entrada de la guía metálica, arrastrando el catéter tras él. Una vez alojado en el túnel subcutáneo se comprobará mediante palpación que la localización del manguito de dacron coincide con la marca previamente elegida en el trayecto del túnel.
Tras la realización del túnel subcutáneo se procederá a la introducción de segmento intravascular del catéter en la vena. Para ello, se utilizará un complejo introductor compuesto por un mandril alojado en una vaina “pelable”. Tras la introducción de este complejo a través de la guía metálica se extraerá esta junto con el mandril y se introducirá en la vaina el segmento intravascular del catéter. Posteriormente la vaina se extraerá mediante su rotura longitudinal. La introducción del complejo introductor se facilitará mediante dos dilataciones consecutivas previas del orificio de entrada vascular con dos dilatadores de diferente calibre a través de la guía metálica.
La correcta posición del catéter se confirmará mediante radioscopia y se fijará a la piel mediante sutura hasta que quede definitivamente anclado al tejido subcutáneo.
2) Implantación retrógrada
Frente al tipo de implantación descrita anteriormente, denominada anterógrada, existe otro tipo conocida como retrógrada, en la que primero se coloca la porción intravascular del catéter, realizándose en un segundo tiempo la tunelización de forma retrógrada, inversamente a como se realiza de forma anterógrada, esto es, introduciendo el tunelizador con la porción extravascular del catéter por el orificio de entrada y extrayéndolo por el orificio de salida lateral del túnel. Para que este tipo de implantación sea posible es necesario que las ramas venosa y arterial puedan separarse del resto del catéter, debiendo ensamblarse a éste una vez implantado. Este tipo de implantación facilita obtener una posición óptima de la punta. La desventaja que presenta es una colocación más compleja.
Algunos modelos de catéter pueden implantarse sin el complejo introductor con vaina “pelable” mediante la incorporación de un estilete hueco en la luz del catéter que le proporciona la consistencia suficiente para permitir su colocación mediante la introducción de la guía en el estilete. Esta posibilidad es muy útil para la implantación de catéteres en la vena yugular interna izquierda en la que la utilización del complejo introductor con vaina puede provocar traumatismos en el vaso (Figura 8).
COMPLICACIONES
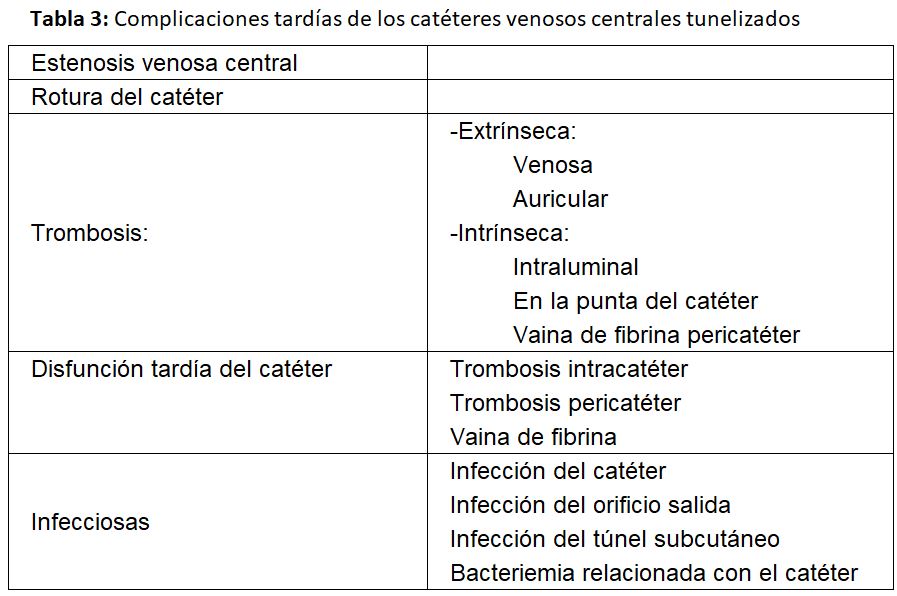
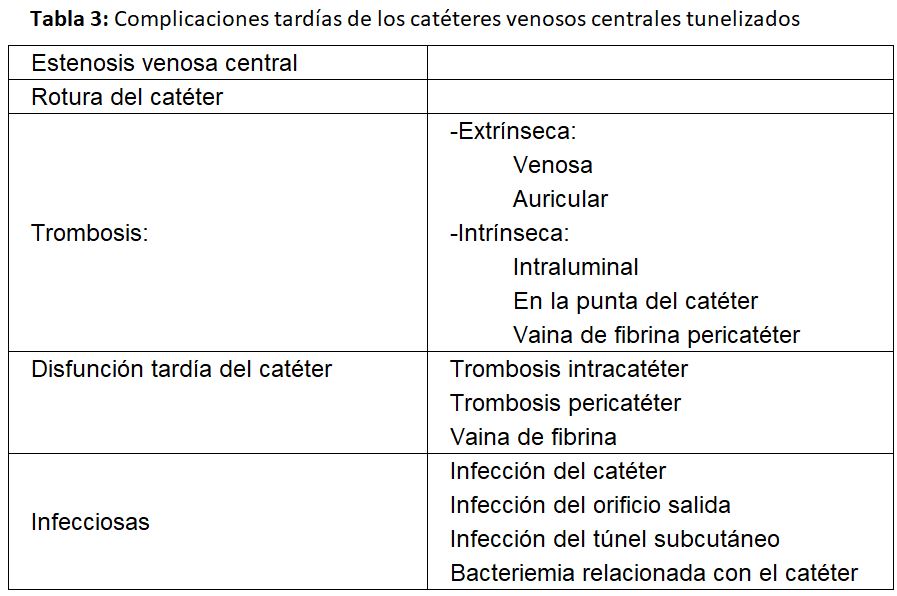
Las complicaciones se clasifican en precoces y tardías [1] [2] [20] (Tabla 2) (Tabla 3).
Complicaciones precoces
1.- Complicaciones de la técnica de implantación
Se consideran complicaciones precoces aquellas que aparecen antes de transcurridos 30 días desde la implantación del catéter [1] [2]. Los mayores determinantes de su aparición son la experiencia del operador y la utilización de técnicas de imagen como la ecografía y la radioscopia, siendo la experiencia del operador el que tiene más peso en la ausencia de complicaciones [1] [2].
Las complicaciones precoces quedan divididas en aquellas relacionadas con la punción venosa y la inserción de la guía metálica y el catéter.
a) Relacionadas con la punción venosa
Entre las complicaciones relacionadas con la punción venosa se encuentran la lesión arterial, la aparición de neumotórax, enfisema y hematomas subcutáneos. Estas son muy poco frecuentes cuando se emplea guía ecográfica.
b) Relacionadas con la inserción de la guía
Las relacionadas con la inserción de la guía incluyen la migración de esta generalmente a la vena subclavia, al tronco braquiocefálico contralateral y a la vena ácigos en el caso del abordaje de la vena yugular interna, o la vena iliaca contralateral en el caso del abordaje de la vena femoral común [1] [2]. Todas ellas provocarían posteriormente la disfunción del catéter, aunque son fácilmente identificables mediante radioscopia. El estímulo de la guía sobre las vías de conducción auriculares puede ser causa de arritmias.
c) Relacionadas con la inserción del catéter
Las complicaciones relacionadas con la inserción del catéter incluyen hematomas locales, embolia gaseosa, evitable mediante apnea del paciente durante la maniobra de inserción, y el acodamiento del catéter a la entrada en la vena yugular, evitable realizando el túnel subcutáneo con curvas lo más abiertas posibles. La parálisis del nervio recurrente laríngeo así como la perforación de la vena cava superior son complicaciones infrecuentes, aunque graves debido al desarrollo de hemotórax o hemopericadio, estando relacionadas con la inserción del catéter.
2.- Complicaciones infecciosas precoces
La infección precoz del catéter generalmente se debe a una inadecuada asepsia durante el procedimiento o a la ausencia de unas mínimas normas de higiene durante los primeros días tras la implantación.
3.- Disfunción precoz del catéter
Una de las complicaciones precoces más frecuentes es la disfunción precoz siendo la causa más común la malposición de la punta. Es más frecuente en catéteres con punta escalonada si la luz arterial queda apoyada en la pared vascular, pudiendo adherirse a esta durante la hemodiálisis. Esta complicación es menos frecuente en catéteres con punta con luces simétricas en Z, con puntas concéntricas o auto-centrados. También la disfunción precoz puede acontecer por quedar alojada la punta del catéter en un vaso erróneo o por retracción del catéter tras su implantación. Se debe tener en cuenta que aunque la punta del catéter quede situada en la aurícula con el paciente en decúbito, al adoptar la posición ortostática la estructuras cardiovasculares alojadas en el mediastino descienden mientras el catéter se mantiene en la misma posición por lo que es posible que la punta se sitúe entonces unos 2 cm más arriba, en la cava superior.
Complicaciones tardías
Se consideran complicaciones tardías cuando aparecen 30 días después de la implantación del catéter [1] [2].
a) Estenosis venosa central: La estenosis ocurre por lesión de la íntima, siendo frecuente cuando se ha implantado en una vena subclavia, llegando a producirse esta complicación entre un 42 y 50 % según las series.
b) Trombosis del catéter: Es otra complicación tardía frecuente. A su vez queda clasificada como:
- Extrínseca, especialmente cuando el catéter se ha colocado en la vena yugular o subclavias izquierdas. Está causada por lesión venosa durante la inserción del catéter en las incurvaciones que tiene que seguir en la vena innominada izquierda y sobre todo cuando se encuentra alojado en el vaso durante un largo período de tiempo.
- Intrínseca: cuando el trombo se encuentra alojado en la luz o en la punta del catéter o por la formación de una vaina de fibrina que lo envuelve. Es obvio pues, que van a causar la disfunción tardía del catéter y generalmente se relacionan con defectos en el manejo de su purgado. No se debería recambiar un catéter con vaina de fibrina por uno nuevo mediante guía si antes no se ha extraído o se ha procedido a su rotura mediante un balón de angioplastia, ya que el nuevo catéter quedaría alojado en la vaina y sería también disfuncionante [21]. Las guías del acceso vascular del GEMAV de 2017 recomiendan utilizar fibrinolíticos y si estos no resolvieran el problema, recambiar el catéter con rotura previa de la vaina de fibrina mediante angioplastia en el caso de que esta sea la causa de la disfunción, siempre que el catéter vaya a ser colocado en la misma localización. El “stripping” de la vaina ha presentado peores resultados que el recambio del catéter por lo que no se recomienda [2].
c) Disfunción del catéter
Las últimas guías KDOQI y del GEMAV definen a un catéter como disfuncionante cuando falla para mantener el flujo sanguíneo prescrito requerido para obtener una hemodiálisis adecuada sin necesidad de alargar el tiempo de tratamiento prescrito [1] [2] situación que generalmente sucede con flujos inferiores a 300 ml/min.
d) Infección tardía del catéter
Por último, una de las complicaciones tardías más graves que podemos encontrar es la infecciosa, manifestada como infección del catéter o del orificio de salida y bacteriemia relacionada con él. Estas pueden ser responsables del fallo del 6-28 % de los catéteres según las series.
ELECCION DEL CVCT
Existen múltiples estudios comparando distintos modelos de CVCT.
Trerotola y cols. compararon un catéter con diseño de puntas separadas, el Ash-Split®, con otro con punta escalonada, el Opti-Flow®. Ambos mostraron flujos elevados, aunque significativamente mayores para el catéter con punta Opti-Flow®, pero con una mayor tasa de recirculación. Sin embargo, el catéter Ash-Split® mostró una mayor supervivencia y una menor tasa de complicaciones [22].
Otro estudio posterior comparó un catéter con punta simétrica como Palindrome® con otro con puntas separadas, no encontrando diferencias en la permeabilidad primaria asistida a los seis meses entre ellos, aunque la tasa de infección fue mayor en el catéter con punta simétrica en Z. [23].
Otros dos estudios compararon un catéter con punta simétrica con otro con punta escalonada. El primero no encontró diferencias en cuanto al flujo y la recirculación entre los dos tipos de catéter, pero aquel con punta simétrica en Z mostró una mayor supervivencia [24]. El segundo estudio mostró que la permeabilidad primaria asistida era similar en ambos tipos de catéteres, al igual que la incidencia de trombosis e infección, aunque el requerimiento de trombolisis fue menor para el catéter Palindrome®, presentando además una mayor tasa de flujo [5].
Ningún modelo de CVCT para hemodiálisis ha demostrado ser superior a otro. Por lo tanto, no existen recomendaciones en cuanto a la elección de un tipo específico. Las guías KDOQI y del GEMAV recomiendan que la elección del catéter debería basarse en la experiencia individual, los objetivos para su uso, y el coste [1] [2].