Historia de la Biopsia Renal
a
Servicio de Nefrología. CH Universitario de Ourense. Galicia
Los inicios de la nefropatología se remontan a los siglos XVII y XVIII y sus autores principales fueron Marcello Malpighi (Bolonia 1628-1694) (Figura 1) [1] un anatomista y biólogo, considerado el fundador de la Histología y Giovanni Battista Morgagni (Padua 1682-1771) (Figura 1) [1] otro gran anatomista, discípulo de Antonio Maria Valsalva [2]. El nombre de “biopsia“(“bio”, "vida", y “opsí”, "observar") se empleó por primera vez en 1929 por Scalabrino [3] .
Los antecedentes históricos, hay que situarlos en la decadencia del mundo medieval y el inicio de la era Moderna. La desaparición del mundo medieval ocurre a lo largo del siglo XV por factores, como el declive del Sacro Imperio Romano Germánico, el debilitamiento de la Iglesia católica a causa de los cismas y los movimientos heréticos - que darían origen a la Reforma protestante y la Guerra de los 30 años - la profunda crisis económica derivada del anquilosamiento del sistema feudal y la decadencia de las artes y las ciencias, lastradas por una teología escolástica sumida en el escepticismo.
Entramos en la era Moderna que se extiende desde el descubrimiento de América (1492) hasta la Revolución francesa (1787) y el Renacimiento. Este fue el gran movimiento cultural producido en Europa entre los siglos XV y XVII y provocó una profunda transformación del pensamiento, las artes y las ciencias, y supuso la verdadera transición entre la Edad Antigua y la Edad Moderna. La nueva corriente de estos tiempos será el humanismo, más interesado en el hombre y la naturaleza, que en las cuestiones divinas y espirituales. En Medicina y durante esta época, hubo importantes avances. Así, en 1543, Vesalio publicó “De humani corporis fabrica” [4] (Figura 1) un compendio de anatomía con profusas ilustraciones, considerado uno de los más influyentes libros científicos de todos los tiempos. Es una anatomía funcional más que topográfica y abrió el camino a otros descubrimientos.
Bartolomeo Eustachio (San Severino Marche,1500-1574) descubrió las cápsulas suprarrenales, Ambroise Paré (Laval 1510-1590) inició la cirugía moderna, Miguel Servet (Villanueva de la Sigena, Aragón, 1509-1553) describió la circulación pulmonar y William Harvey (Folkestone, 1578-1657) la de la sangre, Gabriele Falloppio (Módena, 1523-1562) estudió la estructura interna del oído y Zacharias Janssen (Middelburg, 1585-1632) inventó el microscopio en 1590 (Figura 2) [5].
El primer microscopio construido por Zacharias Janssen no se ha conservado hasta nuestra época, pero gracias a la descripción de William Borelius [6], se ha podido reconstruir. Era un tubo de unos 18 cm al que se podían acoplar dos lentes en sus extremos, de unos 5 centímetros de diámetro. La lente que actuaba como objetivo era biconvexa mientras que la lente ocular era planoconvexa. Tenía una pequeña apertura a cada lado a través de la cual llegaba la luz o se realizaba la observación. El poder de aumento de este microscopio no llegaba a los 9x.
Coincidiendo con la invención del microscopio, se realizaron los primeros estudios de tejidos renales obtenidos a partir de autopsias. En 1666, Malphigi planteó la hipótesis de que la formación de la orina tenía lugar en los riñones a través de un mecanismo de filtrado entre la sangre y los túbulos renales [4] y unos años más tarde, Morgagni, en su enciclopédica obra “De Sedibus et causis morborum per anatomem indagatis“ publicada en 1761 a la edad de 79 años [7] (Figura 2) y basada en más de 600 autopsias, definía que las patologías podían producirse por problemas en órganos específicos. La de Morgagni era una enciclopedia incompleta en la que faltan análisis microscópicos y era debido a que no confiaba en ellos [3]. Entramos en el s XIX, la era de la revolución industrial y de los grandes cambios sociales y económicos que darán un gran impulso a la Medicina. Será el siglo de la salud pública, de la asepsia, de la anestesia y de la cirugía. Nace además la “teoría de la evolución” como expresión antropológica del positivismo científico cuyo fundamento es que la realidad puede medirse y predecirse mediante leyes y estas son comprobadas por los sucesivos experimentos. La gran Figura médica será Rudolph Ludwig Karl Virchow (1821-1902) (Figura 2) el que postuló la teoría de “Omnia cellula a cellula” (toda célula proviene de otra célula) y los organismos vivos serian estructuras formadas por células. Por tanto, la célula como unidad básica de los procesos patológicos [8]. Otra gran aportación fue el concepto de los determinantes de la salud. Enfatizó las circunstancias históricas y materiales concretas en las cuales aparecía la enfermedad, las fuerzas sociales contradictorias que impedían la prevención, y el papel del investigador promoviendo las reformas [9].
William Browman (1816-1892) (Figura 3) “rescató” los trabajos de Malpighi dos siglos más tarde y describió los componentes de la parte proximal de la nefrona con la capsula periglomerular, que posteriormente se le conocería como la capsula de Bowman (Figura 3).
Pero la gran Figura de la anatomía patológica fue Carl Freiherr von Rokitansky (Praga 1804-1878) (Figura 3), que fue un médico, patólogo, humanista, filósofo y político liberal austriaco. Por su meticulosidad descriptiva, fue considerado el “Linneo” de la anatomía patológica. No practicó medicina clínica, pero convivió con renombrados médicos de la época como Josef Škoda (Pilsen.1805-1881) y Ferdinand von Hebra (Brno,1816-1880) entre otros y fueron los pilares de la llamada “nueva escuela de Viena”. Škoda mejoró los métodos clínicos de diagnóstico, Hebra sobresalió por sus habilidades diagnósticas y terapéuticas en dermatología y las contribuciones de Rokitansky fueron primordiales para el desarrollo de la anatomía patológica. Como curiosidad y siendo todavía estudiante, ayudó a Johann Wagner (1800-1833) a realizar la autopsia de Beethoven, el 27 de marzo de 1827 [13].
En la antigua Alejandría, al comienzo de la era, se concretó que la orina procedía de los riñones y el síntoma cardinal del Síndrome Nefrótico (SN), el edema, se consideraba por aquel entonces un trastorno “per se” sin preguntarse los médicos sobre su origen hasta mediados del siglo XVIII. En 1784, el crítico literario Samuel Johnson (Lichfield,1709-1784) murió y se observó en la autopsia de manera fortuita que su fallecimiento había sido causado por “una patología renal”. Esto hizo que las observaciones de Theodore Zwinger (Basilea, 1658-1724) en 1722 cobraran más importancia todavía. Él fue quien realizó una de las primeras descripciones, refiriéndose a ello como “Anasarca Puerorum” en su “Paedojateja práctica”. Zwinger era médico pediatra y profesor suizo de anatomía y teoría médica en la Universidad de Basilea y describió el origen renal y los signos físicos del síndrome nefrótico [13] además de utilizar por primera vez el término “pediatría” [14].
Así fue como se asentó el origen renal del síndrome nefrótico, y Morgagni aún no había escrito el clásico “De sedibus et causis morborum” [7], donde definía que las patologías podían producirse por problemas en órganos específicos. A finales del siglo XVIII, las hidropesías generalizadas se dividieron en las que se producían de una forma general o inflamatoria, y en las que dependían de "vísceras mórbidas" (enfermedad hepática y cardíaca). En las primeras, varios autores observaron la “coagulabilidad” de la orina, entre ellos Doménico Cotugno (Ruvo Pugliese, 1736-1820) (Figura 4) y en el capitulo 17 de su obra “De ischiade nervosa commentarius” publicada en 1764 describió la unión de estas con la proteinuria [15].
Estamos en el s XVIII y la filosofía reinante es el Vitalismo, una teoría protocientífica según la cual los organismos vivos se caracterizan por poseer una fuerza o impulso vital que los diferencia de forma fundamental de las cosas inanimadas y no está sujeta a las leyes fisicoquímicas generales [16] y en la medicina los estudios se realizan sobre la base de la anatomía mórbida y la iatroquímica, precursora de la farmacología y la bioquímica. La síntesis de la urea por Friedrich Wohler (Eschersheim, 1800-1882) en 1828 puso fin al Vitalismo ya que un producto producido por los organismos vivos se puede obtener de forma artificial [17].
Es el momento del positivismo científico, y en este contexto, Richard Bright (Bristol, 1789-1858) y su colega John Bostock (Liverpool, 1773-1846), “reunieron” la triada de proteinuria, edema y enfermedad renal, y describieron el síndrome nefrótico con todo detalle en su clásico “Reports of medical cases” de 1827 [18]. Bostock era químico y médico en Liverpool, cuantificaba las proteínas de la orina y del suero por métodos en función del peso específico, y observó que cuanto mayor era la cantidad de proteinas en la orina, había menos en la sangre. Esta característica fue confirmada en 1829 por Robert Christison (Edinburgo, 1797-1882), el cual afirmó que “ la gravedad específica del suero siempre ha sido menor cuando la orina estaba cargada de albúmina, por lo tanto, es probable que la secreción albuminosa de la orina no sea más que una trasudación de suero de la sangre" [13] .
Durante el primer tercio del siglo XIX, fueron muy destacados los trabajos de Richard Bright y John Bostock en Inglaterra, y de Pierre Francois Olive Rayer (Saint Sylvain, 1793-1867) en Francia, y a finales del mismo, las aportaciones de Friedrich Gustav Jacob Henle (Fürth, 1809-1885) y William Bowman, pero todos ellos realizados sobre material de autopsia. Richard Bright, en base a las descripciones microscópicas, trató de establecer una clasificación de las enfermedades renales, pero admitió no poder diferenciar si eran o no diferentes etapas de la misma enfermedad. En este momento, no podía realizarse una correlación entre el análisis microscópico y la clínica, pero una serie de avances técnicos realizados a mediados del siglo XIX, ayudarían a solventar este problema. El primero se produce en 1866, cuando Wilhelm His (Basilea, 1831-1904) (Figura 4), gran anatomista y embriólogo suizo, profesor de la cátedra de anatomía de la Universidad de Basilea y Universidad de Leipzig, inventa el microtomo [19] y Gabriel Valentin (Breslavia, 1810-1883) (Figura 4), fisiólogo alemán de la Universidad de Bern [20] lo perfecciona al introducir el uso de cuchillas dobles con espaciado de hoja ajustable. Comienza, además una larga serie de descubrimientos sobre las diferentes tinciones, que serán esenciales para el estudio del tejido renal.
En 1854, William Henry Perkin, (Londres,1838-1907) (Figura 5) químico británico, descubre los tintes de anilina [21] y en 1869, Theodor Albrecht Edwin Klebs (Königsberg, Prusia, 1834-1913) (Figura 5) [22] patólogo alemán y discípulo de Rudolph Ludwig Karl Virchow describe la técnica de inclusión del tejido en parafina [23].
En 1863, Heinrich Wilhelm Gottfried von Waldeyer-Hartz (Hehlen, 1836-1921) (Figura 5) anatomista y patólogo alemán, introdujo la tinción de hematoxilina y fue también el que definió el cromosoma en 1888 y dio nombre de “neurona” a la célula nerviosa [24].
En 1874, Heinrich Caro (Posen, 1834-1910), químico alemán, sintetizo la eosina [25] y en 1876 Hermann Emil Fischer (Euskirchen, 1852-1919) (Figura 6), químico alemán y Premio Nobel de química en 1902, promovió su uso en la coloración de varios tejidos [26] y en 1884 Julius Dreschfeld (Niederwerrn, 1846-1907) (Figura 6), patólogo alemán afincado en Inglaterra, introdujo la tinción de eosína como método de coloración rápida en tejidos frescos [27]. La mezcla de hematoxilina-eosina se dice que fue introducida por Wossowzky en 1876, que hasta entonces se utilizaban por separado. Para el estudio de la patología renal, fue fundamental la Teoría de la Lesión de Robert Remark (1815-1865), científico judío polaco, experto neurólogo, fisiólogo, embriólogo, histólogo y micólogo. Sus hallazgos cambiaron mucho la percepción sobre cómo se formaban los seres vivos, al demostrar el concepto de “lesión celular” basado en las observaciones de que la división celular conducía a la renovación celular y que todas las células animales surgían de células embrionarias por división progresiva.
A estos avances también contribuyeron los conocimientos sobre fisiología renal encabezados por Friedrich Henle (Furk, 1809-1885) (Figura 6) medico, patólogo, anatomista y zoólogo alemán. Entre sus muchas aportaciones, cabría destacar los estudios de microanatomía renal y descubrir el segmento tubular que lleva su nombre, el asa de Henle. La descripción de la estructura epitelial abrió la puerta a los fisiólogos para desentrañar sus funciones [28].
En resumen, es a partir de 1870, con la fijación del tejido en parafina, el microtomo, las tinciones de hematoxilina-eosína y el microscopio óptico, cuando se posibilitaron el estudio del tejido renal y por vez primera, Klebs acuña el termino de “glomerulonefritis” [22].
Se empiezan a realizar la correlación clínica y los hallazgos microscópicos. Los pioneros fueron Friedrich Theodor von Frerichs (1819–1885) y Friedrich von Mueller (1858–1941), y continuaron su trabajo Volhard y Fahr (Figura 7).
A Karl Theodor Fahr (1877-1945), patólogo alemán, se le considera como el primer nefropatólogo moderno. En 1914, juntamente con Franz Volhard (1872-1950) crearon un sistema de clasificación de los trastornos renales, haciendo la diferenciación entre enfermedades degenerativas (nefrosis), inflamatorias (nefrítidas) y arterioscleróticas (esclerosis) e introdujeron un poco de orden en la "enfermedad de Bright”, al subrayar que los riñones de los enfermos renales terminales no presentaban un aspecto uniforme. Esta clasificación no tenía mucha utilidad clínica, pero se usó durante unos 30 años [31].
Años más tarde y desde Londres, Sir Arthur William Mickle Ellis (Toronto, 1883-1966), médico, canadiense-británico. con una formación multidisciplinaria en química clínica, patología y medicina interna, estableció una correlación anatomoclínica basada en las observaciones de los cursos clínicos que incluían los análisis de sangre y orina, las afecciones asociadas y los hallazgos histológicos de 600 pacientes con enfermedad de Bright, y los hallazgos postmorten de 200 pacientes [32]. Estableció dos tipos de “nefritis”, la nefritis tipo I, de inicio agudo usualmente después de un proceso infeccioso y con un alto grado de recuperación con una traducción morfológica de hipercelularidad celular e infiltración por neutrófilos. En la forma grave, con edema y proteinuria grave, había presencia de necrosis fibrinoide y semilunas. En la nefritis tipo II con debut más insidioso, había esclerosis focal y nodular. En la (Figura 8) se muestra la descripción original de Ellis [32].
Las primeras biopsias quirúrgicas fueron realizadas en New York en 1904 por el ginecólogo y cirujano George M. Edelbohls (1853-1908) dentro de un protocolo de tratamiento de la Enfermedad de Bright mediante decapsulación completa bilateral y publicó su experiencia en 72 pacientes de los cuales 16 recuperaron función renal [33].
La capsulotomía renal se siguió realizando a lo largo de las tres primeras décadas del siglo XX, especialmente en niños [34].
Las primeras biopsias renales en niños se realizaron en 1899. Ferguson publicó los casos de dos pacientes con enfermedad de Bright para tratamiento quirúrgico (decapsulación) y en 1904, Graham, de Filadelfia, publicó el caso de una niña de 26 meses con una anasarca generalizada y albuminuria masiva. En Europa, las primeras biopsias renales abiertas se realizaron en niños a partir de 1917 en el Royal Hospital for Sick Children, de Glasgow y en Inglaterra, comenzaron a realizarse en 1923 en el Royal Liverpool Children’s Hospital, dentro del protocolo de decapsulación [34].
La primera biopsia renal percutánea fue realizada por Robert P. Ball en 1934 [35] cuando realizaba una investigación etiológica de masas abdominales. En 1939, Poul Iversen (1889-1966) y Kaj Roholm (1902-1948), en Dinamarca, habían descrito la biopsia percutánea del hígado con la utilización de una jeringuilla para aspiración [36] y una década más tarde, en 1951, Poul Iversen y Claus Brun (1914-2014) publican el artículo «Aspiration biopsy of the Kidney» [37] (Figura 9).
El verdadero pionero de la biopsia renal por “aspiración” fué Nils Alwall (1904-1986) de la Universidad de Lund (Suecia), cuando en los años 40 se intentaba obtener tejido hepático y de forma accidental se obtuvo tejido renal [38]. Este hecho fue aprovechado por Alwall para realizar biopsia renal utilizando la técnica “aspirativa”. La practicó en 13 pacientes y en posición de “paciente sentado”, pero cuando uno de ellos falleció, pospuso la técnica y no publicó toda su experiencia hasta 1952 [34].
En EEUU, la técnica entra de la mano de A.E.Parris y J.S. Hove [39] y un año más tarde, Robert Manoah Kark (1911-2002 ) y Robert Muchrcke (1921-2003) (Figura 10) introducen dos modificaciones cruciales. La primera es la Aguja de Vim Silverman, una aguja de corte (Figura 10) y la segunda es la posición en decúbito prono [40].
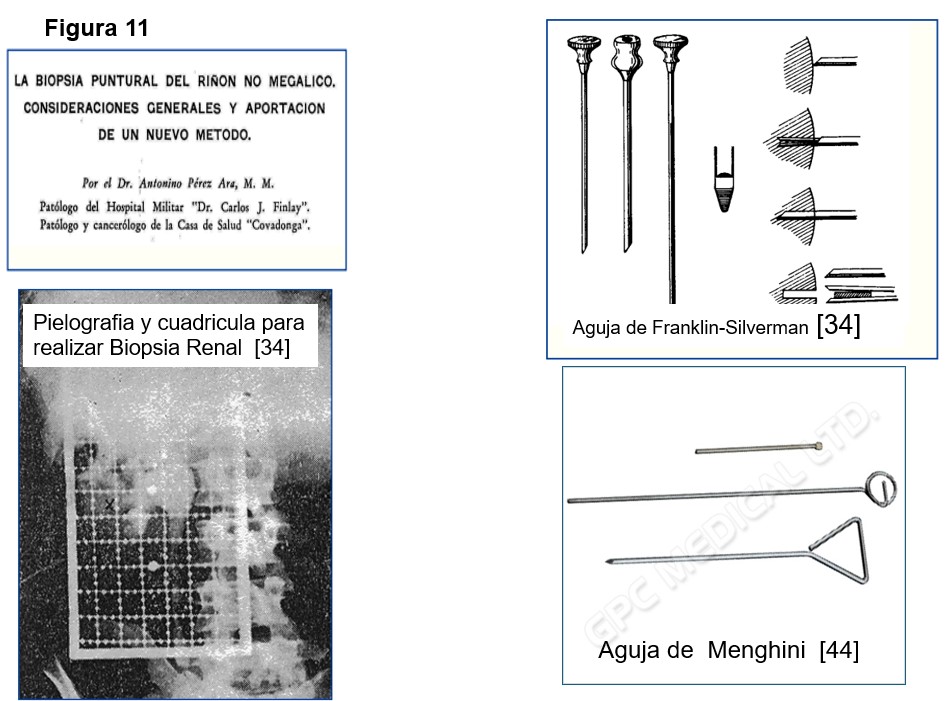
Realmente, la primera publicación referida a la biopsia renal percutánea (BPR) donde se describe su técnica y los resultados obtenidos en 8 casos en los que se había practicado, fue hecha por el patólogo cubano Dr. Antonino Pérez Ara en 1950 [42] (Figura 11).
Estas primeras BRP se hicieron en el período comprendido entre los últimos meses de 1948 y 1950 en el servicio oncológico de la Casa de Salud "Covadonga", hoy Hospital "Salvador Allende”. La técnica, que se describe extensamente en este trabajo, utiliza el urograma descendente para la localización de la víscera, con la ayuda de una cuadrícula o rejilla localizadora (Figura 11) [34]. La aguja que recomienda para la punción es la aguja de Herrera-Pardo modificada por él (denominada en el trabajo como nefrobiotomo). Esta aguja fue originalmente diseñada para la biopsia hepática y Pérez Ara la modificó, le adaptó una cánula que le permitía conservar la vía, para una futura biopsia en caso de intento fallido. No obstante, los primeros casos fueron hechos con la aguja de Vim Silverman. Se puncionaba indistintamente el riñón izquierdo o el derecho [43]. La aguja Vim-Silverman se abandonó para realizar biopsias renales, porque dada la forma de su bisel, se asocia a una tasa muy alta tasa de fracasos. La modificación de Franklin-Silverman (Figura 11), tiene puntas especiales que muerden el núcleo del tejido renal. Se han utilizado otras agujas como la aguja de Menghini (Figura 11) y la aguja de biopsia "abierta" de Hamburger.
En EE. UU., a los patólogos R.M. Kark y R,Muehrcke se une Conrad Levi Pirani (1914-2005) (Figura 12), que forjó la transición de los estudios del riñón basados en la autopsia, a la interpretación patológica moderna basada en la biopsia. El método semicuantitativo que desarrolló para evaluar las biopsias con aguja, no solo es esencial para establecer un diagnóstico preciso, sino que también proporciona información clínica valiosa sobre la actividad y la reversibilidad de la enfermedad que ha ayudado a guiar la terapia óptima. Su enfoque sistemático ha sido fundamental para describir por primera vez las características definitorias de muchas enfermedades renales importantes, como la nefritis lúpica, la nefropatía diabética, la glomerulonefritis postestreptocócica y la enfermedad renal relacionada con el mieloma [45].
A lo largo de los años siguientes, los estudios clínico-patológicos que se realizaron posibilitaron que la biopsia renal fuese adoptada como un proceso de uso clínico [46] y dio paso a otros pioneros (Figura 12) como Benjamin Spargo de la Universidad de Chicago (1919-2014), Jacob Churg (1910-2005 ) y Lotte Strauss (1913-1985) del Mount Sinai School of Medicine, Robert Jennings (1934-2023) de Northwestern University, Robert McCluskey (1923–2006 ) de New York University, Robert Heptinstall (1920-2021) de Johns Hopkins Hospital, Jay Bernstein (1927-2009) del Albert Einstein College of Medicine y Renée Habib (1924-2009) del Institut National de la Santé et de la Recherche Médicale de Paris.
El gran impulso para la comprensión de la enfermedad renal se logró con los estudios sobre las infecciones y la inmunidad. Las enfermedades infecciosas habían sido, con diferencia, la amenaza más importante para la salud y la sociedad durante siglos XIX y principios del XX. A partir del siglo XIX, los trabajos clínicos y experimentales comenzaron a revelar con éxito la base de las infecciones y la inmunidad. Alrededor de 1900, se reconoció que la respuesta inmunitaria causaba enfermedades por inflamación, anafilaxia, alergia y reacción autoinmune. Los primeros avances en inmunología tuvieron un impacto inmediato en el campo renal, así como en todas las demás áreas de la medicina. El Instituto Pasteur de París fue uno de los centros de investigación en este campo. Allí fue donde Theodor Fahr trabajó con Metchnikoff y donde se estudió la enfermedad renal en animales de laboratorio expuestos a sustancias anafilácticas [53] [54].
W. Lindemann también del Instituto Pasteur desarrolló en 1900 un modelo de glomerulonefritis autoinmune inyectando a conejos un antisuero heterólogo obtenido en cobayas contra el riñón de conejo [54]. Este modelo fue estudiado por M. Masugi en 1933 [55] y fue importante en la nueva era que comenzó en 1950. Esta es la frontera en la historia de la nefropatología.
En los años siguientes, la patología renal se constituye en una subespecialidad como consecuencia de los grandes avances logrados, entre los que cabría destacar :
1º.- Jacob Churg (1910-2005) y Edith Grishman (1914-2007) descubren las ventajas de las secciones finas (2-3 nm) para la evaluación de la celularidad glomerular y las lesiones focales [56].
2º.- Se adopta la tinción Tricrómica de Masson (Masson, Claude L. Pierre, Dijon 1880-1959) para cuantificar la fibrosis intersticial e identificar los depósitos. Fue desarrollada en 1929 como una tinción especial para diferenciar simultáneamente numerosas estructuras tisulares mediante tres coloraciones: hematoxilina férrica de Wiegert, para teñir los núcleos en violeta, marrón o negro; fucsina ácida-escarlata de Biebrich para colorear los citoplasmas, la fibrina, y fibras elásticas en rosa, y en rojo la queratina, fibras musculares y la hemoglobina de los eritrocitos; y azul de anilina o fast green que colorean de azul o verde, respectivamente, el mucus y las fibras colágenas [57].
3º.- David B Jones (1921-2007), de la Universidad de Estatal de New York en Búffalo, desarrollo la tinción de plata-metenamina para el estudio de la membrana basal glomerular [58].
4º.- Joseph Forde Anthony McManus (1911-1980), patólogo canadiense, describe una de las tinciones más utilizadas en histopatología: el ácido peryodico de Schiff (PAS) para teñir las membranas basales y el borde de cepillo de los túbulos proximales . McManus. fue un pionero en el campo de la histoquímica durante su período de expansión de crecimiento y aplicación en las décadas de 1940 y 1950. Era, además, un microscopista excepcionalmente observador. Acuñó el término de "Complejo Yuxtaglomerular" que se utilizó para mostrar la relación de la mácula densa tubular renal con las células granulares arteriolares. De sus observaciones se derivó que el “golgi” de las células tubulares distales estaba invertido a una posición debajo de los núcleos en la mácula densa y que la membrana basal entre la mácula densa y las células arteriolares estaba ausente. Sus publicaciones sobre la obsolescencia glomerular y al final de su carrera sobre el riñón de diálisis, se basaron en el mismo estudio meticuloso de la morfología renal [59].
5º.- Albert Coons (1912-1978) y Melvin H Kaplan (1929-2023) en 1950 desarrollan la microscopia de inmunofluorescencia como técnica para detectar depósitos inmunes unidos a tejidos [60].
6º.- En 1955, Robert C. Mellors (1916-2007) aplicó por vez primera la técnica de inmunofluorescencia al tejido renal [61].
7º.- Frank J. Dixon (1920-2008) y Frederick G.Germuth (1921-1984) desarrollan modelos experimentales de la “enfermedad del suero” y la lesión renal producida por complejos inmunes circulantes [62] [63] y todos estos avances abrieron el camino para identificar las glomerulonefritis por inmucomplejos [64] que ampliamente desarrollaron Robert Timmons McCluskey (1923-2006) (Figura 13) [65] y Gloria Ann Gallo (1928-2021) (Figura 13) de la Universidad de New York [66].
Estos avances en el estudio de la patología renal luchaban contra el escepticismo de muchos médicos, y a pesar de ello, durante la década de 1950, la Asociación Renal de Londres tenía reuniones mensuales donde se discutían los hallazgos recientes [1] y en base a las sesiones de la Asociación Renal de Londres, se celebró el Simposio de la Fundación CIBA sobre biopsia Renal que supuso un punto de inflexión sobre el desarrollo de la Biopsia renal. El Simposio fue presidido por Arnold Rich (1893-1968) (Figura 13) y asistieron 29 médicos y patólogos, con una experiencia acumulada de 5000 biopsias [68]. Entre ellos, destacaban A. Bergstrand (Suecia), R. Habib (Francia), R.H. Heptinstall (Gran Bretaña ), R.B. Jennings (EEUU), H.Z. Movat (Canada) y C.L. Pirani (EEUU) [69]. Este hito supuso un gran avance y se dispuso de libros de texto sobre la patología renal. El más destacado fue el de Robert H Heptinstall publicado en 1966 [70], que continuó durante 7 ediciones más. La primera edición relataba los hallazgos de microscopia óptica y electrónica y la segunda de 1974 incluyo observaciones de inmunofluorescencia, y el capítulo de Robert T. McCluskey dedicado a los mecanismos inmunológicos de la enfermedad renal [71].
El primer microscopio electrónico (ME) fue diseñado por Enerts Ruska y Max Knoll entre 1931 y 1936, los cuales se basaron en los estudios de Louis-Victor de Broglie acerca de las propiedades ondulatorias de los electrones. Las primeras observaciones de la patología renal mediante ME se publicaron en 1957. Los primeros estudios se centraron principalmente, en describir características anatómicas en animales de laboratorio, pero pronto hubo informes de enfermedades humanas utilizando tejido obtenido por biopsia. Las primeras observaciones, incluyeron el borramiento de los podocitos en la enfermedad de cambios mínimos, la demostración de depósitos en diferentes sitios en la glomerulonefritis y el lupus eritematoso sistémico, y el engrosamiento de la lámina densa en la diabetes [72]. Desde la década de 1970, el examen ultraestructural de las biopsias renales se ha utilizado de forma rutinaria para descubrir, definir y diagnosticar enfermedades glomerulares. Conrad Pirani en Chicago, Ramzi Cotran de Boston y Jacob Churg y Edith Grishman en Nueva York fueron pioneros en la aplicación de la microscopía electrónica al diagnóstico de la biopsia renal [3].
El primer trabajo publicado en Europa, sobre los mecanismos inmunológicos de la enfermedad renal y en idioma español, es de un grupo cubano del Departamento de Anatomía Patológica del Hospital Universitario “Calixto García” [73]. La técnica para la realización de la biopsia renal, era localización de la víscera mediante un retroneumoperitoneo, aguja de Vim Silvermann y en decúbito prono.
En España, el primer artículo publicado fue en 1958 en la Revista Clínica Española [74] y es la experiencia de 94 biopsias, realizadas sin incidencias y los autores eran Alfonso de la Peña Pineda (1904-1971) (Figura 14) y Vicente Gilsanz García (1911-1992) (Figura 14), Catedráticos de Urología y de Patología y Clínica Médicas de la Facultad de Medicina de Madrid, respectivamente. Ese mismo año y en la misma revista, Carlos Jiménez Diaz (1898-1867) (Figura 14) y Jose Carlos de Oya, (1898-1976) publican una amplia revisión sobre la patología glomerular [77].
En 1962, Gerardo del Río (1925-1999) en Barcelona describe su experiencia en la nefropatía lúpica. Las biopsias se realizaron mediante técnica de Kark y Muhercke, con aguja de Vim-Silverman [79].
En 1968, los Departamentos de Nefrología y Anatomía Patológica de la Fundación Jiménez Díaz de Madrid publicaron en la Revista Clínica Española una «revisión de conjunto» sobre la biopsia renal percutánea [80] y en 1973, el número de biopsias realizadas en el Hospital Clínico de Madrid ascendía a 1.650 [81].
Ese mismo año se publica el primer libro de nefropatología por J. Botella García (1933-2002) de la Clínica Puerta de Hierro en Madrid): Las Glomerulonefritis (Figura 15) dirigido “a aclarar, desde las vertientes anatomopatológicas y clínicas, el concepto actual de las nefropatías glomerulares“ [82].
En 1975, el equipo de la Fundación Jiménez Diaz (Madrid) encabezado por Horacio Oliva Aldamiz (1933-2017) publican [83] patología del glomérulo renal. Atlas de microscopia óptica, electrónica e inmunofluorescencia (Figura 15) [84].
En definitiva, la Patología renal alcanza su mayoría de edad en 1977 cuando Conrad Pirani funda el Club de Patología Renal. Los miembros destacados del club eran: Peter Burkholder, Jacob Churg, Ramzi Cotran, Francis Cuppage, Robert Heptinstall, David Jones, Michael Kashgarian, Richard Kempson, John Kissane, Robert McCluskey, Kash Mostofi, Benjamin Spargo, and Gary Striker, y en 1993, se transformó en la Renal Pathology Society (RPS). En 1990, la especialidad está bien asentada y la biopsia renal se convirtió en una herramienta diagnostica imprescindible. A pesar de todos los avances logrados, en 2007, la etiología de la mayoría de las enfermedades glomerulares era desconocida a excepción de la “nefritis anti-GMB”, que J Charles Jennete y Ronald Falk (Figura 16) [85] [86] habían logrado identificar el anticuerpo citoplasmático antineutrófilo como elemento patogénico de la mayoría de las glomerulonefritis necrotizantes y semilunares pauciinmunes [87].
Desde este momento, se abrieron nuevas ventanas de observación con la biología molecular. Basten como ejemplos la modificación etiológica de la glomerulonefritis mesangiocapilar (GNMP). En los años 70 se conocían tres tipos: GNMP tipo I, II y III en función de la distribución de los depósitos. En la actualidad la GNMP Tipo I y III es la Glomerulonefritis C3, regulada por anomalías hereditarias o adquiridas del complemento. Mientras que la GNMP tipo II es la conocida como enfermedad de Depósitos Densos [88]. Algo parecido pasó con la glomerulonefrítis membranosa primaria mediada por anticuerpos anti fosfolipasa A2 y algunos antígenos, como la albumina sérica catiónica bovina y endopeptidasa neutra [89], y con la aplicación de tinciones para los subtipos de IgG, se han identificado nuevas formas de glomerulonefritis proliferativa y nefritis intersticial autoinmune asociada a IgG4 [69], la descripción de la GN Focal y segmentaria [90] [91], la descripción del síndrome Hemolítico Urémico [92] y los avances en la nefropatología del trasplante renal [93] y la biología del podocito [94].
En la actualidad, los enfoques “ómicos” (Genómica,Transcriptómica, Proteómica, Metabolómica, Epigenómica y Lipidómica) funcionan como un “microscopio molecular“ y abrirán nuevas ventanas patogénicas y se podrán identificar nuevos biomarcadores que ayuden al diagnóstico, al pronóstico y posibiliten nuevas dianas terapéuticas.
Otra opción es la multiómica, que es el enfoque más completo utilizado para el estudio de lo patogenia de la enfermedad. Se combinan múltiples técnicas “ómicas”, y esta combinación da como resultado una imagen holística que representa las interrelaciones entre los hallazgos moleculares de cada método, explicando muchos rasgos fisiopatológicos involucrados en la patogénesis. Todas estas opciones diagnosticas, permitirán muevas vías terapéuticas, como la nanotecnología (NP) [95].
Estas tecnologías ya se han aplicado en algunos estudios experimentales de trastornos renales, como en la Glomerulonefritis IgA. En un modelo murino de nefropatía IgA, el tratamiento con un liposoma cargado con fosfato de prednisolona redujo los depósitos glomerulares de IgA y C3 en un grado mayor que una prednisolona sola [89]. Se ha demostrado que las NP de bajo peso molecular entregan con éxito ARN interferente pequeño (siRNA) o RNA de silenciamiento al endotelio, incluido el tejido renal, y silencian múltiples genes endoteliales [96][97].
Hasta aquí, hemos llegado desde Marcello Malpighi. Los eventos más destacables sobre la historia de la Biopsia Renal se muestran en la (Tabla 1) y el futuro puede estar marcado por las técnicas “ómicas” y la Inteligencia Artificial [98][99].
Figuras
Referencias bibliográficas
2
.
- Malpighi M (1666) De Viscerum Structura execitatio anatomica.Bologna
http://www.ncbi.nlm.nih.gov/pubmed/?term=Bologna
3
.
- Cameron JS, Hicks J. The introduction of renal biopsy into nephrology from 1901 to 1961: a paradigm of the forming of nephrology by technology. Am J Nephrol. 1997;17(3-4):347-58.
http://www.ncbi.nlm.nih.gov/pubmed/?term=1997%3B17%283-4%29%3A347-58
4
.
- biblioteca.ucm.es/historica/de-humanis-corporis-fabrica
http://www.ncbi.nlm.nih.gov/pubmed/?term=es%2Fhistorica%2Fde-humanis-corporis-fabrica
5
.
- https://es.wikipedia.org/w/index.php?title=Renacimiento&oldid=155979806
http://www.ncbi.nlm.nih.gov/pubmed/?term=php%3Ftitle%3DRenacimiento%26oldid%3D155979806
6
.
- https:// microscopiooptico.org/author/emilioduccogmail-com/
http://www.ncbi.nlm.nih.gov/pubmed/?term=org%2Fauthor%2Femilioduccogmail-com%2F
7
.
- Morgagni GB (1761) De Sedibus et causis morborum per anatomem indagatis. Venice
http://www.ncbi.nlm.nih.gov/pubmed/?term=Venice
8
.
- Virchow R. Cellular Pathology New York, NY: De Witt; 1860.
http://www.ncbi.nlm.nih.gov/pubmed/?term=Cellular+Pathology+New+York%2C+NY%3A+De+Witt%3B+1860
9
.
- Waitzkin,H.Un siglo y medio de olvidos y redescubrimientos: las perdurables contribuciones de Virchow a la medicina social Medicina Social Volumen 1, No. 1, Junio 2006 .www.medicinasocial.info
http://www.ncbi.nlm.nih.gov/pubmed/?term=info
10
.
- www.biografiasyvidas.com/biografia/v/virchow.htm
http://www.ncbi.nlm.nih.gov/pubmed/?term=htm
11
.
- Bowman, W. ¿On the Structure and Use of the Malpighian Bodies of the Kidney, with Observations on the Circulation through That Gland.¿ Philosophical Transactions of the Royal Society of London, vol. 132, 1842, pp. 57¿80. JSTOR .www.jstor.org/stable/108143.
http://www.ncbi.nlm.nih.gov/pubmed/?term=org%2Fstable%2F108143
12
.
- Ortiz-Hidalgo, Carlos. (2020). Carl von Rokitansky, el Linneo de la anatomía patológica. Gaceta médica de México,156(6), 595-603.
http://www.ncbi.nlm.nih.gov/pubmed/?term=Gaceta+m%C3%A9dica+de+M%C3%A9xico%2C156%286%29%2C+595-603
13
.
- Cameron JS. Five hundred years of the nephrotic syndrome: 1484-1984. Ulster Med J. 1985 Aug;54 Suppl(Suppl):S5-19. .
http://www.ncbi.nlm.nih.gov/pubmed/?term=
14
.
- Seidler E. El desarrollo de la Pediatría moderna en: LAIN EP. Director. Historia Universal de la Medicina, Positivismo, Tomo VI. 1ª ed . Barcelona: Salvat ; 1974: 203-215.
http://www.ncbi.nlm.nih.gov/pubmed/?term=Barcelona%3A+Salvat+%3B+1974%3A+203-215
15
.
- Borrelli,A. Istituzioni scientifiche Medicina e società. Biografia di Domenico Cotugno (1736-1822), Leo S. Olschki, Firenze 2000
http://www.ncbi.nlm.nih.gov/pubmed/?term=Olschki%2C+Firenze+2000
16
.
- Bechtel, WIlliam and Robert C. Richardson (1998). Vitalism. In E. Craig (Ed.), Routledge Encyclopedia of Philosophy. London: Routledge.
http://www.ncbi.nlm.nih.gov/pubmed/?term=London%3A+Routledge
17
.
- www.biografiasyvidas.com/biografia/w/wohler.htm
http://www.ncbi.nlm.nih.gov/pubmed/?term=htm
18
.
- Boss J. Richard Bright''''s Reports of Medical Cases (1827): a sesquicentennial note. Bristol Med Chir J. 1978 Jan-Apr;93(345-346):5-6, 18.
http://www.ncbi.nlm.nih.gov/pubmed/?term=1978+Jan-Apr%3B93%28345-346%29%3A5-6%2C+18
19
.
- Godoy-Guzman, C. Contribuciones de Wilhelm His a la embriología humana. Int. J. Morphol., 31(1):70-74, 2013.
http://www.ncbi.nlm.nih.gov/pubmed/?term=%2C+31%281%29%3A70-74%2C+2013
20
.
- Gabriel Gustav Valentin (1810-1883). Bern physiologist. JAMA. 1970 Sep 7;213(10):1677-8.
http://www.ncbi.nlm.nih.gov/pubmed/?term=1970+Sep+7%3B213%2810%29%3A1677-8
21
.
- https://es.wikipedia.org/w/index.php?title=William_Perkin&oldid=158144630
http://www.ncbi.nlm.nih.gov/pubmed/?term=php%3Ftitle%3DWilliam_Perkin%26oldid%3D158144630
22
.
- onlineexhibits.library.yale.edu/s/arnold-carl-klebs/item/5324#?c=&m=&s=&cv=&xywh=-482%2C0%2C1381%2C599
http://www.ncbi.nlm.nih.gov/pubmed/?term=edu%2Fs%2Farnold-carl-klebs%2Fitem%2F5324%23%3Fc%3D%26m%3D%26s%3D%26cv%3D%26xywh%3D-482%252C0%252C1381%252C599
23
.
- https://es.wikipedia.org/w/index.php?title=Rudolf_Virchow&oldid=162456313
http://www.ncbi.nlm.nih.gov/pubmed/?term=php%3Ftitle%3DRudolf_Virchow%26oldid%3D162456313
24
.
- VM, Mohan AG, Covache-Busuioc RA, Costin HP, Ciurea AV. Wilhelm von Waldeyer: Important Steps in Neural Theory, Anatomy and Citology. Brain Sci. 2022 Feb 6;12(2):224.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2022+Feb+6%3B12%282%29%3A224
25
.
- https://es.wikipedia.org/w/index.php?title=Heinrich_Caro&oldid=156416269
http://www.ncbi.nlm.nih.gov/pubmed/?term=php%3Ftitle%3DHeinrich_Caro%26oldid%3D156416269
26
.
- https://es.wikipedia.org/w/index.php?title=Hermann_Emil_Fischer&oldid=144540606
http://www.ncbi.nlm.nih.gov/pubmed/?term=php%3Ftitle%3DHermann_Emil_Fischer%26oldid%3D144540606
27
.
- https://en.wikipedia.org/w/index.php?title=Julius_Dreschfeld&oldid=1179430208
http://www.ncbi.nlm.nih.gov/pubmed/?term=php%3Ftitle%3DJulius_Dreschfeld%26oldid%3D1179430208
28
.
- https://es.wikipedia.org/w/index.php?title=Friedrich_Gustav_Jakob_Henle&oldid=141486429
http://www.ncbi.nlm.nih.gov/pubmed/?term=php%3Ftitle%3DFriedrich_Gustav_Jakob_Henle%26oldid%3D141486429
29
.
- www.researchgate.net/figure/Theodor-Fahr-1877-1945-as-Director-of-the-Institute-of-Pathology-at-the-University-of_fig2_12107421
http://www.ncbi.nlm.nih.gov/pubmed/?term=net%2Ffigure%2FTheodor-Fahr-1877-1945-as-Director-of-the-Institute-of-Pathology-at-the-University-of_fig2_12107421
30
.
- www.researchgate.net/figure/Franz-Volhard-1872-1950-as-Director-of-the-Clinic-of-Internal-Medicine-at-the_fig1_12107421
http://www.ncbi.nlm.nih.gov/pubmed/?term=net%2Ffigure%2FFranz-Volhard-1872-1950-as-Director-of-the-Clinic-of-Internal-Medicine-at-the_fig1_12107421
31
.
- Volhard, F; T. Fahr, Die Brightsche Nierenkrankkheit, Klinik, Pathologie und Atlas. . 1914, Berlin: Springer.
http://www.ncbi.nlm.nih.gov/pubmed/?term=1914%2C+Berlin%3A+Springer
32
.
- Ellis A. Natural history of Bright¿s disease. Clinical, histological and experimental observations. Lancet.1942;1:1¿7.
http://www.ncbi.nlm.nih.gov/pubmed/?term=1942%3B1%3A1%E2%80%937
33
.
- Edelbohls GM. The surgical treatment of Bright¿s disease. New York, Lisiecki, 1904.
http://www.ncbi.nlm.nih.gov/pubmed/?term=New+York%2C+Lisiecki%2C+1904
34
.
- García Nieto V, Luis Yanes MI, Ruiz Pons M. Celebrating fifty years of percutaneous renal biopsies in Spain]. Nefrologia. 2009;29(1):71-6.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2009%3B29%281%29%3A71-6
35
.
- Ball R.P: Needle (aspiration) biopsy. J. Tenn. Med. Ass., 27: 203, 1934 .
http://www.ncbi.nlm.nih.gov/pubmed/?term=%2C+27%3A+203%2C+1934
36
.
- Iversen,P. Roholm.K. On aspiration biopsy of the liver, with remarks on its diagnostic significance.Acta Medica Scandinavica. Vol. CII, fasc. 1-11, 1939
http://www.ncbi.nlm.nih.gov/pubmed/?term=1-11%2C+1939
37
.
- Iversen P, Brun C. Aspiration biopsy of the kidney. Am J Med.1951;11:324-30
http://www.ncbi.nlm.nih.gov/pubmed/?term=1951%3B11%3A324-30
38
.
- Alwall N. Aspiration biopsy of the kidney, including report of a case of amyloidosis diagnosed in 1944 and investigated at autopsy. Acta Med Scand. 1952;143:430-5.
http://www.ncbi.nlm.nih.gov/pubmed/?term=1952%3B143%3A430-5
39
.
- Parrish AE, Howe JS. Needle biopsy as an aid in diagnosis of renal disease. J Lab Clin Med. 1953;42(1):152-157
http://www.ncbi.nlm.nih.gov/pubmed/?term=1953%3B42%281%29%3A152-157
40
.
- litfl.com/robert-c-muehrcke/
http://www.ncbi.nlm.nih.gov/pubmed/?term=com%2Frobert-c-muehrcke%2F
41
.
- Kark RM, Muehrcke RC. Biopsy of the kidney in prone position. Lancet. 1954;266(6821):1047-1049.
http://www.ncbi.nlm.nih.gov/pubmed/?term=1954%3B266%286821%29%3A1047-1049
42
.
- Pérez Ara A. La biopsia puntural del riñón no megálico. Consideraciones generales y aportación de un nuevo método. Bol Liga contra Cáncer. 1950;25:121-47
http://www.ncbi.nlm.nih.gov/pubmed/?term=1950%3B25%3A121-47
43
.
Raymed Antonio Bacallao Méndez, C. Hilario Gómez Barry, Aymara Badell Moore, . Betsy Llerena Ferrer LX años de biopsia renal percutánea: Cuba pionera en el mundo Revista Cubana de Medicina. 2011; 50(4):465-469
http://www.ncbi.nlm.nih.gov/pubmed/?term=2011%3B+50%284%29%3A465-469
44
.
- Albornoz Plata, Alberto, Albán Muñoz, Vicente. Biopsia hepática por aspiración con la aguja de menghini. Universidad Nacional de Colombia Revistas electrónicas UN Revista de la Facultad de Medicina. Facultad de Medicina. Universidad Nacional de Colombia. Sede Bogotá. 1959
http://www.ncbi.nlm.nih.gov/pubmed/?term=1959
45
.
- Vivette D. D''''Agati. Dr. Conrad L. Pirani, In Memoriam, Ultrastructural Pathology. 2006; 30 (5): 325-328.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2006%3B+30+%285%29%3A+325-328
46
.
- Muehrcke RC, Kark RM, Pirani CL.Biopsy of the kidney in the diagnosis and magement of renal disease. N Engl J Med. 1955;253(13):537-546
http://www.ncbi.nlm.nih.gov/pubmed/?term=1955%3B253%2813%29%3A537-546
47
.
- Benjamin Spargo, innovative kidney pathologist, 1919-2014 | University of Chicago News www.uchicagomedicine.org/forefront/news/benjamin-spargo-md-innovative-kidney-pathologist-1919-2014
http://www.ncbi.nlm.nih.gov/pubmed/?term=org%2Fforefront%2Fnews%2Fbenjamin-spargo-md-innovative-kidney-pathologist-1919-2014
48
.
- medicalarchives.jhmi.edu/portrait/heptinstall-robert-hodgson/
http://www.ncbi.nlm.nih.gov/pubmed/?term=edu%2Fportrait%2Fheptinstall-robert-hodgson%2F
49
.
- Campos FPF, Geller SA. Churg-Strauss Syndrome: a syndrome described on clinical observation and autopsy findings. [editorial]. Autopsy Case Rep . 2013;3(2):1-4. http://dx.doi.org/10.4322/acr.2013.011
http://www.ncbi.nlm.nih.gov/pubmed/?term=011
50
.
- Jay Bernstein, MD - American Society of Pediatric Nephrology (ASPN)
http://www.ncbi.nlm.nih.gov/pubmed/?term=-+Jay+Bernstein%2C+MD+-+American+Society+of+Pediatric+Nephrology+%28ASPN%29
51
.
- www.legacy.com/us/obituaries/sandiegouniontribune/name/robert-jennings-obituary?id=53481588
http://www.ncbi.nlm.nih.gov/pubmed/?term=com%2Fus%2Fobituaries%2Fsandiegouniontribune%2Fname%2Frobert-jennings-obituary%3Fid%3D53481588
52
.
- Renee Habib, MD (2009) - American Society of Pediatric Nephrology (ASPN)aspneph.org/renee-habib-md-2009/
http://www.ncbi.nlm.nih.gov/pubmed/?term=org%2Frenee-habib-md-2009%2F
53
.
- Richet C (1902) Des effets anaphylactiques de l¿actinotoxine sur la pression arteriolle. Compt Rendu Soc Biol 54:837
http://www.ncbi.nlm.nih.gov/pubmed/?term=Compt+Rendu+Soc+Biol+54%3A837
54
.
- Lindemann W (1900) Sur le mode d¿action de certain poisons renaux. Ann Inst Pasteur 14:49¿59]
http://www.ncbi.nlm.nih.gov/pubmed/?term=Ann+Inst+Pasteur+14%3A49%E2%80%9359%5D
55
.
- Masugi M, Tomizuka Y (1931) Ueber die spezifischen zytotoxischen veraenderungen der niere und der leber durch das spezifische antiserum zugleich ein beitrag zur pathogenese die glomerulonephritis. Trans Jpn Pathol Soc 21:329¿341
http://www.ncbi.nlm.nih.gov/pubmed/?term=Trans+Jpn+Pathol+Soc+21%3A329%E2%80%93341
56
.
Churg J, Grishman E. Applications of thin sections to the problems of renal pathology. J Mt Sinai Hosp. 1957;24(6):736-744
http://www.ncbi.nlm.nih.gov/pubmed/?term=1957%3B24%286%29%3A736-744
57
.
- Caputo LFG, Gitirana LB, Manso PPA. 2012. Técnicas histológicas. En: Conceitos e métodos para a formação de profissionais em laboratórios de saúde, v. 2. Rio de Janeiro: FIOCRUZ (Ed). cap. 3, 157 ¿ 159.
http://www.ncbi.nlm.nih.gov/pubmed/?term=3%2C+157+%E2%80%93+159
58
.
- Jones DB. Glomerulonephritis. Am JPathol. 1953;29(1):33-51
http://www.ncbi.nlm.nih.gov/pubmed/?term=1953%3B29%281%29%3A33-51
59
.
- https://en.wikipedia.org/w/index.php?title=J._F._A._McManus&oldid=1223052178
http://www.ncbi.nlm.nih.gov/pubmed/?term=_McManus%26oldid%3D1223052178
60
.
Coons AH, Kaplan MH. Localization of antigen in tissue cells. II. Improvementin a method for the detection ofantigen by means of fluorescent antibody.J Exp Med. 1950;91(1):1-13
http://www.ncbi.nlm.nih.gov/pubmed/?term=1950%3B91%281%29%3A1-13
61
.
- Mellors RC .Histochemical demonstration of the in vivolocalization of antibodies: antigenic components and the pathogenesisof glomerulonephritis. J Histochem Cytochem 1955. 3:284¿289.
http://www.ncbi.nlm.nih.gov/pubmed/?term=3%3A284%E2%80%93289
62
.
- Dixon FJ, Feldman JD, Vazquez JJ. glomerulonephritis: the pathogenesis of a laboratory model resembling the spectrum of human glomerulonephritis.J Exp Med. 1961;113(1):899-920.
http://www.ncbi.nlm.nih.gov/pubmed/?term=1961%3B113%281%29%3A899-920
63
.
- Germuth FG Jr, Senterfit LB, PollackAD. Immune-complex disease I: experimentalacute and chronic glomerulonephritis.Johns Hopkins Med J. 1967;120(4):225-251.
http://www.ncbi.nlm.nih.gov/pubmed/?term=1967%3B120%284%29%3A225-251
64
.
- McCluskey RT, Vassalli P, Gallo G, Baldwin DA.An immunofluorescent study of pathogenetic mechanisms in glomerular diseases. N Engl J Med. 1966;274(13):695-701
http://www.ncbi.nlm.nih.gov/pubmed/?term=1966%3B274%2813%29%3A695-701
65
.
- www.massgeneral.org/assets/mgh/pdf/pathology/pathology_chap14.pdf
http://www.ncbi.nlm.nih.gov/pubmed/?term=pdf
66
.
- gcfuneralhome.com/tribute/details/3671/Gloria-Gallo/condolences.html
http://www.ncbi.nlm.nih.gov/pubmed/?term=html
67
.
- pathology.jhu.edu/about/history/pathology/arnold-rice-rich
http://www.ncbi.nlm.nih.gov/pubmed/?term=edu%2Fabout%2Fhistory%2Fpathology%2Farnold-rice-rich
68
.
- D''''Agati VD, Mengel M. The rise of renal pathology in nephrology: structure illuminates function. Am J Kidney Dis. 2013 Jun;61(6):1016-25.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2013+Jun%3B61%286%29%3A1016-25
69
.
- Wolstenhome GE,Cameron MP (eds): Ciba Symposium on Renal Biopsy. Boston, MA, Little Brown, 1961, p 371
http://www.ncbi.nlm.nih.gov/pubmed/?term=Boston%2C+MA%2C+Little+Brown%2C+1961%2C+p+371
70
.
- Heptinstall RH Pathology of the kidney (1966) Little, Brown and Company, Boston
http://www.ncbi.nlm.nih.gov/pubmed/?term=-+Heptinstall+RH+Pathology+of+the+kidney+%281966%29+Little%2C+Brown+and+Company%2C+Boston
71
.
- Jennette JC. Historical milestones in renal pathology. Virchows Arch. 2012 Jul;461(1):3-11.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2012+Jul%3B461%281%29%3A3-11
72
.
- Farquhar MG, Vernier RL, Good RA (1957) An electron microscope study of the glomerulus in nephrosis, glomerulonephritis and lupus erythematosus. J Exp Med 106:649¿660
http://www.ncbi.nlm.nih.gov/pubmed/?term=J+Exp+Med+106%3A649%E2%80%93660
73
.
- Pardo V, Cárdenas CF, Masó C. Biopsia renal por punción. Comunicación de 55 casos. Rev Clin Esp. 1953;49:379-82
http://www.ncbi.nlm.nih.gov/pubmed/?term=1953%3B49%3A379-82
74
.
- De la Peña A, Gilsanz V, Hidalgo A, Rey Ramos A, Useros P, Alonso Barrera JM, et al. Biopsia renal transcutánea. Rev Clin Esp 1958;69:65-70.
http://www.ncbi.nlm.nih.gov/pubmed/?term=Rev+Clin+Esp+1958%3B69%3A65-70
75
.
- Biomedes.es/?s=Alfonso+de+la+Peña&post_types=biografia
http://www.ncbi.nlm.nih.gov/pubmed/?term=es%2F%3Fs%3DAlfonso%2Bde%2Bla%2BPe%C3%B1a%26post_types%3Dbiografia
76
.
- Biomedes.es/biografia/gilsanz-garcia-vicente/
http://www.ncbi.nlm.nih.gov/pubmed/?term=es%2Fbiografia%2Fgilsanz-garcia-vicente%2F
77
.
- Jimenz Diaz,C. de Oya JC.Etiopatogenia de las nefritis.Rev, Clin,Esp.LXX,6,1958
http://www.ncbi.nlm.nih.gov/pubmed/?term=LXX%2C6%2C1958
78
.
- Biomedes.es/?s=jimenez+diaz&post_types=biografia
http://www.ncbi.nlm.nih.gov/pubmed/?term=es%2F%3Fs%3Djimenez%2Bdiaz%26post_types%3Dbiografia
79
.
- Del Río G. Nefropatía del lupus eritematoso diseminado. Med Clin 1962;39:353-1.
http://www.ncbi.nlm.nih.gov/pubmed/?term=Med+Clin+1962%3B39%3A353-1
80
.
- Sánchez Sicilia L, Rodicio Díaz JL, Casado Pérez S, Navarro Berástegui V, Oliva Aldamiz H. La biopsia renal percutánea. Rev Clin Esp 1968;108:259-64.
http://www.ncbi.nlm.nih.gov/pubmed/?term=Rev+Clin+Esp+1968%3B108%3A259-64
81
.
- Estrada Saiz RV. Biopsia renal. Med Clin 1973;60:389-97.
http://www.ncbi.nlm.nih.gov/pubmed/?term=Med+Clin+1973%3B60%3A389-97
82
.
- Las glomerulonefritis .Ed. Cientifico Medica .Barcelona 1976
http://www.ncbi.nlm.nih.gov/pubmed/?term=Barcelona+1976
83
.
- Patología del glomérulo renal: atlas de microscopia óptica, electrónica e inmunofluorescencia,Salvat 1975
http://www.ncbi.nlm.nih.gov/pubmed/?term=-+Patolog%C3%ADa+del+glom%C3%A9rulo+renal%3A+atlas+de+microscopia+%C3%B3ptica%2C+electr%C3%B3nica+e+inmunofluorescencia%2CSalvat+1975
84
.
- arhipa.org/HOA.html
http://www.ncbi.nlm.nih.gov/pubmed/?term=html
85
.
- www.med.unc.edu/medicine/nephrology-hypertension/people/ronald-falk/
http://www.ncbi.nlm.nih.gov/pubmed/?term=edu%2Fmedicine%2Fnephrology-hypertension%2Fpeople%2Fronald-falk%2F
86
.
- www.med.unc.edu/oor/experts/wp-content/uploads/sites/1368/2024/02/J.-Charles-Jennette-244x300.jpg
http://www.ncbi.nlm.nih.gov/pubmed/?term=jpg
87
.
- Falk RJ, Jennette JC. Anti-neutrophil cytoplasmic autoantibody with specificity for myeloperoxidase in patients with systemic vasculitis and idiopathic necrotizing and crescentic glomerulonephritis. N Engl J Med. 1988;318(25):1651-1657
http://www.ncbi.nlm.nih.gov/pubmed/?term=1988%3B318%2825%29%3A1651-1657
88
.
- Bomback A, Appel GB. Pathogenesis of the C3 glomerulopathies and reclassification of MPGN. Nat Rev Nephrol 2012;8:634-42
http://www.ncbi.nlm.nih.gov/pubmed/?term=Nat+Rev+Nephrol+2012%3B8%3A634-42
89
.
- Beck LH, Bonegio RGB, Lambeau G et al (2009) M-type phospholipase A2 receptor as target antigen in idiopathic membranousnephropathy. N Engl J Med 361:11¿21
http://www.ncbi.nlm.nih.gov/pubmed/?term=N+Engl+J+Med+361%3A11%E2%80%9321
91
.
D¿ Agati VD, Kaskel FJ, Falk RJ (2011) Focal segmental glomerulosclerosis.N Engl J Med 365:2398¿2411
http://www.ncbi.nlm.nih.gov/pubmed/?term=N+Engl+J+Med+365%3A2398%E2%80%932411
92
.
- Noris M, Remuzzi G (2009) Atypical haemolytic-uremic syndrome. N Engl J Med 361:1676¿1687 ]
http://www.ncbi.nlm.nih.gov/pubmed/?term=N+Engl+J+Med+361%3A1676%E2%80%931687++%5D
93
.
- Solez K (2010) History of the Banff classification of allograft pathology as it approaches its 20th year. Curr Opin Organ Transplant 15:49¿51
http://www.ncbi.nlm.nih.gov/pubmed/?term=Curr+Opin+Organ+Transplant+15%3A49%E2%80%9351
94
.
- Pavenstaedt H, Kriz W, Kretzler M (2003) Cell biology of the podocyte. Physiol Rev 83:253¿307
http://www.ncbi.nlm.nih.gov/pubmed/?term=Physiol+Rev+83%3A253%E2%80%93307
95
.
- Mucha K, Pac M, P¿czek L. Omics are Getting Us Closer to Understanding IgA Nephropathy. Arch Immunol Ther Exp (Warsz). 2023 Apr 15;71(1):12.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2023+Apr+15%3B71%281%29%3A12
96
.
- 89.-Liao J, Hayashi K, Horikoshi S, et al. Effect of steroid-liposome on immunohistopathology of IgA nephropathy in ddY mice. Nephron. 2001;89:194¿200.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2001%3B89%3A194%E2%80%93200
97
.
- Dahlman JE, Barnes C, Khan O, et al. In vivo endothelial siRNA delivery using polymeric nanoparticles with low molecular weight. Nat Nanotechnol. 2014;9:648¿655
http://www.ncbi.nlm.nih.gov/pubmed/?term=2014%3B9%3A648%E2%80%93655
98
.
- Hou J, Nast CC. Artificial Intelligence: The Next Frontier in Kidney Biopsy Evaluation. Clin J Am Soc Nephrol. 2020 Oct 7;15(10):1389-1391.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2020+Oct+7%3B15%2810%29%3A1389-1391
99
.
- Ligabue G, Pollastri F, Fontana F, Leonelli M, Furci L, Giovanella S, Alfano G, Cappelli G, Testa F, Bolelli F, Grana C, Magistroni R. Evaluation of the Classification Accuracy of the Kidney Biopsy Direct Immunofluorescence through Convolutional Neural Networks. Clin J Am Soc Nephrol. 2020 Oct 7;15(10):1445-1454.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2020+Oct+7%3B15%2810%29%3A1445-1454