Biopsia Renal
Introducción
La biopsia renal es uno de los procedimientos que más ha contribuido al conocimiento de las enfermedades renales [1] [2] [3]. Se utiliza desde hace casi 60 años y algunos aspectos acerca de sus indicaciones, técnicas de obtención de tejido renal, procesamiento de la muestra, complicaciones y balance riesgo-beneficio no han perdido vigencia. De hecho, el estudio de la biopsia renal es un tema de gran actualidad, nada alejado de la rutina, y es un reto para clínicos y patólogos dada la complejidad de los mecanismos de las enfermedades renales y la necesaria integración de los datos morfológicos con los aspectos clínicos para su aplicación en la práctica clínica [4]. Como muestra de ello y según la búsqueda en PubMed, utilizando [Mesh] como motor de búsqueda "renal biopsy and/or kidney biopsy", se publican mas de 200 artículos al año, entre los que destaca una reciente publicación que revisa y actualiza los aspectos mas básicos y controvertidos [5]. Otro ejemplo de la importancia que tiene la biopsia renal en el estudio de las enfermedades renales es que la Comisión Nacional de la Sociedad Española de Nefrología (SEN) ha establecido que las Unidades de Nefrología han de hacer al menos 20 biopsias al año (con estudio completo: microscopio óptico, inmunofluorescencia y microscopio electrónico) para ser acreditadas en la docencia postgrado MIR [6].
Aunque la biopsia renal es un procedimiento seguro, no está exento de ciertos riesgos [7]. Por tanto, es indispensable que se cumplan las siguientes condiciones para su indicación de forma adecuada: i) agotar todos los procedimientos no invasivos para el diagnóstico de enfermedades renales cuyos signos y síntomas son compatibles con enfermedades parenquimatosas, ii) considerar que la información suministrada por la biopsia va a proporcionar un diagnóstico lo mas certero posible, iii) asegurar que se puede hacer un estudio por un patólogo experto, con todas las técnicas indicadas anteriormente: óptico, inmunofluorescencia y electrónico [8], así como otras técnicas basadas en técnicas de biología molecular [9] y iv) prever que este diagnóstico influirá en el tratamiento y el pronóstico de los pacientes [10]. En ningún caso se debe aceptar que la biopsia sirva para completar un diagnóstico sin transcendencia clínica o como objetivos meramente docentes. Hacer una biopsia renal supone un compromiso ético y profesional donde el médico y el paciente deben estar de acuerdo [11] [12].
Para un mejor aprovechamiento de la biopsia renal se requiere una buena relación personal y profesional entre clínicos y patólogos [1]. Ambos se necesitan y las correlaciones clínicopatológicas son imprescindibles para cumplir los objetivos de la biopsia renal [13]. Así, el clínico debe tener unas indicaciones claras con datos clínicos bien recogidos y el patólogo debe disponer de experiencia y posibilidades de hacer estudio completo de la muestra [5] [14]. A la inversa, el clínico debe tener conocimientos de Anatomía Patológica renal y el patólogo debe conocer los síndromes renales clínicos y sus correlaciones con los hallazgos histológicos [15]. Es necesario, por tanto, que el Servicio de Anatomía Patológica tenga un especialista dedicado a enfermedades renales, con actualización permanente, con medios físicos y personales para evitar que algunas biopsias no sean correctamente estudiadas [16]. La discusión entre ambos a pie de microscopio y en sesiones periódicas entre sus servicios son imprescindibles.
Las siguientes referencias bibliográficas son una excelente prueba de la relevancia de una interacción generosa entre patólogos y nefrólogos [17] [18] [19] [20] [21] [22] [23] [24].
En resumen, la biopsia renal debe servir para llegar a un diagnóstico de certeza, orientar el tratamiento e informar al clínico acerca de la posible evolución de la enfermedad renal biopsiada [25].
A continuación se resumen y actualizan los aspectos más importantes sobre la biopsia de riñones nativos. La biopsia de injertos renales tiene algunos puntos técnicos en común [26] [27] y es también es un tema de gran actualidad [28], pero no es objeto de esta revisión.
Indicaciones
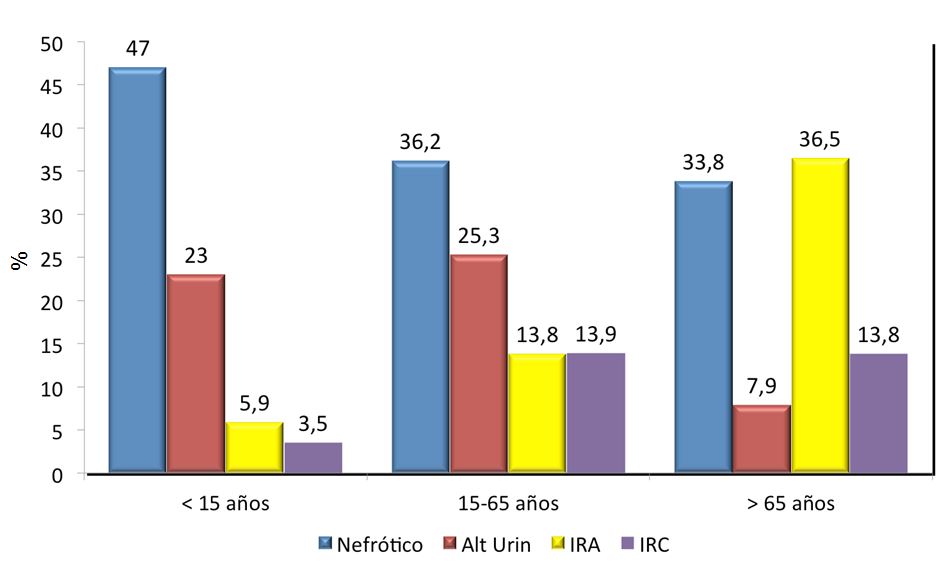
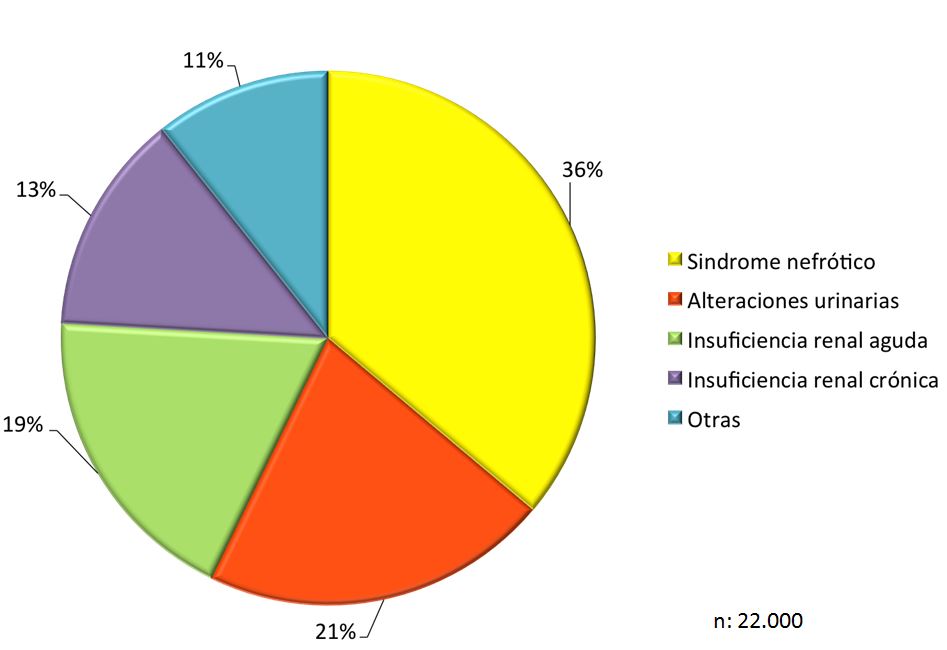
Las indicaciones de la biopsia renal cambian dependiendo de los médicos, de los centros e incluso de las épocas. De hecho, no hay suficientes Guías Clínicas acerca de sus indicaciones, lo que explica cierta disparidad entre los centros encargados del estudio de las enfermedades renales [9]. No todos los países tienen los mismos criterios y en muchas ocasiones las posibilidades de estudio o la interpretación de los resultados influyen sobre cuándo y a quién se debe realizar biopsia renal. En cualquier caso, la indicación se basa en el síndrome o síndromes clínicos predominantes y debe ser discutida en cada Unidad de Nefrología de forma individualizada [29]. Como se ha comentado anteriormente, en nuestro país contamos con el Registro de Glomerulonefritis de la Sociedad Española de Nefrología que ha recogido más de 22.000 biopsias renales de riñones nativos desde 1994, con una media aproximada de 1.300 biopsias anuales [30]. Las (Figura 1) y (Figura 2) representan, por orden de frecuencia, los síndromes clínicos (global y por grupos de edad) que han indicado la biopsia renal en nuestro país (Tabla 1). En otros países estas frecuencias no son las mismas, pero las discusiones respecto a las indicaciones son prácticamente universales [5] [31] [32]. Dado el creciente numero de pacientes ancianos, también se ha demostrado su utilidad en este grupo de edad [33] [34] [35].
Síndrome nefrótico
Es la primera indicación en nuestro país y la menos discutida en la mayoría de los registros de indicaciones de biopsia renal. No obstante, existen algunas excepciones, en las que, de entrada, no está indicada la biopsia renal: i) primer brote de síndrome nefrótico idiopático infantil, dado que más del 90% tienen nefropatía por cambios mínimos y son corticosensibles, ii) nefropatía diabética de evolución típica y iii) en presencia de amiloidosis diagnosticada por otros procedimientos menos agresivos como aspirado de grasa subcutánea o biopsia rectal. Los casos de síndrome nefrótico corticorresistente o corticodependientes, así como los diabéticos con enfermedad renal atípica pueden tener, en opinión de algunos autores, indicación de biopsia renal, puesto que se pueden encontrar lesiones diferentes a la nefropatía diabética clásica [3] [10] [36] [37] [38].
Proteinuria aislada
Los pacientes con nefropatía caracterizada por proteinuria inferior a 1 g/24h, sedimento normal, sin hipertensión ni deterioro renal tienen buen pronóstico. La biopsia renal no modifica el tratamiento y por tanto no está indicada. No obstante, cuando esta proteinuria es superior 1 g/24h algunos autores recomiendan hacer biopsia pues el pronóstico no es tan bueno y hay varias entidades que tienen enfoques terapéuticos diferentes como glomeruloesclerosis focal, nefropatía IgA y nefropatía membranosa [39]. En cualquier caso hay que descartar otras enfermedades que cursan con proteinuria aislada donde no se necesita biopsia renal para el diagnóstico ni el tratamiento: reflujo vesicoureteral, pérdida de masa renal, obesidad importante, diabetes mellitus o hipertensión de larga evolución. Por otro lado, en ciertos formas de mieloma, con evolución atípica y distinta al típico riñón de mieloma, la biopsia puede aportar información útil para su tratamiento [40] [41].
Microhematuria aislada
La hematuria de origen glomerular que no se acompaña de proteinuria, hipertensión ni disminución de filtrado glomerular tiene también un pronóstico excelente. Cuando se ha hecho biopsia se han encontrado los siguientes hallazgos: glomérulos normales, nefropatía IgA, membrana basal fina o enfermedad de Alport. Ninguna de ellas, en este contexto clínico, tiene tratamiento y dado el pronóstico no está justificado hacer biopsia renal de forma rutinaria. No obstante hay algunas excepciones: i) necesidad de consejo genético, ii) estudio de donante vivo y iii) necesidad de un diagnóstico de certeza [42] [43]. En todas estas situaciones es imprescindible un estudio mediante microscopio electrónico. Lógicamente, antes de hacer la biopsia es necesario descartar hematuria de origen urológico así como hipercalciuria, hiperuricosuria o ambas [10].
Proteinuria y hematuria asintomáticas
La asociación entre proteinuria y hematuria orientan hacia una nefropatía glomerular. Las restricciones para indicar biopsia renal son las mismas que cuando van aisladas.
Insuficiencia renal aguda
La mayoría de los fracasos renales agudos se deben a causas que no requieren biopsia para su diagnóstico o tratamiento: depleción hidrosalina, necrosis tubular u obstrucción de vías. No obstante alrededor de un 8% no tienen una causa clara y si presentan características atípicas como hematuria, cilindruria patológica o proteinuria son indicación de biopsia renal urgente para descartar glomerulonefritis con proliferación extracapilar, vasculitis renal o nefritis tubulointersticial aguda [44]. Estas enfermedades requieren tratamientos agresivos que deben justificarse según datos histológicos.
Síndrome nefrítico agudo
El síndrome nefrítico agudo en la edad infantil se debe en casi todos los casos a glomerulonefritis post-infecciosa de evolución favorable con tratamiento sintomático. Por tanto, no está indicada la biopsia renal. En los casos de presentación atípica o cuando aparecen en adultos se suele hacer biopsia pues hay pueden existir otras patologías renales que tienen diferente pronóstico y tratamiento.
Hematuria macroscópica aislada o recidivante
Al igual que las alteraciones urinarias asintomáticas las indicaciones de biopsia son controvertidas. Cuando se asocian a proteinuria persistente superior a 1 g/24h muchos autores preconizan hacer biopsia para diferenciar entidades de diferente pronóstico y tratamiento: nefropatía IgA, enfermedad de Alport, entre otras.
Insuficiencia renal crónica
No está indicada la biopsia pues la rentabilidad diagnóstica es mínima y los riesgos elevados. En algunos casos con deterioro inexplicado y riñones de tamaño superior a 9 cm. la biopsia puede ser útil desde un punto de vista diagnóstico (en casos de nefropatía IgA) pero suele aportar pocos datos para cambiar la actitud terapéutica [45].
Enfermedades sistémicas
El lupus eritematoso diseminado, las vasculitis ANCA+, la enfermedad de Goodpasture y otras enfermedades sistémicas afectan frecuentemente al riñón y condicionan su pronóstico [46]. En estas enfermedades la aparición de anomalías urinarias o deterioro renal de causa parenquimatosa son indicación de biopsia renal, incluso con rangos de proteinuria inferiores a los aceptados en las nefropatías primarias. En estos casos la realización de biopsia renal debe ser urgente para iniciar tratamiento inmunosupresor y frenar o retrasar el desarrollo de fibrosis irreversible [47]. La determinación de anticuerpos antiMBG y ANCA ayudan para el diagnóstico pero no sustituyen a la biopsia renal pues carecen de valor pronóstico y no ayudan a planificar el tratamiento [25]. En algunos casos, especialmente en la nefropatía lúpica, cuando se desea saber el grado de actividad histológica se ha planteado la necesidad de repetir biopsia renal de cara a modificar el manejo de los pacientes, valorar la cronicidad y evitar tratamientos inmunosupresores innecesarios [46] [48] [49].
Contraindicaciones
Las contraindicaciones se indican en la (Tabla 2). Las más importantes son las alteraciones de la coagulación. Es importante disponer de un estudio de coagulación completo, que incluya el tiempo de sangría que, curiosamente, no se hace de rutina en muchos hospitales. Algunas contraindicaciones pueden ser relativas si se logra corregir la causa: control de la coagulación, normalización de la tensión arterial y esterilización de la orina [5].
Requisitos
La (Tabla 3) resume los requisitos mínimos para hacer una biopsia renal. Es imprescindible que la coagulación sea normal o esté controlada (<130/80 mmHg) [50] [51] [52] Es recomendable saber de antemano el grupo sanguíneo y reservar sangre para posibles transfusiones post-biopsia. Los antiagregantes plaquetarios y los AINES se deben suprimir al menos 1 semana antes de la biopsia y reiniciarlos 1 semana después si no han aparecido complicaciones. Si el paciente está anticoagulado con acenocumarol (Sintrom®) hay que programar su paso a heparina de bajo peso molecular y hacer controles de hemostasia antes de la punción renal. No hay suficientes datos acerca del manejo en pacientes tratados con los nuevos anticoagulantes orales directos (dabigatrán, rivaroxaban, apixaban, entre otros), pero lo mas prudente es suspender su administración 3-5 días antes y reiniciarlos 5 días después, administrando enoxaparina en este intervalo de tiempo [53] [54] [55]. Como se ha indicado, la presión arterial debe ser inferior a 130/80 mmHg y el cultivo de orina negativo. Hay que tener constancia en la ecografía de la presencia y características de los riñones.
Es muy importante detectar los pacientes con mayor riesgo de complicaciones para asegurar la indicación de biopsia y tomar medidas preventivas [56]. La presencia de insuficiencia renal, mujeres, presencia de cortical adelgazada [57] y determinadas patologías (vasculitis renales, curso rápidamente progresivo y la necrosis tubular aguda, entre otras) son propensas a tener mas complicaciones (Tabla 4) [7] [58]. En estas situaciones es recomendable iniciar profilaxis con desmopresina intravenosa antes de la biopsia (Minurín® 0,3 mcg/Kg, en infusión lenta de 30 minutos, 1-2 horas antes de la biopsia, diluida con glucosado 5%) [59]. Incluso se ha comprobado que el uso de desmopresina en todos los casos disminuye el riesgo de sangrado post-biopsia renal [60].
Técnica
La biopsia renal percutánea dirigida con ecografía en tiempo real es, sin duda la técnica de elección en el momento actual tanto por su seguridad, eficacia y posibilidad de ser realizada en la práctica clínica [5] [18] [58] [61] [62] [63] [64] [65] [66]. Este procedimiento permite obtener material suficiente en más del 95% de los casos, incluso en pacientes con disminución importante del filtrado glomerular [45]. Es conveniente que se sigan los pasos de una vía clínica personalizada o un protocolo de actuación detallado en cada Unidad de Nefrología para evitar la variabilidad y coordinar a los profesionales implicados: médicos, enfermería y personal auxiliar [67] [68]. La biopsia debe ser realizada por un facultativo experimentado y nunca por especialistas en periodo de formación no supervisados [61]. También es conveniente que se organicen cursos de entrenamiento utilizando, si es posible, modelos de simulación [69] [70] [71] [72] [73] [74] [75]. La polémica sobre quién debe ser el protagonista del procedimiento (nefrólogo, radiólogo, urólogo) no está cerrada [76] y depende de la organización, experiencia y disponibilidades de cada hospital [77] [78]. Lo realmente importante es que el nefrólogo participe de forma activa y que la biopsia sea segura y eficaz para obtener una muestra representativa de la enfermedad renal estudiada. En cualquier caso, las Unidades de Nefrología acreditadas deben incluir la biopsia renal en su cartera de servicios.
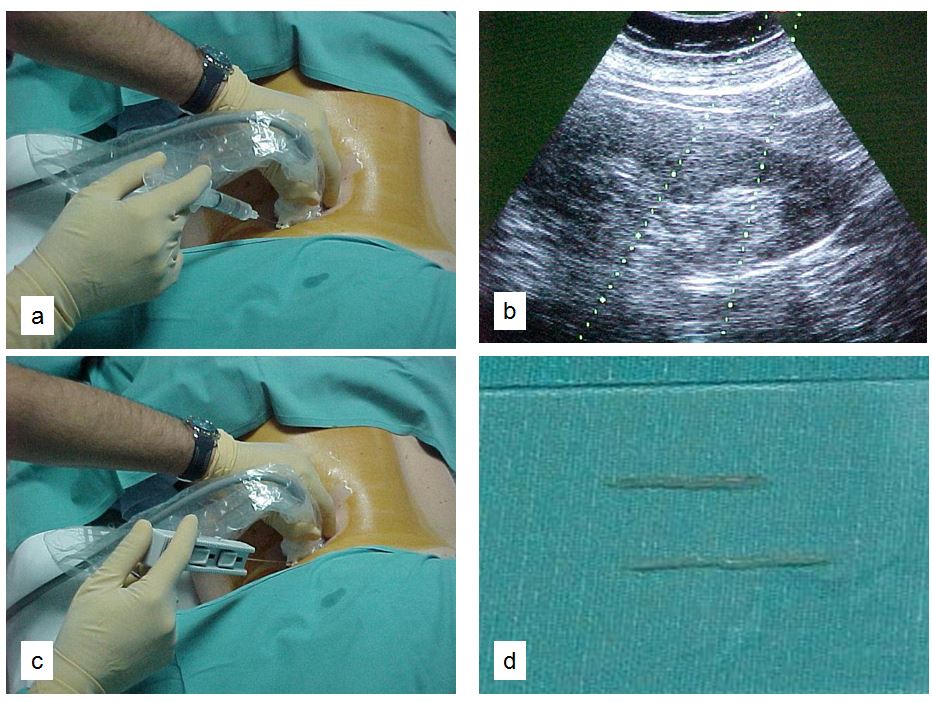
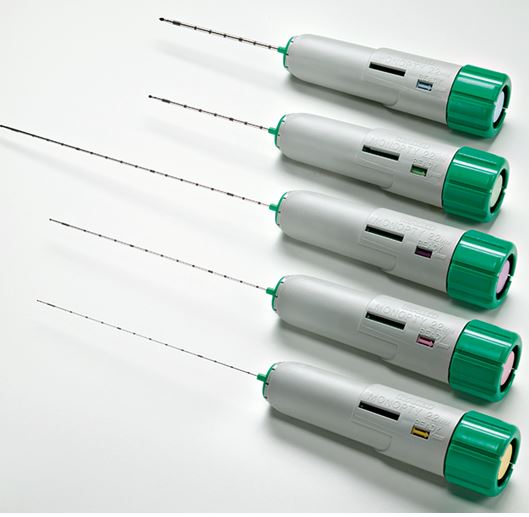
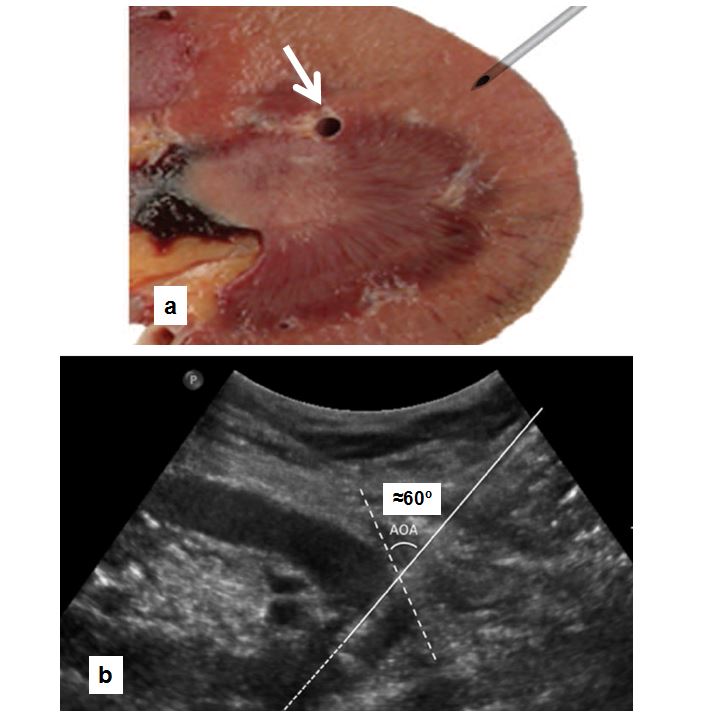
La (Figura 3) indica los pasos a seguir [62] [79]. El paciente debe estar en ayunas y tener canulada una vía venosa periférica. Debe permanecer en decúbito prono y colaborar con los movimientos respiratorios. Es conveniente administrar atropina subcutánea y un ansiolítico oral para mejorar la colaboración y evitar una reacción vagal. Hay que localizar el riñón mediante ecografía, especialmente el polo inferior del riñón izquierdo donde habitualmente es más fácil la punción y hay menos riesgo de lesión en otros órganos (Figura 4). Posteriormente hay que desinfectar la zona de punción y administrar anestesia local. Las sondas ecográficas con adaptador para la aguja permiten la visualización del riñón en tiempo real y permite guiar la progresión de la aguja y el ángulo "de ataque" adecuado (entre 50º-70º) de la aguja respecto a la cortical para obtener material suficiente con un riesgo mas bajo de complicaciones [77] (Figura 4). La aguja debe seguir un trayecto determinado tras sobrepasar la cápsula de cara a obtener muestra de tejido cortical sin alcanzar vasos de cierto tamaño (Figura 4) [8]. Las denominadas pistolas con disparo automático que llevan incorporadas agujas ecogénicas de calibre 14-16 gauges (G) y 20 cms de longitud [7] [64] [80] [81] [82] (Figura 5) son las más sencillas de utilizar, con menos riesgos y mayores posibilidades de obtención de material suficiente para un diagnóstico correcto [61] [63] [83] [84]. Las agujas de menor calibre (20-22 G) no son recomendables, dado que no suelen obtener suficiente tejido renal [81]. Hoy día las antiguas agujas manuales tipo TruCut o la de Menghini han quedado obsoletas. En nuestra experiencia, la aguja Monopty (Bard®) es fácil de utilizar y obtiene material en la mayoría de las ocasiones La punción a ciegas no es recomendable aunque se haya localizado la posición renal en ecografía previa; no obstante, a veces no se dispone de esta posibilidad y hay que guiarse por métodos indirectos, como las oscilaciones de una aguja de punción lumbar con los movimientos respiratorios al localizar la cápsula renal.
En todos los casos hay que extremar las medidas de precauciones universales para evitar contagios procedentes de pacientes infectados por virus de la hepatitis C y B, VIH u otros agentes. Es conveniente extraer al menos 2 cilindros renales y llevarlos inmediatamente al laboratorio de Anatomía Patológica e identificar si hay glomérulos suficientes, es decir más de 5 glomérulos en cada uno de ellos, idealmente 10 o más, ya que las muestras con menos glomérulos no son capaces de detectar lesiones focales. En caso de que no haya material se debe repetir la punción siempre que el paciente pueda colaborar. No es recomendable hacer mas de 4 punciones. En los casos en los que hay que trasladar los cilindros a otro Hospital para estudio histológico, hay que tener organizado con detalle la forma de transporte [85] [86] [87].
Cuando no se obtiene material para estudio con inmunofluorescencia convencional, el uso de inmunofluorescencia en tejido fijado con formalina usando técnicas de digestión con pronasa sobre tejido incluido en parafina puede ser eficaz e incluso puede aportar información diagnóstica en algunas enfermedades glomerulares en las que las técnicas convencionales no son suficientes [88] [89] [90] [91].
En ocasiones no se guarda muestra para estudio ultraestructural y algunas biopsias, al menos en nuestro país, se estudian de forma incompleta. Según los datos del Registro de Glomerulonefritis sólo un 18% de las biopsias tienen estudio completo mientras que la mayoría (alrededor del 75%), tienen informe con microscopio óptico e técnicas de inmunofluorescencia, sin estudio ultraestructural [92]. Aunque muchas enfermedades renales no requieren estudio ultraestructural, otras entidades solo pueden ser diagnosticadas mediante esta técnica. En los estudios mas recientes se insiste en la necesidad de hacer estudio ultraestructural en la mayoría de las biopsias renales [5].
Si hay material excedente, es recomendable almacenar o enviar alguna porción de la muestra para que sea guardada en un biobanco de cara a futuras investigaciones y colaborar con estudios multicéntricos [93] [94].
Técnicas alternativas a la biopsia percutánea
Si existen contraindicaciones (absolutas o relativas) para la punción percutánea, su riesgo es elevado o no se ha podido extraer material en la punción percutánea, se han propuesto otras alternativas: biopsia a cielo abierto, acceso transyugular [95], biopsia por laparoscopia o en posición supino oblicua, especialmente en pacientes con alteraciones de la coagulación, obesidad o enfermedades respiratorias evolucionadas [96] [97]. La elección de alguna de estas técnicas alternativas depende de la experiencia y posibilidades de cada centro [98].
Complicaciones
Aunque las ventajas son superiores a las desventajas, hay que tener en cuenta las posibles complicaciones, que globalmente oscilan entre 6-8%. Las complicaciones mayores (descenso significativo de hemoglobina y/o necesidad de transfusión) aparecen entre 1-3% de los pacientes, mientras que las complicaciones menores oscilan entre 2-7%. No obstante, es una técnica segura pues la mortalidad oscila entre 0,1 y 0,02% [7] [67] [68] [79] [82] [99]. La hemorragia renal y las fístulas arteriovenosas son las complicaciones más importantes [97] [100] (Tabla 5). Para evitarlas, es imprescindible que el paciente guarde reposo y se hidrate adecuadamente por vía oral o intravenosa. Hay que vigilar la presión arterial y el pulso y supervisar la zona de punción y el color de la orina. El paciente debe permanecer al menos 24 horas en el hospital, tras lo cual puede ser dado de alta si no han aparecido complicaciones [7]. Aunque se ha descrito que se puede dar el alta en el mismo día [42], los datos no son concluyentes y es más prudente mantener, al menos en nuestra experiencia, 24 horas de hospitalización. También es recomendable hacer ecografía de control para detectar hematomas renales asintomáticos, que obligarían a prolongar la hospitalización hasta la resolución del problema [66].
Casi todos los pacientes tienen microhematuria tras la punción renal y hasta un 12% de los pacientes tienen hematuria macroscópica que suele ser autolimitada y cede con reposo en pocas horas. Si la hematuria es intensa se pueden formar coágulos que pueden obstruir la vía urinaria. Cuando la hemorragia se almacena en el espacio retroperitoneal puede complicarse con anemia e hipotensión arterial. La ecografía urgente es imprescindible ante la sospecha de complicaciones. En caso de hemorragia activa el tratamiento con procedimientos endovasculares, con embolización selectiva del vaso perforado resuelve los problemas de forma eficaz en la mayoría de las ocasiones. Alrededor de un 1% de los pacientes necesitan ser transfundidos y un 0.1% precisan embolización selectiva o nefrectomía. Si la colección de sangre se almacena en la cápsula renal da lugar a un taponamiento renal que cursa con hipertensión por estímulo del sistema renina-angiotensina (riñón de Page).
La fístula arteriovenosa silente es frecuente pero la mayoría se resuelven de forma espontánea. En casos graves ocasiona hematuria, hipotensión e insuficiencia cardíaca. El procedimiento diagnóstico es la ecografía doppler y su tratamiento es la embolización selectiva [10].
Retos y futuro
Como se ha comentado anteriormente, el estudio de la biopsia renal continua siendo un procedimiento esencial en el estudio de las enfermedades renales. A los aspecto tradicionales acerca de su importancia en el diagnóstico, tratamiento y evolución, se han sumado algunos temas de actualidad que suponen un reto para clínicos y patólogos de cara a una medicina mas moderna y personalizada (Tabla 6).
En los últimos años se han puesto en marcha nuevos enfoques que pretenden mejorar y dar un nuevo enfoque al estudio de las biopsias renales.
En primer lugar, se ha acordado modificar la clasificación de las glomerulonefritis en base a los datos de la inmunofluorescencia y se ha propuesto, al mismo tiempo, un nuevo formato de redacción de los informes anatomopatológicos que incluyan posibles mecanismos patogénicos y datos clínicos [87] [101]. En otra línea de investigación, se han actualizado y validado nuevos parámetros o scores para ayudar a ayudar a conocer el pronóstico, evaluar la intensidad de las lesiones crónicas y predecir la evolución de ciertas entidades, especialmente en la nefropatía IgA [102] [103], nefropatía lúpica [104] y vasculitis renales [105].
En segundo lugar, el estudio mediante inmunofluorescencia debe ser ampliado, especialmente tras los nuevos descubrimientos en los mecanismos de la nefropatía membranosa (identificación de receptor de fosfolipasa PLA2R como antígeno en formas primarias) [106] y en las lesiones mediadas por el complemento como ocurre en el síndrome hemolítico-urémico atípico [107] [108] [109] [110] y en otras entidades relacionadas entre las que destaca la glomerulonefritis C3 [111]. El estudio de las cadenas del colágeno puede abrir nuevas vías de diagnóstico en el síndrome de Alport [112] [113]. Las novedades que puede aportar la aplicación de pronasa en el diagnóstico de varias enfermedades renales mediadas por complejos inmunes suponen un aspecto a tener en cuenta, independientemente de su valor como estudio sobre material fijado [88] [89] [90] [91].
En cuarto lugar, ciertas técnicas utilizando disección con láser y mediante espectrofotometría de masas abren un campo de estudio muy interesante en ciertas enfermedades renales, entre las que destaca la amiloidosis [114] [115] [116] [117].
Finalmente, el estudio de la biopsia renal debe estar en consonancia con la denominada "medicina de precisión", que pretende aunar los datos clínicos y analíticos, con estudios de biología molecular, biomarcadores y estudios genéticos para contribuir al desarrollo de perfiles personalizados de enfermedad, diseñar nuevos tratamientos dirigidos al mecanismo que ha producido la enfermedad renal y la creación de biobancos, tal y como se ha venido haciendo en los pacientes oncológicos [5] [94]. [101].
En resumen, el estudio de la biopsia renal es un tema de continua revisión, con notables avances en los últimos años y que plantea retos y cambios que, sin duda, mejorarán el conocimiento y la evolución de muchas enfermedades renales. Tanto los clínicos como los patólogos se deben sumar a estos retos y motivar a los nuevos especialistas para contribuir a su incorporación en la práctica médica diaria.
Conclusiones
La biopsia renal es un procedimiento indispensable en el estudio de muchas enfermedades renales pero es necesario tener criterios bien definidos acerca de sus indicaciones para que tenga rentabilidad diagnóstica, ayude a establecer el pronóstico y contribuya a modificar el tratamiento. En la actualidad es un tema de gran interés con necesidad de afrontar nuevos retos encaminados a la denominada medicina de precisión para lograr tratamientos individualizados y dirigidos a los mecanismos patogénicos de las enfermedades renales.
Puntos fundamentales:
1.- La biopsia en una herramienta indispensable en el estudio de muchas enfermedades renales.
2.- La biopsia renal tiene unos ciertos riesgos y consume tiempo y recursos médicos, por lo que antes de su realización se requiere, como mínimo:
i) agotar todos los procedimientos no invasivos
ii) considerar que la información suministrada proporciona un diagnóstico de certeza
iii) asegurar que se puede hacer estudio histológico completo
iv) prever que el informe histológico influye en el tratamiento y pronóstico
3.- La colaboración entre clínicos y patólogos es indispensable.
4.- Las indicaciones más frecuentes son el síndrome nefrótico, las alteraciones importantes de la analítica urinaria y el fracaso renal agudo de origen incierto.
5.- Las contraindicaciones más importantes son las alteraciones de la coagulación, la presencia de riñones pequeños o con anomalías anatómicas, la infección urinaria y la hipertensión descontrolada.
6.- Es necesario reconocer los pacientes de mayor riesgo: presencia de insuficiencia renal, antecedentes de hipertensión, cortical adelgazada y edad avanzada. En estos pacientes está justificado el uso profiláctico de desmopresina.
7.- La técnica más reconocida es la punción percutánea ecodirigida en tiempo real, usando pistolas automáticas. Existen otros procedimientos alternativos, en sujetos de riesgo o cuando fracasa la punción.
8.- El estudio con microscopio óptico, inmunofluorescencia y en muchas ocasiones microscopio electrónico, es indispensable para un diagnóstico de certeza. Es conveniente guardar muestra renal en un biobanco.
9.- La complicación más frecuente y grave es la hemorragia, que se puede resolver, en la mayoría de los casos, con medidas conservadoras.
Agradecimientos.
Al Dr. Antonio Barat, impulsor de la Nefropatología en nuestro país y que ha sentado las bases de la colaboración entre patólogos y nefrólogos. También al Dr. Pablo Cannata e Irene Rivera, por la revisión del manuscrito.
Tablas
Figuras