Hidratación en la enfermedad renal crónica
Palabras clave
Hidratación, ingesta líquida, enfermedad renal crónica, vasopresina, hormona antidiuretica, ADH
Resumen
Existe un importante vacío de información en la Guías de manejo de la Enfermedad Renal Crónica (ERC) sobre los potenciales beneficios de una adecuada hidratación para prevenir el daño renal. Aunque no hay evidencias concluyentes, estudios experimentales y poblacionales sugieren que la cantidad de líquido ingerida puede ser un factor de riesgo de ERC no establecido. Los efectos renales adversos de una insuficiente hidratación podrían estar mediados por el incremento de vasopresina. En este sentido, una ingesta hídrica generosa, al menos para eliminar la carga osmótica, puede ayudar a preservar la función renal en pacientes con ERC que conservan la capacidad de generar alto volumen de orina.
El siguiente análisis teórico, pretende proporcionar un argumento razonable para responder a la pregunta ¿Dr cuanto debo beber?: Una dieta estándar genera aproximadamente unos de 650 mOsm de solutos, que deben ser excretados por el riñón. Si asumimos que la máxima concentración urinaria es de 1.200 mOsm/Kg, serán necesarios al menos 500 mL de orina para eliminar la carga de solutos. Cuando existe daño renal avanzado, se pierde la capacidad de concentración y se produce una orina isostenúrica (250-300 mOsm/Kg). Si el volumen urinario obligatorio se obtiene dividiendo la excreción osmolar diaria por la osmolalidad urinaria máxima, sería necesaria una diuresis de al menos 2 L, para eliminar la carga habitual de solutos. Esto se consigue, en función de las perdidas extrarrenales, con una ingesta líquida entre 2,5 y 3,5 L al día.
A pesar que la capacidad de generar elevada diuresis se mantiene hasta etapas avanzadas de la ERC, esta recomendación debe manejarse con máxima cautela, e individualizarse. No es aplicable a pacientes con síndrome cardiorrenal o con riesgo de retención hidrosalina. Asimismo, la ingesta forzada puede exceder la capacidad de dilución del riñón, e inducir hiponatremia. Por ello deben vigilarse los parámetros séricos y urinarios con objeto de prevenir tanto la hiponatremia, como la deshidratación, circunstancia esta última, más frecuente en épocas estivales y en pacientes añosos, que son la población mayoritaria en las consultas ERC avanzada.
Hidratación y volumen de orina
Con frecuencia los pacientes preguntan: ¿Dr. cuánto debo beber?, "porque yo orino mucho, y si bebo más, orino más", ¿es eso malo? A estas cuestiones debemos responder con argumentos convincentes. Resulta llamativo que las Guías KDIGO [1] y las más recientes KDOQI [2] no marquen pautas respecto a la ingesta hídrica y la diuresis deseable en el paciente con ERCA. Tampoco el tratado electrónico UPTODATE hace referencia a la diuresis, advirtiendo únicamente del riesgo de retención hidrosalina en el apartado de complicaciones (http://www.uptodate.com/home: Overview of the management of chronic kidney disease in adults), especialmente si hay antecedentes de insuficiencia cardíaca congestiva y disfunción sistólica. Esto es lógico, pero si lo extendemos a todos los pacientes, podemos quedarnos con la idea que debemos restringir los líquidos, cuando esta recomendación puede tener consecuencias indeseables.
A nivel poblacional, la hidratación como hipótesis de salud es puesta en valor en numerosos trabajos de la literatura [3] [4].
Asimismo, revisiones relevantes han analizado [5] [6] [7] [8] los mecanismos por los cuales la baja ingesta líquida puede tener efectos adversos sobre el riñón y las vías urinarias en cuatro escenarios de enfermedad: urolitiasis, infecciones urinarias, cáncer de vejiga y en la ERC.
En el ámbito de la ERC, en la literatura podemos encontrar datos de los beneficios de una adecuada hidratación para prevenir el daño renal [9] [10] [11]. También, un estudio transversal más reciente, en pacientes con ERC moderada, sugiere que la mayor ingesta de agua se asocia a menor riesgo de albuminuria y de progresión de la ERC [12]. Sin embargo, estos resultados no han sido confirmados por otros autores; Clark W et al [13] en un ensayo clínico controlado, no han podido verificar beneficios renoprotectores con el incremento de ingesta líquida vs ingesta estándar, si bien los niveles de copeptina bajaron significativamente en el grupo con incremento de la hidratación [14].
Con todo, y a falta de evidencias contundentes, el balance de información anima a alcanzar un alto flujo urinario en estos pacientes. Wang CJ et al [6] recomiendan que individuos en riesgo de nefrolitiasis, ERC y PQR pueden beneficiarse de un flujo urinario de 3-4 L y que esta medida es razonablemente segura. Una revisión reciente de la literatura, propone que la óptima ingesta liquida sea de 2,5-3,5 L diarios, haciendo posible una diuresis diluida de 2 a 3 litros [15]. Asimismo, Clark WF et al [8] en un excelente analisis, concluyen en los beneficios de una adecuada hidratación en pacientes con litiasis, ERC, nefropatía mesoamerica y poliquistosis renal.
Hidratación y carga de solutos en el adulto sano
El riñón necesita agua para filtrar y excretar los productos de desecho de la sangre [4] [16] [17]. Una dieta estándar representa aproximadamente la generación de 650 mOsm* de solutos, que deben ser excretados por el riñón [18]. Esta carga renal de solutos (CRS) procede de los alimentos ingeridos y puede estimarse a partir de la siguiente ecuación: CRS = Na + Cl + K + P + (N/28). Na, K, Cl y P se expresan en mmol y el N en mg. En ella se asume que todas las proteínas son convertidas en urea y todos los minerales de los alimentos son eliminados por el riñón. A partir de esta fórmula, la Osm urinaria puede calcularse así: Osm urinaria = CRS (mOsm/día) / (ingesta de agua - perdidas extrarenales de agua en L/día) [18].
El riñón sano es capaz de modificar la osmolalidad (Osm) urinaria entre 40-1.200 mOsm/Kg de agua aproximadamente [16] [17] y el volumen urinario variará en función de la cantidad de osmoles que se necesite excretar. En circunstancias habituales, la Osm urinaria es dos a tres veces superior a la plasmática, siendo entonces la diuresis media diaria en individuos sanos de 1,2-2,0 L [6] [19]. Asimismo, el volumen urinario obligatorio, que se obtiene dividiendo la excreción osmolar diaria (mOsm/día) por la osmolalidad urinaria máxima (mOsm/kg H2O), será aproximadamente, de 500 mL de orina en condiciones de máxima concentración.
Esta información nos puede proporcionar argumentos razonables, para estimar la diuresis mínima necesaria capaz de eliminar la carga de solutos en la ERCA.
La cantidad de líquido ingerida puede ser un factor de riesgo de ERC no establecido
Trabajos antiguos de fisiología renal sostenían que una alta ingesta líquida podía prevenir el daño renal, llegando incluso a recomendar diuresis de 3 L/día [20]. Posteriormente, estudios en animales también constataron los beneficios de la alta ingesta líquida en la ERC [21] [22].
Otros estudios han verificado los potenciales beneficios de la alta ingesta líquida en la prevención de la progresión de la enfermedad renal. Strippoli GF y col [11] realizaron dos cortes consecutivos transversales en la población general mayor de 50 años, demostrando que aquellos individuos con mayor ingesta líquida (quintil más elevado: > 3,2 L/día) tenían menor riesgo de desarrollar ERC. Clark WF y col [10] analizaron la relación entre volumen de orina y deterioro renal en una serie de 2.148 individuos con FG > 60 mL/min durante un período de seguimiento de seis años. Los autores observaron una relación inversa entre volumen de orina y daño renal; destacando que aquellos con una diuresis > 3 L mostraron menor deterioro renal. Sontrop J et al [23] realizaron un amplio estudio poblacional transversal (NHANES Data, FG > 30 mL/min/1,73 m2) hallando mayor deterioro renal en la población con menor ingesta líquida. Hay dos observaciones de interés en este estudio: 1) la ausencia de asociación entre ingesta líquida y enfermedad cardiovascular; y 2) que estos potenciales efectos beneficiosos se pierden cuando la elevada ingesta líquida es a expensas de productos azucarados.
Es muy interesante el trabajo de Peraza S et al [24], a propósito de la Nefropatía Endémica Mesoamericana, que estudiaron una población expuesta a una hidratación insuficiente y prolongada, observando que estos individuos sufrían episodios de daño renal agudo subclínico, y como consecuencia de ello, mayor susceptibilidad a padecer ERC. Este manuscrito y una prolija revisión publicada en un editorial acompañante [25], nos advierten que el reconocido "calentamiento global", como consecuencia del cambio climático, puede ser un riesgo adicional de ERC, especialmente en poblaciones expuestas a duras condiciones de trabajo en climas cálidos.
La ADH tiene mucha culpa
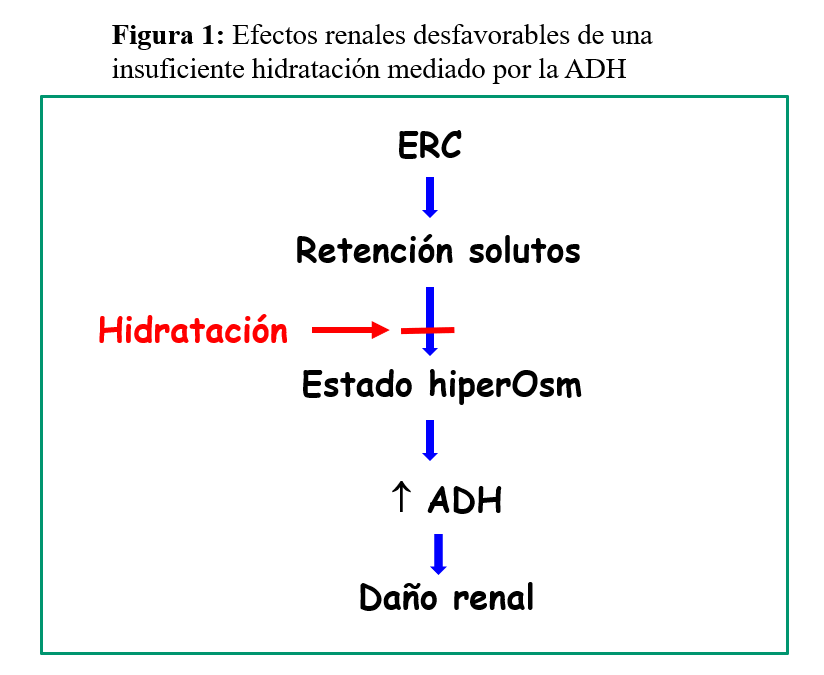
Los datos de la literatura apuntan a que los efectos renales adversos de una insuficiente hidratación, podrían estar mediados por el incremento de vasopresina u hormona antidiurética (ADH) [9] [26] (Figura 1). La ADH activa los receptores V2 [27] [28] induciendo múltiples efectos a nivel renal: vasoconstricción de la arteriola eferente, aumento del flujo plasmático renal y del filtrado glomerular, hiperfiltración glomerular, aumento de la eliminación urinaria de albumina, de la reabsorción tubular de Na, e incremento de la síntesis de renina. Junto al aumento de la reabsorción de agua y Na, también aumenta la permeabilidad a la urea, por lo que la economía de agua se consigue tambien excretando menos urea. Todo esto da lugar a una cascada de eventos que finalmente producen proliferación mesangial [29], daño tubulo-intersticial y nefrosclerosis [9] [17] [30] (Figura 2). En la misma linea, se ha demostrado que el incremento de la concentración urinaria, cursa con mayor riesgo de inicio de tratamiento renal sustitutivo [31]. Por contra, la reducción de los niveles de ADH endógenos con alta ingesta líquida produce descenso de la tensión arterial, de la proteinuria, y potencial beneficio sobre la función renal [30] [32]. En este sentido, la copeptina, un peptido glicosilado, coliberado con la vasopresina, ha demostrado ser un marcador serico fiable de la ADH. Un estudio piloto randomizado en ERC estadio 3 ha demostrado que el incremento de la ingesta líquida se asoción a un descenso significativo de la copeptina [33].
En la poliquistosis renal es donde mejor se han documentado los efectos adversos de la ADH [9] [34] [35] [36], demostrándose que el aumento de ingesta de agua retrasa el crecimiento de los quistes en animales, vía la supresión directa de la ADH. Efectos similares se han demostrado con el empleo de antagonistas selectivos de la vasopresina en pacientes (Tolvaptan) con PQR y función renal preservada [37]. Se considera que estos beneficiós son mayores cuando el riñón conserva aún la capacidad de concentrar orina [9].
¿Dr. cuánto debo beber? Sugerencias para la práctica clínica
Partimos de la premisa de que la información previa fué obtenida de estudios poblacionales y experimentales, y de que no hay evidencia contundente para recomendar una hidratación forzada -pero tampoco para restringir líquidos- en la ERC. Dicho esto, y a la espera de mayor información, con el siguiente análisis teórico, pretendemos proporcionar un argumento razonable para responder a la pregunta que da título al editorial: ¿Dr cuanto debo beber?
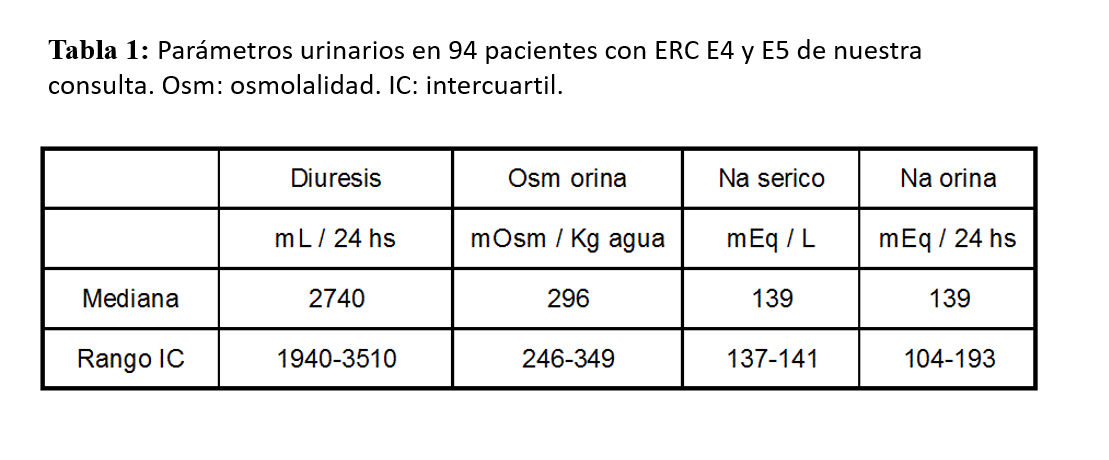
Decíamos que para mantener la homeostasis, la carga obligatoria de solutos a excretar por el riñón es de unos 600 mOsm diarios. También sabemos que cuando existe daño renal avanzado, se pierde la capacidad de concentración y se produce una orina isostenúrica, entre 250 y 300 mOsm/L como término medio [6] [19], que hemos verificado en una serie de pacientes de nuestra consulta observando que estos valores oscilan en un rango intercuartil muy estrecho (Tabla 1). Por lo tanto, en la ERC con masa renal activa reducida, se debe excretar más agua para eliminar los solutos adquiridos con la dieta. Sí como decimos previamente, el volumen urinario obligatorio se obtiene dividiendo la excreción osmolar diaria (mOsm/día) por la osmolalidad urinaria máxima (mOsm/kg H2O) [6] [19], una diuresis de 2 L sería el mínimo requerimiento para eliminar la carga habitual de solutos. Esto se consigue, en función de las perdidas extrarenales, con una ingesta líquida entre 2,5 y 3,5 L al día. De forma general podemos estimar que el 20% de la ingesta líquida proviene de los sólidos y el 80% del agua y otros líquidos [18].
En este sentido, el concepto extendido de “beba lo que tenga de sed” puede resultar insuficiente, especialmente en enfermos añosos [38] y en épocas estivales. Los beneficios de la ingesta líquida más allá de las demandas de la sed, podrían ser clave para retrasar la progresión de la ERC [6] [7]. De hecho, es clásico constatar aumentos de la creatinina sérica en épocas de calor, o durante episodios que cursen con deshidratación (fiebre, diarreas, vómitos...), y que se recuperan tras una adecuada ingesta líquida. Ante estas eventualidades, debemos también asesorar al paciente para una reducción o suspensión transitoria de diuréticos, bloqueantes del eje renina-angiotensina o antihipertensivos, como medidas de prevención de un deterioro agudo, eventualmente irreversible, de la función renal.
Por otra parte, debemos ser muy cautos, los conceptos previos no son aplicables a pacientes con criterios de síndrome cardiorrenal [39]. Ante una función cardíaca precaria (disfunción sistólica o incluso disfunción diastólica severa), con antecedentes de insuficiencia cardíaca congestiva, la hidratación forzada conlleva el riesgo de retención hidrosalina e hiponatremia, especialmente cuando el Na urinario está bajo, indicando que los mecanismos neurohormonales compensadores están en máxima estimulación.
En nuestra consulta ERCA, además de vigilar periódicamente los parámetros urinarios, hemos tomado la rutina de pedir al paciente la medición de la diuresis de 24 hs. una o dos veces al mes, y así cotejar con el volumen que traen para el análisis periódico. De esta forma tenemos el volumen urinario del paciente en perspectiva, aumentamos el nivel de advertencia sobre esta recomendación, y también verificamos el tan frecuente: "Doctor el día que tengo que recoger la orina, siempre orino menos”. En la (Tabla 1) mostramos los valores de diuresis, Osm urinaria, Na urinario y sérico, en una serie de 94 pacientes de nuestra consulta ERCA en estadios 4 y 5 (64±14 años, 78% varones, 48% diabéticos, 71% recibía diuréticos de asa), es decir con un FG calculado inferior 30 ml/min, y que salvo contraindicación explícita recibían la recomendación de beber una cantidad de agua suficiente para alcanzar un volumen urinario superior a los 2 litros. Así podemos comprobar que el alto volumen urinario es una característica de la ERC hasta etapas muy avanzadas (solamente el 25% de los pacientes tenían diuresis inferiores a 2 L). Asimismo la Osm demuestra que la orina es claramente isostenúrica tal como se describe clásicamente y el Na urinario se mantiene algo por encima de las recomendaciones clásicas.
Los valores de Na sérico han demostrado el bajo riesgo de hiponatremia a pesar de estimular la ingesta líquida y reducir el Na de la dieta. Solamente 4 pacientes presentaban cifras de Na inferiores a 130 mEq/L sin acusar ninguna sintomatología. Sin embargo, esto nos advierte, que algunos pacientes presentan también una dificultad mayor para diluir la orina, ante una ingesta forzada de líquidos. Dado que en la práctica clínica son dificiles de detectar a priori, debemos estar advertidos de esta eventualidad que puede pasar clínicamente inadvertida, y que debe ser corregida precozmente.
Conceptos clave:
Medidas complementarias en enfermos con función renal precaria, pero que conservan la capacidad de generar alto volumen de orina (Tabla 2):
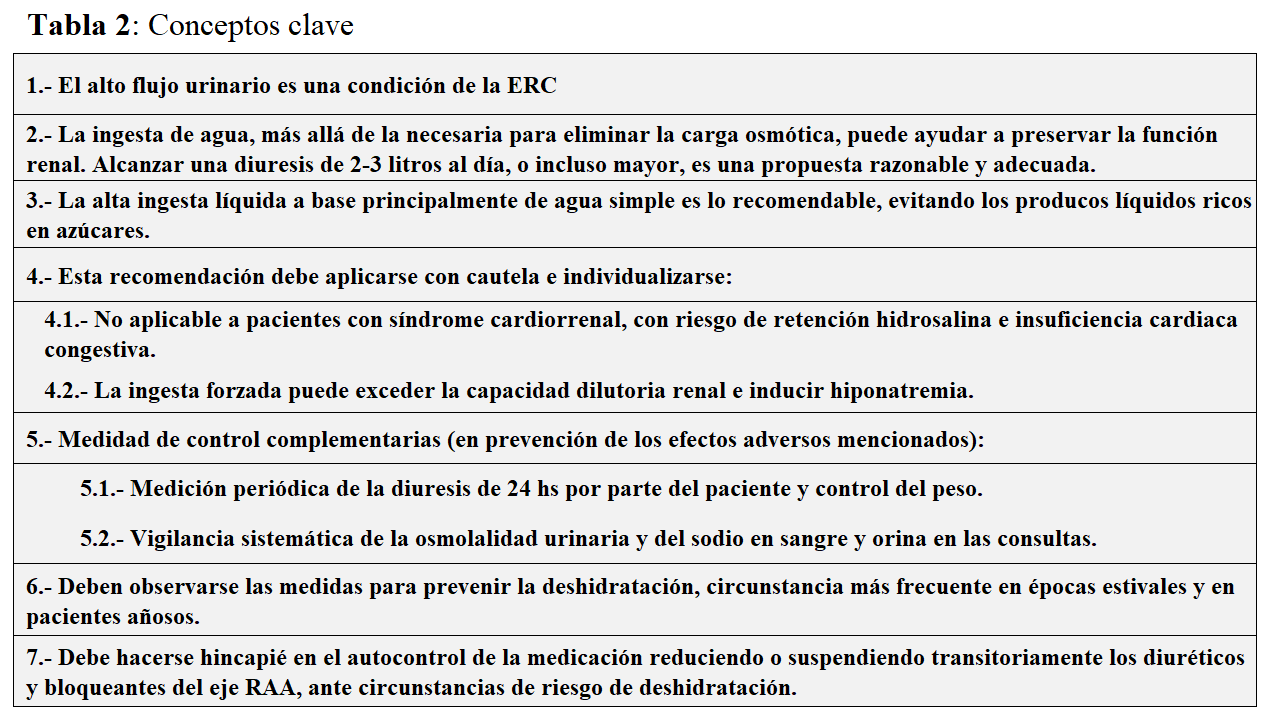
1.- En pacientes con ERCA la capacidad de generar alto volumen de orina se conserva hasta etapas avanzadas de la enfermedad.
2.- La ingesta de agua, más allá de la necesaria para eliminar la carga osmótica, puede ayudar a preservar la función renal. Alcanzar una diuresis de 2-3 litros al día, o incluso mayor, es una propuesta razonable y adecuada. Esta medida se aplica con más evidencia en pacientes con PQR.
3.- La alta ingesta líquida a base principalmente de agua simple es lo recomendable, evitando los producos líquidos ricos en azúcares.
4.- Esta recomendación debe aplicarse con cautela e individualizarse:
4.1.- No es aplicable a pacientes con síndrome cardiorrenal, con riesgo de retención hidrosalina e insuficiencia cardiaca congestiva.
4.2.- La ingesta forzada puede exceder la capacidad dilutoria renal e inducir hiponatremia.
5.- Medidad de control complementarias (en prevención de los efectos adversos mencionados):
5.1.- Medición periódica de la diuresis de 24 hs por parte del paciente y control del peso.
5.2.- Vigilancia sistemática de la osmolalidad urinaria y del sodio en sangre y orina en las consultas.
6.- Deben observarse las medidas para prevenir la deshidratación, circunstancia más frecuente en épocas estivales y en pacientes añosos, que son la población mayoritaria en consultas ERCA.
7.- Debe hacerse hincapié en el autocontrol de la medicación reduciendo o suspendiendo transitoriamente los diuréticos y bloqueantes del eje renina-angiotensina-aldosterona, ante circunstancias de riesgo de deshidratación.
* El concepto de osmolalidad (mOsm/kg de agua) u osmolaridad (mOsm/L de solución) difieren en la unidades que lo expresan. Aunque es más correcto osmolalidad, para los fines clínicos prácticos los podemos usar de forma indistinta. Ambos expresan la concentración de solutos u osmoles de una solución.