Fístulas Arteriovenosas para Hemodiálisis
Palabras clave
Fístulas arteriovenosas
ÍNDICE
- INTRODUCCIÓN
- MOMENTO DE HACER EL ACCESO VASCULAR
- EVALUACIÓN PREOPERATORIA
- HISTORIA CLÍNICA
- EXPLORACIÓN FÍSICA
- PRUEBAS COMPLEMENTARIAS
- TÉCNICA ANESTÉSICA PARA CREACIÓN DE LA FÍSTULA ARTERIOVENOSA
- PROFILAXIS ANTIBIÓTICA EN LA REALIZACIÓN DE LA FÍSTULA ARTERIOVENOSA
- TIPOS DE FÍSTULA ARTERIOVENOSA
- FÍSTULA ARTERIOVENOSA NATIVA
-FÍSTULA ARTERIOVENOSA PROTÉSICA
-TÉCNICAS DE RECURSO.
-FÍSTULA ARTERIOVENOSA EN EL ANCIANO
-COMPLICACIONES DE LOS ACCESOS VASCULARES PARA HEMODIÁLISIS
-TIEMPO MINIMO QUE DEBE PASAR PARA EMPEZAR A UTILIZAR LA FAV
INTRODUCCIÓN
Los pacientes en situación de enfermedad renal crónica avanzada (ERCA) deben recibir información sobre los diferentes tipos de técnicas de diálisis disponibles por parte de personal especializado en Terapia renal sustitutiva (TSR) [1][2]
Debemos considerar la creación del acceso vascular cuando el FGe < 15 ml/min/1,73 m2 y/o una estimación de entrada en diálisis en 6 meses [3][4].
Se recomienda la realización de fístula arteriovenosa con carácter preferente en los pacientes con enfermedad renal crónica de rápida evolución, falta de maduración de la fístula arteriovenosa o portadores de catéter venoso central no tunelizado[1]
En aquellos en los que se elige la hemodiálisis como TSR, se presenta la necesidad de garantizar un Acceso Vascular (AV) adecuado para llevarla a cabo [5][6].
Dicho acceso debería:
- Permitir una diálisis adecuada, proporcionando un flujo sanguíneo suficiente.
- Ser un acceso seguro y repetido sobre el sistema vascular del paciente.
- Tener la mayor permeabilidad en el tiempo y la menor tasa de complicaciones posibles.
El AV que más se acerca a esta situación ideal es la Fístula Arterio-Venosa Nativa (FAVn). Como alternativa se tienen, hoy día, la FAV Protésica (FAVp) y/o el Catéter Venoso Central (CVC) con todas sus posibles variaciones más o menos imaginativas o de recurso. Tal y como se ha referido previamente, el AV de elección es la FAVn, debido esencialmente a que presentan unas tasas de permeabilidad primaria, primaria asistida y secundaria muy superiores a las FAVp y a los CVC.
Asimismo, las FAVn presentan una incidencia de complicaciones inferior a la de los otros accesos, especialmente en cuanto a infecciones y trombosis. Por el contrario, el principal inconveniente de este tipo de FAV radica en su baja tasa de maduración y en el prolongado período que se requiere para utilizarla, sobre todo en los casos en que necesita procedimientos secundarios para su supervivencia.
La morbilidad y mortalidad del paciente en programa de hemodiálisis (HD) tienen relación directa
con el tipo de AV, tanto al inicio como en el seguimiento del TSR. El riesgo de complicaciones infecciosas al inicio de HD se multiplica por 4 cuando se utiliza un CVC comparado con la FAVn o FAVp y hasta por 7 cuando el CVC es el AV prevalente. También, el uso de CVC se relaciona con
significativo incremento en el riesgo de mortalidad, especialmente en el primer año de HD [6], por lo que hay que evitarlo en lo posible y revertir la tendencia que hay en algunos sitios a su incremento.
Dentro de estas líneas generales, hay que individualizar la decisión en función de otros factores como puede ser la urgencia de inicio del TRS, expectativa de vida del paciente o el tiempo que se va a necesitar el AV (por la posibilidad de trasplante renal o diálisis peritoneal), entre otros.
Se ha demostrado que una eficiente gestión del equipo multidisciplinar del acceso vascular puede redundar en un descenso de la prevalencia de catéteres [7].
Los pacientes con AV repetidos suponen un importante reto quirúrgico, dado que demandan más intuición y recursos técnicos para identificar el estado vascular arterial y venoso, permitiendo diseñar la mejor estrategia en cada caso, sin sacrificar futuras opciones de acceso.
MOMENTO DE HACER EL ACCESO VASCULAR (AV)
Como se cita en la introducción, se debe tener en cuenta la necesidad de planificar un acceso vascular si el paciente tiene previsto entrar en diálisis en los siguientes 6 meses o presenta un filtrado menor de 15 ml/min/1,73 m2 [3][4].
En esta decisión es cuándo se demuestra la correcta comunicación entre el nefrólogo y el cirujano vascular, ya que crear una FAV de forma precoz puede llevar a tener complicaciones evolutivas habituales del AV antes de haber empezado a usarse y hacerlo muy tarde obligaría a pasar un tiempo con CVC con las consecuencias que de ello se derivan.
En este aspecto, las experiencias de Consultas Multidisciplinares de Accesos Vasculares para Hemodiálisis han sido muy satisfactorias y con evidente mejoría de los resultados [8].
La recomendación del Grupo Español Multidisciplinar del Acceso Vascular (GEMAV) [1] es:
- Para la FAVn, 6 meses antes del inicio de la hemodiálisis.
- Para la FAVp, 3 a 6 semanas antes del inicio de la hemodiálisis.
EVALUACIÓN PREOPERATORIA
La decisión sobre el acceso vascular más adecuado en cada caso se basará en una evaluación global de la historia clínica, del examen físico vascular y de la ecografía preoperatoria de cada paciente (ver capítulo de Ecografía-doppler en el acceso vascular), teniendo en cuenta sus preferencias
individuales y priorizando la realización de FAV distal en el miembro superior no dominante siempre que sea posible.
Aunque no hay estudios que comparen expresamente la opción de priorizar la extremidad superior no dominante o la contralateral, parece razonable que, a igualdad de situación vascular, se elija la no dominante para no limitar temporalmente la actividad del paciente.
Sin embargo, hay que dejar a la elección del paciente, con el asesoramiento profesional, la decisión de si la siguiente FAV debe hacerse en una localización más proximal de la misma extremidad o en la localización más distal de la contralateral [9][10].
HISTORIA CLÍNICA
Son numerosas las circunstancias asociadas a la comorbilidad del paciente con ERCA que pueden influir en un adecuado desarrollo del AV, lo que obliga a un conocimiento previo de todos los factores implicados. En la revisión de la historia clínica, se deben contemplar los antecedentes patológicos que puedan aumentar de algún modo el riesgo de fallo del AV o predisponer a la aparición de morbilidad secundaria a dicho acceso [5].
Con respecto a los antecedentes que conllevan un riesgo de fracaso de la FAV se encuentran, en primer lugar, la presencia de comorbilidades asociadas a un peor pronóstico del AV en general (Tabla 1): edad avanzada, presencia de diabetes mellitus (DM), arteriopatía periférica, tabaquismo u obesidad [11][12][13][14][15][16] y en segundo lugar, la presencia de antecedentes a considerar a la hora de planificar la óptima localización del acceso (Tabla 2): antecedente de CVC o marcapasos (MCP), historia de AV previos, traumatismos o cirugías previas en brazo, cintura escapular o tórax, o canulaciones venosas previas [5]. Además, se debería tener en cuenta si el paciente es zurdo o es diestro, si ha recibido quimioterapia o radioterapia que puedan afectar a la FAV, antecedentes de cateterismo cardiaco a través del brazo, uso de anticoagulantes y antiagregantes, y preferencias individuales. Otros factores a considerar se encuentran en la (Tabla 3).
En los pacientes de edad avanzada, se ha demostrado las ventajas del AV nativo, siempre y cuando tenga un sistema venoso superficial adecuado. Lo que sí se prioriza menos es la localización más distal posible si la FAVn es más segura a nivel del codo o brazo, ya que tendrán menos necesidades de conservar capital venoso para futuras reintervenciones.
Pese a no existir evidencia científica de calidad y basándonos en los criterios de buena práctica
clínica, se recomienda extremar la conservación de la red venosa superficial de ambas extremidades superiores, que deben preservarse libres de punciones y canulaciones. Para ello es imprescindible instruir al personal sanitario e informar al paciente [1]. Siempre que sea posible, se realizarán las extracciones de sangre en el dorso de la mano o en su defecto en la vena mediana basílica de la extremidad dominante (dejando la no dominante como primera elección para realizar la FAV) (Tabla 4).
clínica, se recomienda extremar la conservación de la red venosa superficial de ambas extremidades superiores, que deben preservarse libres de punciones y canulaciones. Para ello es imprescindible instruir al personal sanitario e informar al paciente [1]. Siempre que sea posible, se realizarán las extracciones de sangre en el dorso de la mano o en su defecto en la vena mediana basílica de la extremidad dominante (dejando la no dominante como primera elección para realizar la FAV) (Tabla 4).
EXPLORACIÓN FÍSICA
En la evaluación del paciente será necesario una exploración física que valore la existencia.
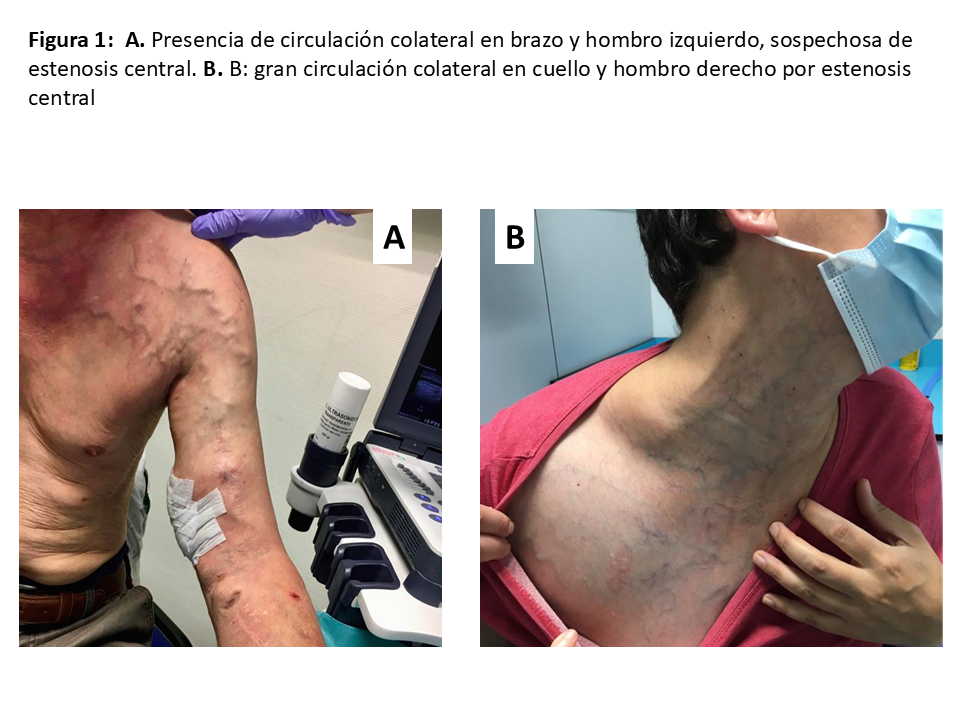
de limitaciones articulares, déficits motores o sensitivos, grosor del tejido celular subcutáneo e integridad de la piel, edema de la extremidad, existencia de circulación colateral en brazo, hombro o cuello (Figura 1 A), (Figura 1 B ) y cicatrices o trayectos venosos indurados. La exploración física debe incluir la palpación de pulsos señalando la existencia y calidad de estos, incluyendo la maniobra o test de Allen, valoración del relleno venocapilar, temperatura y coloración de la mano, la toma de presión arterial en ambas extremidades superiores y la exploración del sistema venoso mediante la palpación, percusión y transmisión venosa, con y sin torniquete (Tabla 5).
PRUEBAS COMPLEMENTARIAS
La realización de exploraciones complementarias deberá plantearse como ayuda necesaria e imprescindible para definir la estrategia a seguir en el orden de realización del AV. La realización de un mapeo ecográfico completo de forma rutinaria aumenta la supervivencia del acceso [5][17][18][19]. Se evaluará el diámetro y la calidad de la pared arterial y la anatomía y la permeabilidad del sistema venoso profundo y superficial de la extremidad.
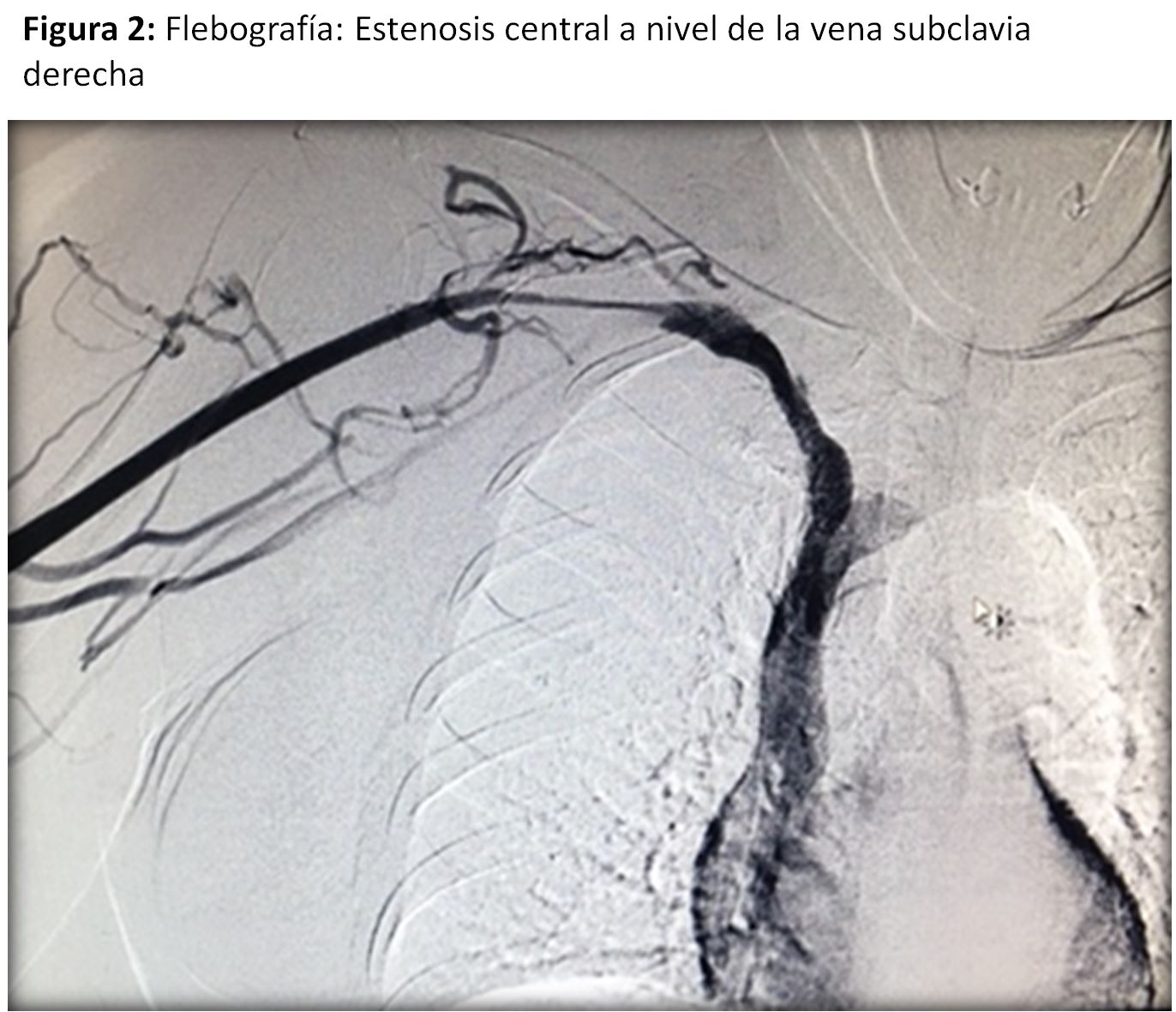
En casos seleccionados o en aquellos en que se sospeche una estenosis central se podría plantear la realización de una fistulografía para la correcta planificación de la cirugía (Figura 2)
TÉCNICA ANESTÉSICA PARA LA CREACIÓN DE LA FÍSTULA
Un metaanálisis realizado en 2017 demuestra que el uso sistemático del bloqueo axilar regional para la creación del AV permite una intervención más favorable además de disminuir la tasa de fallo primario del acceso [20] en comparación con aquellos pacientes que se operan con anestesia local.
Se cree que el bloqueo de la inervación simpática produce una vasodilatación similar al observado en la anestesia raquídea regional (Figura 3).
PROFILAXIS ANTIBIOTICA EN LA CREACIÓN DE FISTULAARTERIOVENOSA
Una de las complicaciones más importantes asociada al AV es la infección, que en muchas ocasiones deriva en la pérdida de este. A este hecho se añade que, al tratarse de estructuras superficiales, la infección de la herida quirúrgica puede condicionar la infección de la FAV con relativa facilidad.
La FAVn, no obstante, presenta una tasa muy baja de infección perioperatoria, por lo que no hay evidencia que justifique la profilaxis preoperatoria sistemática en estos pacientes. En cambio, en las FAVp se describe una mayor incidencia y gravedad de las infecciones, que en muchos casos obliga a su retirada en un paciente que tiene unas posibilidades muy limitadas para realizar nuevos AV. Los microorganismos que con mayor frecuencia colonizan o infectan la FAVp suelen formar parte de la microbiota cutánea (estafilococos, estreptococos y corinebacterias), siendo el más frecuente es Staphylococcus aureus. Por esta razón, numerosos estudios abogan por la administración preoperatoria de antibióticos profilácticos. La pauta más aceptada es una dosis única de vancomicina o cefazolina intravenosa.
TIPOS DE ACCESOS VASCULARES
Repasando los AV según su tipo, los agruparemos en:
• FAVn en muñeca y antebrazo.
• FAV radiocefálica en muñeca.
• FAV en tabaquera anatómica.
• FAV radiocefálica en antebrazo.
• Transposición radiobasílica.
• FAV cubitobasílica.
• Transposiciones venosas.
• FAVn en fosa antecubital (codo) y brazo.
• FAV humerocefálica.
• FAV humeroperforante (FAV de Gracz).
• FAV de arteria radial proximal.
• FAV humerobasílica.
• FAV humerohumeral.
• Otras transposiciones venosas.
• FAVp en miembros superiores.
• Injerto radioantecubital recto.
• Loop húmero/radio-antecubital.
• Injerto humerohumeral/axilar recto.
• Loop humerohumeral/axilar.
• Técnicas de recurso.
• AV en miembros inferiores.
• Injerto femorofemoral proximal (ingle).
• Injerto femorofemoral en el tercio medio del muslo.
• Transposición de la vena femoral.
• Dispositivo prótesis-catéter tunelizado (HeRO).
• Accesos vasculares "exóticos".
• Catéter venoso central.
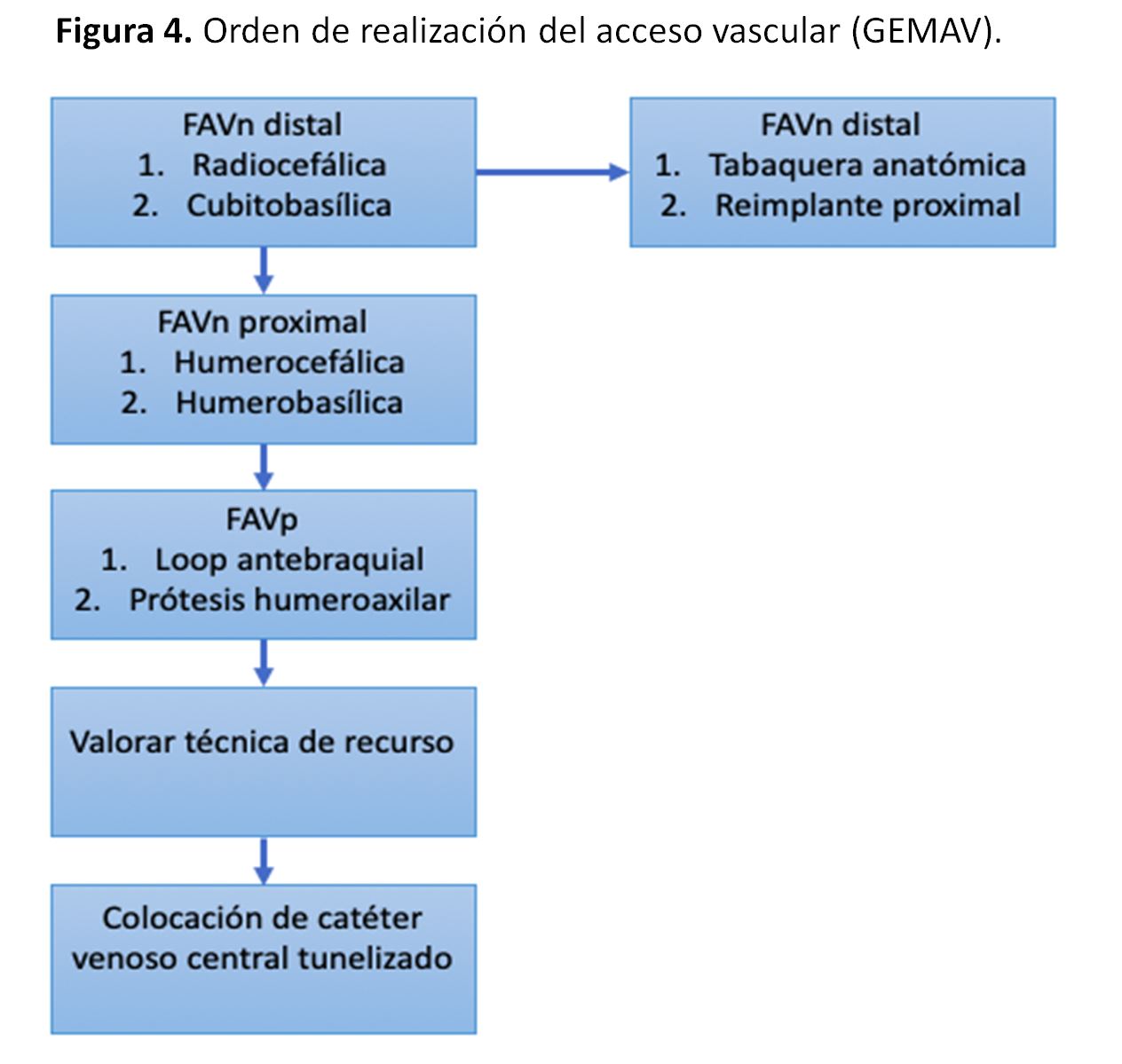
ORDEN DE REALIZACIÓN DEL ACCESO VASCULAR
Según la guía clínica del GEMAV [1] (Figura 4).
-Como primer acceso vascular se recomienda crear una FAVn lo más distal posible, en la extremidad superior no dominante.
-Tras agotar el acceso vascular radiocefálico a lo largo del antebrazo, se recomienda la FAVn a nivel de codo, siendo la fístula arteriovenosa humerocefálica o radiocefálica proximal la primera alternativa a considerar.
-Si no se puede realizar una FAV radiocefálica o humerocefálica, se recomienda la realización de una FAV humerobasílica con superficialización o transposición venosa en el brazo o antebrazo, como opción previa a la utilización de una FAVp.
-Se recomienda que la FAVp en la extremidad superior se limite a los siguientes supuestos:
A. Pacientes sin venas anatómicamente adecuadas en el brazo o antebrazo.
B. Pacientes que requieren hemodiálisis de modo inmediato y se quiere evitar la implantación de un CVC tunelizado.
- Si ha fracasado una FAV previa, se recomienda que la decisión del lugar anatómico de la creación de la siguiente fístula sea consensuada con el paciente, para decidir si se da prioridad al criterio de cuanto más distal mejor o al criterio de extremidad no dominante.
- En los casos en los que se han agotado los accesos vasculares a nivel de ambas extremidades superiores, se sugiere el empleo de las técnicas de recurso, priorizando la FAVp a nivel de muslo y el dispositivo prótesis-catéter tunelizado como primeras opciones a considerar.
FÍSTULA ARTERIO-VENOSA NATIVA
Consiste en la unión directa entre la arteria y la vena del paciente para el desarrollo y punción fácil de la última. El objetivo es realizarla lo más distal posible en la extremidad superior para preservar la mayor cantidad de segmento de venas puncionables y mantener la posibilidad de ir ascendiendo proximalmente las anastomosis futuras, cuando sean necesarias [21].
FAVn Radio-Cefálica:
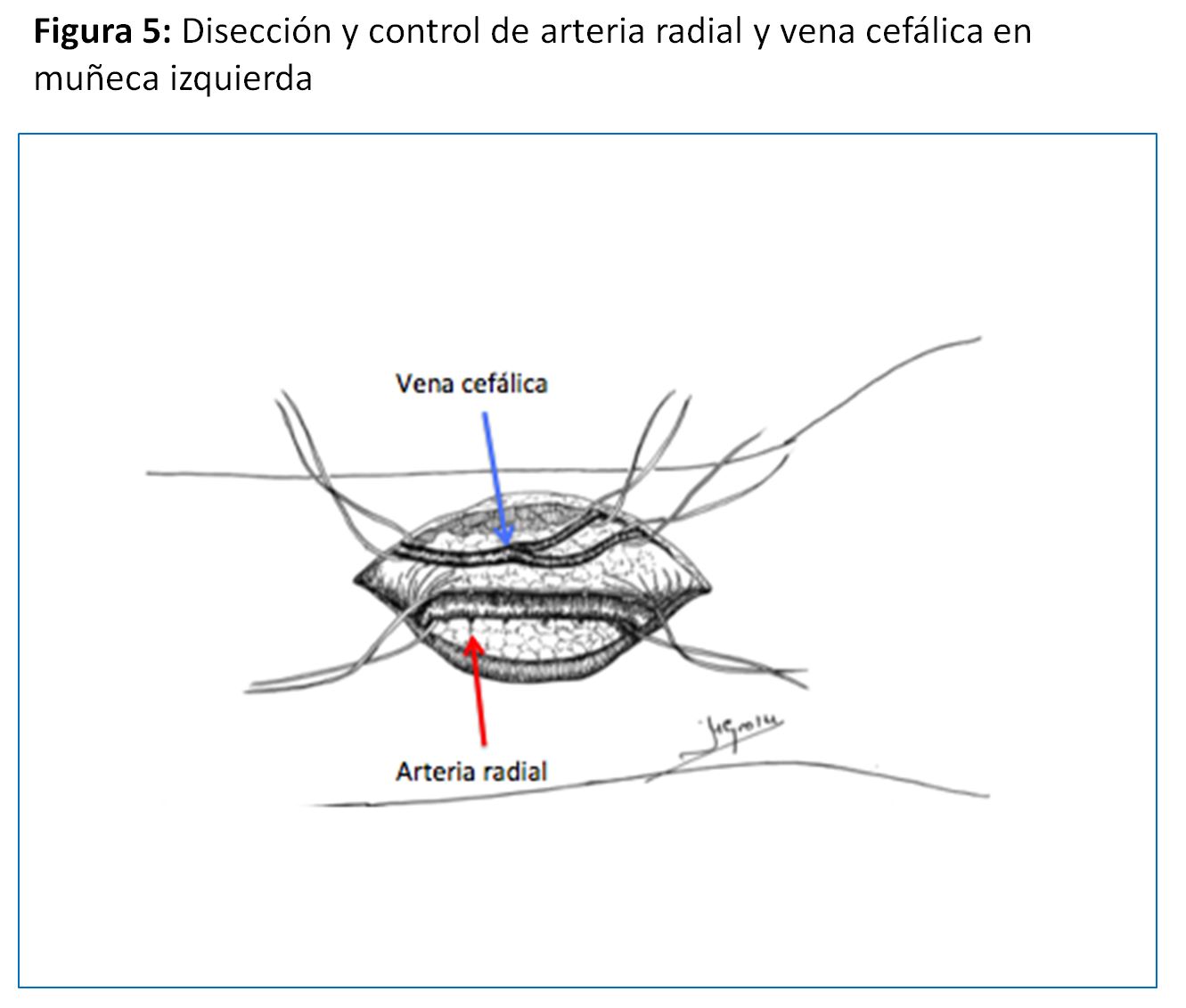
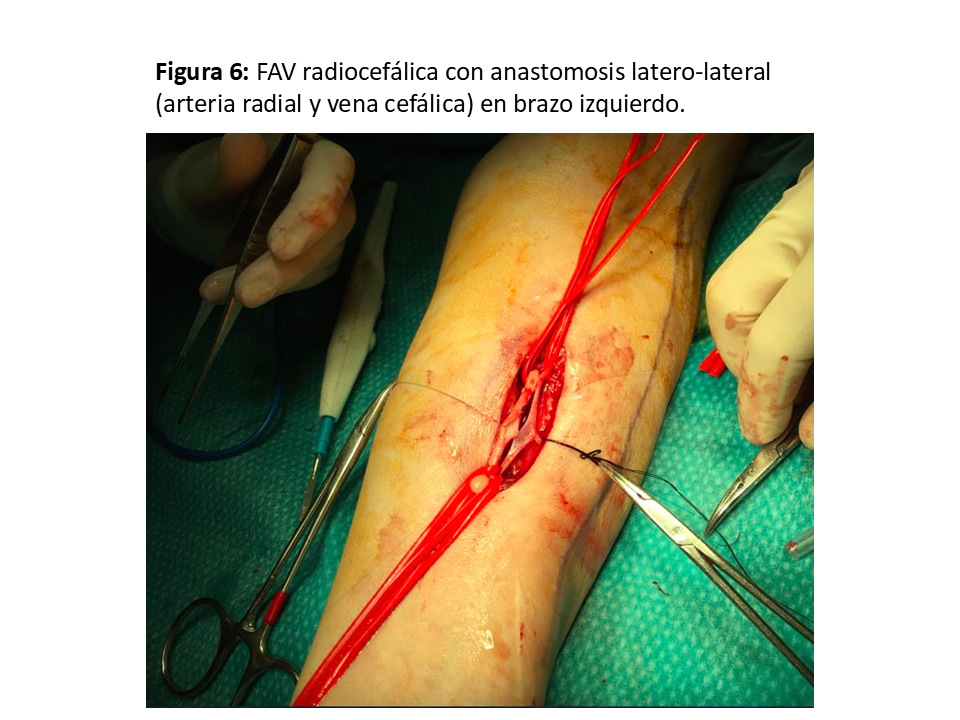
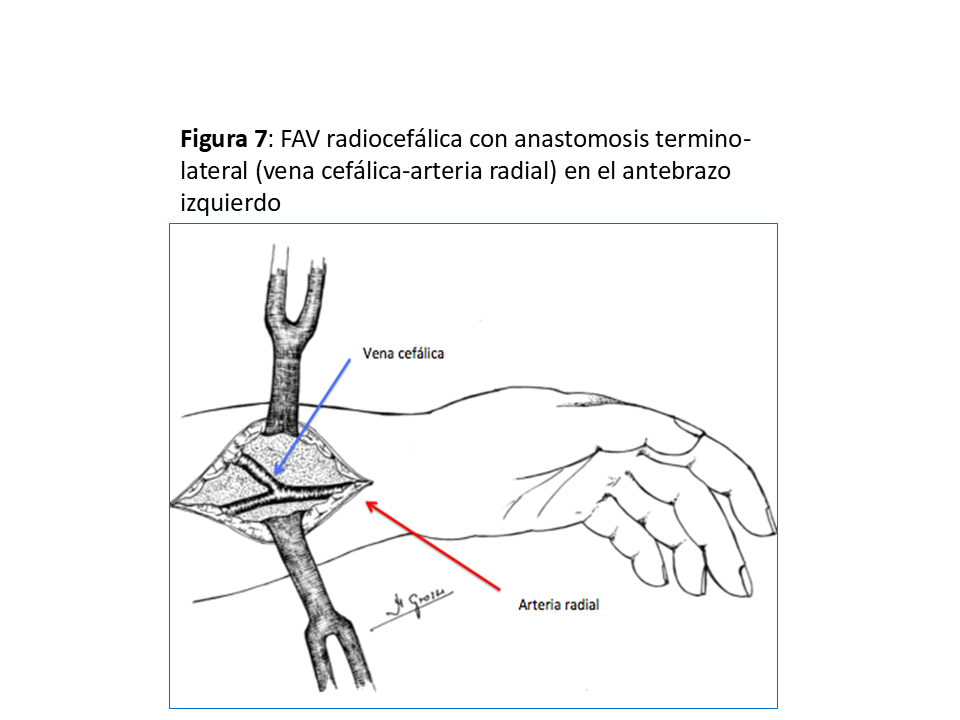
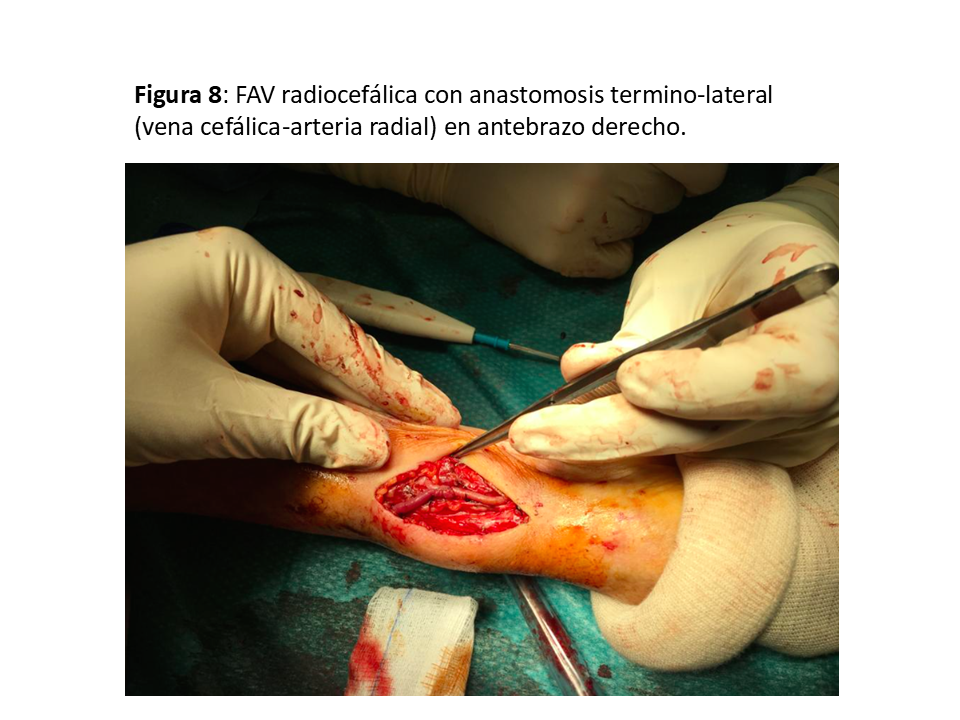
Realizada por primera vez en 1966 por el cirujano Kenneth C. Appell, del Hospital VA del Bronx (NY) compartiendo su primera publicación con el jefe de departamento de Nefrología, James E. Cimino, y Michael Brescia miembro del equipo de diálisis [22] [6]. La que se realiza en el tercio distal del antebrazo sigue siendo la referencia y la que se debe intentar como primera opción dada la baja tasa de complicaciones y su excelente permeabilidad aunque a costa de una relativa alta tasa de fallo primario que oscila entre el 10 y 30 % (y en algunos grupos llega al 50%), sea por trombosis precoz y por falta de maduración (hasta el 30 % a los 3 meses), especialmente en pacientes diabéticos, ancianos y mujeres [23] [24]. Puede ser realizada a pacientes de todas las edades, desde niños de corta edad hasta ancianos. (Figura 5) (Figura 6) (Figura 7) y (Figura 8).
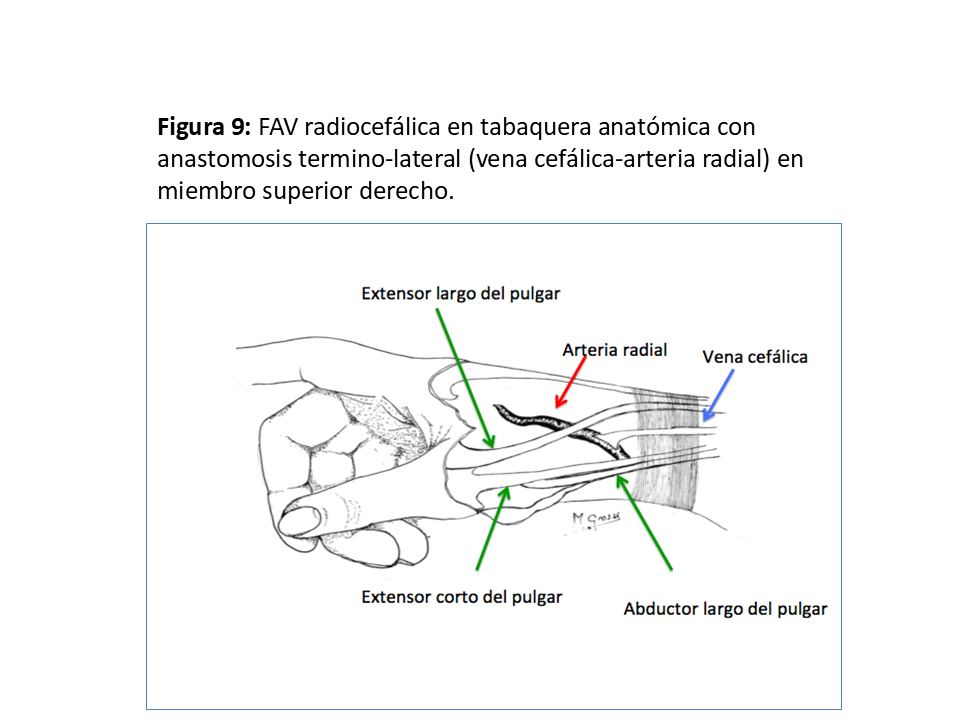
Otra localización de la FAV radiocefálica es la tabaquera anatómica, usando la rama posterior de la arteria radial entre los tendones extensores corto y largo del pulgar (Figura 9), que tiene una mayor complejidad técnica pero con unas permeabilidades del 65% al año y del 45% a los 5 años, permitiendo conservar todo el trayecto venoso para futuros reimplantes proximales [25].
La anastomosis entre la arteria radial y la vena cefálica se puede hacer prácticamente en todo el antebrazo, aunque se precisaría efectuar una “ventana” en la musculatura suprayacente a partir de cierto punto para evitar compresiones. Esto puede ser necesario tanto por los hallazgos ecográficos en el mapeo preoperatorio o como para “rescatar” una FAVn distal trombosada o estenosada.
Programas de ejercicio supervisado para desarrollo y aumento del diámetro de las venas de antebrazo, como el implantado por nuestro grupo en un ensayo clínico [26] han demostrado que, planificando adecuadamente el momento de realizar el acceso, se puede conseguir hacer más AV nativos con mejores resultados en cuanto a maduración y permeabilidad. (Figura 10).
FAVn en fosa antecubital (pliegue del codo):
Según las directrices de la Kidney Disease Outcomes Quality Initiative (KDOQI) [5], la FAV radiocefálica y la FAV humerocefálica son la primera y la segunda opción para crear un AV, respectivamente. Este tipo de FAV tienen muchas posibilidades y variantes dada la alta variación anatómica venosa en fosa antecubital (Tabla 6).
Son vasos de mayor calibre con lo que los fallos primarios y de maduración son menores, con la contrapartida de tener menos trayecto de punción disponible (aunque se podría plantear una valvulotomía de la vena de antebrazo para permitir flujo anterógrado y retrógrado, con un posible aumento del riesgo de hipertensión venosa) [27]. También tiene más posibilidades de edema de la extremidad y de riesgo de complicaciones isquémicas de la mano (robo arterial). Otra consideración a tener en cuenta a la hora de plantearlas, es la adiposidad del brazo ya que puede dificultar su utilización rutinaria o requerir intervenciones secundarias (como incluso una liposucción o lipectomía) para su superficialización [28][29].
FAVn Humero-cefálica latero-terminal (L-T)
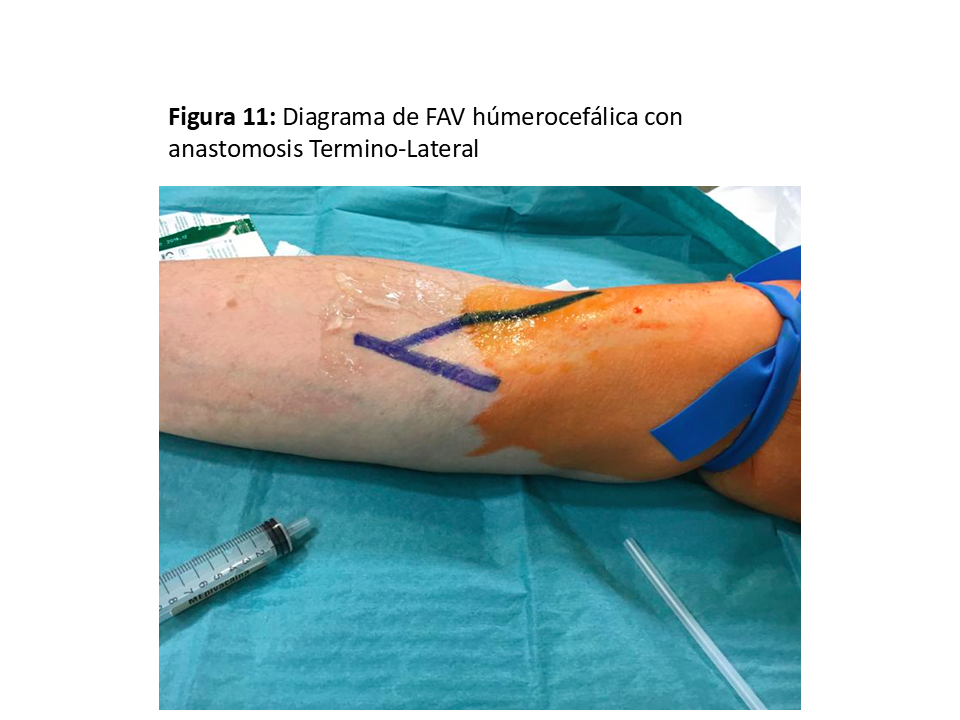
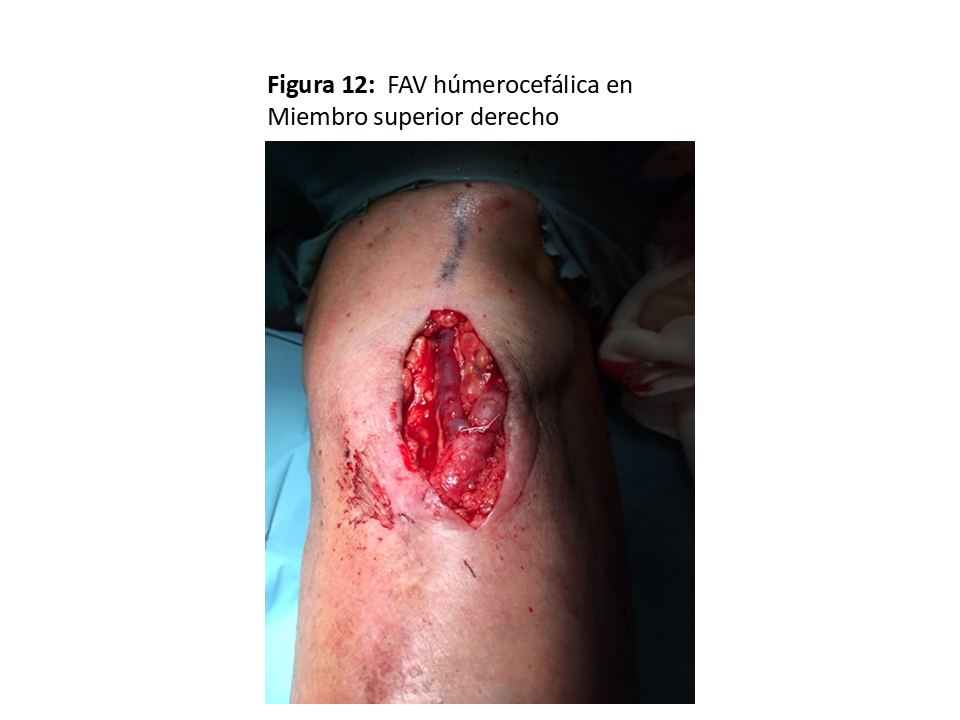
La anastomosis se hace eligiendo el segmento más “sano” de la vena, ya que es localización frecuente de punciones repetidas para extracciones de muestras sanguíneas o infusión intravenosa, obligando en ocasiones a movilizaciones de la vena para llegar hasta la arteria. La longitud de dicha anastomosis no debe superar los 6-7 mm [1], ya que aumentaría las posibilidades de isquemia distal de la extremidad [30] (Figura 11) y (Figura 12).
En ocasiones, se puede realizar la anastomosis en latero-lateral (L-L) con la vena mediana basílica sin anulación de la salida por la vena basílica del brazo, cuando no se esté seguro que la vena cefálica vaya a madurar suficientemente, dejando así la puerta abierta a utilizar la vena basílica con una superficialización posterior. Recomendamos la ligadura de la vena perforante antecubital en el mismo acto quirúrgico para evitar la hipertensión venosa y la salida hacia el sistema venoso profundo, que puede restar flujo a las venas superficiales que se van a puncionar en las diálisis.
FAVn con la perforante antecubital o de Gracz
Con la misma filosofía de lo señalado en último lugar y para reducir la posibilidad de robo, se puede realizar la anastomosis entre la arteria humeral o incluso radial proximal con la vena perforante cuando discurre muy próxima a éstas en su unión con las venas del sistema profundo, quedando además protegida de punciones accidentales [31] [32].
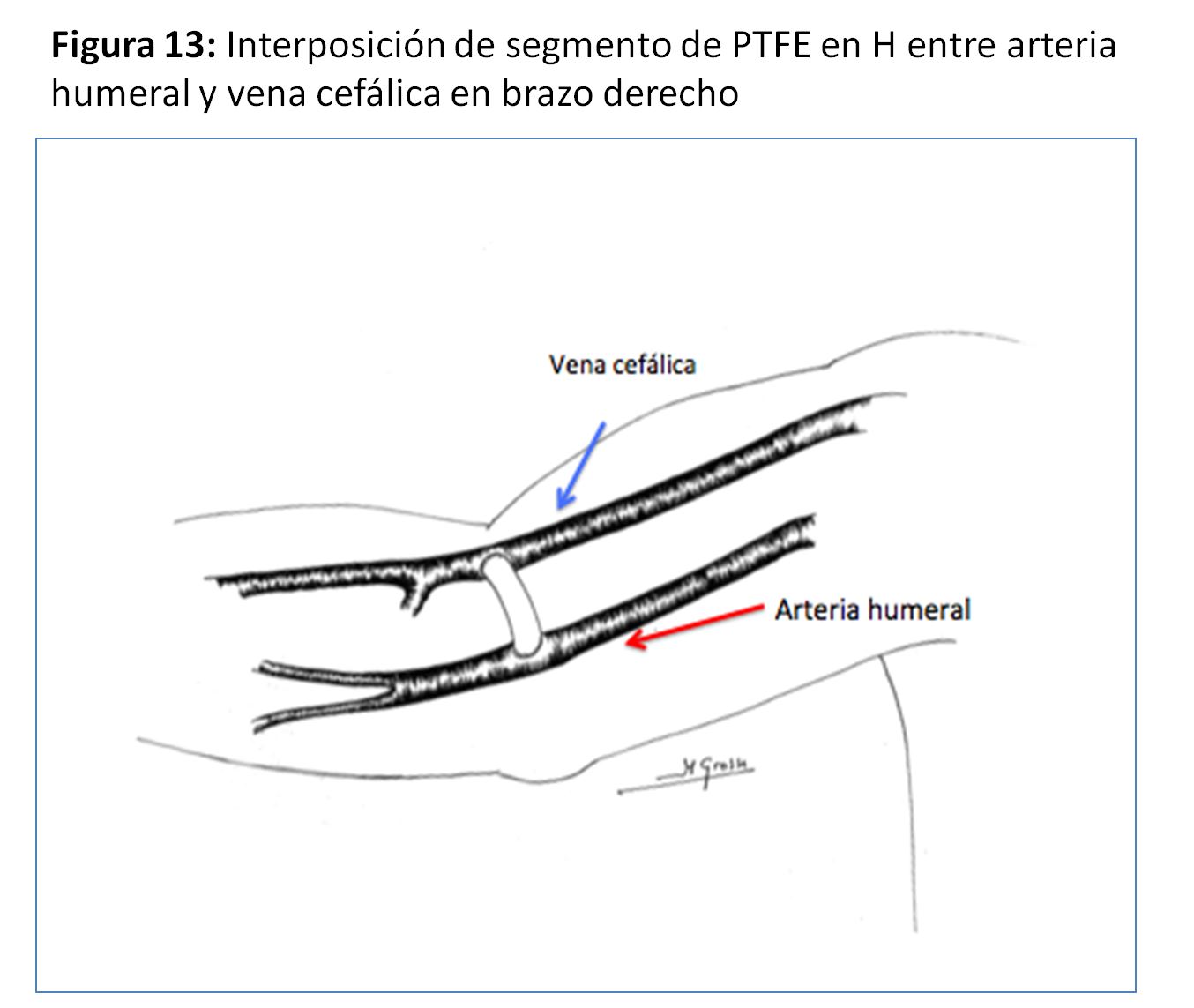
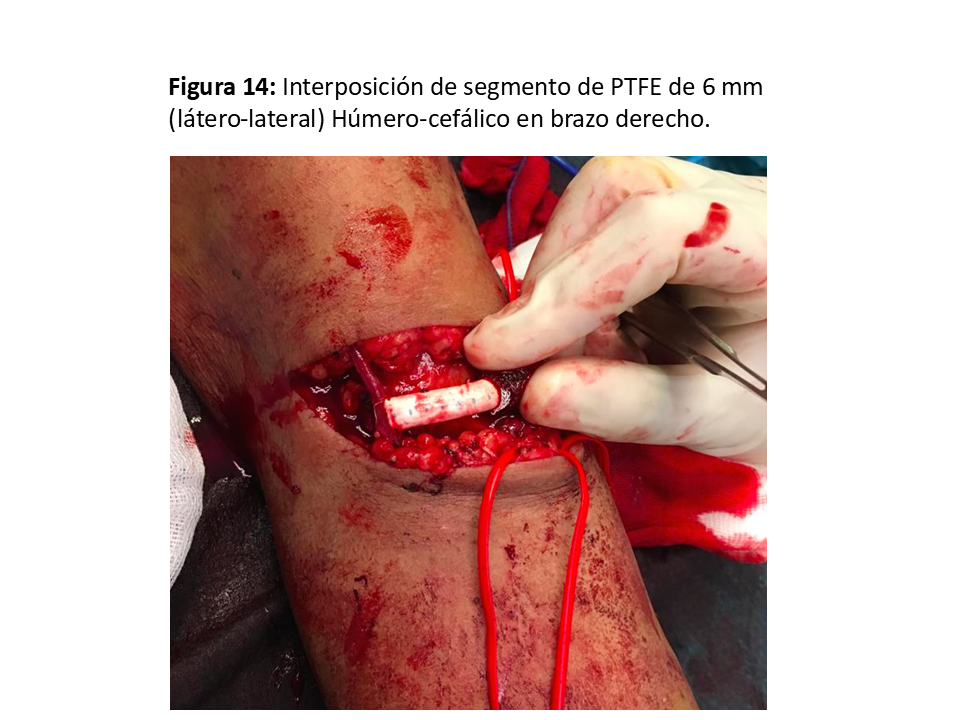
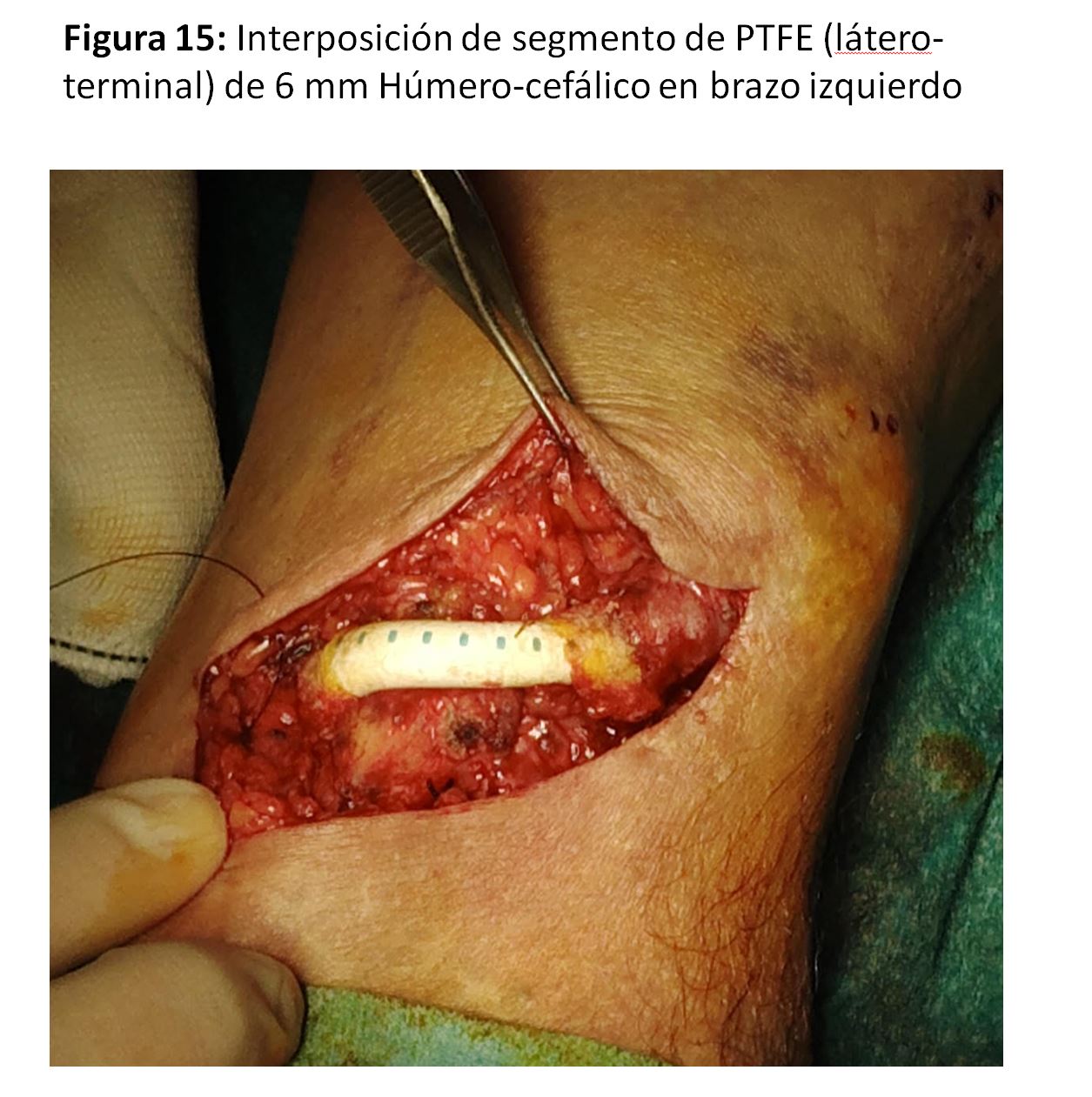
FAVn Humero-cefálica con interposición protésica en "H"
No se podría considerar una FAV protésica en sí porque la prótesis no va a servir para las punciones sino para conectar arteria y vena (Figura 13) cuando están a una distancia que impide su anastomosis directa sin transposiciones complejas. También puede ser una técnica de “rescate” cuando hay complicaciones estenóticas o aneurismáticas yuxtaanastomóticas en una FAVn en codo. Se suele utilizar una prótesis de politetrafluoretileno expandido (PTFE) de 6 mm. (Figura 14) y (Figura 15).
FAVn Humero-basílica
Sería la alternativa a las anteriores antes de plantear el implante de una prótesis [33]. La vena basílica del brazo, al ser una vena profunda, suele estar protegida de venopunciones y tiene un calibre muy importante habitualmente. Además, el curso de la vena basílica es adyacente al paquete vasculonervioso de la extremidad, lo que deja a estas estructuras vulnerables a posibles lesiones por punción durante la diálisis.
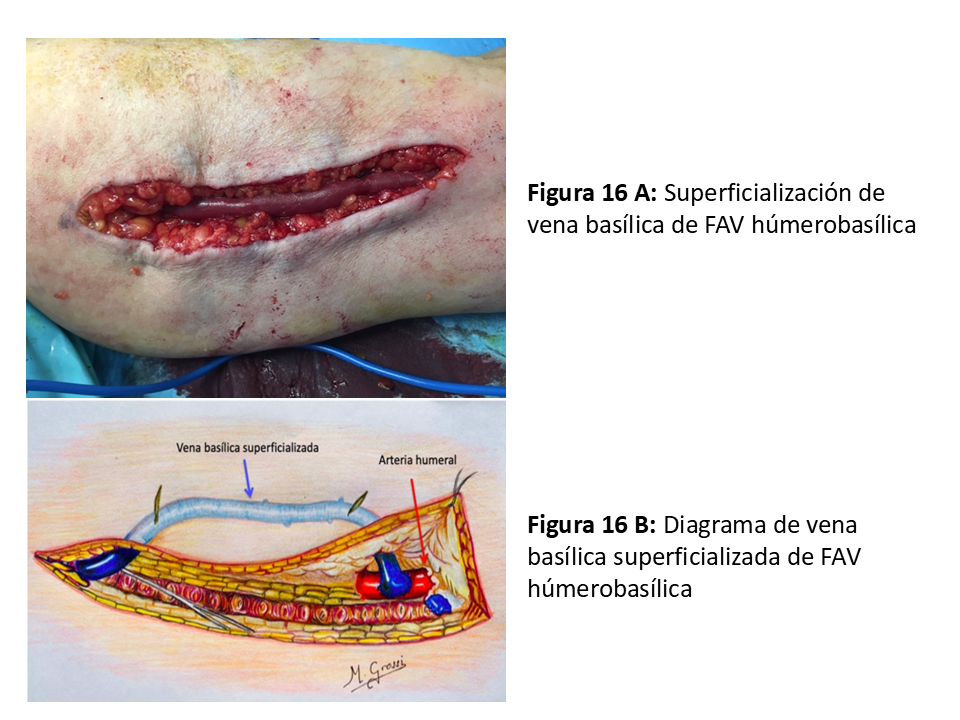
Esta profundidad es la que obliga a su superficialización o transposición para poder puncionarla con facilidad, que se puede hacer en el mismo acto de la anastomosis o en un segundo tiempo pasados 30-90 días [34] (Figura 16) A y B. La desventaja de esta última opción es la necesidad de realizar dos intervenciones quirúrgicas, pero tiene la ventaja de que, si hay fracaso precoz, no se somete a la cirugía traumática de disección extensa de una vena con íntima relación con estructuras nerviosas que muchas veces hay que sacrificar, además de una cicatriz amplia sujeta a complicaciones. Para decidir este tipo de FAV es fundamental que la vena basílica tenga un trayecto mínimo antes de la desembocadura en el sistema venoso profundo (en el tercio medio-superior), se descartan las que tiene un trayecto corto con desembocadura precoz en la vena humeral.
Otras FAVn quirúrgicas en el antebrazo
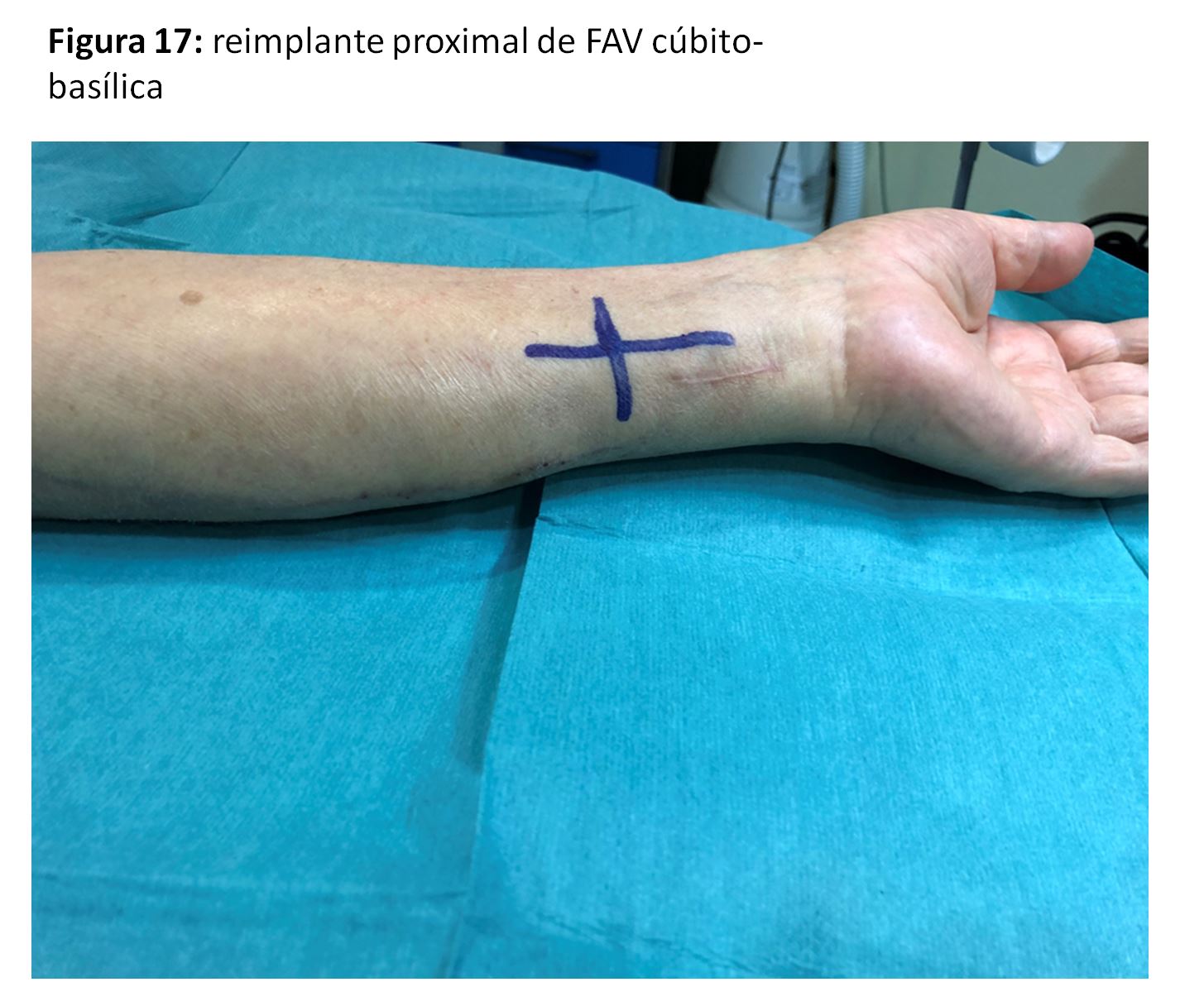
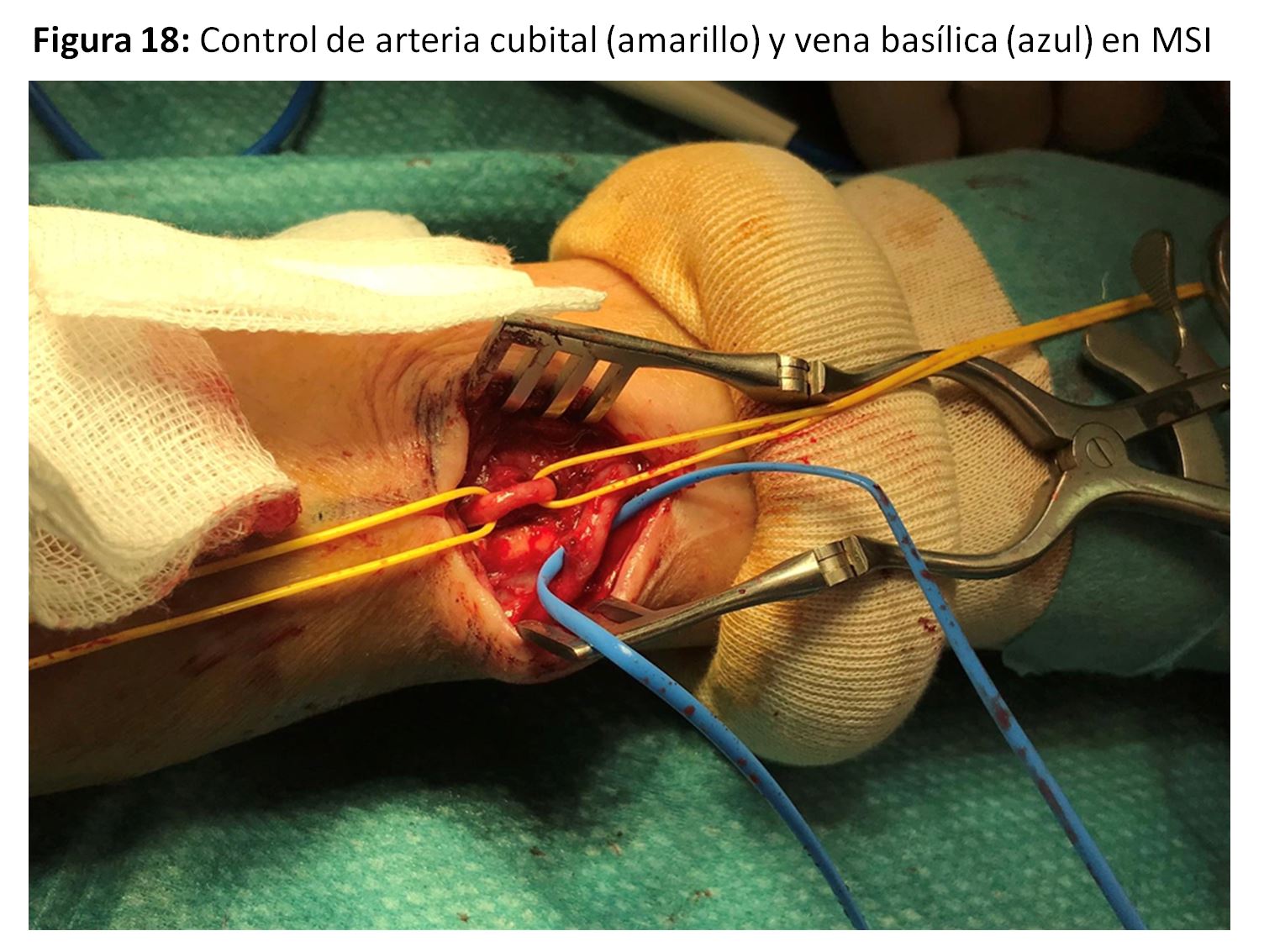
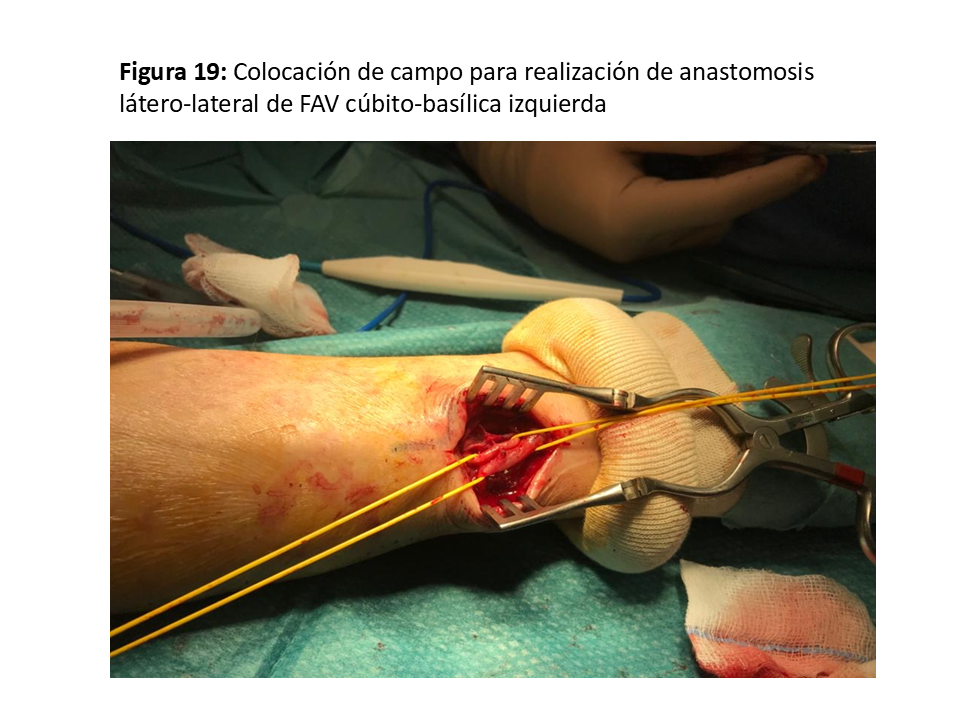
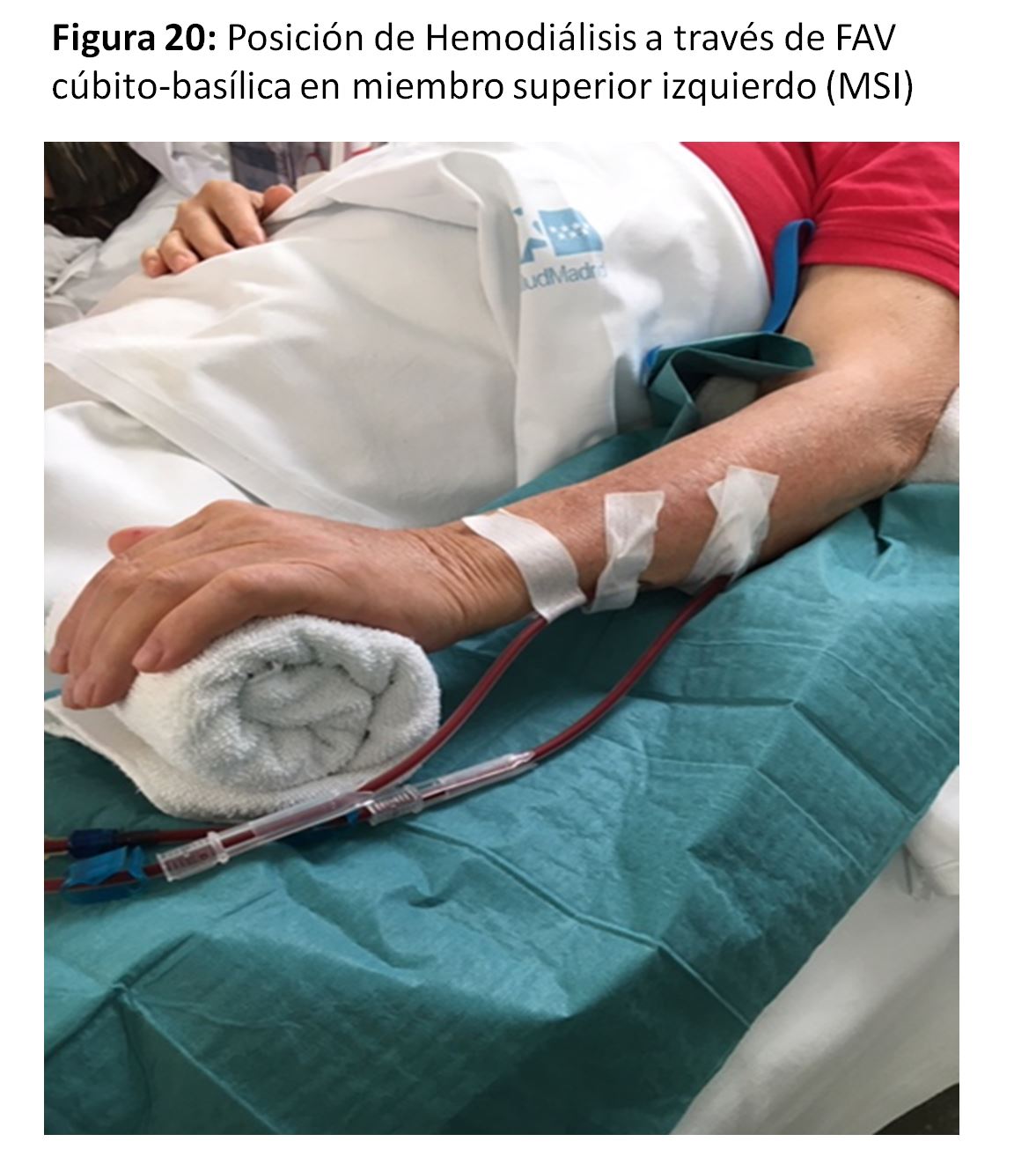
Se trataría de las anastomosis radio-basílicas con transposición venosa o cúbito-basílica directa (Figura 17) (Figura 18) y (Figura 19), con excelentes resultados pero con la dificultad de punción y mantenimiento de las agujas para la hemodiálisis por su trayecto en cara postero-interna del antebrazo [35]. Para paliar esta situación se han descrito soportes que facilitan ambas cosas (Figura 20).
Creación endovascular de FAV
Se han descrito resultados de técnicas de creación de la unión arterio-venosa por un canal provocado de forma endovascular [36] [37]. Una de ellas es el Sistema WavelinQ¿ EndoAVF (actualmente de la compañía Becton & Dickinson) con la reciente innovación de reducción del calibre de 6 a 4 French. Consiste en 2 catéteres con una porción imantada que se introducen uno en arteria y otro en vena de forma percutánea, se unen en la zona elegida y crean el canal con la energía generada por radiofrecuencia. Los requisitos anatómicos para su realización se han encontrado hasta en el 75% de la población estudiada según ha sido descrito por los investigadores. En el estudio multicéntrico NEAT [38] se registró un éxito técnico del 98% y una permeabilidad primaria al primer año del 73%, con complicaciones graves relacionadas con el dispositivo o el procedimiento del 8%.
Otra técnica endovascular aprobada por la FDA es el Sistema Ellipsys [39], que utiliza un solo catéter para establecer la comunicación de la arteria radial proximal con la vena perforante antecubital.
Ambas técnicas crean la FAV a nivel proximal del antebrazo por lo que, si hay posibilidad de realizar una FAVn radio-cefálica quirúrgica distal, esta se debe intentar primero.
FÍSTULA ARTERIO-VENOSA PROTÉSICA
Cuando no existen venas adecuadas en las extremidades superiores, la solución viable y efectiva para conseguir una FAV, es el uso de material protésico [40][41][42]. La conexión entre arteria y vena se hace a través de una prótesis sintética de PTFE [1], que será la que se puncione para conseguir la hemodiálisis. Siempre se propone que cuando se han agotado las posibilidades de FAVn, aunque hay autores que propugnan su creación de entrada en pacientes con esperanza de vida corta (menor de 2 años) o en pacientes que tienen que empezar la hemodiálisis de forma inmediata, como alternativa al CVC, por su disponibilidad en dos semanas o menos si es una prótesis de punción inmediata, con excelente permeabilidad desde el principio y su facilidad de utilización.
Tiene mayor coste económico tanto por el material protésico que se usa como por la necesidad de reintervenciones a lo largo de su vida útil para mantenerlas permeables y utilizables (alta incidencia de trombosis, estenosis en anastomosis venosa, pseudoaneurismas y degeneración de la prótesis por punciones repetidas en la misma zona). Tienen la ventaja de su utilización más precoz, pues no necesitan tiempo de maduración, y fácil punción incluso en pacientes obesos.
Cuando se planea su creación, hay que tener información precisa de la arteria donante (que debes ser de al menos 4 mm de diámetro) y la vena receptora, eligiendo la localización más distal posible de ambas [43]. De esta forma pueden crearse [44]:
FAVp Recta en antebrazo tanto de la forma más habitual de arteria radial a una vena de drenaje en fosa antecubital, como en sentido inverso de arteria humeral a vena cefálica distal si es que se quiere aprovechar la permeabilidad y desarrollo de ésta por una FAVn previa.
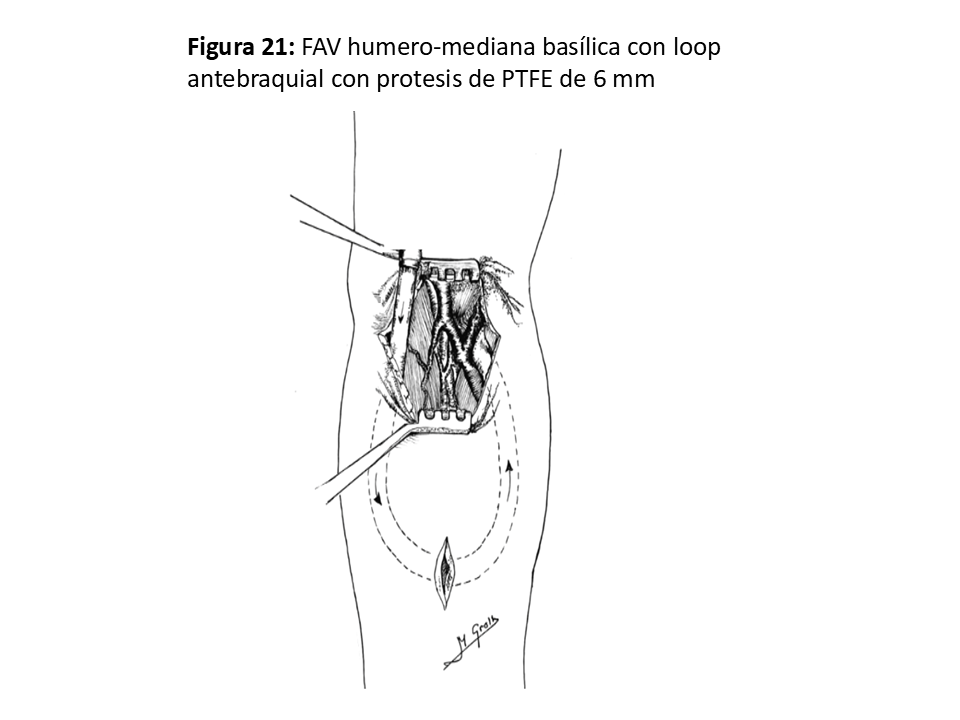
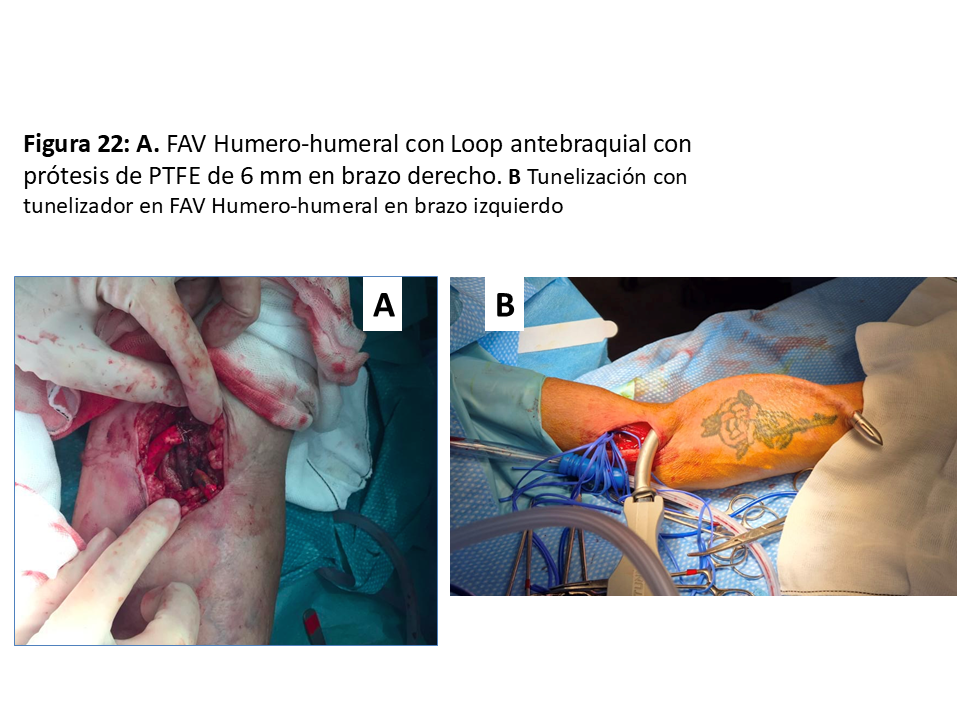
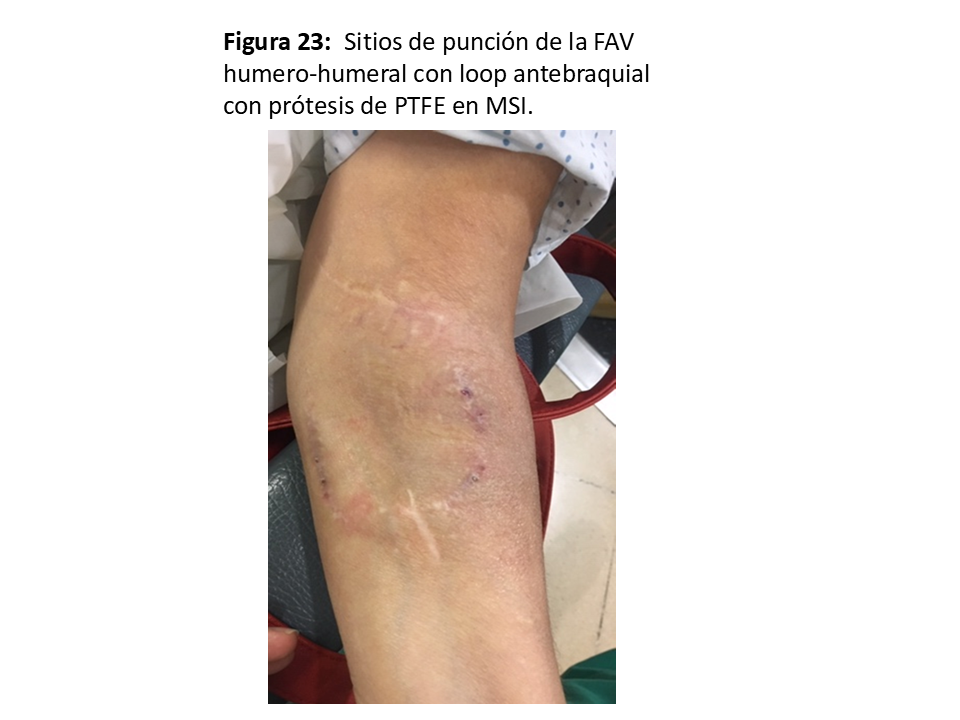
FAVp en "Loop" antebraquial entre arteria humeral (Figura 21), (Figura 22) y (Figura 23) y cualquiera de las venas adecuadas del confluente antecubital. En ocasiones se puede utilizar incluso una de las venas humerales del sistema profundo, ya que suelen estar más desarrolladas cuando las superficiales no lo están.
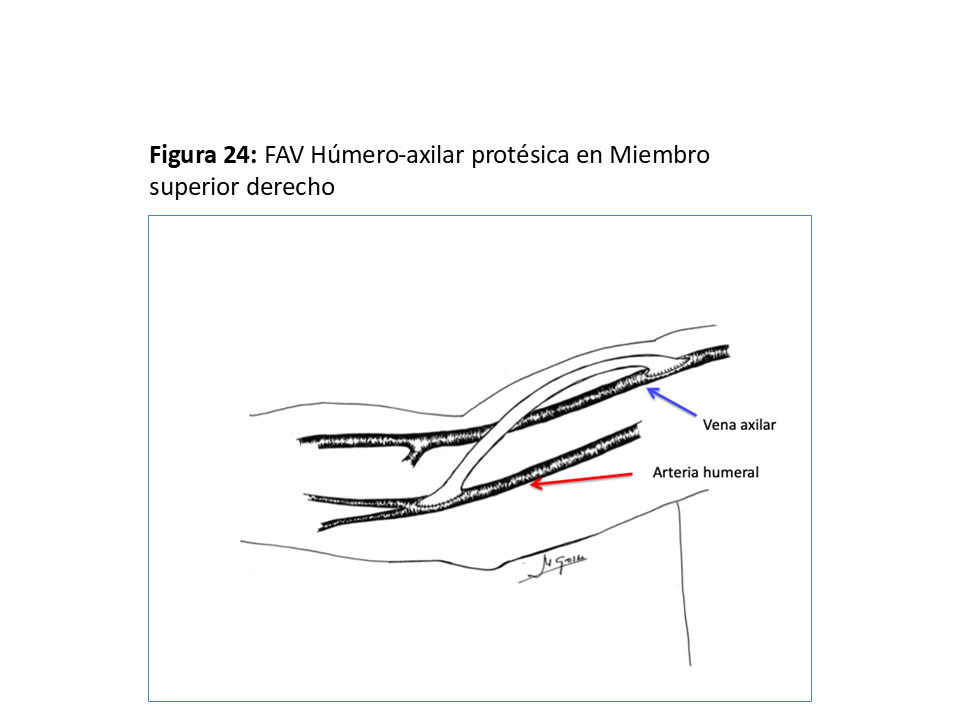
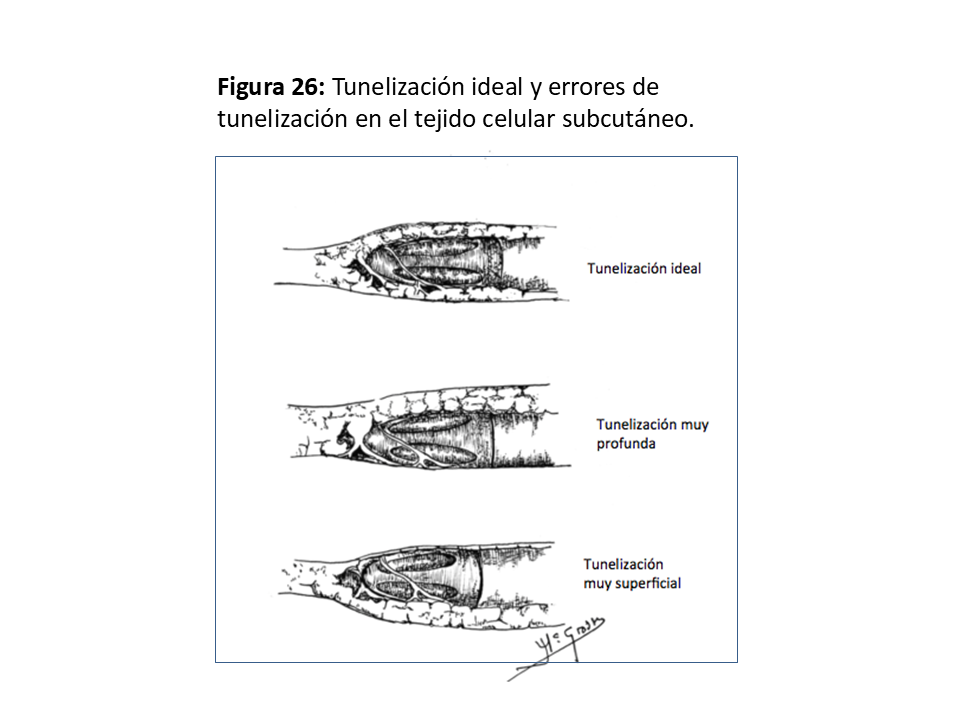
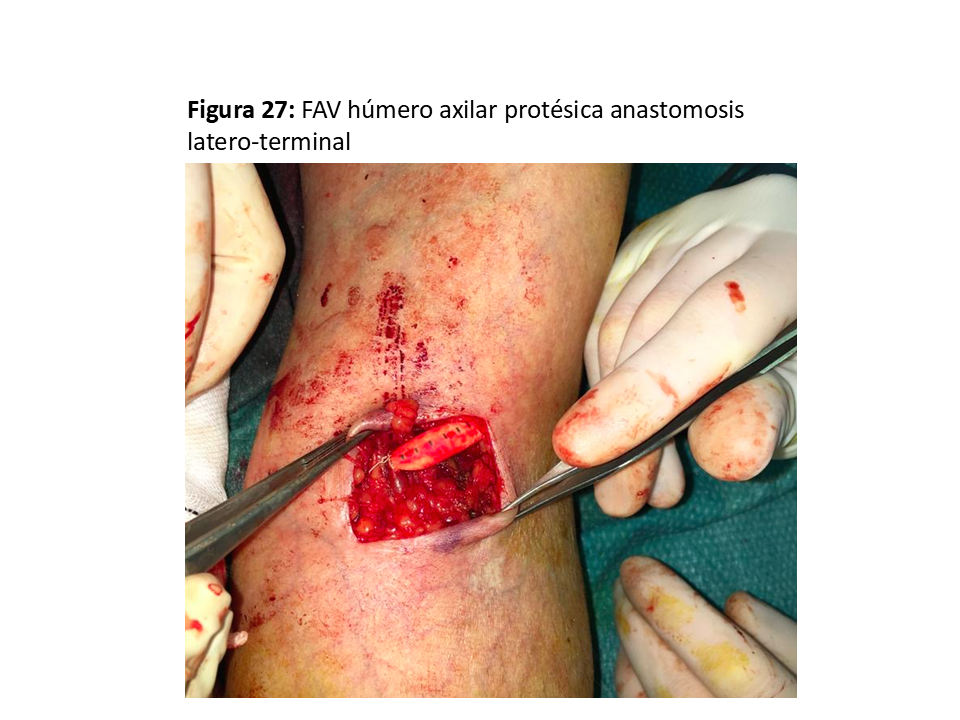
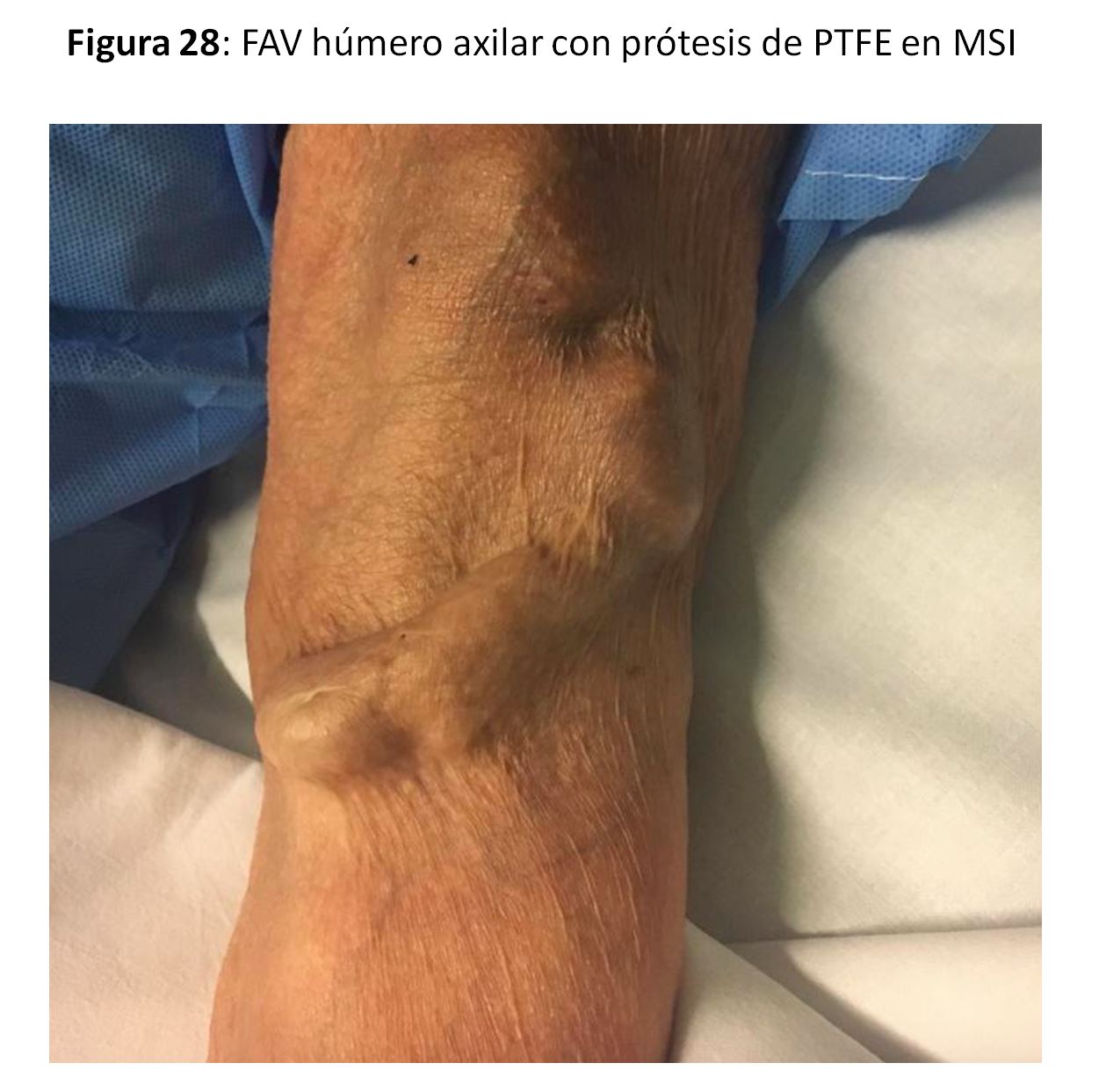
FAVp Húmero-axilar con un trayecto subcutáneo con curvatura de convexidad lo más externa posible para facilitar la punción "en escalera" en un segmento lo suficientemente largo. (Figura 24) (Figura 25) (Figura 26) (Figura 27) y (Figura 28).
Por regla general, la prótesis de PTFE puede empezar a utilizarse a las 2 semanas de su creación lo que, junto a sus otras ventajas descritas antes, nos puede hacer caer en la tentación de realizarlas antes de agotar las posibilidades de FAVn.
FAVp Axilo-axilar en "loop" cuando la arteria Humeral distal no es adecuada.
Otras alternativas protésicas:
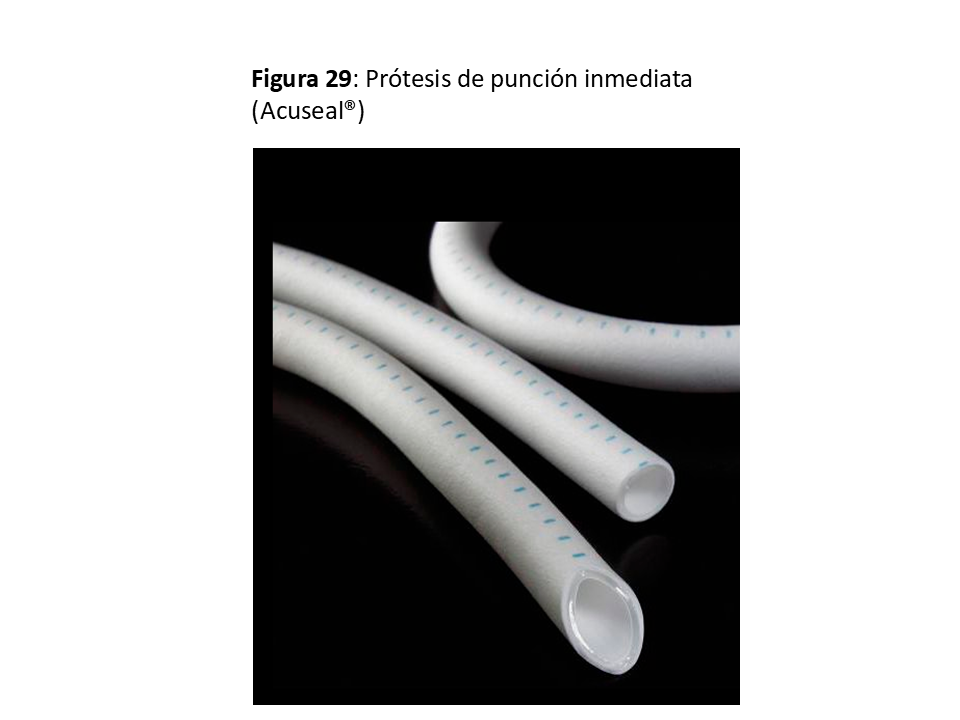
*Prótesis de Punción Inmediata: La más desarrollada consiste en 2 capas de PTFE con otra capa de un elastómero entre ellas. Permite la punción a las 24 h de su implante con una técnica y supervisión especial, con unos resultados similares a las prótesis convencionales [45] (Figura 29).
*Prótesis Biosintéticas: Se fabrican con una matriz de poliéster de forma tubular sobre la que se cultiva colágeno procedente de la oveja, lo que le proporciona mayor resistencia a la infección. Se le atribuye una permeabilidad e índices de complicaciones similares a las prótesis de PTFE [46].
*Dispositivo híbrido prótesis-catéter tunelizado: Su nombre comercial es HeRO (Hemodialysis Reliable Outflow) y estaría indicado en las obstrucciones del sistema venoso central que no posibiliten otros tipos de FAVn o FAVp. La parte de catéter se progresa hasta la vena Cava Superior- Aurícula y se conecta con una prótesis de PTFE que se ha tunelizado y anastomosado a la arteria humeral en codo. Es una técnica compleja y de coste elevado, pero puede ser una alternativa a otras técnicas que calificaremos como “exóticas” o de recurso [47] [48] [49].
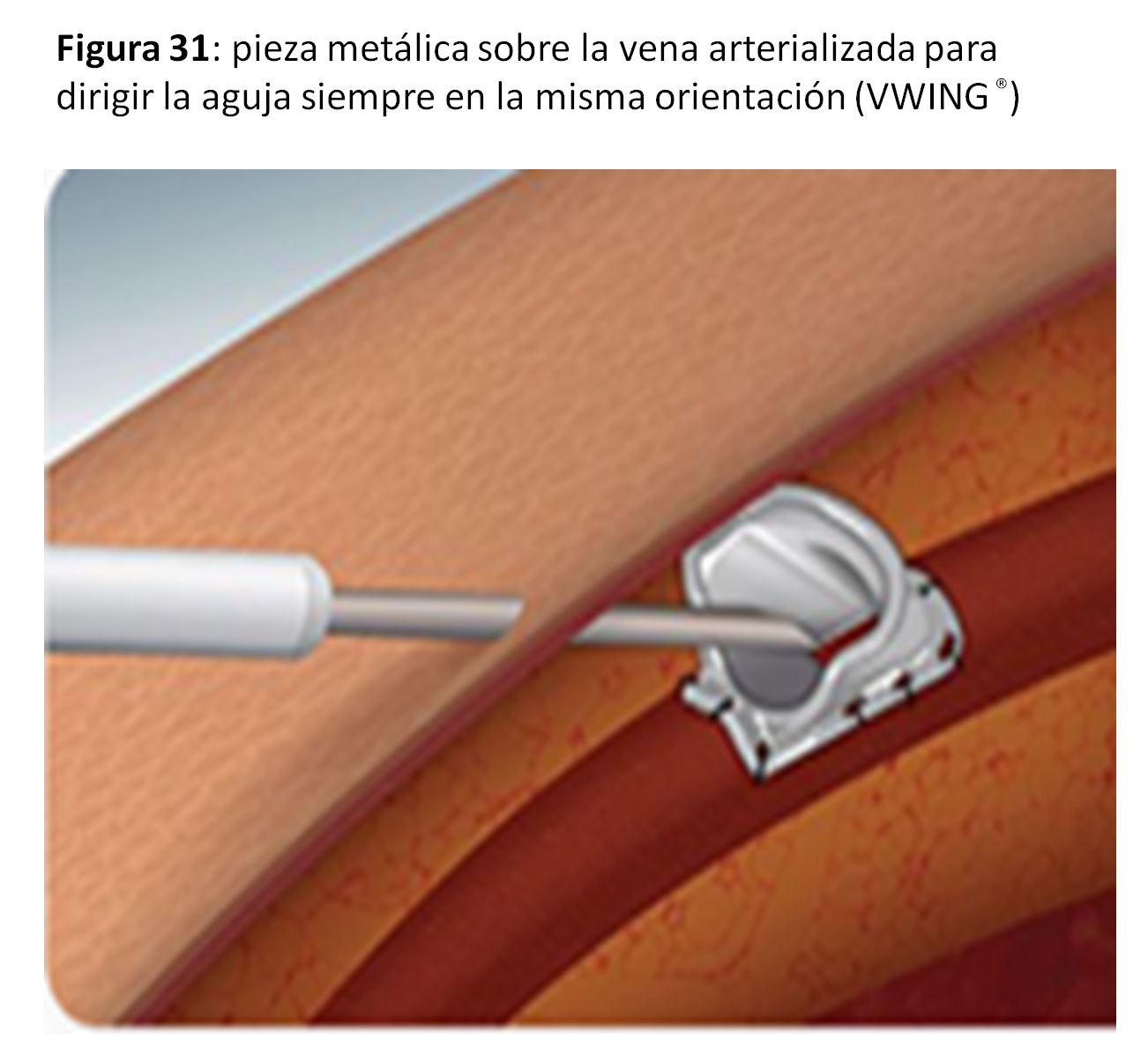
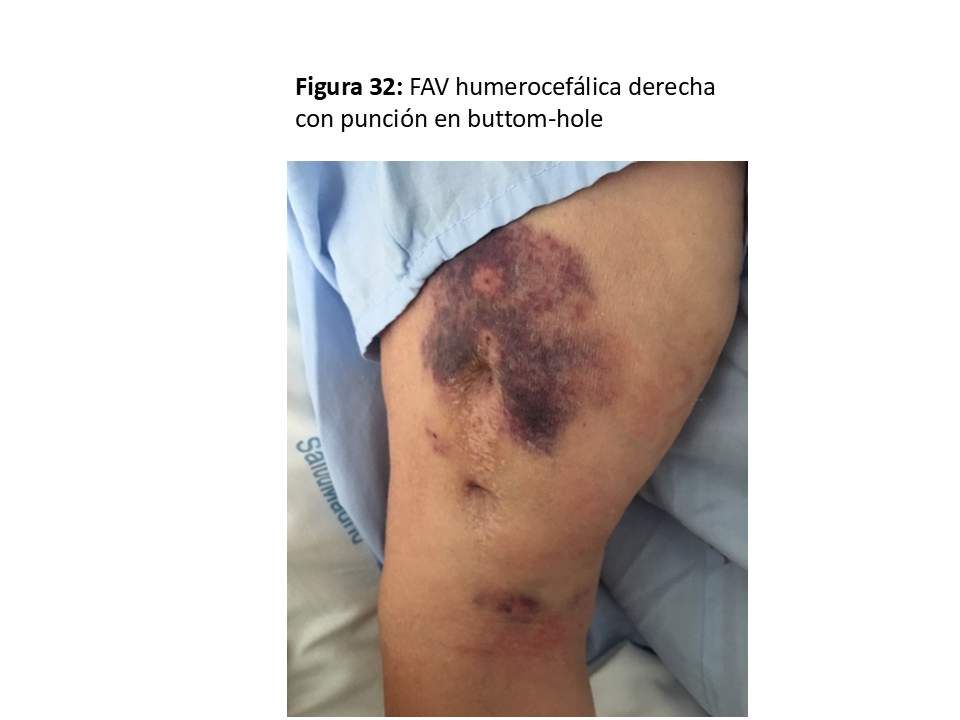
*Se puede considerar más una forma de punción alternativa a la punción en área o escalera, pero la técnica del Buttom-hole [50] [51] [52] la podemos incluir en este apartado porque se puede facilitar con la implantación subcutánea de una pieza metálica sobre la vena arterializada para dirigir la aguja siempre en la misma orientación (VWING®) (Figura 30) (Figura 31) y (Figura 32).
ACCESOS VASCULARES DE RECURSO
Se plantearán cuando se hayan agotado las posibilidades en miembros superiores y se quiere evitar el catéter venoso central permanente por su elevada comorbilidad. En su conjunto suelen ser más complicadas técnicamente, tienen mayores complicaciones operatorias y en su vida útil, además de tener una permeabilidad menor.
FAV en miembros inferiores (MMII):
Se pueden plantear tanto autólogas, usando la vena safena interna (a nivel tibio-safeno o fémoro- safeno) o la vena femoral traspuesta en muslo, como protésicas tipo “Loop” en ingle o rectas en muslo. Tienen unas tasas de permeabilidad aceptables y complicaciones asumibles, siempre que no exista una arteriopatía oclusiva significativa que pueda provocar isquemia en la extremidad por robo [53].
Derivaciones a venas centrales:
Cuando existe una oclusión de la vena axilar sin posibilidad de recuperación quirúrgica o endovascular, se puede “saltar el hombro” con derivaciones directas a vena subclavia o a través de vena yugular interna [54] [55].
Derivaciones a venas de MMII desde la arteria axilar, sea a vena iliaca-femoral como a vena poplítea [56] [57].
FAVp en la pared anterior del tórax:
Se pueden disponer en forma de “loop” axilo-axilar homolateral o de forma recta axilo-axilar cruzado de un lado a otro. Tienen unas permeabilidades similares a las FAVp de miembros superiores, pero sus complicaciones pueden ser más graves por afectar a vasos sanguíneos más profundos y cercanos a estructuras mediastínicas.
Otras alternativas "desesperadas"
Se han descrito derivaciones a la aurícula derecha, derivación fémoro-femoral cruzada, áxilo-renal o áxilo-vena cava inferior, pero todas tienen un carácter excepcional y con pocos casos publicados [58].
No pueden considerarse una FAV, ya que no drenan en una vena sino en arteria, las derivaciones protésicas arterio-arteriales o la superficialización de una arteria para posibilitar su punción. Son evidentes los riesgos de isquemia distal por embolización durante las punciones u originados desde los trombos que se crean para cerrar el orificio de punción o desde las placas de ateroma de la pared arterial.
FÍSTULA ARTERIOVENOSA EN EL ANCIANO
Hay un debate sobre el AV de primera elección en el paciente de edad avanzada, de forma que, ante la elevada tasa de fallo primario de las FAV autólogas en muñeca y dada la limitada expectativa de vida del paciente geriátrico, se discute la conveniencia de priorizar el uso de la FAVp sobre la FAVn, y de la FAVn en brazo sobre la FAVn en muñeca.
La FAVp se plantea a priori como una buena opción en estos pacientes, ya que presenta una baja tasa de fallo primario y acorta de forma drástica el complejo proceso de maduración; el inconveniente de sus peores tasas de permeabilidad y mayor incidencia de complicaciones quedaría minimizado por tratarse de pacientes con baja o muy baja esperanza de vida; por ello se ha incluido en las propuestas de varios autores. Pese a ello, las series en las que se validan son de un número limitado de pacientes, y los trabajos con gran número de pacientes de avanzada edad siguen confirmando los beneficios de la FAVn en todos los grupos de edad con respecto a la FAVp y al CVC, incluso en casos con importantes comorbilidades, con la posible excepción del paciente nonagenario.
Por este motivo, el GEMAV considera intentar lograr una HD a través de una FAVn, incluso en los casos de edad avanzada. Sobre la posibilidad de plantear de entrada el AV en el brazo, la evidencia disponible confirma el peor pronóstico de las FAVn de antebrazo con respecto a la población general; en cambio, es difícil y subjetivo valorar si este hecho justifica una recomendación generalizada en este sentido. En cambio, el GEMAV plantea una valoración cuidadosa del paciente de edad avanzada, mapeo ecográfico incluido, antes de decidir el tipo de FAVn a realizar; se considera que no existe la suficiente evidencia como para poder recomendar la realización de una FAVn en el brazo como primera opción en todos los casos de este grupo, si bien se aconseja de igual manera intentar evitar en la medida de lo posible la realización de FAV de dudosa viabilidad, dada la mayor trascendencia que tiene en este grupo de pacientes la morbimortalidad asociada al fracaso primario del AV y se considera el mapeo ecográfico como la herramienta de mayor utilidad en este sentido.
COMPLICACIONES DE LOS ACCESOS VASCULARES PARA HEMODIÁLISIS
DISFUNCIÓN
Suelen estar causadas por la hiperplasia intimal en la zona yuxtaanastomótica en la FAVn, en la zona vecina a la anastomosis prótesis-vena en FAVp o por la punción repetitiva sobre una zona. Provocan estenosis con la consecuencia de disminución del flujo, recirculación o aumento de la presión venosa de retorno, según dónde se localice.
Ante una estenosis significativa en una FAV disfuncionante se planteará la intervención electiva preferente de la estenosis con la finalidad de evitar la trombosis. Para tratar de forma preventiva una estenosis debe cumplir dos criterios principales (morfológico y/o hemodinámico) y al menos un criterio adicional entre los siguientes [1]:
CRITERIOS PRINCIPALES
Reducción > 50% luz del vaso. Ratio VPS est/VPS pre > 2.
CRITERIOS ADICIONALES
Luz permeable < 2 mm.
Qa Absoluto: < 500 ml/min (FAV) o < 600 ml/min (PTFE) Disminución temporal superior al 20-25% si Qa < 1000 ml/min.
El tratamiento varía según el tipo de estenosis:
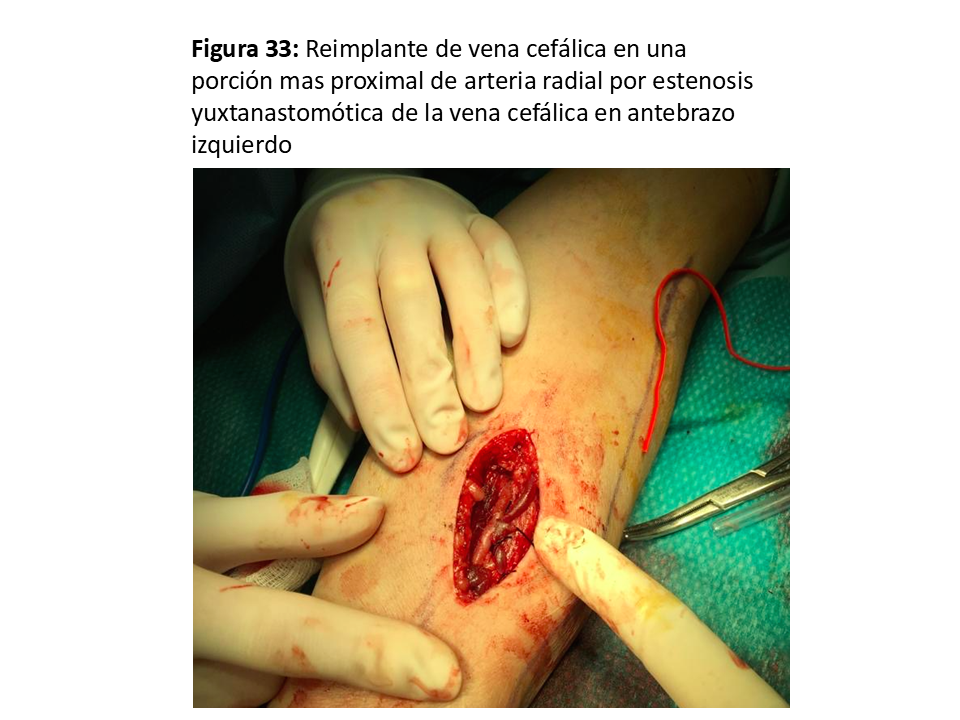
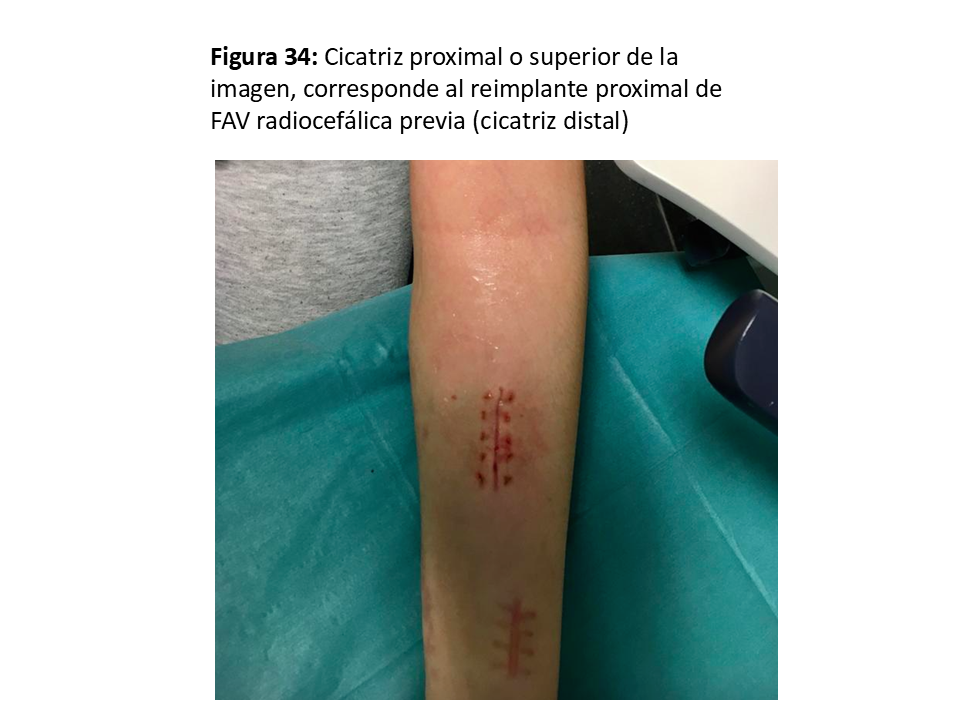
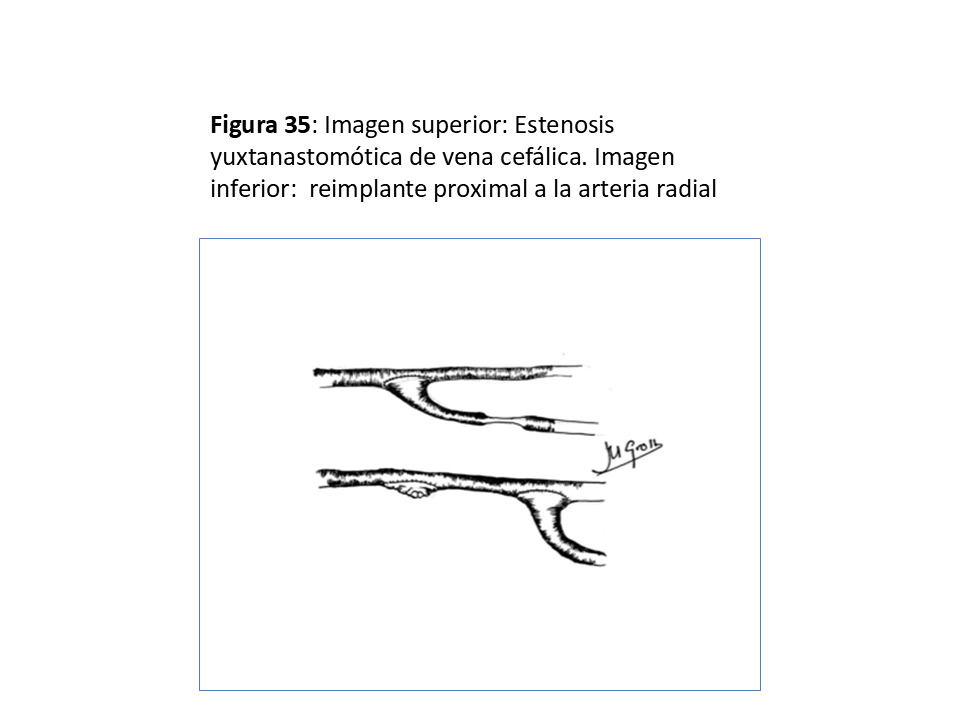
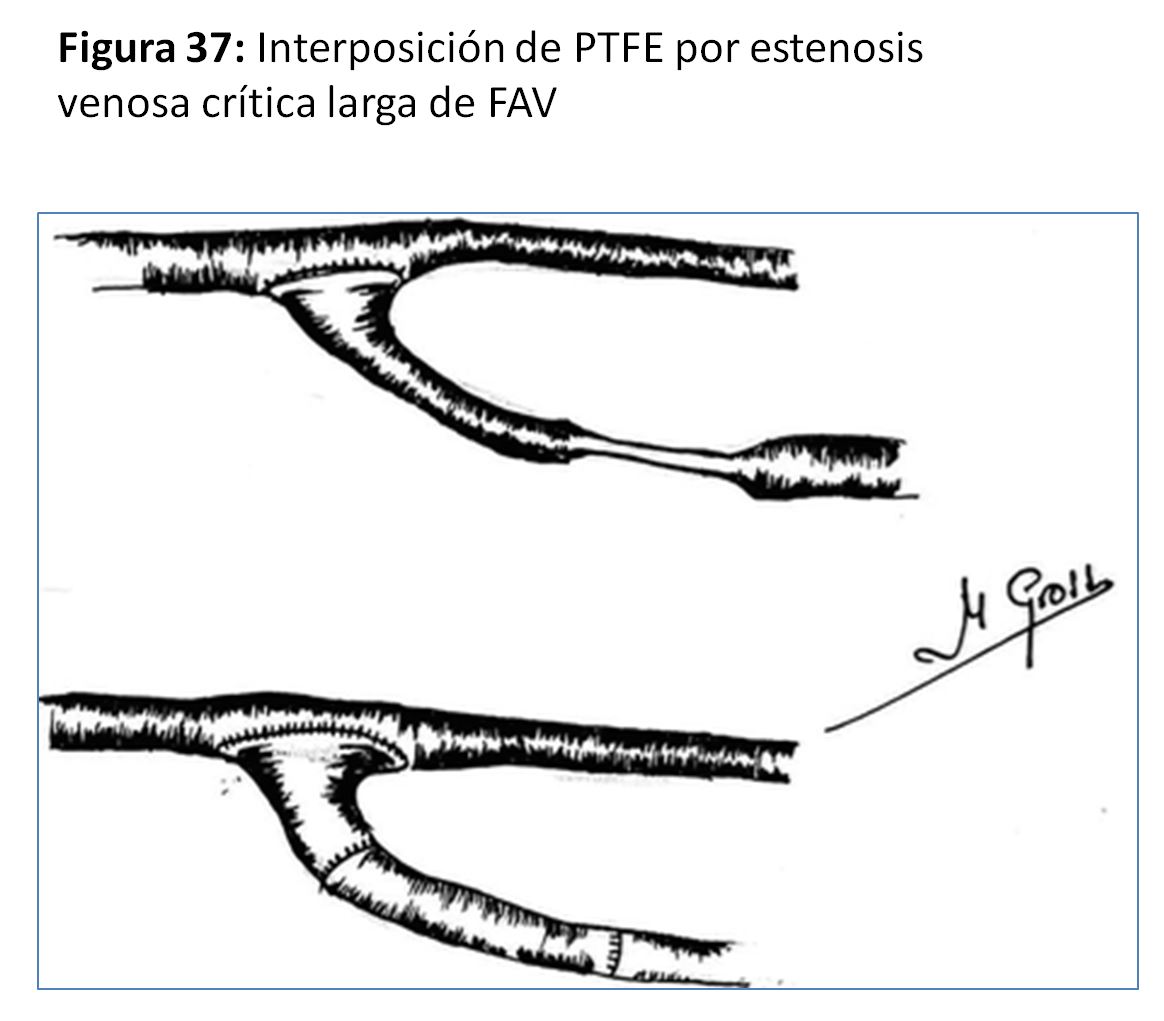
- En las yuxtaanastomóticas de FAVn se suele intentar el reimplante (58) o reanastomosis proximal utilizando vena sana y ya dilatada por el tiempo que ha estado en uso (Figura 33) (Figura 34) (Figura 35) (Figura 36) y (Figura 37).
- En las que se relacionan con la FAVp, se puede intentar inicialmente una angioplastia endovascular, con una duración limitada en el tiempo [60] por recidiva que parece haberse mejorado con el uso de balones de angioplastia de alta presión o con drogas (paclitaxel), así como también implantando endoprótesis tipo stent recubierto o no (recomiendan evitar el uso de stent simple en las guías KDOQI) [5].
En otras ocasiones, es necesaria una extensión proximal en la vena axilar con un segmento corto de prótesis, siempre que no se haya implantado un stent previamente o que sea inaccesible a la incisión quirúrgica axilar.
En caso de estenosis intraprotésicas, la angioplastia endovascular no suele conseguir resultados definitivos y se solucionan mejor con un legrado del interior de la prótesis o sustitución de ese segmento protésico por uno nuevo interpuesto en el antiguo.
TROMBOSIS
ver https://www.nefrologiaaldia.org/es-articulo-trombosis-de-la-fistula-arteriovenosa-601
La trombosis es la principal complicación de la FAV. El principal factor predisponente es la presencia de estenosis venosa, que es responsable del 80-90% de las trombosis. Se produce como consecuencia de la disfunción cuando el flujo se reduce hasta un límite crítico (< 400 ml/min en FAVn o < 600 ml/min en FAVp).
Su tratamiento, que debería ser urgente para posibilitar la HD por dicho acceso y evitar la necesidad de CVC temporal, consiste en la extracción del trombo de forma quirúrgica o su disolución mediante métodos endovasculares (fibrinólisis, trombolisis mecánica, su combinación o con tromboaspiración) [61]. En cualquiera de las dos situaciones, lo ideal sería resolver la causa de la trombosis (generalmente una estenosis crítica) en el mismo acto para evitar retrombosis a corto plazo.
SANGRADO EN LOS LUGARES DE PUNCIÓN
En ausencia de un trastorno de la hemostasia-coagulación, suele ser indicativo de una hipertensión intraacceso por estenosis de la salida venosa. Puede obligar a compresiones prolongadas, uso de hemostáticos locales o incluso la reparación quirúrgica urgente. Ésta se hace inicialmente de forma emergente con un punto cutáneo hemostático, pero suele precisar actuaciones quirúrgicas más definitivas en un segundo tiempo.
INFECCIÓN
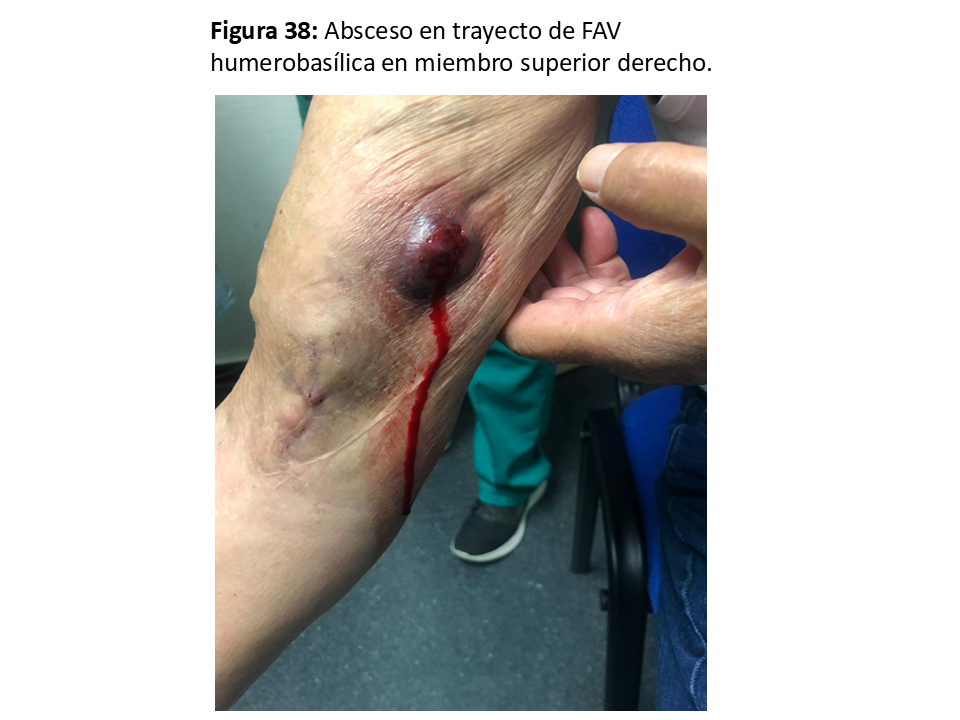
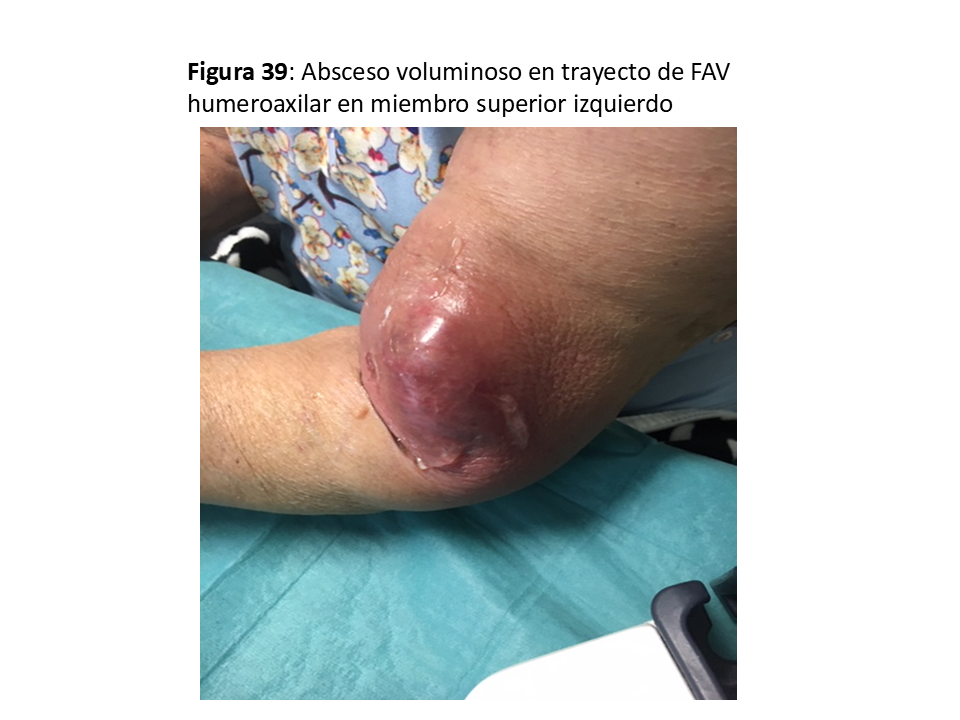
Es excepcional en las FAVn y no suele necesitar actuación quirúrgica excepto que existan embolismos sépticos, que obligarían a su anulación [62] (Figura 38) y (Figura 39).
En las FAVp [63], si aparece de forma inmediata postquirúrgica, obliga a la retirada completa de la prótesis y dejar “descansar” la zona quirúrgica para un intento posterior. En prótesis “antiguas” suele aparecer en un segmento aislado por lo que la solución puede ser su excisión y sustitución parcial por una prótesis tunelizada evitando la zona infectada, que conecte zonas libres de infección
HIPERTENSIÓN VENOSA DISTAL
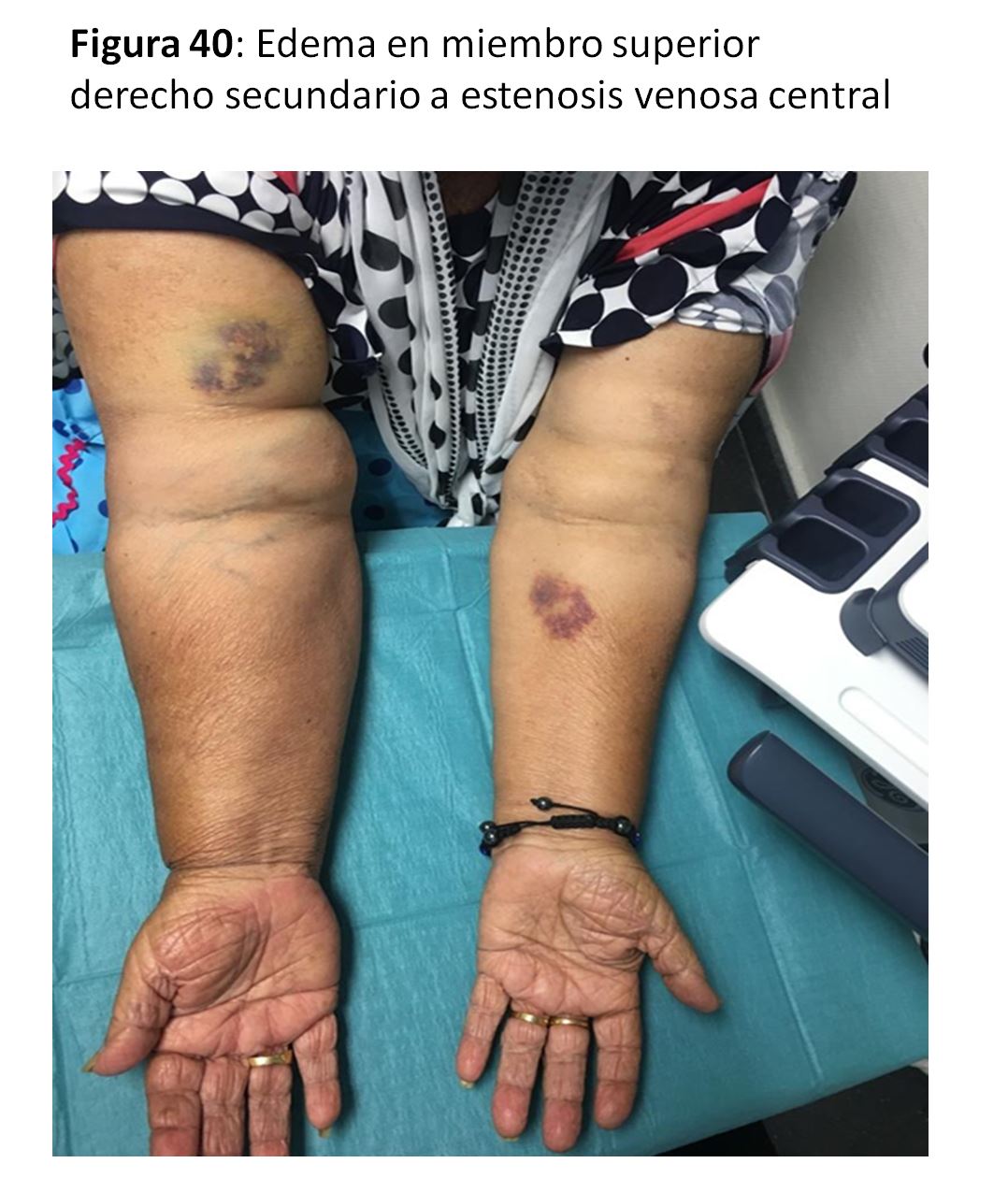
Siempre se debe a una estenosis de las venas de drenaje o de las centrales y provoca edematización (Figura 40), enrojecimiento o cianosis y aumento de la circulación venosa colateral. A veces puede manifestarse con calor local, lo que puede interpretarse erróneamente como una infección. Su tratamiento sería el mismo de una estenosis venosa sea de forma endovascular o con extensiones quirúrgicas a venas más proximales (infraclavicular o en cuello).
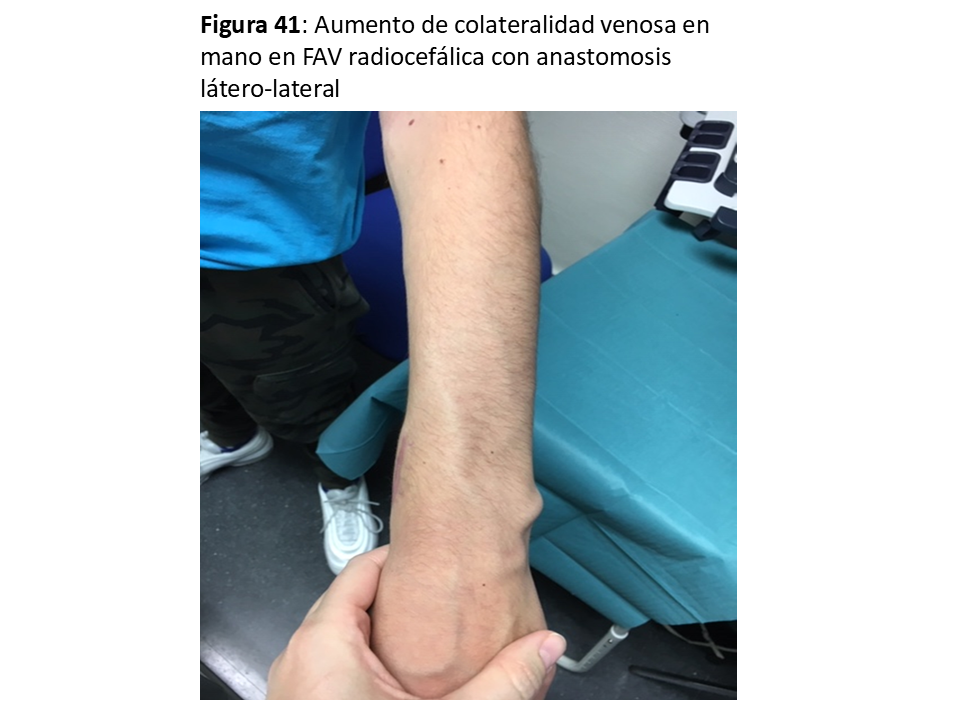
En ocasiones se asocia a FAVn realizadas de forma latero-lateral sin ligadura de la vena distal tanto a nivel de muñeca (Figura 41) como, sobre todo, en codo cuando no se anula la salida por la perforante. Su solución sería la ligadura de las venas con salida distal a la mano. En el caso de precisar su anulación definitiva, podría dar tiempo a la creación y maduración de un AV en la extremidad contralateral.
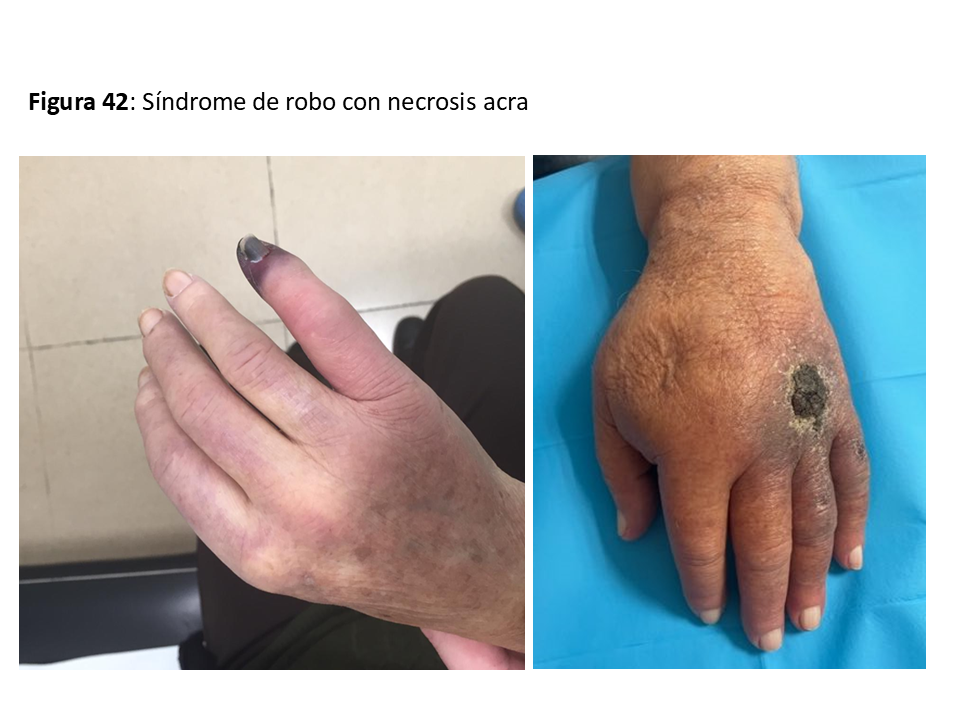
SÍNDROME DE ROBO
Aparece cuando se produce algún grado de isquemia en los tejidos distales al AV, variando desde la simple sensación de frialdad en los dedos de la mano hasta la necrosis isquémica de los mismos [64]. Suele deberse a que la enfermedad aterosclerótica del lecho arterial distal provoca una resistencia al flujo superior que la del AV, por lo que dicho flujo se deriva preferentemente hacia la vena. Otra causa podría ser una estenosis proximal a la arteria donante del AV. En cualquier caso, se previenen en gran medida no haciendo anastomosis muy largas (recomendado < 6 mm en codo) o no utilizando prótesis de diámetro demasiado grande con respecto al de la arteria donante (Figura 42).
Según la causa que se identifique, las soluciones terapéuticas son distintas:
1) En los AV con hiperaflujo: ver https://www.nefrologiaaldia.org/es-articulo-sindrome-de-hiperaflujo-de-la-fistula-arteriovenosa-582
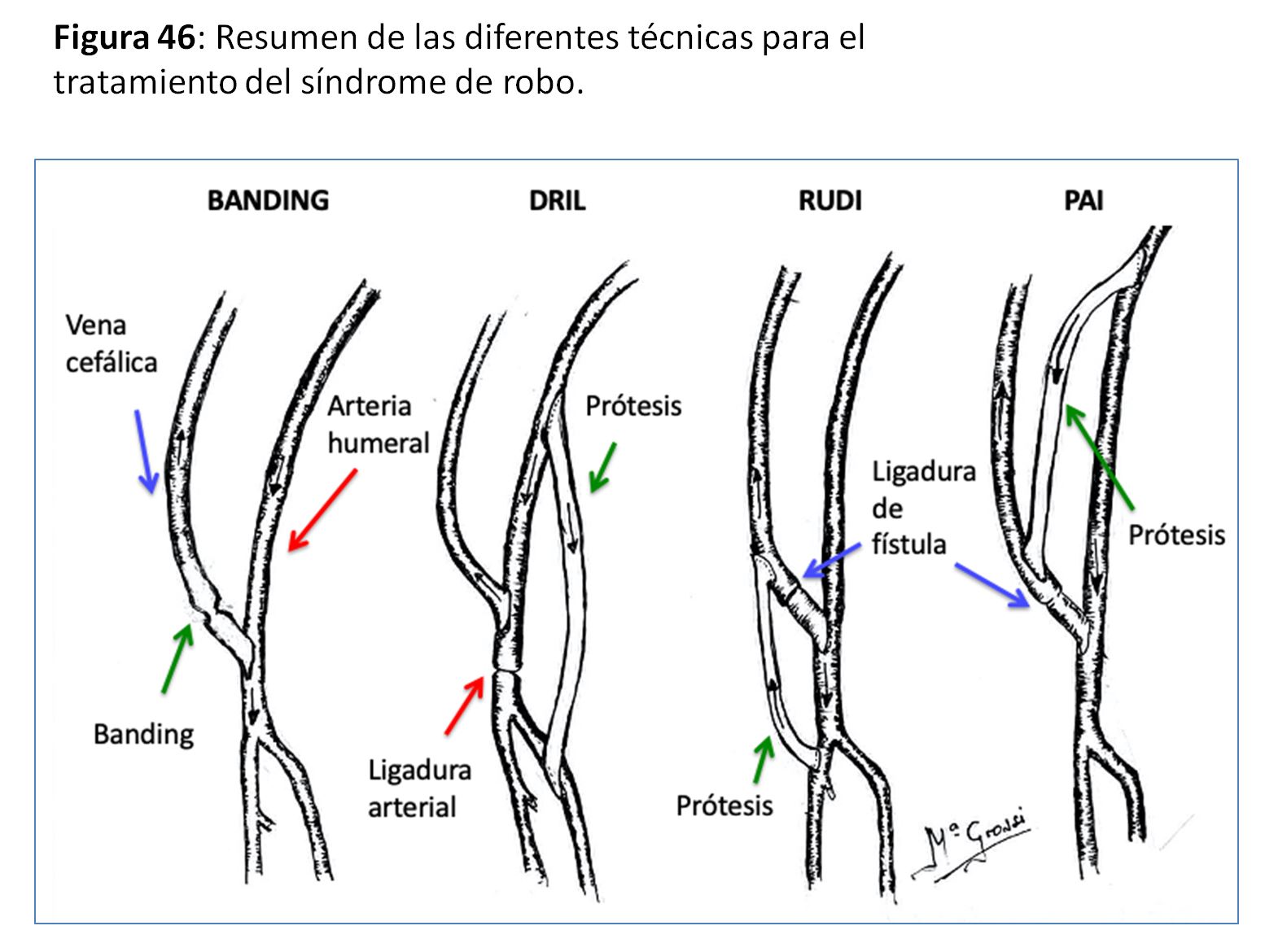
Ligadura distal de la arteria radial si hay buena suplencia de la mano por la arteria cubital (Distal Radial Artery Ligation o DRAL) [65]
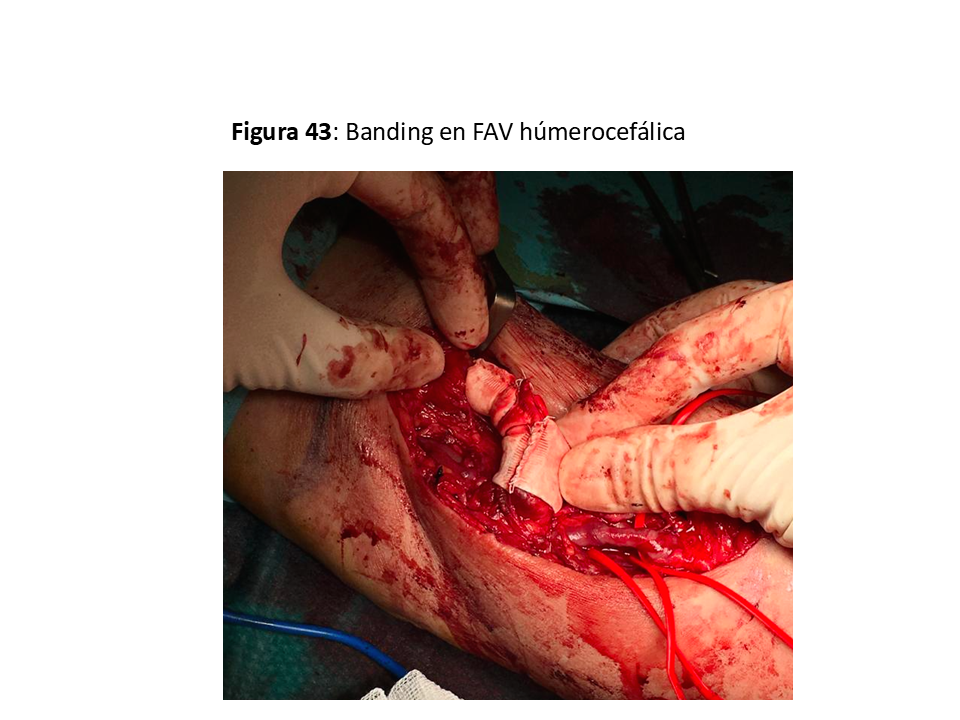
“Banding” de la salida cercana a la anastomosis arterial sea con ligaduras, estrechamientos por suturas o con prótesis reductoras [66] (Figura 43).
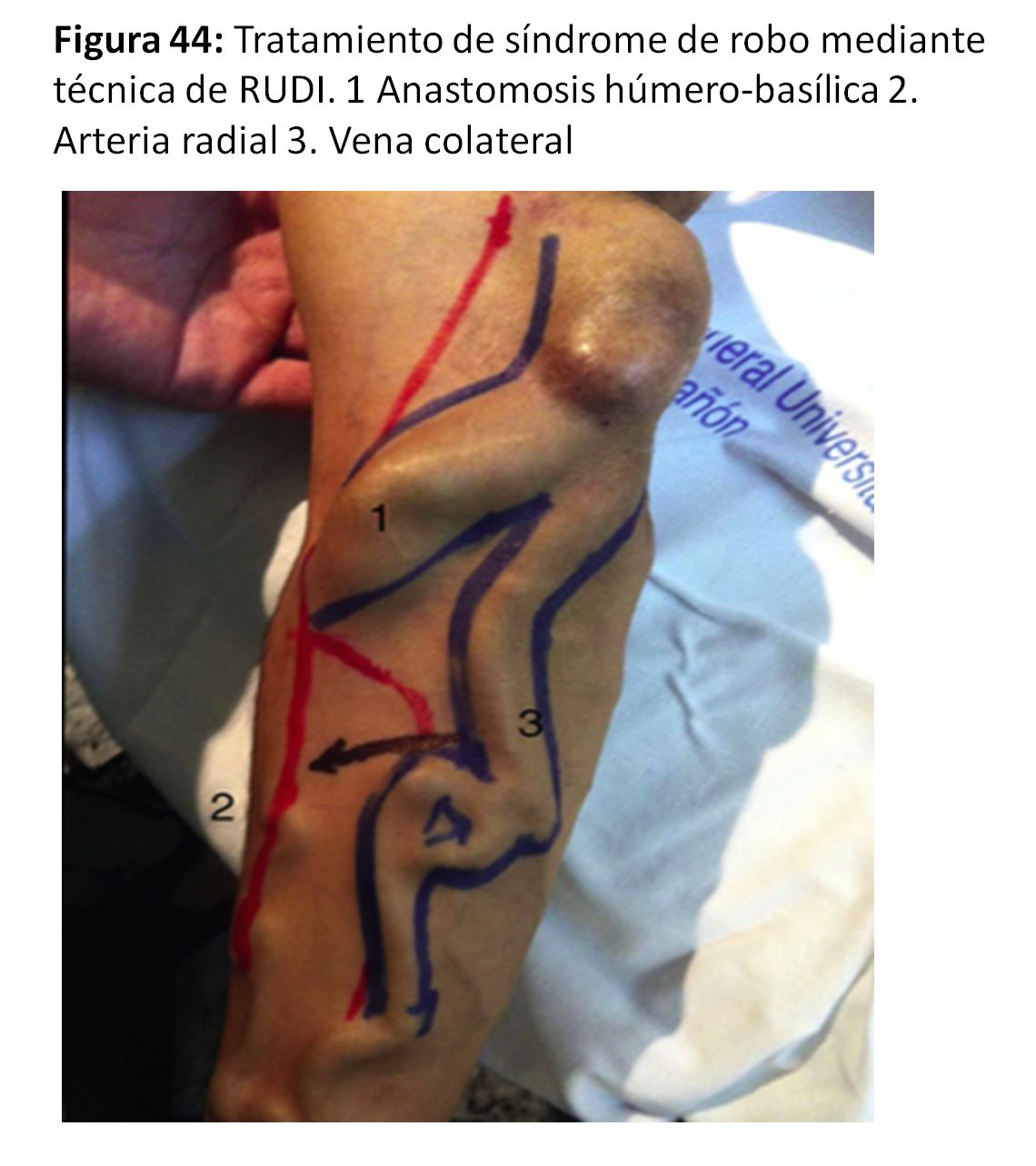
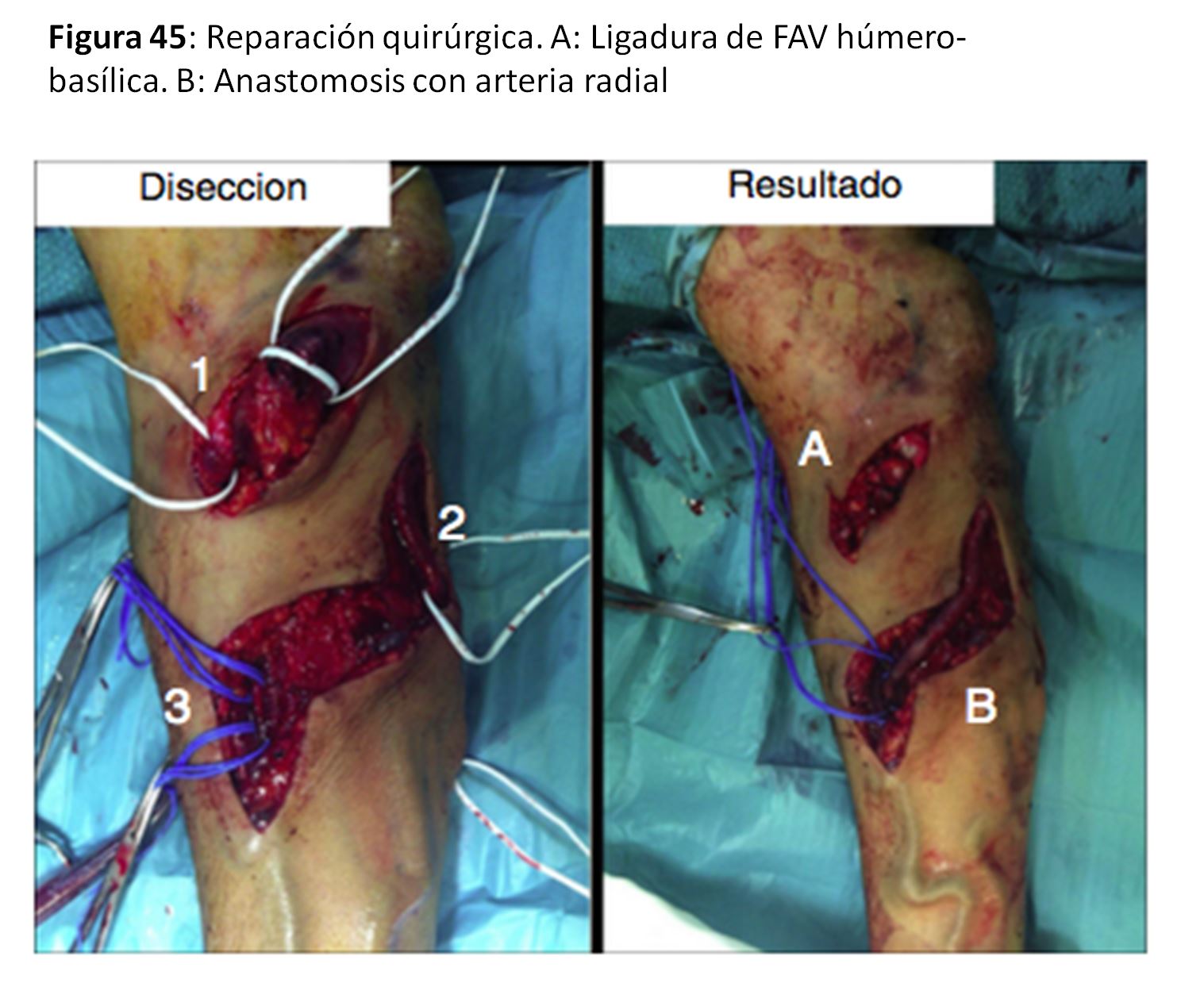
Otra técnica de reducción del flujo del AV sería la extensión distal de la anastomosis (Revision Using Distal Inflow o RUDI) [67] (Figura 44) y (Figura 45).
2) En AV de flujo normal y cuando se trata de una inversión del flujo arterial desde el antebrazo al AV:
Proximalización de la anastomosis arterial mediante un segmento de PTFE, anulando la anastomosis original (PAI). [68]
Revascularización distal con ligadura intermedia (Distal Revascularization and Interval Ligation o DRIL) [69] (Figura 46).
El control del buen resultado de la técnica en el intraoperatorio puede obtenerse con la recuperación del pulso arterial distal al AV o a la mejoría de la pulsioximetría registrada en un dedo. En el postoperatorio el alivio de los síntomas y signos será determinante.
Cuando estas técnicas no son resolutivas o no son realizables, la solución será la anulación del AV de forma definitiva.
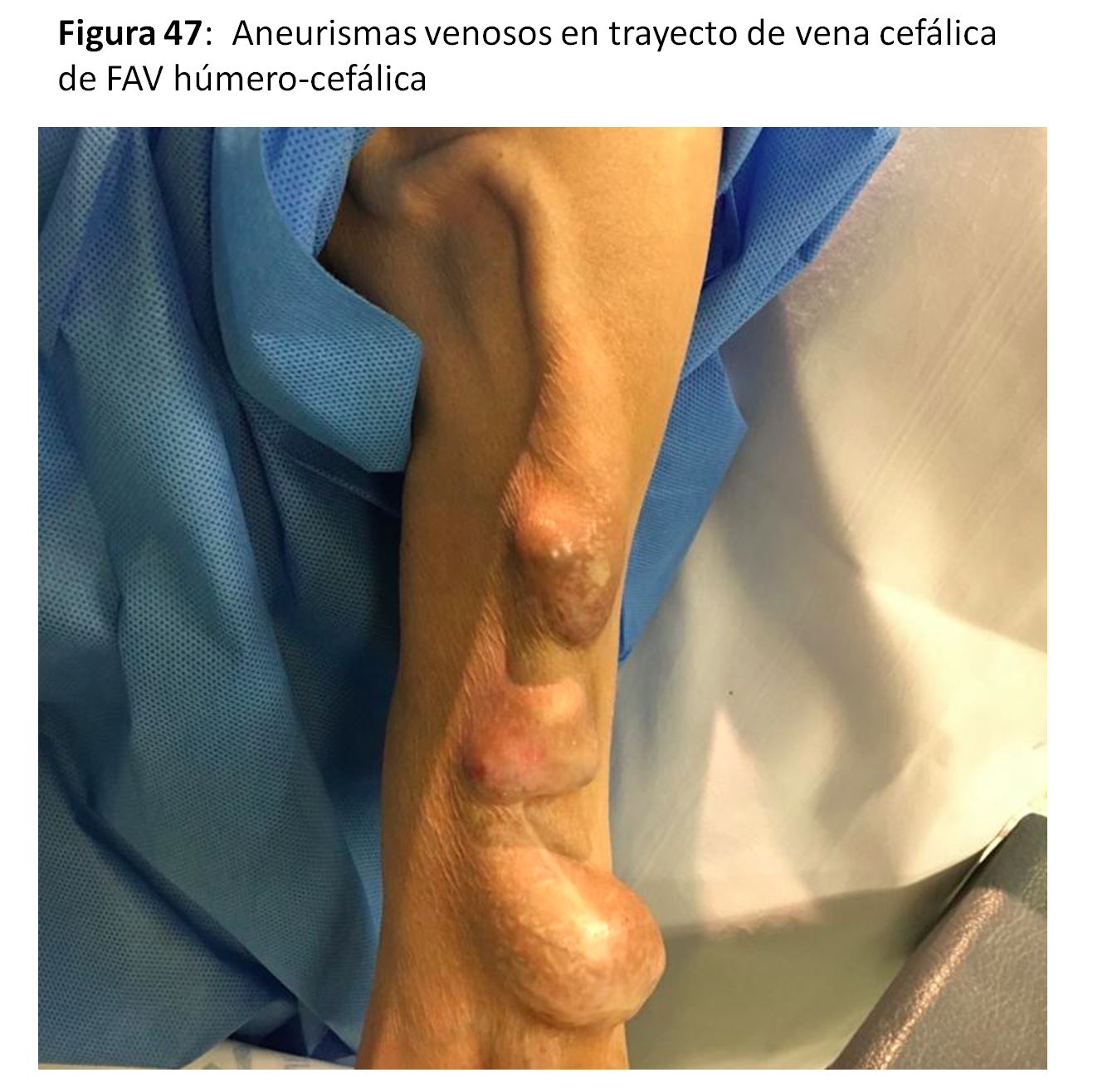
ANEURISMAS VERDADEROS Y PSEUDOANEURISMAS
(Figura 47) (Figura 48) y (Figura 49).
Los aneurismas venosos [70] son frecuentes en los puntos de punción repetitiva cuando se utiliza la técnica de área, al ser más fáciles de canalizar con las agujas. La prevención se hace con la técnica de punción en escalera. Otras veces se asocia a estenosis venosas en los puntos de drenaje sea en el cayado de vena cefálica en hombro o en venas centrales. El tratamiento de estas lesiones estenóticas suele mejorar o detener el crecimiento de estos aneurismas. La reparación quirúrgica se puede hacer frunciendo la vena con una sutura.
En las FAVp, se tratan de pseudoaneurismas ya que no tienen las capas de la arteria ni de la prótesis, sino que se producen por la rotura de la integridad protésica con formación de
hematoma encapsulado. Puede tener causas análogas a las descritas anteriormente y la solución preferente es sustituir el segmento afectado por una nueva prótesis. Si no se demuestra disfunción del AV causante de la dilatación, se recomienda la rotación de las zonas de punción o la punción lateralizada de la prótesis.
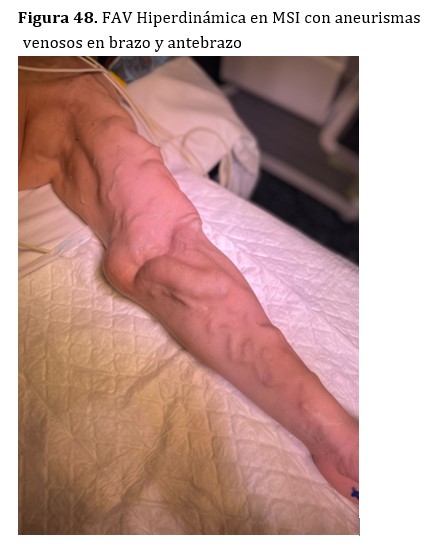
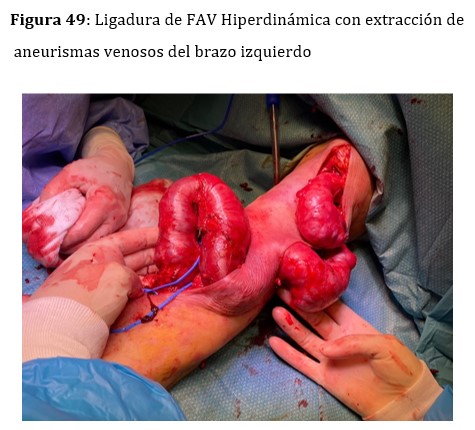
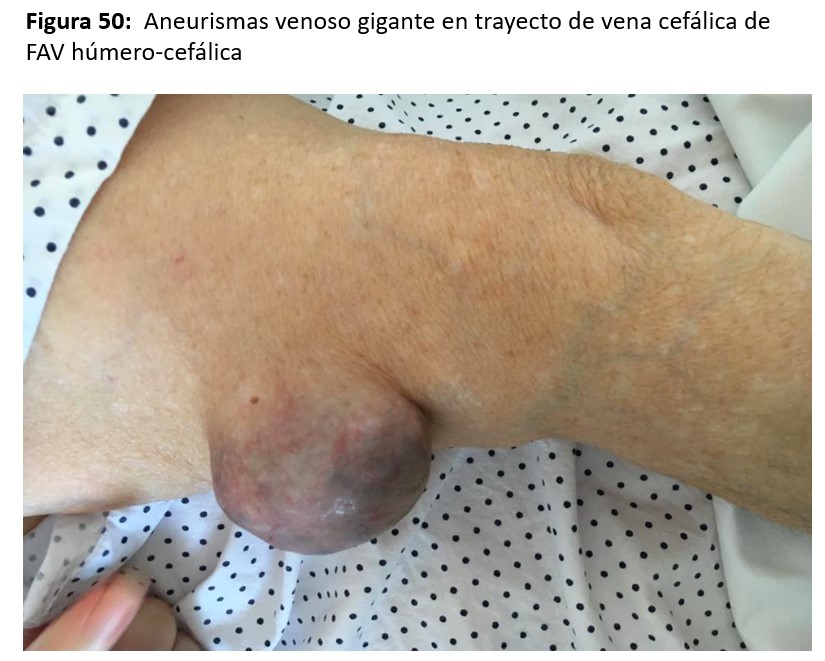
En pacientes trasplantados con injertos normofuncionantes y fistulas hiperdinámicas, los aneurismas venosos suelen crecer y adquirir tamaños considerables (Figura 50). En ciertos casos seleccionados, cuando la FAV hiperdinámica tiene indicación de ligadura, se podrían extraer los aneurismas en el mismo procedimiento de la ligadura de la FAV (Figura 49).
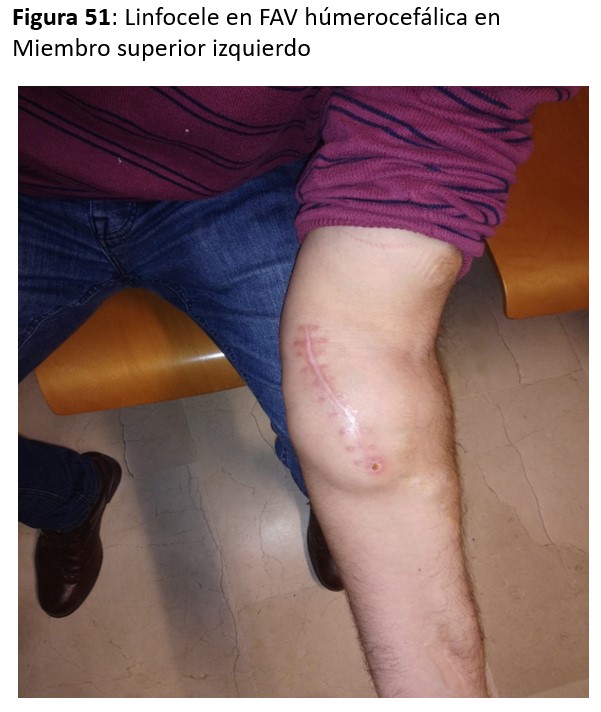
LINFOCELES o COLECCIONES SEROSAS PERIPROTÉSICAS
Son relativamente poco frecuentes (Figura 51) y se deben a la falta de integración de la prótesis de PTFE en el tejido circundante, generalmente vecina a la anastomosis arterial, y requiere la resección del segmento no integrado y sustituirlo por otro tunelizado por otro canal subcutáneo.
INSUFICIENCIA CARDIACA POR ALTO GASTO
El aumento del gasto cardiaco por la existencia de una FAV suele ser bien compensado por el organismo. Cuando los datos y la valoración por parte del cardiólogo aconsejan su resolución [71], se pueden plantear las mismas técnicas descritas para los AV con hiperaflujo y robo, pudiendo llegar a tener que anularlo y optar por el CVC.
TIEMPO MINIMO QUE DEBE PASAR PARA EMPEZAR A UTILIZAR LA FAV
Se recomienda no iniciar la punción antes de las 2 semanas de la creación de la fístula arteriovenosa nativa e individualizar en cada paciente el momento idóneo para efectuar la primera punción.
En cuanto a la FAVp se recomienda iniciar la punción entre las 2 y 4 semanas desde su construcción, excepto en las de punción inmediata.