Accesos Vasculares Percutáneos: Catéteres
Palabras clave
Catéteres tunelizados, Sellado, Inserción catéter, Catétetes venosos
INTRODUCCIÓN
En su último informe, la Sociedad Española de Nefrología señalaba que en 2022 había 29.862 pacientes en diálisis y que el 78,4% de los pacientes incidentes en terapia renal sustitutiva iniciaban su tratamiento con hemodiálisis (HD) [1]. La HD requiere de un acceso vascular para su realización, siendo la fístula arteriovenosa nativa (FAV) de preferencia al catéter venoso, según guías nacionales e internacionales [2] [3]. La utilización del catéter venoso central (CVC) frente a la FAV autóloga o protésica está asociada a un aumento de la morbimortalidad por su alto riesgo de complicaciones infecciosas y trombóticas [4] [5], por lo que las recomendaciones actuales aconsejan una entrada programada en HD con FAV madura en torno al 80%, hecho que como todos sabemos no suele producirse [6] y en muchas ocasiones, debemos utilizar un CVC.
Sin embargo, para los nefrólogos el CVC sigue siendo de gran utilidad para la realización urgente de HD, plasmaféresis o cualquier otra técnica de depuración extracorpórea en ausencia de un acceso vascular mejor, dado que el propio nefrólogo la puede canalizar a pie de cama del enfermo y utilizar de forma inmediata tras su inserción. Por otro lado, existen otras situaciones no urgentes en las que el CVC pueda aportar beneficios: periodo ventana hasta el trasplante renal, previsión de recuperación de función renal, o inicio de diálisis peritoneal, corta expectativa de vida o deseo expreso del paciente.
En los últimos años se ha impuesto el abordaje individualizado del paciente renal, dado que cada vez son más añosos y comórbidos, con una clara disminución del capital venoso disponible, en cuyo caso puede ser más beneficioso el empleo del catéter para HD [7].
Los catéteres venosos centrales se clasifican en no tunelizados o transitorios (para un uso inferior a 2 semanas) y tunelizados o permanentes (cuando se pretende su utilización superior a 2-3 semanas).
CATÉTERES NO TUNELIZADOS
Están indicados cuando el tiempo esperado de utilización es inferior a 2 semanas y tienen la ventaja de que se pueden canalizar a pie de cama con las adecuadas medidas de asepsia.
Los catéteres no tunelizados son útiles para las técnicas de depuración renal continuas o intermitentes en el fracaso renal agudo y en la insuficiencia renal crónica para situaciones de urgencia en ausencia de un acceso definitivo, así como para la realización de plasmaféresis urgentes.
Las características de los catéteres han ido perfeccionándose a lo la largo del tiempo desde 1961, cuando Shaldon describió una alternativa al shunt arteriovenoso de Quinton y Scribner como acceso para HD mediante la canalización percutánea de arteria tibial y vena safena. Dicho acceso ofrecía como principal ventaja un tiempo de canalización menor y mayor durabilidad. En 1963 publicó la doble punción venosa con dos catéteres gemelos de teflón sobre la vena femoral con la punta en cava inferior, evitando así el acceso arterial y, posteriormente el catéter venoso de doble luz.
Las características ideales que debe reunir un catéter temporal son las siguientes:
- Adecuado flujo para realizar una terapia efectiva.
- Suficiente rigidez para no permitir acodamientos que limiten el flujo pero a su vez flexible para no dañar la pared vascular.
- Ser biocompatible y escasamente trombogénico.
- Inserción fácil y segura.
- Escasas complicaciones infecciosas.
Tratando de reunir estas características hay diferentes modelos, realizados en distintos materiales, con longitudes, calibres y terminaciones distintas. Por ello podemos clasificar los catéteres temporales según:
MATERIAL
El material elegido es importante y debe ser biocompatible, con la flexibilidad y rigidez adecuada. Actualmente, se emplean de silicona o poliuretano. Los CVC de teflón, polietileno y polivinilo están en desuso.
- Silicona: Es un material más biocompatible, pero también más fácilmente colonizable y con una rigidez menor por lo que su colocación es más dificultosa.
- Poliuretano: El más utilizado en la actualidad por su adecuada termosensibilidad, lo que implica adecuada rigidez a temperatura ambiente que facilita su canalización, mientras que a temperatura corporal son más flexibles adaptándose a la forma del vaso.
POR SU CONFIGURACIÓN INTERNA
- Luces Concéntricas o Coaxiales.
- Luces Paralelas: en Doble D o Doble O
POR SU CONFIGURACIÓN EXTERNA:
- Rectos: pueden utilizarse en accesos femorales, yugulares y subclavios.
- Curvos: más cómodos para accesos superiores (yugulares o subclavios).
POR SU CALIBRE:
Es un factor importante a la hora de elegir un catéter, ya que el flujo va a venir determinado principalmente por su calibre interno. Es importante matizar que el calibre que consta en un catéter hace referencia a su diámetro total sin tener en cuenta el espesor de la pared: ante 2 catéteres del mismo calibre, aquel que tenga un espesor de pared menor ofrecerá un mayor flujo.
Según los distintos calibres los podríamos clasificar en:
6-8 F: Utilizados en población pediátrica.
11-12 F: Empleados para técnicas habituales, con ellos se consiguen flujos de hasta 250-300cc/h.
13-14 F: Cuando se requieren flujos superiores hasta 400-500 cc/h.
POR SU LONGITUD:
En función del acceso venoso elegido y las características antropométricas del paciente el catéter deberá tener una longitud determinada para alcanzar la posición adecuada: punta en aurícula derecha en accesos yugulares y subclavios, y en vena cava inferior para el acceso femoral. Las longitudes más frecuentemente utilizadas son:
6-8 cm: para población pediátrica.
15-20 cm: Válidos para accesos superiores yugular y subclavios, teniendo en cuanta que los accesos izquierdos requerirán una longitud mayor.
20-25 cm: Para accesos femorales.
POR SU TERMINACIÓN:
Los catéteres no tunelizados, a diferencia de los permanentes, suelen terminar en punta con la luz venosa a unos 2-3 cm de la arterial. En catéteres temporales de mayor calibre (13-14F) la terminación suele ser en cañón de escopeta.
CATÉTERES TUNELIZADOS
Se trata de un CVC que se inserta mediante una técnica de imagen (ecografía y radioscopia de elección, mínimo recomendado con ecografía) y que consta de una porción intravenosa, una porción subcutánea y una externa. Suelen presentar un manguito o cuff de dacron o poliuretano que promueve la reacción fibrótica del tejido subcutáneo a su alrededor, impidiendo la movilización del catéter y la entrada de bacterias. Suelen estar hechos de materiales más flexibles que los temporales, como poliuretano (Figura 1) o carbotano (Figura 2) y pueden ser dobles en su totalidad (por ejemplo el catéter Tesio) (Figura 3) o único con doble luz en su interior (como el Hickman) (Figura 4). Los catéteres varían en tamaño, grosor, número de orificios y longitud, y no requieren de un período de maduración mínimo, aunque es muy conveniente diferir su uso 24 horas tras la implantación para evitar el desplazamiento de la punta.
Actualmente, y dado que una de las principales desventajas de los catéteres es su elevada tasa de infección y trombosis [4] [5], se han desarrollado diversos modelos de catéter recubiertos de sustancias anticoagulantes y con efecto bactericida, como los compuestos de plata o heparina.
La duración de un catéter dependerá de diversos factores, como el diseño del mismo, lugar de inserción (yugular interna derecha > yugular interna izquierda > femoral) y status diabético [8]. En la práctica clínica diaria, es fundamental el correcto manejo y experiencia por parte de enfermería y la educación del paciente.
Indicaciones de los catéteres tunelizados
Se emplean preferentemente en las siguientes circunstancias:
• Inicio de HD sin FAV:
o Ausencia de FAV o en fase de maduración.
o Imposibilidad de realización de una FAV.
o Disfunción de una FAV en espera de solución.
o Contraindicación de FAV por hipertensión pulmonar grave o insuficiencia cardíaca con derivación (shunt) [9].
o Previsión de período corto de HD: receptor de trasplante renal de vivo o corta expectativa de vida.
• Inicio no programado o urgente de diálisis peritoneal:
o Ausencia de catéter o en fase de maduración.
o Descanso peritoneal.
o Paso urgente a HD (peritonitis refractaria o tunelitis con retirada de catéter).
• Tratamiento con plasmaféresis durante más de 3 semanas.
• Deseo expreso del paciente.
Medidas de mantenimiento
• Los catéteres no deben ser manipulados por personal no especializado ni deben utilizarse para nada diferente a las conexiones para HD.
• Las maniobras de conexión y desconexión deben realizarse bajo medidas universales y estrictas de asepsia.
• El orificio de salida debe recibir curas una vez por semana, evitando lesionar la piel con curas excesivas, y cubrirse con un apósito que impida la maceración de la piel. Los extremos del catéter deben cubrirse con un apósito diferente acolchado para evitar tracciones.
• Como antiséptico es recomendable la clorhexidina al 2%, ya que la povidona yodada puede ser perjudicial para el catéter y llegar incluso a corroerlo hasta su rotura.
• Debe cambiarse el apósito cuando se humedezca, suelte o ensucie. Se cambiará con más frecuencia en aquellos pacientes que suden profusamente.
• No es conveniente sumergir el catéter en agua. Se recomienda proteger el catéter y la conexión con un recubrimiento impermeable durante la ducha.
• No deben aplicarse solventes orgánicos (acetona o éter) en la piel para el cambio de apósitos, ni colocar tiras autoadhesivas estériles en el punto cutáneo de inserción.
• Se aconseja el empleo de tapones de un solo uso, con rosca de seguridad.
• Cada unidad de HD debe llevar un registro de complicaciones de los catéteres y contar con un protocolo de actuación ante las posibles complicaciones.
Sellado del catéter
La necesidad de un catéter duradero en el tiempo, sin complicaciones trombóticas o infecciosas, ha planteado el uso de múltiples soluciones de sellado del mismo sin existir, hasta la fecha, un protocolo definitivo. Las guías españolas del acceso vascular recomiendan que el sellado del catéter se realice con heparina, citrato o activador tisular del plasminógeno alternado con heparina [3]. Una revisión sistemática reciente compara los siguientes métodos de sellado: heparina 5000 UI/ml, heparina a dosis baja (500-2500 UI/ml), citrato, urokinasa, antibiótico + EDTA o citrato. Los autores plantean que, ponderando los riesgos hemorrágicos frente a la disminución de eventos infecciosos, la mejor opción sería la combinación de dosis bajas de heparina en asociación con antibiótico [10].
Otro meta análisis reciente que incluyó 13 estudios objetivó que parece existir reducción del riesgo de infección empleando soluciones antibióticas asociadas a anticoagulación, sobre todo gentamicina + citrato, aunque las resistencias eran un inconveniente a tener en cuenta. La gran heterogeneidad en cuanto a soluciones en estos estudios impidió establecer un protocolo unificado en cuanto a principio activo a emplear y dosis [11].
El sellado de los CVC tunelizado con taurolidina en combinación con heparina o urokinasa ha mostrado eficacia frente al biofilm bacteriano y como profilaxis de la bacteriemia asociada a infección de CVC. EL uso de taurolidina ofrece como ventaja una disminución en la creación de resistencias antibióticas, debido a un mayor efecto antiséptico que antibiótico [3]. A pesar de ser un fármaco prometedor, su uso no está muy extendido aún. La pauta de sellado con taurolidina que recomienda el fabricante es la siguiente:
• Cebado del catéter con la cantidad exacta en cada línea para evitar entrada de taurolidina en el torrente sanguíneo. Se debe reconstituir el vial de TauroLock-U25.000™ (TauroPharm GmbH, Germany) 5 ml, que contiene Taurolidina + 4% citrato + 25.000 IU urokinasa y cebar ambas líneas. Es importante que la urokinasa se reconstituya inmediatamente antes del sellado, ya que su vida media es de 16 minutos. Pueden usarse otras presentaciones que incluyen heparina en lugar de urokinasa.
En nuestra Unidad de HD, la tasa de infección de los catéteres es de 0.13 enfermos/año (0.011 enfermos/mes) y el sellado del catéter se realiza con urokinasa tras cada sesión. El protocolo es el siguiente:
• Pinzar las ramas del catéter y desconectar las líneas.
• Desinfectar la zona de conexión clorhexidina: Cristalmina® (Gluconato de clorhexidina al 1%) o Hibitane®, en gasa estéril (sólo en casos excepcionales usaremos povidona yodada o agua oxigenada como alternativa). No utilizar alcohol ni acetona por riesgo de rotura.
• Cargar dos jeringas de 10 ml con suero fisiológico y conectarlas a las ramas del catéter. Despinzar e introducir el contenido de la jeringa en cada rama. Pinzar nuevamente las ramas del catéter.
• Coger dos jeringas precargadas con 3 ml de urokinasa (2000 UI/ml) e inyectar su contenido en cada rama del catéter. Pinzar sin aspirar.
• Colocar tapones estériles. Las ramas del catéter deben permanecer pinzadas hasta su próxima utilización.
INSERCION DEL CATÉTER
La inserción de un catéter, ya sea tunelizado o no, es una técnica invasiva que entraña riesgos. La frecuencia de las posibles complicaciones se minimiza con la utilización de la ecografía [12], preferiblemente la canalización ecodirigida y aséptica a tiempo real de la vena seleccionada (yugular, subclavia, lumbar o femoral).
Generalmente, en situaciones de urgencia o gravedad, se suele considerar como primera opción el abordaje femoral, siendo el abordaje yugular, sobre todo el derecho, el preferido para la implantación de catéteres tunelizados, que se insertan lo más cerca de la clavícula para comodidad del paciente.
En los catéteres tunelizados se comprueba el posicionamiento de la punta del catéter mediante fluoroscopia, y si ésta es correcta (en la unión entre vena cava superior y aurícula derecha de preferencia), se procede a la tunelización de manera que el dacron quede en el tejido subcutáneo a nivel pectoral. Por ello, este tipo de catéteres requiere de salas habilitadas con el adecuado revestimiento, material de imagen y protección necesaria, así como personal entrenado en su uso (nefrólogo o radiólogo intervencionista).
En función de la vena elegida para la canalización se selecciona la longitud del catéter a insertar, siempre teniendo en cuenta la constitución y características del paciente. De preferencia, las localizaciones elegidas son: yugular interna derecha, yugular interna izquierda, femoral izquierda, femoral derecha y translumbar. No se suele emplear el acceso subclavio, salvo casos excepcionales, debido a la alta incidencia de estenosis en dicho acceso que comprometen la vascularización del miembro superior ipsilateral y la realización de una posible FAV en dicha extremidad en el futuro.
COMPLICACIONES RELACIONADAS CON LOS CATÉTERES VENOSOS
Las complicaciones surgidas tras la implantación de un catéter venoso central para HD pueden clasificarse en precoces y tardías.
Complicaciones precoces
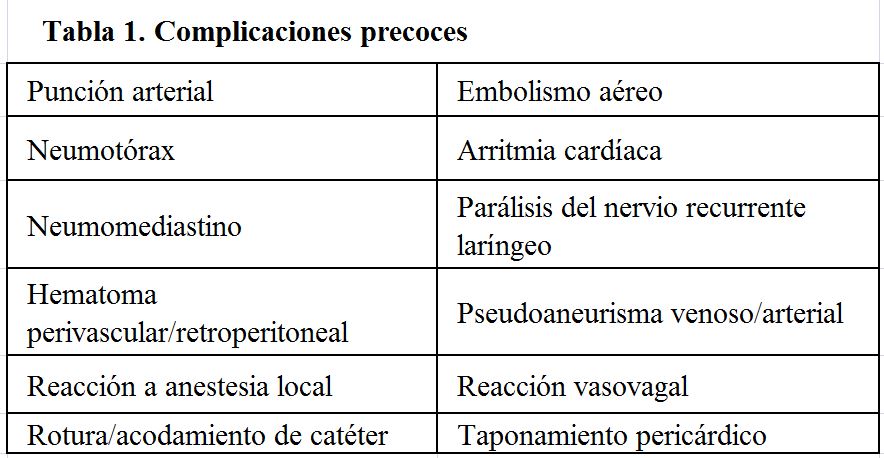
Este tipo de complicación es infrecuente y ocurre de manera inmediata durante o tras la implantación en relación con la punción y/o la inserción. La (Tabla 1) muestra las más comunes:
La mayoría de las complicaciones precoces pueden evitarse con un correcto procedimiento de inserción con guía ecográfica a tiempo real en manos expertas y la adecuada monitorización del paciente durante el procedimiento. Debe realizarse control estricto por parte de enfermería en las primeras horas tras la implantación.
Complicaciones tardías
Las complicaciones tardías están relacionadas con el cuidado y la función del catéter, y difieren en el tiempo desde su inserción. Una de sus consecuencias es la retirada del catéter, por lo que es fundamental su detección temprana [5] [13] [14]. La (Tabla 2) resume las complicaciones tardías, centrándonos en las más frecuentemente encontradas en la práctica clínica diaria.
Estenosis venosa central
Según los estudios publicados hasta la fecha, su incidencia es muy variable, aunque los más recientes concuerdan en torno al 10-13% [15] y se agrupó entre aquellos con catéteres de hemodiálisis tunelizados, dispositivos cardiacos y antecedentes previos de acceso para diálisis o trasplante.
Ocurre con más frecuencia en la vena subclavia que en la yugular [16] [17], siendo mayor el riesgo cuanto mayor sea el número de catéteres canalizados en una misma localización y la presencia de infección. La estenosis venosa suele ser asintomática, aunque en ocasiones cursa con edema de la extremidad superior ipsilateral: el llamado síndrome de vena cava superior con edema en esclavina. Su tratamiento consiste en angioplastia, con o sin stent de la misma [18]. Algunos autores defienden la implantación de un nuevo catéter venoso central en la vena angioplastiada para evitar la inserción de nuevos catéteres en otras venas sanas y con ello su estenosis [19].
Trombosis y vaina de fibrina
La disfunción tardía del catéter generalmente se debe a su trombosis total o parcial, ya sea intraluminal o extraluminal [12]. Su patogenia se relaciona con un estado de hipercoagulabilidad condicionado por la uremia, factores protrombóticos como diabetes y la lesión de la pared vascular producida al insertar el catéter. Otros factores a tener en cuenta son el barotrauma causado por los altos flujos de entrada y salida durante la HD [20] y la composición de los catéteres [21].
Migración del catéter
Todos los catéteres, ya sean de implantación reciente o no, pueden migrar, por lo que es importante comprobar ocasionalmente la posición de la punta para evitar posibles disfunciones y arritmias secundarias a su movilización [22]. La placa de tórax es la prueba de elección, aunque no se ha definido la frecuencia con la que debe realizarse.
Infección
Es la complicación más frecuente y grave, asociando elevada morbimortalidad [23] y suele, en muchos casos, suponer su retirada.
El riesgo de presentar una bacteriemia es 10 veces más alto en pacientes con CVC comparado con una FAV nativa. Asimismo, la bacteriemia relacionada con catéter es de 2 a 3 veces más frecuente en los catéteres no tunelizados frente a los tunelizados [24].
Los factores de riesgo para presentar un episodio de bacteriemia son: la presencia de diabetes, aterosclerosis periférica, haber presentado episodios previos de bacteriemia, ser portador nasal de S. Aureus, mayor tiempo de permanencia del CVC, necesidad de tratamiento fibrinolítico intraluminal e infección local [25].
La infección del CVC puede ocurrir a 3 niveles [2]:
• Orificio o infección local no complicada, que se suele acompañar de un exudado purulento a través del orificio del catéter.
• Tunelitis o infección local complicada, que se define como aparición de signos inflamatorios que se extienden por el trayecto subcutáneo.
• Bacteriemia relacionada con el catéter, que se define como aislamiento de un mismo organismo en sangre y en el CVC en ausencia de otro foco de infeccióEn este caso pueden aparecer complicaciones metastásicas como endocarditis, tromboflebitis o espondilodiscitis. Es la más grave y en la que nos vamos a centrar.
Ante la sospecha de infección y antes de la administración de antibioterapia empírica, es importante la realización hemocultivos, tanto de sangre periférica como de las luces del catéter en el caso de sospecha de infección de catéter y/o cultivo del orificio si se sospecha infección del mismo [2].
Antes de hablar de tratamiento empírico, es importante recalcar que, ante toda infección asociada a catéter, se deberá retirar el mismo de forma inmediata si:
• es un catéter venoso temporal.
• en presencia de shock séptico.
• ante persistencia de fiebre o bacteriemia 48-72 horas tras inicio de tratamiento antibiótico adecuadamente dirigido a la sensibilidad del microorganismo.
• ante la evidencia de infección metastásica o aislamiento de microorganismos muy virulentos como S. Aureus, Pseudomonas, Candida o microorganismos multirresistentes [26].
El tratamiento empírico de la infección por catéter debe incluir antibióticos de amplio espectro por vía intravenosa, para microorganismos grampositivos y gramnegativos [18]. La combinación de vancomicina o daptomicina, que cubre grampositivos incluido el Staphylococcus Aureus resistente a meticilina, muy prevalente en las unidades de HD, y gentamicina o ceftazidima, que cubre gramnegativos, puede ser adecuada en la mayoría de ocasiones, y por sus características farmacocinéticas permite una cómoda dosificación en HD. En función de la gravedad del cuadro, la cobertura frente a gramnegativos se podrá ampliar con el uso de piperacilina-tazobactam o carbapenémicos.
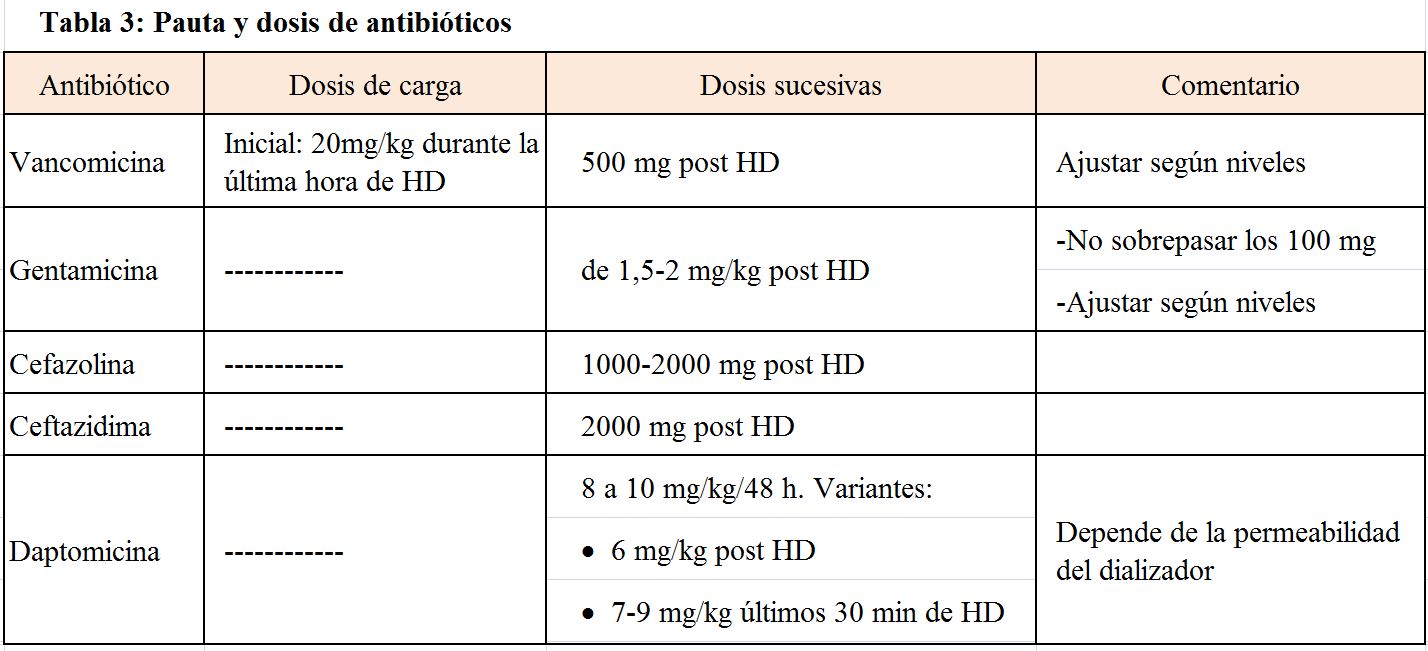
Las dosis y pautas recomendadas de antibióticos [27][28][29] se resumen en la (Tabla 3).
La duración del tratamiento en una bacteriemia asociada requiere de un tiempo mínimo de 2 a 3 semanas en ausencia de complicaciones metastásicas, tiempo que debe completarse incluso tras la retirada del catéter [26]. El sellado intraluminal con antibiótico del catéter es una medida que puede incrementar los resultados del tratamiento, siempre en asociación con el tratamiento sistémico, dado que en una reciente revisión no se obtuvo evidencia suficiente para recomendar tratamiento intravenoso con sellado sobre intravenoso exclusivo [30]. Existe una notable variabilidad en cuanto a las concentraciones utilizadas para el sellado y algunas de las más aceptadas serían las siguientes: vancomicina, 2-5 mg/ml; daptomicina 5 mg/ml; gentamicina 2 mg/ml; piperacilina-tazobactam 10 mg/ml [3].
Si tras el tratamiento instaurado, e incluso la retirada de catéter, persiste mala evolución clínica y se mantiene positividad del aislamiento microbiológico, se debe sospechar posibilidad de enfermedad metastásica, para lo que habrá que ir en busca de su existencia, pues cambiaría el manejo de la infección así como la duración del tratamiento hasta 6-8 semanas. En estos casos, las pruebas diagnósticas a realizar son:
• Ecocardiografía transtorácica y/o transesofágica para descartar la existencia de endocarditis infecciosa. Su presencia alarga el tratamiento hasta 6-8 semanas y, en ocasiones, el paciente puede requerir un recambio valvular [26].
• Resonancia magnética de columna si existe sospecha clínica de espondilodiscitis. La duración del tratamiento será de hasta 6-8 semanas por vía intravenosa pudiendo necesitar hasta 24 meses de tratamiento por vía oral y, en casos refractarios o con inestabilidad vertebral, precisar incluso una intervención quirúrgica [31].
• Tomografía computarizada, ecografía o flebografía si se sospecha tromboflebitis séptica. El uso de la heparina en estos casos es controvertido, estando contraindicados los agentes trombolíticos. [26]. La duración del tratamiento será entre 6-8 semanas.
Seguimiento de la infección
Se efectúa a través del curso clínico junto con la realización de hemocultivos periódicos, en el momento del diagnóstico, a las 72 horas de iniciar tratamiento antibiótico definitivo y a la semana de finalizar los antibióticos [26].
El sellado empírico del catéter con antibiótico como prevención primaria se desaconseja por su escaso coste-efectividad y la generación de resistencias [32].