Fibrilación auricular no valvular en enfermedad renal crónica y anticoagulación
Palabras clave
Antagonistas vitamina K, Anticoagulantes orales
RESUMEN
La fibrilación auricular (FA) es la arritmia más frecuente en la enfermedad renal crónica (ERC) y ambas entidades mantienen una estrecha interrelación. La presencia de ERC en pacientes con FA aumenta el riesgo de eventos tromboembólicos, de mortalidad y de sangrado. Los antagonistas de la vitamina K (AVK) han sido el pilar fundamental en la prevención de eventos tromboembólicos en la FA hasta hace poco, con claros beneficios en pacientes con FA y ERC estadio 3. Sin embargo, el riesgo-beneficio de los AVK en pacientes con FA y ERC estadios 4-5 es controvertido debido a la falta de ensayos clínicos aleatorizados (ECA). El tratamiento con AVK en pacientes con ERC se ha asociado a una peor calidad en la anticoagulación, mayor riesgo de sangrado grave, mayor progresión en la calcificación vascular y valvular y mayor riesgo de calcifilaxis. Los anticoagulantes orales de acción directa (ACODs) han mostrado una eficacia igual o superior en la prevención de ictus/embolismo sistémico (I/ES) y un mejor perfil de seguridad que los AVK en pacientes con FA no valvular (FANV) con ERC estadio 3 en análisis post-hoc de ECA pivotales. Sin embargo, todavía es escasa la evidencia del riesgo-beneficio en estadios más avanzados de ERC. Estudios observacionales parecen indicar que los ACODs muestran un buen perfil de seguridad-eficacia en comparación con los AVK en pacientes con ERC-no diálisis (ERC-ND).
Además, los ACODs se han asociado con un menor riesgo de fracaso renal agudo (FRA), o desarrollo y progresión de la ERC respecto a los AVK. Esta revisión sintetiza la evidencia existente sobre la eficacia y la seguridad de los cumarínicos y los ACODs en pacientes con FA en diferentes estadios de ERC, así como sus efectos sobre la función renal, la calcificación vascular y valvular y la salud ósea, y brevemente otras alternativas a la anticoagulación en esta población.
INTRODUCCIÓN
La FA es la arritmia cardíaca más frecuente y se asocia a un mayor riesgo de ictus/embolismo sistémico (I/ES) [1]. Además, los ictus cardioembólicos asociados a la FA suelen asociarse a mayor gravedad, discapacidad y mortalidad, así como a una estancia hospitalaria más prolongada [2].
La ERC también es una patología frecuente, con una prevalencia creciente en todo el mundo [3][4]. La FA es más prevalente en presencia de ERC, tanto en pacientes con ERC no en diálisis (ERC-ND, 16-21%, prevalencia que aumenta en estadios más avanzados de ERC), como en pacientes con enfermedad renal crónica terminal en diálisis (ERC-D)(17-27%) [5].
De hecho, la relación entre la FA y la ERC es bidireccional: la FA se asocia a un mayor riesgo de ERC (disminución del filtrado glomerular estimado [FGe] o aparición de albuminuria), mientras que la ERC se asocia a una mayor incidencia y prevalencia de FA [6][7][8][9]. La FA y la ERC comparten varios factores de riesgo (edad avanzada, hipertensión, diabetes mellitus, enfermedad cardiovascular); asímismo, la inflamación, frecuente en la ERC, se ha implicado en el inicio y la perpetuación de la FA [10].
Los pacientes con ERC avanzada con frecuencia presentan patología cardíaca que favorece el desarrollo de FA (hipertrofia ventricular izquierda, fibrosis miocárdica o dilatación de la aurícula izquierda) [11]. De igual forma, los cambios bruscos de electrolitos y del pH sérico durante las sesiones de hemodiálisis (HD) pueden actuar como desencadenantes de la FA.
La anticoagulación oral (AO) con los antagonistas de la vitamina K (AVK) y, más recientemente, con los anticoagulantes orales de acción directa (ACODs), ha sido la piedra angular para la prevención de I/ES en pacientes conFANVcon alto riesgo deaccidentes cerebrovasculares. Sin embargo, la presencia de ERC en pacientes con FA aumenta el riesgo de I/ES (incremento del 46-49% en pacientes con ERC-ND y un 83% en ERC-D), de muerte (exceso de riesgo del 60-65% en ERC-ND y en ERC-D) [5], pero también de sangrado en pacientes con AO, lo cual genera dudas sobre el riesgo-beneficio de la misma [5][9][12][13].
La FA se asocia a un estado protrombótico a través de numerosas vías fisiopatológicas, lo cual se agrava todavía más por la presencia de ERC debido a los cambios en la aurícula izquierda, a la disfunción endotelial y a la activación de la coagulación y las plaquetas [9]. Sin embargo, no existe una clara evidencia del aumento significativo del riesgo de I/ES en pacientes con ERC-Dy FA. Las posibles explicaciones incluyen: la alta prevalencia e incidencia de ictus no relacionados con FA en ERC-D, la disfunción plaquetaria en la uremia, el uso de heparina intradiálisis y a la naturaleza paroxística y autolimitada de los episodios de FA asociadas a la HD, que deberían asociarse con un bajo riesgo de I/ES, en contraposición con la FA persistente/permanente asociada a cambios estructurales crónicos de la aurícula izquierda [14][15].
Así pues, en ausencia de una evidencia clara de una asociación entre FA e I/ES en los pacientes en hemodiálisis, la necesidad de AO en esta población está siendo cuestionada [14].
ANTAGONISTAS DE LA VITAMINA K EN PACIENTES CON FIBRILACIÓN AURICULAR Y ENFERMEDAD RENAL CRÓNICA
Los AVK reducen la incidencia de I/ES en pacientes con FANV en la población general [16]. Sin embargo, los AVK presentan varios inconvenientes: inicio de acción y cese de su efecto lentos, rango terapéutico estrecho que requiere una monitorización y ajustes de dosis frecuentes, además de presentar un considerable número de interacciones fármaco-alimentarias [17] que pueden verse agravadas por las restricciones dietéticas en los pacientes con ERC [18]. A ello hay que añadir que la evidencia de la eficacia y la seguridad de los AVK es escasa en los pacientes con ERC y FA debido a los pocos ECA en esta población.
Warfarina a dosis ajustadas para conseguir un INR 2-3 frente a aspirina en dosis bajas, redujo el riesgo de I/ES un 76% sin incrementar el riesgo de sangrado graveen pacientes con FA y ERC estadio 3 [19]. No obstante, no hay ECA que muestren evidencia del riesgo-beneficio de los AVK en pacientes con FA y ERC con estadio 4 o superior.
En un metaanálisis de estudios observacionales, warfarina redujo el riesgo de I/ES, así como la mortalidad (30% y 35% respectivamente), sin incrementar el riesgo de sangrado mayoren el grupo de pacientes con ERC-ND; sin embargo, en los pacientes con ERC-D, warfarina no redujo el riesgo de I/ES ni la mortalidad, y si aumentó el riesgo de sangrado en un 30%, lo cual sugiere que los AVK presentan un perfil riesgo-beneficio favorable para pacientes con ERC-ND, pero no para los pacientes con ERC-D [20]. Estos datos coinciden con el metaanálisis actualizado sobre 15 estudios observacionales en pacientes con ERC-Dy FA, en los cuales, los pacientes que recibieron warfarina, presentaron un 49% más de ictus hemorrágicos, sin observarse claros beneficios sobre los ictus isquémicos, sangrado grave o mortalidad frente a los que no recibieron warfarina [21]. De la misma manera, en dos estudios recientes se observaron resultados similares; un estudio observacional [22] y un estudio retrospectivo de pacientes con ERC avanzada y FA de aparición previa al inicio de diálisis [23].
A pesar de las limitaciones de estos estudios (observacionales, resultados sujetos a confusión, heterogeneidad moderada-alta, o sin datos sobre la calidad en la anticoagulación), sugieren que los AVK pueden no ser eficaces en la prevención del I/ES en pacientes con FA y ERC-D, e incluso podrían ser perjudiciales [20[21][24]. Además, el tiempo de rango terapéutico (TRT) es menor en los pacientes con ERC; a menor función renal, menor TRT y peor calidad en la anticoagulación, que a su vez se asocia a un mayor riesgo de eventos tromboembólicos y hemorrágicos [25][26][27]. Asimismo, la variabilidad del INR también se ha asociado con complicaciones hemorrágicas y mortalidad en pacientes con ERC-D [28]. Además, los pacientes con ERC moderada-severa requieren habitualmente menores dosis de AVK, y presentan con frecuencia un INR por encima del rango terapéutico, y por lo tanto, un mayor riesgo de sangrado [29][30]. En los próximos años se esperan nuevos datos sobre el perfil de riesgo-beneficio clínico de los AVK gracias a dos ECA en curso que comparan el riesgo hemorrágico y trombótico de los AVK frente a no anticoagular a pacientes con FA en HD: The Oral Anticoagulation in Haemodialysis Patients (AVKDIAL) (NCT02886962),y el estudio Danish Warfarin-Dialysis Study - Safety and Efficacy of Warfarin in Patients With Atrial Fibrillation on Dialysis (DANWARD) (NCT03862859).
ANTICOAGULANTES ORALES DE ACCION DIRECTA EN PACIENTES CON FIBRILACIÓN AURICULAR Y ENFERMEDAD RENAL CRÓNICA
Los ACODs, a diferencia de la warfarina, tienen una actividad anticoagulante predecible, menos interacciones farmacológicas y menor necesidad de monitorización continua.
La eficacia de los ACODs (dabigatran, rivaroxaban, apixaban y edoxaban) en la prevención de los I/ES y su perfil de seguridad frente a los AVK han sido demostrados en ECA pivotales[31][32][33][34]. Un metaanálisis de dichos ensayos mostró que los ACODs presentan una mayor eficacia en reducir los I/ES, principalmente debido a la reducción de los ictus hemorrágicos, el riesgo de mortalidad y el riesgo de sangrado mayor, aunque de forma no significativa (significativo para hemorragias intracraneales) [35].
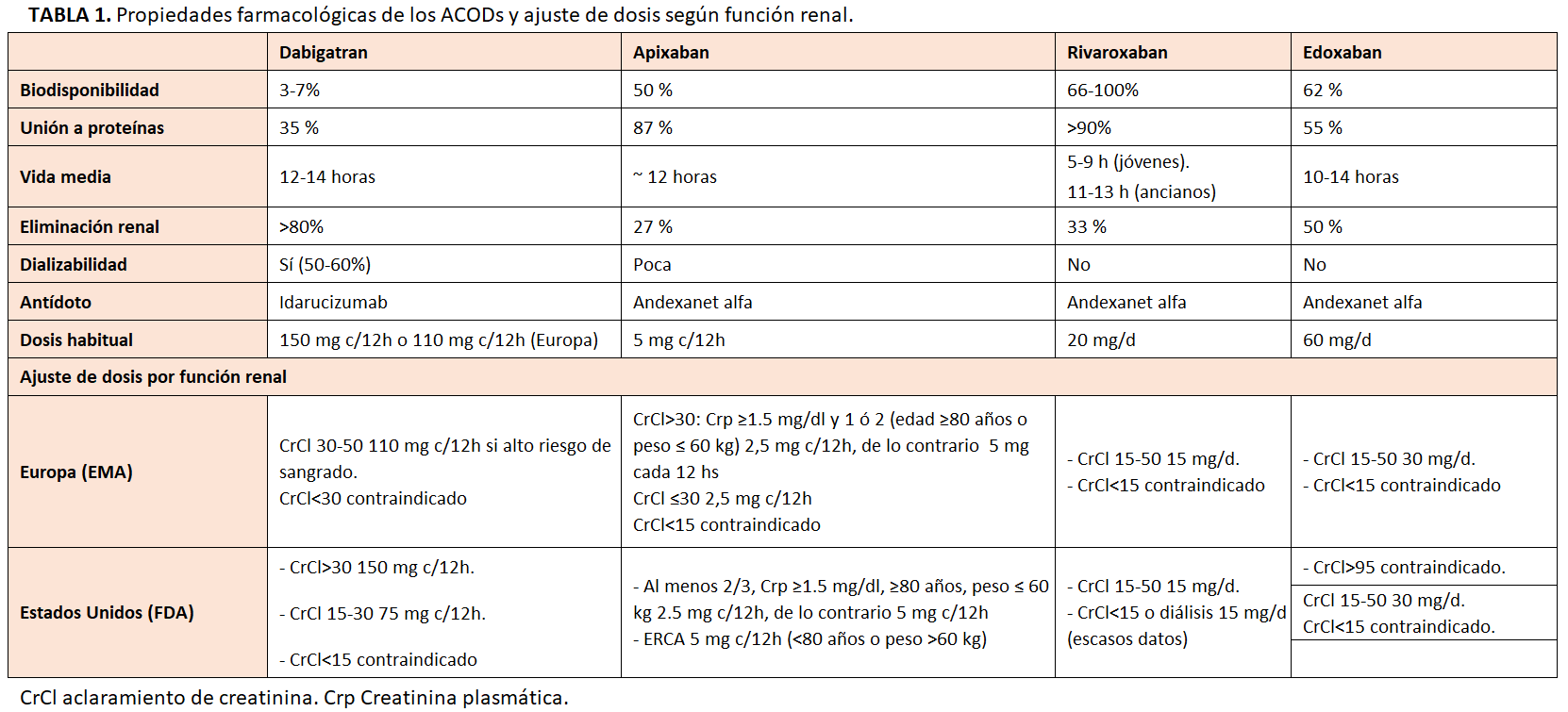
Sin embargo, la eliminación de los ACODs actualmente disponibles es renal en diverso grado. El aclaramiento renales aproximadamente del 80% para dabigatran, 50% para edoxaban, 33% para rivaroxabán y 27 % para apixaban [36], lo cual requiere ajustar la dosis de los mismos en la ERC moderada-severa (Tabla1). En este sentido, podría ser útil medir el efecto anticoagulante de los ACODs en los estadios más avanzados de la ERC o en pacientes con deterioro de la función renal [37].
Los análisis post-hoc de ECA pivotales que compararon ACODs frente a warfarina en pacientes con ERC moderada y FANV [38][39][40][41][42], mostraron un perfil de riesgo-beneficio favorable para los ACODs, lo cual ha sido confirmado en varios metaanálisis [43][44][45]. En el metaanálisis de la Cochrane que incluyó 12.545 pacientes con FA y ERC (390 pacientes con ERC estadio 4), los ACODs redujeron la incidencia de I/ES (RR 0.81, 95% CI 0.65-1.00) y redujeron de forma no significativa la incidencia de sangrado mayor (RR 0.79, 95% CI 0.59-1.04) frente a warfarina [43]. No obstante, estos estudios sólo incluyeron pacientes con aclaramientos de creatinina (ClCr) >30 ml/min (Apixaban for the Prevention of Stroke in Subjects with Atrial Fibrillation [ARISTOTLE] incluyó pacientes con ClCr>25 ml/min). Por lo tanto, el perfil riesgo-beneficio de los ACODs en pacientes con FA con ERC estadio 4-5 es incierto. Un análisis post-hoc del ensayo ARISTOTLE confirmó el perfil de seguridad de apixaban pues los pacientes con ClCr 25-30 ml/min presentaban un riesgo un 66% menor de sangrado mayor [46].
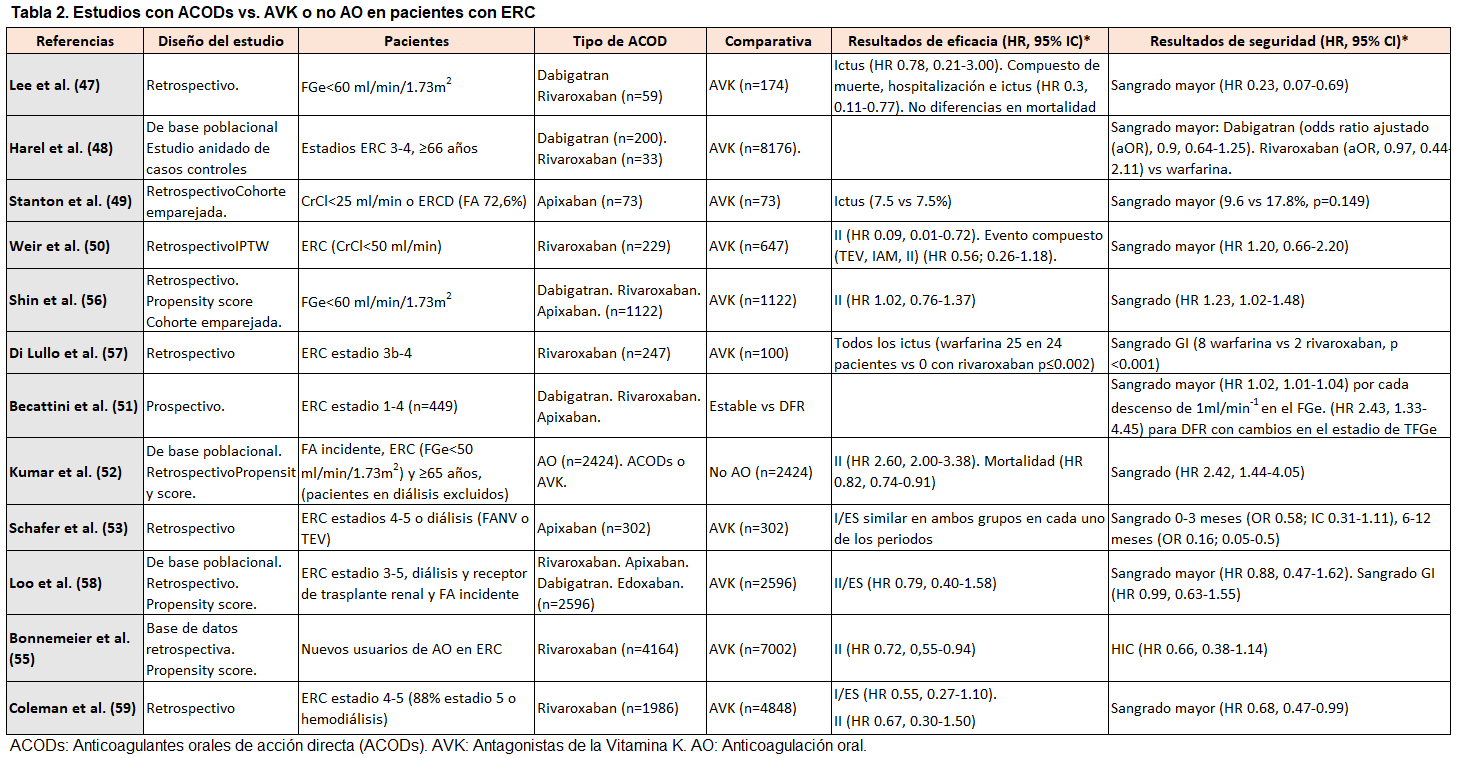
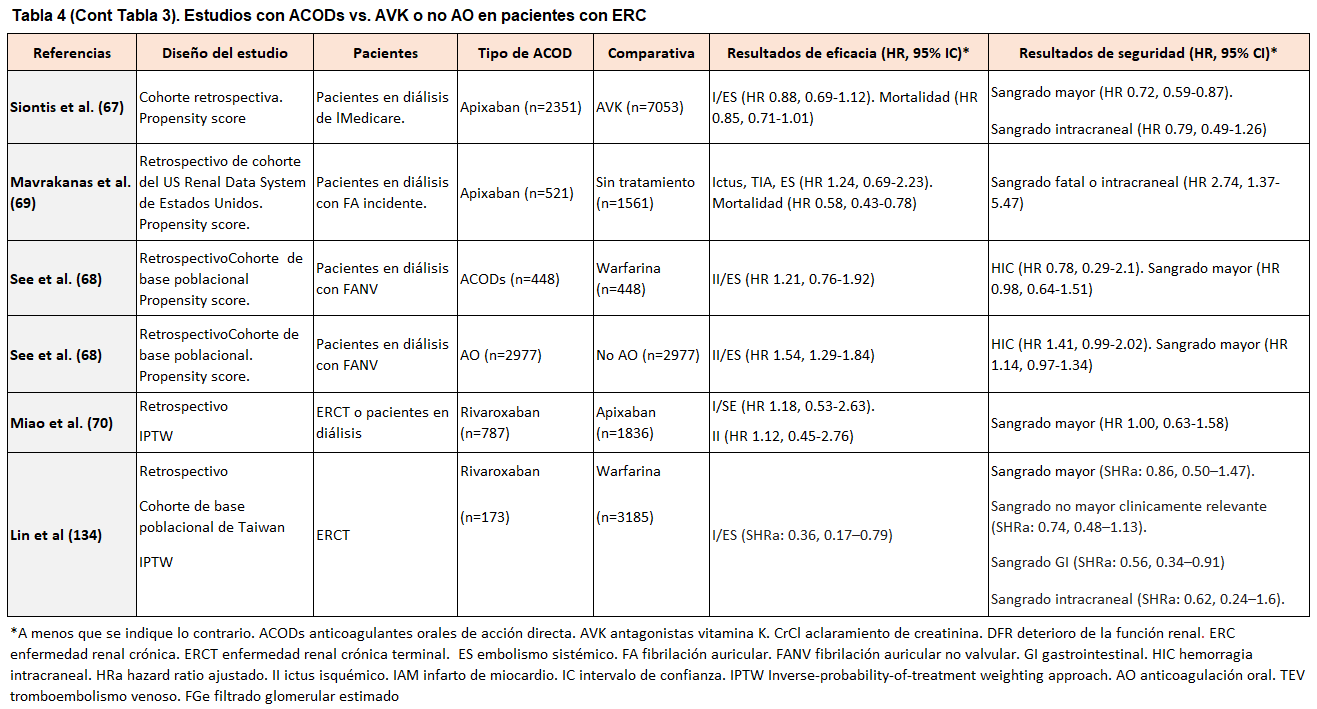
Varios estudios observacionales han evaluado la efectividad y la seguridad de los ACODs frente a warfarina en diferentes estadios de ERC [27][47][48][49][50][51][52][53][54][55][56][57][58][59][60][61][62][63] (Tabla 2) (Tabla 3) (Tabla 4). A pesar de la baja calidad en la evidencia debido a la heterogeneidad y al diseño retrospectivo, los estudios sugieren que los ACODs son una alternativa válida a los AVK en pacientes con ERC-ND, con un beneficio neto observado en un metananálisis [64].
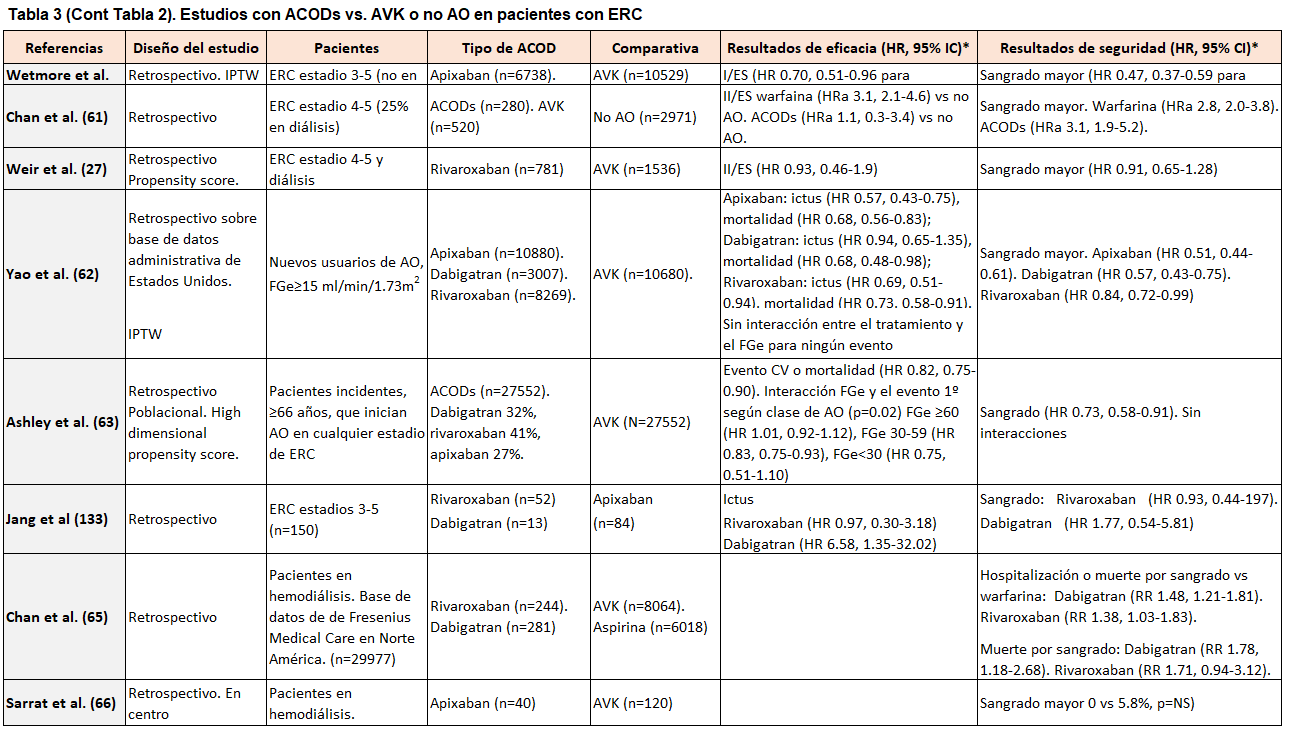
En los estudios observacionales de pacientes con ERC-D que comparan los ACODs frente a AVK se observa una alta heterogeneidad[65][66][67][68][69][70][71]: los estudios iniciales describieron problemas de seguridad con dabigatran y rivaroxaban frente a warfarina [65]. En contraposición, un estudio retrospectivo que comparaba apixaban frente a warfarina mostró tasas similares de I/ES, aunque con tasas significativamente más bajas de episodios de sangrado mayor. Asímismo, apixaban a dosis de 5 mg/12 h se asoció a un menor riesgo de I/ES y mortalidad frente a warfarina [67]. A pesar de todo, estudios recientes no han podido confirmar estos beneficios [68], como tampoco el beneficio de los ACODs frente a la noAO en esta población [69].
En un reciente metaanálisis en pacientes con ERC-Dy FA, los ACODs mostraron una efectividad y seguridad comparable a los AVK, mientras que la AO frente a la no AO se asoció a un riesgo mayor de I/ES y a un riesgo similar de sangrado grave [68]. Otro metanálisis más reciente en esta población concluyó que los anticoagulantes orales no se asociaron con una reducción del riesgo de eventos tromboembólicos en pacientes con fibrilación auricular en diálisis crónica: Comparado con no anticoagulación, apixabán y warfarina no se asociaron con una disminución significativa de accidentes cerebrovasculares y/o tromboembolismo sistémico. Mientras, Warfarina, dabigatran y rivaroxaban se asociaron con un riesgo de hemorragia significativamente mayor en comparación con apixaban y no anticoagulación, por lo que la relación riesgo-beneficio de los anticoagulantes orales en pacientes con fibrilación auricular en diálisis crónica precisa su validación en ensayos clínicos aleatorizados [72].
Un ECA en pacientes en HD con FANV analizó la progresión de los depósitos cálcicos cardio-aórticos (como evento primario) asociados a AVK, a rivaroxaban 10 mg/d y a rivaroxaban10 mg/d más vitamina K2 2000 µg/tres veces por semana durante 18 meses. Tras el seguimiento inicial, solo disminuyeron los episodios de sangrado grave en los pacientes tratados con rivaroxabán [73]. Ahora bien, tras un seguimiento más prolongado (18 meses más), se observó una reducción en el resultado combinado de eventos cardiovasculares fatales y no fatales y de complicaciones hemorrágicas graves o potencialmente mortales en comparación con el uso de AVK, aunque el riesgo de ictus o muerte no mostró diferencias entre los grupos [74].
Por lo tanto, a pesar de la urgente necesidad clínica de obtener esta información, no hay evidencia de un beneficio clínico neto de los ACODs en pacientes con ERC-D con FA. Varios ECA en curso están evaluando el uso de la AO, comparando la seguridad y la eficacia de los ACODs frente a los AVK en esta población. El ensayo RENAL-AF trial (Renal Hemodialysis Patients Allocated Apixaban Versus Warfarin in Atrial Fibrillation trial; NCT02942407) se paró prematuramente por falta de reclutamiento, pero no se observó un beneficio en el perfil de eficacia y seguridad vs. Warfarina (RENal hemodialysis patients ALlocated apixaban versus warfarin in Atrial Fibrillation - American College of Cardiology (acc.org). Otros estudios en marcha son el Compare Apixaban and vitamin-K antagonists in patients with AF and ESKD [AXADIA]; NCT02933697, o el Strategies for the Management of Atrial Fibrillation in patiEnts Receiving Dialysis, [SAFE-D] NCT03987711, los cuales probablemente proporcionarán información útil.
En las (Tabla 2) (Tabla 3) (Tabla 4) se muestran los datos de los estudios con ACODs vs. AVK o no AO en pacientes con ERC.
CONTROL DE LA FUNCIÓN RENAL DURANTE LA ANTICOAGULACIÓN ORAL
El deterioro de la función renal (DFR) es frecuente en los pacientes con FA [75][76] y se asocia a un incremento en el riesgo de eventos cardiovasculares, mortalidad por todas las causas y hemorragia [42][75][76][77]. Este deterioro es también común en los estudios observacionales [51][78][79], especialmente en pacientes con ERC, y resulta mejor predictor de I/ES y sangrado que la disfunción renal per se [51][80]. Junto con los cambios en la función renal a lo largo del tiempo debido a tratamientos concomitantes (inhibidores del sistema renina-angiotensina-aldosterona y diuréticos) o episodios agudos, el DFR requiere monitorización estrecha para ajustar la dosis de los ACODs. Existen discrepancias entre la prescripción en la práctica clínica de ACODs y las indicaciones según ficha técnica, lo cual puede condicionar que haya sobre o infradosificación. La sobredosificación de los ACODs debido a un inadecuado ajuste incrementa el riesgo de sangrado, mientras que la infradosificación se asocia a un aumento del riesgo de ictus, especialmente con apixaban [81][82].
El ajuste de dosis de los ACODs según la ficha técnica se basa en el aclaramiento de creatinina (ClCr) estimado utilizando la fórmula de Cockcroft-Gault (CG), en lugar de FGe mediante las ecuaciones MDRD o CKD-EPI, más usadas por los laboratorios. El FGe proporciona una mejor estimación de la función renal, sobre todo en pacientes encamados cuyo peso es difícil de estimar [83][84].
Las discrepancias de resultados según las diferentes ecuaciones pueden dar lugar a una clasificación errónea de los pacientes y a una dosificación inadecuada (como considerar apto a un paciente para tomar ACODs cuando los tiene contraindicados) [85][86][87][88]. En una reciente revisión se ha visto que esta discrepancia de dosis es frecuente entre diferentes fórmulas, por lo que es un fenómeno clínicamente relevante [87]. Es probable que este problema se aborde en un futuro próximo, pero hasta que se disponga de más datos, es razonable utilizar la fórmula de CG-CrCl para ajustar la dosis de ACODs.
Las guías recomiendan medir la función renal al inicio del tratamiento con ACODs y anualmente a partir de entonces, pero sugieren una monitorización más frecuente en pacientes con ERC mayores de 75 años, frágiles, y aquellos tratados con ACODs con un mayor aclaramiento renal [89]. En los pacientes con ERC el intervalo para la monitorización de la función renal (en meses) puede calcularse dividiendo FGe/10. También debería considerarse monitorizar la función renal en pacientes en tratamiento con ACODs cuando se sospeche DFR, tras un episodio agudo o cuando se prescriban otros fármacos que afecten a la hemodinámica renal [89].
COMPLICACIONES DE LA ANTICOAGULACIÓN ORAL: ANTICOAGULANTES ORALES DE ACCION DIRECTA FRENTE A LOS ANTAGONISTAS DE LA VITAMINA K
1- EFECTOS SOBRE LA FUNCIÓN RENAL
1.a. Fracaso renal agudo/nefropatía asociada a anticoagulantes
La nefropatía asociada a warfarina (NAW) se define como un episodio de fracaso renal agudo (FRA) asociado a Warfarina y cuyo primer caso se notificó en 2009 [90]. Se caracteriza por un aumento de la creatinina sérica, con micro o macrohematuria, en ausencia de otras causas de FRA, a menudo debido a valores de INR supraterapéuticos. Estudios posteriores informaron de varios casos de NAW, la mayoría asociados a un INR>3 [91]. Las biopsias renales mostraron signos de daño tubular agudo, hemorragia glomerular con hematíes en el espacio de Bowman y obstrucción tubular renal por cilindros hemáticos. A pesar de que en el estudio inicial todos los casos presentaban una enfermedad renal subyacente [90], estudios posteriores describieron casos de NAW en pacientes con ERC y sin ERC, en ambos casos se asoció a un incremento en el riesgo de mortalidad [91] y una progresión más rápida de la ERC [92].
También se han notificado varios casos de FRA en pacientes tratados con ACODs, particularmente con dabigatran (Boletín mensual de seguridad de la AEMPS sobre medicamentos de uso humano del mes de octubre de 2021 - Agencia Española de Medicamentos y Productos Sanitarios). Los hallazgos patológicos fueron similares a los observados con la NAW, por lo que ahora se conoce esta entidad como nefropatía asociada a anticoagulantes (NAA). En un estudio histológico reciente sobre NAA, la mayoría de los casos se asociaban a una enfermedad renal subyacente [93], lo cual sugiere que una anticoagulación excesiva agrava una enfermedad glomerular subyacente y aumenta la hematuria glomerular. Otro posible mecanismo de FRA en la AO es el estrés oxidativo debido a la liberación de hierro libre y a la toxicidad tubular de la hemoglobina.
En pacientes con FA el riesgo de FRA es muy elevado. En un estudio observacional, uno de cada siete pacientes presentó un episodio de FRA durante los dos años de seguimiento [78]. En varios estudios observacionales se observó que el riesgo de FRA fue mayor en pacientes con ERC que recibían AVK respecto a los pacientes tratados con ACODs [78][94][95][96][97].
1.b Desarrollo y progresión de la enfermedad renal crónica
Los análisis post-hoc de los ensayos ROCKET (the Rivaroxaban Once Daily Oral Direct Factor Xa Inhibition Compared with Vitamin K Antagonism for Prevention of Stroke and Embolism Trial in Atrial Fibrillation) [75] y RE-LY (Randomized Evaluation of Long-Term Anticoagulant Therapy with Dabigatran etexilate) [98] sugieren que los ACODs tienen un efecto más beneficioso sobre la función renal que warfarina, lo cual ha sido confirmado en varios estudios observacionales [78][96][97][99][100][101]. El beneficio renal de los ACODs fue más evidente con rivaroxaban y dabigatran, y fue notablemente mejor que en los pacientes tratados con AVK que presentaban niveles de INR supraterapéuticos.
El beneficio renal de los ACODs frente a los AVK puede deberse a un efecto dosis-respuesta más predecible y a un menor riesgo de hemorragias; existe menor riesgo de FRA, lo que puede influir en el deterioro progresivo de la función renal, y a su potencial efecto antiinflamatorio renal, como se ha observado en modelos experimentales [102]. Así mismo, los AVK pueden favorecer la calcificación vascular (ver más abajo), aumentando la rigidez arterial, favoreciendo la hipertensión sistólica y un flujo pulsátil en la microvasculatura, todo ello tiene efectos deletéreos sobre la función renal [103].
Por último, el estudio prospectivo observacional XARENO (Factor XA Inhibition in Renal Patients with Non-valvular Atrial Fibrillation-Observational Registry (NCT02663076)) comparará la progresión de la ERC con rivaroxaban, AVK o la no anticoagulación en pacientes con ERC estadio 3-4 y FANV.
2. CALCIFICACIÓN VASCULAR Y VALVULAR Y RIESGO DE CALCIFILAXIS
La calcificación vascular (CV) es una complicación frecuente en los pacientes con ERC, está inversamente relacionada con la función renal y directamente relacionada con un peor pronóstico en esta población [104]. Además, la calcificación vascular medial favorece la rigidez arterial, lo que se asocia a hipertensión sistólica, hipertrofia ventricular izquierda y disminución del flujo coronario, es por tanto, un factor de riesgo para eventos cardiovasculares y para la progresión de la ERC [103]. Los AVK impiden la ¿-carboxilación de los factores de la coagulación, así como otras proteínas dependientes de vitamina K que inhiben la CV, como matrix Gla protein, Gla-rich protein, o GAS-6, evitando su activación [105]. Por otro lado, el FXa juega un papel central en el aumento de las respuestas inflamatorias y fibróticas a través de las vías de señalización intracelular de los receptores activados por proteasa (PAR), que ejerce un efecto quimioatrayente sobre los fibroblastos y un estímulo proliferativo sobre las células del músculo liso vascular
De hecho, los AVK se han asociado a un incremento en la progresión de la CV [106], y de la rigidez arterial [107], especialmente relevante en pacientes con ERC. Ello apoyaría el uso de ACODs sobre los AVK como tratamiento más seguro, especialmente en pacientes con ERC, aunque no se han podido demostrar diferencias en estos parámetros en un ECA reciente [73]. A pesar de que el cambio de warfarina por rivaroxaban mejoró la rigidez arterial en un estudio prospectivo [108], este hallazgo no ha podido ser confirmado en el ECA antes citado [73]. En un estudio en pacientes en hemodiálisis el tratamiento con Warfarina se asoció con un aumento del riesgo de insuficiencia cardiaca que se atribuyó al aumento de la rigidez arterial y del riesgo de enfermedad vascular periférica [109]. Por el contrario, en el estudio Valkyrie antes mencionado hubo menor riesgo de enfermedad vascular periférica con rivaroxabán que con warfarina [74].
Además, también se observó que rivaroxaban reducía la progresión de la CV aórtica y mitral frente a los AVK en un estudio observacional retrospectivo en pacientes con ERC estadio 3b-4 [110] y un estudio prospectivo del mismo grupo [111].
La calcifilaxis es una complicación rara pero grave, especialmente en los pacientes en diálisis, y se caracteriza por necrosis y ulceración de la piel, paniculitis, calcificación y oclusión luminal de pequeñas arteriolas y capilares subcutáneos [112][113]. La calcifilaxis se asocia con una alta morbilidad y mortalidad. El tratamiento con AVK incrementa varias veces el riesgo de calcifilaxis tanto en pacientes urémicos como no urémicos [114], sugiriendo un efecto beneficioso de los ACODs en la prevención de esta complicación. DE hecho, recientes estudios observacionales demuestran la seguridad de ACODs en pacientes con esta complicación [115][116].
3. ANTICOAGULACIÓN ORAL Y SALUD ÓSEA
Los pacientes con ERC-ND y los pacientes con ERC-D son propensos a sufrir fracturas y osteoporosis debido a varios factores, entre ellos, la enfermedad mineral ósea [117]. Los AVK inhiben la γ-carboxilación de osteocalcina que juega un importante papel en la formación de la matriz ósea [18]. No obstante, el papel de los AVK sobre el riesgo de fracturas y la densidad ósea es controvertido. En un reciente metaanálisis, el uso de AVK durante más de un año no se asoció a un incremento en el riesgo de fracturas en comparación a los controles o a los pacientes tratados con ACODs, aunque el riesgo se vió incrementado en mujeres y en pacientes ancianos frente a los controles [118].
La evidencia disponible sugiere que los ACODs se asocian con un impacto menor en el metabolismo óseo y potencialmente con un menor riesgo de fractura que los AVK [119][120][122][123][124][125][126], aunque son necesarios más estudios especialmente diseñados para corroborarlo. En un estudio, el cambio de warfarina por rivaroxaban se asoció a una mejora en los marcadores metabólicos óseos [108].
CIERRE PERCUTANEO DE LA OREJUELA IZQUIERDA
Debido al mayor riesgo de sangrado en pacientes con ERC avanzada, el cierre percutáneo de la orejuela izquierda (CPOI) puede ser una alternativa atractiva para reducir el riesgo de I/ES evitando el uso de AO. Todos los ECA que han demostrado que el CPOI es no inferior a la AO en la prevención de ictus y eventos hemorrágicos han excluido a pacientes con ERC avanzada; sin embargo, en un reciente estudio prospectivo se observó que, a los dos años de seguimiento, el CPOI en pacientes en diálisis no se asoció a episodios tromboembólicos y mostró una disminución en los episodios de sangrado comparado con la cohorte de pacientes tratados con AO [127], resultados similares se observaron en un pequeño estudio de nuestro grupo [128]. Actualmente está en curso un estudio prospectivo de un solo brazo del dispositivo Watchman® en pacientes en diálisis (NCT03446794).
Mas recientemente han aparecido análisis en pacientes con ERC en distintos estadios, como un subanálisis del estudio LAARGE que demostró que el CPOI era seguro y asociado con prevención del ictus a lo largo de todos los estadios de ERC, incluido el estadio 5 [129]. Sin embargo, el CPOI en pacientes con ERC se asocia con un mayor riesgo de ictus/accidente isquémico transitorio y fracaso renal agudo que en los pacientes sin ERC y en pacientes con ERC-D con una mayor mortalidad [130], lo que confirma que los procedimientos cardiológicos invasivos, incluido en CPOI [131] se asocian con mayores complicaciones, lo que obliga a una evaluación individualizada del riesgo beneficio de esta técnica en esta población [132].
CONCEPTOS CLAVE
1 La prevalencia y la incidencia de fibrilación auricular es mayor en la enfermedad renal crónica y aumenta con el grado de disfunción renal. La presencia de enfermedad renal crónica en pacientes con fibrilación auricular incrementa el riesgo de ictus y embolismo sistémico, mortalidad y de sangrado.
2 La anticoagulación oral con antagonistas de la vitamina K en pacientes con enfermedad renal crónica leve-moderada y fibrilación auricular tiene un beneficio clínico neto, aunque no existen datos concluyentes del riesgo-beneficio en estadios más avanzados de enfermedad renal crónica, especialmente en pacientes con enfermedad renal crónica terminal en diálisis. El tratamiento con antagonistas de la vitamina Ken pacientes con enfermedad renal crónica se asocia con un baja calidad en la anticoagulación y un mayor riesgo de sangrado.
3 Los ensayos clínicos aleatorizados pivotales han demostrado un beneficio clínico neto de los anticoagulantes orales de acción directa frente a warfarina en la fibrilación auricular no valvular en pacientes con enfermedad renal crónica leve-moderada, pero existe poca evidencia en pacientes con fibrilación auricular y enfermedad renal crónica estadio 4 o superior. Los estudios observacionales sugieren que el beneficio se mantiene en los pacientes con enfermedad renal crónica no en diálisis (ERC-ND), pero de forma controvertida en los pacientes con enfermedad renal crónica terminal en diálisis (ERC-D).
4 Los antagonistas de la vitamina K (AVK) se asocian con un riesgo mayor de nefropatía asociada a los anticoagulantes (NAA), fracaso renal agudo (FRA) y progresión más rápida de la enfermedad renal crónica que los anticoagulantes orales de acción directa, especialmente en los pacientes con enfermedad renal crónica.
5 En pacientes con fibrilación auricular no valvular, el deterioro de la función renal es frecuente y se asocia a peores resultados clínicos. La función renal debe controlarse periódicamente y la dosis de anticoagulantes orales de acción directa ajustarse para evitar sobre o infradosificar. La función renal debería monitorizarse utilizando el CG-CrCle, en lugar del FGe para el ajuste de dosis de ACODs.
6 Los antagonistas de la vitamina K (AVK) se han asociado a un incremento de riesgo de calcificación vascular y valvular en enfermedad renal crónica y probablemente a un mayor riesgo de osteoporosis y fracturas, especialmente relevantes en la enfermedad renal crónica.