Nefropatía Congestiva
Palabras clave
Venous Excess Grading System, VExUS, fenómeno compensatorio de retención de sodio tras el diurético, Compensatory post-diuretic renal sodium reabsorption, fenómeno de frenado, Braking phenomenon,
INTRODUCCIÓN
Una de las áreas de mayor expansión del conocimiento en Nefrología es la importante interacción cardio-renal. Desde la primera definición basada en fenotipos, propuesta por Ronco y el grupo Acute Disease Quality Initiative (ADQI) en el año 2008 [1], se han escrito más de 2000 manuscritos centrados en el estudio de los mecanismos y tratamientos relacionados con el daño agudo o crónico del corazón y el riñón en situaciones agudas o crónicas en la que estos dos órganos pueden verse implicados. En algunos casos es difícil reconocer en la práctica clínica habitual el órgano inicialmente afectado, razón por la cual algunos autores proponen describir mecanismos fisiopatológicos comunes a los dos órganos [2].
Un mecanismo común es la congestión, en especial en los pacientes con síndrome cardiorrenal tipo 1. En estos pacientes, el estudio de la congestión ha evolucionado desde las primeras descripciones respecto a la formación de los edemas propuesta por Starling [3], hasta nuevos conceptos como la visión multiparamétrica de la congestión [4]. Esta nueva visión permite entender que los efectos sistémicos y las consecuencias de la congestión van más allá de la mera percepción de la presencia de signos clínicos de sobrecarga de volumen y nos ha permitido evolucionar hacia nuevas vías de diagnóstico, fenotipado y tratamiento.
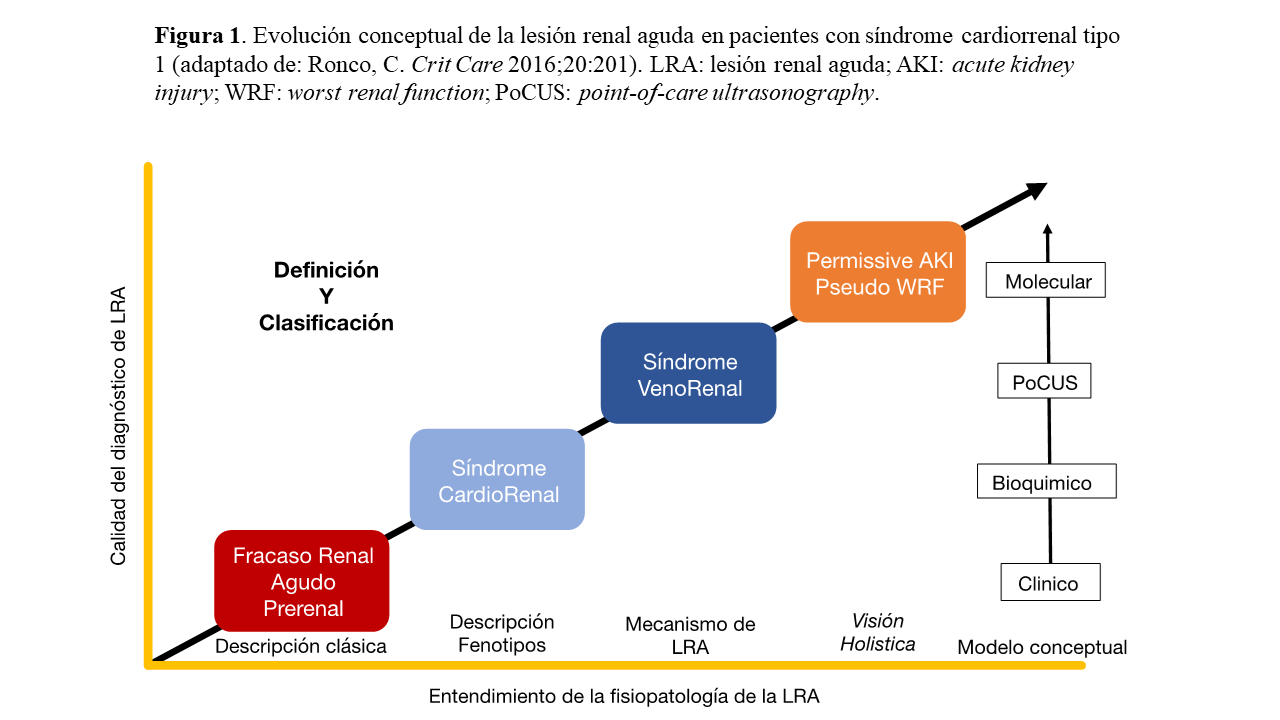
Entender que la congestión tiene efectos sistémicos permite reconocer un nuevo mecanismo de daño renal asociado al desarrollo de lesión renal aguda (LRA), que recientemente se denominó nefropatía congestiva [5] [6]. En pacientes con insuficiencia cardiaca (IC), la congestión y en especial la congestión vascular tiene un papel determinante en el deterioro de la función renal que incluso va más allá de las fluctuaciones de la creatinina o de los conceptos tradicionales como azotemia o insuficiencia renal aguda prerrenal [7] (Figura 1).
LOS EFECTOS SISTÉMICOS DE LA CONGESTIÓN
La congestión es cardinal en el paciente con IC. De hecho, en el registro ADHERE [8], el principal motivo de ingreso hospitalario fue la congestión en el 95% de los pacientes; este dato se mantiene en el registro europeo, en el que más del 80% de los pacientes ingresó con algún fenotipo de congestión [9]. Sin embargo, es aún más llamativo que entre el 16-20% de los pacientes fueron dados de alta con algún grado de congestión y que este grupo de pacientes tuvo mayores tasas de reingresos hospitalarios (23% al mes y 40% a los tres meses) [8] [9], además tuvieron una mortalidad significativamente mayor que los pacientes no congestivos [9]. Recientemente se describió la presencia de algún grado de congestión tisular en la ecografía pulmonar, sin evidencia de síntomas, condición que se denominó congestión subclínica. En este grupo de pacientes, Rivas-Lasarte y colaboradores [10] demostraron que aproximadamente el 50% de los pacientes reingresan por congestión clínica (presencia de crepitantes) a los 15 días y estos pacientes tienen tan malos desenlaces en términos de mortalidad o reingresos hospitalarios como aquellos con congestión clínica al alta.
La congestión puede ocasionar lesión orgánica, desencadenar disfunción y, finalmente, conducir al fallo de los órganos diana, incluyendo corazón, pulmones, riñones, hígado, intestino, vasos sanguíneos y cerebro [11]. La congestión pulmonar es el efecto resultante del incremento de las presiones de llenado en el lado izquierdo del corazón, lo cual puede conducir a disfunción endotelial, fibrosis y engrosamiento de la matriz extracelular y finalmente, hipertensión pulmonar. La congestión de los órganos en la cavidad abdominal habitualmente emerge como consecuencia de la disfunción del lado derecho del corazón y la subsecuente congestión venosa [11]. La hepatopatía congestiva persistente debida al aumento mantenido de la presión venosa central (PVC), puede conducir a fibrosis hepática y cirrosis. La congestión intestinal aumenta la permeabilidad de la barrera intestinal favoreciendo la translocación de endotoxinas y generando un estado proinflamatorio que favorece la disfunción endotelial [12]. Adicionalmente, el edema de la pared intestinal complica el tratamiento de la IC, al disminuir la absorción intestinal de algunos fármacos como la furosemida [13]. La nefropatía congestiva, ocasionada por el aumento de la PVC y la compresión extrarrenal (hipertensión intraabdominal), puede provocar una reducción del flujo sanguíneo renal, hipoxia renal, aumento de la presión intersticial y finalmente, fibrosis intersticial [5].
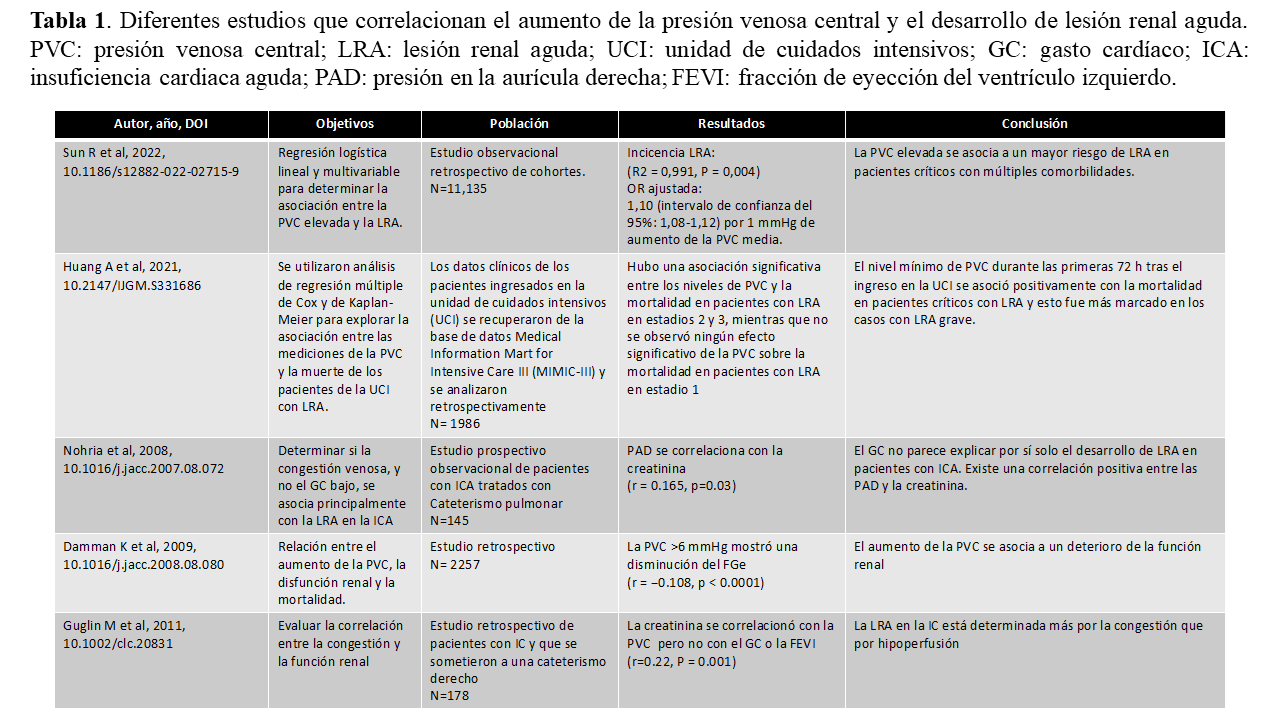
Desde el punto de vista nefrológico, el deterioro de la función renal en el contexto de la IC clásicamente se había considerado secundario a una situación de bajo gasto (anterógrada). Sin embargo, como demostraron Hanberg y colaboradores [14], no existe una correlación entre el descenso del gasto cardíaco (GC) y las alteraciones del nitrógeno ureico en sangre (BUN), la creatinina sérica (Cr) o la tasa del filtrado glomerular estimado (TFGe). Estos mismos resultados han sido replicados por diversos autores. La razón de ello se debe a que el GC influye de manera directa en la hemodinámica intrarrenal ya que los riñones están constantemente adaptando el flujo sanguíneo renal a través de la modulación de la resistencia vascular, un proceso conocido como autorregulación [15]. Los receptores sensibles al estiramiento, localizados en las paredes de las arteriolas aferentes, ajustan el tono vascular preglomerular para mantener constante la presión intraglomerular, dentro de un rango de presión arterial media que oscila entre 70 y 150 mmHg. Asimismo, la activación del sistema renina-angiotensina induce vasoconstricción de la arteriola eferente mediada por angiotensina II, lo que incrementa la resistencia vascular renal, aumentando aún más la presión intraglomerular [15]. Por el contrario, existe una fuerte correlación entre el aumento de la PVC o el aumento de la presión en la aurícula derecha (PAD) y el deterioro de la función renal, entendiendo la presencia de LRA en estos pacientes como secundaría a un mecanismo retrógrado y no anterógrado como inicialmente se pensaba (Tabla 1) [16] [17] [18] [19] [20].
FISIOPATOLOGÍA DE LA NEFROPATÍA CONGESTIVA
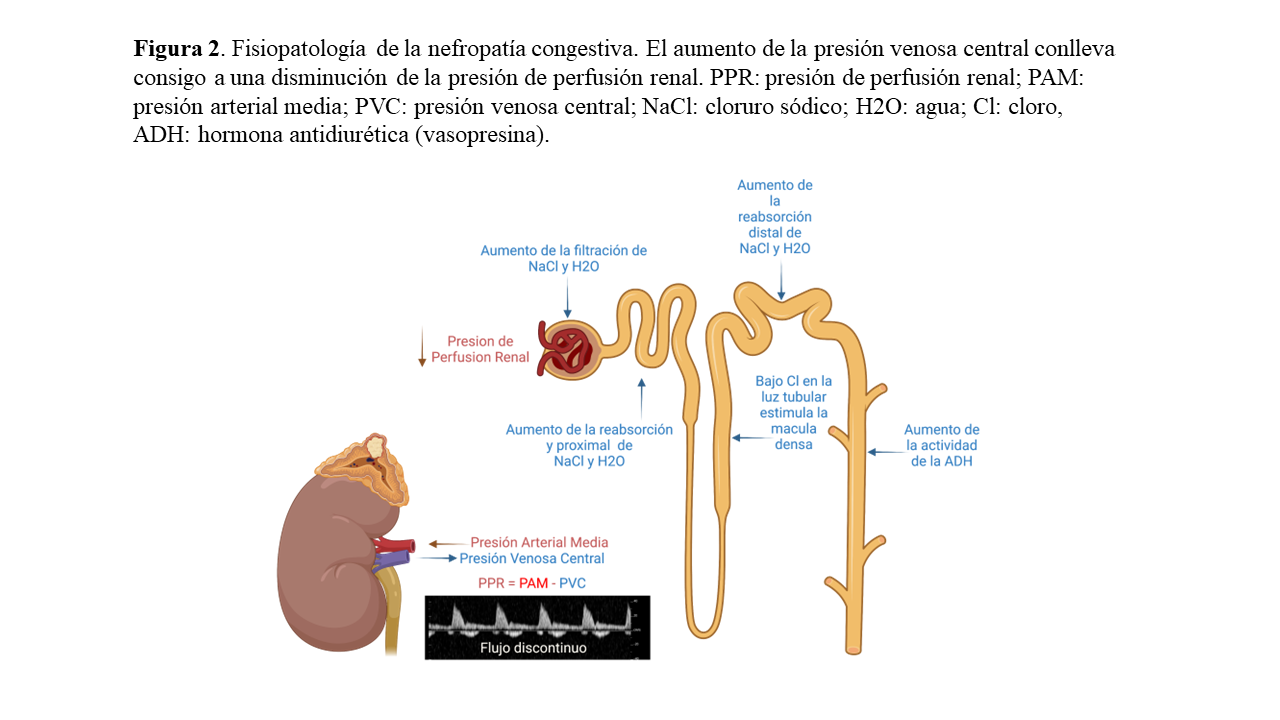
A diferencia del GC, la PVC es uno de los tres factores hemodinámicos que determinan la presión de perfusión renal, junto con la presión arterial y la resistencia vascular renal. De hecho, en estudios experimentales realizados en animales y humanos se ha visto una relación curvilínea entre la PVC y la TFGe; a medida que la PVC aumenta, la TGFe primero aumenta ligeramente y luego cae con brusquedad (Tabla 1) [16] [17] [18] [19] [20].
En pacientes con IC la congestión habitualmente empieza en el espacio intravascular, ocasionando un aumento en la PAD y de la PVC [21]. Se presume que el aumento inicial de la TFGe se debe a un aumento en la presión hidrostática glomerular debido a la elevada presión capilar peritubular a nivel proximal, que resulta en un incremento de la presión de la arteriola eferente. Este fenómeno es comparable con el mecanismo de autorregulación glomerular, donde la vasoconstricción de la arteriola eferente conduce a un aumento de la presión hidrostática intraglomerular y de la fracción de filtración, la cual puede aumentar por encima de un 60% en situaciones de IC para mantener una adecuada TFGe y, como consecuencia, también se produce un aumento en la filtración de cloruro sódico (NaCl) y agua [15] [22]. Este aumento de la fracción de filtración estimula la reabsorción proximal de NaCl hasta un 80%, aumentando la presión hidrostática en el intersticio renal y disminuyendo la presión oncótica [22]. A su vez, el aumento de la reabsorción de NaCl en el túbulo proximal conlleva una disminución del cloro disponible en el asa de Henle, que estimula la actividad de la mácula densa aumentando la actividad del sistema renina angiotensina-aldosterona (SRAA) lo que a su vez produce un incremento mayor de la presión hidrostática en el intersticio renal [22] [23]. Además, se activan otros mecanismos contrarreguladores como el sistema nervioso simpático y la liberación de vasopresina, empeorando aún más la retención hidrosalina [22] (Figura 2).
Este aumento de la presión hidrostática es especialmente importante en el intersticio renal ya que al ser un órgano encapsulado no puede distenderse (situación recientemente conocida como taponamiento renal) [6]. Por último, aumentos adicionales en la presión venosa renal se traducen finalmente en hipoperfusión renal, edema intersticial, disfunción endotelial, reducción de la disponibilidad de óxido nítrico, aumento de la producción de citoquinas inflamatorias, especies reactivas de oxígeno y deterioro de la función renal [5].
DIAGNOSTICANDO LA NEFROPATÍA CONGESTIVA
La creatinina es en la actualidad el biomarcador más ampliamente utilizado para el diagnóstico de la LRA. Sin embargo, es evidente que su elevación es tardía siendo necesario que exista una disminución de más del 50 % de la masa nefronal para que se eleve de forma significativa en sangre [24]. Además, existen diferentes factores como la masa muscular, y algunos fármacos que pueden alterar significativamente su concentración en sangre [24]. Incluso en pacientes con IC en los que se inicia una terapia depletiva la elevación de la creatinina no siempre se asocia a lesiones estructurales del túbulo renal o a peores desenlaces renales (pseudoworst kidney function o permissive acute kidney injury) [25] [26]. En estos pacientes es fundamental reconocer de forma efectiva el estado de volumen para poder discriminar entre un verdadero deterioro de la función renal, en los que se podría plantear una titulación a la baja del tratamiento diurético, o aquellos pacientes que persisten congestivos, en los que se debería mantener la terapía depletiva independientemente de la aparente función renal o considerar el inicio de terapias extracorpóreas de ultrafiltración [27].
Evaluar de forma correcta la presencia de congestión es fundamental en el diagnóstico y el seguimiento del paciente con nefropatía congestiva. Recientemente se propuso la incorporación de la valoración ecográfica de la congestión en pacientes con LRA o enfermedad renal crónica utilizando al menos dos estrategias que además permiten caracterizar de forma correcta la congestión [28]. La primera sería la ecografía pulmonar que permite identificar la sobrecarga izquierda mediante la presencia de congestión tisular pulmonar y/o derrame pleural; y la segunda la valoración ecográfica de la congestión venosa aplicando el protocolo Venous Excess Grading System (VExUS por sus siglas en inglés) [29]. Véase Score VEXUS (Venous Excess Ultrasound Score) en el síndrome cardiorrenal
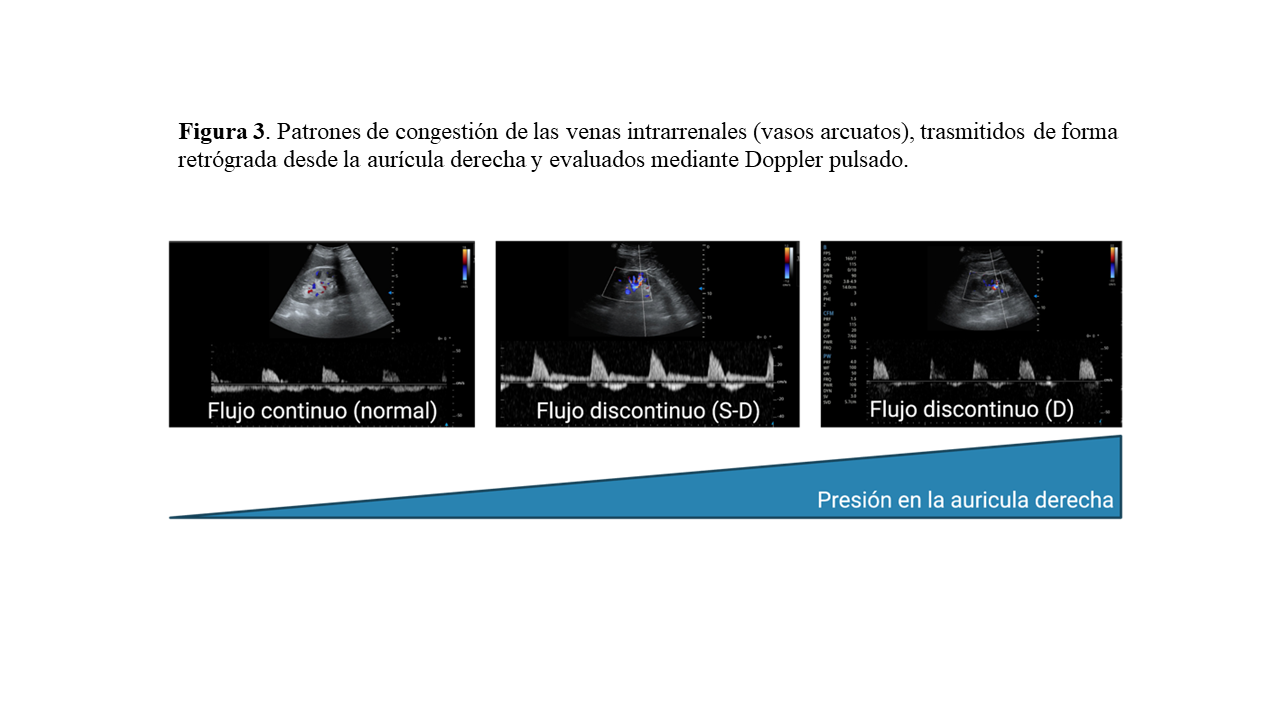
El protocolo VExUS se inicia con la valoración del diámetro y colapsabilidad de la vena cava inferior (VCI), ya que a medida que aumenta la PVC, aumenta el diámetro de la vena cava de manera lineal, hasta valores por encima de los 20 mmHg en los que no puede distenderse más [30]. En este caso, el aumento de la presión se acompaña de pulsatilidad retrógrada en territorios venosos como la vena porta, las suprahepáticas y los vasos intrarrenales. La exploración de los vasos intrarrenales se realiza mediante Doppler pulsado de los vasos interlobares por encima de la médula renal, en los que la arteria y la vena discurren juntos, obteniendo en el trazado por encima de la línea de base el flujo arterial bifásico y por debajo el flujo venoso [31]. En condiciones normales, el flujo venoso es continuo, pero a medida que aumenta la pulsatilidad, o lo que es lo mismo, la congestión venosa, este flujo cambia a un flujo discontinuo que puede ser bifásico (S-D) o monofásico (D) [32] (Figura 3). La presencia de un flujo discontinuo se asocia a congestión venosa renal transmitida retrógradamente desde la aurícula derecha [33].
Un interesante estudio publicado por Iida N et al [34] demostraron que el flujo discontinuo de las venas intrarrenales se asociaba a disminución de la TFGe, aumento de biomarcadores de congestión como BNP, mayor disfunción diastólica, mayor disfunción del ventrículo derecho y mayores presiones en la aurícula derecha sin cambios significativos en el índice cardíaco. Es de destacar que en este estudio más del 60 % de los pacientes con un flujo discontinuo presentaban deterioro de la función renal. Además, aquellos pacientes con flujo bifásico y monofásico presentaban peores desenlaces. Otro estudio publicado por Beaubien-Souligny y colaboradores [35] demostró que aquellos pacientes que después de la cirugía cardíaca tenían un flujo monofásico, tenían mayor probabilidad de desarrollar LRA (HR: 2,81 (1,42–5,56); p=0,003). Por último, un metaanálisis publicado recientemente por Ferrari y colaboradores [36], que incluyó más de 400 pacientes, demostró que la presencia de un flujo continuo de las venas intrarrenales se asociaba a una menor probabilidad de desarrollar LRA (RR: 0,46 (0,28–0,76). Sin embargo, es importante destacar la gran heterogeneidad de los estudios incluidos en el análisis. Existe además, una interesante correlación positiva entre el flujo discontinuo de las venas intrarrenales medido en las primeras 24h del ingreso por un episodio de IC aguda y la elevación del antígeno carbohidrato 125 (CA-125), sin encontrarse correlación con otros biomarcadores de congestión como el NT-proBNP [37].
Finalmente, la albuminuria emerge como un nuevo biomarcador en el escenario de la congestión, probablemente en relación con la presencia de disfunción endotelial y el aumento de la PVC [38]. En un reciente estudio publicado por Boorsma y colaboradores [39], en el que se analizaron dos cohortes independientes del estudio BIOSTAT-CHF, que incluyó más de 3746 pacientes, se observó que la prevalencia de albuminuria > 300 mg/g era del 10% y la > 30 mg/g era del 35%. La presencia de albuminuria se correlacionaba con datos clínicos y ecográficos, entre ellos el aumento de la PVC y la elevación de biomarcadores séricos de congestión. Además, la presencia de albuminuria en pacientes con IC se asoció a mayor mortalidad y mayores ingresos por IC.
MECANISMOS DE RESISTENCIA A DIURÉTICOS: DESCUBRIENDO AL CULPABLE
Se define la resistencia a diuréticos como el fallo para aumentar la eliminación de sodio y agua de forma suficiente para eliminar este exceso a pesar de tratamiento con dosis plenas de diuréticos de asa [40]. Cuantitativamente esta resistencia existe cuando la dosis de furosemida oral de 160 mg dos veces al día o el equivalente de torasemida no es suficiente para eliminar al menos 90 mmol de sodio en tres días o, si en una muestra simple de orina se eliminan menos de 50 mmol de sodio 1-2 horas tras la administración de un diurético de asa [41]. Más del 90% de los diuréticos se unen a la albúmina tras su absorción por lo que la hipoalbuminemia y la disminución del flujo sanguíneo renal disminuyen la acción de los diuréticos. Por ello, se ha propuesto la administración de albúmina junto a los diuréticos para mejorar la respuesta al fármaco. De los diuréticos, la furosemida es la de menor biodisponibilidad, debido a un primer paso hepático que no tienen torasemida o bumetanida. Además, su metabolismo renal le confiere otros efectos secundarios en presencia de insuficiencia renal [40] [42].
Existen varios mecanismos implicados en la resistencia a diuréticos, que enumeramos a continuación:
1) Diagnóstico incorrecto de la situación de volemia o una pobre adherencia a la medicación.
2) Disminución de la llegada de diuréticos al riñón en situaciones de edema de pared intestinal, hipoalbuminemia o una dosis o frecuencia inadecuada de diuréticos [42].
3) Reducción de la secreción de diuréticos por inhibición de transporte tubular por toxinas urémicas, así como fármacos como antiinflamatorios no esteroideos (AINEs), que compiten con los diuréticos de asa por el transporte tubular a nivel del OAT 1 y OAT 2 en la célula del epitelio proximal tubular [13].
4) Descenso de la presión de perfusión renal. La presión de perfusión renal es la diferencia entre la presión media arterial (MAP) y la PVC. En estos casos habrá menor filtración glomerular de agua y sodio y, por tanto, menor secreción tubular de diuréticos [13].
5) Respuesta renal insuficiente al diurético de asa: en situaciones de enfermedad renal crónica cuando hay disminución de masa renal funcionante, pero también incremento de avidez por el sodio. Esto ocurre en el fenómeno compensatorio de retención de sodio tras el diurético (CPDSR o Compensatory post-diuretic renal sodium reabsorption) o en el fenómeno de frenado (Braking phenomenon)[42].
En el CPDSR, realizado en estudios con voluntarios sanos se ha demostrado que tras administrar diuréticos de asa por vía endovenosa, existía un incremento de la excreción del sodio, con un posterior incremento de la retención del mismo como mecanismo de protección renal y como respuesta adecuada al exceso de diuréticos. Esta situación no ocurre en la IC congestiva, en la que existe resistencia a diuréticos [43].
El fenómeno de frenado consiste en la adaptación crónica al uso continuado de diuréticos de asa. En este caso se produce una reabsorción tubular que es estimulada tras la pérdida de fluidos por la activación del SRAA, noradrenalina y activación del sistema nervioso simpático [13]. En este fenómeno, a nivel celular, hay hipertrofia e hiperplasia de células tubulares distales de la nefrona (transportador Na-Cl). Estos canales están activamente presentes y se relacionan con la avidez al sodio en el fenómeno de frenada [44]. Al contrario que en voluntarios sanos, en pacientes con ICC se ha demostrado un estado continuo de avidez al sodio, con lo que no hay rebote (no CPDSR) [43]. En estos pacientes, la primera muestra de eliminación de sodio predice la evolución. Cuando la respuesta es elevada, será mejor que cuando exista una pobre respuesta inicial. En este caso, al tener una reducción de flujo urinario, con hiperfiltración a nivel de la nefrona, se produce un incremento de la filtración de agua y solutos, aumenta la presión oncótica peritubular y hay un mayor flujo linfático renal, que tiene como resultado una mayor reabsorción de agua y sodio en el túbulo proximal [43]. Este mecanismo puede tener lugar también en el asa de Henle, llegando un menor flujo de sodio y cloro, lo que provoca la liberación de renina (por descenso de la cantidad de cloro que llega a la mácula densa), activando por tanto el SRAA [13]. Asimismo, el descenso de flujo tubular hacia el túbulo colector aumentará los niveles de aldosterona y hormona antidiurética (ADH), incrementando la reabsorción de sodio y agua [13] [43].
Predecir en la práctica clínica habitual la resistencia diurética sigue siendo un reto. Evaluar la respuesta diurética utilizando el test de estrés de furosemida [45] y la respuesta natriurética midiendo el sodio urinario (NaU) parecen dos estrategias razonables [23]. El test de estrés de furosemida evalúa la respuesta diurética al administrar furosemida en bolo (1,5 mg/kg en paciente naïve y 1 mg/kg en pacientes que ya utilizan furosemida). Una diuresis menor a 200 mL dos horas después de la administración de furosemida mostró una mayor probabilidad de desarrollar LRA grado 3 o la necesidad de terapias de reemplazo renal [46].
Por otro lado, valores de NaU menores a 50-70mmol/L dos horas después de administrar furosemida mostraron una menor respuesta al diurético y peores desenlaces [47]. Un estudio publicado por Caravaca Pérez et al mostró que, en pacientes con IC aguda, la respuesta negativa al test de estrés de furosemida y valores de NaU < 113mmol/L se asociaban a una menor diuresis acumulada, menor pérdida de peso y pobre respuesta diurética. Además, se asoció con una mayor estancia hospitalaria, empeoramiento de la IC y mayores reingresos por IC [48].
Para finalizar, se proponen varias estrategias para reducir la resistencia a los diuréticos y aumentar su eficacia: conocer perfectamente el fármaco (mecanismo de acción, vías de administración, dosis y farmacocinética), inducir el bloqueo secuencial de la nefrona para evitar reabsorción de sodio distal, antagonizar la vasopresina mediante el uso de acuaréticos para aumentar la excreción de agua libre, y si fallan estos mecanismos plantear la ultrafiltración con máquina o con diálisis peritoneal [40].