Embarazo y Riñón
Palabras clave
Preeclampsia, Eclampsia, Síndrome HELLP, COVIS-19
Resumen ejecutivo
1 Cambios Hemodinámicos y Fisiologia Renal en el Embarazo
2 Anatomía y Fisiologia de la Placenta.
2-1 Componente Fetal de la Placenta
2-2 Componente Materno de la Placenta
2-3 Formación de la Placenta
2-4 Funciones de la Placenta
3 Hipertensión Arterial en el Embarazo
4 Preeclampsia (PE)
5 Nefropatía de la PE. Sindrome Nefrótico
6 Tratamiento de la PE y de la Hipertensión Arterial del Embarazo
7 Prevención de la PE
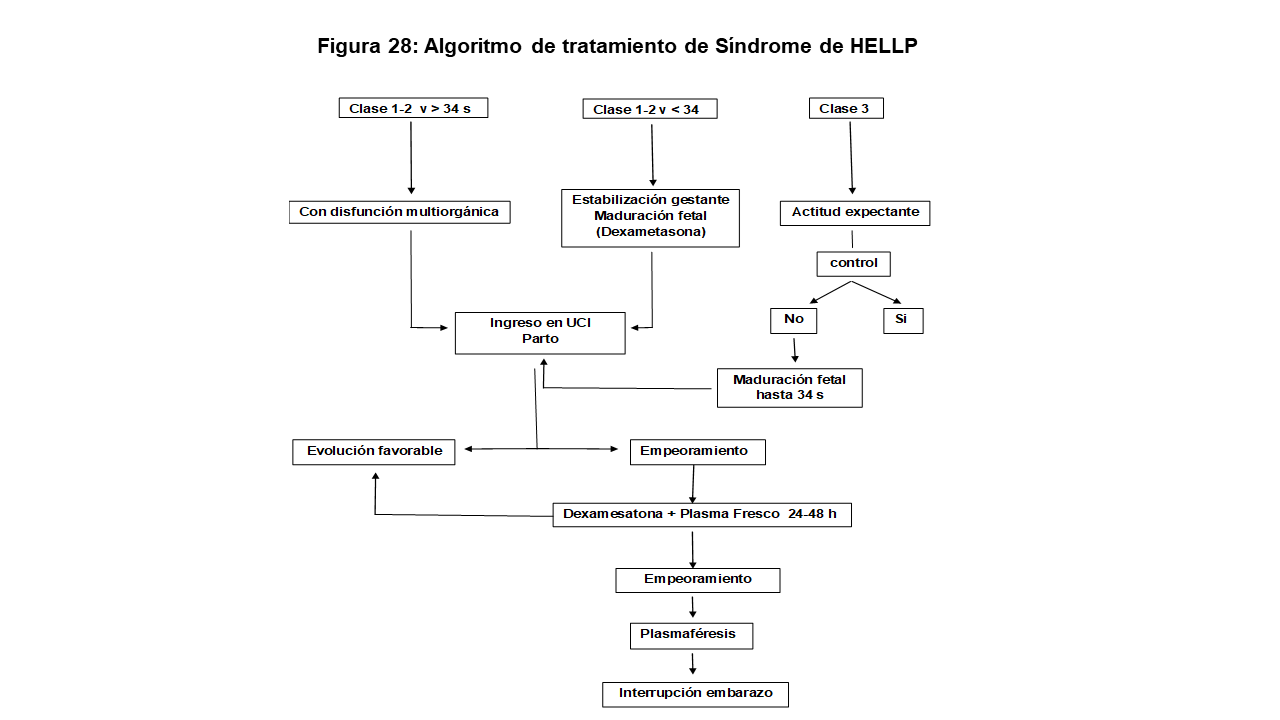
8 Sindrome de HELLP (Hemolysis, Elevated Liver Enzimes, Low-Platelet count)
9 Embarazo como Factor de Riesgo Vascular
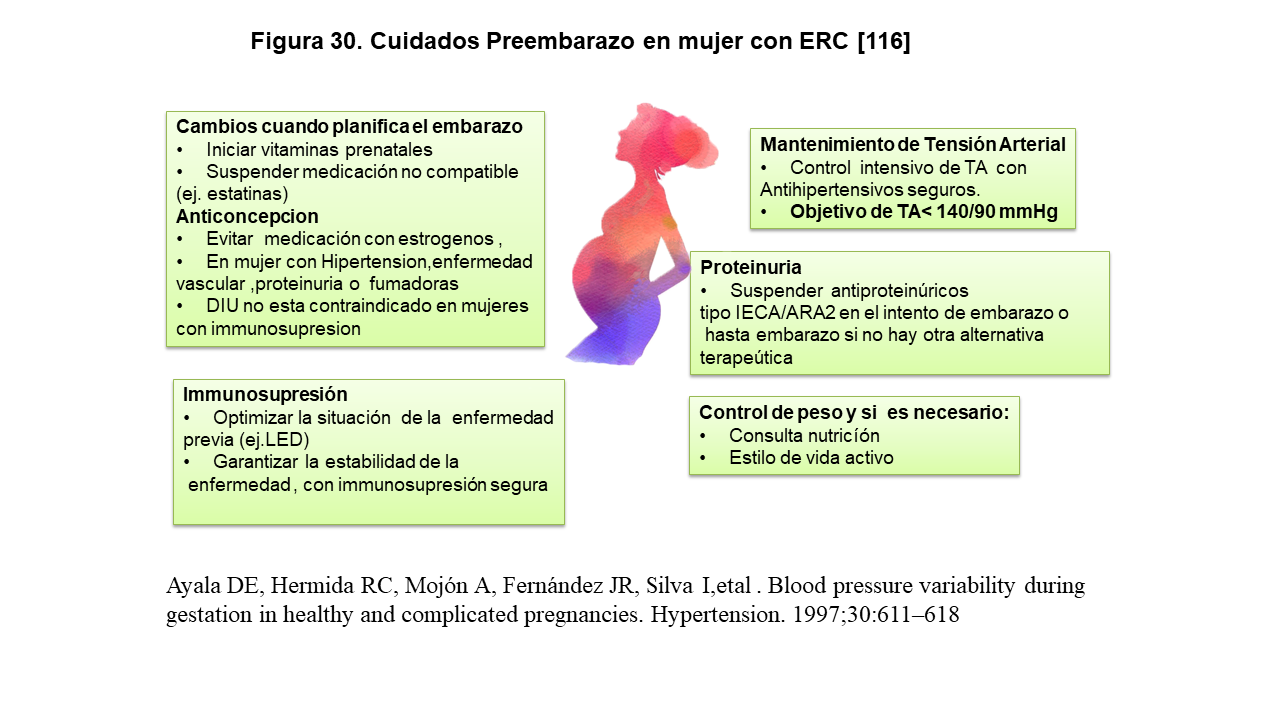
10 Embarazo y Enfermedad Renal Crónica
11 Embarazo y Trasplante Renal
12 Embarazo y Diabetes Mellitus
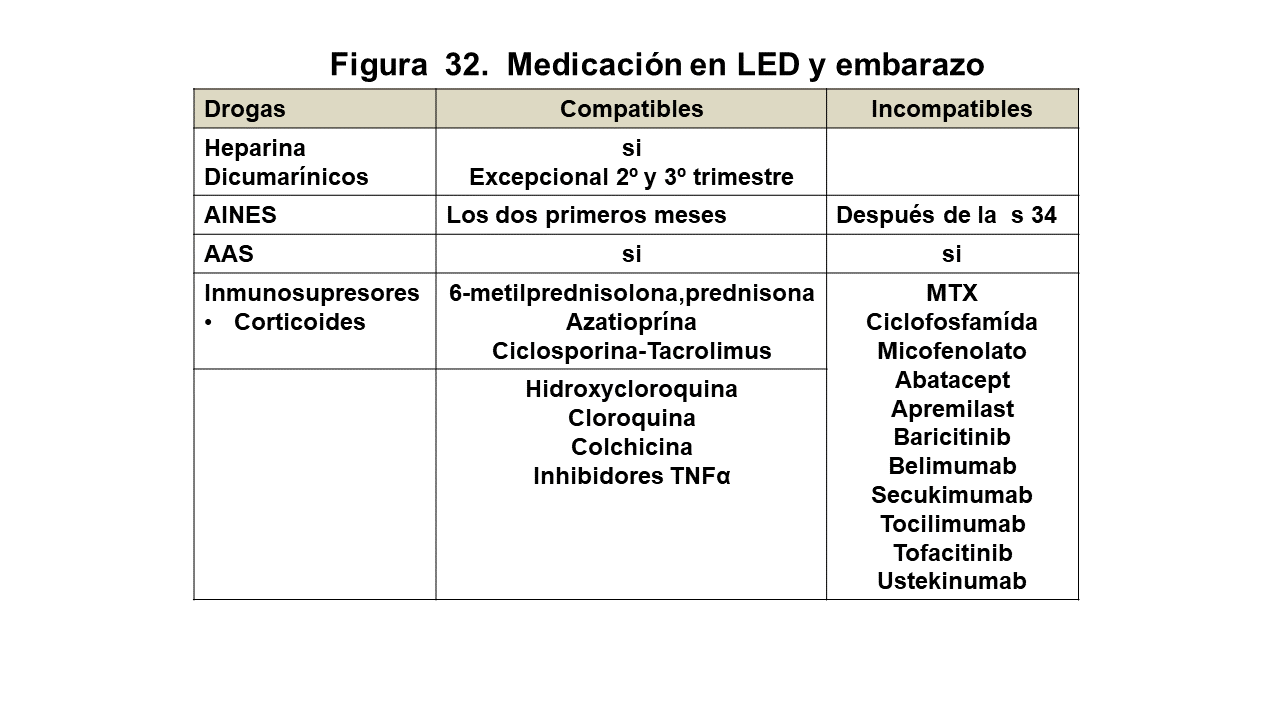
13 Embarazo y Enfermedades Sistémicas
14 Embarazo y COVID-19
RESUMEN EJECUTIVO
1º.- Los cambios hemodinámicos más importantes del embarazo son:
Aumento de GC (Gasto Cardiaco) un 50% hasta la semana 24, disminución de la TA 10 mmHg hasta el final del 1º trimestre y aumento del VS (Volumen Sistólico) y a término, el volumen total es 100 ml/Kg.
La sobrecarga de volumen produce un remodelado cardiaco que revierte posparto.
Aumento de la masa de hematíes y volumen sanguíneo, produciendo una anemia fisiológica, necesaria para disminuir la viscosidad sanguínea y aumentar el FPR (Flujo Plasmático Renal) y placentario. Paralelamente, se producen modificaciones del sistema de coagulación (descenso de Proteína S, incremento de Factores I, II, V, VII, VIII y XII, y aumento de la actividad de los inhibidores de la fibrinólisis PA-1 y PA-2) y se produce un estado de hipercoagulabilidad para proteger a la gestante frente a las hemorragias posparto, pero aumenta el riesgo de procesos tromboembólicos.
2º.- Los cambios funcionales del riñón asociados al embarazo esencialmente son:
Hiperfiltración Renal por aumento del FG un 40-60%, aumento del sistema renina angiotensina aldosterona (SRAA) pero por aumento de la síntesis de PGE2 y la amplia expansión de volumen, la angiotensina II a nivel renal y placentario no tiene acción vasoconstrictora.
La función tubular se caracteriza por aumento de la reabsorción de Na+ a un ritmo de 20-30 mEq/semana, y discreta hiperkaliemia por el efecto antimineralocorticoide de la progesterona.
3º.- Función metabólica: el coste energético es de 80.000 kCal durante el embarazo y la mitad se produce durante la fase anabólica o “primera mitad” de la gestación.
El metabolismo de la glucosa esta condicionado por la resistencia a la insulina, similar a la Diabetes Mellitus.
El balance nitrogenado es negativo, el consumo de aminoácidos disminuye, el perfil lipíco cambia con un aumento dos veces de los trigliceridos, y un 50% el colesterol. El hierro disminuye por la práctica desapricion de la hepcidina.
Las reservas totales de calcio y fósforo disminuyen. La tasa de PTH esta disminuida y el control del Ca++ se hace a través de PTHrP.
La hipouricemia, es por disminución de la reabsorción tubular, se desconoce la causa de la aminoaciduria, la glucosuria se debe a un defecto tubular primario y el pH ligeramente alcalino es por hiperventilación.
4º.- El mecanismo patogénico de la PE es la HIPOXIA, secundaria a la alteración de la transformación del endometrio vascular a endotelio como consecuencia de mayor tasa de sFlT1 (soluble fms-like-tyrosine kinase) por mayor expresión de AT1AA (anticuerpos agonistas de AT1) y Endoglina que condiciona la inhibición de los factores de crecimiento vascular: VEGF (factor de crecimiento vascular) y PIGF (factor de crecimiento placentario).
5º.- El criterio diagnóstico de PE es:
TAS > 140 mmHg o TAD > 90 mmHg en dos ocasiones, al menos 4 horas de diferencia después de la semana 20, y en mujer previamente sin HTA, proteinuria > 300 mg en 24h ó cociente proteína/creatinina > 0,3 mg/dl en ausencia de proteinuria, y al menos debe tener uno los siguientes factores:
Trombocitopenia < 100.000 / ml
Insuficiencia renal: Cr(p) > 1,1 mg/dl o doble de creatinina en ausencia de enfermedad renal previa
Disminución de función hepática: elevación de transaminasas al doble.
Edema pulmonar
Cefalea o síntomas visuales
6º.- Diagnóstico precoz de la PE:
Factores de riesgo dependientes de la madre (edad, nuliparidad, PE previa, diabetes, enfermedad renal), (Calidad evidencia: ALTA. Fuerza recomendación: Fuerte).
Medición de TA: Monitorización Ambulatoria de la Presión Arterial (MAPA)/48 h y cálculo del Índice Hiperbárico (IHB) antes de la semana 16 (IHB patológico > 12) (Calidad evidencia: ALTA. Fuerza recomendación: Fuerte).
Biomarcadores (PIGF+PAPP-A) y EcoDoppler de la arteria uterina (Calidad evidencia: ALTA. Fuerza recomendación: Fuerte).
7º.- La prevención primaria de la PE se debe tratar con AAS 100 mg/día/nocturno, preferiblemente antes de la 16 semana y continuar hasta la semana 36 (Calidad evidencia: ALTA. Fuerza recomendación: Fuerte).
8º.- El tratamiento de la PE es el parto y el objetivo terapéutico de la HTA en PE, es la prevención del ACVA en la madre, puesto que la PE no se corrige; y la TA "objetivo" es 130-150/80-100 mmHg (Calidad evidencia: ALTA. Fuerza recomendación: Fuerte).
9º.- Las complicaciones hipertensivas del embarazo pueden considerarse como un posible factor de riesgo cardiovascular futuro.
10º.- El embarazo en situaciones especiales:
En la ERC moderada (E1-2) o severa (E3-4) existe alto riesgo de PE, progresión de la enfermedad renal y riesgo fetal. En el E5 el esquema dialítico es diálisis larga nocturna.
En el Trasplante Renal es aconsejable retrasar el posible embarazo al menos 1 año, y durante el cual la función renal sea estable y con mínima proteinuria. La PE aparece en un tercio de las mujeres, las infecciones por Poliomavirus se trasmiten verticalmente, los inmunosupresores son teratogénicos.
En la Diabetes Mellitus es más frecuente el parto prematuro y el deterioro de la función renal.
Entre las enfermedades sistémicas, la más representativa es el lupus y el embarazo es un factor de reactivación. El uso de anticoagulantes está restringido a la heparina y los inmunosupresores no teratogénicos son la prednisona y la azatioprina.
El embarazo es una situación de ALTO RIESGO para COVID-19, especialmente en 2 y 3º trimestre. Los criterios diagnósticos son iguales a la población general y los tests serológicos de ELISA IgM con PCR aumenta la sensibilidad diagnostica (98%) y no hay contraindicación para la realización de pruebas radiológicas (TAC). No existe transmisión vertical al feto como tampoco por la lactancia. No hay un tratamiento eficaz (esteroides o antipalúdicos) y los antirretrovirales, estarían indicados (lopinavir/ritonavir) si no hay otras opciones para la vida materna.
1. CAMBIOS HEMODINÁMICOS Y FISIOLOGÍA RENAL EN EL EMBARAZO
1.1.- Cambios Hemodinámicos
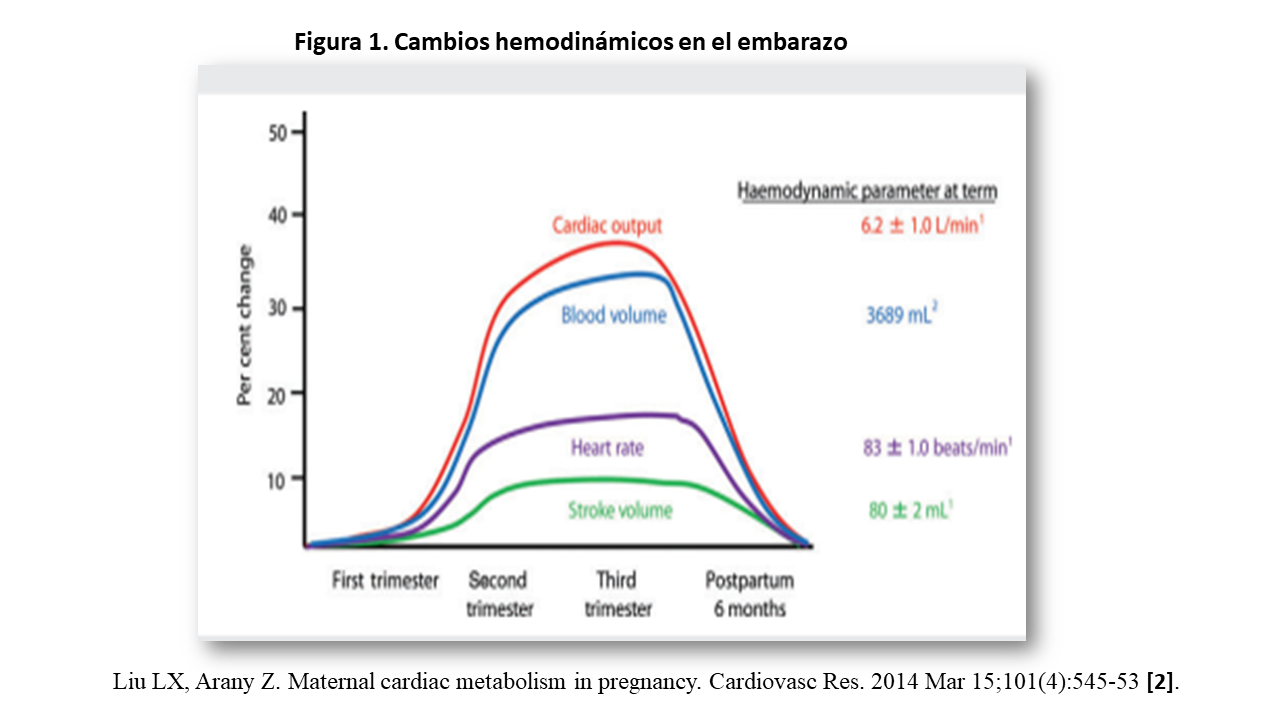
Los más importantes son (Figura 1) :
a) Gasto Cardiaco (GC): aumenta hasta un 50% en la semana 24 [1] debido al incremento de la precarga por mayor volumen vistólico, disminución de la poscarga por aumento de la frecuencia cardiaca y reducción de las resistencias periféricas un 30% desde la semana 8 de gestación debido a la circulación uteroplacentaria [2].
La contractilidad miocárdica y las fracciones de eyección ventricular izquierda y ventricular derecha no parecen cambiar durante el embarazo [3] pero la sobrecarga de volumen produce remodelado cardiaco. El grosor de la pared ventricular izquierda y la masa aumentan un 28% y un 52% por encima de los valores previos al embarazo, y a lo largo de la gestación. Los estudios realizados en ratones gestantes sugieren que el remodelado cardiaco, es temporal, asociado a la sobrecarga de volumen. La hipertrofia ventricular, se acompaña de un aumento del factor de crecimiento endotelial vascular y de la angiogénesis miocárdica. sin incremento de la fibrosis cardíaca. Esta hipertrofia cardíaca fisiológica inducida por el embarazo, revierte después del parto [4] y las vías de señalización molecular cardíaca, activadas en la hipertrofia inducida por el embarazo, son distintas de las activadas durante la hipertrofia patológica. Se ha demostrado que algunas de estas vías están reguladas por miARN.
Las vías mejor caracterizadas son phosphoinositide-3-kinase/protein kinase B/glycogen synthase kinase 3? (PI3K/Akt/ GSK3?), mitogenactivated protein kinase (MAPK), señalización de calcineurina, y transducer and activator of transcription (STAT3). No obstante, son precisas mas investigaciones para aclarar su papel como biomarcador y implicación en el desarrollo de la hipertrofia cardiaca funcional [5] [6].
b]) Presión Arterial (PA): disminuye 10 mmHg al final del 1º trimestre, pero en el segundo y tercero vuelve a valores pre-embarazo; los mecanismos implicados son el aumento de la producción de óxido nítrico (ON) y la reducción de la resistencia aórtica.
c) Volumen sanguíneo (VS): aumenta un 50% desde el primer trimestre. Inicialmente 10 a 15 % entre la semana 6 y 12, y sigue elevándose hasta la semana 34. Desde ese momento, y hasta el parto, el incremento ya es menor. El péptido natriuretico atrial (PNA) esta disminuido, aunque en el embarazo complicado con preeclampsia, esta aumentado [7].
El volumen total de sangre a término es 100 mL/Kg. La masa de hematíes aumenta, pero el mayor incremento del VS produce un descenso del hematocrito, fenómeno conocido como “anemia fisiológica”. Los beneficios son la disminución de la viscosidad sanguínea, la protección frente a las hemorragias postparto, y un mayor flujo renal y placentario que contribuye a una mejor nutrición fetal.
Paralelamente, se producen modificaciones del sistema de coagulación como: descenso de Proteína S, incremento de Factores I,II,V,VII,VIII y XII, y aumento de la actividad de los inhibidores de la fibrinólisis PA-1 y PA-2.
Estos cambios producen un estado de hipercoagulabilidad cuya misión fundamental es la protección frente a las hemorragias postparto, pero el efecto peligroso es el aumento del riesgo de procesos tromboembólicos.
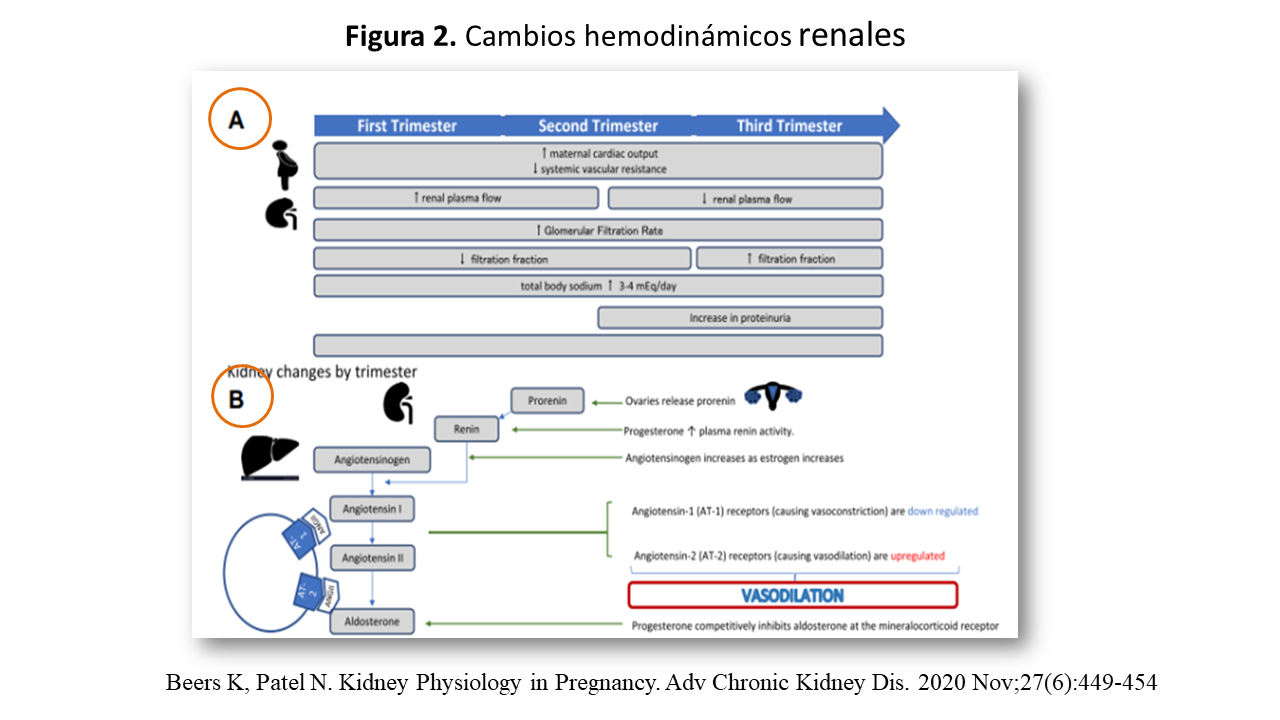
1.2.- Cambios Anatómicos y Hemodinámicos Renales (Figura 2)
Cambios anatómicos
Desde la 5ª semana de gestación, el riñón aumenta un centímetro de longitud como consecuencia del incremento del volumen vascular renal, pero el cambio más llamativo es la dilatación del sistema colector o hidronefrosis fisiológica del embarazo, presumiblemente debida a una mayor secreción de prostaglandinas. Esto contribuye a un aumento de la incidencia de reflujo vesicoureteral, y puede mantenerse hasta las 12 semanas postparto.
Filtrado glomerular (FG) y Flujo plasmático renal (FPR)
En la embarazada sana el FG aumenta entre 40-60% y el FPR un 60-80 %; es un estado de hiperfiltración [8] cuyos mecanismos fisiológicos son:
* Aumento del Gasto cardiaco e incremento del FPR. En el primer trimestre el FPR aumenta hasta 809 ml/min y se mantiene alrededor de 695 ml/min en las últimas 10 semanas; y en el posparto desciende hasta 482 ml/min.
* Menor presión oncótica y hemodilución
* Menor resistencia vascular renal (RVR). Es debido a una mayor producción de relaxina por el cuerpo lúteo, estimulado por la gonadotropina coriónica que convierte la endotelina en su forma activa y aumenta la producción de ON [9].
La traducción clínica de este aumento del FG, es la disminución de las tasas plasmáticas de urea y creatinina (Cr). Los niveles plasmáticos de Cr pueden ser inferiores a 0,5 mg/dl, y en consecuencia, el eGFR no se puede calcular por las fórmulas de estimación [10].
Sistema Renina-Angiotensina-Aldosterona (SRAA):
La clave para el mantenimiento de la vasodilatacion en la gestación, es la modificación del SRAA como se ilustra en la Figura 2 B (Figura 2). La renina está aumentada hasta ocho veces y el angiotensinógeno hasta tres o cuatro, por lo que es posible que la Actividad de Renina Plasmática (ARP) esté aumentada hasta 15 veces debido a una mayor producción por el ovario y la decidua materna [11] [12], como también sucede con la prorrenina y curiosamente la ECA (enzima de conversión de la angiotensina) esta disminuida. Todos estos cambios, se producen en un ambiente con amplia expansión del volumen extracelular y mayor carga filtrada de Na+ en el túbulo distal, y por tanto no se suprime el eje SRAA. La Angiotensina II (AII), esta aumentada, e incrementa la síntesis de progesterona y postaglandina PGE2 y esta, a su vez aumenta el FPR por lo que, curiosamente, la AII a nivel de circulación renal y placentaria no tendrá acción vasoconstrictora [13]. Es posible que a ello contribuya que los receptores de angiotensina I (vasoconstrictores) estén “downregulated” y los receptores de AII (vasodilatadores) estén “upregulated” [14].
Síntesis de Prostaglandinas (PG)
Los tejidos placentarios y la arteria umbilical pueden generar entre 10 a 100 veces más PG que otras arterias, pero esta mayor síntesis disminuye de forma significativa en situaciones de PE [15]. El mecanismo no es conocido, pero es una situación similar al Síndrome de Bartter, en su concepción patogénica clásica: concentraciones elevadas de PG, resistencia a la acción de AII y TA baja o normal [12] [16].
Función tubular
La situación de hiperfiltración condiciona alteraciones de la función tubular que, esencialmente, son:
Sodio: El embarazo es el ejemplo más importante de la eficacia del equilibrio glomérulo tubular para conservar un adecuado balance de sodio. El FG está aumentado un 50%, y si la carga filtrada de Na+ es 140 mEq/L x 100 ml/min de FG, el Na+ filtrado es 20.160 mEq/L, pero si el FG aumenta un 50%, el Na+ filtrado seria 30.240 mEq/L lo que obliga a reabsorber 10.000 mEq/L más, que en la mujer no gestante. La reabsorción se produce a lo largo de todo el túbulo renal y los mecanismos implicados no son totalmente conocidos. Es posible que la disminución de la sintesis del PNA desempeñe un papel importante [17].
Como consecuencia de la disminución de las RVS y la expansión del volumen extracelular, se puede producir retención de Na+ a un ritmo de 20-30 mEq/semana, lo que se traduce en un aumento de 12-13 Kg/peso, y puede producir edema, pero no tiene significado patológico. En el último tercio del embarazo puede aumentar como consecuencia de la compresión de la vena cava inferior y la reducción de la presión coloidosmótica.
Agua: Las embarazadas mantienen un equilibrio del agua y conservan intacto el mecanismo de concentración y dilución.
Potasio: A pesar del aumento de aldosterona, el K+ esta discretamente elevado debido al aumento de progesterona y su efecto antimineralocorticoide [18].
1.3 Metabolismo del embarazo [2]
* El coste energético del embarazo es muy variable, pero por término medio, es del orden de 80.000 kcal, la mitad de produce durante la fase anabólica del embarazo o primera mitad del embarazo y se almacena como grasa materna, con un aumento medio de 3,5 Kg. La otra mitad del aporte calórico es en la segunda mitad del embarazo o fase catabólica, y corresponde al crecimiento fetal alcanzando 250 kcal/día cerca del final del embarazo.
* Glucosa: La glucosa es el sustrato preferido del feto y su manejo cambia drásticamente durante el embarazo. La resistencia materna a la insulina se desarrolla, normalmente al principio del embarazo, llegando a disminuir un 80% la sensibilidad a la insulina, limitando así el consumo materno de glucosa y permitiendo la derivación de la mayor parte de la glucosa a la placenta. Por lo tanto, el embarazo se caracteriza por una resistencia a la insulina similar a la de las pacientes diabéticas.
La glucosuria, se acompañada de otros azúcares (lactosa, fructosa,..) cuyo mecanismo es tanto por un aumento de carga filtrada como un defecto tubular primario.
* La resistencia a la insulina, también produce lipólisis, aumentando la tasa de ácidos grasos para el consumo materno y se cambia el glicerol como sustrato gluconeogénico y se preservan los aminoácidos para el feto.
* El balance nitrogenado es negativo y se refleja en una menor secreción de urea, principalmente al final de la gestación.
* El consumo de aminoácidos de cadena ramificada disminuye, mientras que la síntesis de proteínas se eleva en un 25% en el tercer trimestre. Existe aminoaciduria, excepto para arginina, y la causa es desconocida.
* Los lípidos séricos aumentan drásticamente durante el embarazo. Los triglicéridos se multiplican por dos o por cuatro, el colesterol total aumenta un 25-50% y el LDL por 50%. Así pues, el embarazo genera un perfil lipídico relativamente aterogénico, que puede contribuir a la propensión al daño endotelial durante el embarazo.
* El hierro es bajo y la madre deberá aumentar su ingesta hasta 5 veces diaria porque la hepcidina, la principal hormona que regula la homeostasis del hierro es casi indetectable.
* Ácido úrico: La síntesis de uratos permanece constante durante el embarazo, pero su aclaramiento aumenta, causando una discreta hipouricemia (2,5 a 4 mg/dL) en las primeras semanas, posiblemente por disminución de hasta un 25% de la reabsorción tubular. En la fase final del embarazo y coincidente con el descenso del FPR, el ácido úrico vuelve a su tasa normal.
* Equilibrio Ácido Base: El pH es ligeramente alcalino, contrariamente a lo esperado, y es debido a la hiperventilación y las elevadas tasas de progesterona.
* Vitaminas hidrosolubles
La valoración de las tasas plasmáticas de las vitaminas hidrosolubes se puede realizar a través de la excreción unrinaria. No se observaron cambios en los niveles de excreción urinaria de vitamina B2, B6, B12, biotina o vitamina C entre etapas. Los niveles de nicotinamida y folato en orina son más altos en las mujeres embarazadas que en las mujeres control. El nivel de excreción urinaria de vitamina B1 disminuye durante la lactancia y la de ácido pantoténico disminuye durante el embarazo y la lactancia [19].
* Calcio:
El embarazo tiene varios efectos sobre la homeostasis del calcio materno y, aunque el calcio sérico ionizado permanece constante durante todo el embarazo, las reservas totales de calcio y fosfato disminuyen, pero el feto recibe por transporte placentario activo 30-35 g de calcio durante las 40 semanas de gestación. En el mecanismo de control intervienen diferentes factores, pero la PTH o bien permanece inalterada o disminuye de forma significativa en el primer trimestre y después, va aumentando hasta el final de la gestación [20].
Las tasas de 1,25-(OH)2D3 están significativamente elevadas posiblemente debido a que el gen CYP24A1, responsable de la 24-hydroxylasa, esta reducido en la placenta, mientras que el gen CYP27B1 de 1-?-hydroxilasa esta aumentado [21], pero el mecanismo que subyace al aumento de la producción de 1,25(OH)2D3 no está claro. En general, la PTH es la hormona clave que estimula la síntesis renal de 1,25(OH)2D3, sin embargo, dado que la concentración de PTH está disminuida en el embarazo, es poco probable que sea la principal responsable del aumento de 1,25(OH)2D3. Aunque hormonas como los estrógenos, la prolactina, la hormona de crecimiento y el factor de crecimiento similar a la insulina-I pueden inducir la actividad de la 1-?-hidroxilasa, es probable que la PTHrP desempeñe un papel clave. El receptor de la PTH/PTHrP, presenta “efectos PTH”, incluida la estimulación de la producción renal de 1,25(OH)2D3 y se detecta en concentraciones elevadas en el plasma de las embarazadas, probablemente procedentes de los tejidos fetal, placentario y mamario, y su concentración se multiplica por dos aproximadamente, desde el principio hasta el final del embarazo. La PTHrP también puede desempeñar otras funciones en el embarazo, como la regulación del transporte placentario de Ca+ y la modulación del recambio óseo [22] [23]. Todo ello contribuye a una mayor absorción intestinal de Ca++; consecuentemente, existe mayor carga filtrada y también mayor incidencia de litiasis, a pesar de la excreción de inhibidores como citrato y magnesio.
2.- ANATOMÍA Y FISIOLOGIA DE LA PLACENTA.
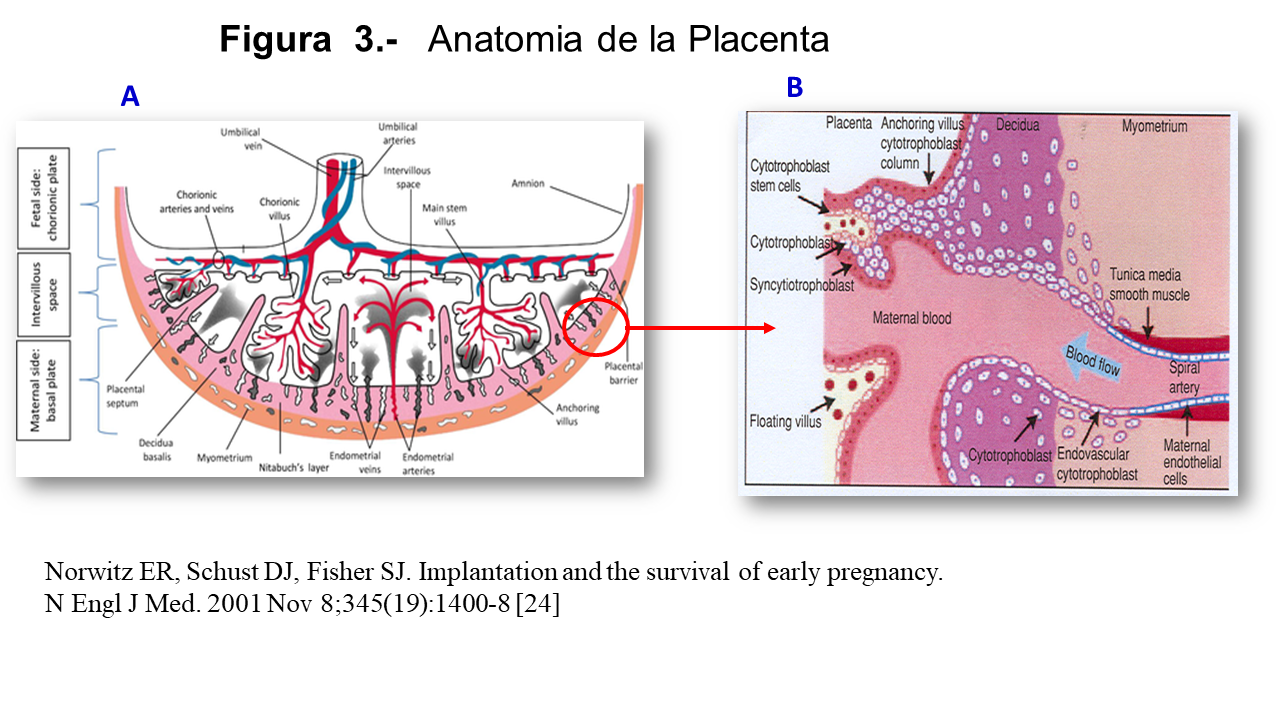
La placenta (Figura 3) es el órgano mas especializado, y mas implicado, con ayuda del líquido amniótico, en el desarrollo del embarazo [24].
La placenta tiene una parte fetal y otra materna cuyas funciones y desarrollo se muestran a continuación.
2-1.- Componente fetal de la placenta
El trofoblasto aparece al 5 día de la fecundación y se diferencia rápidamente (diferenciación trofoblástica) en dos capas:
a) Sincitiotrofoblasto que es una membrana en contacto directo con la sangre materna. Funciona como una diálisis biológica y es donde se realiza el intercambio de moléculas que entran o salen de la circulación fetal; expresa células dendríticas (CD), macrófagos o células de Hofbauer [25] encargadas de transferir IgG materna al feto. Está compuesto por células multinucleadas provenientes de células mononucleadas del citotrofoblasto. Esta proliferación del sincitiotrofoblasto ocasiona la formación de las vellosidades coriónicas y los espacios intervellosos con los que incrementan masivamente la superficie disponible para el intercambio de nutrientes entre la madre y el feto. Tiene funciones endocrinológicas y las hormonas esenciales secretadas son la progesterona y la gonadotropina coriónica (hCG).
b) Citotrofoblasto o capa más interna del trofoblasto, es un anclaje para el corión embrionario al endometrio materno. Se desarrolla durante la primera semana embrionaria y continúa creciendo en las vellosidades coriónicas. El citotrofoblasto tiene moléculas antigénicas y sus células, son células madre, capaces de diferenciarse en diversos tejidos.
2-2.- Componente materno de la placenta
La porción materna o placa basal es la parte más externa de la placenta, en contacto con la pared uterina. Está formada por el tejido embrionario (citotrofoblasto y sincitiotrofoblasto) así como tejido materno (la decidua basal con los vasos y glándulas uterinas).
La decidua es el tejido materno que tapiza el útero gestante, como se ilustra en la Figura 3A (Figura 3), y está en contacto con las células fetales. Es un tejido de migración y expresa linfocitos NK y células dendríticas, que funcionan como células presentadoras de antígeno. Comienza a formarse cuando el blastocisto se implanta en el útero y las células trofoblásticas penetran en las capas del útero, conectando con las células estromales endometriales (ESC), las cuales experimentan una rápida transformación hasta convertirse en células deciduales estromales (DSC). Estas células constituyen el principal componente celular, regulan la invasión del trofoblasto, controlan el stress oxidativo y son responsables de disminuir la respuesta inmunológica.
2-3.- Formacion de la Placenta
La placenta se forma durante las 3 primeras semanas de gestación, y alcanza su forma definitiva al tercer mes. Los procesos de placentación son: preimplantación, implantación y decidualización, que preparan al organismo para realizar la diferenciación de membrana embrionaria y comenzar con la formación de las membranas placentarias. Veamos algunas caratctristicas de estos procesos:
Fertilización o preimplantación
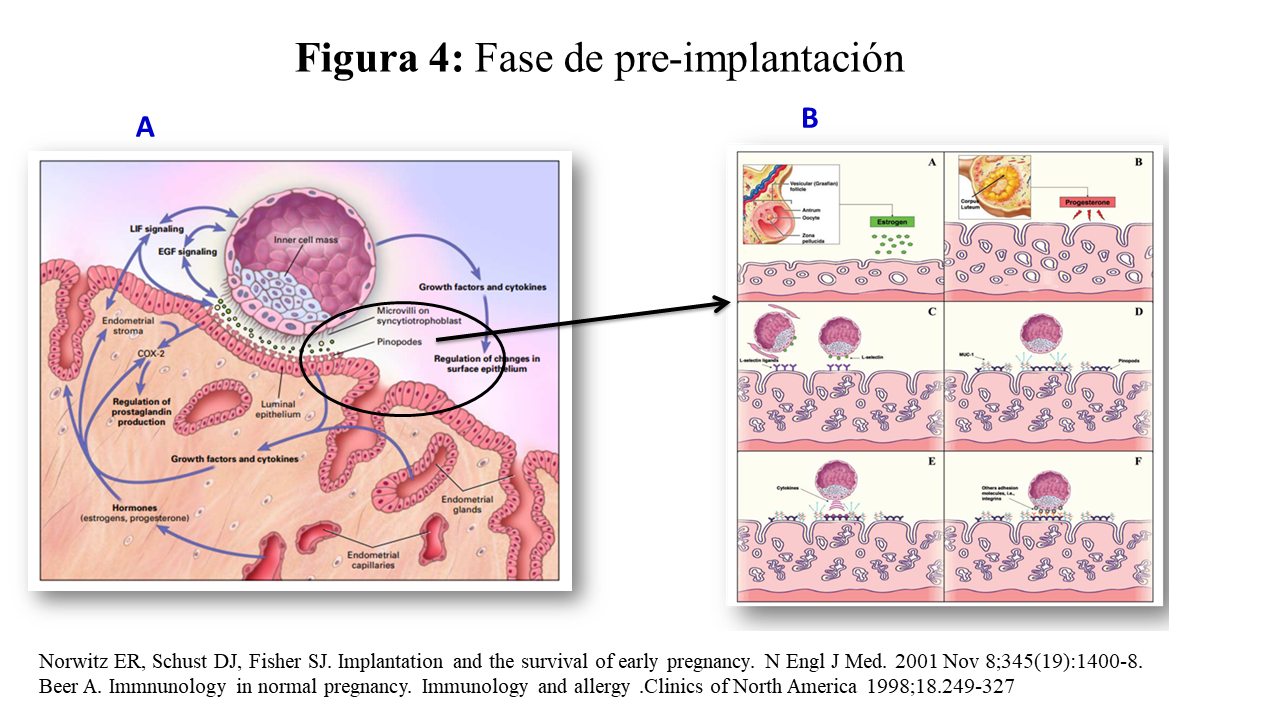
Es el proceso que ocurre en las trompas de Falopio entre las 24-48 h postovulacion y el zigoto se transforma en mórula (12-16 celulas) y a los 2-3 dias “entra” en la cavidad uterina y se transforma en blastocisto y posteriormente las células superficiales, en trofoblasto. Al 6º-7º dia después de la fertilización, se produce la implantación. El proceso comienza cuando las microvellosidades de la superficie apical del sincitiotrofoblasto se “interdigitan” con microprotrusiones de la superficie apical del epitelio uterino, conocidas como “pinopodios” imagen A de la (Figura 4).
La expresión de los “pinopodios” es limitada a un máximo de 2 días, son “progesterona dependiente” y del homeobox gen HOXA-10. La fase inicial de la implantación esta regulada por la L-selectina (expresada en el trofoblasto) y su receptor [25], un oligosacárido, expresado en el endometrio: imagen B de la (Figura 4). El siguiente paso parece que esta determinado por la mucina endometrial MUC-1. Las mucinas son glicoproteínas de alto peso molecular que contienen al menos un 50% de carbohidratos ligados a un núcleo peptídico rico en treonina/serina. Entre las 14 mucinas humanas clonadas, sólo la MUC-1 y, en menor cuantía, la MUC-6, se han encontrado en el endometrio humano. Aumenta en el momento de la implantación, y se piensa que desempeñan un papel crucial para dirigir al embrión hacia un área de implantación efectiva. En esta fase intervienen moléculas de adhesión como las integrinas y cadherinas, para asegurar la adhesividad entre el embrión y el endometrio [26].
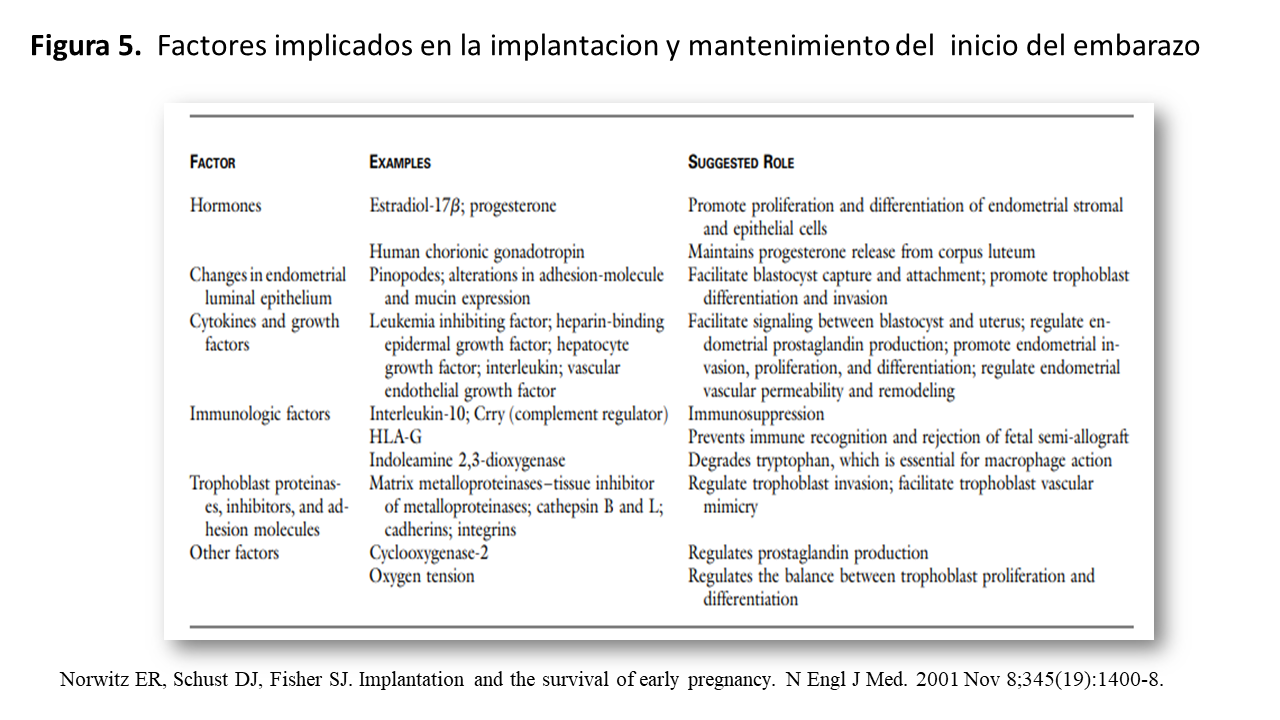
Otros factores responsables de la preparación del utero para una adecuada implantación se muestran en la (Figura 5) [24] pero esencialmente son las hormonas esteroideas.
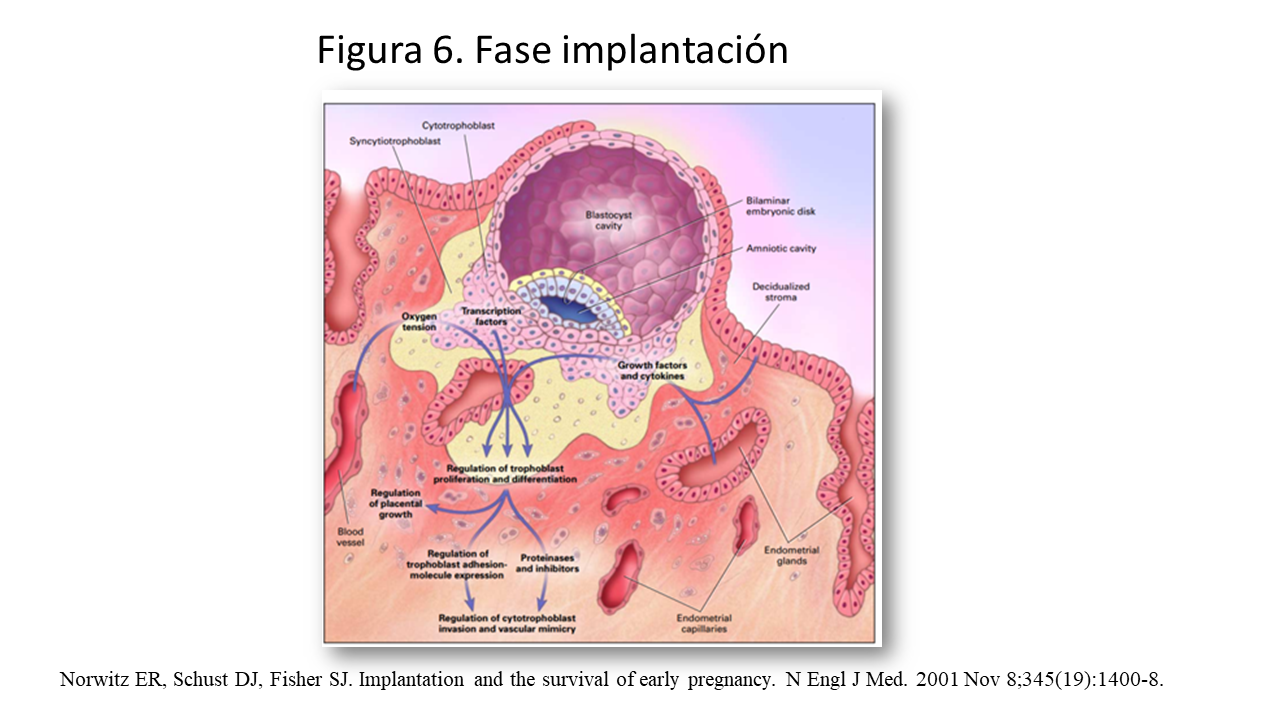
Implantación (Figura 6)
Es fundamental para la supervivencia de la especie, a pesar de que este proceso en humanos tiene una tasa de fracaso sorprendentemente alta. La probabilidad de quedar embarazada en cada ciclo es del 30% y solo el 50% de las concepciones avanzan más allá de las 20 semanas de gestación y, de todos los embarazos fallidos, el 75% representan un fracaso de implantación [24].
La implantación consiste en la aproximación, aposición, contacto e invasión del blastocisto en el endometrio. La “invasión” se produce en dos fases.
La "primera ola" de invasión de trofoblastos ocurre entre los días 7 y 10 postconcepción, comenzando poco después de que el blastocisto eclosiona fuera de la zona pelúcida. Durante este tiempo, el blastocisto invade activamente los tejidos del útero y el día 10 después de la concepción, el blastocisto está completamente enterrado dentro del revestimiento endometrial. En este momento, la placenta aun no es hemocorial (contacto directo con la sangre materna) y el blastocisto es alimentado por secreciones de las glándulas endometriales en condiciones de hipoxia e hipoglucemia. Las altas tasas de O2 y glucosa dañan el embrión en desarrollo.
La “segunda ola” se produce a las 8-10 semanas de gestación, las células del citotrofoblasto extravelloso placentario cambian su expresión y salen de las vellosidades placentarias para invadir todo el espesor del endometrio decidualizado (decidua) y el tercio interno del miometrio. Estas células invaden las arterias espirales maternas, atraídas en parte por la alta tensión de oxígeno y por el reclutamiento activo por las células uterinas NK y los macrófagos, y remodelan estos vasos destruyendo la capa muscular y reemplazando el revestimiento endotelial con un pseudoendotelio de origen fetal. Este proceso, se completa a las 18 semanas de gestación y es crítico para el establecimiento de la circulación uteroplacentaria definitiva. Este proceso de angiogénesis–vasculogenesis se comenta mas adelante.
Decidualización
Son los cambios funcionales y morfológicos que ocurren en el endometrio para formar el revestimineto decidual en el que se implanta el blastocisto. Lo más importante, es la diferenciación de las células de fibroblastos del estroma endometrial en células deciduales estromales (DSC). La capacidad de las DSC para diferenciarse en este estado celular alternativo es lo que parece ser el elemento clave en la transformación decidual. Las DSC no son simplemente células endometriales estromales (ESC) modificadas; son un tipo de célula distinto resultante de la diferenciación terminal y la reprogramación genética de las ESC. Esta reprogramación incluye la regulación a la baja de los genes involucrados en la respuesta proinflamatoria y en la resistencia a la invasión tisular junto con una mayor expresión de genes que promueven la proliferación celular, fomentan la tolerancia y facilitan la invasión tisular.
La decidualizacion es un proceso complejo en el que interviene multiples factores [27].
Factores hormonales: es básico la producción de gonadotropina coriónica (hCG) por las células trofoblásticas. Inhibe la luteolisis y mantine así la producción de progesterona hasta que la placenta asuma esta función en la semana 5-7 de gestación. Se producen además otras hormonas como la relaxina y la hormona liberadora de cortitropina (CRH) como respuesta a la hCG y se establece un “bucle” autocrino/paracrino para promover la implantacion, decidualizacion, y el embarazo.
Factores bioquímicos: los más reseñables son los mediadores lipídicos como el ácido lipofosfatídico (LPA), producidos por el epitelio uterino, que regulan la señalización del factor de crecimiento epidérmico de unión a heparina (HB-EGF), del receptor del factor de crecimiento epidérmico (EGFR), así como la ciclooxigenasa 2 (COX2) y, en consecuencia, la producción de prostaglandina E2 (PGE2), que junto con el interferón-? controlan la decidualización de las ESC. La ciclooxygensa es la enzima de conversión de ácido araquidónico a protaglandina y existe en dos isoformas. La COX1 (ciclooxigenasa constitutiva) y la COX2 (ciclooxigenasa inducible). En el endometrio la COX1 esta disminuida por acción de la progesterona y el estradiol 17ß, pero existe una producción localizada de COX-2 inducida por la progesterona y la interleuquina-1 (IL-1). La prostaglandina E2 producida por la acción de la COX-2, y a traves de factores de transcripción nuclear Peroxisome-Proliferator-Activated Receptor λ (PPARλ) regula la diferenciación celular. Esta interacción es probablemente crítica. Los ratones fetales que carecen del receptor PPARλ, mueren a mitad del periodo gestacional por un defecto de “placentación.
Otros factores autocrinos/paracrinos, como la expresión de varios factores de crecimiento y citocinas dentro del útero (por ejemplo, el factor inhibidor de la leucemia, la interleucina-1 y sus receptores, factores de crecimiento similares a la insulina I y II y sus proteínas de unión, y Transforming growth factors α y β (Figura 5) sugiere que pueden tener importantes funciones. Por ejemplo, la interleucina-1 aumenta la producción de metaloproteinasas (MMPs) en el citotrofoblasto, tanto la MMP2 (gelatinasa A) como la MMP9 (gelatinasa 9). La actividad de estas enzimas proteolíticas es la degradacion de la matriz extracelular (ECM) para lograr una adecuada invasión trofoblástica. La deficiencia de MMPs es una de las causas de “placentación anómala” y causante de la PE [28]. La proteína 2 de la morfogénesis ósea (BMP2) y el factor de determinación izquierda-derecha 2 (LEFTY2) también parecen ser importantes para mantener el proceso de decidualización, promover la señalización de cAMP y matriz extracelular (MEC), regular la angiogénesis y apoyar la implantación embrionaria.
Es por tanto, un proceso complejo realizado entre un utero receptivo y un blastocisto activado. Para ello, básicamente, se precisa el incremento previo de 17β-estradiol que estimula la proliferación y diferenciación de las células epiteliales, y de progesterona secretada por el cuerpo lúteo, que activa la proliferación y diferenciacion de las células estromales.
Factores inmunológicos. Están impulsados, en parte, por factores intrínsecos, incluida una gama de señales endocrinas y autocrinas / paracrinas, y factores extrínsecos. Uno de estos factores es la exposición al líquido seminal tanto antes como alrededor del momento de la implantación. La exposición al antígeno paterno por vía no vaginal también puede preparar inmunológicamente el endometrio. Aunque el mecanismo responsable de este efecto no está claro, el líquido seminal contiene agentes de señalización solubles y transmitidos por exosomas que promueven el reclutamiento de leucocitos y la generación de células T reguladoras que suprimen la inflamación, promueven la adaptación vascular y fomentan la tolerancia hacia los antígenos fetales.
Con el tiempo, el citotrofoblasto invade todo el endometrio y el tercio interno del miometrio (invasión intersticial), así como la vasculatura uterina (invasión endovascular). Este último proceso, establece la circulación uteroplacentaria, y pone a los trofoblastos en contacto directo con la sangre materna [24].
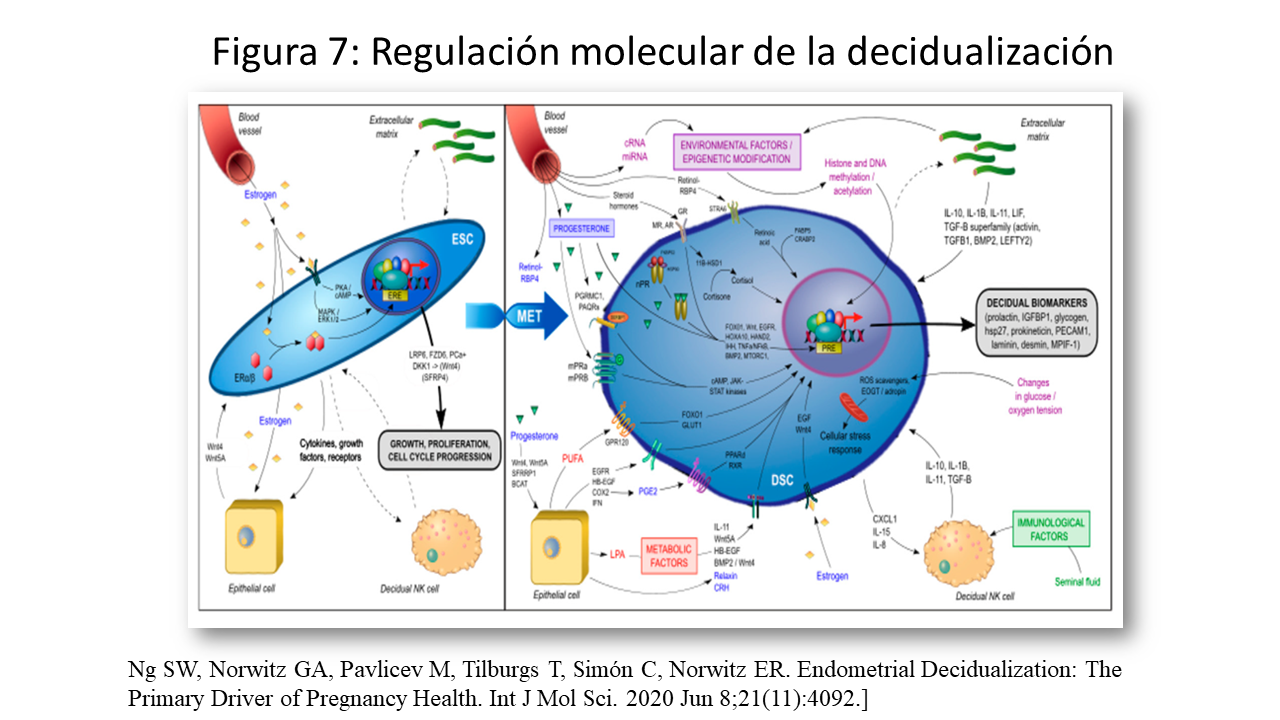
Regulación molecular de la decidualización
Además de los factores hormonales, metabólicos e inmunológicos maternos están involucrados otros factores localesAlgunos de ellos, son de origen embrionario, como lactato, relaxina, CRH y hCG, Durante la decidualización, las ESC diferenciadoras llevan una firma molecular de transición mesenquimal-epitelial (MET) a medida que se reprograman para convertirse en DSC con cambios generalizados en la expresión génica, incluida la inducción de genes como HOXA10, HOXA11, FOXO1, WNT4, IGFBP1 y prolactina (PRL). Las vías de transducción de señales implicadas en la reprogramación genética y la diferenciación terminal de las ESCs en DSCs (Figura 7) y se puede ampliar en una magnifica revisión de Ng SW y cols [27]:
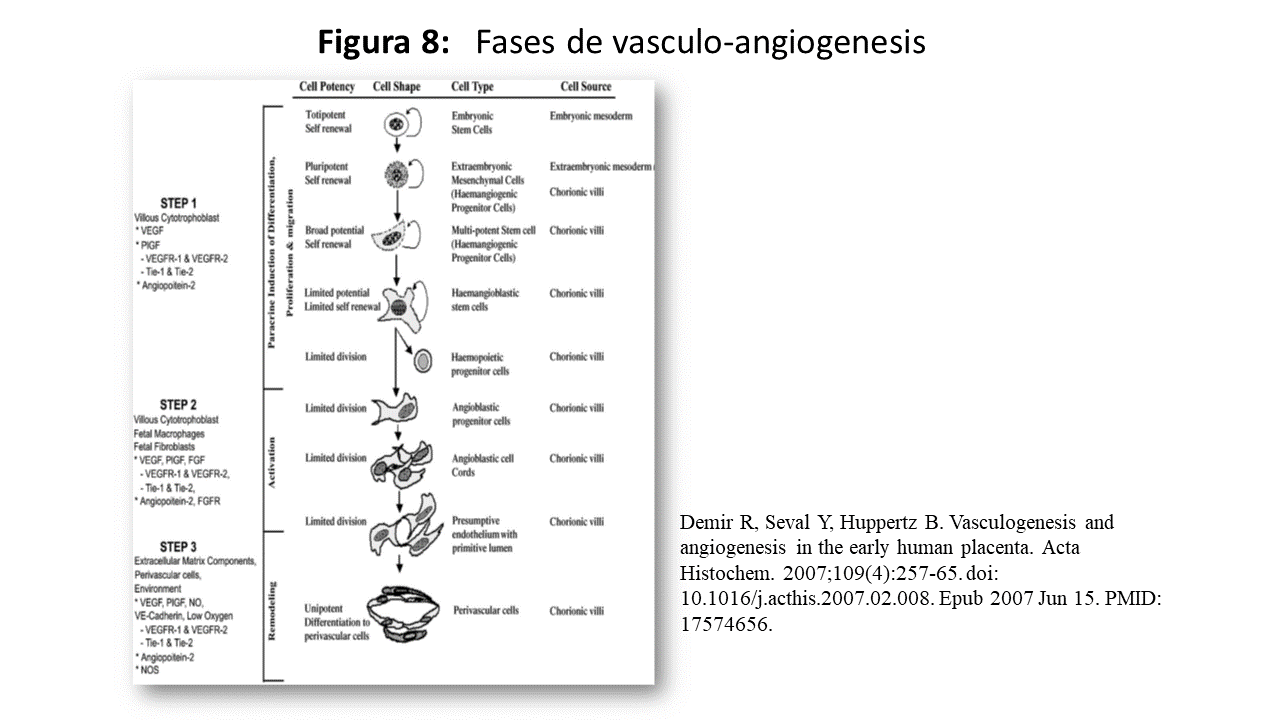
El proceso de vasculogenesis y angiogénesis (Figura 8) se incia a los 18-20 días postconcepcion y hay evidencia morfológica de vasculogénesis dentro de los núcleos de las vellosidades mesenquimales, Las células hemangioblásticas se diferencian “in situ” y forman pequeños grupos o cordones de células justo debajo del epitelio trofoblástico. Estas células endoteliales precursoras están unidas por desmosomas o uniones estrechas, y los cordones adquieren gradualmente lúmenes y se unen para formar vasos. Los primeros signos de formación de lumen se observan alrededor de los 23 días post-concepción, y las evidencias inmunohistoquímicas y morfológicas sugieren que es por un proceso de apoptosis [29].
A las 4 semanas post concepcion, se pueden observar perfiles capilares periféricos en el núcleo velloso muy cerca del trofoblasto y los capilares están conectados a través del cordón umbilical en desarrollo al corazón fetal y al plexo vascular del saco vitelino.
Durante el primer y principios del segundo trimestre, hay un aumento gradual en el número, volumen y área de superficie de los perfiles capilares dentro de las vellosidades placentarias y la tasa de aumento de la longitud se acelera alrededor de las 25 semanas, y la longitud total aumenta exponencialmente hasta el término.
Las fases de este trascendental proceso, son [29]:
Fase 1: vasculogénesis: iniciada por células madre hemangiogénicas, inducidas a diferenciarse de forma paracrina, por las células citotrofoblásticas a través del factor de crecimiento endotelial vascular (VEGF).
Fase 2: angiogénesis I: las redes prevasculares se producen de forma escalonada durante la angiogénesis, inducidas por factores de crecimiento derivados de células citotrofoblásticas y de Hofbauer.
Fase 3: angiogénesis II: diferenciación de las células perivasculares, incluidos los precursores del músculo liso centrándose en la función desencadenante de la maduración de las vellosidades en paralelo a la vasculogénesis y la angiogénesis
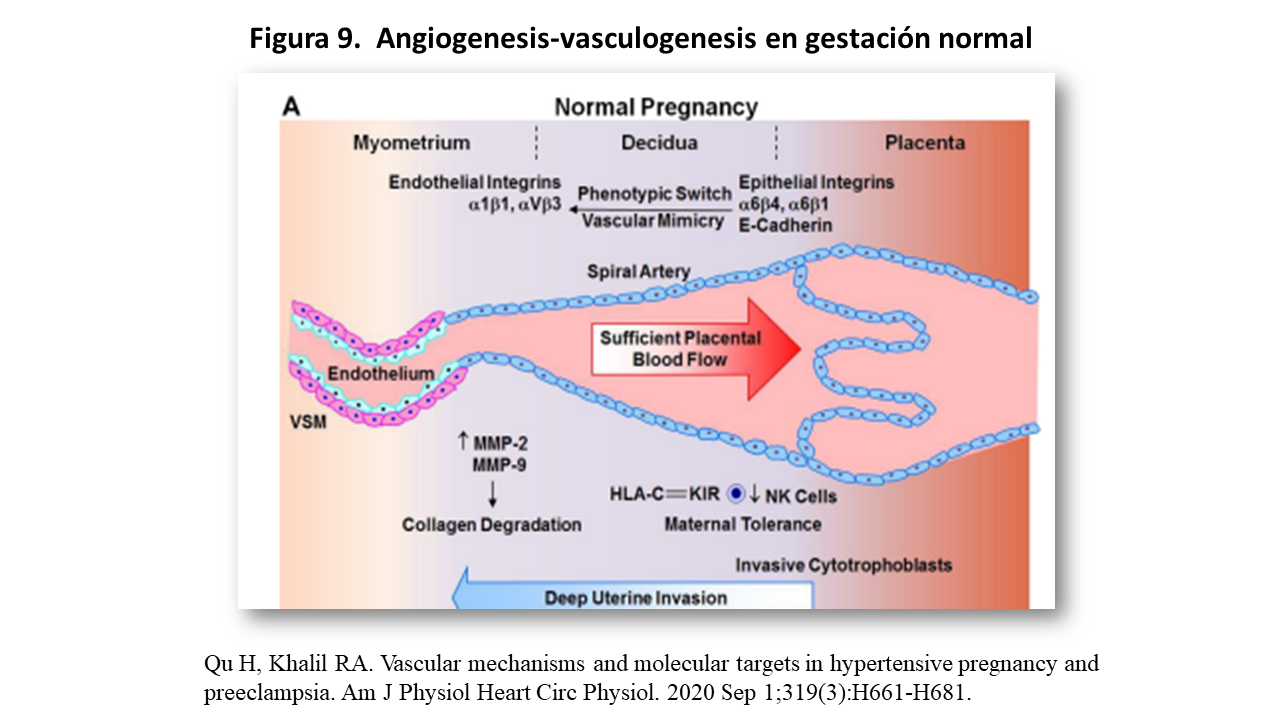
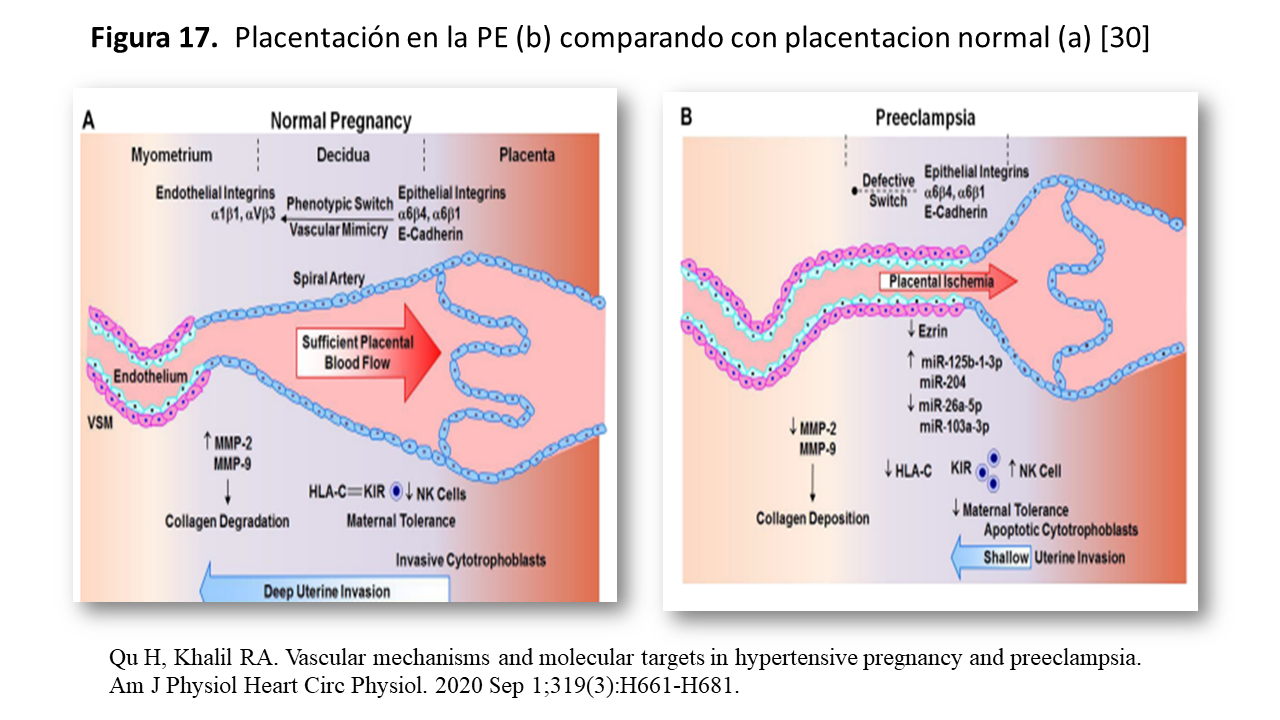
En el embarazo normal, como vemos en la imagen de la (Figura 9), el citotrofoblasto invasor, en las arterias uterinas "downregulate" receptores epiteliales como endotelina, E-Cadeherina y α 6 4 integrinas, los cuales son sustituidos por moléculas de adhesión endotelial como: PECAM (platelet-endothelial cell adhesión molecule), VE-Cadherina, VCAM 1 (vascular cell adhesión molecule 1) yα1β 1 y αV-β3 integrinas. Estas integrinas modulan la integración de células trofoblásticas en redes celulares endoteliales a través de vías invasivas que incluyen la galectina-1, el inhibidor tisular de la metaloproteinasa-1 (TIMP-1), el inhibidor del activador del plasminógeno-1 (PAI-1), la producción de MMP-2 y MMP-9 (Figura 9) produciendo la “degradación” del colágeno [30] [31].
Todo este proceso está controlado por factores proangiogénicos como la familia VEGF (VEGF A-B-C-D-E), el factor de crecimiento placentario (PIGF), los factores antiangiogénicos, representados por sFlt1 (soluble fms-like tyrosine kinase) y metaloproteinas uteroplacentarias (MMP)
Veamos algunas características de los factores angiogenicos (VEGF, PIGF) y antiangiogenicos (sFlT-1, sEng) :
1º.- Factor de crecimiento vascular endotelial (VEGF)
Es el mas importante factor que promueve la diferenciación de células mesenquimales en células “stem” hemagioblásticas. Es expresado intensamente por las células citotrofoblásticas en las primeras semanas del embarazo. Incrementa el calcio citosólico (Ca2+), el cociente Ca2+/calmodulina y, aumenta la actividad de sintasa endotelial del ON (eNOS) y prostaciclina PGI2. Es responsable de la expresión endotelial de integrinas y moléculas de adhesión, y se detecta en elevadas concentraciones en el citotrofoblasto en la 6ª semana. Promueve la proliferación, supervivencia de células endoteliales, angiogénesis, y permeabilidad vascular.
Actúa a través de dos receptores presentes en las células endoteliales: KDR (kinasa-insert domain-receptor) y Flt1 (Fms-like tyrosine kinase1). La expresión del gen Flt1 es regulado por la hipoxia a través del HIF-1 o HIFs (hipoxia inducible factor-1). En condiciones normales es rápidamente degradado, pero en hipoxia, suprarregula el gen Flt-1 produciendo la forma soluble sFlt-1.
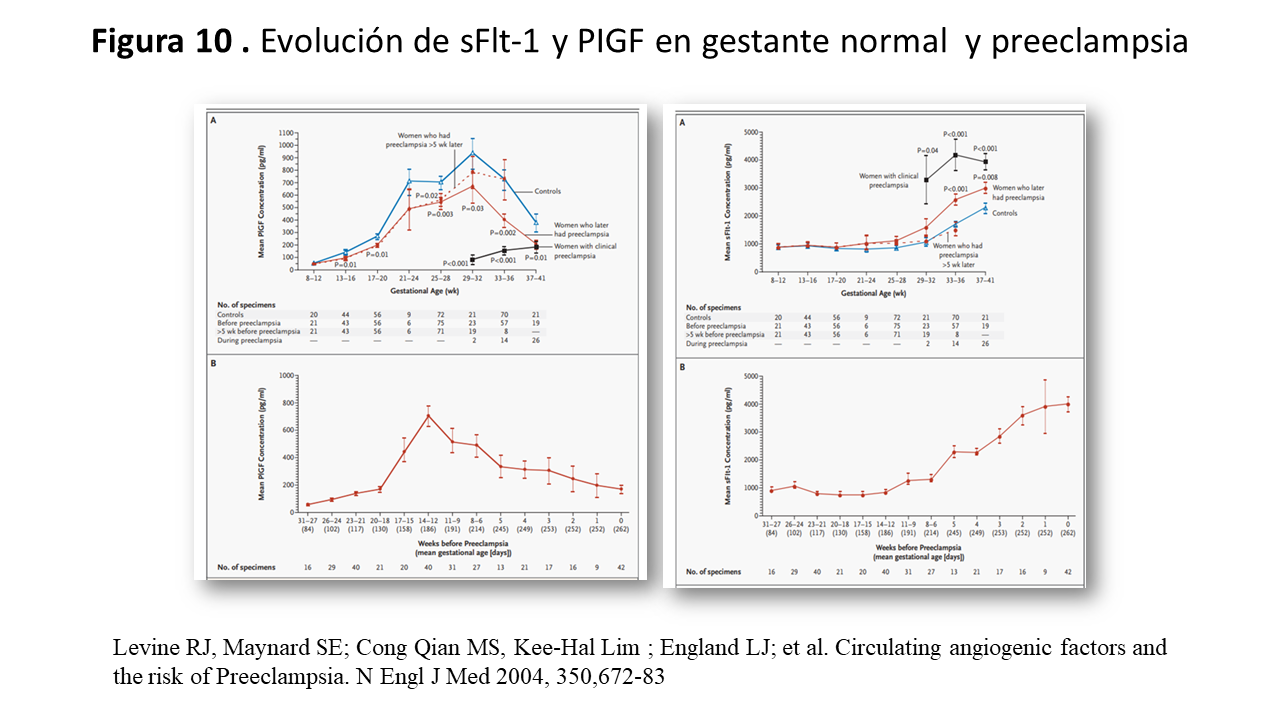
Las tasas plasmáticas de VEGF, son similares en la gestante normal y en la futura gestante con preeclampsia, desciende de forma significativa 5 semanas antes del desarrollo de PE [32].
Durante la gestación normal, la placenta secreta altas cantidades de PIGF y sFlt-1, este se une a VEGF y PIGF en la circulación materna y reduce así su bioactividad y la unión a receptores. Actúa por tanto modulando la disponibilidad de VEGF y evitando los efectos tóxicos locales derivados de su exceso.
VEGF también es sintetizado constitutivamente por los podocitos, y receptores de VEGF están presentes en las células endoteliales. De forma experimental, la infusión de VEGF disminuye las lesiones glomerulaes asociadas a Microangiopatia Trombotica (MAT) [33].
2º.- Factor de crecimiento placentario (PIGF)
El PIGF pertenece a la familia VEGF (50% de homología) se expresa en el trofoblasto y aunque su función esta menos clara que el VEGFA, se une a Flt1 pero no a KDR, actua asi sobre la angiogénesis y menos sobre vasculogénesis. PIGF-Flt1 moviliza el precursor de la celula endotelial mesenquimal que contribuye a la vasculogenesis, produce una mayor vasodilatación de los vasos uterinos y circulación mesentérica a través del factor hiperpolarizante derivado del endotelio (EDHF). En el pasado fué catalogado como un inhibidor competitivo de VEGFA, pero es un mitógeno relativamente débil para las células endoteliales. Sin embargo, los datos “in vivo” indican que puede ser tan potente como el VEGFA para estimular el crecimiento de nuevos vasos. Aumenta durante los dos primeros trimestres alcanzado el pico a las 32 semanas en la gestante normal (Figura 10) imagen A; y en la PE tiene un perfil similar pero con tasas menores y comienza a descender entre 11 y 9 semanas antes del inicio de la PE [32].
En definitiva, VEGF y PIGF, a través de Flt1, vía NOSe, sintetizan ON y realizan la normal transformación de epitelio a endotelio.
3º.- Complejo HLA
En gestación normal, el citotrofoblasto expresa moléculas del complejo HLA, HLA-C, HLA-E y HLA-G [34] las cuales interaccionan con sus respectivos receptores KIR inhibiendo las células NK e impidiendo el ataque a células placentarias y tejido fetal (Figura 9).
4.- Angiopoyetinas
Son otra familia de factores de crecimiento responsables de la angiogénesis placentaria. La angiopoyetina-1 (ANG-1) y la 2 (ANG-2) son ligandos del receptor de tirosina quinasa TIE2. La ANG-1 y ANG-2 se producen en el trofoblasto velloso desde el inicio de la gestación y va aumentando con el progreso del embarazo y el TIE2 tambien esta presente en células endoteliales vellosas y trofoblasto. La fosforilizacion de TIE2 medidada por ANG-1, favorece la supervivencia de las células endoteliales y el reclutamiento de pericitos y celulas musculares lisas para estabilizar los capilares recién formados y por el contrario, la ANG-2 actua como inhibidor competitivo de ANG-1 [35].
5.- Oxido Nítrico (ON)
Es un potente vasodilatador y relajante del VSM, difunde libremente hasta VSM e incrementa cGMP lo cual disminuye el Ca2+ de VSM y produce relajación del VSM. Si bien es conocido que la disfunción endotelial se asocia con descensos de síntesis /bioactividad de ON, en la PE los nitritos/nitratos urinarios eran menores que en las gestantes normales, pero no se observaron diferencias en las tasas plasmáticas [36]. En un modelo de presión de perfusión uteroplacentaria reducida en ratas preñadas y no preñadas, se demostró una reducción de la relajación vascular inducida por ACh, de la expresión de eNOS y de la producción de ON. Por tanto, el ON juega un importante papel como antioxidante y su disfunción puede contribuir de forma significativa en la patogenesis de la PE.
6.- Oxigeno (O2) como regulador de la angiogénesis
En la actualidad se acepta ampliamente que la placenta humana se desarrolla a bajas concentraciones de oxígeno durante el primer trimestre, aumentando la tensión de oxígeno de <20 mmHg a las 8 semanas de gestación a >50 mmHg a las 12 semana Esta transición resulta en un “estallido” de estrés oxidativo en la placenta. Al final del mismo, el O2 alcanza su máximo nivel y va progresivemente disminuyendo hasta el final del embarazo. El embarazo, representa por tanto, un estado de “estrés oxidativo” produciendo especies reactivas de oxigeno (ROS) causado por el metabolismo maternal y el placentario, pero durante el embarazo normal, la producción de ROS es contrabalanceado por antioxidantes como por ejemplo la la isoforma NOX4 de la NADPH oxidasa, que protege la función vascular [37][38].
7º.- sFlt-1 (soluble fms-like tyrosina-1 o sVEGFR-1)
Es un factor antiangiogénico que bloquea VEGF y PIGF, es estable durante la gestación normal y aumenta después de la semana 36.Su gen esta situado en cromosoma 13q12.La isquemia/hipoxia placentaria es el mayor “productor” de sFlt-1.y en esta situación de hipoxia, HIF-1 se une al promotor del gen flt-1 conduciendo a una supraregulacion de sFlt-1, el cual se une a VEGF y se bloquea el proceso de vasculogenesis-angiogenesis.
El ratio sFlt-1/PIGF esta elevado en PE y el ratio VEGF/sFlt-1 y PIGF/Flt-1 desciende un 50% y 70% respectivamente en la placenta de PE. sFLt-1 aumenta la tasa plasmática (Figura 10) imagen B; cinco semanas antes de la aparición de la PE [31].
La eliminación de sFLt-1 por aféresis en pacientes con PE, desciende sFlt-1/PIGF, mejora los síntomas y se prolonga la gestación [39].
8º.- Endoglina
Es una glicoproteína de membrana tipo I l, es correceptor transmembrana para el complejo receptor beta de TGF (TGF-β1, TGF-β3) y es expresado en las membranas de células endoteliales y sincitiotrofoblasto. Las funciones principales de la endoglina incluyen angiogénesis, diferenciación de células endoteliales y regulación del tono vascular a través de eNOS.
La escisión proteolítica del dominio extracelular de la endoglina, genera sEng que presumiblemente funciona como factor limitante para la actividad de TGF-β y el eNOS, y como factor antiangiogénico, inhibe la señalización de TGF-?1 y la activación de eNOS mediada por TGF-β1, y en consecuencia, disminución de la vasodilatación.
Aumenta la tasa plasmática 3,5 a 10 veces, 2 ó 3 meses antes en moderada-severa PE y síndrome HELLP. A nivel experimental, la acción sinergica de sEng y sFlt-1 produce síndrome de HELLP con traducción morfológica de endoteliosis glomerular, infartos placentarios y necrosis hepática [40].
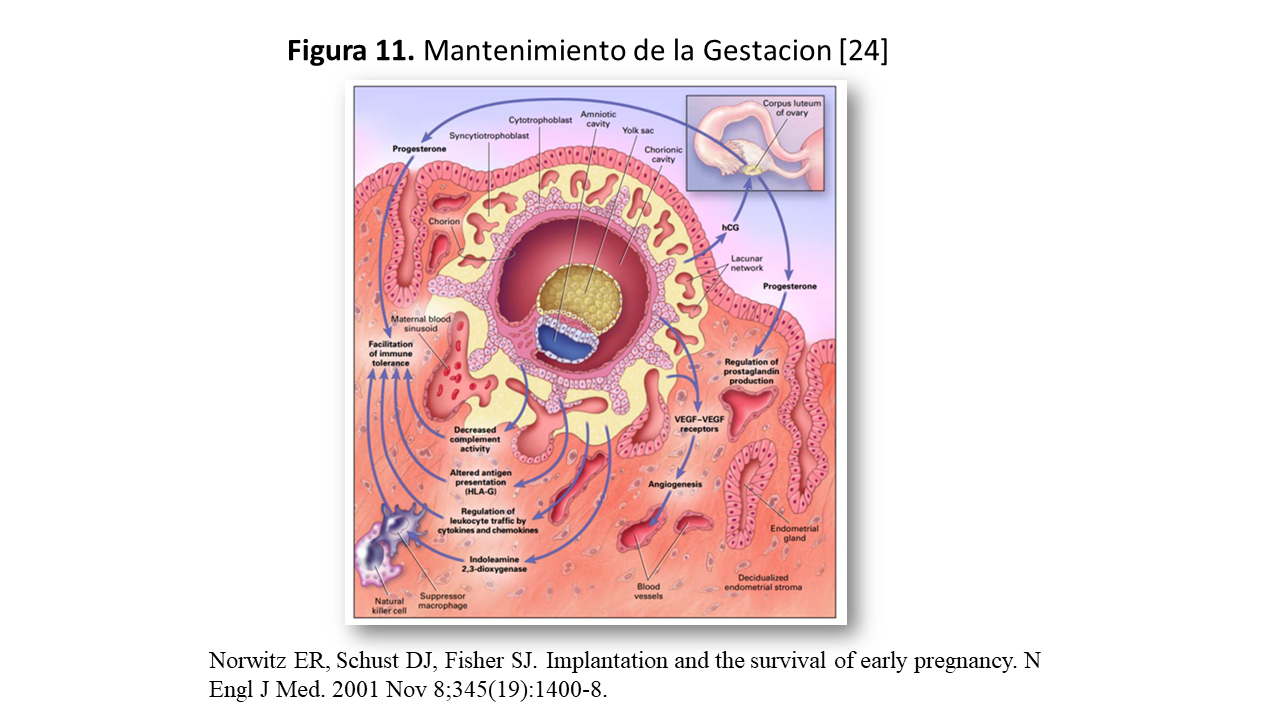
El siguiente paso, es mantener la gestación. Los factores que determinan su mantenimeinto son esencialmente hormonas esteroideas, prostaglandinas, factores de crecimiento y factores inmunológicos (Figura 11).
Entre las hormonas esteroideas, la progesterona es crítica para el mantenimiento de la gestación. Es producida por el cuerpo lúteo, hasta que la placenta se haga cargo de esta función sobre las 7ª-9ª semanas de gestación. El cuerpo lúteo se mantiene gracias a la producción de gonadotropina coriónica por los trofoblastos.
Entre sus funciones esta:
* Regular/Inhibir la producción prostaglandinas en la decidua a lo largo de la gestación, o bien directamente (promoviendo la captación y el almacenamiento de ácido araquidónico), o indirectamente (aumentando la síntesis local de inhibidores endógenos de la síntesis de prostaglandinas, como el componente secretor de la IgA). La administración de prostaglandinas exógenas -por vía intravenosa, intraamniótica o vaginal- induce el aborto en todas las especies y en cualquier fase de la gestación.
* Regular la respuesta inmunitara de la placenta. Una de las funciones más interesantes de la placenta es la regulación de la respuesta inmunitaria materna de modo que el “injerto semialojenico” fetal, sea tolerado durante el embarazo. Los mecanismos implicados son:
o El trofoblasto no expresa las moléculas clásicas del complejo mayor de histocompatibilidad (CMH) de clase II. El citotrofoblasto expresa más HLA-G, una molécula MHC de clase Ib, El HLA-G presenta un polimorfismo limitado, y esta en contacto directo con los linfocitos maternos. La mayoría son células NK CD56+ pero, los leucocitos deciduales tienen una actividad citotóxica baja, en comparación con los linfocitos de sangre periférica. Los factores responsables de esta inmunosupresión localizada no son bien conocidos, pero probablemente incluyan la IL-10 derivada del citotrofoblasto, una citocina que inhibe las respuestas alogénicas.
o La expresión de una enzima, la indoleamina 2,3-dioxigenasa, que degrada rápidamente el triptófano, es esencial para la activación de las células T. No se sabe si este mecanismo ocurre en humanos, aunque los sincitiotrofoblastos humanos expresan indoleamina 2,3-dioxigenasa y las concentraciones de triptófano maternas disminuyen durante el embarazo.
2-4.-Funciones de la placenta.
Las funciones son de transporte, metabolismo, protectoras y endocrinas, siendo la suministradora principal de oxígeno, agua, aminoácidos, lípidos, vitaminas, minerales, carbohidratos… en definitiva todos los nutrientes necesarios para el desarrollo del feto [41].
Funcion transportadora
El transporte es la función esencial de la placenta. Existen multiples mecanismos, pero el mas sencillo es la difusión. La placenta es el mayor proveedor de nutrientes para el feto. Para el paso de glucosa se han identificado 6 transportadores en el trofoblasto GLUT1-2-3-4-5-7. El principal es la isoforma GLUT-1la cual realiza el intercambio entre la membrana maternal del sincitiotrofoblasto y la fetal.
Los ácidos grasos, sustancias fundamentales para la formación de membranas lipídicas, se han identificado diferentes transportadores: La proteína ligante de ácidos grasos de la membrana plasmática (FABP pm), la translocasa de ácidos grasos (FATP) y la familia de proteínas ligantes de ácidos grasos citoplasmáticos.
Los aminoácidos (AA) se transportan por mecanismos de tranferencia muy variados y se conoce un transportador neutral Na dependiente (SNAT) con 3 isoformas (SNAT 1-3). Lo importante es que la deficiencia de este transportador se asocia con retraso de crecimiento intrauterino (RCIU). El transporte AA esta disminuido en las embarazadas obesas y además tienen estas, mayor resistencia a la leptina. Esta circunstancia se relaciona con un inicio tardío y una progresión lenta del trabajo de parto.
El transporte de minerales como el calcio se hace a graves de canales específicos y el hierro es transportado a través del receptor transferrina-diférrica que se encuentra en el sincitiotrofoblasto [41].
Funcion endocrina
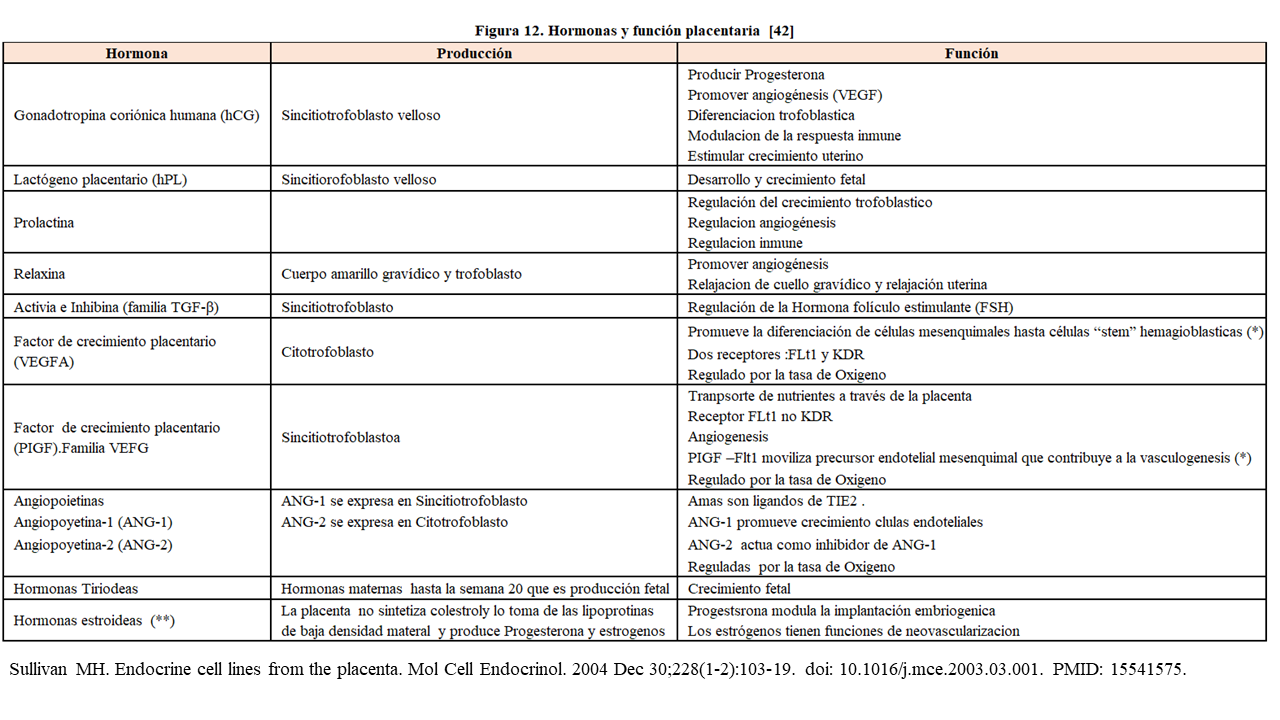
La placenta, aunque no es un órgano dependiente del sistema endocrino maternal, puede estar regulado por el eje hipotálamo-pituitario-adrenal (HPA) y el eje hipotálamo-pituitario-gonadal (HPG) y las células placentarias tendrán una función endocrinológica diferente según los estados de la gestación (Figura 12).
Función inmunológica
El feto, es un como un trasplante semialogénico, que hace del embarazo un estado inmunológico único. Como se comentó con anterioridad, el sistema inmunológico materno debe establecer y mantener la tolerancia al feto alogénico y al mismo tiempo preservar la capacidad de protección contra desafíos microbianos. Por otra parte, los estados inmunológicos maternos se adaptan activamente y cambian con el crecimiento y desarrollo del feto en las diferentes etapas de la gestación.
En conclusión “La placenta es un órgano extraordinario, ha evolucionado a lo largo de los siglos en muchas formas para adaptarse a las diversas necesidades de desarrollo de los mamíferos euterios. Posee tipos celulares completamente ajenos al organismo adulto y que participan en procesos biológicos en gran parte no vistos postnatalmente, la placenta hace posible la existencia del feto en un entorno uterino inhóspito gracias a nuevas tecnologías adaptadas exclusivamente a las necesidades fetales. Nuestro reto para el futuro es redoblar los esfuerzos de tecnologícos para comprender mejor el desarrollo normal de la placenta y mejorar nuestra capacidad de predecir y tratar las complicaciones del embarazo. Complicaciones que provocan una enorme morbilidad y mortalidad en todo el mundo. Además, dado que la placenta es la interfaz entre la madre y el feto, las terapias eficaces dirigidas a ella tendrán la ventaja añadida de tratar múltiples alteraciones, dado lo que ahora sabemos sobre los mecanismos de programación fetal. Así pues, mejorar nuestra capacidad para optimizar la salud de la placenta tendrá un impacto desproporcionado en nuestra salud colectiva” [41].
3.- HIPERTENSION ARTERIAL (HTA) EN EL EMBARAZO
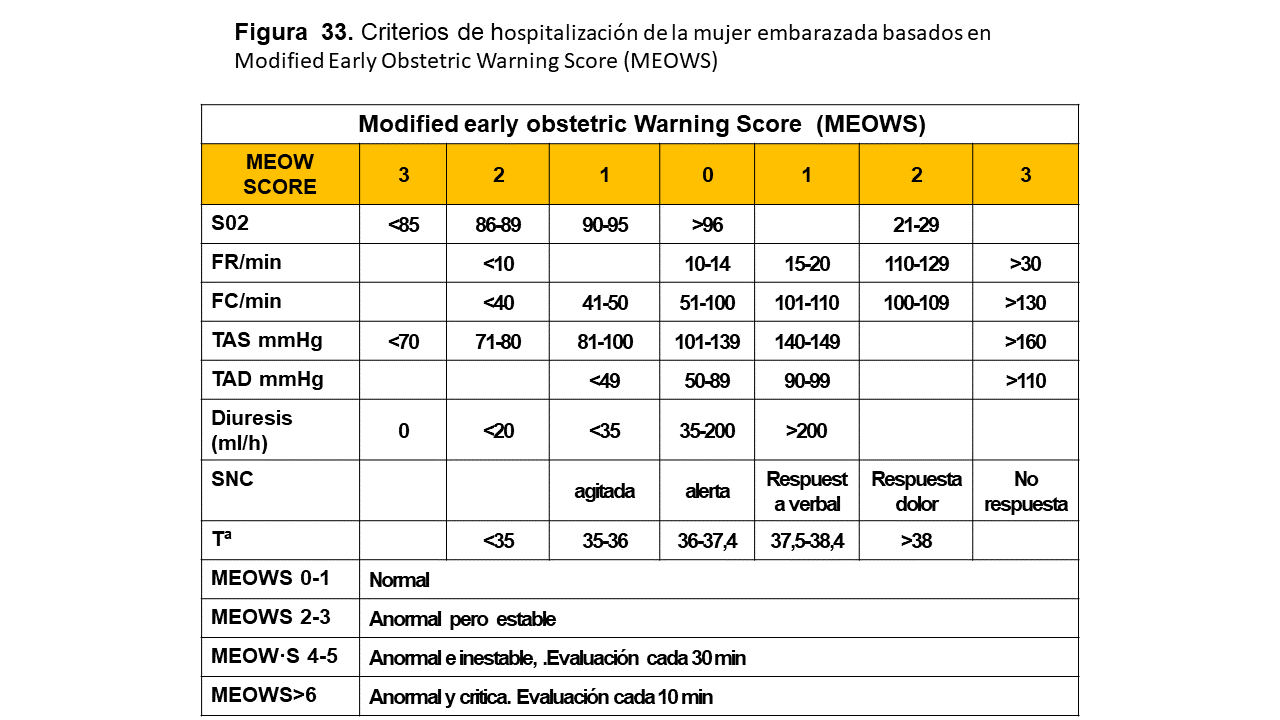
La HTA es la complicación médica más habitual del embarazo; aproximadamente el 10% de las embarazadas tienen una TA > 140/90 mmHg, y la frecuencia es bimodal: es más frecuente en las mujeres jóvenes primíparas y en las mujeres mayores multíparas y aumenta en 5 veces la morbimortalidad perinatal.
3.1.- Criterios diagnósticos
La definición de HTA en el embarazo es controvertida. Mientras que en la población no gestante, el límite superior de la presión arterial (PA) viene dado por la evidencia epidemiológica de desarrollo de enfermedad vascular, en el embarazo este criterio no es válido y lo relevante es el nivel de PA que induce lesión en el feto.
Un valor de consenso es [43]:
>25 mmHg TA sistólica (TAS) / >15 mmHg TA diastólica (TAD) respecto a pre-embarazo ó
PAD > 75 mmHg en 2º Trimestre
PAD > 85 mmHg en 3º Trimestre
3.2.- Clasificación de la HTA en el embarazo
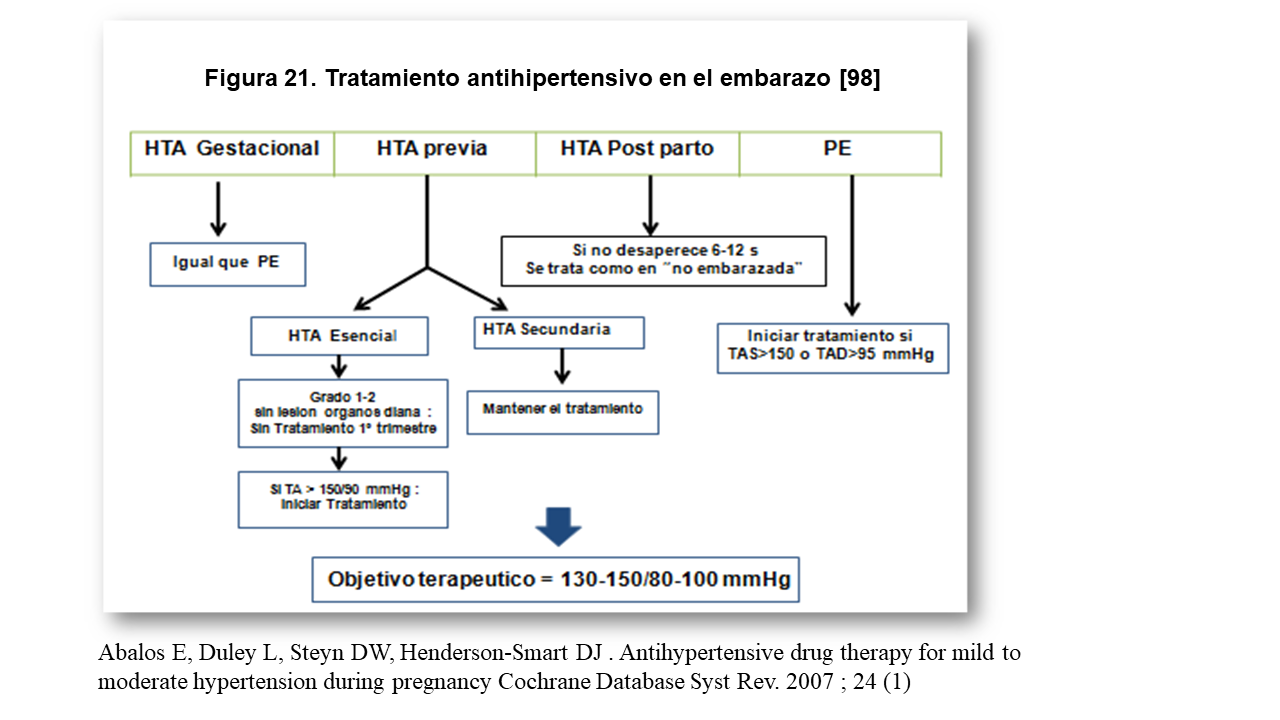
a) HTA de novo o gestacional: definida como HTA >140/90 mmHg que aparece después de la semana 20 y se acompaña de proteinuria mínima y se normaliza en el postparto [41]. La HTA gestacional puede ser un estado PE "like". Se ha descrito alta mortalidad perinatal en gestantes con HTA no proteinúrica [44] y tienen una alta frecuencia de trombopenia y disfunción hepática [45]. En consecuencia, la HTA gestacional grave, debe ser manejada como la PE y en términos de riesgo cardiovascular puede ser indistinguible de la misma [46].
b) PE: HTA que aparece después de semana 20 con proteinuria > 3 gr/24 h: En ausencia de proteinuria, la HTA gestacional con algunos de los factores que se muestran en la (Figura 13), puede ser diagnostica de PE [47].
c) HTA crónica: HTA conocida ya antes del embarazo o que aparece < 20 semana y persiste 12 semanas postparto.
Los efectos adversos asociados a la HTA previa [48] [49] son:
PE: 10.25%
Abruptio Placentae: 0,7-1,5%
Parto prematuro: 12-34%
Retraso crecimiento fetal: 8-16%
d) HTA Posparto: Usualmente la HTA relacionada con el embarazo desaparece en el posparto antes de la 12 semana. Si persiste más tiempo, debe estudiarse como en la mujer no embarazada.
4.- PREECLAMPSIA (PE)
La PE es una enfermedad multisistémica, con traducción morfológica de disfunción endotelial y aparece después de la 20 semana de gestación y con los criterios diagnósticos se muestran en la (Figura 13) [47]. Se desarrolla en embarazadas previamente sin HTA ni proteinuria, o como consecuencia de importantes alteraciones de los factores angiogénicos que regulan la formación de la placenta. Es una importante causa de morbimortalidad fetal, debido al bajo peso al nacer o prematuridad; y las complicaciones maternales pueden variar desde fracaso renal agudo a síndrome de HELLP, fallo hepático, edema cerebral, convulsiones o muerte. En el mundo occidental afecta al 2-7% de todos los embarazos, pero en otras áreas geográficas se puede triplicar [48]. Es una enfermedad que solo ocurre en la especie humana, y la PE, si no es tratada, puede progresar a Eclampsia.
4.1.- Factores de riesgo:
La PE es considerada como una enfermedad del primer embarazo, aunque el efecto de la multiparidad se pierde con el cambio de padre. Los factores de riesgo son [47] [49]:
a) Dependientes de la madre
Inherentes
Edad < 20 ó 35-40 años
Nuliparidad
Raza negra
Embarazo múltiple
Antecedentes personales o familiares de PE, o enfermedad cardiovascular
Condiciones médicas
Diabetes mellitus y obesidad
Enfermedad renal crónica
HTA
Más de 6 años desde el ultimo embarazo
Anticuerpos Anti fosfolipídico primario o enfermedades del tejido conectivo
Trombofilia
Desnutrición calórica
Menor ingesta de calcio
Infección por COVID-19
b) Específicos del embarazo
Gestación multiple
Reproduccion asistida
Infección del tracto urinario
Afectaciones congénitas
Mola hidatiforme
Hydrops fetalis
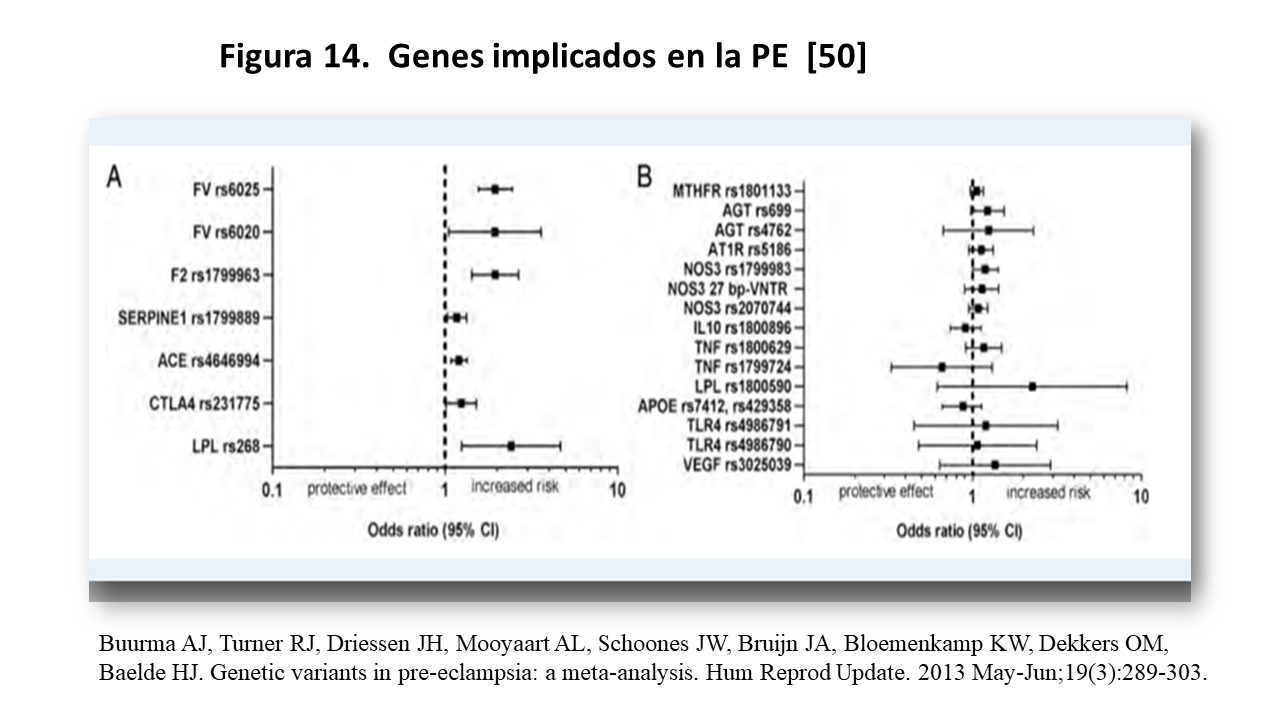
El riesgo de PE como vimos es multifactorial, pero en los últimos años los factores genéticos o heredabilidad han adquirido mayor importancia. Se han identificado 7 genes asociados a PE y estas variantes genéticas (Figura 14) estan “cerca” de los genes implicados en la aparición de HTA o enfermedad cardiovascular, como la enzima conversión angiotensina ACE rs 4646994, de genes implicados en la inflamación como cytotoxic T-lymphocyte-associated protein 4 (CTLA4) rs231775, o genes responsables de la coagulación/fibrinólisis, como del gen del Factor II de coagulación (F2 rs 1799963), del FactorV (rs 6025 y rs 6020) o la variante rs1799889 en Serpina Peptidasa inhibitor (SERPINE1) también conocido como plasminógeno activador-inhibidor tipo1, y finalmente la variante rs268 de la lipoprotein lipase (LPL) [50].
Pero al igual que otras enfermedades complejas, la PE es poligénica y futuros estudios contribuiran a un mayor conocimiento patogénico.
El papel de los factores de riesgo vascular convencionales, como tabaquismo, uso de anticonceptivos orales y antecedentes de enfermedad vascular familiar, sí son significativos [51]. En nuestra experiencia [52] la existencia de antecedentes familiares de HTA supone un Riesgo Relativo (RR) de PE de 6,9 (IC: 3,3-14,1); el ser primigesta añosa es RR= 2,81; el uso previo de anticonceptivos orales es RR 2,87 y el ser hipertensa, el RR es 6,39.
Dos factores importantes desde el punto de vista epidemiológico y patogénico, son la diabetes y la obesidad. La gestación normal condiciona una relativa resistencia a la insulina e hiperinsulinemia para lograr una adecuada nutrición fetal, pero en la PE se asocian hiperinsulinemia y acúmulo de glicógeno placentario, provocando una mayor inactivación de factores angiogénicos y en consecuencia mayor riesgo de PE [53]. Y en la obesidad materna se caracteriza por una vascularización placentaria, acompañada de alteraciones en la expresión de los transportadores de nutrientes en la barrera placentaria, lo que contribuye a alterar el crecimiento fetal y a provocar anomalías metabólicas a largo plazo.
Finalmente una reflexión sobre la hiperuricemia (HUR). Múltiples autores correlacionaron la HUR con la severidad de la PE [54], la lesión glomerular [55], la morbimortalidad perinatal y la precocidad de la PE [56]. A pesar de todo ello el valor predictivo de la HUR en la PE es muy discutido. En dos recientes revisiones sistemáticas, una concluye [57] que no existe evidencia suficiente que correlacione la HUA con la PE, y la segunda demuestra que el ácido úrico en un pobre predictor de las complicaciones materno-fetales [58]. Todo ello se podría explicar a través del manejo del ácido úrico en el riñón. En condiciones normales, el ácido úrico es completamente filtrado en el glomérulo, el 90% se reabsorbe en el túbulo proximal (TPx), el 50% se secreta en el segmento S2 del mismo y, finalmente, existe una reabsorción postsecretoria en los últimos segmentos del TPx. La HUR de la PE se debe a una mayor producción por la placenta [59] y a un aumento de la reabsorción en el TPx. La administración de probenecid [54] reduce la tasa de ácido úrico y no altera el curso clínico de la PE, por lo que la HUR no parece ser un elemento importante en su desarrollo [60].
4.2.- Criterios diagnósticos
a) TA > 140/90 mmHg (Figura 13) en dos o tres ocasiones antes de la semana 20 de gestación [43] [61]; o TA > 160/110 mmHg o bien HTA definida como ascenso de > 25 mmHg de TAS o > 15 mmHg TAD sobre los valores preembarazo, aunque este criterio tiene un escaso valor pronóstico [51].
b) Proteinuria > 300 mg/24 o 0,3 g/g proteina/creatinina (Figura 13).
c) Tasa plasmática de factores angiogénicos: ratio sFlt1/PIGF, pero su valor predictivo positivo es del 32% en la semana 28 [62].
d) Índice Pulsatil de la Arteria Uterina (UTPi): El uso diagnóstico de la velocidad de flujo de la arteria uterina en la predicción de la PE es controvertido porque los estudios no son homogéneos, debido a diferentes técnicas de muestreo, criterios diferentes para definir la anormalidad de las ondas o para definir la PE, o la edad gestacional en el que se realizó el examen ecográfico. Una reciente revisión sistemática [63] concluye que el UTPi es más preciso para la predicción de PE en el segundo trimestre que en el primero por lo que los expertos no lo recomiendan para la detección precoz de la PE [64].
La asociación de varios biomarcadores y el UTPUi, mejora la sensibilidad y especificidad diagnóstica, como se mostrara en la prevención de la PE.
4.3.- Mecanismos patogénicos
El fenómeno patogénico básico de la PE es la hipoxia y disfunción endotelial condicionada por un disbalance de factores angiogénicos que producen anomalías de la placentación e isquemia placentaria, y desarrollo de un síndrome maternal y alteraciones de la tolerancia inmunológica en la interfase maternal-placentaria. No es un proceso limitado que se resuelva con el parto, ya que la disfunción endotelial puede persistir y convertirse en un factor de riesgo cardiovascular futuro.
Los mecanismos patogénicos son:
* Placentación anormal
* Alteración maternal
Veamos detenidamente cada uno de ellos:
a) Placentación anormal
Los estudios en modelos experimentales sugieren que la isquemia/hipoxia placentaria es el mayor desencadenante de la PE, y es consecuencia de una disrregulación de la angiogénesis y un defecto de implantación de la placenta, definido por factores intrínsecos (anomalía del trofoblasto velloso) y factores extrínsecos que alteran la decidualización. Los hallazgos histológicos placentarios más comunes en la PE son arterioesclerosis, esclerosis de arterias y arteriolas, depósito de fibrina e infartos, hallazgos producidos por hipoperfusión e isquemia, que además se correlaciona con la severidad de la PE [65].
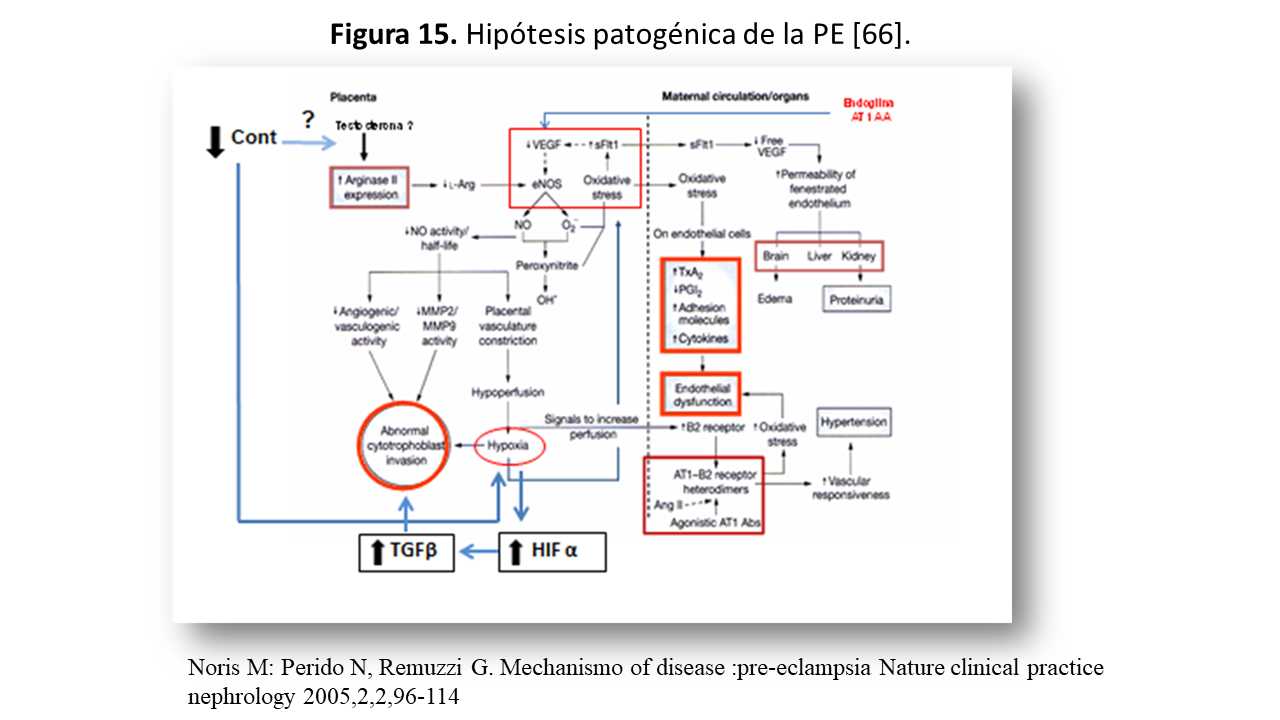
Vamos a revisar como se desarrolla la placentación en la gestante con PE (Figura 15) [66]. La génesis de la hipoxia/isquemia comienza por la disminución de ON en la placenta. Esta no se debe a la falta de sintasa endotelial de óxido nitroso (eNOS) ya que se expresa en cuantía normal en la PE. Posiblemente el fenómeno patogénico sea la disminución de la vida media del ON, que rápidamente se degrada a peroxynitrito (ONOO-), un potente agente citotóxico. La explicación puede ser que la producción de ON condicione la producción de anión superoxido (O2-) que esta regulado por L-Arginina, que a su vez, está disminuida en la placenta de la PE, posiblemente por mayor expresión de arginasa II, sobrerregulada en la PE por la testosterona [67]. En consecuencia, se produce mayor síntesis de Radícales Libres de Oxígeno (ROS). A nivel experimental, la administración de un inhibidor de L-Arginina a ratas embarazadas condiciona el desarrollo de una situación de PE [64]. En esta situación de deficit de L-Arginina/ON e hipoxia, los factores antiangiogénicos están elevados (sFlt-1 y sEng), los proangionegicos disminuidos (VEGF, PIGF, TGF-1α), las citokinas proinflamatorias están aumentadas (TNFα, LIGHT, IL-6) y disminuidas las antiinflamatorias (IL-10). El factor inducible por hipoxia (HIF), las especies reactivas de oxigeno (ROS) y los autoanticuepos AT1(AT1AA), están aumentados.
Otro factor, también muy importante en el desarrollo de la hipoxia placentaria, es catechol-O-methyltransferasa (COMT). Su papel patogénico en la PE no es bien conocido, pero su función es convertir el 17-hydroxiestradiol en 2-metoxyestradiol (2-ME) un inhibidor de HIF-1. Es posible que las bajas concentraciones y baja actividad demostrada en las placentas humanas preeclámpticas, pueda ser consecuencia de alteraciones genéticas asociadas a diferentes polimorfismos [68].
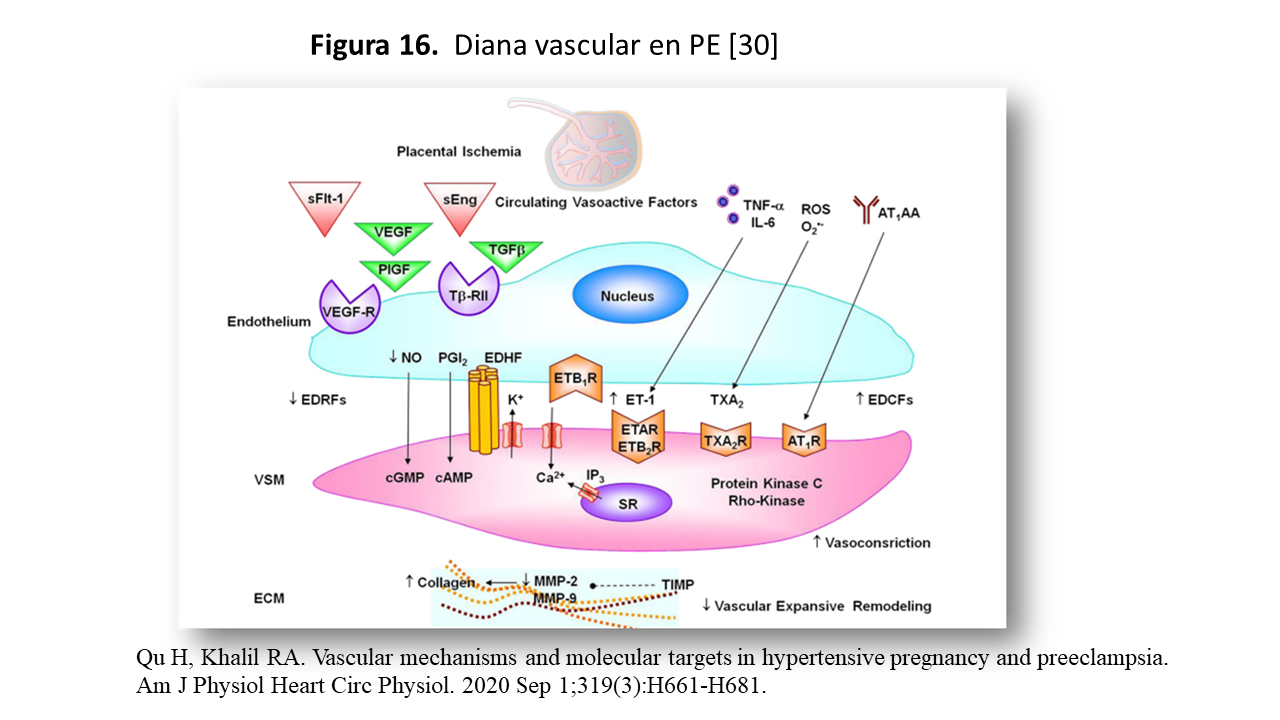
Estos factores se dirigen al endotelio vascular a través de las “dianas” correspondientes (Figura 16) causando disfunción endotelial y cambios en los factores relajantes y contráctiles derivados del endotelio, alteraciones en VSM y ECM. Se altera la decidualización, y consecuentemente, se producen deficiencias en de implantación (angiogénesis/vasculogenesis) produciendo hipoperfusión e isquemia placentaria, que es el mecanismo patogénico básico de la PE.
La acción de los factores antiangiogenicos como sFlt-1 y sEng ya fueron comentados con anterioridad y ahora veremos la descripción de otros factores bioactivos implicados en el desarrollo de la PE [30]:
1.- Citokinas, TNF e interleukinas. La isquemia placentaria induce la síntesis de citokinas inflamatorias. El TNFα incrementa 2 veces su valor, aumenta la permeabilidad vascular, la proliferación fibroblástica, activación de linfocitos y la producción de IL6 y IL-8, “downregulate” eNOS aumentado el estrés oxidativo y disminuye la expresión de moléculas de adhesión. Curiosamente, el Ácido urico estimula la secreción de IL por los monocitos y la hiperuricemia observada en la PE puede condicionar una mayor tasa de TNF-α e IL-1β. La IL-6 aumenta en la PE y promueve la “dimerización” de GP-130 (proteína transmembrana receptor de citokinas) y produce una anormal señalización intracelular.
La IL-10 es una citokina antiinflamatoria responsable de la maduración del cuerpo lúteo y de la producción de progesterona, esta disminuida en la PE.
2.- Endotelina -1 (ET-1) es el mayor vasoconstrictor en la patogenia de la PE. Factores como cytokinas, hipoxia, AT1-AA estimulan su expresión por EC. ET-1 activa (Figura 16) su receptor ETAR en VSM y ETB2R en EC en células renales y reduce la presión de perfusión uterina (RUPP). Induce apoptosis de células trofoblásticas, reduce el remodelado de arterias espirales, disminuye los antioxidantes, incrementa la expresión de sFlt1 y reduce VEGF. Via ETAR, estimula la liberación de Ca2+ intracelular y a través de PKC, aumenta la contracción de VSM y esto se potencia por la hipoxia. A través de ETB1R, puede ejercer las acciones contrarias: estimula la libración de ON, PGI2 y EDHF, disminuyendo el tono vascular, y produciendo vasodilatación de las arterias renales e hiperfiltratión [37].
3.-Protaglandinas y TXA2: la dismunción de síntesis de PGI2 y Tromboxano A2 (TXA2) es una causa importante de desarrollo de PE. PGI2 es un potente vasodilatador producido via COX-1 y COX-2 pero la hipoxia “donwregulate” COX-1 y consecuentemente la producción de PGI2 por ECs se reduce.
El TXA2 es un potente vasoconstrictor y estimulante de la agregación plaquetaria, también induce proliferacion de VSM y mitogenesis. La hipoxia via peroxidacion lipídica aumenta la actividad de COX-1 y en consecuencia de TXA2 en PE [37].
4.- El factor inducido por hipoxia (HIF). HIF-α1 es un heterodimero con una subunidad HIFα 1 y HIFα2 regulada por 02 y una HIF-β1, constitutiva y regula genes de VEGF, TGF-β3 y NOS. En el embarazo, los estrógenos-progesterona aumentan la expresión de HIF y en la PE esta muy elevado HIF-1α y “suprarregula” sFlt-1 y sEng, incrementando ET-1 mRNA, reduciendo la invasión trofoblástica y aumentando la producción de AII.
5.- Especies reactivas de Oxygeno (ROS). En el embarazo normal el estrés oxidativo producido por el metabolismo materno y placentario es controlado por un incremento de antioxidantes como heme oxygenasa 1(HO-1), la HO-2, superoxido dismutasa (SOD) y glutatión peroxidasa (GPx). En la PE las mayores fuentes de ROS son los neutrófilos y monocitos. En la PE los neutrófilos producen mas peróxido de hidrogeno (H2O2) y superoxido (O2-). Esto elimina el ON para formar perooxynitrito (ONOO-) y al disminuir la bioactividad del ON se produce daño endotelial. Este descenso de la actividad antioxidante conduce a la peroxidacion lipídica, aumento de tromboxano A2 y disminución de la actividad de glutatión peroxidasa en la placenta [69].
6.- Factor hiperpolarizante derivado del endotelio (EDHF). El endotelio controla el tono vascular no sólo mediante la liberación de ON y prostaciclina, sino también por otras vías que provocan la hiperpolarización de las células musculares lisas subyacentes. Este es el origen de la denominación factor hiperpolarizante derivado del endotelio (EDHF). Las respuestas mediadas por el EDHF implican un aumento de la concentración de Ca2+, la apertura de canales de potasio activados por calcio de conductancia pequeña (SKca) e intermedia (IKca) y la hiperpolarización de las células endoteliales. Esto da lugar a una hiperpolarización dependiente del endotelio de las células musculares lisas, que puede ser evocada por el acoplamiento eléctrico directo a través de las uniones mioendoteliales (MEGJS) y/o la acumulación de iones de potasio en el espacio intercelular. La PE se asocia con la contribución heterogénea de EDHF, y el mecanismo detrás de las respuestas de tipo EDHF está mediado por MEGJ solos o en combinación con H2O2 o metabolitos epoxigenasa del citocromo P-450 de AA.
Es posible que las alteraciones morfológicas dentro de la pared vascular pueden ser la base de la contribución disminuida que hacen los MEGJ en la mediación de la vasorelajación del EDHF en la PE [70].
7.- Los AT1-AA (Anticuerpos Anti-AT1). Son un factor bioactivo, autoanticuerpos capaces de activar el receptor AT1 de angiotensina II del trofoblasto humano [71] y es posible que su generación sea secundaria a la reducción de la circulación placentaria y persisten posparto contribuyendo asi al incremento del riesgo cardiovascular que se observa en las mujeres que han tenido PE.
Casi el 40% de la AII es producida localmente en la placenta por una chymasa. La AII, via AII Type 1 receptor (AT1R) promueve vasococonstricción, crecimiento vascular, inflamacion, aumento de Ca2+ y actividad de Rho/Rho-kinasa en VSM y via AT2R activa eNOS, incrementa producción de ON y PGI2 y en la “no-embarazada” aunque las tasas de renina y AII están elevadas, la respuesta a AII esta disminuida porque su acción se realizada posiblemente a través de AT2R.
La respuesta a AII está aumentada en la PE pero no a través de AT1 [64], es posiblemente a través del receptor B2 Bradikinina-AT1s [72]. Los AT1 forman un heterodímero con el receptor B2-bradiquinina, y este complejo AT1/B2 es resistente a la inactivación por ROS y se convierten en "hiperrespondedores" a la A II. Asimismo, la activación de AT1-AA incremeta sFLt1, ROS,Ca++ celular, activación de factores de coagulación, disminuye secreción de aldosterona.
En la PE, sus acciones más destacables son:
* Inducen mayor expresión de sFlt-1. En condiciones normales de embarazo AT1 vs AII es el mayor regulador de sFlT-1, pero en la PE existe una acción adicional a través de AT1-AA que lo incrementa notablemente y tiene importantes acciones antiangiogénicas.
* Estimulan mayor síntesis y secreción de PAI-1 en células mesangiales contribuyendo a la lesión glomerular y la aparición de proteinuria, y la mayor secreción de PAI-1 por células trofoblásticas puede contribuir a una mayor hipercoagulabilidad.
Los AT1-AA pueden ser detectados en sangre materna antes de la 20 semana de gestación en la embarazada con disminución de flujo placentario, pero no es un marcador específico [73]. Existen evidencias [32] [73] de que la disfunción endotelial en la PE se asocia con un incremento de sFlt-1 y que el regulador in vivo es AII. En ratas, tras la infusión de AII los niveles de sFlt-1 aumentan más en las embarazadas que en los controles, pero si previamente se tratan con Losartán o FK 506, se inhiben, lo que demuestra que la activación AT1 es vía Calcineurina.
* Aumenta la agregación plaquetaria e incrementa las tasas de Endotelina -1 [30].
8.- VSM y Ca2+. El Ca2+ de VSM es el mayor determinante de contraccion de VSM a través del complejo Ca2+/calmodulina (CAM) el cual activa las cadenas ligeras de miosina. En situación de hipoxia la disminución de factores relajante del endotelio, aumenta el Ca2+ y causa vasoconstriccion. En PE se han demostrado un incremento de Ca2+ en eritrocitos, plaquetas y linfocitos via AT1R y que puede persistir hasta 6 semanas postparto [74].
9.- La quinasa Rho (ROCK). Pertenece a la familia “small GTP-binding proteins” (G proteins), son proteínas monoméricas con un peso molecular de 20–40 kD y desempeñan un papel central en la organización del citoesqueleto de actina y está involucrado en una amplia gama de funciones celulares fundamentales como la contracción, la adhesión, la migración, la proliferación y la expresión génica. Se supone que dos isoformas, ROCK1 y ROCK2, son funcionalmente redundantes, basándose en gran medida en los principales activadores comunes, el alto grado de homología dentro del dominio quinasa. Extensos estudios experimentales y clínicos apoyan un papel crítico para la vía RhoA / ROCK en el lecho vascular en la patogénesis de las enfermedades cardiovasculares, en la que el aumento de la actividad de ROCK media la hipercontracción de las células del músculo liso vascular, la disfunción endotelial, el reclutamiento de células inflamatorias y la remodelación vascular. En PE la placenta muestra una anormal expresión de ROCK-2 con incremento de la sensibilidad a Ca2+, también Ang-II via AT1R incrementa la actividad de ROCK y la inhibición de Rho kinasa, disminuye la tasa de TXA2 [37].
10.- Protein Kinasa C. Importante mediador de contracción de VSM y puede incrementar la producción de AT1-AA el cual estimula AT1R [71].
11.- Deficiencia de vitamina D. 25(OH)D3 y 1,25(OH)2D3 son potentes moduladores de la respuesta inmune innata y adquirida, incluyendo la supresión de las NK e inhibición de las CD [75] y además regulan el VEGF [76]. En la PE la tasa de vitamina D esta disminuida lo que contribuye a la disfunción endotelial, vía SRAA y también al desarrollo de HTA [77]. No está claro si la deficiencia de vitamina D es causa o consecuencia de la PE.
12.- Resistencia a la insulina: se demostró una correlación lineal entre HOMA (índice de resistencia a la insulina) y VEGF. La insulina reduce la expresión de VEGF mRNA lo que contribuye a un defecto de la angiogénesis y a la disfunción endotelial (DE) [78].
12.- Metaloproteinas uteroplacentarias (MMP) y matriz extracelular (EMC). Como ya se comentó con anterioridad las MMP son enzimas proteolíticas que degradan la (EMC) para lograr una adecuada invasión trofoblastica, degradando colágeno, y esencialmente realizado por MMP-9. Las MMP pueden estar reguladas por microRNAs. En la PE hay una mayor expresión de miRNA 125b-13p que reduce S1PR1, una Proteina G que facilita la invasión de trofoblasto y la mayor expresión placentaria de miR-517ª/b y miR517c y miR204 reducen la acción invasiva del trofoblasto [30].
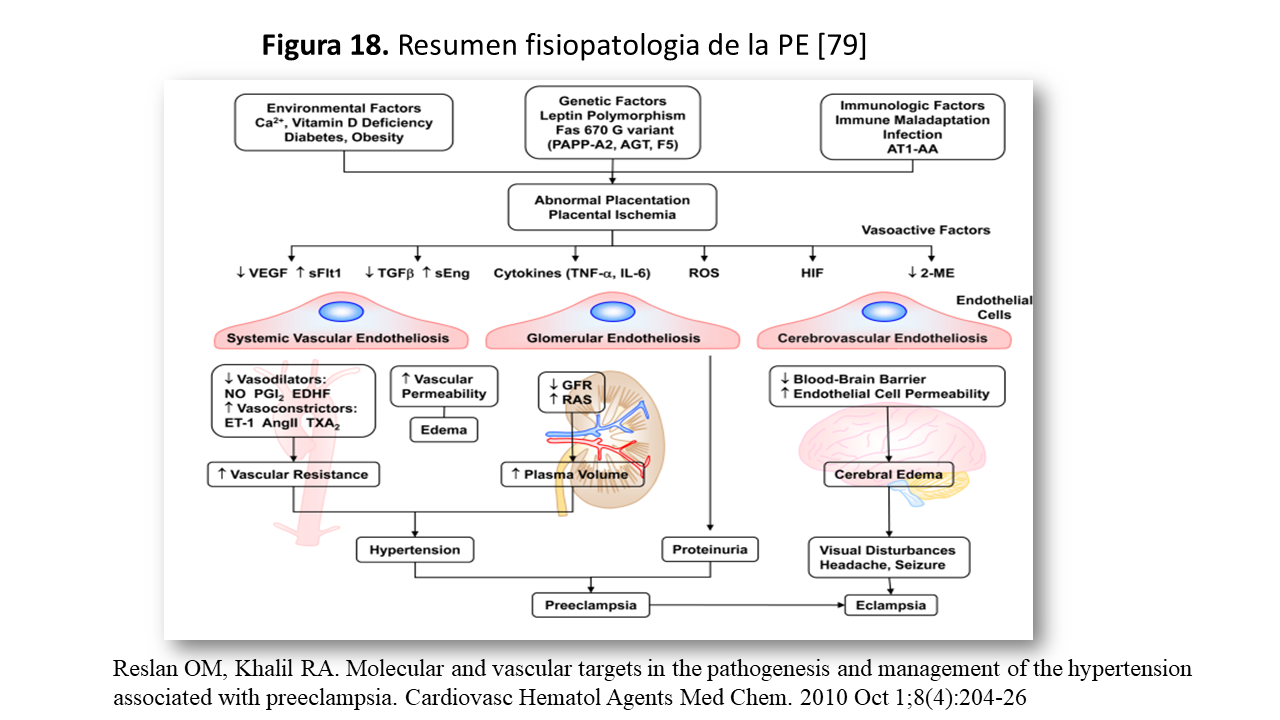
En definitiva se configura una alteración placentaria (Figura 17) con disfunción endotelial e isquemia /hipoxia placentaria.
b) Alteración maternal
Las anomalías de la placenta en la madre condicionan diferentes problemas, pero lo esencial es la disfunción endotelial y la HTA. En la (Figura 15) se muestra un resumen de esta asociación de diferentes factores. En el lado maternal, comparada con la situación de vasodilatación del embarazo normal, la PE es una situación de vasoconstricción universal y esta situación se expresa como disfunción endotelial, estando implicadas gran cantidad de sustancias vasoactivas entre las que destacan: Endotelina 1, Tromboxano A2 y disminución de agentes vasodilatadores como Prostaglandina I2 (PGI2).
La integración de esta hipótesis se observa en la (Figura 15) [66]. En el lado materno, el VEGF-Flt1 induce, estrés oxidativo como ya se comentó en y la liberación de TXA2, citokinas … que contribuyen a la disfunción endotelial, que traduce las alteraciones cerebrales, renales y hepáticas.
En conclusión: Factores genéticos, inmunológicos o factores de riesgo preexistentes, producen la hipoxia placentaria, estrés oxidativo, disfunción endotelial e HTA, y las alteraciones en cerebro, hígado y riñón (Figura 18) [80]. A nivel renal existe evidencia de necrosis fibrinoide, proliferación de neoíntima y depósitos de macrófagos y arterioesclerosis (expresión de NFkß, ROS y Flt-1) [79].
Brevemente vemos un descriptivo de las alteraciones cerebrales, hepaticas y cardiacas en la PE
a) Alteraciones Cardiacas:
La enfermedad cardíaca en la madre es la causa más importante de mortalidad materna y no ha habido signos de disminución en su incidencia en las últimas décadas. La disección aórtica, la miocardiopatía periparto y la cardiopatía isquémica son causas raras pero importantes de mortalidad materna.
La prevalencia de la cardiopatía isquémica ha aumentado debido a los cambios en el estilo de vida con más mujeres con obesidad, hipertensión y diabetes, y la tendencia a la edad más avanzada en el primer embarazo, incluido el aumento progresivo de la fecundación in vitro y los embarazos múltiples.
La miocardiopatía periparto (MCPP) es una enfermedad a menudo mortal que afecta a las mujeres embarazadas próximas al parto, y se presenta con mayor frecuencia en mujeres con preeclampsia y/o gestación múltiple. Aún se desconoce la etiología de la MCPP y por qué se asocia a la PE. Experiencias recientes demuestran que la MCPP está causada por disfunción vasculo-metabólica. Se han propuesto al menos dos mecanismos. El primer mecanismo se descubrió utilizando ratones modificados genéticamente para anular el factor de transcripción STAT3 (Signal Transducer and Activator of Transcription 3) en los cardiomiocitos. En estos ratones, la prolactina de la gestación tardía se descompone de forma aberrante en el corazón en un fragmento de 16 kDa que es tóxico para la vasculatura cardiaca. El tratamiento con bromocriptina, un inhibidor de la prolactina, corrige los tratornos inducidos en los cardiomicitos. Se están realizando ensayos clínicos de bromocriptina y un estudio piloto inicial mostró resultados prometedores [80].
El segundo mecanismo propuesto (no excluyente con el primero) se descubrió utilizando ratones modificados genéticamente para carecer de PGC-1 (Peroxisome proliferator-activated receptor-gamma coactivator-1alpha) un miembro de la familia de co-activadores de transcripción y poderoso regulador de la angiogénesis. En estos ratones, la expresión cardíaca reducida del factor angiogénico VEGF hace que el corazón sea susceptible a la acción antiangiogenica de sFlt1. La sFLT1 exógena por sí sola causó disfunción diastólica en ratones de tipo salvaje, y disfunción sistólica profunda en ratones carentes de PGC-1α cardíaca. En gestantes con PE y MCPP, la tasa plasmática de sFlt-1 se correlacionan con la gravedad de la cardiopatía [81]. En PE los datos ecocardiograficos demuestran la prevalencia de disfunción diastólica con función sistólica conservada. [82]
b) Alteraciones cerebrales
La vasculatura cerebral materna es altamente vulnerable a los efectos adversos de la PE. Las complicaciones cerebrovasculares a corto y largo plazo de la PE incluyen el síndrome de encefalopatía posterior reversible (PRES), el síndrome de vasoconstricción cerebral reversible (RCVS), el accidente cerebrovascular hemorrágico e isquémico, la enfermedad cerebral de vasos pequeños y la demencia vascular [83].
c) Alteraciones Hepáticas
Las enfermedades hepáticas específicas del estado gestante se pueden clasificar en las del embarazo precoz (hiperémesis gravídica [HG]) y las del embarazo tardío (hígado graso agudo del embarazo [AFLP], PE con afectación hepática incluyendo hemólisis, enzimas hepáticas elevadas y síndrome de plaquetas bajas (HELLP), rotura/infarto hepático y colestasis intrahepática del embarazo (PIC) [84]. En el 20-30% de los casos de PE, hay afectación hepática que se cree que es secundaria a la vasoconstricción del lecho vascular hepático [85].
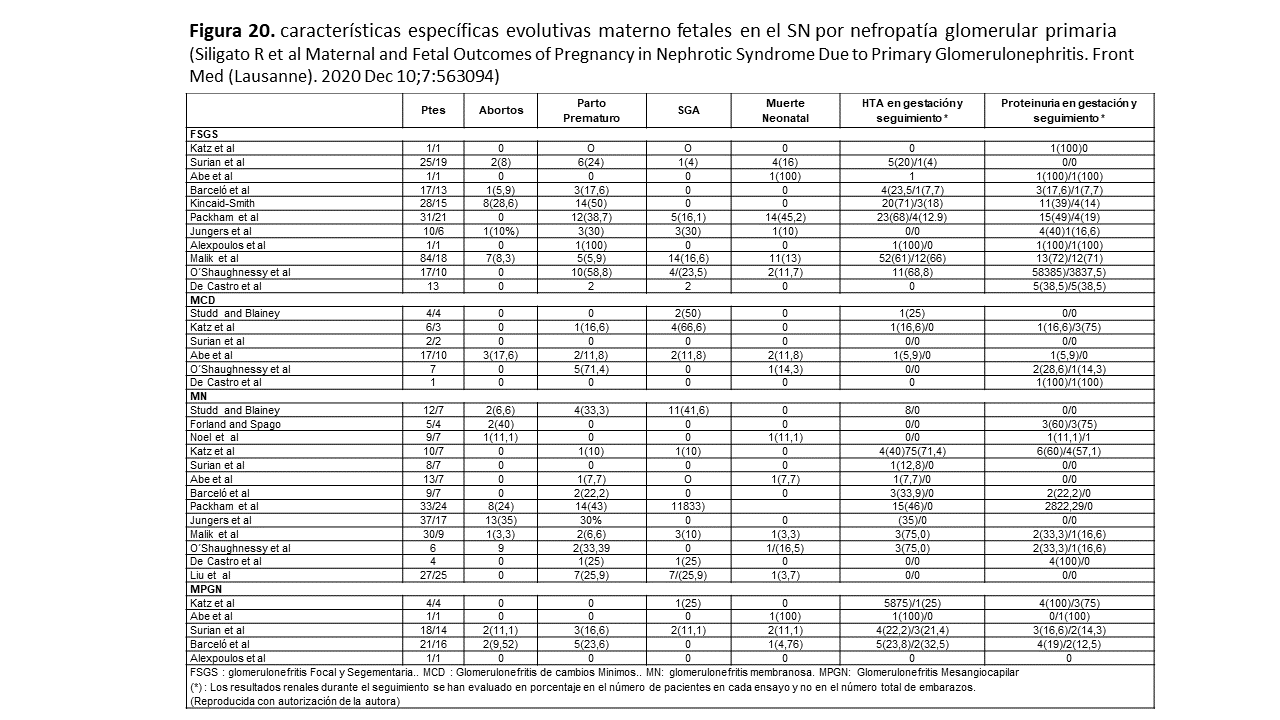
5. Nefropatía de la PE
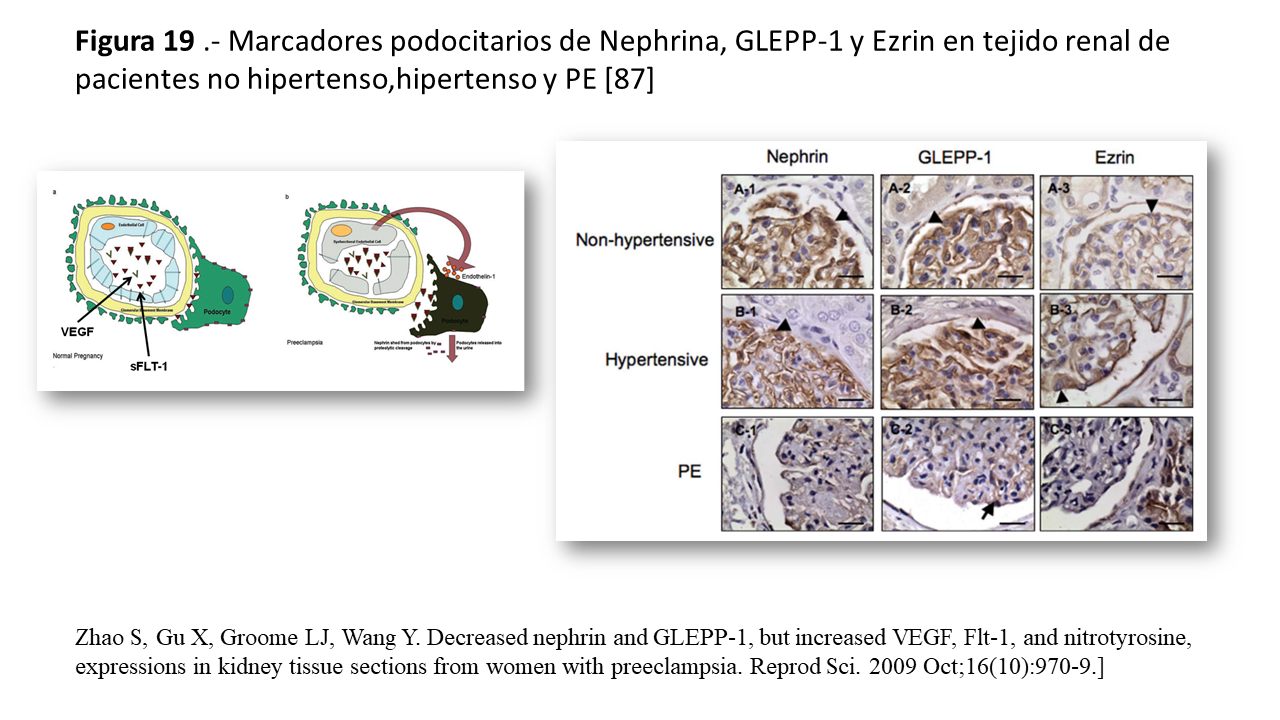
Es ampliamente considerada como un claro ejemplo de enfermedad endotelial o “endoteliosis” entendido como la hinchazón de las células endoteliales por la expansión citoplasmática, proliferación de células mesangiales sin engrosamiento de la membrana basal, y depósito de fibrinógeno (Figura 19). La endoteliosis expresa exclusivamente una lesión celular endotelial y la activación de la coagulación intravascular pero no existe evidencia de lesión inmunológica [86].
La membrana basal y los podocitos no están afectados como se suele observar en las imágenes de microscopia electrónica. No obstante, a pesar de esta demostración histológica, hay evidencia de que la alteración podocitaria es básica en el desarrollo de la nefropatía de la PE. En diferentes experiencias se observó una baja expresión de nefrina, GLEPP-1 (glomerular epitelial protein-1) y ezrin (Figura 19) [87] y synaptopodina [90] y la expresión de podocina no se modifica lo cual podría ser la causa de la proteinuria [88].
Diferentes líneas de evidencia demuestran que la desregulación de los factores proangiogénicos, son los responsables de la lesión podocitaria. La perdida de nefrina podría ser debida a una mayor tasa de endotelina-1 y al descenso de VEGF [89] [90] por un incremento de sFlt-1 circulante, y como consecuencia de la DE, se libera Endotelina 1 que produce la lesión podocitaria via receptor ETA [92]. El uso de bevacizumab, un antiVEGF, las alteraciones morfológicas renales detectadas son similares a la PE y a Sindrome de HELLP [91]
La podocituria no solo aparece antes de la proteinuria, sino que ademas se correlaciona con el grado de proteinuria, por lo que podría ser un marcador precoz de PE [2]
En la PE, además de la nefropatía típica o endoteliosis puede desarrollarse una Glomerulonefritis Focal y segmentaria (GEFS). Esta, podría ser una manifestación secundaria a hipertensión sistema severa, e hiperfltración [93], es autolimitada [94], pero puede persistir proteinuria hasta los 30 meses postparto [95]. El diagnóstico diferencial frente a la GEFS de novo no es fácil pero la coexistencia de lesiones histológicas tipo esclerosis global y atrofia túbulo/intersticial, indica que presumiblemente se trate de una lesión glomerular primaria [93].
La expresión de nephrina, GLEPP-1 y Ezrin esta mas reducida en podocitos (C-1, C-2, and C-3) en la PE, comparado con los controles de no Hipertenso (A-1, A-2, and A-3) e hipertenso (B-1, B-2, and B-3) [87]
El Síndrome Nefrótico (SN) en el embarazo, es una entidad rara [96], se estima que ocurre en el 0,028% de las gestaciones [98] y la causa más frecuente es la PE, aunque sin diagnósticos histológicos, la incidencia de SN secundario a nefropatía glomerular primaria es difícil de establecer, máxime, si coexiste con PE.
En una amplia y reciente revisión de Siligato y col [97] revisan características específicas evolutivas materno fetales en el SN por nefropatía glomerular primaria (Figura 20). En la glomerulonefritis focal y segmentaria (FSGS) existe una alta incidencia de aborto espontáneo (5,9-28,6%), parto prematuro en el 5,9-58,8% de los casos, y muerte perinatal entre 11,7-45,2%. La HTA aparece en el 20-71% de las gestantes y persiste más de 6 meses en el 4-66% de las mujeres. En la glomerulonefritis por cambios mínimos (CM) se incrementa la proteinuria en el postparto y la muerte perinatal ocurre en el 14,3 % de los casos. En la glomerulonefritis membranosa (MN) es destacable la baja incidencia de abortos y muerte perinatal. La HTA está registrada en el 7,7-45,4% de las gestaciones. En la glomerulonefritis mesangiocapilar (MPGN) el parto prematuro aparece en el 16,7-23,8% y la muerte fetal es menos frecuente que en la FSGS y MN, oscilando entre 0-11%.
El tratamiento del SN en el embarazo tiene algunas particularidades [97]. El uso de diuréticos se debe reservar para el SN refractario a inmunosupresores y con estricto control sobre los trastornos hidroelectrolíticos materno-fetales. El uso de albumina no está indicado y además puede aumentar la hiperfiltración. Cuando la albumina plasmática es menor de 2 gr/L, el estado de hipercoagulabilidad se debe tratar con heparina de bajo peso molecular. En las glomerulonefritis primarias, el uso de inmunosupresores tiene limitaciones: el ácido micofenólico y la ciclofosfamida son teratógenos y los anticuerpos monoclonales tipo antiCD20 (Rituximab) atraviesan la barrera feto-placentaria y puede inducir depleción transitoria de células B en el feto. Los inhibidores de la calcineurina (Ciclosporina A) pueden ser usados, no hay evidencia de teratogenicidad ya que la glicoproteína P, la inactiva a su paso por la placenta.
Los esteroides de vida media corta (prednisona y metilprednisolona) también pueden ser utilizados debido a su inactivación por la 11?hidroxiesteroide deshidrogenasa tipo 2 de la placenta, que evita los efectos adversos de los esteroides en el feto.
En conclusión, la aparición de SN debido a una nefropatía glomerular primaria, es una entidad rara en la gestación, aunque se puede presentar con PE sobreimpuesta lo cual dificulta el diagnóstico. La incidencia de PE oscila entre 2-7 % de los embarazos y es muy importante la prevención primaria no solo por las complicaciones materno-fetales que produce, sino además, porque es un factor de riesgo cardiovascular que persiste más allá del embrazo. En la actualidad el método diagnóstico precoz y de fácil aplicación clínica, es la determinación del Índice Hiperbarico (IHB) mediante monitorización ambulatoria de la presión arterial (MAPA) lo cual posibilita el tratamiento preventivo con ácido acetil salicílico (ver Prevención de la PE). En el caso de SN por nefropatía glomerular primaria, la glomerulonefritis por cambios míninos es la más favorable y las de peor pronostico son la glomerulonefritis Mesangiocapilar y glomerulonefritis focal y segmentaria. En el tratamiento, se debe evitar el uso de diuréticos, albumina parenteral e inmunosupresores excepto anticalcineurínicos, y se debe prevenir las consecuencias de la hipercoagulabilidad.
6.- TRATAMIENTO DE LA PE Y LA HTA DEL EMBARAZO
El tratamiento definitivo de la PE es el parto, el cual es siempre beneficioso para la madre, ya que su prolongación conduce a situaciones de alto riego de morbimortalidad materna y además la PE es un proceso reversible. Por el contrario, el parto puede ser nefasto para el feto y por ello en determinados casos se debe perseguir la maduración fetal.
5.1.- Indicación de tratamiento antihipertensivo
La mayor indicación de terapia antihipertensiva en la PE es la prevención del accidente vascular cerebral, la insuficiencia cardiaca e isquemia miocárdica ya que la disminución de la TA no modifica la PE, puesto que ésta, como ya se comentó con anterioridad, es consecuencia de la disfunción placentaria. Se aconseja iniciar tratamiento antihipertensivo en mujeres pre eclámpticas con TAS > 150 mmHg o TAD > 95-100 mmHg.
Un factor limitante, son los posibles efectos sobre el feto. Una amplia revisión de la Cochrane Database Syst Rev 2007 [98] no demuestra que el tratamiento de la HTA moderada condicione mayor mortalidad o prematuridad. Al contrario, otro metaanálisis encuentra que el tratamiento de la HTA moderada disminuye el crecimiento fetal, asi por cada descenso de 10 mmHg de la TA Media, se asocia con una disminución de 176 gr de peso al nacer [99].
No existe, por tanto, un consenso para iniciar el tratamiento anthipertensivo, pero la mayoría de los autores coinciden en que el tratamiento puede ser iniciado en mujeres con PE con síntomas atribuibles a la HTA, tal como cefalea, alteraciones visuales, y en mujeres jóvenes cuya TA basal era baja (< 95/75 mmHg). El objetivo de TA es: TAS 130-150 y TAD 80-100 mmHg, con medicación oral, si no existe ninguna intolerancia.
El tratamiento antihipertensivo (Figura 21) en las otras situaciones hipertensivas de la mujer embarazada es:
a) HTA Gestacional: Las indicaciones son las mismas que para la mujer con PE.
b) HTA Previa o Preexistente: Como ya vimos anteriormente, las mujeres con HTA previa tienen una alta probabilidad de desarrollar PE (10-25%) además de otras complicaciones. Las indicaciones de tratamiento son:
HTA esencial: Diferentes estudios controlados no han demostrado que el tratamiento de la HTA esencial grado 1-2 reduzca el riesgo de PE o Abruptio o mejore la situación futura del feto o de la madre [98] aunque si puede descender la incidencia de HTA severa [73]. Teniendo en cuenta estos datos, se sugiere que en la embarazada con HTA previa, Grado 1-2 (sin lesión en órganos diana) se puede suspender la medicación antihipertensiva, al menos durante el primer trimestre, monitorizar la TA y reintroducirla si la TA > 150 / 90-99 mmHg.
HTA secundaria: en los subgrupos de mujeres con enfermedad renal, colagenosis, Diabetes Mellitus, historia previa de ictus, mayores de 40 años o con lesión en órganos diana (retinopatía, disfunción ventricular, etc.) se debe mantener el tratamiento antihipertensivo y el objetivo terapéutico es 130-150/80-90 mmHg.
c) HTA Postparto: La HTA asociada a PE usualmente desaparece entre las semanas 3 y 12 postparto, pero en algunos casos puede persistir hasta los 6 meses. En estos casos el tratamiento sigue las indicaciones generales de la mujer hipertensa no embarazada. Los antihipertensivos se muestran en la (Figura 22), y en las emergencias hipertensivas, las opciones terapéuticas son:
Labetalol perfusión: 200 mg/200 ml de suero salino 0,9% a 60-120 ml/hora
Urapidil perfusión: 30 a 60 mg/hora
Furosemida i.v. (si existe edema agudo de pulmón)
Sulfato de magnesio: el efecto anticonvulsivante se explica por qué bloquea la transmisión neuromuscular al disminuir la liberación de acetilcolina y reduce la sensibilidad de la placa motora terminal. Los efectos secundarios más llamativos son la depresión respiratoria y la hiporeflexia o prolongación de PR y ensanchamiento del complejo QRS. La desaparición del reflejo rotuliano se observa cuando la tasa plasmática alcanza los 8 a 10 mEq/L. En situación de hipermagnesemia el antídoto es gluconato cálcico 10 ml al 10% (IV) a la dosis de: 4 a 6 gr al 20% (IV) seguidos de 1 a 2 gr/hora.
Otras drogas como fenitoina, diazepan u otras benzodiacepinas (midazolan, lorazepan, fenobarbital) pueden ser utilizadas como anticonvulsivantes, pero se deben usar conjuntamente con antagonistas del calcio.
Nuevas estrategias terapéuticas
Se están ensayando diferentes estrategias terapéuticas, como los ligandos de sFlt1 con VEFG recombinante en ratas que sobre expresan sFlt1. Su administración disminuye la TA, la nefropatía y no se produce afectación fetal [100], y similares resultados se encontraron con PIGF recombinante [101].
Otro ensayo se realizó con Sildenafil (inhibidor de la 5 phosfhodiesterasa) y en diferentes modelos animales, se redujo la TA y aumentó el peso fetal, pero el estudio STRIDER [102] realizado en mujeres con insuficiencia placentaria y retraso de crecimiento del feto, se cerró por desarrollo de lesión pulmonar y muerte fetal. Se realizaron también estudios con Metformina, la cual reduce los factores antiangiogénicos, pero no hay estudios clínicos en prevención de PE [103]. Los ensayos realizados con inhibidores de bombas de protones (PIPs), cuyo mecanismo es bloquear la producción de sFlt1, se demostró este efecto en cultivo celular, pero no in vivo [104].
El uso de aféresis LDL para remover sFlt1, redujo sFlt1, tambien la proteinuria, se controló mejor la TA y permitió prolongar la gestación. Tanto las gestantes como los recién nacidos no tuvieron efectos adversos, aunque al no ser una adsorción selectiva, otros factores plasmáticos pueden ser removidos entre ellos el fibrinógeno [105].
7.- PREVENCIÓN DE LA PREECLAMPSIA
El primer objetivo del tratamiento de la PE es su diagnóstico precoz. Un cuidado prenatal adecuado con especial vigilancia de la ganancia de peso, la monitorización de la TA y el control de la proteinuria, pueden reducir la incidencia y gravedad de la PE. Pero es preciso disponer de algún método de diagnóstico precoz y para ello se han utilizado diferentes indicadores como:
1º.- sFlt1 5 a 6 semanas antes de PE, índice sFlt1/PIG o PAPP-A (Pregnancy Associated Plasma Protein A, metaloproteinasa secretada por sincitiotrofoblasto y disminuida en PE), polimorfismo GEN VEGF + 405, polimorfismos de AII, NOS, MTHFR (metilentetrahidrofolato reductasa) ó IL6 , IL10, TNF, ADMA (dimetilarginina asimétrica) pero ninguno de ellos aislado tiene la sensibilidad y especificidad necesarias para su uso en la clínica diaria [108], aunque la combinación de varios de ellos y la UTPi [47] [106], puede elevar el índice de detección hasta el 74,8% [107] (Figura 23).
Recientemente un amplio estudio [108] valoró la utilidad de un “marcador” multiple: edad gestacional, HTA crónica, sFLt-1, NT-proBNP y ácido urico frente al ratio sFlt-1/PIGF, en gestantes entre la semana 23 y 36. El valor predictivo positivo (PPV) del marcador multiple para PE era 83.1% (95% CI 78.5–88.2) comparado con el ratio sFlt-1/PIGF era 72.8% (95% CI 67.4–78.4). La especificidad del modelo era 94.9% vs. 91%, respectivamente. Otra experiencia [108] se realizó utilizando Ca-125 ó MUC-16 pero solamente para valorar la gravedad de PE. Se precisan otros diseños para usarlo com método de prevención precoz.
Por todo ello, un objetivo importante es conseguir un método diagnóstico rápido, fiable, de fácil aplicación clínica y se planteó utilizar la TA como un valor predictivo.
Clásicamente se consideraba que la TA en etapas precoces del embarazo podría servir de detección de PE, y la mayor aproximación era cuando la presión arterial media superaba 90 mmHg, pero en esta situación, solo un tercio de las embarazadas desarrollaban PE [51]. Estos pobres resultados de la medida estática de la TA eran consecuencia de utilizar el umbral que define la HTA esencial. Se trató de superar este problema utilizando la Monitorización Ambulatoria de la Presión Arterial (MAPA), pero los primeros estudios tampoco fueron concluyentes porque el diagnóstico de HTA en el embarazo con MAPA de 24 h se basó en el uso del umbral que define la HTA esencial, usualmente 130/80 mmHg [109], y esto condicionó deficiencias para el diagnóstico de HTA en la gestación.
Por tanto, el primer paso era definir el patrón de TA en la embarazada normal, y en la gestante con PE e HTA.
En la gestante normal, el perfil de TA, es descenso de TAS/TAD hasta la 20 semana, seguido de un incremento de la misma hasta el parto. La variabilidad predecible de la TA a lo largo del embarazo en la gestante mormotensa, es un incremento de un 7% en TAS y 9% para TAD [110].
El patrón de TA en mujeres con PE o HTA es diferente, pero predecible también. La TAS en la primera mitad del embarazo es ligeramente más elevada en la PE que en las mujeres con HTA gestacional y en la segunda mitad, la elevación también es mayor en las que desarrollan PE que en la HTA gestacional [110]. Las diferencias de TA entre embarazadas normotensa y embarazadas complicadas (PE o HTA gestacional) son detectadas desde el primer trimestre [110] con diferencias significativas en el MESOR circadiano de TAS: 12 mmHg y 7 mmHg en TAD.
Un nuevo concepto, derivado de la MAPA es el Índice Hiperbárico (IHB) [111] (Figura 24) definido como área de exceso de presión arterial por encima del límite superior del intervalo de tolerancia, como veremos, es un concepto clave en la prevención primaria de la PE.
Con estos patrones de TA en la gestante normal, como en la hipertensa o la que desarrolla PE, ya se puede utilizar la MAPA como predictor de PE. En un amplio estudio realizado en 92 mujeres con embarazo no complicado y en 60 embarazadas que desarrollaron HTA o PE, Ayala y cols [110] demostraron que el IHB >12 y antes de la semana 12 de gestación tiene un valor predictivo positivo al 96% en todos los trimestres, y la sensibilidad y especificidad para el diagnóstico precoz de PE es del 99%. En nuestra experiencia [112] y utilizando el IHB como método diagnóstico precoz de riesgo hipertensivo en las gestantes de alto riesgo, la incidencia de PE se redujo un 96%.
Prevención Primaria de la PE
En la PE, como consecuencia del daño isquémico placentario se produce una activación de las plaquetas y del sistema de coagulación que produce un disbalance entre la síntesis de prostaciclinas y la de tromboxano A2. En función de ello, surgieron múltiples estudios sobre la utilidad de los agentes antiagregantes en la prevención primaria de la PE.
El primer agente estudiado fue el Ácido Acetil Salicílico (AAS), pero los resultados iniciales fueron muy contradictorios y no homogéneos, en unos casos, por el uso de dosis bajas y no haber regulado el momento de administración [113] [114]. En otras observaciones, se comparó con otros agentes antiplaquetarios y el riesgo relativo de desarrollar PE fue de 0,90 (IC95% 0,84-0,97; p=0,004), el de presentación de un parto muy precoz (antes de la semana 34) de 0,90 (IC95%: 0,83-0,98; p=0,01) y el de padecer un embarazo con complicaciones graves (incluida muerte fetal o materna) de 0,90 (IC 95%: 0,85-0,96; p=0,001). El AAS no mostró efectos significativos sobre la mortalidad fetal o el nacimiento de niños con bajo peso para su edad gestacional. No existió tampoco, un mayor número de incidentes hemorrágicos en la madre o el feto y no hubo ningún subgrupo de mujeres donde el beneficio fuera más destacado. El problema que se plantea es: ¿Qué dosis? ¿Cuándo empezar? ¿A qué hora?:
1º.- En cuanto a la dosis de AAS, se observó que el efecto preventivo fue mayor a dosis más altas (100 a 150 mg / 24h) en comparación con dosis más bajas (50 a 80 mg / 24 h) [87] [88].
2º.- Se debe comenzar la administración de AAS, antes de la semana 16 [115]. Se justifica porque las mujeres que desarrollan complicaciones hipertensivas del embarazo, se caracterizan por una TA estable hasta la mitad de la gestación y un aumento continuo y lineal de la presión arterial en la segunda mitad del embarazo [116], y las diferencias al final del primer trimestre entre los embarazos normales y las que desarrollan PE, son muy significativas, llegando a 13 mm Hg de diferencia en la PAS.
3º.- El momento de administración de AAS también es relevante. Los resultados de estudios doble ciego, aleatorizados, controlados [117] [118], sobre la influencia de dosis bajas de AAS en la presión arterial en mujeres embarazadas indican un efecto altamente significativo (P < 0,001) en función del momento de administración. No hubo efecto del AAS sobre la presión arterial cuando se administraba al despertar (en comparación con el placebo), pero el descenso de la PA fue estadísticamente significativo cuando se administró el AAS, 8 horas después de despertar y, en mayor medida, cuando se administraba al acostarse. Un clásico estudio [119], ya demostró que la inhibición de la síntesis de Tromboxano A2 por AAS era dosis dependiente y cuando se administrada por la noche .
En conclusión, la prevención se establece además de por la presencia de los factores de riesgo convencionales, por un IHB > 12. La prevención primaria es con AAS a dosis altas entre 100-300 mg, antes de la semana 16, hasta la semana 36 y de administración nocturna.
8.- SÍNDROME DE HELLP
Una variante de la PE es el Síndrome de HELLP (Hemolysis, Elevated Liver Enzimes, Low-Platelet count) aparece en el 0,5 a 0,9% de todos los embarazos y en el 10 a 20% de las PE [120]. El 70% se desarrolla preparto entre las semanas 27 y 37 (un 10% antes de la semana 27 y un 20% después de la 37 semana) y un 30% en el postparto [121].
La mortalidad maternal es del 1 % y la morbilidad incluye: coagulación intravascular diseminada (21%), desprendimiento prematuro de placenta (16%), insuficiencia renal aguda (7,7%), edema pulmonar (6%), hematoma subcapsular del hígado (0,9%), y desprendimiento de retina (0,9%). La abruptio placentae (desprendimiento de la placenta) está fuertemente correlacionado con el desarrollo de la coagulación intravascular diseminada (CID), insuficiencia renal aguda y edema pulmonar. El síndrome de HELLP postparto tiene más alta incidencia de edema pulmonar e insuficiencia renal.
8.1.- Cuadro clínico:
Los síntomas típicos son dolor epigástrico, con nauseas o vómitos, cefalea y en un 20% visión borrosa o síntomas inespecíficos como síndrome viral-like que pueden exacerbarse por la noche y se reducen durante el día.
Los datos bioquímicos cardinales son: anemia hemolítica microangiopática, elevación de enzimas hepáticas y trombocitopenia.
8.2.- Criterios diagnósticos
Existen dos tipos de clasificación del Síndrome de HELLP [120]
Tennessee Classification System
Plaquetas <= 100.109 /L
AST >= 70 IU/L
LDH >= 600 UI/L
Misissipi classification, basada esencialmente en el contaje de plaquetas
Tipo 1: Plaquetas <= 50.109 /L
AST o ALT >= 70 UI/L
LDH >= 600 IU/L
Tipo 2: Plaquetas = 50.10 9 /L
AST o ALT >= 70 UI/L
LDH >= 600 IU/L
Tipo 3: Plaquetas <= 150.10 9 /L
AST o ALT >= 40 UI/L
LDH >= 600 IU/L
Para algunos autores es necesaria la presencia de datos clínicos de PE severa [122] mientras que para otros, puede ser incompleto [123]. El diagnóstico diferencial se muestra en la (Figura 25) [120].
8.3.- Complicaciones del Síndrome de HELLP
El síndrome de HELLP puede presentar severas complicaciones maternas y fetales que se muestran en la (Figura 26) [120].
En el síndrome de Microangiopatía Trombótica (MAT) el cual engloba: AFLP (Acute Fatty Liver Pregnancy), PE, HUS (hemolytic uremic syndrome), Síndrome de HELLP y PTT (Purpura thrombotic thrombocytopenica), APS (antiphospholipidic syndrome) el fracaso renal agudo (FRA) es la complicación más frecuente y su sustrato morfológico más habitual es la necrosis tubular aguda [124]. Habitualmente surge en el seno del resto de las complicaciones severas, y es necesario el tratamiento mediante diálisis [125]. En la (Figura 27) se muestran las características bioquímicas diferenciales de los cinco cuadros clínicos. [126].
8.4.- Mantenimiento de la mujer con síndrome de HELLP
El algoritmo del tratamiento de la mujer son síndrome de Hellp se ilustra en la (Figura 27) [120] [127].
8.4.1.- Preparto
Objetivos del tratamiento
Prevención de las convulsiones
Control de la tensión arterial
Control de los trastornos de la coagulación
Control y reposición de volúmenes
Evaluación del estado materno-fetal
Interrupción de la gestación.
El tratamiento de estas pacientes depende del tiempo de gestación y el estado materno-fetal, por ejemplo:
a) Gestación > de 34 semanas, pero con disfunción multiorgánica, coagulación intravascular diseminada, infarto o hemorragia hepática, fallo renal agudo, hematoma retroplacentario con o sin sufrimiento fetal agudo, se debe interrumpir la gestación inmediatamente.
b) Gestación entre 24 y 34 semanas. Estabilización de la gestante y después de 48 horas reevaluación de la situación y valorar interrumpir la gestación.
c) Gestación < de 34 semanas, pero con un estado clínico favorable y anormalidades humorales iniciales. Se aconseja actitud expectante y completar las 34 semanas, utilizando los tratamientos disponibles, como:
Antihipertensivos
Esteroides
Plasma fresco vs plasmaféresis
Anticonvulsivantes
Antiagregantes plaquetarios
Si empeora la situación materna, está indicada la realización de cesárea.
8.4.2.- Opciones terapéuticas en el Síndrome de HELLP
Las opciones terapéuticas se muestran en el (Figura 28).
a) Esteroides. El uso de esteroides induce maduración pulmonar fetal [128], pero no existe una clara evidencia de beneficio en la mujer con Síndrome de HELLP. Actualmente no existen datos concluyentes que indiquen que el uso de dexametasona (10 mg/iv/12h) se asocie a una mejoría evidente de las alteraciones bioquímicas [129]. Sin embargo, en aquellos casos con severa trombopenia (< 50.000 plaquetas), la dexametasona propició una recuperación más rápida de la misma [130]. Otros autores aconsejan, y sobre todo entre la 24 y 34 semana, la administración de dexametasona (6 mg/iv/12h) y 24 horas más tarde inducir el parto [132].
b) Plasma fresco vs. plasmaféresis. Aunque controvertido, en situación de hemolisis, trombopenia e hipoproteinemia, el uso de plasmaféresis con plasma fresco y albumina, es eficaz [130].
c) Trasplante hepático. Se recurre a esta terapéutica como tratamiento alternativo para aquellos casos con complicaciones graves, como la hemorragia hepática descontrolada, necrosis hepática e insuficiencia hepática severa o ruptura. En La mayoría de los pacientes en los que se ha practicado han presentado una evolución satisfactoria [133]. En el AFLP, la indicación principal es la interrupción del embarazo y de forma excepcional puede ser necesario un trasplante hepático.
En el HUS, las opciones fundamentales son la terapia plasmática (infusión de plasma fresco y plasmaferesis) y el tratamiento específico con Eculizumab, anticuerpo IgG2/4kappa monoclonal humano el cual inhibe la actividad de la proteína C5 del complemento [134] y no esta contraindicado su uso en la paciente gestante [135]. En el APS, se recomienda ver el apartado de Gestación y Enfermedades Sistémicas.
8.5.- Morbilidad y mortalidad maternal y perinatal
La mortalidad maternal es aproximadamente del 1,1% [136]. La mortalidad perinatal oscila entre el 7,4% y el 34%, y aumenta en función del tiempo de gestación: antes de la 34 semana es del 34% y después de la 32 semana, es el 8% [137]; la ruptura hepática eleva la mortalidad perinatal hasta el 80%.
La trombocitopenia aparece entre el 15% y 30% de los casos y es especialmente complicada por la aparición de hemorragia intraventricular [130]. El futuro de los nacidos de madres con Síndrome de HELLP es controvertido, aunque es posible que muchas de la diferencias existentes en los distintos estudios sean más dependientes de los cuidados postparto que derivados del propio síndrome de HELLP, es posible, que los neonatos tengan un futuro normal [120].
9.- EMBARAZO COMO FACTOR DE RIESGO VASCULAR
En una revisión sistemática de Bellamy y cols [138] que incluye 3.488.160 mujeres, de las cuales 198.252 sufrieron PE y 29.495 diferentes eventos cardiovasculares, encuentran que el riesgo relativo para HTA era 3,70 después de 14 años del parto; de cardiopatía isquémica 2,16 a los 11,7 años, de ictus 1,81 a los 7 años; para la mortalidad general el riesgo relativo era de 1,49 a los 14,5 años, y no había mayor riesgo relativo de cáncer.
En otra amplia revisión, Garovic y cols [139] encuentran que las alteraciones hipertensivas del embarazo, juntamente con otras alteraciones como tabaquismo, parto prematuro, bajo peso del feto, o mayor edad en el momento del embarazo afecto, pueden identificar a mujeres con un mayor riesgo futuro de enfermedad cardiovascular.
Todas las hipótesis sobre la fisiopatología de la PE coinciden en que el proceso es consecuencia de un fallo de implantación y de la deficiente remodelación de las arterias espirales uterinas vs decidualización que ocasionan una mala perfusión y, consecuentemente, isquemia placentaria, liberándose desde estas zonas isquémicas hacia la circulación materno-fetal diversos factores que, consecuentemente, provocan daño vascular demostrándose una vez más que el sustrato es la disfunción endotelial vs arterioesclerosis.
La arterioesclerosis y su relación con el embarazo se demuestran en varias observaciones. Recientemente se observó una susceptibilidad incrementada para el desarrollo de arterioesclerosis en arterias de adultos que habían sido expuestas a riesgos maternales en su etapa intrauterina; Valdivia-Silva [140] en 16 gestantes sanas y 24 con PE, encuentran que las tasas elevadas de sVEGF-1/sFlt-1 se correlacionan con la expresión de HIF-2 alfa y CD40L en células endoteliales, estando aumentado el espesor Íntima-Media. En definitiva, las moléculas implicadas en el proceso de arterioesclerosis están aumentadas en la vasculatura periférica con un incremento del espesor de la intima arterial maternal lo que la predispone en un futuro a desarrollar enfermedad arterioesclerótica, y es posible que sea extrapolable al feto.
Matsuyama y cols [141] en 30 pacientes con PE valoraron la relación de los factores inductores de la PE como sEndo, VEGF, PIGF; sFlt1, y su relación con Leptina, adiponectina y resistencia a Insulina. Evidentemente las tasas de sEndo son significativamente más elevadas que en el grupo control (60,9 ±28,8 ng/ml vs 11,2 ± 4 ng/ml) y existe una correlación significativa entre sEndo y factores determinantes de la angiogénesis como así mismo con Leptina, Adiponectina y HOMA.
10.- EMBARAZO Y ENFERMEDAD RENAL CRÓNICA (ERC)
En la actualidad, la mayor prevalencia de ERC, juntamente con el mayor retraso de la maternidad y los avances tecnológicos hacen que cada día sea mayor la posibilidad de gestación en el seno de la ERC, por tanto, es necesario establecer algunas condiciones para el desarrollo y seguimiento del embarazo, como son los cuidados antenatales o la optimización preembarazo.
Los datos bibliográficos son amplios y contradictorios, pero en base al grado de función renal, se puede establecer el riesgo de embarazo y progresión de la disfunción renal [142].
En la gestante, como ya se comentó con anterioridad, no es aconsejable la utilización de formulas de eGFR ya que infraestiman la función renal [10], y es más útil usar la creatinina plasmática (Cre). Una clasificación de la función renal en la gestante, sería: ERC mínima (Cre 2,0 mg/dl). Veamos las circunstancias clínicas de cada estadio:
1º.- ERC E1-2. Se define como Cre 70 ml/min ó E 1-2 e incluye diferentes grados de proteinuria. Sobre las complicaciones del embarazo, los datos son contradictorios. En el estudio italiano [143] de forma significativa se describe mayor tasa de parto prematuro, aunque estos datos no fueron confirmados en el HUNT II [144]. La gestación en estos estadios con moderada insuficiencia renal y TA controlada, tendrá un embarazo normal con muy bajo riesgo de progresión de la ERC [142].
2º.- ERC moderada (E 2-3) y severa (E3-4). Los datos son escasos pero se puede asegurar que solo las mujeres con proteinuria mayor de 1gr/24 h tiene riesgo significativo de progresión de la insuficiencia renal [140] .
Las incidencias durante la gestación en este grupo de pacientes son: mayor tasa de cesárea (70%), parto prematuro (89% antes de la semana 37 y 25% antes de la 34 semana) y mayor riesgo neonatal (70%) [143].
3º ERC E5. En este estadio de ERC, es muy raro un embarazo, aunque en pacientes en hemodiálisis se documentó una frecuencia entre menos del 1% a 7% [145] y en diálisis peritoneal todavía es mas infrecuente. Pero las nuevas técnicas de diálisis han posibilitado una mayor incidencia de gestación. En el Registro Australiano y de Nueva Zelanda de Diálisis y Trasplante (ANZDATA) se registró un aumento de la incidencia que varió de 0 en 1976 a 3,3 /1000 personas/años entre 1996 a 2008 [146], y en el registro canadiense [147] la tasa de embarazo aumentó de 15% a 20% en pacientes en terapia dialítica nocturna, posiblemente por normalización del eje hipotálamo-hipofisario.
La evolución del embarazo es dependiente del esquema dialítico y la supervivencia del feto es < 48% en mujeres con tiempo en hemodiálisis < 20 horas/semana y 75% en aquellas cuyo tiempo en hemodiálisis es entre 21 y 36 horas/semana [147]. La tasa de PE es un 18% y en el 44% de las gestaciones, el feto tiene un peso < 2.500 g y el 6% es menor de 1.500 g [147].
Por tanto, el esquema dialítico más adecuado, seria la hemodiálisis nocturna [141]: 5-7 noches x 7-8 horas/sesión; Qb: 300 a 400 ml/min y Qd: 500 a 750 ml/min.
11.- EMBARAZO Y TRASPLANTE RENAL (TX)
En el postrasplante, el eje hipotálamo-hipofisario se recupera rápidamente. Algunos autores [148] documentan que durante el primer año postrasplante, las complicaciones obstétricas y del injerto son similares a las de las embarazadas con trasplante renal de más larga evolución, por el contario, para otros, el riesgo es mayor [152]. Las complicaciones más frecuentes son:
Perdida fetal 45% [149]
La PE se desarrolla en un tercio de las mujeres con TX renal [150]
Mayor tasa de diabetes gestacional [151] e infecciones del tracto urinario [151]
Las infecciones por Polyomavirus puede ser trasmitido verticalmente [152]
A pesar de todo ello, es aconsejable retrasar el embarazo al menos 1 año desde el Tx y que se cumplan los criterios siguientes : Ningún dato de rechazo en ese año, función renal estable, y mínima proteinuria [153]. El rechazo durante la gestación es raro (< 4,2%) [149].
Los inmunosupresores utilizados y el riesgo fetal se muestran en la (Figura 29) [152]. Durante el TX, los anticonceptivos no están contraindicados, como tampoco la lactancia, pero no están definidos con claridad los niveles de los agentes inmunosupresores en la leche materna [150], y el ganciclovir no se puede utilizar por sus efectos teratógenos [154]. Ante la posibilidad de embarazo en ERC o TX, es conveniente optimizar estrategias para el buen desarrollo. En la (Figura 30) se muestran los cuidados pregestación y en la (Figura 31) los cuidados antenatales de la mujer con ERC [142].
12.- EMBARAZO Y DIABETES MELLITUS
Las mujeres con nefropatía diabética y embarazo tienen un peor curso clínico y los riesgos son [155]:
Parto prematuro: 29-91%
Bajo peso al nacer: 15%
PE: 27-69% y se asocia con los niveles de HbA1c
Deterioro de la función renal
El uso de antihipertensivos es igual que en embarazada no diabética.
13.- EMBARAZO Y ENFERMEDADES SISTEMICAS
La enfermedad autoinmune que mas compromete el embarazo, es el Lupus Eritematoso Sistémico (LES) y uno de los mayores riesgos es la reactivación de la enfermedad.
13.1.- Lupus Eritematoso Sistémico
Es un embarazo de ALTO RIESGO [156] y las siguientes características condicionan alta mortalidad materno-fetal [157]
Hipertensión pulmonar severa (> 50 mmHg)
Enfermedad pulmonar restrictiva
Insuficiencia cardiaca
Enfermedad Renal Crónica (Cre > 2 mg/dl)
Neuropatía Lúpica activa
Historia de PE o Síndrome de HELLP
Accidente vascular cerebral 6 meses antes del embarazo
Tasa elevada de Anticuerpos Antifosfolipídicos (AFL) especialmente Anticardiolipina (aCl) IgG
La reactivación de LED durante el embarazo, parece ligada a un desbalance entre Linfocitos Th1/Th2 [158] y la incidencia oscila entre 13% y 60% de las pacientes si el LES está controlado, pero si el embarazo coincide con un periodo de actividad, los brotes pueden aparecer hasta en el 60% de las gestantes [157]. La mayoría son exacerbaciones leves, solamente un 20 % son graves y usualmente son más frecuentes al final del embarazo y en el puerperio. El diagnóstico diferencial puede plantear alguna duda con la PE, pero la coexistencia de Anti-DNA elevado, hipocomplementemia, sedimento activo y ácido úrico normal, permite diferenciar el cuadro clínico.
La nefropatía lúpica puede empeorar en el 5-10% de las embarazadas con LED controlado antes de la gestación, pero en las que coincide el embarazo con una crisis lúpica, la nefropatía, empeora en el 50-60% de los casos [159] y con mayor probabilidad en las nefropatías tipo III y IV [160].
El tratamiento del LED en la gestante, debe ser el mismo que fuera del embarazo (Figura 32) y una consideración especial, es que al recién nacido de madre tratada con altas dosis de glucocorticoides, se deberá controlar porque puede desarrollar insuficiencia suprarrenal [161].
Las complicaciones fetales más relevantes son: La tasa de aborto espontáneo es del 20% y la prematuridad oscila entre el 20-50% (rotura prematura de membranas, oligohidroamnios, PE, o síndrome de HELLP) y son consecuencia de la enfermedad renal y/o la coexistencia de anticuerpos antifosfolipídicos (AFL). En aquellas embarazadas portadoras de anticuerpos anti-Ro/SSA y anti-La/SSB, la aparición de LES neonatal o bloqueo auriculoventricular es más frecuente [162]. Aunque estas complicaciones fetales son muy infrecuentes (menos del 2%) se recomienda evaluar el ritmo fetal para el diagnóstico precoz del bloqueo AV y si existe, se recomienda el tratamiento con betametasona (atraviesa la barrera placentaria) o implantar un marcapaso fetal si fuera preciso [157] [162].
13.2.-Situaciones especiales en mujeres con criterios de síndrome antifosfolípido (APS)
a) Mujeres con trombosis previas: Mujeres con criterio diagnóstico de APS e historia previa de trombosis arterial o venosa: se aconseja tratamiento con HBPM (heparina de bajo PM) y continuar en postparto.
b) Mujeres con perdida fetal tardía: Mujeres con pérdida fetal después de 10 semanas de gestación, se aconseja la administración conjunta de AAS y HBPM.
c) Mujeres con abortos repetidos (< 10 semanas de gestación). Hay pocos datos en la literatura, pero se sugiere empezar con AAS al inicio del embarazo y una vez confirmado éste, empezar con HBPM [163].
d) Mujeres con PE severa o retraso de crecimiento fetal. Bajas dosis de AAS iniciado de forma precoz y seguir todo el embarazo. Si se detecta fracaso de la terapia con AAS o existe vasculopatía y/o trombosis de la placenta, iniciar tratamiento con HBPM.
e) En mujeres con anticuerpos anticardiolipina o anticoagulante lúpico positivo pero sin APS. El 50% de estas pacientes desarrollan la gestación sin incidencias y sin medicación específica [164].
f) Mujeres sometidas a fertilización in vitro (IVF). Los datos son escasos y controvertidos; no existe una actitud definida y por ahora es una decisión individual del médico, en función de cada paciente.
h) En postparto. Se aconseja el uso de anticoagulación. Aquellas mujeres que en el embarazo ya estaban tratadas con HBPM, deben continuar, reanudando la terapia 12 horas post cesárea ó 6 horas post parto vaginal, y durante 6 semanas. Se debe evitar el uso de anticonceptivos orales por el elevado riesgo de ACVA o IAM [165].
i) Fallo terapéutico. En algunas mujeres fallan los tratamientos descritos y existen datos sobre otras opciones, aunque datos escasos y pueden condicionar mayor morbilidad.
Inmunoglobulina IV: 0,4 gr/Kg/ día durante 5 días, cada mes en el próximo embarazo. Su eficacia no está demostrada.
Plamaféresis: Los datos existentes son derivados de casos aislados, aunque no se describe muerte materna o eventos trombóticos. El feto nació vivo en el 100% de los casos y los efectos adversos documentados fueron: parto prematuro (22%) oligohidramnios y distress fetal (16%), retraso de crecimiento fetal (11%), PE (5%) y trombocitopenia (5%) [166].
Hidroxycloroquina: No hay datos de superioridad frente al no tratamiento.
13.3.- Síndrome de Sjogren.
Existe poca experiencia habida cuenta que es una enfermedad que aparece por encima de los 40 años. Puede haber mayor prevalencia de bajo peso y/o bloqueo cardiaco congénito [167].
13.4.- Esclerosis sistémica.
La incidencia es escasa; se debería desaconsejar el embarazo en pacientes con esclerodermia y afectación pulmonar, cardiaca o renal.
13.5.- Enfermedad de Behcet.
No es una enfermedad infrecuente, pero no tiene repercusión en el embarazo.
13.6.- Vasculitis y Miopatías.
Suelen aparecer en mujeres de más de 40 años por lo que no es frecuente su aparición en el embarazo.
14.- EMBARAZO Y COVID-19
El coronavirus (CoV) es un virus ARN betacoranovirus, de la familia de Coronaviridae que causa desde el resfriado común hasta formas más severas de enfermedad como la Severe Acute Respiratory Syndrome (SRAS) cuya tasa de letalidad es aproximadamente del 10,5% y el Middle East Respiratory Syndrome (MERS) con una letalidad de 34,4%. Hacia finales del año 2019, se identificó una nueva mutación de CoV (etiquetada como SARS-COV-2) en Hubei (China) como causante de una enfermedad respiratoria grave, llamada COVID-19.
La enfermedad tiene esencialmente tres fases. La primera, es la infección temprana (desde el 1 al 8 dias) es un período de incubación con síntomas leves e inespecíficos, es la fase de multiplicación del SARS.Cov-2 y se une a su receptor (ECA2) localizado esencialmente en las células alveolares tipo II y epitelio intestinal. En la segunda fase o inflamatoria (7 a 11 días) se desarrolla una neumonía viral con tos, fiebre e hipoxia y finalmente un pequeño porcentaje de pacientes evolucionan a la fase mas grave de la enfermedad, que se caracteriza por el desarrollo de un síndrome de inflamación sistémica extrapulmonar (SIRS). Son población de alto riesgo, los pacientes con comorbilidad asociada (cardiovascular, inmunodeprimidos) y los mayores de 65 años. La mujer gestante, no es una persona inmunodeprimida en el concepto clásico, pero es bien sabido que las adaptaciones fisiológicas de la madre al embarazo predisponen a las mujeres embarazadas a una mayor susceptibilidad a patógenos intracelulares, especialmente virus, bacterias y parásitos, lo cual se traduce en una mayor morbilidad materna y fetal.
En una reciente revisión sistemática [168] que incluyen a 79 mujeres de las cuales 41 (51,9%) estaban infectadas por COVID- 19, 12 (15,2%) por MERS y 26 (32,9%) por SARS. Los síntomas más comunes fueron fiebre (82,6%), tos (57,1%) y disnea el 27,0%. Las incidencias obstétricas en todas las infecciones por CoV, fueron: aborto espontáneo en el 32,1%, parto prematuro (< 37 semana) el 24,3%, rotura de membranas 20,7%, PE el 16,2%, retraso de crecimiento fetal el 11,7% y el 84% fueron partos por cesárea y la tasa de muerte perinatal fue el 11,1%. En las gestantes afectas de COVID-19, la complicación obstétrica más frecuente fue el parto prematuro (< 37 semanas) en el 41% de los casos y la tasa de muerte perinatal fue el 7%, y en ninguno de los 41 recién nacidos se demostró la transmisión vertical del virus.
El diagnóstico de infección y clasificación clínica sigue las normas generales [169], pero es preciso hacer algunas consideraciones especiales en la mujer embarazada:
1º.- Cada gestante debe ser considerada de alto riesgo por la mayor susceptibilidad debido a una respuesta inmune alterada, especialmente en segundo trimestre. Todas las mujeres embarazadas y para prevenir infecciones, deben tener amplias medidas preventivas como higiene de manos, desinfección de superficies con etanol 60% y adherirse estrictamente a las medidas de distanciamiento social.
2º.- Con la evidencia actual disponible, las mujeres embarazadas parecen tener un curso similar de la enfermedad, a la población general. Sin embargo, brotes anteriores con virus respiratorios similares (SARS, MERS) han demostrado que esta población, era más vulnerable en el segundo y tercer trimestre. Por lo tanto, hasta que se disponga de más datos, las embarazadas con edad gestacional mayor de 24 semanas, deben estar estrictamente protegidas contra la infección.
3º.- El parto prematuro, la rotura prematura de membranas y el sufrimiento fetal intrauterino son las posibles complicaciones de la infección materna por COVID-19, posiblemente causadas por hipoxemia materna. Las tasas de cesáreas son mucho más altas que en la población gestante general, y por causas todavía no conocida.
4º.- El retraso del crecimiento intrauterino podría ser una posible complicación a largo plazo en pacientes que se recuperan de la infección por COVID-19. Por lo tanto, es necesario el seguimiento del crecimiento fetal en pacientes embarazadas infectadas con COVID-19, con evaluaciones periódicas en las semanas 24-28-32-36.
5º.- El momento del parto depende de las condiciones de la gestante, la edad gestacional y las condicciones fetales. La transmisión vertical a través del canal de parto es poco probable, pero los datos son escasos. Por lo tanto, si la condición materna lo permite y se puede garantizar una buena vigilancia fetal, se prefiere el parto vaginal.
6º.- El diagnóstico igual que en la población general, serán los métodos bioquímicos y test serológicos. La tasa de detección positiva aumentó significativamente (98,6%) al combinar el ensayo ELISA IgM con PCR, en comparación con una sola prueba PCR (51,9%).
No existe contraindicación para la realización de estudios radiológicos. La dosis de radiación para el feto en una Rx de torax es 0,0005-0,01 mGy y la de un TAC pulmonar o angiotac es 0,01-0,66 mGy. Los efectos secundarios graves fetales por irradiación, son con dosis > 610 mGy [169].
7º.- Hasta ahora, la transmisión vertical intrauterina no se ha demostrado con COVID-19, al menos cuando la infección ocurre entre las 25 y las 39 semanas de embarazo. Las complicaciones del primer trimestre y los datos sobre teratología aún no están documentados, pero basándose en el supuesto de que las células en la interfaz fetal-materna son menos susceptibles a la infección por COVID-19, se estima que el riesgo de complicaciones en el primer trimestre es bajo, Por lo tanto, se recomienda que a las embarazadas que se les informe sobre los riesgos bajos o inexistentes de infección intrauterina por el virus COVID-19.
8.- La transmisión postnatal de los padres o cuidadores al neonato es posible, por lo tanto, se recomiendan medidas estrictas de higiene, incluidas máscaras, higiene de manos y distanciamiento social (en la medida de lo posible).
9º.- La transmisión vertical a través de la leche materna parece poco probable pero los recién nacidos podrían ser más vulnerables a desarrollar complicaciones (graves) de COVID-19 teniendo en cuenta su sistema inmune inmaduro y se han propuesto dos alternativas:
Las ventajas de la vinculación madre-hijo y la lactancia materna (con medidas preventivas como el uso de una máscara quirúrgica, la higiene de manos y la desinfección de los pezones antes de amamantar) superan el posible riesgo de infección neonatal (con los datos limitados actuales que sugieren un curso de la enfermedad bastante leve en neonatos).
El recién nacido se aísla en una sala de neonatología durante 10-14 días para vigilancia, y permanecer separado de su madre hasta que la enfermedad clínica remita y se levanten las medidas de precaución. Dado que la transmisión a través de la leche materna parece poco probable, se puede extraer leche materna y alimentar con biberón. Es una alternativa basada en las experiencias adquiridas en las epidemias de SARS y MERS.
Dependiendo de la disponibilidad de evidencia adicional, los riesgos y beneficios de ambos enfoques deben ofrecerse y explicarse a los padres para una decisión conjunta.
10º.- Hospitalización: los criterios para la hospitalización de la mujer embarazada se basan en Modified Early Obstetric Warning Score (MEOWS) (Figura 33).
a) No hospitalización: Gestantes con moderada enfermedad y sin comorbilidades (Figura 34) esencialmente con ausencia de disnea y signos vitales estables, puede ser seguida en domicilio y la indicación de ingreso seria través de los criterios MEOWS (Figura 33).
b) Hospitalización en Obstetricia: La indicación seria en gestantes con moderada enfermedad o moderada enfermedad con comorbilidades (Figura 33):
Neumonia aguda adquirida en la comunidad con necesidad de oxigenoterapia.
Desaturacion 21 respiraciones /min o evidencia clara de disnea.
Signos de infección respiratoria con comorbilidades (Figura 33).
c) Hospitalización en UCI: La indicación seria enfermedad severa con FR >3º /min, P02/Fi02 < 300 mmHg o enfermedad critica : shock séptico, refractaria hipoxemia
11º.-Tratamiento: Como todavía no se ha establecido un tratamiento para COVID-19, todos los ensayos farmacológicos deben considerarse experimentales, y esto debe explicarse a los pacientes y a su pareja.
Los corticosteroides solo tienen un lugar en la prevención de la hipoplasia pulmonar neonatal, la enterocolitis necrótica y la hemorragia interventricular debido a la prematuridad.
Los antipalúdicos (hidroxicloroquinina) tiene un perfil de seguridad razonable en el embarazo, pero se deben tomar precauciones generales. Las dosis son:
Cloroquina 600 mg en el momento del diagnóstico y 300 mg/12 h 1º día y seguido de 300mg hasta el día 5, o fosfato de cloroquina 1000 mg al diagnóstico y 500 mg 12 h, el 1º día, seguido de 300 mg dos veces al día hasta el día 5.
Hydroxychloroquine 400 mg en el momento del diagnóstico, y 400 mg c/12 h el 1º día y seguido de 200 mg cada/12 h hasta el día 5.
Los posibles efectos adversos de los antipalúdicos son la prologanción del QT o la aparición de cataratas. La interacción con otras drogas se puede ver en la siguiente URL: http://www.covid19-druginteractions.org [170].
Los antirretrovirales no tienen indicación terapeútica en el embarazo a menos que no existan otras opciones de tratamiento para la vida materna. La dosis de lopinavir/ritonavir 400/100 mg (200/50 mg) /12 h durante 14 dias). Darunavir/ritonavir debe evaluarse caso por caso, y el uso de darunavir/cobicistat porque existen pruebas de que el embarazo podría reducir las acciones farmacológicas del darunavir activo.
En la Guía ISIDOG [167] aporta una amplia documentación sobre la organización, cuidados y medicación que se puede utilizar en el parto de la gestante con COVID-19.