Manejo de los trastornos hipertensivos del embarazo
ÍNDICE
Introducción
Medida de la Presión Arterial (PA) en consulta:
Medidas de PA ambulatoria (AMPA y MAPA):
Conceptos, definiciones y criterios diagnósticos
Cribado y seguimiento de riesgo
Medidas Preventivas:
Aplicables a todas las gestantes
Aplicables a Gestantes con alto riesgo de Preeclampsia (PE)
Manejo para el control de la PA
Objetivos terapéuticos
Fármacos de uso en Trastornos Hipertensivos del Embarazo (THE)
Manejo específico del síndrome de HELLP
Cuando finalizar la gestación
Control postparto y alta
Cuidados de la PA y el Riesgo Cardiovascular (RCV) al finalizar la gestación
Introducción
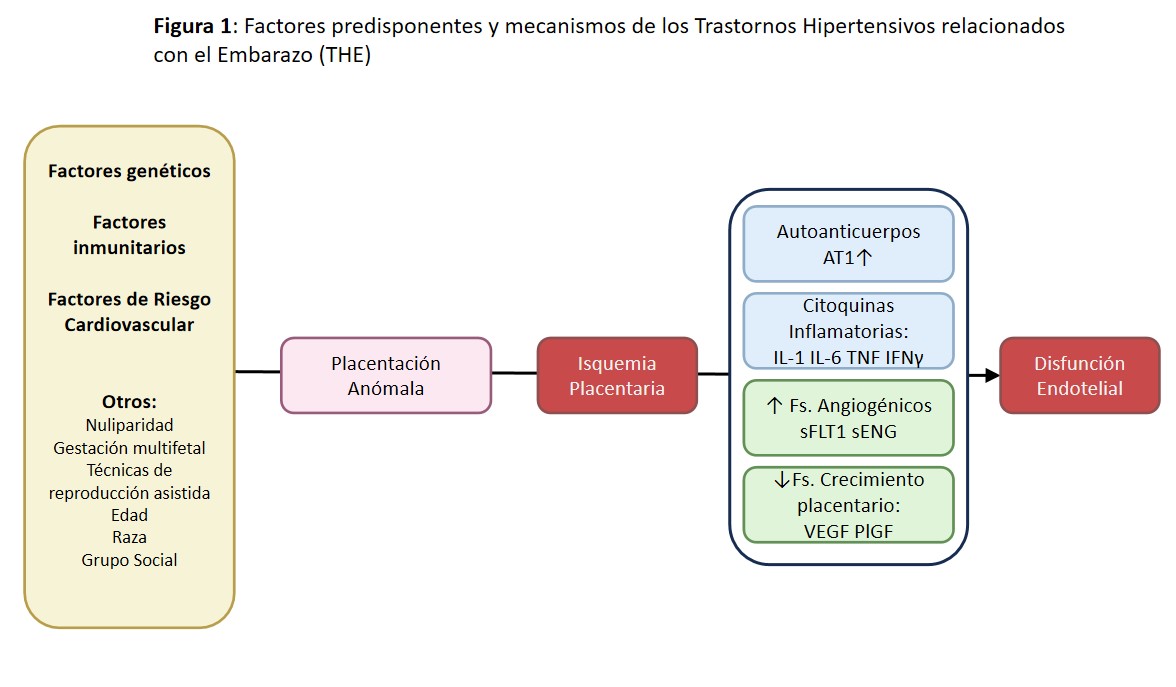
En una gestación fisiológica, en la placenta, se liberan una serie de vasodilatadores endoteliales (óxido nítrico, estradiol…) que conducen a una disminución de las resistencias vasculares periféricas, taquicardia y disminución de la PA El resultado final es un aumento del volumen sanguíneo y del gasto cardíaco x 1,5, cuyo objetivo final es el aumento del aporte sanguíneo útero-placentario. Este mayor aporte se puede ver comprometido, dando lugar a isquemia, por una disfunción vascular uterina basal y/o por una placentación anómala del sincitiotrofoblasto. Secundario a la isquemia, se produce un fallo en la regulación y liberación de mediadores angiogénicos (sFLT1, sENG, PlGF, VEGF…) así como liberación de mediadores inflamatorios (AT1-AA, IL-6…). Este proceso desencadena una situación de inflamación y daño endotelial en la madre gestante que puede dar lugar a una disminución del crecimiento fetal intrauterino. El aumento de la PA es el marcador orgánico más precoz y relevante de esta inflamación endotelial. Por ello, este aumento de PA es clave en la clasificación, diagnóstico, tratamiento y monitorización de todos los trastornos hipertensivos del embarazo (THE); incluyendo: Preeclampsia (PE), Eclampsia, Hipertensión Crónica (HTAc), Hipertensión Gestacional (HTG) y Síndrome de HELLP (sHELLP: acrónimo derivado del inglés: H de hemólisis, EL de elevación de enzimas hepáticas, y LP de trombopenia). Los THE pueden aparecer hasta en un 15% de las mujeres gestantes y son la causa más frecuente de morbimortalidad materno-fetal, siendo responsables de hasta el 7% de la mortalidad relacionada con la gestación [1] [2] [3] (Figura 1).
En este capítulo, exploraremos de manera práctica el manejo de los THE. Para una comprensión más detallada de su fisiopatología, de la fisiología renal sistémica y placentaria durante la gestación y de sus implicaciones en enfermedades renales, autoinmunes y cardiovasculares se recomienda consultar el tema "Embarazo y riñón" en NAD. (https://www.nefrologiaaldia.org/es-articulo-embarazo-rinon-586)
Medida de la PA en consulta
Debemos aprovechar en lo posible todos los contactos de las gestantes con el sistema de salud para medir la PA (Matrona, Obstetricia, Atención Primaria, Nefrología…)
La medición debe llevarse a cabo mediante una técnica estandarizada, utilizando un dispositivo automático validado específicamente para embarazadas [4], ya que no todos los dispositivos disponibles en la práctica diaria cumplen con esta validación. Es importante tenerlo en cuenta especialmente ante diagnósticos de naturaleza incierta.
El procedimiento siempre debe incluir [5]
- Periodo de reposo (aunque sea corto, 2-4 min)
- Posición sentada, con la espalda recta y sin cruzar las piernas ni hablar.
- Realizar 2 o más medidas separadas al menos 30 segundos, tomar la media de las 2 últimas o la última.
- Evitar factores estresantes como la vejiga llena, cafeína, tabaco… en el momento de la medida y en los 30-60 minutos previos.
- Emplear un manguito adecuado a la medida del brazo.
- El brazo debe estar en reposo a la altura del corazón.
Medidas de PA ambulatoria (AMPA y MAPA):
La AMPA (automedida de la PA ambulatoria) supera la medición en consulta para la prevención de mortalidad y enfermedad cardiovascular en población general con HTA [6]. En el ámbito de los THE, la AMPA ha mostrado beneficios en comparación con la medición en consulta en términos de necesidad de inducción al parto, el peso al nacer y la tasa de reingresos postparto [7]. Sin embargo, fue equiparable a la medición en consulta en el control de cifras de PA en THE, en la precocidad para el diagnóstico de THE en gestantes con alto riesgo de PE [8] [9]. En la práctica clínica, la AMPA es útil para descartar la presencia de HTA reactiva, para reducir el número de visitas hospitalarias y para el ajuste de dosis de tratamiento antihipertensivo [10].
Por otra parte, la MAPA (monitorización ambulatoria de la PA con dispositivos automáticos) ha demostrado una gran utilidad en el ámbito de los THE. Permite, al igual que la AMPA, descartar la HTA reactiva y beneficiosamente en comparación con la AMPA permite descartar hipertensión enmascarada o un mal control enmascarado de la PA. Esto tiene especial importancia en pacientes THE, ya que hasta el 60% tienen un patrón circadiano con ausencia de descenso nocturno [11]. Este patrón se ha asociado, así como otros parámetros que aporta la MAPA (presión de pulso, la carga hipertensiva, el incremento matutino o la variabilidad) con una mayor morbimortalidad materno-infantil [4] [6].
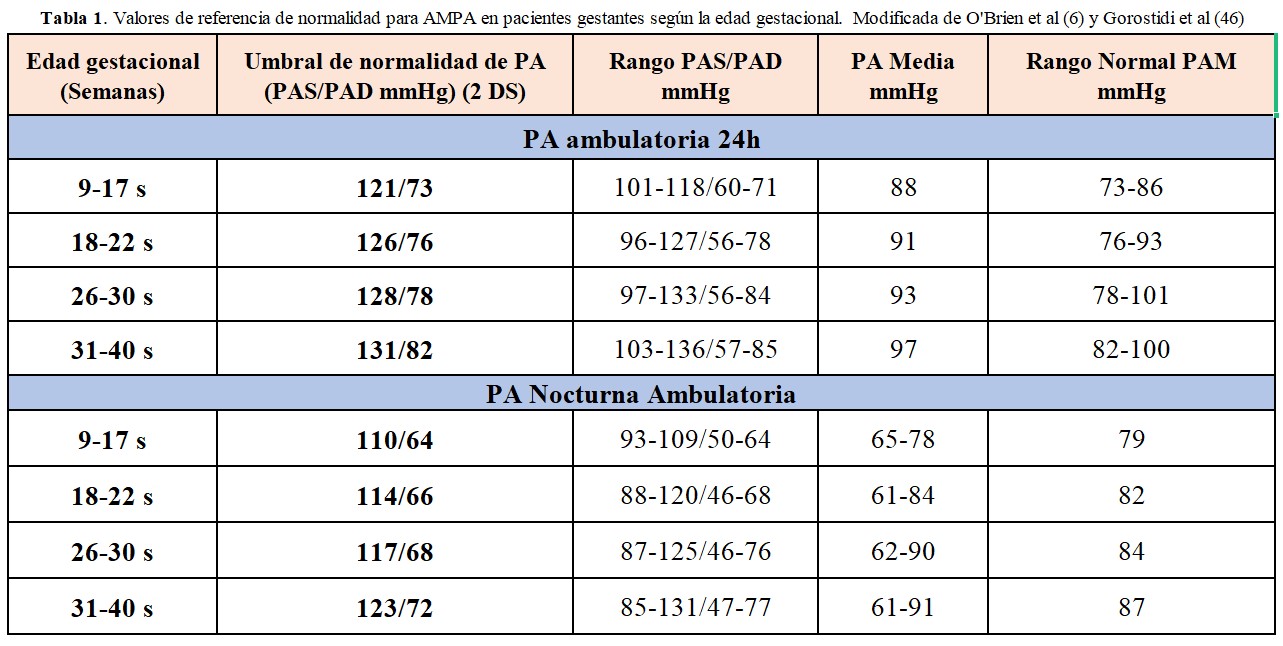
Durante la gestación, la PA tiende a ser más baja de manera fisiológica, especialmente en los dos primeros trimestres, y los rangos normales de medidas ambulatorias son distintos (Tabla 1). Sin embargo, aunque se debe tener en cuenta al confirmar o descartar una hipertensión reactiva, actualmente no se sugiere reducir los umbrales para diagnosticar THE en comparación con la medición en consulta [3] [4].
AMPA:
Recomendaremos la automedida de la PA en domicilio en:
• Pacientes con screening positivo de alto riesgo de PE.
• Pacientes con diagnóstico de THE
• Pacientes con sospecha de hipertensión reactiva (siempre que esté disponible convendría realizar también una MAPA de 24h, al menos una vez, para tener un perfil de la PA nocturna)
Recomendaciones AMPA para pacientes
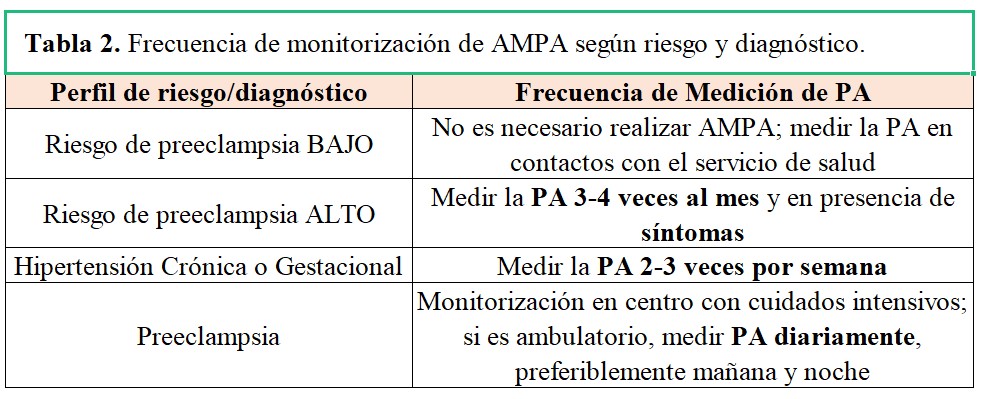
La frecuencia de AMPA según la edad gestacional, el riesgo y el diagnóstico queda resumido en la (Tabla 2)
• Gestantes con screening de riesgo de PE BAJO: No precisan realizar AMPA, recordar aprovechar los contactos con el sistema de salud para medir la PA
• Gestantes con screening de riesgo de PE ALTO: Medir la PA 3-4 veces al mes y siempre que exista clínica compatible con aumento de la PA (cefalea, náuseas, mareo…)
• Gestantes con Hipertensión Crónica o Gestacional: Medir la PA 2-3 veces por semana
• Gestantes con PE: como norma general deben estar monitorizadas en un centro con disponibilidad de cuidados intensivos materno-infantiles, si una evolución favorable permite un seguimiento ambulatorio: medir la PA todos los días, preferiblemente mañana y noche
Cómo medir la PA en domicilio:
Medir siempre la PA sentada con al menos 5 minutos de reposo. Colocar el brazo a la altura del corazón y no cruzar las piernas. Hacer siempre 2 o más tomas con 2-3 min de separación. Tomar en cuenta la última medida o la medida de las dos últimas.
Qué hacer según las cifras de PA domicilio:
Debemos tener en cuenta que, por lo general, las gestantes serán mujeres entre los 20-49 años con un perfil elevado de empoderamiento en el autocuidado. En la (Tabla 3) se ilustran una serie de recomendaciones para gestantes en función de las cifras de PA que encuentren en el AMPA.
MAPA:
Emplearemos un dispositivo de MAPA de 24h en:
- Gestantes con sospecha de hipertensión reactiva, para confirmar el diagnóstico de THE.
- Pacientes con diagnóstico de THE establecido para:
- Determinar el perfil circadiano y otros parámetros que aporta la MAPA como la presión de pulso, la carga hipertensiva, la variabilidad…
- Ajuste de tratamiento farmacológico, cronoterapia
Conceptos, definiciones y criterios diagnósticos:
En la toma de decisiones para el manejo de los THE serán clave las definiciones y los criterios diagnósticos, nos van a permitir tener claro el punto de partida, la gravedad y la urgencia en el abordaje de la situación materna y fetal. Debemos tener claros dos aspectos fundamentales:
- La edad gestacional: si es mayor o menor de la semana 20. Como punto de corte para definir el trastorno como gestacional.
- ¿Existe daño orgánico? La presencia de daño orgánico obligará a una mayor rapidez en la aplicación de medidas terapéuticas, a llevar a cabo una monitorización materno-fetal más estrecha y tendrá una implicación importante en la decisión de finalizar la gestación.
Hipertensión Reactiva o de “Bata Blanca”
Elevación de la PA en consulta que se normaliza tras un periodo de reposo de al menos 10 minutos (hasta 4 horas de reposo se consideraría reactiva al evento, como la consulta médica) y no se confirma al tomar una medida ambulatoria de la PA (AMPA o MAPA)
Se ha de tener siempre en consideración el riesgo que implica un fallo en el diagnóstico (falso negativo) en este caso, por ello en gestantes con alto riesgo de PE, o a partir de las 28 semanas de gestación, se ha de ser muy estricto con el diagnóstico de HTA reactiva.
Hipertensión Crónica o “pregestacional” (HTAc)
Aumento de la PA ≥ 140/90 mmHg de PA Sistólica (PAS) y/o PA Diastólica (PAD) respectivamente, que ya está presente antes de la gestación o que se diagnostica antes de la semana 20.
Hipertensión Enmascarada
HTA según criterios de medida ambulatoria de la PA (AMPA o MAPA), con PA en consulta normal.
Hipertensión Gestacional (HTG)
HTA diagnosticada a partir de la semana 20 de gestación, en ausencia de proteinuria u otro dato de daño orgánico.
Preeclampsia
Elevación de PA que cumple criterios de HTAc/HTG acompañada de “daño orgánico”, definidos en la (Tabla 4) como Criterios de Daño Orgánico en los THE:
a) Proteinuria: En muchos casos constituye el dato más precoz de daño, pero no siempre, y por ello desde hace unos años ya no es condición indispensable para el diagnóstico de PE [3] [10] [12] [13]. Tiene una clasificación específica, debido a que el daño no se debe estrictamente a una lesión endotelial, sino que en este caso, la disregulación angiogénica (↓VEGF) da lugar a una afectación primaria de la estructura del podocito, produciendo aumento de la permeabilidad de la barrera de filtración glomerular, borramiento de los procesos podocitarios y pérdida de podocitos al espacio urinario [14] [15]. La magnitud de la proteinuria no debe correlacionarse como marcador de gravedad en los THE [3].
b) Daño orgánico Materno: Aunque para algunos autores serían los marcadores de “PE grave” las recomendaciones más recientes abogan por NO clasificar la PE en “grave” y “no grave”, en función del tipo de daño orgánico.
El objetivo es evitar la falsa sensación de “levedad” de una PE exclusivamente proteinúrica, debido al potencial de rápida progresión en cualquiera de sus estadios evolutivos [3] [10]. Sí se recomienda emplear los criterios de gravedad de PE para facilitar fines de investigación y análisis posterior.
c) Disfunción uteroplacentaria: Datos objetivables de lesión vascular-parenquimatosa placentaria son criterios diagnósticos de PE. Desde hace unos años disponemos de determinaciones analíticas que determinan el grado de disbalance angiogénico (sFLT1 y PlGF). Su empleo está sujeto a controversia, y de momento NO están consolidados como criterio diagnóstico de PE, aunque son de gran utilidad en la monitorización y evaluación del riesgo de desarrollo de complicaciones [2] [3].
Acepciones añadidas al diagnóstico de PE:
- “Superimpuesta/Injertada” vs “de novo”: según existiera diagnóstico HTA pregestacional/crónica previa al diagnóstico de PE.
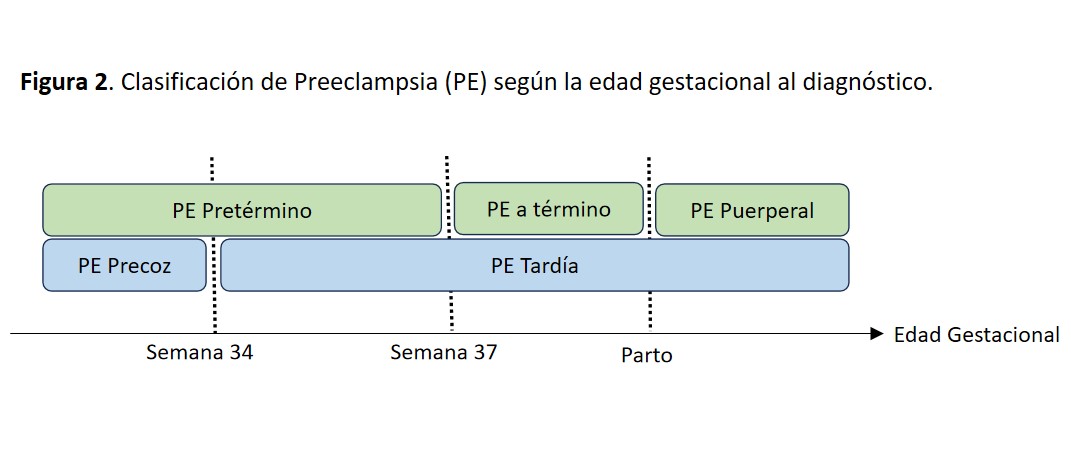
- Clasificación de PE según edad gestacional al diagnóstico: Preeclampsia Precoz (<34 semanas) Preeclampsia Tardía (>34 semanas). Preeclampsia Pretérmino (< 37 semanas) Preeclampsia a Término (> 37 semanas) Preeclampsia Puerperal (Postparto). Representado gráficamente en la (Figura 2)
- PE “Grave”: Uso para fin exclusivo de investigación y análisis posterior [3] [16]. PE con cifras de PA >160/110 mmHg y/o datos de daño orgánico, a excepción de proteinuria.
Eclampsia
PE con asociación de daño neurológico grave: crisis convulsivas o coma no atribuibles a otra etiología. El síndrome de encefalopatía posterior reversible (PRES) se puede considerar un equivalente eclámptico para muchos autores [16] [17].
Síndrome de HELLP
Asociación de PE con hemólisis, elevación de enzimas hepáticas y consumo de plaquetas. Según autores se puede considerar una forma específica de manifestación grave de PE o un síndrome microangiopático independiente. Siempre obliga a establecer un diagnóstico diferencial con otros procesos microangiopáticos.
Cribado y seguimiento de riesgo
Determinar qué gestantes se encuentran en riesgo de desarrollar un THE es clave por dos motivos fundamentales:
1. Aplicar cuanto antes las medidas preventivas convenientes que reduzcan el riesgo de complicaciones.
2. Llevar a cabo una monitorización más estrecha para la detección precoz de:
- Sufrimiento Fetal: mediante seguimiento cardiotocográfico y ecográfico
- Daño Orgánico Materno: mediante marcadores analíticos
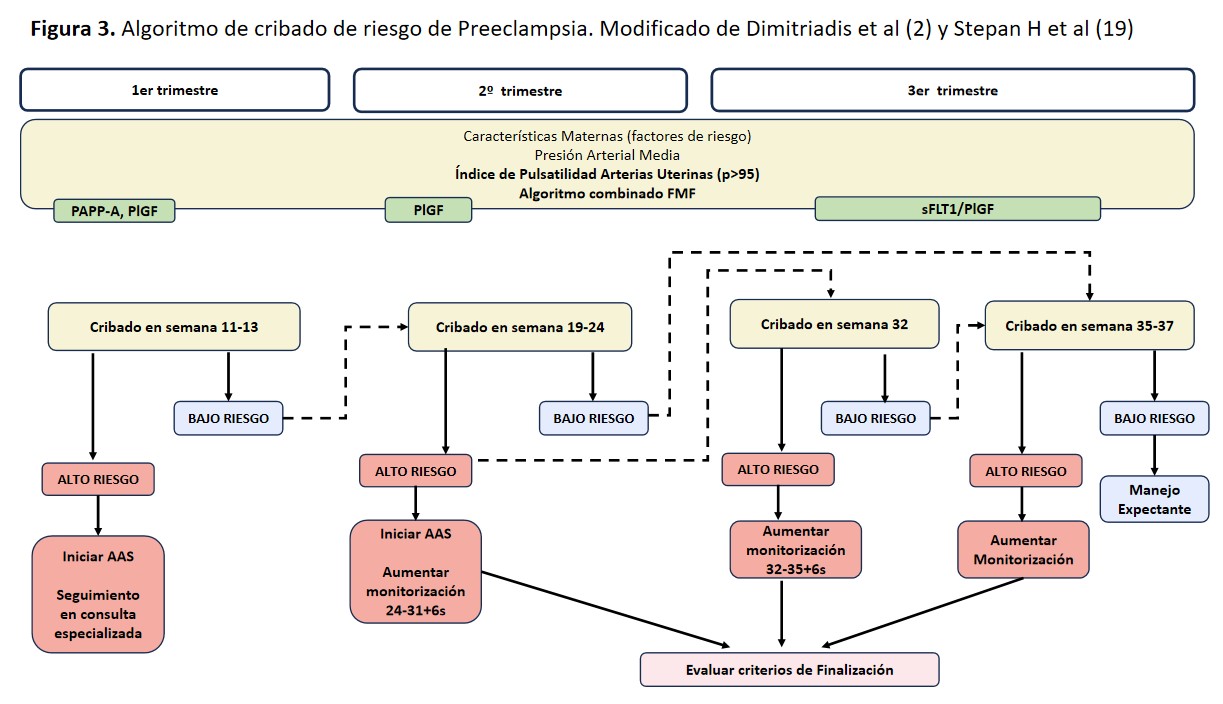
Los momentos esenciales en la aplicación de métodos de screening son los 3 trimestres de la gestación. En cada trimestre, el método de screening, el objetivo y las medidas de actuación serán diferentes [3] [18] [19].
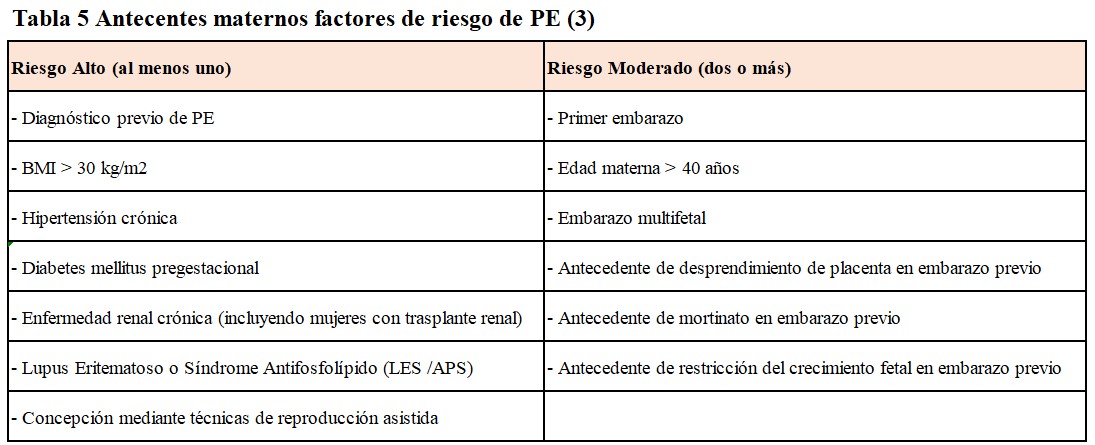
Cribado Primer Trimestre (11–13 semana): Siempre que sea posible debe estar basado en modelos de riesgo multivariante (que incluya PA, índice de pulsatilidad de arterias uterinas y marcadores angiogénicos). En situaciones donde no haya disponibilidad de métodos multivariantes, se debe realizar el screening con variables clínicas (Tabla 5) [3].
Cribado Segundo Trimestre (19-24 semana): Se sugiere repetir el cribado en el segundo trimestre para gestantes con bajo riesgo en el primer trimestre. Preferiblemente, se deben utilizar métodos multivariantes. En su ausencia, calcular el índice de pulsatilidad de las arterias uterinas es de gran utilidad, considerando un percentil superior al 95 como alto riesgo. Se recomienda evaluar este índice en todas las gestantes, integrado en un modelo de riesgo multivariante o de forma independiente [18].
Cribado Tercer Trimestre (32/35-37 semana): En el tercer trimestre, de nuevo se recomienda realizar cribado mediante un modelo multivariante de riesgo y/o si está disponible mediante el cociente de marcadores angiogénicos (PlGF/sFLT1):
- En pacientes de bajo riesgo en trimestres previos se recomienda realizar el cribado en la semana 35-37.
- En pacientes de alto riesgo en trimestres previos se recomienda realizar cribado la semana 32 y si es positivo aumentar la frecuencia de control ecográfico hasta la semana 36.
Son de especial utilidad los algoritmos multivariantes disponibles online desarrollados por la Fetal Medicine Foundation (FMF) disponibles en:
https://fetalmedicine.org/research/assess/preeclampsia/first-trimester.
https://fetalmedicine.org/research/assess/preeclampsia/second-trimester
https://fetalmedicine.org/research/assess/preeclampsia/third-trimester
Por consiguiente, una vez identificadas las gestantes con alto riesgo de desarrollar preeclampsia, resulta crucial implementar las medidas preventivas adecuadas y llevar a cabo la monitorización correspondiente. En la (Figura 3) se presenta un esquema que ilustra los momentos óptimos para realizar el cribado y el seguimiento según los resultados obtenidos.
Medidas Preventivas
Aplicables a todas las gestantes:
Aporte de Calcio en la dieta: Recomendada, sobre todo en pacientes con una ingesta de calcio basal inadecuadamente baja [3] [12] [13] [20]
Dosis: conseguir una ingesta de al menos 500-1500 mg al día de calcio (no superar 3000 mg)
Iniciar durante el primer trimestre o preconcepcional.
Programas de ejercicio físico controlado
Salvo que exista contraindicación por alguna causa específica, se recomienda hacer ejercicio físico durante la gestación.
Se recomiendan 140 min de ejercicio de intensidad moderada a la semana (“poder hablar pero no cantar”) y siempre que sea posible promover programas de ejercicio físico controlado por personal específicamente formado (fisioterapeutas, matronas…) [13] [21] [22].
No se recomienda hacer ejercicio físico en pacientes con diagnóstico de PE [3].
Aplicable a Gestantes con alto riesgo de PE:
Ácido acetil salicílico (AAS): Indicada en todas las pacientes con screening de riesgo de PE elevado [3] [23]. Hasta la fecha, es la única intervención farmacológica preventiva que ha demostrado una disminución en la incidencia de THE en pacientes de riesgo [23].
Dosis 100-150 mg cada 24h.
Iniciar el tratamiento entre la semana 12 y 16.
En caso de que la paciente se encuentre por encima de las 16 semanas, se debe iniciar igualmente, como mínimo hasta la semana 28 [24].
Suspender en la semana 36
Manejo para el control de la PA
Objetivos terapéuticos
Se recomienda iniciar tratamiento antihipertensivo en todos los THE, preferiblemente en monoterapia y se conseja no alcanzar las dosis máximas de esta primera línea sin haber iniciado previamente otro tratamiento de un grupo farmacológico diferente. Los objetivos de control de la PA deben ser los mismos, y se insta a iniciar el tratamiento antihipertensivo, independientemente del tipo de THE, con el propósito de prevenir la aparición de daño orgánico y evitar la progresión a formas más graves [3] [13] [25] [26] [27].
El conocimiento de las implicaciones cardiovasculares a largo plazo de una elevación significativa de la PA en la población general, junto con la creciente evidencia que sugiere la ausencia de un mayor riesgo para el feto al establecer objetivos de PA similares a las de la población general han llevado a que la mayoría de los grupos de expertos adopten una postura menos laxa en relación con los objetivos de control de la PA durante la gestación [24] [24] [2] [4] [28] [29].
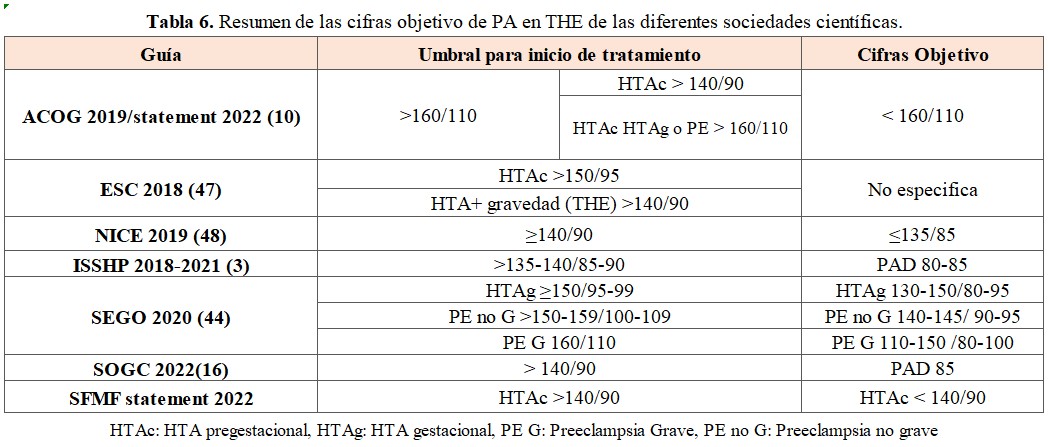
La laxitud en los objetivos previamente establecidos, aún respaldada por algunos grupos de expertos que abogan por iniciar el tratamiento solo cuando la PA supera los 160/110 mmHg, tenía como determinante principal el riesgo de sufrimiento fetal [10]. En esta postura, se aconseja no iniciar tratamiento hasta que la PA alcance estos niveles; sin embargo, cuando la PA es tan elevada, la recomendación es iniciar tratamiento urgente endovenoso debido al riesgo de complicaciones graves. En la (Tabla 6) se especifican los objetivos de PA y los umbrales para el inicio de tratamiento de diferentes grupos de expertos internacionales.
Desde un punto de vista fisiológico, el objetivo final de todas las modificaciones vasculares placentarias que resultan de la interacción maternofetal (reducción de la resistencia vascular de los vasos arteriales uterinos) es asegurar un flujo sanguíneo constante de la madre hacia el feto [30]. La continuidad del flujo sanguíneo depende en gran medida del flujo durante la diástole, por ello es crucial considerar la presión arterial diastólica (PAD) al establecer objetivos terapéuticos, con un umbral razonablemente aceptado de PAD > 80 mmHg [3]. Esto, junto con una monitorización adecuada del flujo vascular mediante el doppler de arterias uterinas, permitiría garantizar la perfusión fetal en gestantes con THE.
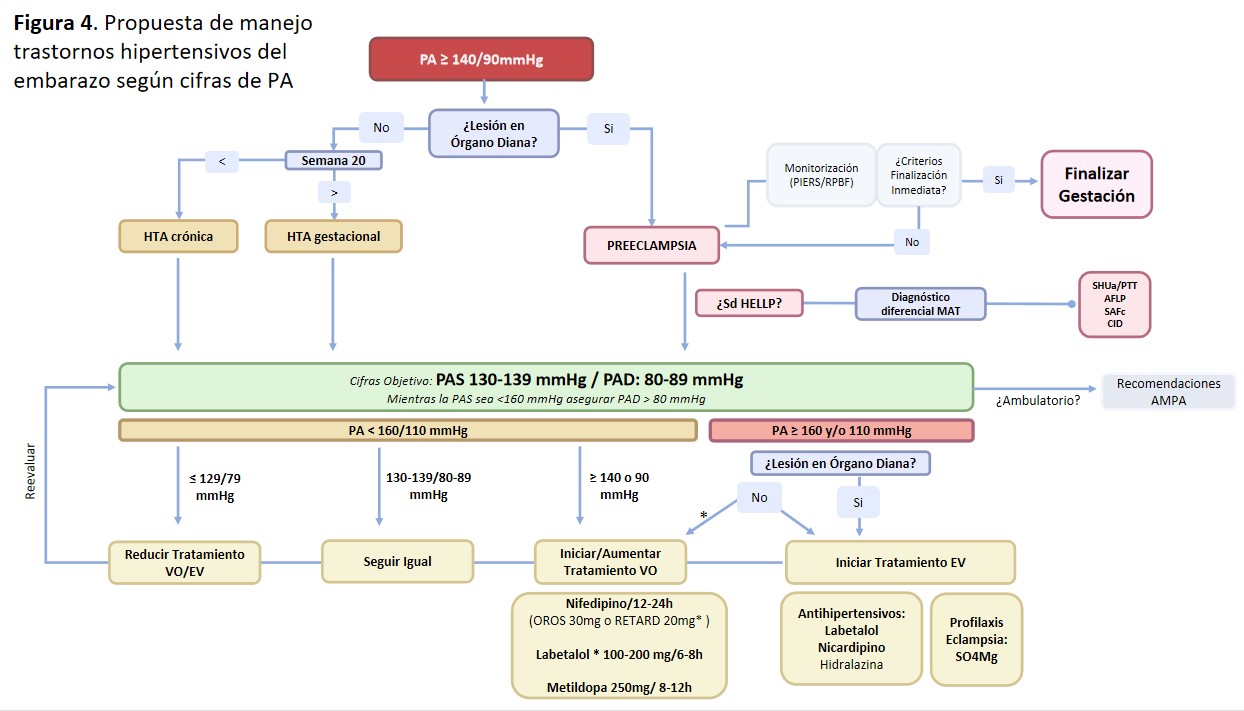
Premura en el manejo
La prontitud en la bajada de la PA depende la presencia de cifras de hipertensión grave (> 160 y/o 110 mmHg) o de daño orgánico (a excepción proteinuria aislada).
a) En ausencia de ambos debemos llevar a cifras objetivo (130-139/80-89 mmHg) en 24-48h empleando fármacos de administración oral.
b) Si existe HTA grave, el control de la PA debe ser urgente: < 160/110 mmHg en menos de 180 min y 130-139/80-89 mmHg en 12-24h
- En ausencia de daño orgánico: podemos emplear medicación endovenosa o vía oral (siempre que empleemos fármacos de acción rápida por esta vía oral como Labetalol o Nifedipino de liberación inmediata o RETARD (No emplear la formulación OROS) [31].
- En presencia de daño orgánico: Requiere vigilancia intensiva y preferiblemente emplear medicación endovenosa, así como el inicio de tratamiento preventivo de Eclampsia con sulfato de magnesio (SO4Mg) endovenoso (también debemos iniciar tratamiento con SO4Mg en caso de síntomas neurológicos, cefalea, escotomas…)
La propuesta de manejo de los THE según las cifras de PA se ilustra en la (Figura 4).
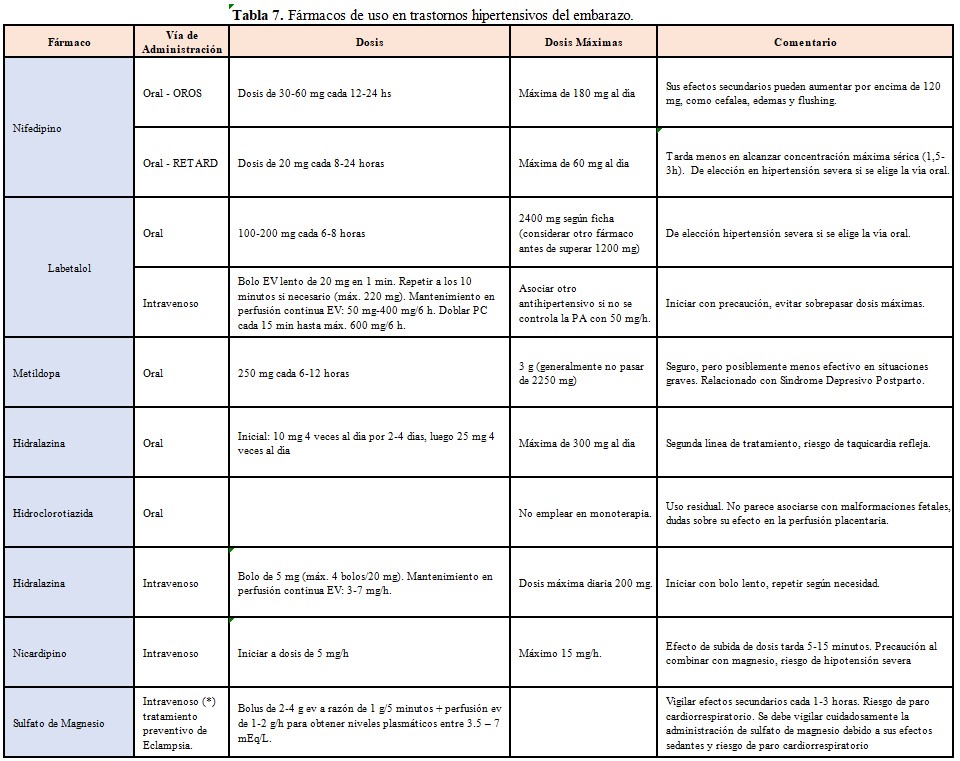
En la (Tabla 7) se describen los fármacos de uso en los THE.
Manejo específico del síndrome de HELLP
El sHELLP constituye una manifestación microangiopática intrínseca a la gestación, desencadenada por daño agudo en el endotelio debido a una disfunción uteroplacentaria. Se puede considerar una forma específica de manifestación grave de PE o un síndrome microangiopático independiente de los THE. Hasta un 15 al 20% de las pacientes con sHELLP no presentan hipertensión previa o proteinuria. La presentación clínica más común incluye dolor abdominal y aumento de sensibilidad en áreas como el epigastrio, cuadrante superior derecho o debajo del esternón. La mayoría de los casos se diagnostican entre las semanas 28 y 36, pero los síntomas pueden presentarse hasta siete días después del parto. Por lo general, los síntomas aparecen de manera rápida y progresiva, lo que subraya la importancia de un diagnóstico precoz, especialmente para detectar la presencia de hemólisis [32].
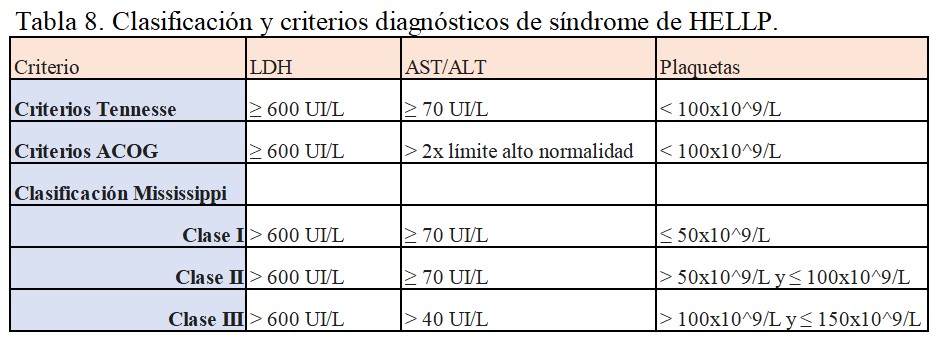
Existen varias clasificaciones y criterios diagnósticos, las más empleadas están detallados en la (Tabla 8). Todas ellas se basan en la presencia de los siguientes criterios para establecer un diagnóstico:
a) Hemólisis, definida por al menos dos de los siguientes datos:
- Frotis periférico con esquistocitos y células de rebabas.
- Bilirrubina Indirecta sérica ≥1,2 mg/dL
- Consumo de Haptoglobinas séricas
- LDH ≥ 2 veces el nivel superior de lo normal o > 600 UI/L
- Anemia grave, no relacionada con la pérdida de sangre.
b) Enzimas hepáticas elevadas: AST o ALT ≥ 2 veces el nivel superior de lo normal o una concentración > 70 UI/L
c) Consumo de Plaquetas: <100.000 células/microL. En la clasificación de Tennesse se establecen tres niveles de gravedad según el recuento de plaquetas.
El tratamiento definitivo del sHELLP, al igual que cualquier forma de PE grave, es finalizar la gestación. El tratamiento de soporte en unidades de monitorización intensiva también es fundamental. El uso de corticoides se ha relacionado con un aumento de la cifra de plaquetas y otras mejoras en valores analíticos en sHELLP, pero NO se recomienda el uso de corticoides para acelerar la resolución del cuadro, ya que no han demostrado un beneficio claro [3]. Si se recomienda para maduración fetal. En pacientes con ausencia de mejoría clínica tras finalizar la gestación y hasta que se esclarezca la causa del cuadro microangiopático, algunos grupos abogan por el tratamiento con plasmaféresis [33].
Diagnóstico Diferencial del sHELLP con otras Microangiopatías Trombóticas
Tras una confirmación diagnóstica de sHELLP debemos plantearnos si el cuadro se debe a una manifestación microangiopática secundaria a la disregulación angiogénica por isquemia placentaria o si de otra manera la disfunción endotelial de un THE actúa como desencadenante de otra forma de MAT [34]. En la (Tabla 9) se resumen las entidades clínicas que debemos incluir en el diagnóstico diferencial del sHELLP con otras MAT (SHUa, PTT, AFLP, SAFc), así como un resumen de su aproximación terapéutica. Se puede encontrar una mayor profundidad en el diagnóstico diferencial de las MAT fuera de la gestación y manejo específico en el capítulo de NAD “Síndrome Hemolítico Urémico” (https://www.nefrologiaaldia.org/es-articulo-sindrome-hemolitico-uremico-628)
Por otra parte, cabe mencionar que una de las formas de afectación microangiopática multiorgánica más grave es la Coagulación Intravascular Diseminada (CID). La CID se produce como consecuencia de una incapacidad para frenar una cascada trombótica microvascular, lo que conduce a un consumo de factores de coagulación que supera el ritmo de producción hepática, ya sea por daño microvascular de gran entidad o insuficiencia hepática coyuntural. Esto da lugar, paradójicamente, a una diátesis hemorrágica debido al consumo de factores coagulantes, plaquetas y liberación de productos de degradación de fibrina [35].
En su forma aguda, la CID tiene un alto potencial de gravedad y puede conducir a un fallo multiorgánico, con una elevada mortalidad. En el contexto de la gestación patológica, los eventos que pueden conducir a una CID incluyen, por orden de frecuencia: desprendimiento de placenta, hemorragia posparto, trastornos hipertensivos del embarazo, hígado graso agudo del embarazo, embolia de líquido amniótico y sepsis relacionada con el embarazo [36]. Aunque inicialmente las manifestaciones de la CID pueden ser prácticamente indistinguibles de una MAT grave (incluso puede ser una complicación de esta), debemos sospecharla ante la presencia de las siguientes alteraciones [35]:
• Prolongación del tiempo de tromboplastina parcial activada (TTPa), el tiempo de protrombina (TP) y el tiempo de trombina (TT).
• Hipofibrinogenemia.
• Dímero D muy elevado (precaución, ya que los valores normales de dímero D en la gestación son más elevados)
Cuando finalizar la Gestación
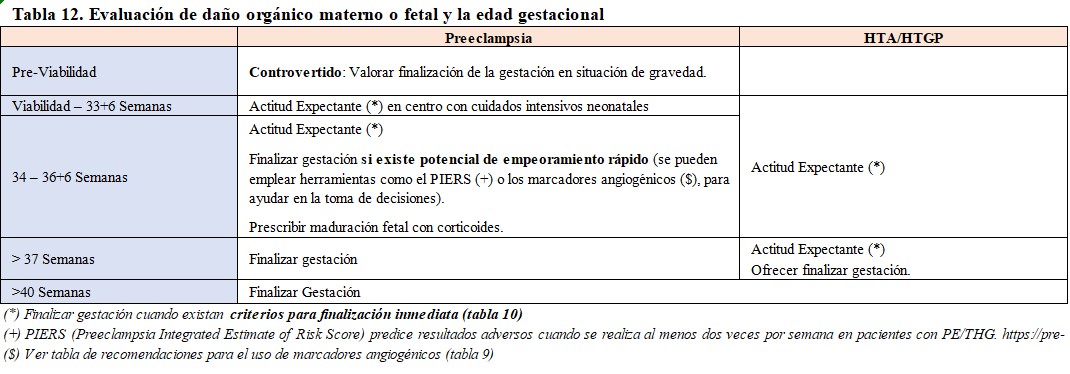
El tratamiento definitivo de todos los THE es el final de la gestación y el alumbramiento. En la fase final de la gestación y en presencia de THE, madre y feto pueden considerarse "actores con intereses contrapuestos" en lo que respecta al control de la PA y la finalización de la gestación. Se debe hacer un balance, en cada caso entre el riesgo de daño endotelial materno y el sufrimiento fetal intraútero.
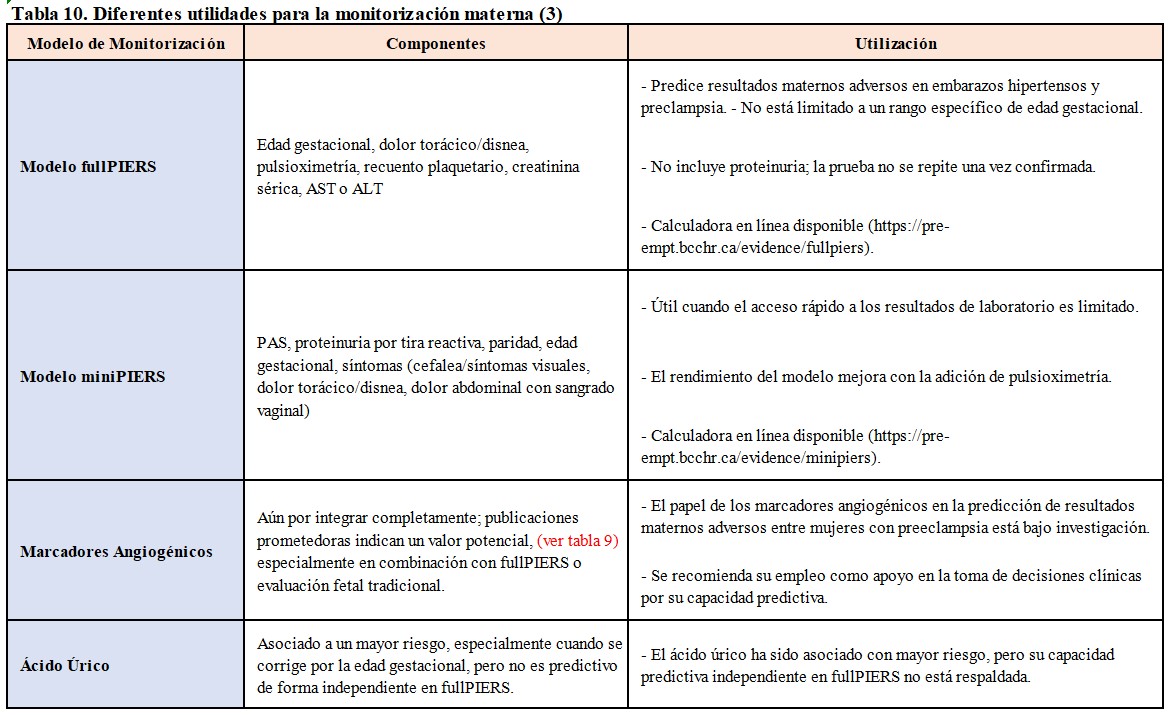
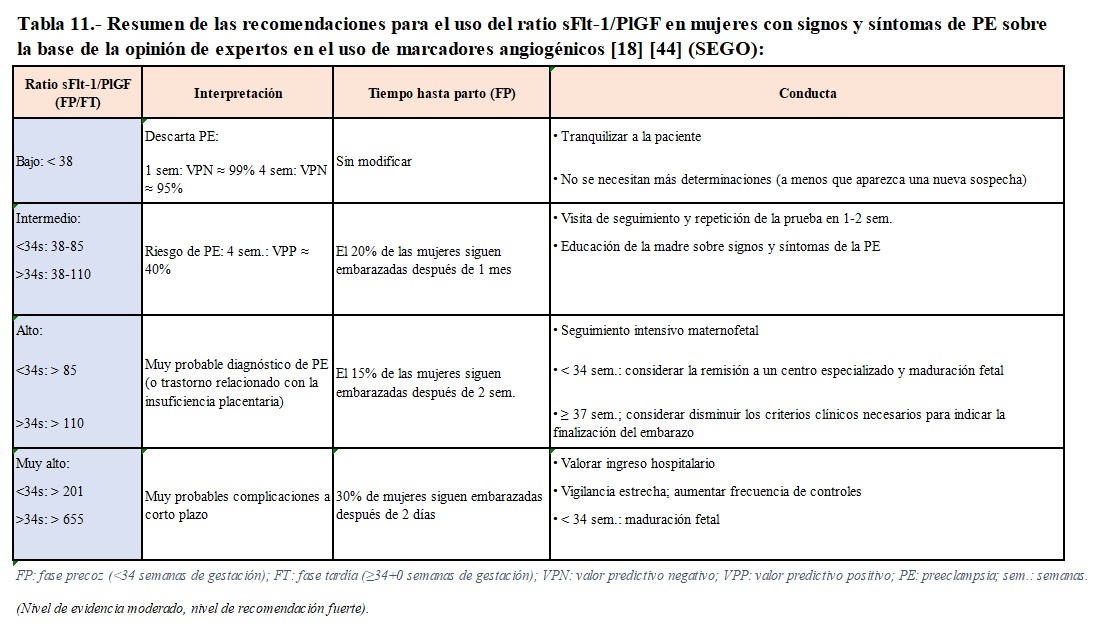
- Riesgo de complicaciones maternas: debemos evaluar la PA, la proteinuria y emplear modelos de predicción de riesgo. En este contexto, los modelos fullPIERS (Preeclampsia Integrated Estimate of Risk Score) y miniPIERS desempeñan roles significativos. En la (Tabla 10) destacamos diferentes utilidades para la monitorización materna, teniendo en cuenta diversos factores de riesgo y resultados. La evaluación del cociente sFlt-1/PlGF (Tabla 11) en mujeres con signos y síntomas de PE es de especial y prometedora relevancia en la evaluación de riesgo de complicaciones y actualmente se recomienda valorar su uso como apoyo en la toma de decisiones al final de la gestación [18].
- Sufrimiento Fetal: Aunque no existe clara evidencia de un método estandarizado, para el monitoreo fetal, se utilizan diferentes medios, como el monitoreo del ritmo cardíaco fetal (RCF) de manera seriada y cardiotocografías cada 6 horas en mujeres hospitalizadas. La ecografía para evaluar el crecimiento fetal y el líquido amniótico está recomendada, pero se desconoce la frecuencia óptima. La ecografía Doppler de la arteria umbilical y del ductus venoso se utiliza para evaluar el riesgo perinatal en embarazos de alto riesgo. El perfil biofísico no se recomienda debido a su limitada utilidad. También existen métodos multivariantes con posible utilidad, aunque aún carecen de validación en grandes estudios poblacionales [37].
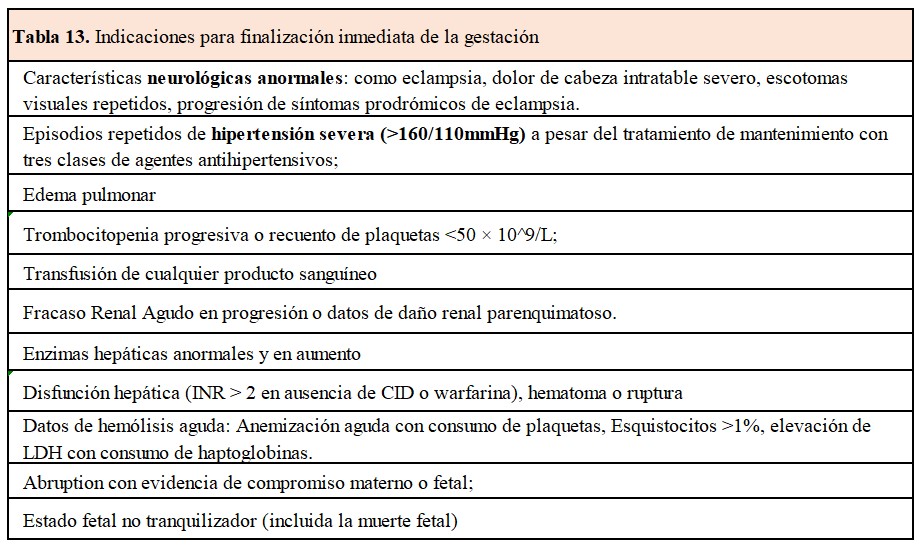
Así, la toma de decisiones en cuanto a la finalización de la gestación se lleva a cabo con la evaluación de riesgo de complicaciones, la evaluación de daño orgánico materno o fetal y la edad gestacional (Tabla 12) y (Tabla 13).
Control postparto y alta
Seguimiento inmediato
Aunque el final de la gestación es, por definición, el tratamiento definitivo de todos los THE relacionados con una disfunción uteroplacentaria, en algunas pacientes el zenit de cifras máximo de PA ocurre en el periodo postparto, sobre todo en las primeras 72 horas. Además, en algunas series se describe hasta el 5-30% de diagnósticos de PE ocurren postparto, asociándose en este caso con mayor probabilidad de daño orgánico en contexto de una PE, así como de la incidencia de ictus isquémico [38].
Por ello, se recomienda que en todas las pacientes con diagnóstico de THE o con riesgo previo de PE se lleve a cabo una monitorización estrecha de la PA en los primeros 3-7 días postparto.
- En pacientes con cribado de alto riesgo sin THE, o con PE sin daño orgánico endotelial se puede recomendar control ambulatorio de la PA diario durante la primera semana postparto.
- En pacientes con PE se recomienda no dar de alta hasta que pasen, al menos, 48-72 horas de estabilidad en objetivos adecuados de cifras de PA.
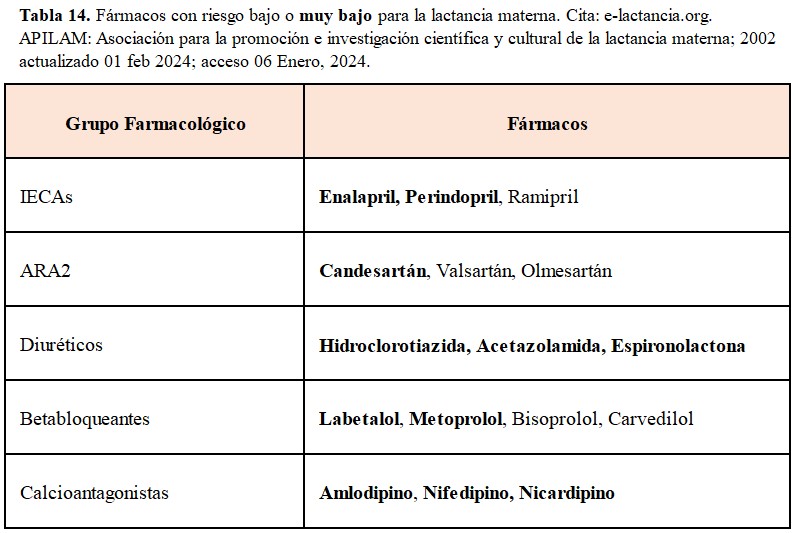
Tratamiento antihipertensivo postparto: Los objetivos de cifras de PA posparto deben ser iguales que durante la gestación, pudiendo ser más estrictos en la actitud terapéutica con las cifras de PAD. Una vez finalizada la gestación se abre el arsenal terapéutico disponible para el control de la PA y queda limitado por la seguridad de uso en lactancia materna (Tabla 14).
Seguimiento a largo plazo
Los THE constituyen un daño endotelial que, junto con la afectación vascular previa a la gestación, presente en pacientes con factores de riesgo cardiovascular (FRCV) previos, ejercen un considerable impacto a medio y largo plazo en el RCV. Las mujeres que presentan HTG y PE tienen una mayor propensión a desarrollar HTA crónica, enfermedad cerebrovascular, cardiopatía isquémica y enfermedad renal crónica [13] [39].
Por ello se sugiere llevar a cabo un seguimiento del RCV en estas pacientes a nivel ambulatorio al menos con dos consultas en el primer año postparto (al primer mes y entre 6-12 meses) para:
- Medición de PA y si es posible marcadores no invasivos de daño y rigidez vascular (Índice Tobillo Brazo (ITB), Velocidad de Onda de Pulso (VOP)…)
- Monitorización de dosis de antihipertensivos según necesidad.
- Dar recomendaciones e información sobre RCV y modificaciones de estilo de vida.
Posteriormente se recomienda incluir a estas pacientes dentro de los programas de ambulatorios de cribado de RCV [40].
Protocolo de cuidados y seguimiento de HTA y RCV al finalizar la gestación
Con el objetivo de llevar a cabo una estrategia de mejora en la detección y manejo precoz del RCV en pacientes gestantes que hayan padecido THE, se propone el siguiente programa de seguimiento [1] [2] [3] [10] [12] [14] [39] [41] [42] [43] [44].
Valoración Pre-Alta, seguimiento precoz.
Objetivos:
- Monitorización de dosis de antihipertensivos.
- Recomendaciones sobre AMPA y estilo de vida.
- Laboratorio (habitualmente ya estará hecho): Cociente albúmina /Creatinina en orina, perfil sérico renal y hepático + LDH, Hemograma.
Consulta en el 1er mes postparto, consulta de seguimiento posTHE
Objetivos:
- Medir la PA, peso e IMC, ITB y VOP (cuando estén disponibles)
- ECG (derivar a pruebas diagnósticas)
- Monitorización de dosis de antihipertensivos si los precisa.
- Laboratorio: Cociente albúmina/creatinina, Perfil renal y hepático y hemograma.
Consulta 6-12 meses postparto, evaluación de daño y screening de RCV y metabólico.
Objetivos:
- Medir PA, peso e IMC, ITB y VOP (cuando estén disponibles)
- Monitorización de dosis de antihipertensivos si los precisa.
- Recomendaciones: Información sobre RCV y modificaciones de estilo de vida.
- Laboratorio: Cociente albúmina/Creatinina en orina, Perfil sérico lipídico (no antes), renal y hepático, Hb glicosilada y Hemograma.
Seguimiento a largo plazo:
A) Pacientes con HTA crónica, marcadores de daño vascular (ITB, VOP, albuminuria, voltaje ECG…) y/o otros FRCV
Responsable: Agenda específica CEXT Sº Nefrología
Objetivos:
- Medir PA, peso e IMC anualmente
- ITB y VOP (cuando estén disponibles) cada 5 años
- Monitorización de dosis de antihipertensivos si los precisa.
- Recomendaciones: Información sobre RCV y modificaciones de estilo de vida.
- Laboratorio: Cociente albúmina/Creatinina en orina, Perfil sérico lipídico, renal y hepático y Hemograma.
B) Pacientes con normalización de la PA y ausencia de marcadores de daño vascular y de otros FRCV.
Responsable: Atención Primaria (se establecerían recomendaciones en el informe de alta de Nefrología)
Objetivos:
- Medir: PA, Peso e IMC anualmente
- Reescreening de RCV cada 5 años