Ecografía Doppler en el Acceso Vascular
Palabras clave
Fistula arteriovenosa, acceso vascular, ecografía doppler
INDICE
1. Conceptos básicos de ecografía doppler necesarios para realizar ecografía de acceso vascular
2. Ventajas e inconvenientes de la Ecografía doppler
3. Indicaciones para la utilización de la ecografía doppler en relación al acceso vascular
4. Datos a tener en cuenta para realizar una adecuada exploración con ecografía doppler
5. Sistemática de la exploración con ecografía doppler en el mapeo prequirúrgico
a. Exploración arterial
b. Exploración venosa
6. Sistemática de la exploración con ecografía doppler de la fístula arteriovenosa (FAV) prevalente
a. Exploración arterial morfológica
b. Anastomosis
c. Exploración venosa
d. Medida del flujo de acceso y el índice de resistencia
7. Criterios ecográficos de fístula madura
1. CONCEPTOS BÁSICOS DE LA ECOGRAFÍA DOPPLER NECESARIOS PARA REALIZAR ECOGRAFÍA DE ACCESO VASCULAR.
La ecografía doppler (ED) es una técnica de imagen diagnóstica basada en la emisión de ultrasonidos (US) a través de una sonda o transductor que puede ser lineal, convexa o sectorial. Para permitir la adecuada trasmisión de los US se debe colocar gel entre la sonda de ultrasonidos y la piel del paciente.
Los transductores tienen cristales con propiedades piezoeléctricas que emiten haces de US a modo de pulsos que se propagan a través de los tejidos. Cuando las ondas pasan de un tejido a otro con diferentes propiedades físicas (Interfase acústica), una parte de los US atraviesa el tejido correspondiente y otra parte se refleja. Los US reflejados vuelven al transductor, a la unidad de procesamiento del ecógrafo, que genera una imagen en la pantalla en una escala de grises (Modo B).
Hay tejidos como el hueso que no dejan pasar prácticamente ningún US, por lo que casi todos los ultrasonidos serán reflejados al transductor y la imagen será hiperecóica (blanca).
En el otro extremo, están los líquidos que dejan pasar prácticamente todos los US a su través siendo escasa la reflexión de los mismos y dando una imagen resultante anecóica (negra).
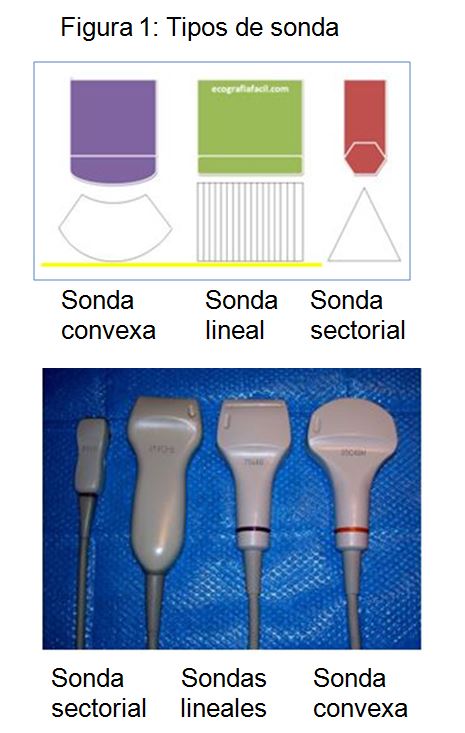
Tipos de sonda.
La sonda lineal de tipo multifrecuencia (entre 7,5 y 12,5 mHz) es la más adecuada para realizar el estudio vascular (Figura 1). Tiene muy buena resolución espacial pero poca capacidad de penetración en el tejido por lo que es ideal para el estudio de vasos superficiales como en es el caso de la FAV.
Las sonda convexa es de baja frecuencia (3-5 mHz). Tiene menor resolución, pero mayor capacidad de visualizar estructuras profundas y es de elección para la exploración abdominal.
La sonda sectorial también de baja frecuencia (3-9 mHz) y con morfología cuadrada permite obtener un campo visual muy estrecho proximalmente y muy ancho distalmente, siendo de especial utilidad para la ecografía cardiaca.
Modo B
Modo bidimensional, que nos muestra la imagen morfológica en tiempo real en escala de grises. Entre los ajustes más importantes en la obtención de la imagen en escala de grises destacan:
- Profundidad. Número de centímetros que penetramos desde la piel. Debe estar ajustada de tal forma que la imagen objeto de estudio (Ej. Arteria Humeral) este situada en el centro de la pantalla con un tamaño suficiente para poder diferenciar los componentes de la imagen (Ej. Intima-media).
- Ganancia. Intensidad con la que vemos la imagen en la pantalla. Tiene que estar ajustada de tal forma que seamos capaces de diferenciar los diferentes tejidos, pero evitando la aparición de artefactos.
- Foco. Marcador que permite enfocar con mayor resolución una franja horizontal de la pantalla aunque no todos los ecógrafos portátiles disponen de este ajuste.
Modo Doppler
Modo que nos permite llevar a cabo un estudio funcional de la estructura a valorar gracias al efecto Doppler, que consiste en detectar y representar con color las zonas donde se detecta movimiento.
Se basa en un principio sencillo, cuando los US chocan con una partícula en movimiento existe un cambio de frecuencia proporcional a la velocidad de la estructura reflectora. El transductor recibe este cambio de frecuencia y es capaz de detectar donde hay movimiento. Además, permite medir la velocidad de la sangre mediante la llamada ecuación doppler.
El ángulo de insonación formado entre el haz de US y la estructura en movimiento influye en la ecuación doppler y debe estar situado entre 45º y 60º.
Si el ángulo Doppler es de 90º no se detecta cambio alguno en la frecuencia Doppler dado que el coseno de 90º es 0 y por ello, la imagen obtenida es "ausencia de flujo".
Si el ángulo Doppler es mayor de 60º, pequeños cambios en el ángulo se asocian con grandes cambios en el coseno del ángulo Doppler y por tanto en el cálculo de la velocidad.
Por tanto, el ángulo Doppler debe ser inferior a 60º para que la velocidad medida sea fiable; lo ideal está entre 45º y 60º.
Cuando manejamos el efecto doppler, es fundamental realizar en todo momento el ajuste de la Frecuencia de Repetición de pulso (PRF) que indica el número de pulsos de US emitidos por segundo. Está relacionada con la velocidad del flujo a estudiar y con la profundidad a la que se encuentra la estructura de estudio.
- Si la velocidad es alta requiere un PRF más alto para obtener una alta tasa de muestreo de los múltiples hematíes que atraviesan el vaso por segundo. (A mayor velocidad mayor PRF y a menor velocidad menor PRF).
- Si el vaso es muy superficial los US tendrán que recorrer poca distancia hasta llegar a la estructura de estudio y podremos enviar un mayor número de US obteniendo mejor resolución de imagen. Sin embargo, si el vaso es profundo los US tienen que recorrer una distancia mayor y los US que se reflejan pueden chocar con los US que se emiten artefactando la formación de la imagen. Por ello, cuando la estructura de estudio es profunda habrá que disminuir el PRF.
Los cambios en el PRF implican cambios en la escala de velocidad, es decir, en el rango de velocidades representadas mediante Doppler color o Doppler espectral.
Cuando la velocidad del flujo es mayor al doble del PRF ajustado aparece un fenómeno de mezcla de colores o turbulencia llamado aliasing.
La escala de velocidad y el PRF se ajustan por separado en el Doppler color y en el Doppler pulsado.
Modo Doppler Color.
El modo Doppler-Color (DC) codifica en escala de rojos y azules la imagen en movimiento. Por consenso se representa en rojo cuando la sangre se acerca al transductor y en azul cuando la sangre se aleja del transductor. El color es de mayor o menor intensidad según la velocidad de flujo sea mayor o menor.
Modo Power-Color. El modo Power-Color o Doppler de Potencia en Color (DPC), [en inglés Power Doppler Image (PDI)], consiste en una escala de naranjas que nos permite valorar con mayor sensibilidad que el Doppler Color dónde hay movimiento y dónde no lo hay, aunque no nos permite saber si la sangre se acerca o se aleja del transductor.
Dopler pulsado [Pulse wave (PW)]. Nos permite obtener el registro espectral de la onda de pulso en el vaso que estamos estudiando. Dentro de este registro, los parámetros de estudio más importantes en el contexto del mapeo vascular y la ecografía de fístula serán:
- Velocidad pico sistólica (VPS). Velocidad máxima de la sangre que tiene lugar durante la sístole. Se mide en centímetros por segundo (cm/sg)
- Índice de Resistencia. Indica la resistencia que existe al paso de la sangre.
- Medida del flujo de acceso (QA). Es la medida de la cantidad de sangre que pasa por el vaso que estamos estudiando y se mide en mililitros por minuto (ml/min). Es importante asegurarse de que el ecógrafo portátil dispone de esta aplicación incluida en el software del equipo ya que es esencial para la vigilancia de las FAV.
2. VENTAJAS E INCONVENIENTES DE LA ECOGRAFÍA DOPPLER
La ecografía doppler (ED) es una técnica diagnóstica no invasiva, de bajo coste, rápida de utilizar a pie de cama del paciente, y que asocia elevada sensibilidad y especificidad en manos expertas. Por estos motivos, ha ido aumentando su utilización en la evaluación preoperatoria del paciente candidato a FAV, en la maduración postquirúrgica y en el seguimiento periódico de la FAV prevalente.
Entre sus inconvenientes destacan:
- Técnica observador dependiente. Precisa entrenamiento específico por parte del Nefrólogo y del personal de Enfermería.
- Dificultad para su uso en pacientes con vendajes, heridas.
- Dificultad de valoración diagnóstica adecuada en arterias calcificadas.
- Dificultad para visualizar correctamente el territorio venoso central.
3. INDICACIONES PARA LA UTILIZACIÓN DE LA ECOGRAFÍA DOPPLER EN RELACIÓN AL ACCESO VASCULAR.
Las indicaciones de la ecografía Doppler en la evaluación preoperatoria, la maduración, la canulación, la evaluación de complicaciones y la vigilancia periódica de las FAV han aumentado exponencialmente en la última década. Por ello, es fundamental que tanto los médicos especialistas en Nefrología como la enfermería nefrológica reciban una adecuada formación en el correcto uso de la ED [1][2][3][4].
Las actuales guías GEMAV [5] recomiendan la utilización de la ecografía doppler en los siguientes supuestos:
- Se recomienda realizar un mapeo vascular ecográfico preoperatorio de forma rutinaria antes de la realización del acceso vascular, en el que se debe evaluar el diámetro y la calidad de la pared arterial, y la anatomía y la permeabilidad del sistema venoso profundo y superficial de la extremidad [6] [7] [8] [9] [10] [11] . (Recomendación 1.3.3. Página 14 Guías Gemav). Esta recomendación se mantiene en las guías Europeas de cirugía vascular [12], pero en las guías americanas KDOQI se recomienda realizar mapeo selectivo en pacientes con factores de riesgo de fallo primario [13][14].
- Se recomienda efectuar una ecografía Doppler ante toda FAV nativa con un desarrollo insuficiente evidenciado mediante la exploración física en la consulta de enfermedad renal crónica avanzada [15] [16]. (Recomendación 3.3.2. Página 34 Guías Gemav)
- Se recomienda utilizar indistintamente cualquier método de segunda generación para evaluar la función de la FAV, ya sea ecografía Doppler o métodos de cribado dilucionales, ya que presentan un rendimiento equivalente en la determinación del flujo sanguíneo [17] [18] [19] [20] [21] [22] [23] [24] [25] [26] [27] (Recomendación 4.7.1. Página 55 Guías Gemav).
- Según el concepto vigente de estenosis significativa se recomienda utilizar tanto los métodos de primera como de segunda generación para la monitorización y vigilancia de la FAV nativa (Recomendación 4.8.3. Página 61 Guías Gemav). La recomendación de vigilancia periódica basada en flujo de acceso en FAV nativas se mantiene en las Guías Europeas de Cirugía Vascular [12]. No obstante, tanto las guías Europeas de Buena Práctica clínica (EBGP) como las Guías KDOQI señalan la necesidad de más ensayos clínicos y afirman que no hay evidencia suficiente que soporte esta recomendación [13][14][28].
- Se recomienda la ecografía Doppler como exploración de imagen de primera elección en manos de un explorador experimentado, sin necesidad de fistulografía confirmatoria para indicar el tratamiento electivo ante toda sospecha de una estenosis significativa [5][29] [30] (Recomendación 4.7.2. Página 55 Guías Gemav)
- Se recomienda reservar la fistulografía como exploración diagnóstica de imagen únicamente para los casos de resultado no concluyente de la ecografía Doppler y sospecha persistente de estenosis significativa [5][12][29][30][31][32] (Recomendación 4.7.3. Página 55 Guías Gemav)
Además de estas recomendaciones, las guías vigentes reflejan la utilidad de la ecografía para detectar complicaciones de la FAV y evaluar aneurismas, pseudoaneurismas, trombosis parciales o zonas de infección local. Asimismo, la ED es fundamental para la punción de FAV complejas. Con evidencia creciente en los últimos años, la punción eco-guiada o eco-dirigida por parte de enfermería se consolida como una herramienta para mejorar los resultados de la punción y reducir el número de complicaciones frente a la punción tradicional a ciegas [33][34][35][36].
4. DATOS A TENER EN CUENTA PARA REALIZAR UNA ADECUADA EXPLORACIÓN CON ECOGRAFÍA DOPPLER
[5][32] [37]. (Tabla 17 página 56 guías Gemav)
Posición.
Tanto en el mapeo prequirúrgico como en la exploración de la FAV prevalente es imprescindible comenzar con un adecuado posicionamiento de paciente y explorador. La posición del paciente puede ser en decúbito supino o en sedestación, siempre que sea cómoda y que el miembro estudiado se pueda apoyar sobre una superficie dura y lisa con una angulación de unos 45 grados respecto al cuerpo del paciente (Si esto no es posible, una alternativa adecuada es apoyar el miembro estudiado sobre las rodillas del explorador).
Momento y lugar para realizar la exploración.
En pacientes ya incluidos en programa de hemodiálisis es conveniente realizar la exploración en el periodo interdiálisis para evitar los apósitos y el sangrado en las zonas de punción. En caso de indicación de ecografía urgente, debemos de tener en cuenta que si la exploración se realiza postdiálisis, la exploración y especialmente la medida del QA estará artefactada por la depleción de volumen postdiálisis.
El lugar donde se realiza la exploración debe tener una temperatura cálida y constante para evitar la vasoconstricción.
Sonda utilizada.
La sonda de estudio debe ser una sonda de tipo vascular, multifrecuencia con una frecuencia de estudio entre 7,5 y 12,5 mHz.
Es necesario que el ecógrafo tenga disponible además del modo B (escala de grises), doppler color, doppler pulsado, y que incorpore en su software el cálculo de velocidades y la medida de flujo de acceso.
Ajustes clave.
Trabajando en el modo B es fundamental ajustar adecuadamente la ganancia, la profundidad y el foco para que la imagen obtenida pueda ser interpretada de forma correcta.
Respecto al doppler color y el doppler pulsado es clave ajustar adecuadamente la frecuencia de repetición de pulso (PRF) y el ángulo de insonación (para una correcta medida del QA se recomienda un ángulo de insonación entre 45 y 60º), además de los parámetros anteriores.
5. SISTEMÁTICA DE LA EXPLORACIÓN CON ECOGRAFÍA DOPPLER EN EL MAPEO PREQUIRÚRGICO
[5][32][38] [39] [40] [41] [42] [43] [44] [45] [46] [47]
De forma general, el mapeo prequirúrgico se debe realizar en ambos miembros superiores (MMSS) y decidir después el mejor lugar para realizar la FAV.
Para ello, se tendrán en cuenta los hallazgos ecográficos y las características individuales y preferencias de cada paciente (edad, sexo, peso, comorbilidad, brazo dominante, profesión del paciente y antecedentes de catéteres, marcapasos/desfibrilador, cirugías, fracturas, radioterapia, etc.) (Punto 1.3 Página 14 Guías Gemav)
La ED debe ser realizada después de la exploración física y tras haber tomado la TA al paciente en ambos MMSS. Para valorar adecuadamente arteria y vena es recomendable comenzar con la sonda en posición transversal y pasar posteriormente a la valoración longitudinal del vaso.
a. Exploración arterial
La exploración arterial debe ser realizada antes de la exploración venosa. En ella debemos de tener en cuenta los siguientes factores en arteria humeral, radial y cubital:
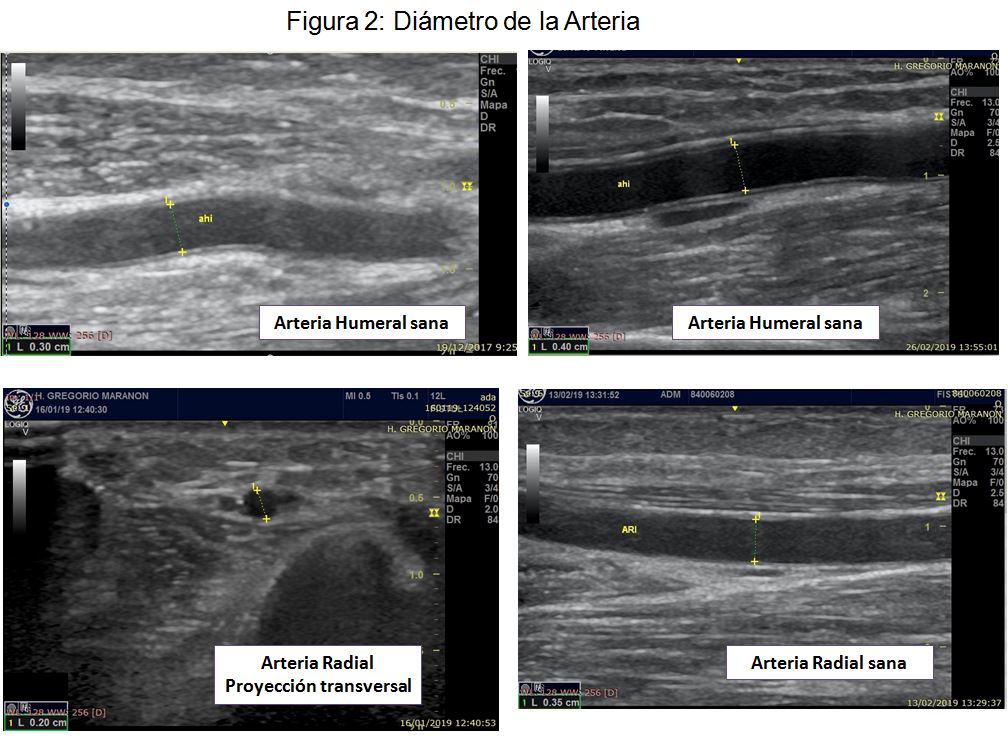
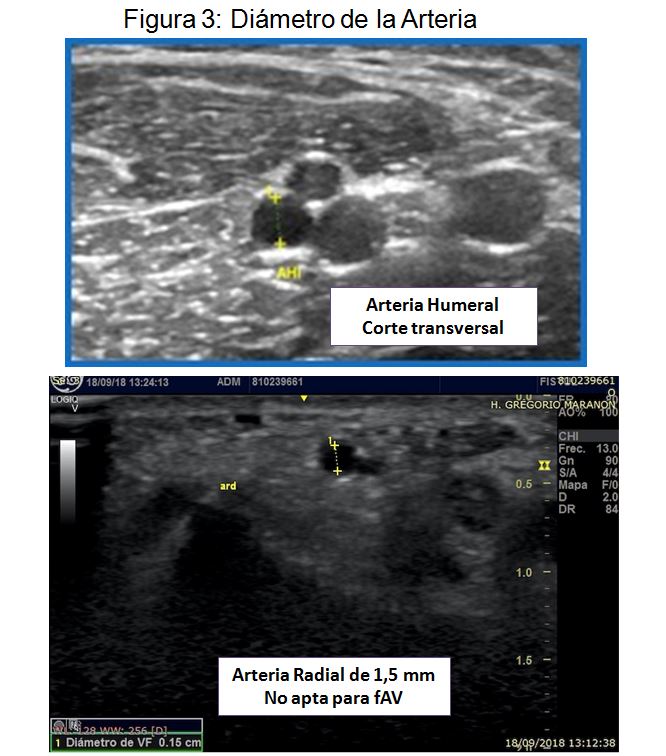
- Diámetro de la arteria (Tabla 6, página 16, guías Gemav). A mayor calibre arterial mejor pronóstico. Aunque la literatura es heterogénea, de forma general, se asocian a peor pronóstico las FAV realizadas con arterias menores a 1,8-2 mm, no recomendándose en ningún caso realizar anastomosis con arterias iguales o menores a 1,5 mm [39] [40] [41] [42] [43] [44][45][46][47] (Figura 2)(Figura 3)
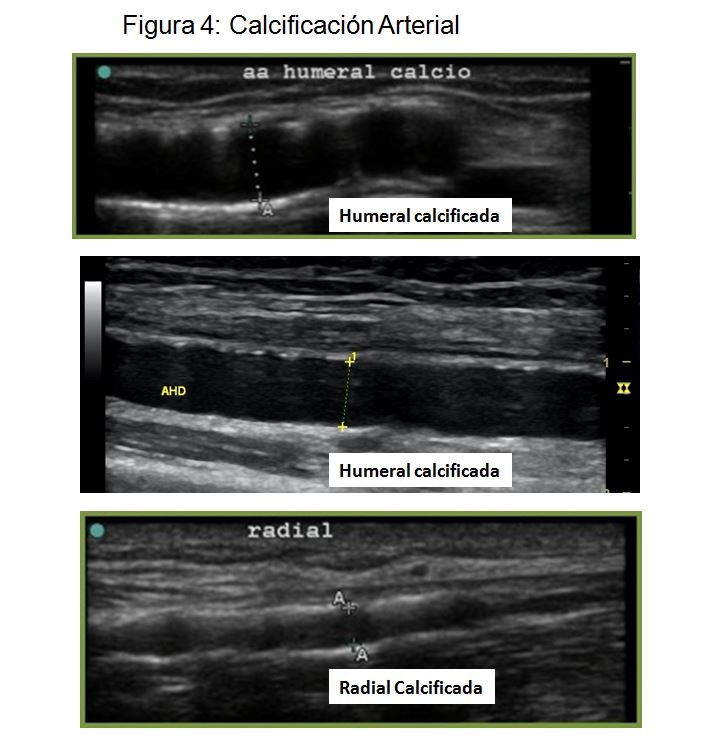
- Calcificación. A mayor calcificación mayor riesgo de fallo primario y mayor riesgo de síndrome de robo (Figura 4).
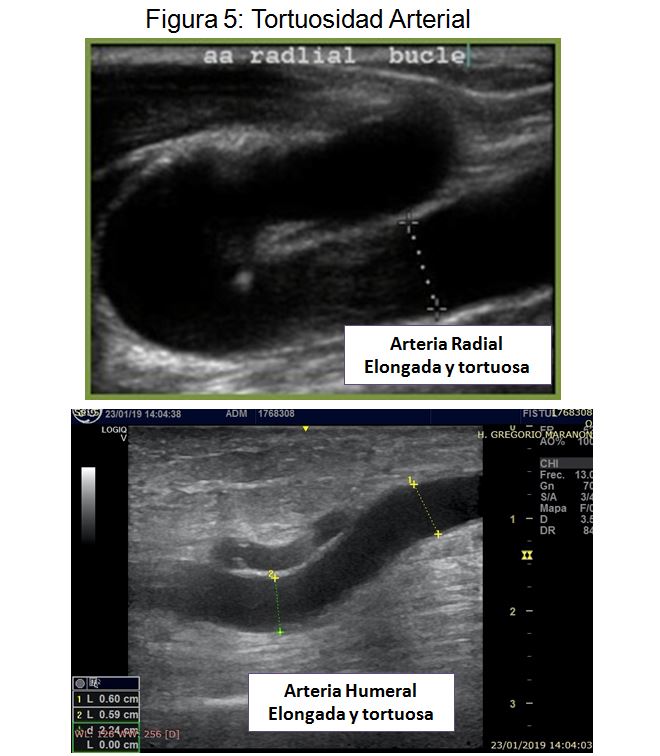
- Tortuosidad. A tener en cuenta especialmente en la zona de la anastomosis (Figura 5).
- Estenosis arterial. Es poco frecuente en pacientes que no han sufrido intervencionismo o cirugías previas, pero en ocasiones se pueden diagnosticar estenosis significativas de arteria humeral o radial que, en función de la severidad, pueden contraindicar la FAV distal a la región estenótica.
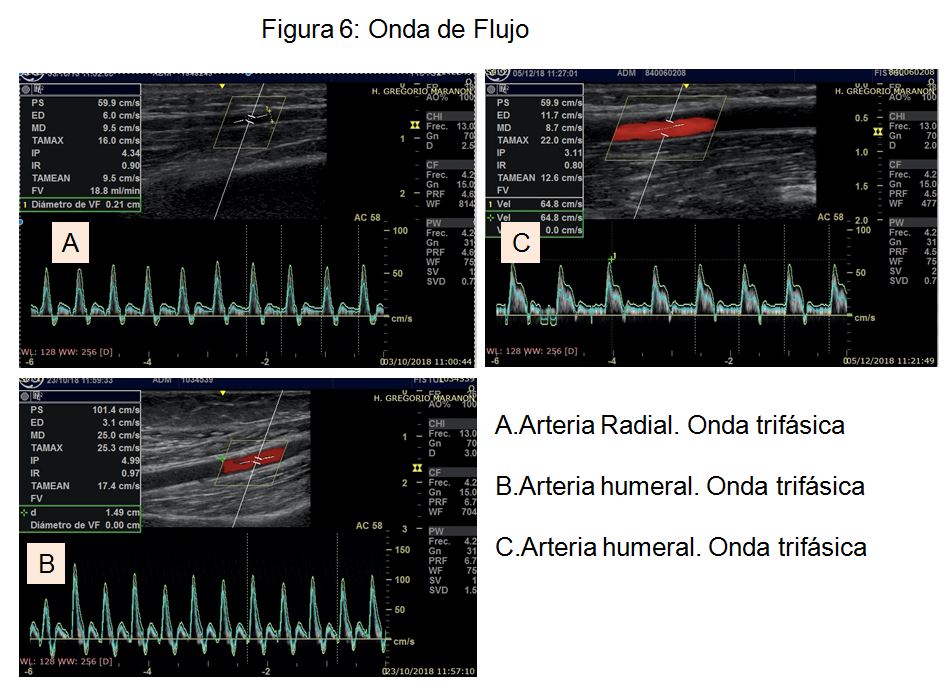
- Onda de flujo (monofásica, bifásica o trifásica) y velocidad pico sistólica (VPS). Se asocia a mejor pronóstico una onda de flujo trifásica con VPS superior a 50 cm/sg. La onda de flujo de peor pronóstico será aquella con morfología monofásica y VPS menor de 35 cm/sg. Un flujo de arteria radial > 50 ml/min se ha asociado con mejor pronóstico de la FAV [43] (Figura 6).
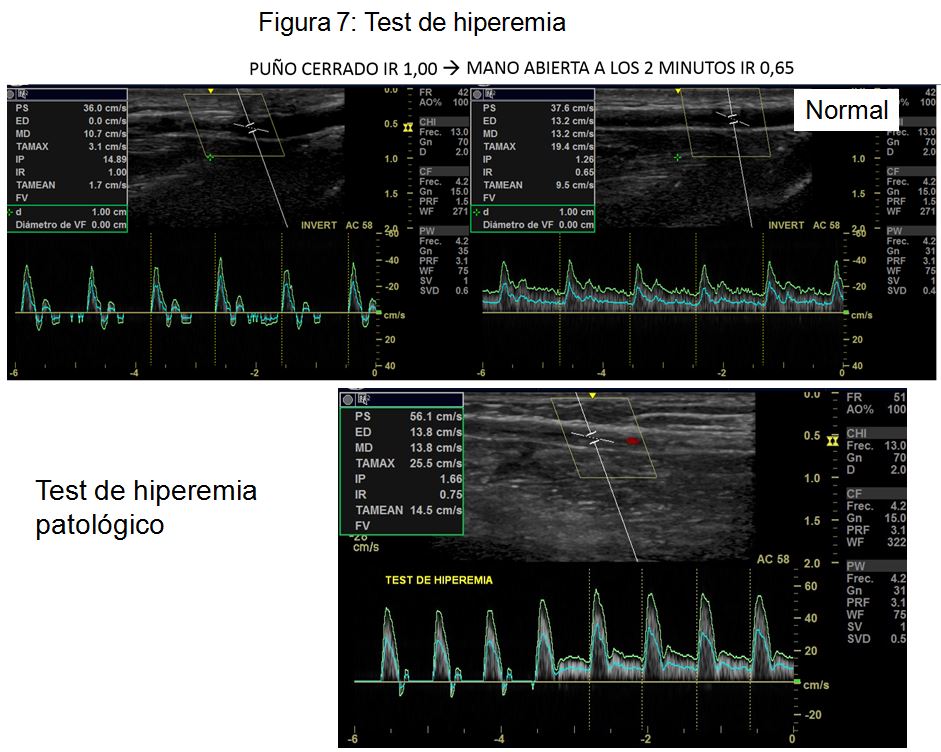
- Test de hiperemia. El test de hiperemia consiste en pedir al paciente que apriete el puño durante 2 minutos y comparar la onda de flujo con el puño apretado y tras abrir la mano. Típicamente, la onda de flujo pasará de ser trifásica con índice de resistencia (IR) de 1 a tener una morfología de baja resistencia sin inversión de la diástole. Cuando al abrir la mano el IR es < de 0,7 es un dato de buen pronóstico (Figura 7).
b. Exploración venosa.
La exploración venosa se debe realizar con un compresor. Idealmente se realizará una primera exploración sin compresión y una segunda valoración de mapeo con compresor que es la que determinará los calibres venosos a tener en cuenta para la intervención. Se deberán tener en cuenta los siguientes factores:
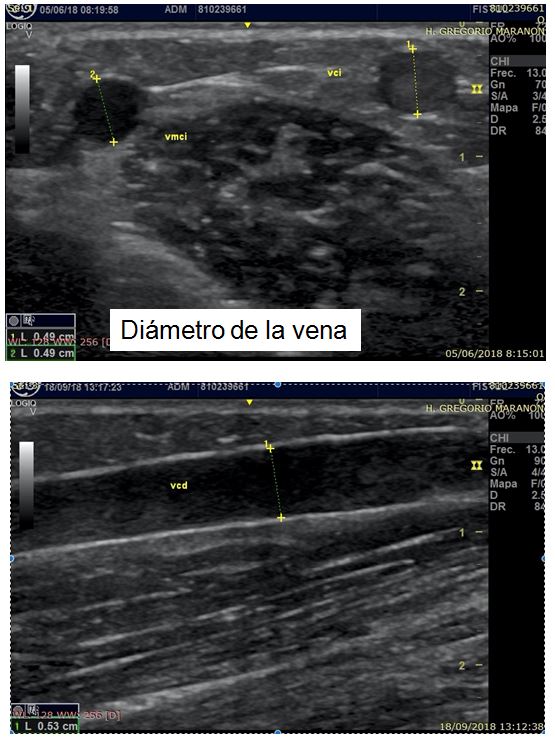
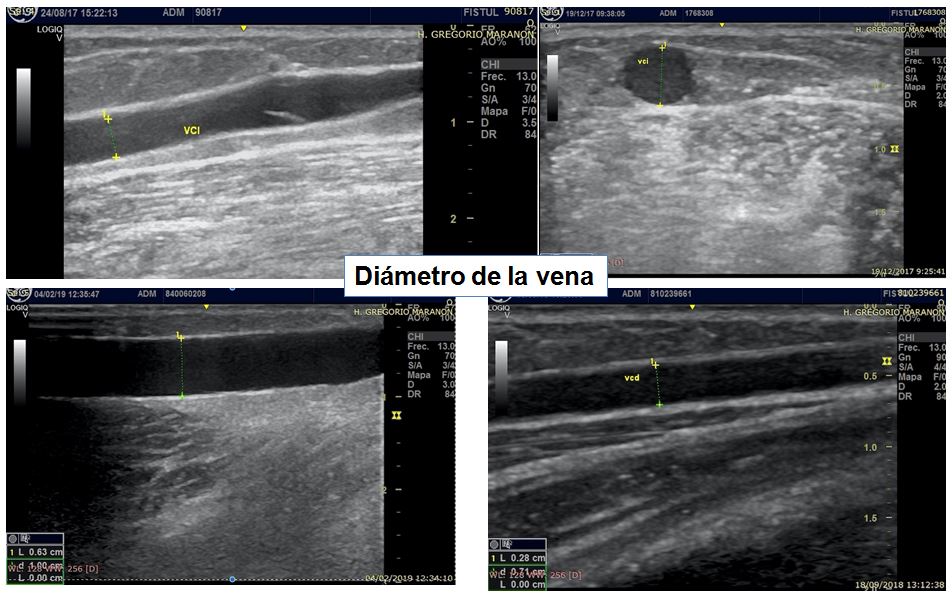
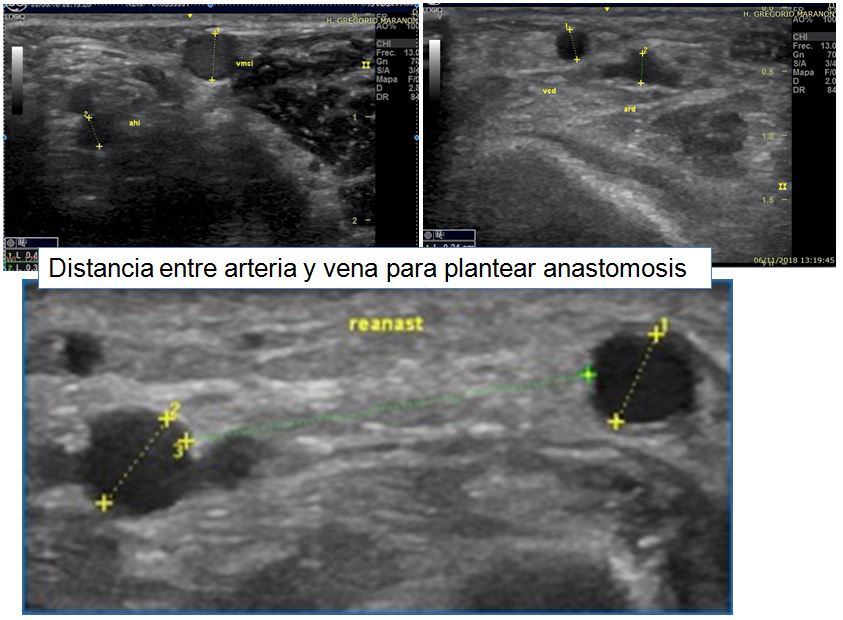
- Diámetro de la vena (Tabla 7 página 16 guías Gemav). A mayor calibre venoso mejor pronóstico. De nuevo no existe un consenso claro en la literatura sobre los calibres mínimos para realizar la FAV, pero sabemos que se asocia a mejor pronóstico una vena mayor a 2 mm en antebrazo y mayor a 2,5-3 mm a nivel de la flexura del codo (Figura 8) y (Figura 9). Se debe evitar realizar anastomosis con venas menores a 1,6 mm medidas con compresor. Cuando existe un aumento del calibre venoso superior al 40% al comparar la vena antes y después de colocar el compresor es un factor de buen pronóstico [39] [41] [42] [46]. También es importante determinar la distancia con la arteria para plantear la mejor zona para realizar la anastomosis (Figura 10).
- Compresibilidad. Mientras pasamos el transductor por encima de la vena debemos ir comprimiendo periódicamente la misma a lo largo de todo el recorrido. Esta maniobra unida a la medida del calibre venoso nos permitirá detectar zonas de rigidez, fibrosis o estenosis de la vena que modifiquen la decisión sobre la mejor localización de la FAV.
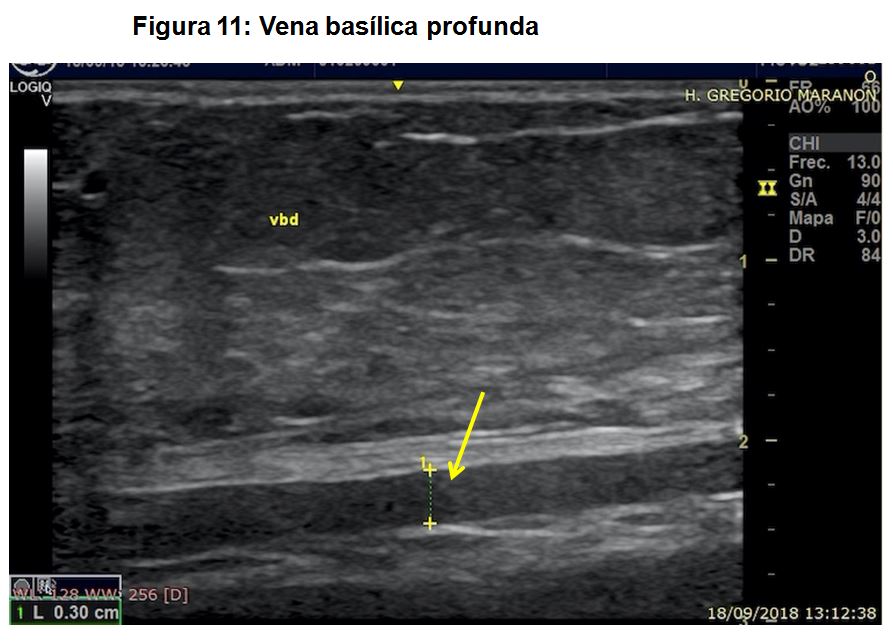
- Tortuosidad y profundidad de la vena. A tener en cuenta de cara a las futuras punciones, especialmente en pacientes con circunferencia braquial importante y presencia de abundante tejido adiposo (Figura 11).
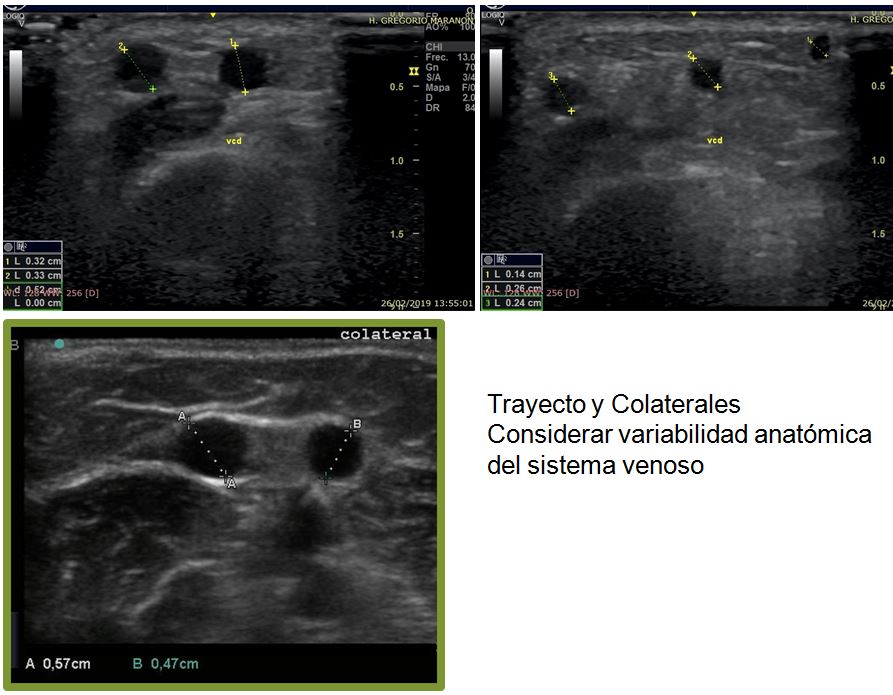
- Trayecto. Colaterales- Es fundamental tener en cuenta la enorme variabilidad anatómica del sistema venoso a la hora de decidir la FAV y planificar la cirugía en función de los hallazgos (distancia con la arteria, necesidad de cierre de colaterales, posibilidad de descolgar la vena vs necesidad de un puente de PTFE, tipo de anastomosis más adecuado latero-lateral vs latero-terminal, etc) (Figura 12).
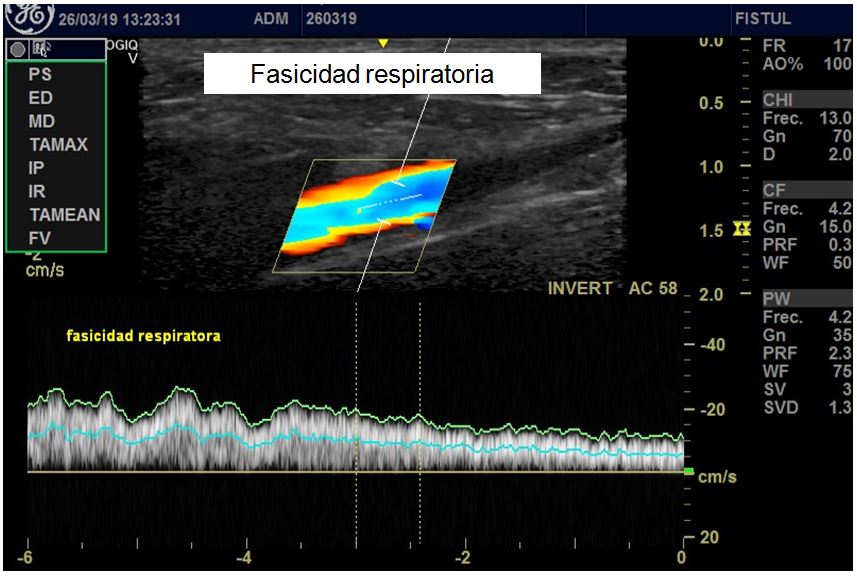
- Fasicidad respiratoria. Consiste en valorar la modificación de la onda de flujo en vena axilar o subclavia con la inspiración. En condiciones normales la VPS de la onda de flujo aumenta con la inspiración. La ausencia de modificación de la onda de flujo con la inspiración es un signo indirecto de estenosis central. Ante la duda se debe solicitar una flebografía para valorar el sistema venoso central antes de realizar la FAV (Figura 13).
6. SISTEMÁTICA DE LA EXPLORACIÓN CON ECOGRAFÍA DOPPLER DE LA FAV PREVALENTE
La sistemática de la exploración ecográfica de la FAV prevalente comienza con la arteria aferente continúa con la anastomosis arteriovenosa y finaliza con la vena eferente hasta el territorio central.
a. Exploración arterial morfológica.
Inicialmente con el modo B valoraremos las características morfológicas de la arteria humeral y radial. Al igual que en el mapeo preoperatorio prestaremos especial atención al valorar calibre, calcificación, tortuosidad y posible presencia de estenosis arterial. Hasta el 30% de los casos de FAV disfuncionante se han relacionado con la presencia de patología de la arteria nutricia [48] [49] (Figura 2) (Figura 3) (Figura 4) (Figura 5).
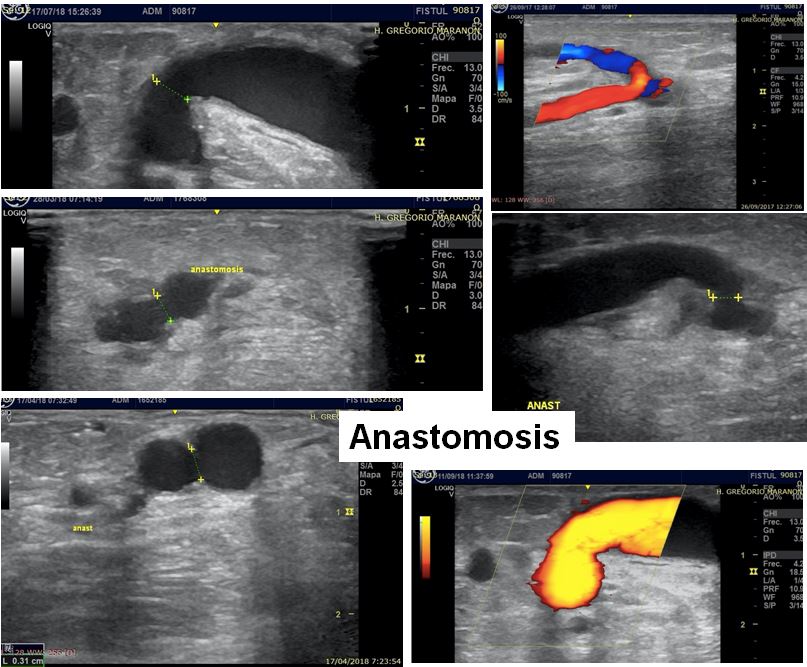
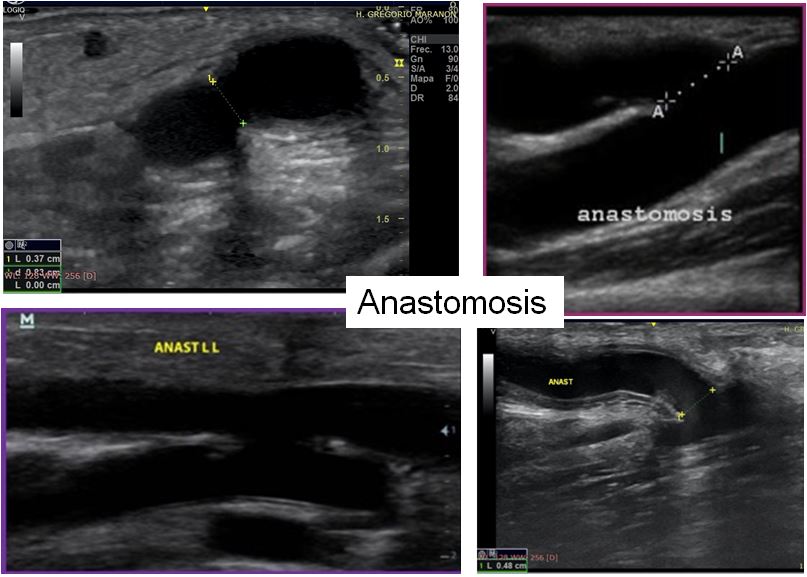
b. Anastomosis.
A nivel de la anastomosis debemos valorar el tipo de anastomosis (latero-lateral vs latero-terminal), el calibre de la misma y la VPS.
En general, el calibre de la anastomosis debe estar entre 3 y 5 mm aunque puede ser mayor en FAV de largo tiempo de evolución. En FAV humero-cefálicas no se recomienda realizar anastomosis mayores a 4 mm ó superiores al 75% del calibre de la arteria nutricia. En FAV radio-cefálicas se deben evitar anastomosis superiores a 7 mm. Anastomosis demasiado amplias pueden asociarse a FAV hiperdinámicas y a mayor riesgo de síndrome de robo [50][51].
La presencia de turbulencia o aliasing se observa de forma habitual a nivel de la anastomosis y a ese nivel no se considera patológica. El aliasing indica una zona de aceleración de la sangre donde la velocidad del flujo al menos duplica la frecuencia de emisión de pulsos del transductor. La VPS a nivel de la anastomosis suele ser < 400 cm/sg, pero en anastomosis de pequeño calibre puede superar los 400 cm/sg sin ser un dato patológico, siempre y cuando el flujo de acceso se encuentre dentro del rango normal (Figura 14) (Figura 15).
c. Exploración venosa.
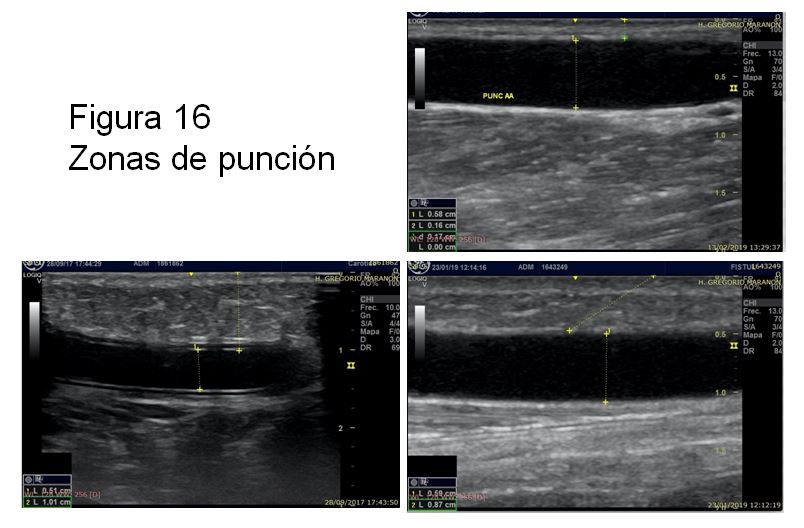
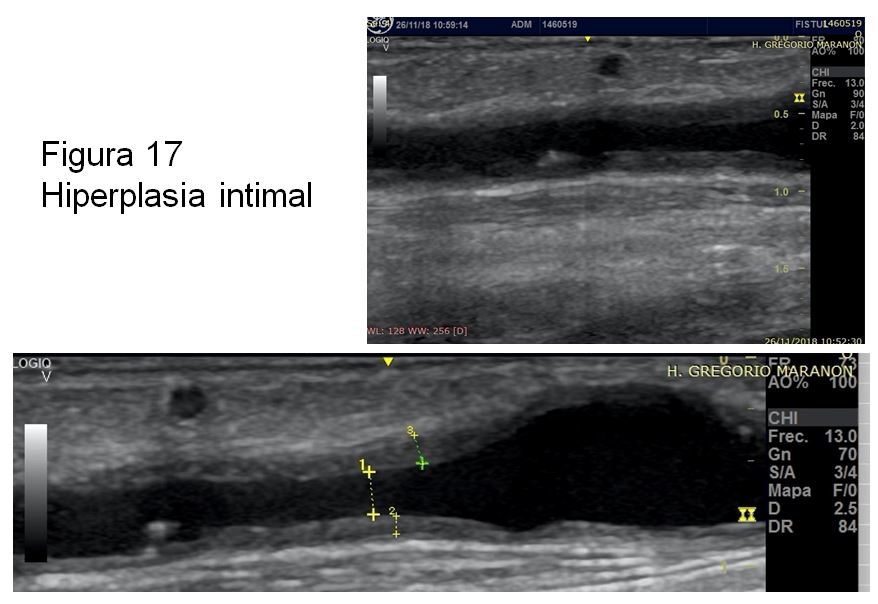
Debemos realizar un recorrido cuidadoso primero transversal y posteriormente longitudinal de todo el trayecto venoso incluyendo las zonas de punción (Figura 16) y el sistema venoso central que podemos visualizar con la ED. Es fundamental explorar detenidamente la vena postanastomótica, valorando la frecuente presencia de hiperplasia intimal (Figura 17), seguido de una evaluación minuciosa de las zonas de punción, donde podremos encontrar alteraciones como:
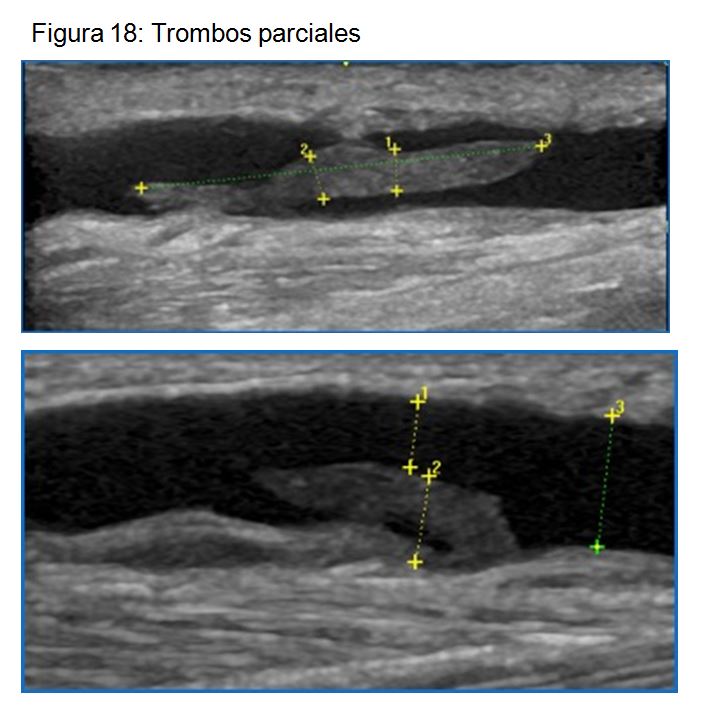
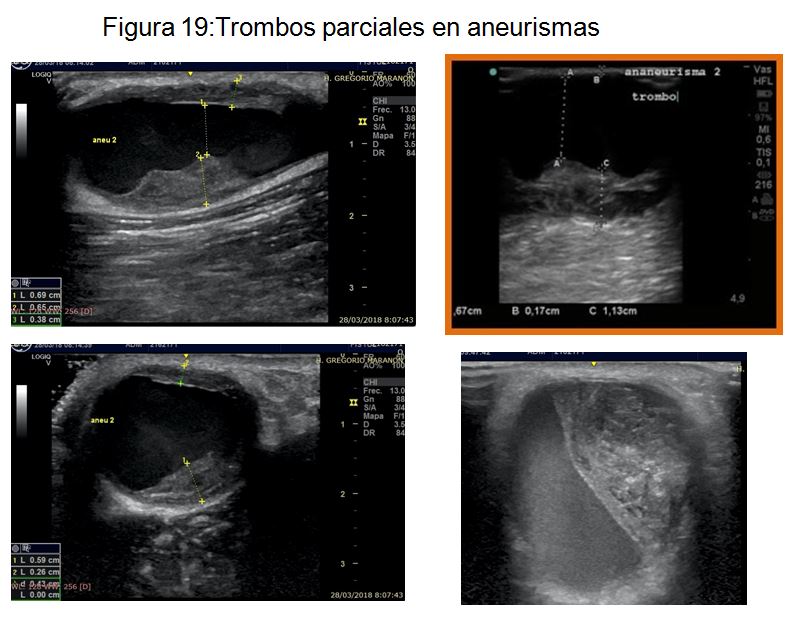
Trombos parciales. En el caso de zonas de trombosis reciente a raíz de una punción traumática, donde se objetiva un trombo homogéneo, aún no organizado, puede reabsorberse el trombo dejando de pinchar en la zona afectada (Figura 18) (Figura 19).
Lesiones propias de la pared de la vena de salida por la canulación repetida (aneurisma, pseudoaneurisma, hematoma)[36]:
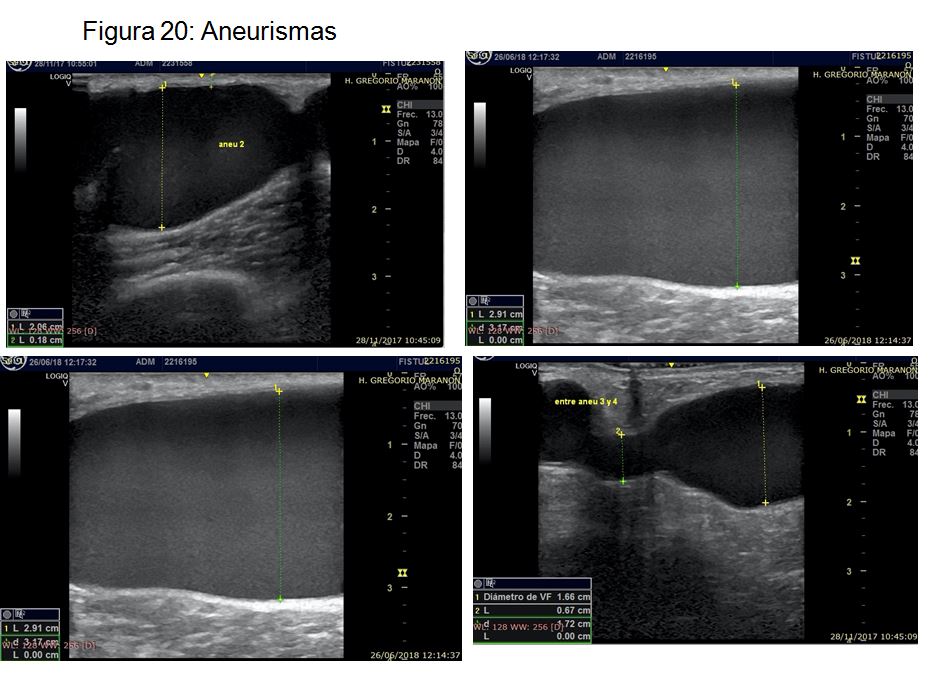
A)Aneurisma o dilatación venosa sacular o fusiforme, mayor de 1,5-2 veces el diámetro del vaso no dilatado, que involucran las 3 capas de la pared. Es importante valorar el grosor de la misma e intentar evitar punciones repetidas sobre las zonas de pared menor a 2 mm (Figura 20).
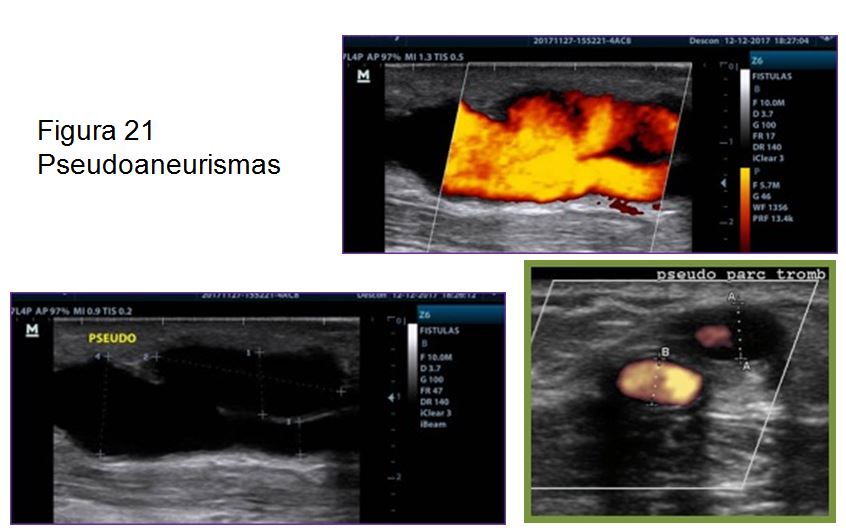
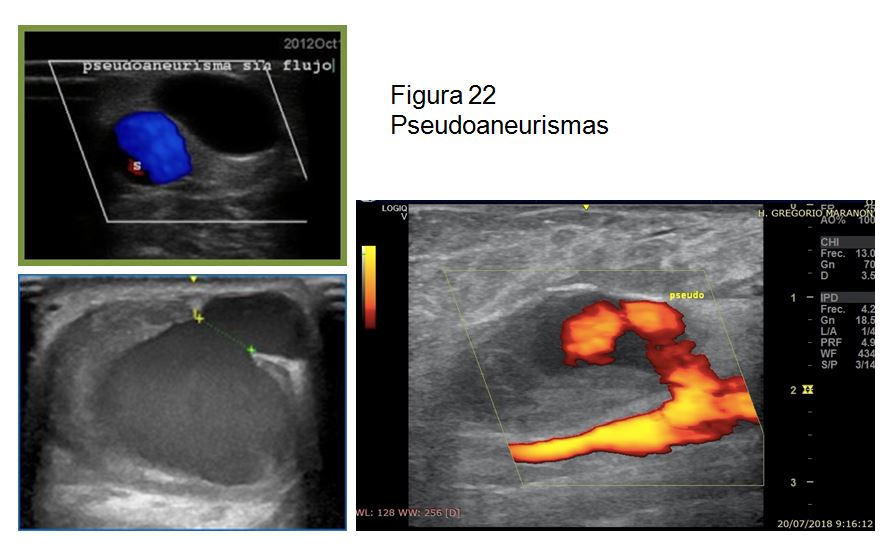
B)Pseudoaneurisma o colección perivascular generada por un hematoma, en el que el orificio del vaso no se cierra y el sangrado es constante. A diferencia del aneurisma, no tiene pared propia. Mediante el estudio Doppler debemos valorar si se rellena con flujo parcial o totalmente o por el contrario se trata de un pseudoaneurisma totalmente trombosado (Figura 21) (Figura 22).
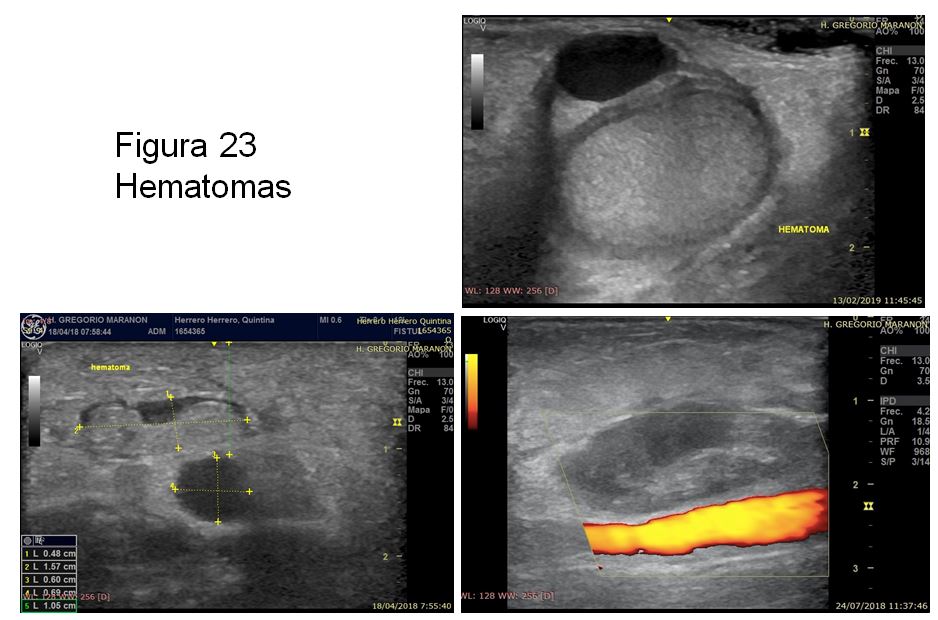
C)Hematoma o colección de sangre fuera del vaso, sin continuidad con el mismo y sin evidencia de flujo en el modo Doppler. Es importante ver si el hematoma es compresivo sobre la FAV generando una zona de estenosis o si por el contrario se mantiene intacto el calibre del vaso (Figura 23).
El manejo de estos hallazgos será valorado con mayor detenimiento en el apartado del tratamiento de las complicaciones de la FAV.
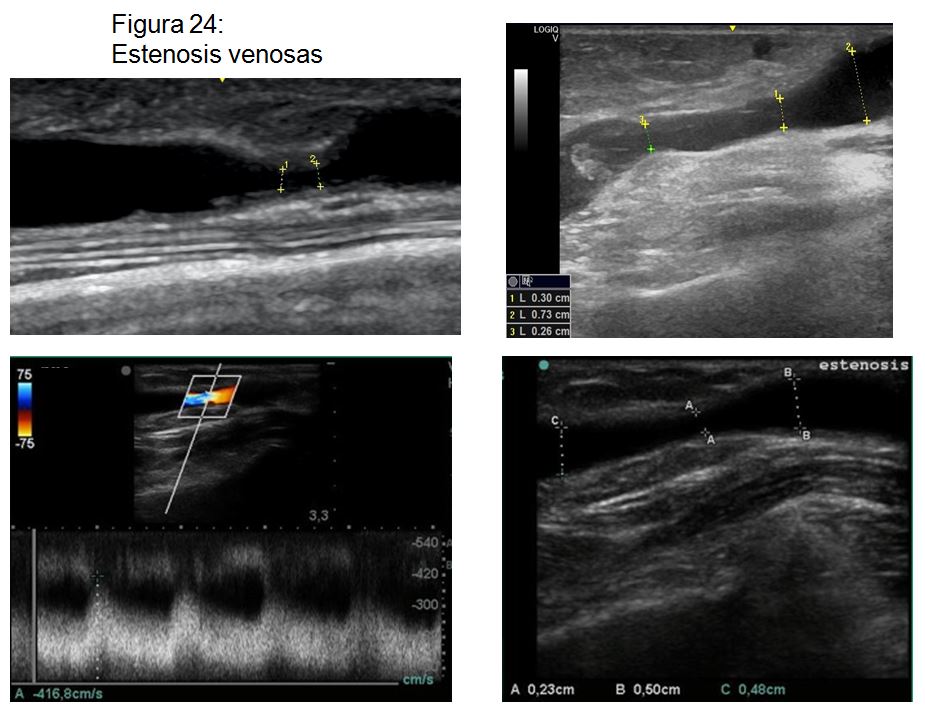
Detección de estenosis venosas. Las estenosis pueden aparecer en cualquier localización a lo largo del trayecto de la vena, siendo más frecuentes las estenosis postanastomóticas o estenosis de inflow en las FAV radiocefálicas y las estenosis de outflow en las FAV humerocefálicas (Figura 24).
Al detectar una estenosis debemos analizar el impacto anatómico y hemodinámico de la misma y en función de los datos de reducción de calibre del vaso, VPS y QA valorar la necesidad de intervención sobre la misma. (Tabla 19, página 57, guías Gemav).
Para plantear la intervención sobre una estenosis esta debe cumplir al menos dos criterios principales y uno adicional (Recomendación 4.9.1. página 63, guías Gemav)
CRITERIOS PRINCIPALES
Reducción > 50% luz del vaso.
Ratio VPS est/VPS pre > 2.
CRITERIOS ADICIONALES
Luz permeable < 2 mm.
QA Absoluto: < 500 ml/min (FAV) o < 600 ml/min (PTFE)
Disminución temporal superior al 20-25% si QA< 1000 ml/min.
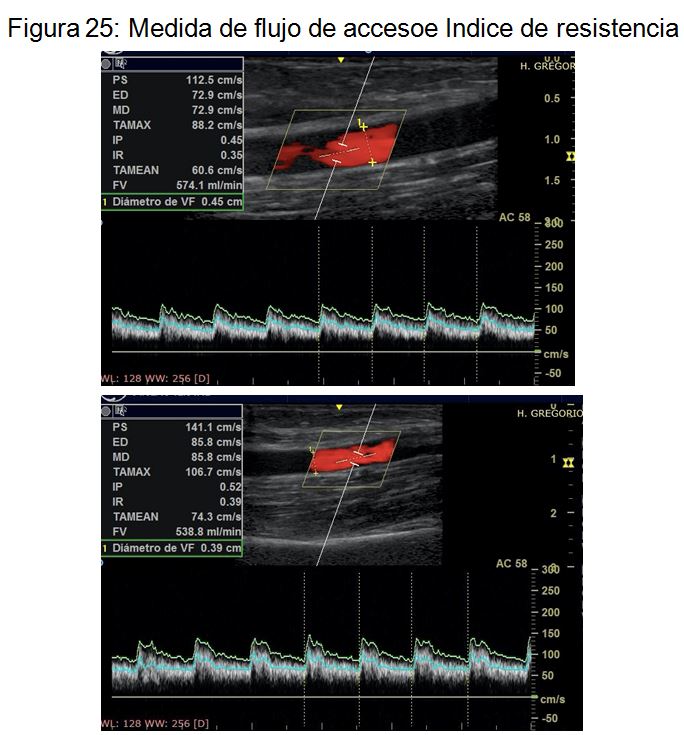
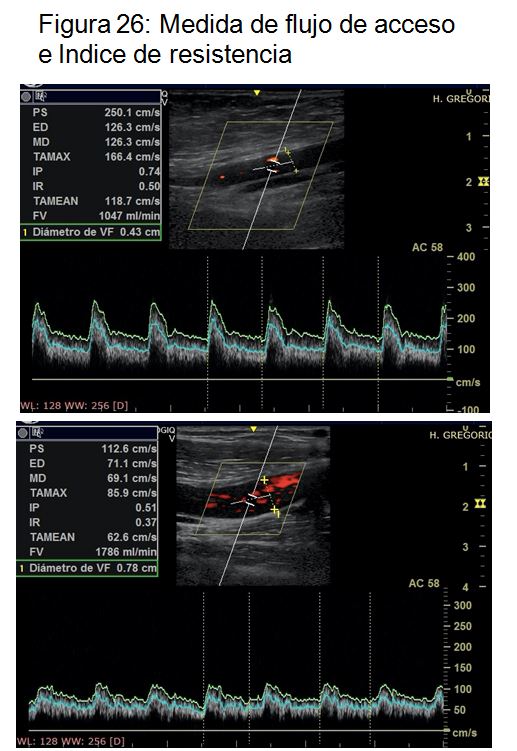
d. Medida del flujo de acceso y el índice de resistencia
Una vez finalizada la exploración de la FAV procederemos a medir el QA (Figura 25) (Figura 26).
Localización. La medida del QA debe ser realizada a nivel de la arteria humeral, tanto en FAV distales como en FAV proximales ya que muchas de las FAV radiocefálicas se nutren en parte por la arteria cubital a través del arco palmar y la medida del QA en la arteria radial podría subestimar el flujo real.
Debemos elegir dentro de lo posible una zona no calcificada y de trayecto recto. Para realizar la medida colocaremos el transductor en posición longitudinal.
No se recomienda la medición en la propia vena, por la existencia de colaterales, que pudieran robar parte de flujo y/o por la compresibilidad de las mismas, que podría dar lugar a variabilidad y errores por infraestimación del diámetro. Únicamente podría ser válida la medida del QA en un AV de PTFE, donde la ausencia de colaterales y la rigidez del mismo nos daría un resultado fiable.
Angulo de insonación. El ángulo de insonación ideal estará entre 46 y 60º, para ello debemos posicionar adecuadamente la caja y buscar una zona de la arteria humeral ligeramente inclinada que nos permita obtener este ángulo.
Tamaño de muestra. El tamaño de la muestra debe ocupar entre el 50 y el 70% de la luz del vaso, para poder medir la información de la mayor parte de los hematíes pero evitando medir el flujo turbulento cercano a las paredes del vaso.
Una vez obtenido el registro Doppler mediremos el diámetro de la arteria humeral sobre la imagen congelada poniendo especial cuidado en que la medida sea perpendicular al vaso y esté recogida de íntima a íntima para evitar la sobrestimación de la medida. Para esta medida puede resultar útil quitar el color de la imagen.
La mayor parte de los ecógrafos portátiles actuales permiten medir el QA de forma semi-automática. Una vez introducido el calibre del vaso nos permitirá seleccionar varios ciclos o los seleccionará el ecógrafo de manera automática. Es fundamental verificar que está preseleccionada la medida de le velocidad media de los hematíes (TAMEAN Time averaged mean velocity) y no la velocidad pico de los mismos, ya que en este último caso sobrestimaremos la medida del flujo de acceso.
Dado que se trata de una medida observador dependiente se recomienda realizar la media de al menos tres medidas consecutivas del QA. Se considera normal un QA entre 500 y 1500 ml/min en FAV autólogas y entre 600 y 1800 ml/min en FAV protésicas. Un flujo de acceso por debajo de estos valores nos alerta sobre la presencia de estenosis significativa (arterial, venosa o a nivel de la anastomosis). El QA tiene una elevada sensibilidad y especificidad siempre que sea obtenida por un explorador experimentado.
Periodicidad de medida del QA. No hay evidencias sobre la periodicidad con la que debemos medir el QA. La mayor parte de los estudios recomiendan su medida trimestral en FAV autólogas y mensual o bimensual en FAV protésicas, ya sea mediante ED o utilizando métodos dilucionales [17] [21] [22] [23] [24] [25] [26] [27][51][52]. El seguimiento periódico del flujo de acceso ha demostrado reducir la tasa de trombosis y aumentar la supervivencia global en FAV autólogas, siendo más controvertida su eficacia en las FAV protésicas [17] [18] [22] [23] [24] [25] [26] [27] [51][52]. En aquellas FAV con estenosis no significativas en seguimiento individualizaremos la periodicidad de la medida del QA en función de la severidad de la estenosis y el tipo de FAV.
Medida del Indice de resistencia. Por último, debemos recoger el dato del IR. La mayoría de los ecógrafos nos darán la medida de forma automática al recoger el registro doppler pero en algunos equipos será necesario calcularlo de forma manual posicionando el transductor sobre los valores pico y valle de uno de los ciclos. (Velocidad pico sistólica – Velocidad telediastólica / Velocidad pico sistólica)
Tras la creación de una FAV, pasamos de una arteria de alta resistencia con morfología trifásica a una arteria de baja resistencia. La monitorización del IR nos ayuda para confirmar una adecuada maduración de la FAV, cuando haya alcanzado un valor menor de 0,5-0,6. De la misma manera, el seguimiento del mismo y un posible aumento de su valor por encima de 0,6 nos alertaría sobre la presencia de una estenosis significativa (arterial, venosa o a nivel de la anastomosis). No obstante, el IR es un parámetro con elevada sensibilidad pero baja especificidad para detectar patología de la FAV, de forma que un IR normal no nos asegura que la FAV sea normofuncionante.
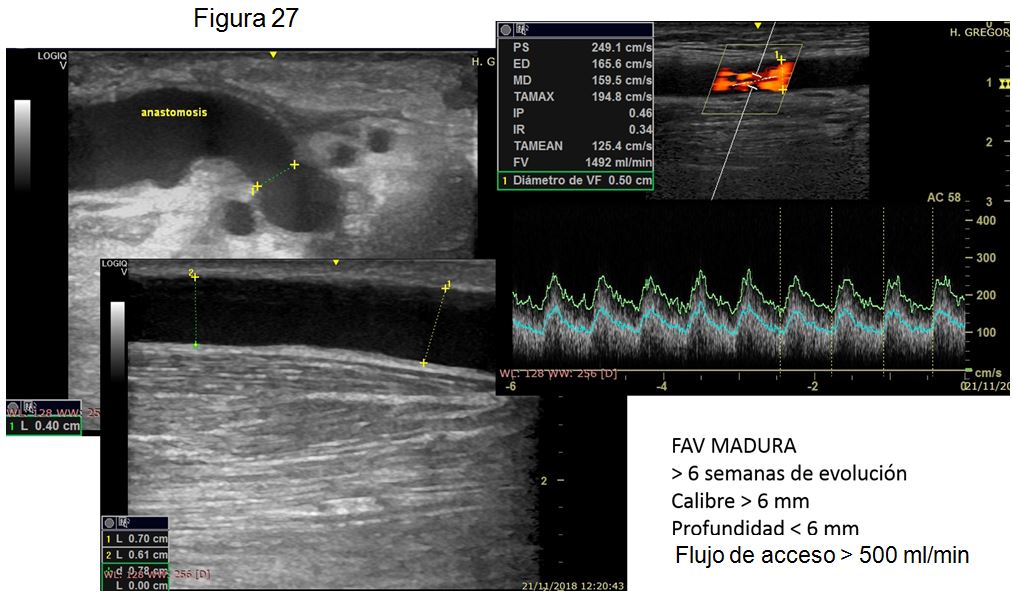
7. CRITERIOS ECOGRÁFICOS DE FÍSTULA MADURA.
Una adecuada exploración física nos da mucha información sobre el estado de maduración de la FAV (Tabla 23, página 82, guías Gemav), pero la ecografía doppler permite detectar el diámetro exacto de la vena, el flujo de acceso y en casos de falta de maduración nos da información sobre el motivo por el cual la fístula no ha madurado. En las semanas tras la creación de la FAV, a mayor flujo de acceso, mejor diámetro de vena y menor profundidad de la misma, aumenta a probabilidad de obtener una FAV adecuada para hemodiálisis. El momento adecuado para realizar la ecografía doppler de maduración es a las 4-6 semanas tras la cirugía, antes del inicio de las punciones [53][54].
La literatura es heterogénea sobre la definición exacta de FAV madura. De forma general, hablaremos de FAV madura cuando la vena tenga un calibre > 5-6 mm, esté situada a menos de 6 mm de profundidad y detectemos una media de QA mayor de 500 ml/min. La FAV con vena < de 4 mm y/o un QA < 500 ml/min será una FAV con fallo de maduración [54][55] [56] [57] [58] (Figura 27).