Consideraciones Quirúrgicas en el Trasplante Renal Infantil
Abreviaciones:
CAKUT: Anomalías congénitas del riñón y del tracto urinario
DRMQ: Displasia renal multiquística
EPU: Estenosis pieloureteral
ERCT: Enfermedad renal crónica terminal
RVU: Reflujo Vésico-ureteral
VUP: Válvulas de uretra posterior
Introducción
El trasplante renal es el tratamiento de elección en la enfermedad renal crónica terminal (ERCT) tanto en el adulto como en el niño ya que mejora la supervivencia y la calidad de vida en comparación con la diálisis. Por lo tanto, debemos de considerarlo siempre que sea posible en situación de prediálisis [1] [2]; siendo la mejor opción en pediatría el trasplante anticipado de donante vivo.
En esta población debemos de considerar ciertas peculiaridades. En primer lugar, la causa de la insuficiencia renal es distinta a la del adulto: en población pediátrica las causas más frecuentes son las anomalías estructurales (principalmente la uropatía obstructiva y el reflujo vesicoureteral) y las displasias renales quísticas / hereditarias. De esta manera los problemas urológicos, especialmente aquellos que afectan el tracto urinario inferior, representan un problema sobreañadido. Generalmente son niños en los que se realiza intervenciones previas, debiendo habitualmente tomar medidas específicas antes y después del trasplante [3] [4] [5].
Otro hecho importante es la edad y el desarrollo pondoestatural, que normalmente se encuentra afectado debido a la ERCT. Esto supone problemas de espacio en niños pequeños e injertos de adulto (riñones grandes), por lo que es muy importante una perfecta planificación quirúrgica, seleccionando correctamente tanto al donante como al receptor.
En edad pediátrica no tenemos problemas de arterioesclerosis, pero en cambio nos podemos encontrar con problemas de malformaciones vasculares que requerirán de estrategias quirúrgicas distintas, como la realización de un trasplante ortotópico.
Finalmente, un hecho importante son las complicaciones tanto intraoperatorias como postoperatorias. Dicha tasa varía entre las diferentes series y va del 5% al 34%, así como la gravedad de las mismas [6] [7] [8].
Etiología de la enfermedad renal crónica terminal en edad pediátrica
A diferencia de las entidades relacionadas con la ERCT en adultos (nefropatía diabética, hipertensión o poliquistosis renal autosómica dominante, que rara vez causan ERCT en niños), las causas primarias más frecuentes son las anomalías congénitas del riñón y del tracto urinario (CAKUT: Congenital Anomalies of the Kidney and Urinary Tract) en niños pequeños, seguida de las displasias renales quísticas/genéticas y, en tercer lugar, las enfermedades glomerulares, como la glomeruloesclerosis segmentaria y focal, principalmente en adolescentes (datos obtenidos del Registro Pediátrico Español de Insuficiencia Renal –REPIR-) [3] [9] [10]. Las CAKUT son responsables del 30% de las ERCT en los niños [11]. Estas incluyen anomalías del sistema excretor renal: estenosis pieloureteral (EPU), reflujo vésico-ureteral (RVU), estenosis vésico-ureteral (EVU), megauréter, duplicidad renal y del tracto urinario, ureterocele y válvulas de uretra posterior (VUP); anomalías del parénquima renal: hipoplasia o displasia renal, displasia renal multiquística (DRMQ) y agenesia renal; y finalmente, anomalías de posición o migración del riñón: ectopia renal o riñón en herradura [12]. Otras causas importantes en los niños son la disfunción neuropática de la vejiga (consecuencia de problemas de la médula espinal: meningomielocele, tumores) o la disfunción miccional severa (i.e. síndrome de Hinman).
Evaluación urológica pretrasplante
El estudio pretrasplante se debe iniciar lo antes posible, siempre previo al desarrollo de un estadio 5 de ERC (Tasa de Filtrado Glomerular –TFG- estimado < 15 ml/min/1,73 m2). Además de la evaluación nefrológica (metabólica, inmunológica y hematológica), desde el punto de vista urológico debemos descartar malformaciones anatómicas (sobre todo aquellas que afectan a la vejiga) y confirmar la existencia de un reservorio viable de bajas presiones para evitar dañar el nuevo injerto renal y garantizar el mejor resultado tras el trasplante.
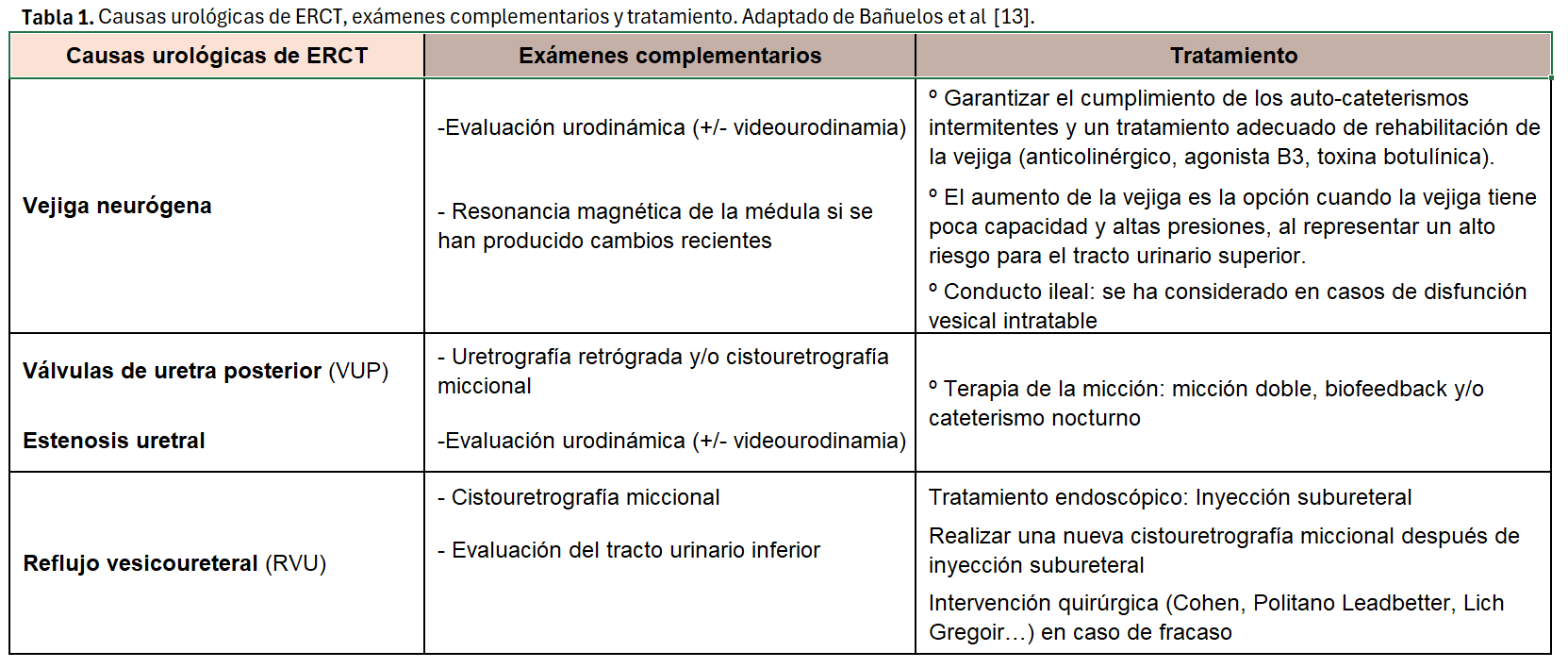
En este sentido, los niños sin anomalías urológicas como causa primaria de la ERCT no requieren de una evaluación urológica exhaustiva. En estos casos, la evaluación del tracto urinario inferior con ultrasonografía urinaria, scores de valoración de sintomatología, y flujometría cuando sea posible, suele ser suficiente para descartar cualquier disfunción subyacente del tracto urinario inferior [13]. Sin embargo, los niños con anomalías urológicas como causa de la ERCT, requieren una evaluación especial y tratamiento específico antes e incluso después del trasplante (Tabla 1). Para el estudio vesical podemos realizar una flujometría con la valoración del residuo posterior. En determinadas ocasiones, además, deberemos realizar un estudio urodinámico que nos informará de la capacidad vesical y alteraciones en su funcionamiento. La cistoscopia y la cistografía, al ser pruebas más invasivas, se reservan para aquellos casos más complejos.
El objetivo es conseguir una vejiga con una capacidad adecuada y de bajas presiones ya que, de lo contrario, esta podría ser perjudicial para el tracto urinario superior. En determinadas ocasiones puede ser necesario el uso de auto-cateterismos intermitentes, para conseguir un vaciado correcto de la vejiga.
Aunque los niños no tengan calcificaciones, es necesario un estudio vascular básico para confirmar la viabilidad de los vasos previo al trasplante. Por ello es necesario realizar una ecografía Doppler para poder determinar un buen flujo arterial y venoso, y descartar malformaciones a nivel del territorio ilio-cavo. En ocasiones puede ser necesario la realización de una resonancia magnética [14].
La nefrectomía bilateral previa al trasplante no está indicada, salvo en determinadas situaciones como una hipertensión no controlada, reflujo con infecciones de repetición, poliuria no controlada, excesiva pérdida salina en riñones nativos displásicos, riñones poliquisticos de gran tamaño [15], riesgo aumentado de tumor de Wilms (síndromes de Denys-Drash o Beckwith-Wiedemann) [16], y cálculos renales no tratados o potencialmente infecciosos (alta carga de cálculos) [17].
Aspectos quirúrgicos específicos del trasplante renal infantil
Tamaño y edad donante - receptor
Aunque no haya un consenso claro en este tema, es bien conocido que la diferencia de tamaño entre el donante y el receptor puede llegar a ser un problema importante y es esencial una correcta selección en cada caso.
Injertos de gran tamaño procedentes de un adulto puede causar un conflicto de espacio en un receptor pequeño en edad, pudiendo causar un síndrome compartimental con un riesgo elevado de retraso en la función del injerto y trombosis vascular.
La discrepancia entre el diámetro de los vasos del donante y del receptor puede ser también problemático, habiéndose atribuido una mayor tasa de trombosis en niños que en adultos, sobre todo cuando se asigna un riñón pequeño de un donante a un receptor pequeño [18]. En el registro de la ESPN/ERA-EDTA se constató que los receptores de edad inferior a 5 años presentaban una peor supervivencia del injerto en comparación con los otros grupos de edad, especialmente cuando recibían un riñón de un donante pequeño (< 5 años) y durante los primeros 3 meses postrasplante, en relación principalmente a complicaciones quirúrgicas. Sin embargo, gracias a la mejora en la técnica quirúrgica y cambios en los protocolos de anticoagulación, la tasa de complicaciones quirúrgicas y el riesgo de trombosis se ha reducido significativamente [19].
Especificaciones técnicas. Abordaje quirúrgico
Técnicamente, el trasplante renal pediátrico es un procedimiento quirúrgico bien estructurado al igual que en el adulto, con algunas pequeñas consideraciones. Dicha técnica varía según la edad y peso del niño y el tamaño del injerto, aunque no hay un consenso para ello.
El trasplante renal se suele colocar en la fosa ilíaca mediante un abordaje retroperitoneal a través de una incisión derecha en forma de J (Gibson) cuando el tamaño del niño y el tamaño del injerto lo permiten. La incisión debe ser del tamaño necesario para poder introducir el riñón.
En niños de poco peso (menos de 15 kg) y/o cuando hay una incongruencia entre el tamaño del riñón y el del niño, es preferible realizar el trasplante por vía transperitoneal a través de una incisión media para abordar la vena cava inferior y la aorta. Algunos equipos abordan los grandes vasos por vía extraperitoneal ampliada, pero la colocación del riñón, sobre todo cuando es de gran tamaño, puede implicar la apertura del peritoneo y la colocación del riñón en la cavidad abdominal si el espacio retroperitoneal es demasiado restringido [20]. El abordaje retroperitoneal permite realizar las anastomosis vasculares a nivel de los vasos ilíacos primitivos o externos, e incluso en la vena cava inferior y la aorta. Con un abordaje transperitoneal, las anastomosis a nivel de la vena cava inferior y la aorta resultan mucho más sencillas.
Un hecho importante en los niños es el crecimiento que experimentarán por lo que muchos grupos recomiendan la realización de las suturas vasculares utilizando puntos sueltos en al menos una de las caras de la anastomosis y no continua como en los adultos. Pero no hay estudios randomizados que confirmen unos mejores resultados con una u otra técnica.
Especificaciones técnicas del trasplante renal transperitoneal
Cuando el trasplante se realiza por vía transperitoneal, hay que tener en cuenta una serie de aspectos técnicos:
- La vía transperitoneal permite la realización de la nefrectomía del riñón nativo cuando este sea demasiado grande o por falta de espacio para el injerto también de gran tamaño.
- Para evitar problemas a nivel del pedículo vascular, como posibles angulaciones y mala perfusión renal es importante colocar el injerto en la posición definitiva, en la fosa lumbar o zona ilíaca antes de realizar las anastomosis vasculares. Una vez colocado en la posición adecuada se cortan los vasos renales en la longitud adecuada, intentando dejarlos lo más cortos posible.
- La anastomosis arterial suele realizarse en el lado anterolateral derecho de la aorta, entre la arteria mesentérica inferior y la bifurcación aórtica. Si la arteria es demasiado larga, es necesario volver a cortarla y realizar una anastomosis arterial sin parche.
- A pesar de estar situado detrás del colon derecho, el trasplante es mucho más móvil cuando se realiza por vía transperitoneal. Por lo tanto, se puede realizar la fijación del injerto al músculo psoas, para ello es necesario mantener la grasa perineal del riñón, y sí evitar pinchar el parénquima renal.
Especificaciones técnicas en caso de anomalías venosas: vena cava inferior y/o venas ilíacas
Cuando la vena cava inferior y/o las venas ilíacas no son permeables, ya sea por una anomalía congénita (agenesia) o adquirida (trombosis del catéter, hipercoagulabilidad, filtro de vena cava, etc.), no permite realizar el trasplante en la posición habitual heterotópica [21] [22]. Por lo tanto, la localización tipo de anastomosis venosa dependerá de la extensión de la trombosis, del tamaño y del tipo de red venosa colateral, pero también de las limitaciones asociadas al abordaje elegido para el trasplante, del tamaño del injerto y de la longitud del uréter del injerto [23].
Cuando el diagnóstico se realiza antes de la cirugía, el abordaje dependerá obviamente de los datos radiológicos, pero puede ser prudente considerar un trasplante renal transperitoneal a través de la línea media, que permitirá realizar todo tipo de anastomosis venosas (sistémicas y portales), especialmente cuando el niño es pequeño. Sin embargo, obviamente es posible utilizar un abordaje quirúrgico extraperitoneal cuando se ha establecido un diagnóstico de trombosis de la vena cava inferior antes del trasplante y existe un flujo normal de la vena ilíaca externa en el eco-doppler [24].
Por el contrario, si la trombosis venosa se objetiva durante un trasplante renal a través de una incisión pararrectal vía extraperitoneal, la incisión ilíaca derecha se ensanchará hacia arriba hasta localizar una zona de drenaje venoso adecuado. La anastomosis arterial puede entonces realizarse sobre la arteria ilíaca primitiva si la longitud del pedículo y la posición del riñón lo permiten, o directamente sobre la aorta [25] [26].
En casos excepcionales en niños, puede realizarse un trasplante renal izquierdo-ortotópico, con una anastomosis venosa terminal a la vena renal y una anastomosis arterial utilizando la arteria esplénica o la aorta. En ciertos pacientes de edad pediátrica con síndrome de vena cava inferior los riñones se han revascularizado usando la vena renal propia del paciente y la arteria ilíaca externa con la interposición de injertos vasculares, debido sobre todo a malformaciones vasculares. Dichas series realizan el trasplante ortotópico en ambos lados, utilizando en el lado derecho la arteria renal, la aorta o injertos vasculares para la revascularización del riñón [27] [28].
Por último, cuando la vena cava es totalmente inutilizable, puede utilizarse el sistema portal para desviar el efluente venoso del trasplante renal. Se han descrito varias técnicas de derivación portal:
- Anastomosis venosa directamente en la vena porta [29].
- En la derecha, anastomosis venosa directamente a la vena mesentérica inferior del receptor y anastomosis arterial directamente a la aorta.
- En la izquierda, anastomosis venosa directamente a la vena esplénica o en la vena mesentérica superior y anastomosis arterial directamente a la aorta o a la arteria esplénica [20] [30].
Especificaciones técnicas de las anastomosis urinarias
El tipo de anastomosis urinaria dependerá de la posición del trasplante, la longitud del uréter del injerto, el tamaño del receptor, la presencia o ausencia de uréteres y la causa de la ERCT [20]. Cuando el trasplante se sitúa en la parte alta de la cavidad abdominal, se prefiere la anastomosis pieloureteral utilizando el uréter propio. Por otra parte, si la causa de la ERCT son anomalías del sistema excretor renal (EPU, RVU, EVU, megauréter…), no puede utilizarse la vía excretora nativa y debe realizarse una anastomosis vesicoureteral. Existen dos tipos de reimplante vesico-ureteral, el extravesical (Lich Gregoire) o intravesical (Lead Better Politano), que se usan tanto en el niño como en el adulto. Realizar un reimplante extravesical requiere colocar un catéter “doble J”, que requerirá de una segunda anestesia para su extracción.
Resultados y complicaciones quirúrgicas tras el trasplante renal pediátrico
Existen datos suficientes que reflejan los excelentes resultados del trasplante de riñón en edad pediátrica, aunque la supervivencia de los pacientes y de los injertos varía entre las distintas series. En Norteamérica el “North American Pediatric Renal Transplant Cooperative Study” notificó una supervivencia del injerto a 5 años del 86,50% en receptores de donante vivo y del 83,2% en receptores de donante fallecido [31]. En Europa, las series mostraron tasas de supervivencia del injerto del 85,5% a los 5 años, del 71,1% a los 10 años y del 62,1% a los 15 años. La supervivencia global del injerto a los 5 años es del 90% para la RT de donante vivo y del 70% para la RT de donante cadáver [32] [33].
Como hemos visto, el trasplante renal infantil es una cirugía difícil con características y complicaciones especiales, sobre todo en receptores de bajo peso (<15kg) [19]. Estos pacientes corren el riesgo de sufrir síndromes compartimentales abdominales y dificultades de cierre de la pared abdominal cuando se utilizan injertos grandes procedentes de adultos. Los injertos también presentan un mayor riesgo de trombosis vascular e hipoperfusión debido a la disparidad en el calibre de los vasos y a un flujo sistémico inferior al necesario en el receptor para conseguir una función adecuada del trasplante. Recientemente, Wang et al [34] notificaron una incidencia acumulada del 1,5% de pérdida del injerto en el primer año secundaria a trombosis vascular en un amplio estudio retrospectivo del US Renal Data System. Sin embargo, también objetivaron una reducción de la pérdida del injerto debido a trombosis entre los años 1995 y 2014 gracias a la mejora de las técnicas quirúrgicas y médicas. Actualmente, las complicaciones más frecuentes tras el trasplante renal pediátrico son las urológicas: fístula de orina, obstrucción urinaria (estenosis o compresión de la anastomosis), urolitiasis y RVU. Recientemente, Martinez Urrutia y cols. han objetivado de una tasa de complicaciones urológicas del 9,5% tras el trasplante renal pediátrico [35]. El síndrome compartimental del injerto renal es una entidad infrecuente pero peligrosa que puede conducir a una disfunción precoz del injerto y a la pérdida del injerto [36]. Una de las principales causas de síndrome compartimental del injerto renal en el trasplante infantil es la compresión del parénquima renal o de los vasos renales debido al espacio limitado y al cierre hermético de la pared abdominal, que suele ser consecuencia de la discrepancia de tamaño entre el donante y el receptor [37] [38].
Novedades en el trasplante pediátrico
En los últimos años se ha producido grandes avances en las técnicas de imagen y la técnica quirúrgica con la introducción del robot.
Gracias al avance en imagen e impresión de modelos en 3D podemos realizar un modelo específico para cada paciente previa a la intervención y planificar de esta forma cirugías complejas con una mayor precisión. Una situación tributaria a este tipo de planificación, serían los casos de trasplantes en niños pequeños (<15kg) permitiendo de esta forma confirmar la viabilidad del mismo. En este sentido podemos encontrar varios casos publicados en la literatura, concretamente el grupo de Chandak y Cols, que ha utilizado el modelo de impresión 3D en tres casos de trasplante de donante vivo con muy buenos resultados [39]. Otro tema importante es la cirugía robótica que ha permitido la realización de trasplantes robóticos de vivo con buenos resultados [40]. Dicha técnica también se ha usado en niños de forma satisfactoria, pero en esta población se añaden dos grandes dificultades: el menor espacio a nivel abdominal y el bajo volumen de sangre circulante. El primer trasplante infantil robótico fue realizado en Bélgica por Decaestecker en 2019 en un niño de 8 años concluyendo que era viable y seguro [41]. Recientemente se ha publicado una serie que compara el trasplante renal abierto y robótico en niños, en el que objetivaron un menor dolor post-operatorio con buenos resultados funcionales [42]. Es importante destacar que el trasplante renal robótico se debe realizar en aquellos centros con experiencia suficiente para ello.
Conclusiones
El trasplante renal en edad pediátrica es el tratamiento de elección al igual que en el adulto. En estos pacientes debemos hacer una correcta selección entre el donante y el receptor para evitar problemas a nivel de espacio durante la intervención. Las nuevas tecnologías de imagen e impresión 3D permiten planificar mejora la cirugía. La utilización de la cirugía robótica ha demostrado ser factible y con buenos resultados siempre y que se realice en centros especializados.