Alteraciones Nutricionales en la Enfermedad Renal Crónica (ERC)
Palabras clave
Desnutrición, Sobrepeso, Obesidad, parámetros antropométricos, desgaste energetico-proteico, DEP, PEW, Nutrición en DIálisis
Introducción y definiciones
Valoración del estado nutricional
Historia clínica
Encuesta dietética
Parámetros bioquímicos
Parámetros antropométricos
Perfil nutricional en la ERC
Circunstancias favorecedoras del desgaste energético proteico y desnutrición
Circunstancias favorecedoras del sobrepeso y obesidad
INTRODUCCIÓN Y DEFINICIONES
La Enfermedad Renal Crónica (ERC) es un estado patológico de acumulación de productos del metabolismo celular, que ocasionan un disbalance en el organismo, aumentando los riesgos para la salud del enfermo. En este sentido, la nutrición juega un papel relevante en esta enfermedad crónica. El libro publicado por Kopple JD y col en 2012 y las Guías de práctica clínica analizan en profundidad las alteraciones nutricionales en la ERC y su impacto sobre la morbimortalidad [1] [2].
El concepto de malnutrición engloba tanto los problemas derivados del déficit como del exceso de ingesta de nutrientes. No debe considerarse sinónimo de desnutrición. Este concepto hace referencia, a las deficiencias en los marcadores bioquímicos y/o antropométricos de las reservas de nutrientes; y a las complicaciones derivadas de estas. Por lo tanto, el concepto de desnutrición debemos usarlo con cautela, y reservarlo para aquellos casos en que el estado funcional del organismo aparece comprometido.
Clásicamente, en el ámbito poblacional, se describen 2 tipos de desnutrición.
1. Marasmo o desnutrición calórica: es la consecuencia de un aporte calórico insuficiente durante la evolución de una enfermedad crónica. Existe una importante pérdida de peso, masa muscular y grasa subcutánea. Las proteínas viscerales están conservadas.
2. Kwashiorkor o desnutrición proteica: es la consecuencia de un déficit proteico visceral debido a un proceso agudo intercurrente que activa moléculas pro-inflamatorias y reactantes de fase aguda. Hay un descenso de la producción y una activación del catabolismo proteico que conducen a una situación de hipoalbuminemia.
Más recientemente se han acuñado nuevas definiciones para los déficits nutricionales, con frecuencia observados en la ERC [3] [4] [5] [6] [7] [8] y que se describen más adelante.
En el otro extremo del espectro, nos encontramos las consecuencias del exceso de ingesta de nutrientes. Con la creciente prevalencia del síndrome metabólico y la diabetes en la población general [9] [10]; y siendo esta última la principal causa de ERC terminal; el sobrepeso y la obesidad se han convertido en un problema mórbido relevante en la ERC [11] [12] [13] [14] [15].
VALORACION DEL ESTADO NUTRICIONAL
La limitación en la valoración del estado nutricional deriva, en parte, en que no existe un marcador fiable y precoz. Por lo tanto, esta valoración no debe ser un procedimiento estático. Las guías K/DOQI y las guías europeas realizan una profunda revisión de este tema [1] [2].
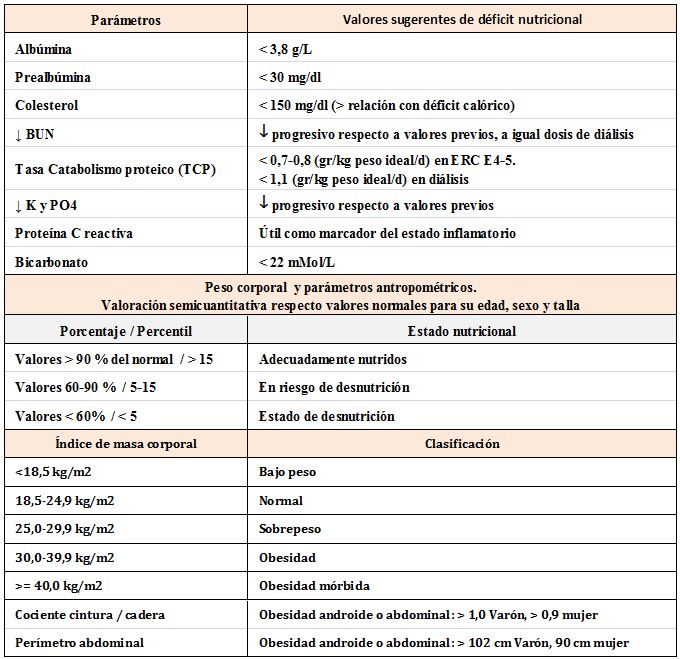
En la (Tabla 1) se resumen sugerencias prácticas para la evaluación nutricional del paciente renal. En la (Tabla 2) se describen los indicadores más frecuentemente empleados en la valoración del estado nutricional y los criterios de déficit en el paciente renal.
Historia clínica general
La entrevista clínica del paciente nos proporcionará información sobre su estado nutricional presente y pasado. La presencia de otras enfermedades puede en el estado nutricional del paciente: diabetes, enfermedades gastrointestinales, neurológicas, alcoholismo... Asimismo, debemos incluir: hábitos tóxicos, antecedentes quirúrgicos y hospitalizaciones, anamnesis dirigida hacia síntomas y signos específicos relacionados con la alimentación (nauseas, vómitos, anorexia, pérdida de peso...), síntomas depresivos, procesos intercurrentes actuales y hábitos dietéticos. Es también relevante realizar una entrevista psicosocial donde valoremos la educación, estilo de vida, nivel económico...
Encuesta dietética
Las guías K/DOQI [1] recomiendan el registro dietético para medir la ingesta de proteínas, calorías y nutrientes; y como ayuda para identificar ingestas inadecuadas. La credibilidad de los datos recogidos en las encuestas se ha puesto en entredicho, aunque la declaración de la ingesta en series publicadas en países y áreas geográficas distintas, resulta bastante similar. Sin embargo, no aporta información sobre el estado nutricional del enfermo, ni se correlaciona con el perfil antropométrico de los pacientes estables. Existen 3 métodos bien definidos para evaluar la ingesta de los pacientes con ERC [16] [17] [18]:
Registro dietético de 24 horas: Se realiza una entrevista donde se recoge la ingesta realizada durante las 24 horas previas a la misma. La principal ventaja de este método es la rapidez en su realización y el fácil recuerdo de la ingesta por el paciente. Este método extrapola la ingesta de un día como la ingesta habitual del sujeto. Poco útil en pacientes en hemodiálisis, donde la ingesta varía de un día a otro.
Diario dietético: Deben de ser recogidos durante 3-7 días, incluyendo un día de hemodiálisis si es el caso y un día de fin de semana. Para su correcta interpretación, es preciso hacer una entrevista nutricional que analice el registro. Los programas informáticos ayudarán a calcular la composición de los alimentos a partir de tablas estándar. Las limitaciones fundamentales incluyen la adherencia a las instrucciones dadas para su implementación, olvidos en el registro de ciertos alimentos y la imposibilidad de detectar variaciones estacionales en la ingesta.
Cuestionario de frecuencia.
Se trata de un cuestionario dietético que puede realizar el paciente por sí mismo o con la ayuda de un nutricionista. Se compone de una serie de alimentos habituales en el consumo, especificando mediante preguntas la frecuencia y la cantidad de la ingesta realizada en los últimos 6 a 12 meses. Se estima la cantidad ingerida multiplicando la frecuencia por la cantidad específica para la medida aportada. La principal ventaja de este método es la posibilidad de abarcar un periodo más largo de ingesta, por lo que son muy útiles en estudios epidemiológicos, más limitado en la evaluación individual o de un grupo pequeño de sujetos.
Parámetros bioquímicos
Los parámetros bioquímicos están representados fundamentalmente por las proteínas séricas. Pueden estar influenciados por factores no nutricionales por lo que se consideran poco específicos del estado nutricional y suelen ser tardíos [2].
Albúmina: es el parámetro más difundido como indicador del estado nutricional [19] [20]. Al ser un reactante de fase aguda sus valores están influenciados por los estados inflamatorios agudos. Su vida media es de 20 días. La hipoalbuminemia, aunque es un marcador tardío e inespecífico de desnutrición, se ha señalado como un factor independiente de mortalidad en hemodiálisis [21] [22]. De determinación sencilla y económica, es el más empleado en estudios observacionales.
Prealbúmina: es considerada una proteína de trasporte con una vida media corta (2-3 días), concentración plasmática baja y tasa catabólica constante, lo que la hace útil para evaluar el estado nutricional. Su interés radica en su utilidad como marcador nutricional inmediato y como indicador de la función hepática y de fase aguda [23].
Proteína C reactiva (PCR): se asocia a procesos inflamatorios; es un parámetro complementario determinante en la valoración del estado nutricional. Su incremento se relaciona la inflamación sistémica, la aterosclerosis y la morbi-mortalidad, sobre todo de origen cardiovascular.
Bicarbonato: La concentración de bicarbonato o CO2 total, también puede utilizarse como indicador complementario del estado nutricional en ERC cuando el FG es < 60 ml/ min. Los niveles bajos de bicarbonato son indicativos de acidemia y están asociados con degradación proteica e hipoalbuminemia además de su acción sobre el hueso. La Guías KDIGO recomiendan mantener los niveles de bicarbonato = 22 mMol/L [24].
Otros: Determinaciones rutinaria, como BUN, creatinina, perfil lipídico, fósforo y potasio sérico son útiles ya que su descenso, sin cambios en la dosis de diálisis o fármacos, nos sugieren una reducción de la ingesta de nutrientes. Asimismo, parámetros séricos como la transferrina, la proteína ligada al retinol, el complemento, la concentración de aminoácidos, etc., son inespecíficos y no han ganado adeptos para su uso en la práctica clínica habitual.
Cinética de la urea
El modelo cinético de la urea se ha empleado para estimar la ingesta proteica en pacientes estables a través de la tasa de catabolismo proteico.
La tasa de catabolismo proteico (TCP) (nPCR: protein catabolic rate, o también conocido como nPNA: protein nitrogen appearance, ambos en nomenclatura anglosajona) se correlaciona con la ingesta proteica en pacientes estables (no en anabolismo o catabolismo). Se calcula en función de la eliminación de nitrógeno (N) urinario en la ERCA; o en función del incremento de BUN en el periodo interdiálisis [24] [25] [26] [27] y ajustando para el peso ideal del paciente. Sus valores de referencia deberían ser las recomendaciones de ingesta proteica para el estadio de ERC correspondiente.
En la (Tabla 3) se describen ecuaciones habituales para estimar la ingesta proteica en pacientes con ERCA, en hemodiálisis (HD) o en diálisis peritoneal (DP).
Parámetros antropométricos
Los parámetros antropométricos [28] [29] [30] [31] proporcionan información acerca de las reservas de energía y de proteínas; son útiles para estudios epidemiológicos y para seguimiento en el tiempo con mediciones seriadas; siempre que sean debidamente estandarizados. La información obtenida se interpreta en base a patrones establecidos en la población general o en subgrupos específicos. Los resultados deben analizarse con precaución, dado que están influenciados por factores distintos a la ingesta de nutrientes, como factores demográficos (edad, sexo) o metabólicos (resistencia a la insulina, diabetes, sedentarismo, etc.) que son los principales determinantes de la antropometría. El déficit de ingesta debe ser prolongado para que afecte a estos parámetros.
En pacientes en hemodiálisis debe considerarse el peso postdiálisis y es muy importante la ganancia de peso entre diálisis.
Peso corporal
El peso ideal o estándar es el relativo a las tablas estandarizadas para la población con la misma edad, sexo y talla. También la fórmula de Lorrentz que es antigua y probablemente infra estima el peso, permite estandarizar los valores:
Peso ideal (mujer)= altura (cm) -100 ((altura (cm)-150) / 2)
Peso ideal (hombre)= altura (cm) -100 ((altura (cm) -150) / 4)
Cuando están entre 60-90% del normal o percentil 5-15 se considera riesgo de desnutrición, y cuando están por debajo del 60% del normal o percentil < 5 se considera desnutrición.
Se pueden emplear otros métodos que permiten valorar el peso ideal:
Para determinar los requerimientos energéticos sobre todo si existe sobrepeso se puede emplear la fórmula del peso ajustado:
Peso ajustado=peso (kg) + (peso ideal - peso real (kg)) x 0.2
Altura
Los pacientes deben medirse sin zapatos, empleando un calibrador de altura, al menos una vez al año. En pacientes ancianos o amputados se puede calcular la altura midiendo la distancia (d) entre la cadera y la rodilla (en cm.)
Altura mujer (cm)= 84.88-0.24 x edad + 1.83 x d
Altura hombre (cm)= 64.19 -0.004 x edad + 2.02 x d
Índice de Masa Corporal (IMC, o de Quetelet)
Se calcula mediante la fórmula: Peso (Kg)/talla (m2)
Se considera un indicador del compartimiento graso, pero en sí mismo no especifica el estado nutricional del enfermo. La interpretación de su rango de valores según el Comité de Expertos de la OMS se muestra en la (Tabla 2). Un IMC inferior a 23 kg/m2 en los pacientes en tratamiento sustitutivo renal ha sido asociado a mayor mortalidad [5].
Cintura/cadera
La circunferencia de la cintura se mide con el paciente de pie, tomando como referencia la mitad de la distancia entre el margen costal inferior y la cresta iliaca, con cinta métrica inextensible. La circunferencia de la cadera se medirá a la altura de los trocánteres mayores y se tomara la circunferencia mayor. El cociente cintura/cadera mayor de 1 en el varón o mayor de 0,90 en la mujer es indicativo de obesidad androide o abdominal y se relaciona con el síndrome metabólico y mortalidad cardiovascular.
Perímetro abdominal
Se mide mediante una cinta métrica inextensible y con el paciente en sedestación, localizando el punto intermedio entre el margen costal y la cresta iliaca, con cinta métrica inextensible. Un perímetro abdominal mayor de 90 mm en la mujer y de 102 mm en el varón será indicativo de obesidad androide la cual se relaciona con el síndrome metabólico y la mortalidad cardiovascular. Una fuerte asociación se ha establedico entre el aumento del perímetro abdominal y el riesgo cardiovascular en ERCA y diálisis [32] [33].
Pliegues
Los pliegues se miden con un caliper tipo Harpenden: se coge firmemente entre el dedo gordo y el índice el pliegue compuesto por: piel-grasa subcutánea-piel. Para asegurarse de que no se coge fascia ni musculo, debemos provocar la contractura del musculo subyacente. El caliper se aplica por debajo de la pinza hecha con los dedos. Los pliegues deben medirse por triplicado y en caso de pacientes en HD tras la sesión, tomando como valor final la media de las tres medidas.
Pliegue del tríceps: con el individuo en bipedestación se mide el punto medio entre el acromion y el olecranon, en el brazo contrario al acceso vascular.
Pliegue bicipital: se mide por la cara anterior del brazo, tomando el pliegue en vertical por encima de la fosa cubital, al mismo nivel que el pliegue tricipital.
Pliegue subescapular: se mide justo por debajo y lateralmente al Angulo de la escapula con el hombro relajado.
Pliegue abdominal: se mide a la altura de la línea medio axilar justo por encima de la cresta iliaca en dirección oblicua.
Perímetros: la medida de la circunferencia del brazo (CB, en cm) se realiza con una cinta métrica inextensible en el punto medio entre el acromion y el olecranon, sin comprimir ni distorsionar el contorno del brazo, y utilizando el mismo brazo que para la determinación del pliegue tricipital.
Los siguientes parámetros se obtienen mediante la combinación del pliegue tricipital (PT) y el perímetro braquial, según la fórmula:
• Circunferencia muscular del brazo (cm): CB-(μ*PT cm).
• Área muscular del brazo (cm2): (CB - μ*PT cm)2/4μ.
• Área adiposa del brazo (cm2): (PT * CB)/2 - (μ*PTcm2 / 4).
• Porcentaje de grasa corporal (%GC) (80): se estima a partir de los 4 pliegues (bíceps, tríceps, subescapular y suprailíaco) y del peso corporal. Fórmula:
1º: X= Log (suma de los 4 pliegues en cm)
2º: Densidad (d): Varones: 1,161 - 0,0632 * X
Mujeres: 1,158 - 0,0720 * X
3º: Porcentaje de Grasa Corporal (%GC)= (4,95/d - 4,5) * 100
Estos resultados absolutos, deben analizarse como porcentaje, percentil o Z score, respecto a los valores normales para su edad, sexo y talla. El empleo de los percentiles es recomendable para el estudio de una población relativamente bien nutrida, donde haya pocos pacientes con valores extremos, como es el caso de la población de diálisis. De esta forma tampoco se introducen errores si los datos no tienen una distribución normal.
Escalas de valoración nutricional
Son de fácil uso, de escaso coste y pueden ser utilizados por cualquier profesional sanitario. Steiber A. et al han realizado una excelente revisión y actualización de las escalas de valoración nutricional [32] [33].
Valoración global subjetiva (SNGA Subjective Nutritional Global Assessment)
Es un método sencillo de cribado nutricional que combina características subjetivas y objetivas de la historia clínica. Este modelo tiene en cuenta 5 parámetros de la historia clínica (pérdida de peso, ingesta dietética, síntomas gastrointestinales, capacidad funcional relacionada con los requerimientos nutricionales) y 3 componentes del examen físico (signos de pérdida de masa muscular, edema y ascitis), siendo razonablemente validado en la población en hemodiálisis [34].
Posteriormente a la descripción original, se han publicado numerosas variantes, con objeto de mejorar el valor predictivo del estado nutricional [33] [35] [36] [37] [38] [39] [40].
Escala de desnutrición para pacientes en diálisis (DMS Dialysis Malnutrition Score)
Esta escala ha demostrado una mejor correlación con otros parámetros nutricionales que la VGS, al incluir dentro de las variables la comorbilidad asociada al tiempo en diálisis [38] [39].
Escala de desnutrición-inflamación (MIS Malnutrition Inflamation Score)
Escala desarrollada para la identificación precoz de estados de desnutrición-inflamación. Numerosos estudios han establecido una relación entre el MIS y parámetros nutricionales, estado inflamatorio y mortalidad. Se trata de un cuestionario validado para la población en diálisis que está compuesto por 10 componentes, cada uno de ellos con una valoración de 0 a 3: cambio de peso, apetito, síntomas gastrointestinales, capacidad funcional relacionada con factores nutricionales, comorbilidades incluyendo años en diálisis, pérdida de grasa subcutánea, masa muscular, BMI, albúmina sérica, capacidad total de fijación del hierro. La puntuación máxima es de 30 puntos [8] [39].
Dada la variabilidad de los datos publicados, ninguna puede ser considerada el patrón oro para la valoración nutricional del paciente renal, por lo cualquiera de estos métodos pueden ser útiles en la valoración clínica del estado nutricional valorados en conjunto con las determinaciones antropométricas, laboratorio e ingesta dietética [33].
Determinación de la composición corporal total
Se han descrito varias técnicas de complejidad variable para la estimación de la composición corporal total; éstas se consideran más precisas, pero a su vez más sofisticadas y costosas que la antropometría clásica. Las guías europeas de nutrición [2] recomiendan herramientas como la bioimpedancia eléctrica y la absorciometría de rayos X de doble energía corporal total (DEXA), aunque aún se mantienen bajo el ámbito experimental. Se podría usar otras técnicas de imágen como TAC o RMN para medir de forma cuantitativa la composición corporal pero son métodos caros y que generan radiación al paciente.
Bioimpedancia eléctrica
El análisis de la bioimpedancia permite cuantificar los distintos compartimentos del cuerpo humano y proporciona información útil para valorar el estado de hidratación y nutricional de los pacientes en diálisis. Se basa en el principio de que los tejidos biológicos se comportan como conductores y/o aislantes de la corriente eléctrica dependiendo de su composición. Las soluciones electrolíticas de los tejidos blandos son óptimos conductores, mientras que el hueso se comporta como aislante. Se trata de un método de fácil manejo y cada vez más asequible por lo que su uso se está extendiendo. Las mediciones que el monitor realiza se obtienen a través de señales eléctricas (resistencia, reactancia y ángulo de fase) del cuerpo humano y que utiliza, junto con otros parámetros (peso, talla, edad y sexo), para calcular volúmenes y masas corporales. Los sistemas de mayor uso son la bioimpedancia multifrecuencia espectroscópica (BIS) y la bioimpedancia monofrecuencia vectorial (BIVA). La bioimpedancia multifrecuencia hace posible discernir entre el contenido de agua intra y extracelular, incrementando su valor diagnóstico respecto a los modelos monofrecuencia, sobre todo en cuanto a la hidratación corporal. La medición debe realizarse con el paciente durante al menos 10 minutos en decúbito supino, colocando los dos pares de electrodos en muñeca y tobillo del hemicuerpo (libre de acceso vascular). El software del sistema mide la resistencia, reactancia, ángulo de fase, porcentaje de agua extracelular, masa grasa, masa magra, y masa celular corporal. En el caso de pacientes en hemodiálisis o diálisis peritoneal debe realizarse entre dos sesiones de hemodiálisis o tras drenaje del líquido peritoneal respectivamente [41].
Esta técnica, aunque su uso va ganando adeptos en centros de diálisis, aún no se han estandarizado las recomendaciones para la práctica clínica cotidiana. En cuanto al estado nutricional dado que usa la estimación del contenido de agua en el cálculo de la masa muscular, por tanto, el volumen podría influenciar en los resultados obtenidos.
DEXA (Absorciometría de Rayos X de doble energía corporal total)
Se trata del gold standard para la determinación de la composición corporal. Este método ha sido validado para la población con ERC y diálisis [42] [43].
Gasto energético basal (GEB)
El GEB se calcula para optimizar los requerimientos calóricos en función de parámetros antropométricos sencillos [44]. La formula de Harris Benedict se emplea clásicamente, para estimar de forma práctica y razonablemente precisa el GEB.
Hombres: 66 + (13,7 x peso [kg]) + (5,0 x talla [cm]) - (6,8 x edad [años]).
Mujeres: 655 + (9,6 x peso [kg]) + (1,7 x talla [cm]) - (4,7 x edad [años]).
Este resultado debe multiplicarse por un factor de corrección correspondiente al grado de actividad del sujeto, para obtener el gasto energético total (GET). Aunque existen tablas más completas, un esquema práctico es el siguiente:
Sedentario: GEB x 1,3
Actividad leve: GEB x 1,5
Actividad moderada: GEB x 1,75
Actividad intensa: GEB x 1,75-2
El cociente entre las kilocalorías ingeridas y el GET nos da información de las ingesta energética en relación a las necesidades del sujeto, que idealmente debe ser mayor de uno. En pacientes en HD crónica se ha demostrado que el GEB es un 5-15% superior que en los sujetos sanos.
FACTORES DETERMINANTES DEL ESTADO NUTRICIONAL
El perfil nutricional en la ERC viene determinado por factores previos al estado urémico, circunstancias relacionadas con la enfermedad de base y sus complicaciones, factores genéticos, ambientales, procesos agudos coexistentes y otros relacionados con el tratamiento sustitutivo renal si es el caso.
Circunstancias favorecedoras del desgaste calórico-proteico y de desnutrición
El balance calórico-proteico puede hacerse negativo por disminución de la ingesta de nutrientes, o por incremento del catabolismo proteico. Este último viene favorecido por las diferentes alteraciones hormonales y metabólicas asociadas a la ERC, la acidosis metabólica, el estado inflamatorio crónico; así como el tratamiento sustitutivo en sí mismo.La prevalencia de la desnutrición en la ERC oscila en un amplio rango, entre el 12 y 75% según las series (distintas poblaciones con factores epidemiológicos, culturales y hábitos dietéticos distintos) y los diferentes métodos empleados en la detección y monitorización [6] [48] 45]. Por lo tanto, la literatura no ha permitido sacar conclusiones de peso acerca de la verdadera prevalencia de la desnutrición en los pacientes renales.
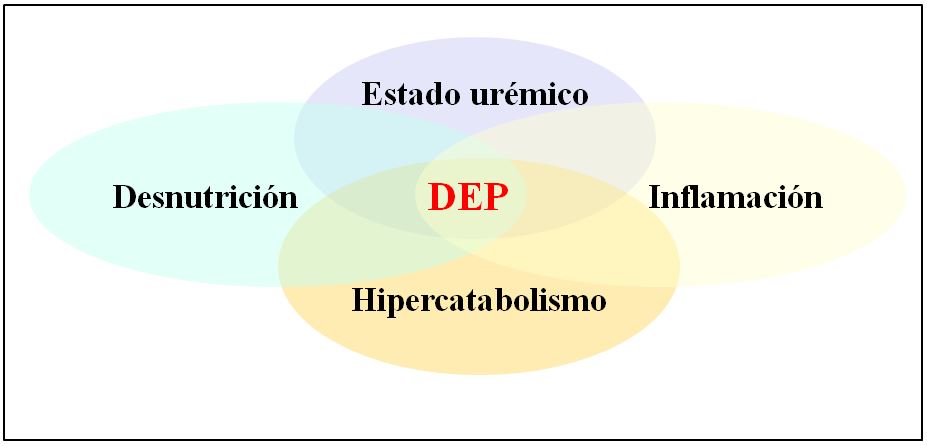
En el paciente urémico existe una relación directa entre la inflamación crónica silente y la desnutrición. Estas patologías convergentes y fuertemente ligadas entre si se han definido como síndrome MICS (Malnutrition-Inflammation Complex syndrome) o síndrome MIA (Malnutrition-Inflammation-Atherosclerosis), ya que influyen de forma notable en la aceleración del proceso arterioesclerótico y en la morbimortalidad cardiovascular del paciente en diálisis [3] [[4] [6] [7] 8] [39] [45] [46] [47] [48] [49]. De hecho, durante la sepsis o estados febriles se produce la activación de citoquinas proinflamatorias que producen supresión del apetito, proteolisis muscular, hipoalbuminemia, desnutrición y aterosclerosis.
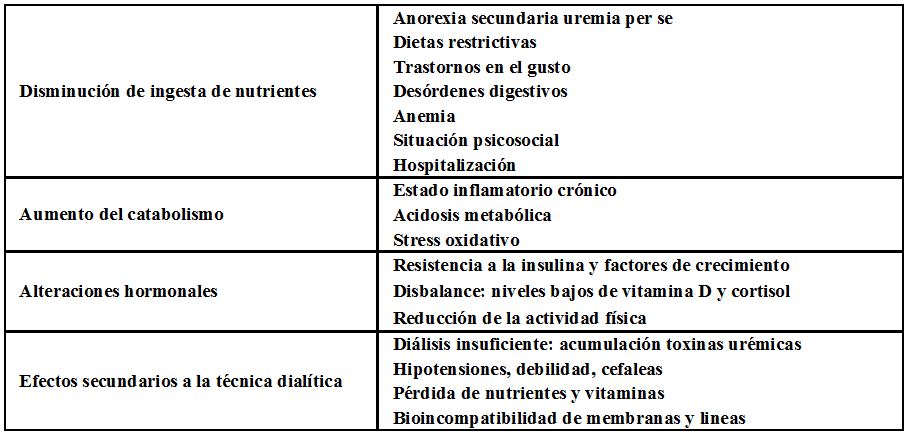
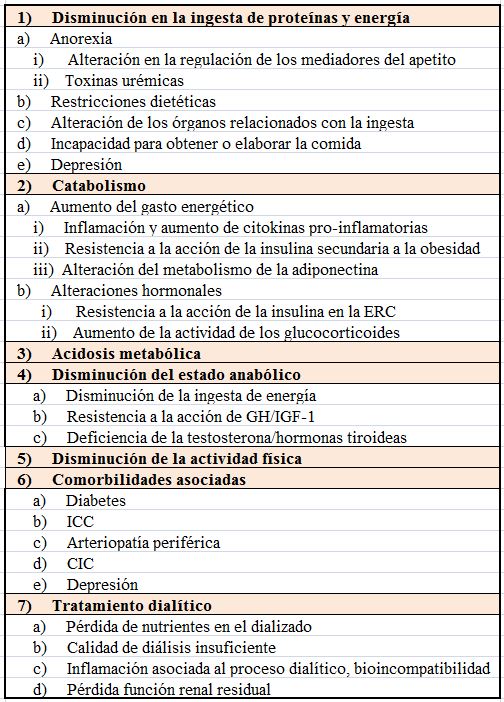
En el año 2008 la Sociedad Internacional de Nutrición Renal y Metabolismo (ISRNM) [5] decidió unificar estos síndromes, bajo el concepto protein-energy wasting (PEW) syndrome o su equivalente en español desgaste energético-proteico (DEP) [5] [48] [49]. Este término se define como un estado patológico en que se asocia un déficit de las reservas energéticas y proteicas y un estado hipercatabólico, situación frecuente en el paciente renal complicado. Las causas determinantes del DEP se ilustran en la (Tabla 4) [50]. Se ha demostrado que la DEP es un factor de riesgo cardiovascular, de infección y globalmente, de morbimortalidad en el enfermo renal [6] [7] [39] [51] 52].
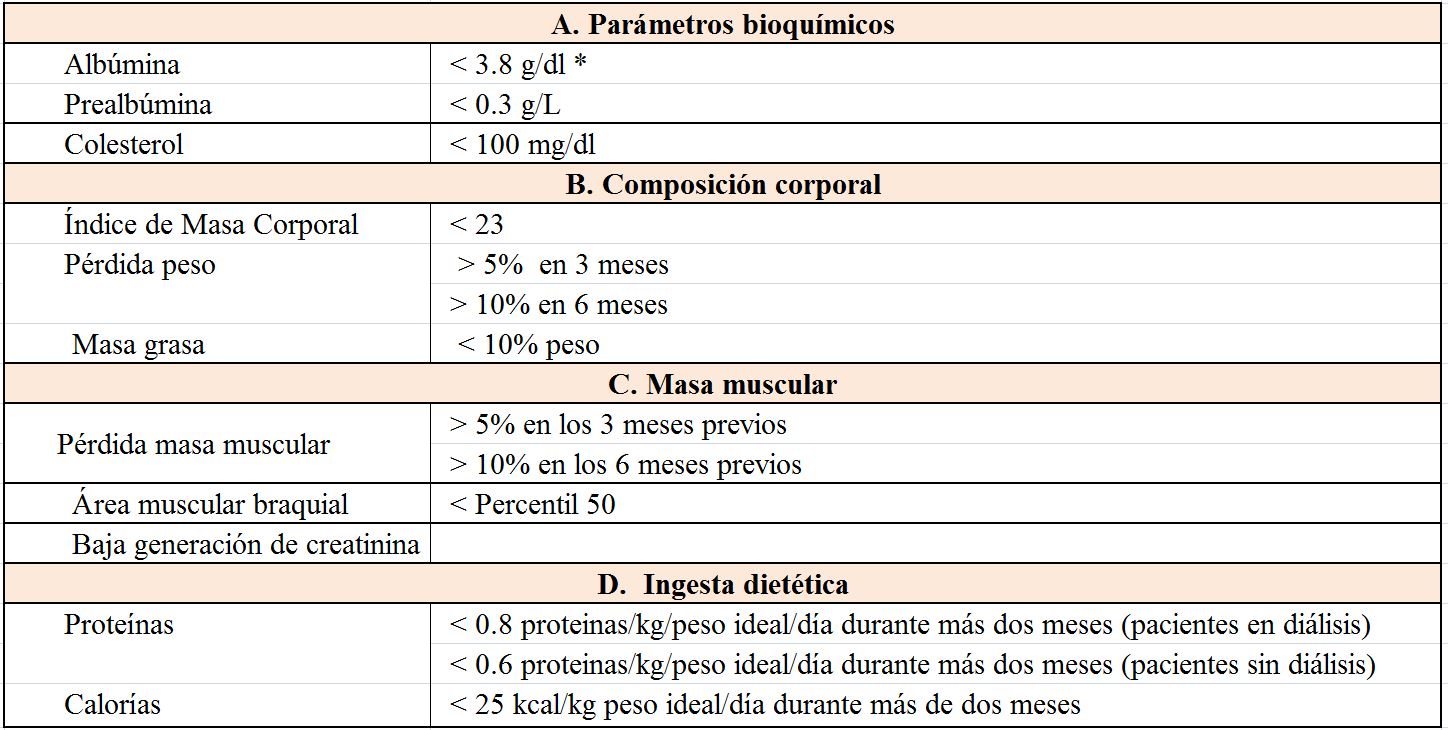
Se han establecido una serie de criterios diagnósticos empíricos de PEW, clínicos, bioquímicos y de composición corporal (Tabla 5) Cada parámetro se debe confirmar al menos 3 veces en un periodo de separación de 2-4 semanas. Sin embargo los criterios no han sido validados aún para el diagnóstico ni han demostrado su implicación en cuanto a su utilidad clínica [5] [48]. Por lo tanto, de forma orientativa mantenemos los valores descritos en la (Tabla 2) como sugerentes de DEP.
En la (Figura 1) se ilustra la confluencia de circunstancias determinantes del DEP en la ERC [50]: insuficiente ingesta calórico-proteica, estado hipercatabólico, acumulación de toxinas urémicas, procesos inflamatorios intercurrentes. En la (Tabla 6) se describen los factores de riesgo de DEP en la ERCA y en diálisis. Los más destacados se desarrollan a continuación:
Anorexia
Este es el síntoma determinante de la reducción de la ingesta, su prevalencia se ha descrito en torno al 35-50 % en pacientes en diálisis e influye de manera notable en la morbimortalidad y calidad de vida del enfermo renal [7] [53]. Habitualmente, de etiología multifactorial [54] [55] [56] [57] va ligada a otras complicaciones de la ERC (problemas gastrointestinales, alteración de hormonas reguladoras del apetito, inflamación) e incluso a la pérdida de nutrientes en el proceso dialítico (aminoácidos, vitaminas..). Además, existen causas atribuibles a esta situación, por ejemplo: el empleo de dietas muy restrictivas para controlar otros factores (potasio, fósforo...), no estando la mayoría de las veces elaboradas por profesionales expertos en esta materia [58].
Los mecanismos que influyen en la regulación del apetito son muy complejos y no del todo bien entendidos. Tanto factores psico-sociales y culturales como biológicos han sido relacionados. La anorexia en la ERC se ha asociado a la retención de moléculas reguladoras del apetito (péptido PYY, grelina..), diversas citokinas (TNF, IL-6...) y hormonas (leptina). La alteración de órganos implicados en la ingesta (cavidad bucal o tracto gastro-intestinal) tiene su papel relevante en este sentido condicionando, por ejemplo, alteraciones en la deglución o digestión. Por otro lado, el estado de depresión en estos pacientes ERC se ha relacionado con marcadores inflamatorios (IL-6, PCR) [46] [54] [55] [56].
Aumento del gasto energético
El catabolismo se puede ver incrementado por distintas patologías asociadas a la ERC como el hiperparatiroidismo, la diabetes descompensada y los procesos infecciosos intercurrentes, contribuyendo al estado hipermetabólico existente en el enfermo renal [59].
Inflamación crónica o persistente
Se trata de un estado donde los estímulos pro-inflamatorios están constantemente impulsados. En el caso de la ERC avanzada, existe un aumento de la concentración de citokinas y AGES (productos de glicosilación avanzados) de forma general, debido fundamentalmente a la disminución de la función renal y al aumento en la producción. Esta última se explica por las comorbilidades asociadas (infecciones, alteraciones vasculares, enfermedades subyacentes), la anorexia, el proceso dialítico per se, el catabolismo muscular y la obesidad [3] [4] [7] [46] [47] 60].
Acidosis metabólica
La acidosis metabólica promueve el catabolismo muscular mediante la activación de dos vías proteolíticas y del complejo ubiquitina proteosoma, promoviendo la ruptura proteica y la atrofia muscular [61] [62]. Además, disminuye la síntesis de albúmina, favorece la inflamación y promueve la resistencia a la acción de la insulina [63].
Resistencia a la acción de la insulina
La resistencia a la acción de la insulina en la ERC es de origen multifactorial. Su aparición está condicionada por la disminución del filtrado glomerular, sin embargo, otros factores como las tóxinas, moléculas proinflamatorias, el déficit de vitamina D y la acidosis metabólica, contribuyen a su desarrollo [64] [65]. Además, distintas condiciones que de forma clásica fueron relacionadas, como la obesidad, la inactividad física o el envejecimiento, son comunes en la ERC.
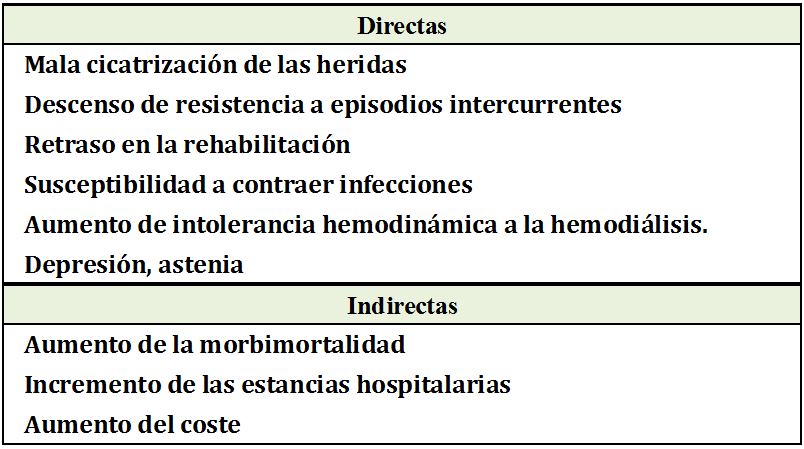
En la (Tabla 7) se exponen las consecuencias del DEP. Para la prevención y manejo de esta complicada patología, deben complementarse estrategias nutricionales, incluídos suplementos y agentes anabólicos; estrategias antiinflamatorias, y óptimas dosis de diálisis si es el caso [37].
Circunstancias favorecedoras del sobrepeso y la obesidad
El sobrepeso y la obesidad son alteraciones nutricionales muy frecuentes en la ERC avanzada, afectando entre el 20 y el 60 % de los pacientes según las series. El hecho de que en estos enfermos el sobrepeso sea el patrón predominante, probablemente es el reflejo del perfil antropométrico de la población general y de sus hábitos de vida [11] [13] [14] [15].
El sobrepeso y la obesidad tienen connotaciones negativas para la evolución del paciente ya que favorecen la hiperfiltración renal y es un factor reconocido de riesgo cardiovascular [11] [12]. Esto se ha visto principalmente en la distribución grasa de tipo central, más sensible a estímulos lipolíticos, y que se acompaña de un perfil lipídico patológico (exceso de triglicéridos y VLDL), hiperinsulinismo y resistencia periférica a la acción de la insulina, conocido como síndrome metabólico. Este, siendo la antesala de la diabetes, se detecta incluso en el 30% de los pacientes no diabéticos en estadios avanzados de ERC. Es importante reseñar que la existencia de sobrepeso u obesidad no excluye el déficit de la ingesta de proteínas y energía, encontrándose estos pacientes en riesgo de desnutrición.
En la modalidad de DP el sobrepeso es más acusado, durante el primer año el contenido en grasa corporal puede incrementarse hasta un 30% y el sobrepeso aparecer hasta en el 50% de los pacientes.
Como contrapartida, debemos destacar que se han descrito efectos beneficiosos del sobrepeso sobre la supervivencia en diálisis. Es el fenómeno conocido como "epidemiologia inversa" y que afecta también a variables como la presión arterial o el colesterol, entre otras [12] [66] [67] 68]. No sabemos si lo que es bueno a corto plazo puede ser perjudicial a largo plazo. Tal vez en la longitud del tiempo de seguimiento encontremos la explicación o, al menos, parte de la explicación, para las variables que presentan epidemiologia inversa.
Aunque este fenómeno sigue siendo objeto de controversia, al menos, en la etapa prediálisis es prudente recomendar una moderación en la ingesta y una actividad física acorde como medida reno y cardioprotectora, para prevenir el síndrome metabólico. Muy importante, la reducción del exceso de peso es una prerrequisito para incluir un paciente en lista de trasplante renal (en general ante un IMC> 32-35 según los centros).
Perfil nutricional en la ERC
Inicialmente viene determinado por los hábitos alimentarios y el estado clínico del paciente. En estadios 4 y 5 de ERC, los pacientes no complicados presentan buen apetito y suelen mantener un peso estable. En estos casos, la alteración nutricional más frecuente es el sobrepeso, especialmente en la población anciana y diabética, reflejando el perfil antropométrico de la población general [13][69]. La limitación física propia de la edad y favorecida por la comorbilidad asociada favorece esta condición. Asimismo, los parámetros bioquímicos indicadores del estado nutricional se mantienen en rango normal en la mayoría de los enfermos. Los pacientes diabéticos merecen una consideración adicional, como norma general, los parámetros antropométricos y bioquímicos del diabético tipo 2 son similares a los de no diabéticos de la misma edad y sexo, con algo más de sobrepeso. Sin embargo, lo pacientes diabéticos tipo 1 refleja un perfil opuesto. En definitiva, el perfil antropométrico del paciente depende de su estado metabólico y es antagónico entre diabético tipo 1 y 2.
Una vez iniciada la diálisis, el estado nutricional es más vulnerable. Sin embargo, el normopeso y el sobrepeso siguen siendo los patrones predominantes en el paciente estable. El estado urémico de un enfermo bien dializado no debe provocar desnutrición. Sin embargo, los problemas de acceso vascular y subdiálisis suelen ser factores frecuentes que afectan a las reservas energético-proteicas y el paciente entra en riesgo de desnutrición. Ante un paciente con un perfil nutricional progresivamente deficiente hay que explorar un proceso comorbido subyacente que lo explique o subdiálisis. La corrección de la desnutrición en estos casos comienza por frenar el proceso inflamatorio subyacente. Un paciente complicado y con signos de desnutrición requiere probablemente ingreso, aplicando medidas generales y nutricionales agresivas para sacarlo de un circulo vicioso, muchas veces, irreparable.
Un paciente con ERC bien controlada y sin complicaciones no debe presentar signos de desnutrición. El descenso de las reservas nutricionales es consecuencia de algún proceso infeccioso-inflamatorio subyacente que induce pérdida de apetito o déficit de entrada de nutrientes e hipercatabolismo.
Tablas