Alteraciones Cardiovasculares en la Enfermedad Renal Crónica
Insuficiencia cardíaca en la enfermedad renal crónica: Conclusiones de Conferencia de Controversia de KDIGO (Kidney Disease Improving Global Outcomes)
KIDNEY INT 2019. TRADUCCIÓN AL ESPAÑOL EN NEFROLOGÍA AL DÍA.
Enfermedad Renal Crónica y Arritmias: Aspectos más destacados de la Conferencia de Controversias Kdigo
KIDNEY INT 2018. TRADUCCIÓN AL ESPAÑOL EN NEFROLOGÍA AL DÍA.
ÍNDICE
1.-Introducción
2.-Hipertrofia de ventrículo izquierdo
3.-Aterosclerosis
4.-Calcificaciones vasculares
5.-Endocarditis
6.-Pericarditis
7.-Arritmias
8.-Hipertensión pulmonar
9.-Bibliografía
INTRODUCCIÓN
La enfermedad cardiovascular es muy frecuente entre la población en diálisis y, además, es la causa más importante de mortalidad, ya que representa el 40-50% del total, mucho más elevada que entre la población general, especialmente en los pacientes más jóvenes [1] [2] [3].
La enfermedad cardiovascular se inicia en fases precoces de la enfermedad renal crónica (ERC), de modo que cuando los pacientes inician un tratamiento renal sustitutivo, más de la mitad ya tienen lesiones cardiovasculares importantes, que van a establecer su pronóstico [3].
Las tres lesiones más importantes son la hipertrofia del ventrículo izquierdo, la aterosclerosis y las calcificaciones vasculares. Cada una de ellas tiene sus factores de riesgo específicos y sus consecuencias clínicas derivadas, aunque muchos de los factores y de las manifestaciones clínicas son comunes [4]. Para una mayor simplificación, describiremos los tres tipos de lesiones por separado.
HIPERTROFIA DEL VENTRÍCULO IZQUIERDO (HVI)
Prevalencia y factores de riesgo
La prevalencia de la HVI es muy alta en la ERC y aumenta conforme disminuye el filtrado renal glomerular [5] [6]. La HVI constituye un importante factor de riesgo de mortalidad cardiovascular, así como de muerte súbita [6] [7].
Manifestaciones clínicas
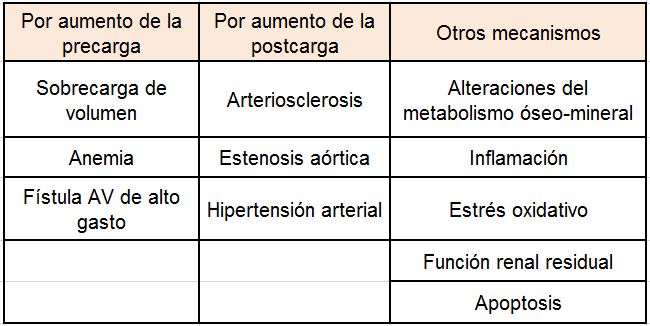
La HVI supone un mecanismo de adaptación del músculo cardíaco a un exceso mantenido de trabajo por sobrecarga de presión o de volumen. En el primer caso, se produce un aumento en el grosor de los sarcómeros y una disposición en paralelo de las nuevas células, lo que da lugar a un aumento del grosor de la pared ventricular (HVI concéntrica). Las causas más importantes son la hipertensión arterial, la estenosis aórtica y la arteriosclerosis. En la sobrecarga de volumen hay un alargamiento de los sarcómeros y una disposición en serie de las nuevas fibras, que origina un aumento del tamaño de la cavidad ventricular (HVI excéntrica). Las causas más frecuentes son la retención hidrosalina y el estado hiperdinámico generado por la anemia o por las fístulas arteriovenosas de alto gasto [8]. Sin embargo, el tratamiento con diálisis es probablemente la situación donde coinciden mayor número de factores predisponentes para el desarrollo de hipertrofia del ventrículo izquierdo. Otros factores implicados están reflejados en la (Tabla 1).
Además del aumento en el grosor de la pared y en el tamaño de la cavidad ventricular, se produce una alteración en el remodelado cardíaco y una fibrosis miocárdica, que establecen las diferencias entre la hipertrofia del ventrículo izquierdo fisiológica de los deportistas y la patológica de la uremia. Además, la densidad de capilares por unidad de volumen de miocardio en pacientes en diálisis es aproximadamente la mitad que en sujetos normales, el diámetro de los miocitos es casi el doble y el intersticio no vascularizado es mucho mayor [9].
Las consecuencias clínicas de la HVI son principalmente la disfunción sistólica y diastólica, con desarrollo de insuficiencia cardíaca congestiva, la cardiopatía isquémica por aumento en la demanda de oxígeno y dificultad para el llenado coronario (incluso con arterias coronarias normales), la hipotensión en diálisis y las arritmias. Todas ellas son causas de mortalidad y, en ocasiones, de muerte súbita [8] [9].
Diagnóstico
La resonancia magnética cardiaca es el mejor método para el diagnóstico de la HVI, sin embargo, no está disponible en todos los casos, por lo que el ecocardiograma constituye el método más habitual. Con esta técnica, la masa del ventrículo izquierdo (MVI) se calcula habitualmente con la ecuación de Devereaux [60]. basada en tres parámetros determinados al final de la diástole: diámetro telediastólico (DTD), grosor del tabique interventricular (TIV) y grosor de la pared posterior del ventrículo izquierdo (PP), donde:
MVI = 1,04 × [(DTD + TIV + PP)3 − DTD3] − 13,6
Las dimensiones se calculan en centímetros y la MVI en gramos. Cuando se corrige para la superficie corporal, obtenemos el índice de MVI (IMVI), cuyos valores normales son < 100 g/m2 en mujeres y 130 g/m2 en varones. Es aconsejable realizar la medición en el día siguiente a la sesión de hemodiálisis.
Para diferenciar la HVI concéntrica de la excéntrica, se calcula el grosor relativo de la pared ventricular (GR), que viene dado por la expresión
GR = (TIV + PP)/DTD
De modo que valores de GR > 0,45 corresponden a HVI concéntrica, y valores de GR < 0,45 a HVI excéntrica.
Tratamiento
La mejor manera de tratar la HVI es prevenir su desarrollo desde fases precoces de la ERC, actuando sobre cada uno de los factores implicados (Tabla 1). Una vez en diálisis, el adecuado control de la hipertensión arterial, del volumen extracelular, de la anemia, de las alteraciones del metabolismo óseo-mineral y de la inflamación son aspectos fundamentales que se comentan en otros capítulos de esta obra.
La restricción de sal desempeña un papel capital en el control de la sobrecarga de volumen, de la hipertensión arterial y de la HVI. Se recomiendan ingestas < 5-6 g/día, aunque este objetivo no es fácil de obtener en la práctica habitual. En casos en los que la hipertensión no se pueda controlar con dieta y ultrafiltración, es preferible usar bloqueantes del sistema renina-angiotensina y β-bloqueantes, que pueden asociar un efecto beneficioso en el control de la HVI y en el manejo de la insuficiencia cardíaca congestiva. En casos de hipertensión arterial refractaria o de frecuentes episodios de insuficiencia cardíaca congestiva, la diálisis diaria o diálisis más largas son excelentes alternativas.
ATEROSCLEROSIS
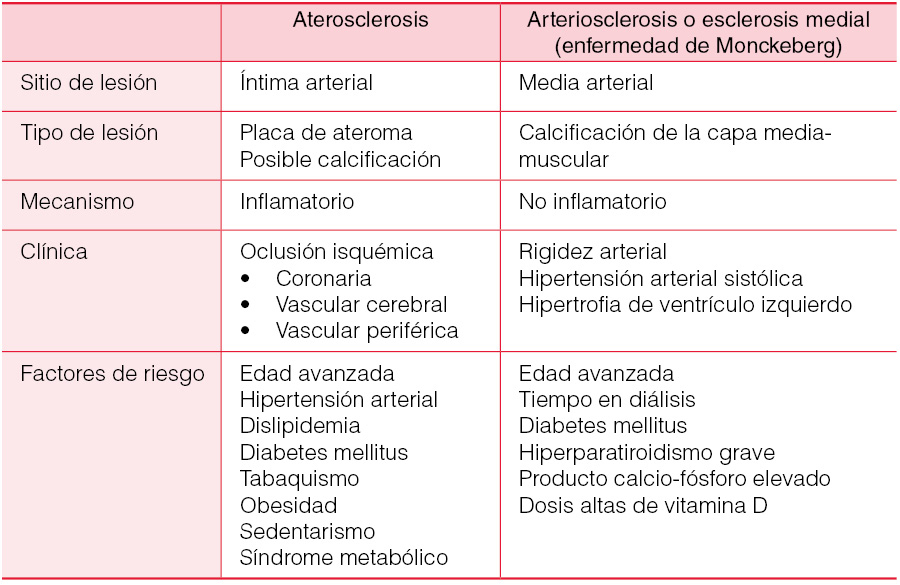
Es la lesión caracterizada por la presencia de placas de ateroma en la íntima de las arterias de mediano y gran tamaño, como consecuencia de un proceso inflamatorio [12]. La localización más frecuente está en las arterias coronarias, en las carótidas y en arterias periféricas, y sus consecuencias clínicas son las derivadas de un síndrome oclusivo a distintos niveles. En la (Tabla 2) se exponen las diferencias con la arteriosclerosis o calcificación de la capa media de las arterias [13].
La aterosclerosis es muy frecuente en los pacientes en hemodiálisis, aunque no hay datos para establecer una verdadera prevalencia. La formación de placas de ateroma suele iniciarse en fases precoces de la ERC, incluso en población joven, y su crecimiento es muy rápido [14].
La (Tabla 3) muestra los factores de riesgo más importantes relacionados con el desarrollo de aterosclerosis. Muchos de ellos son comunes con la población general, y otros son más específicos de la uremia y su tratamiento con diálisis.
En la formación de la placa de aterosclerosis intervienen, por un lado, el depósito de material lipídico, que constituye la placa inicial; posteriormente, por estímulo de linfocitos Th2, la placa tiende a encapsularse mediante un proceso de fibrosis y calcificación, y forma la placa estable. La coexistencia de un proceso inflamatorio puede estimular linfocitos Th1, capaces de liberar metaloproteasas, que pueden debilitar la cápsula fibrosa de la placa y originar una placa inestable, que puede romperse y poner en contacto su contenido con la sangre, lo que da lugar al inicio de la trombosis arterial [15].
Las consecuencias clínicas de esta lesión son las derivadas de los procesos obstructivos a distintos niveles, que comprenden la enfermedad coronaria, la enfermedad vascular cerebral, la isquemia intestinal, la enfermedad vascular periférica y la aterosclerosis aórtica con aneurismas toracoabdominales incluidos.
Cardiopatía isquémica
La enfermedad coronaria junto con las alteraciones en el remodelado cardíaco pueden dar lugar a la isquemia segmentaria del miocardio. Las consecuencias clínicas pueden ser la angina, el infarto agudo de miocardio, la insuficiencia cardíaca congestiva, las arritmias o la muerte súbita [16].
El desarrollo de un infarto agudo de miocardio empeora el pronóstico de los pacientes en diálisis, con supervivencias al año inferiores al 50% [17] [18]. Es importante destacar de nuevo que la lesión isquémica puede producirse sin alteraciones significativas de las arterias coronarias, como consecuencia de la afectación de pequeños vasos [19].
No existe acuerdo para realizar las exploraciones diagnósticas rutinarias para el diagnóstico de cardiopatía isquémica, por lo que parece obligado llevarlas a cabo en casos de angina o infarto, así como en pacientes diabéticos en lista de espera para trasplante renal y es recomendable realizarlas de forma periódica en el resto de los pacientes en diálisis.
Los procedimientos diagnósticos no se diferencian de los indicados en la población general: ecocardiografía de estrés con dobutamina como prueba de elección ante la sospecha, y coronariografía como prueba de confirmación. No obstante, el angioTAC coronario se ha convertido en una exploración menos invasiva que la coronariografía y con una gran capacidad para seleccionar pacientes con cardiopatía isquémica [20].
La modificación de los factores de riesgo señalados en la (Tabla 3) es un aspecto clave del tratamiento [21]. Un ejercicio moderado, pérdida de peso en casos de obesidad, el abandono del hábito tabáquico en fumadores, el control de glucemias en diabéticos y una alimentación equilibrada en contenido lipídico son obligadas en todos los casos. En la actualidad, no existen evidencias que demuestren que iniciar tratamiento con estatinas reduzca la mortalidad en pacientes en diálisis. Sin embargo, en aquellos pacientes que llegan a diálisis ya tratados con estos fármacos, se recomienda mantenerlo.
El manejo de la hipertensión arterial no controlada con ultrafiltración en pacientes con cardiopatía isquémica debe llevarse a cabo preferentemente con β-bloqueantes e inhibidores de la enzima de conversión de la angiotensina (IECAs o ARA-2). Es importante evitar la hipotensión intradiálisis por ultrafiltración excesiva, por el riesgo de angina, por el efecto sobre la función renal residual, y el riesgo de isquemia intestinal y cerebral. No disponemos de datos concluyentes sobre las potenciales ventajas del tratamiento con ácido acetilsalicílico.
Las indicaciones de revascularización coronaria son las mismas que en la población general [22] [23].
Enfermedad vascular cerebral
La frecuencia de accidentes vasculares cerebrales agudos es mucho mayor en pacientes en diálisis que en la población general. Entre los factores de riesgo, destacan la existencia de placas de ateroma o esclerosis medial en los troncos supraaórticos, la hipertensión diastólica, la fibrilación auricular, la malnutrición y el tratamiento anticoagulante [24] [25] [26]. La enfermedad vascular cerebral se asocia también con una alta mortalidad en diálisis.
Enfermedad vascular periférica
La frecuencia de la enfermedad vascular periférica es también mucho mayor en los pacientes en diálisis que en la población general, y se produce sobre todo en pacientes con antecedentes de aterosclerosis grave. Los factores de riesgo son: edad avanzada, diabetes mellitus, tiempo en diálisis, inflamación, bajos niveles de parathormona (PTH), hipoalbuminemia e hipotensión diastólica prediálisis [27]. La presencia de enfermedad vascular periférica en pacientes en diálisis se asocia a un riesgo de mortalidad ajustada superior al doble que en los pacientes sin ella [28] [29].
CALCIFICACIONES VASCULARES
Las alteraciones del metabolismo óseo-mineral tienen lugar en casi todos los pacientes con ERC, incluso desde fases precoces de la enfermedad [30]. Los factores de riesgo y mecanismos implicados se explican con detalle en otro capítulo de esta obra.
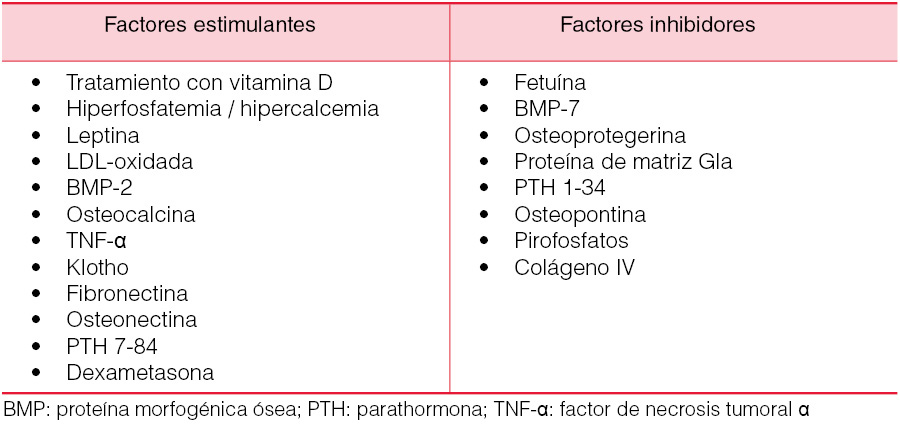
El incremento del fósforo en medios de cultivo favorece la transformación de células musculares lisas en células osteogénicas, con producción de matriz colágena y posterior mineralización. El aumento en la calcemia es también un estímulo para las calcificaciones. Los tratamientos con vitamina D, con sales de calcio por vía oral y el excesivo balance de calcio en la hemodiálisis pueden ser factores que contribuyen al balance positivo de calcio. Como consecuencia de lo anterior, el producto calcio-fósforo elevado desempeña un papel dominante en la formación de calcificaciones vasculares. No obstante, la calcificación vascular es un proceso activo y complejo, en el que están implicados numerosos factores estimulantes e inhibidores, que se resumen en la (Tabla 4).
La actividad ósea guarda una relación inversa con la calcificación vascular, de modo que la enfermedad ósea adinámica se acompaña de una frecuencia mayor de calcificaciones vasculares.
La propia técnica de hemodiálisis constituye un factor que puede aumentar la calcificación vascular, especialmente al final de las sesiones, momento en el que coinciden el mayor balance de calcio hacia el paciente con la situación de mayor alcalinidad, circunstancia que favorece el proceso de calcificación. Por tanto es importante evitar una alcalinización excesiva al final de cada sesión. Para ello, es recomendable un control periódico de los niveles de bicarbonato sérico postdiálisis, que deben oscilar entre 26-28 mEq/L.
Las calcificaciones vasculares más frecuentes en la ERC son las que afectan a la capa media de las arterias, aunque también pueden producirse calcificaciones de la placa ateromatosa en la íntima (Tabla 2). Una forma diferente de calcificación vascular es la calcifilaxis o arteriolopatía urémica calcificante, que afecta a las pequeñas arteriolas de la piel y su presencia se acompaña de una alta mortalidad. Los factores de riesgo de la calcifilaxis quedan reflejados en la (Tabla 5).
Las calcificaciones de las válvulas cardiacas son una alteración frecuente en pacientes en diálisis, y tienen un mecanismo similar a las calcificaciones vasculares [31] [32] [33]. Afectan sobre todo a la válvula mitral, y a la válvula aórtica en segundo lugar, aparecen precozmente en la evolución de la ERC y constituyen unfactor de riesgo de mortalidad [34].
ENDOCARDITIS
El incremento progresivo de la prevalencia de catéteres venosos centrales para diálisis ha ocasionado un incremento de las bacteriemias por Staphylococcus aureus y de todas las alteraciones asociadas a esta complicación, entre las que destacan las endocarditis. Sin embargo, aunque la mayoría de las endocarditis son producidas por este microorganismo, se han implicado otros, como Staphylococcus epidermidis, Enterococcus o gérmenes gramnegativos. La válvula mitral es la que se afecta con más frecuencia, especialmente si existe calcificación valvular previa, que actúa como factor predisponente. La localización aórtica ocupa el segundo lugar en frecuencia, y la afectación de la válvula tricúspide es rara, en relación con un menor grado de calcificación previa [35].
Los síntomas más habituales son síndrome febril acompañado frecuentemente con criterios de gravedad como hipotensión arterial o leucocitosis [36]. En cualquier caso, la presencia de fiebre sin foco aparente en un paciente portador de catéter venoso central obliga a descartar una endocarditis, pese a que el diagnóstico de sospecha sea bajo. El pronóstico de la endocarditis infecciosa en pacientes en diálisis es pobre, con una mortalidad superior al 50%, mientras que en la población general suele ser inferior al 10%. Entre los factores de riesgo se han implicado la ausencia de fiebre y la presencia de endocarditis con hemocultivos negativos o sobre una válvula protésica [37].
El diagnóstico debe sospecharse ante la existencia de hemocultivos positivos en pacientes portadores de catéter venoso central o infecciones protésicas, y la confirmación se realiza con ecocardiografía, preferentemente transesofágica.
El tratamiento de la endocarditis debe iniciarse lo más precozmente posible, incluso de forma empírica ante la sospecha inicial. Se recomienda el uso de vancomicina intravenosa poshemodiálisis. Como dosis estándar se puede administrar 1 g semanal y en casos de membranas de alta permeabilidad 500 mg tres veces por semana, si bien las dosis deben individualizarse en función de cada paciente, y a ser posible, monitorizando niveles plasmáticos del fármaco. Algunos autores recomiendan asociar fármacos que cubran gramnegativos, como aminoglucósidos. El tratamiento debe mantenerse durante 4-6 semanas, incluso en casos con buena evolución desde el inicio, con el fin de evitar el acantonamiento valvular del microorganismo. El tratamiento antibiótico debe acompañarse siempre de la erradicación de la puerta de entrada del germen, ya sea el catéter venoso central o la fístula protésica. En casos de resistencia se puede valorar la asociación de rifampicina, aunque es aconsejable el planteamiento de cirugía para la sustitución valvular, especialmente cuando coexiste una gran desestructuración valvular o el cuadro se asocia con insuficiencia cardíaca. Debe mencionarse que, además de la vancomicina, ha sido aceptado el uso de daptomicina como fármaco seguro y eficaz para el tratamiento de las bacteriemias y endocarditis secundarias a Staphylococcus aureus meticilin resistente en pacientes con ERC, incluido el estadio 5. La dosis propuesta para los pacientes en diálisis por los documentos de consenso es de 6 mg/kg/48 horas [38].
PERICARDITIS
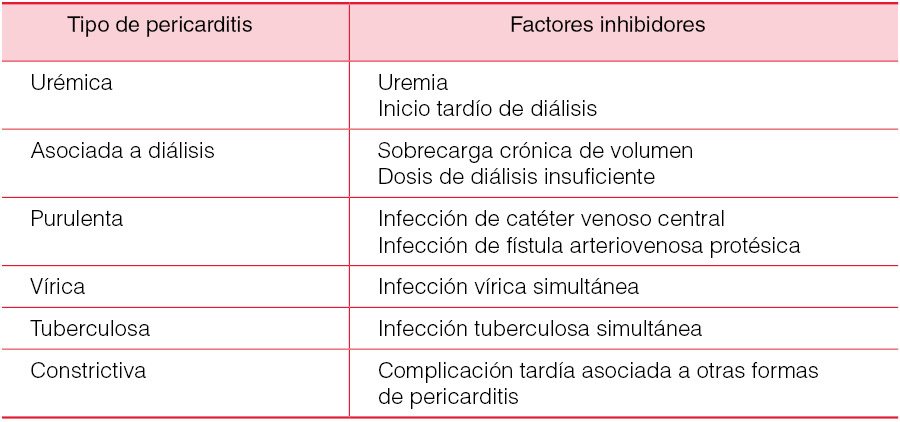
El inicio más controlado del tratamiento con diálisis en pacientes con ERC, la mejoría de las técnicas empleadas y de su eficacia han disminuido la incidencia de pericarditis de forma notable. Por la naturaleza del cuadro y los factores predisponentes implicados, podemos establecer diferentes tipos de pericarditis que se describen en la (Tabla 6) [39].
El síntoma más frecuente es el dolor torácico de características pleuríticas, acompañado de fiebre en las formas infecciosas y febrícula en las urémicas y asociadas a diálisis. Es habitual la mala tolerancia a la ultrafiltración con hipotensión intradiálisis, incluso en pacientes previamente hipertensos. El signo más característico es el roce pericárdico, aunque no aparece en todos los casos, junto con la ingurgitación yugular. Puede producirse pulso paradójico en algunos casos [40].
Las complicaciones clínicas más destacables son las derivadas del taponamiento cardíaco, que es una situación de urgencia que muchas veces no va precedida de otros signos clínicos, y si no se actúa con rapidez, puede resultar fatal. El cuadro clínico es el de una insuficiencia cardíaca derecha con hipotensión refractaria a la infusión de líquidos. Otra complicación infrecuente es la pericarditis constrictiva, que puede producirse junto con la forma asociada a diálisis o a la pericarditis urémica. El cuadro clínico es el de una insuficiencia cardíaca derecha y el diagnóstico diferencial puede precisar un cateterismo derecho [41].
El diagnóstico puede sospecharse ante la presencia de cardiomegalia en la radiografía de tórax. En el ECG puede apreciarse una elevación del segmento ST, aunque esta alteración puede estar ausente cuando el derrame pericárdico no es muy importante. La confirmación habitualmente se establece por los hallazgos en el ecocardiograma. Sin embargo, es importante tener en cuenta que, en raras ocasiones, el derrame pericárdico es mínimo o inexistente, con lo que el diagnóstico se puede complicar. En casos de grandes derrames pericárdicos, la constricción pericárdica es más frecuente y su vigilancia debe ser más estrecha.
El tratamiento en la mayoría de los casos debe ser conservador, siendo suficiente incrementar la dosis y la periodicidad de la diálisis, junto con el uso de analgésicos. La pericarditis es una clara indicación de diálisis diaria, evitando el empleo de heparina para prevenir el derrame hemorrágico. Tradicionalmente se han usado antiinflamatorios no esteroideos (indometacina, 50-75 mg/día; ibuprofeno 600 mg/8 h), pero no se dispone de evidencias suficientes para recomendarlos y en el caso de la etiología urémica, su uso debe de ser asociado a la diálisis diaria. Los esteroides no están indicados, pero pueden utilizarse en determinadas situaciones como pericarditis recidivantes o de etiología autoinmune. En caso de pericarditis purulenta debe asociarse con tratamiento antibiótico [42].
En el derrame pericárdico de gran tamaño, con riesgo de taponamiento, debe considerarse la pericardiocentesis de forma electiva antes de que se produzca la complicación dramática. Un contenido estimado superior a 250 ml o un espesor superior a 1 cm en la cara posterior deben considerarse puntos de corte para el tratamiento agresivo.
ARRITMIAS
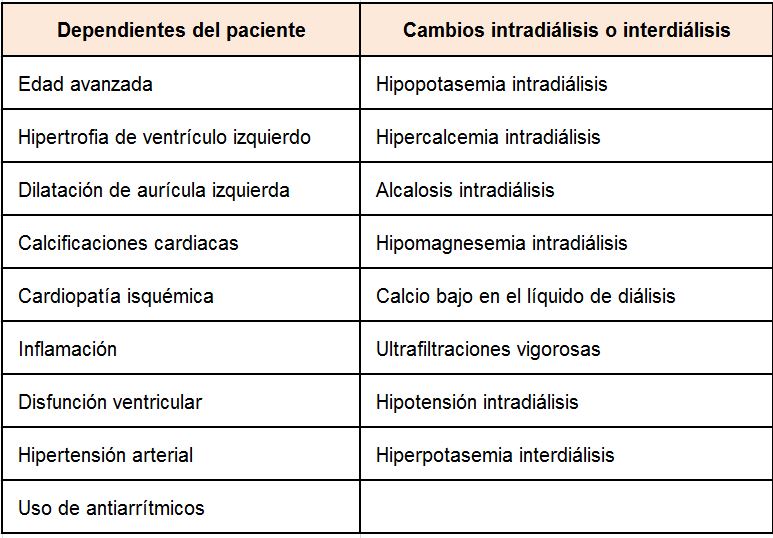
Las arritmias supraventriculares y ventriculares son frecuentes en pacientes en diálisis, con especial interés durante las sesiones de hemodiálisis, donde destacan las rachas de taquicardia supraventriculares [43] [44] [45] [46]. Las arritmias son un factor de riesgo de mortalidad, especialmente de muerte súbita, y se asocian a una mayor prevalencia de eventos cardiovasculares no fatales [43] [44] [45] [46]. Las arritmias son mucho menos frecuentes en pacientes en diálisis peritoneal que en hemodiálisis, donde parecen estar aumentadas en posible relación con la edad más avanzada de los pacientes [47] [48]. Los factores de riesgo asociados se señalan en la Tabla 7 [49] [50]. Entre ellos se distinguen los que dependen de la situación cardiológica del paciente y otros que dependen de los cambios agudos que pueden producirse durante las sesiones de hemodiálisis o en los períodos interdiálisis [51] [52].
Los síntomas más frecuentes y graves se presentan intradiálisis y destacan las palpitaciones, el dolor torácico, la inestabilidad hemodinámica y las alteraciones mentales, incluso con pérdida de conciencia. Sin embargo, es importante destacar que la mayoría de las arritmias intradiálisis son de corta duración, al final de la sesión, autolimitadas y silentes desde el punto de vista clínico, por lo que para su diagnóstico es necesaria la monitorización electrocardiográfica continua en diálisis [43].
Las medidas preventivas de los factores de riesgo asociados (Tabla 7) son fundamentales en el tratamiento de las arritmias. En pacientes de riesgo, su incidencia puede disminuir evitando la ganancia excesiva de peso, las ingestas excesivas de potasio, el uso de concentraciones altas de calcio o bajas de potasio en el líquido de hemodiálisis o el empleo de digitálicos [53].
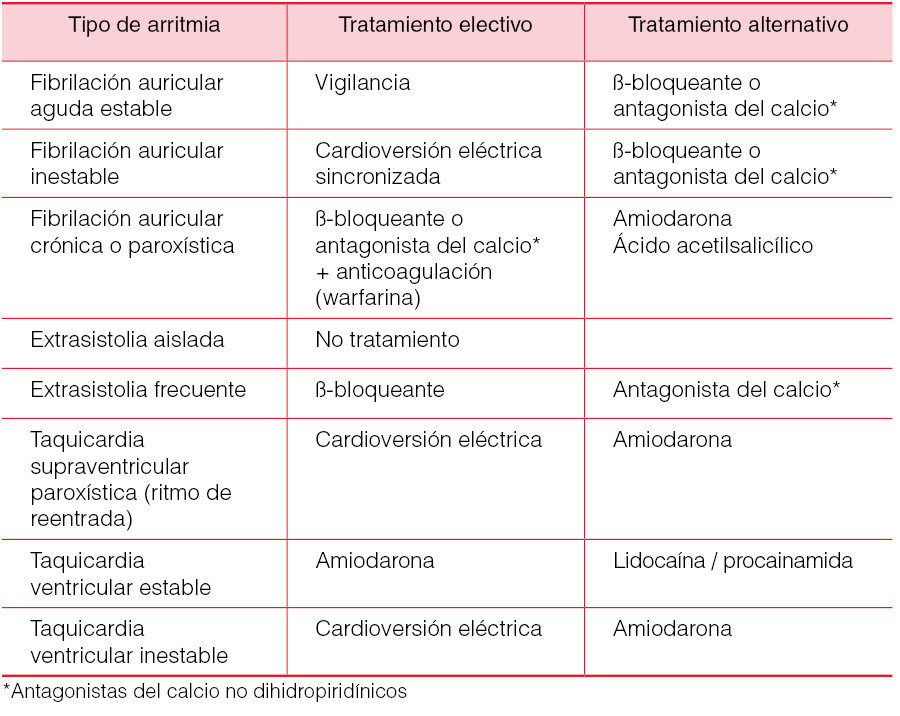
Cuando la arritmia sintomática se produce durante la sesión de hemodiálisis, debe interrumpirse la sesión, dejar accesible una vía venosa central o el propio acceso vascular, monitorizar el ritmo cardíaco y tener preparado el protocolo de resucitación cardiopulmonar. En casos complicados, es recomendable la asistencia por el cardiólogo. En la (Tabla 8) se establece una guía terapéutica general para las arritmias. Con carácter general, la amiodarona reduce la incidencia de arritmias ventriculares; los β-bloqueantes están indicados en el postinfarto inmediato y los IECAs en la insuficiencia cardíaca congestiva.
Las arritmias supraventriculares son el trastorno del ritmo más frecuente en la población en diálisis. La fibrilación auricular refleja una enfermedad cardíaca subyacente y constituye un factor de riesgo de accidente vascular cerebral agudo y muerte.
La fibrilación auricular de aparición aguda en la hemodiálisis no es rara en pacientes de riesgo. La mayor parte de las veces no requiere tratamiento específico y suele revertir a ritmo sinusal tras un período de tiempo variable, en el que se produce un reajuste de la distribución de cationes posthemodiálisis. En casos con inestabilidad hemodinámica, puede ser necesaria la cardioversión eléctrica y el ingreso hospitalario para vigilancia intensiva.
Los pacientes con fibrilación auricular paroxística en hemodiálisis deben tratarse como aquellos con fibrilación auricular crónica o persistente. Los objetivos del tratamiento son el control del ritmo cardíaco, con β-bloqueantes o antagonistas del calcio no dihidropiridínicos. La anticoagulación con warfarina para evitar accidentes vasculares cerebrales agudos embólicos sigue siendo objeto de gran controversia en pacientes en diálisis, pero en un reciente metaanálisis, se concluye que la anticoagulación en pacientes con fibrilación auricular no se asocia a claros beneficios y en cambio, aumenta claramente el riesgo de hemorragias [63]. La digoxina no está indicada por falta de eficacia y por el alto riesgo de desarrollar otras arritmias.
HIPERTENSIÓN PULMONAR
La hipertensión pulmonar (HTP) es una complicación frecuente en la ERC, se agrava con la pérdida de función renal y su prevalencia aumenta de forma significativa en hemodiálisis hasta alcanzar casi a la mitad de los pacientes [55] [56] [57]. Entre los factores de riesgo para su desarrollo destacan la edad, los antecedentes cardiovasculares, la hipertrofia del ventrículo izquierdo, la disfunción ventricular y la sobrecarga de volumen. La HTP es un predictor independiente de eventos cardiovasculares y de mortalidad [58] [59] y a pesar de su relevancia, es una patología cardiovascular poco estudiada y poco tenida en cuenta en el seguimiento de los pacientes con ERC y en diálisis.
El diagnóstico preciso de esta complicación debe realizarse mediante un cateterismo cardiaco derecho, pero se trata de una prueba invasiva, costosa y no realizable en todos los pacientes, por lo que en su lugar, se emplea de forma habitual la ecocardiografía doppler transtorácica, que presenta una buena correlación con la primera [60]. Para su diagnóstico, se utiliza la estimación de la presión sistólica de arteria pulmonar, que define la HTP cuando es superior a 35 mmHg y la HTP severa cuando es superior a 45 mmHg. Dada la importancia que tiene la sobrecarga de volumen en su valoración, es aconsejable que el ecocardiograma se realice al día siguiente de la sesión de diálisis.
En pacientes en hemodiálisis, es necesario tener en cuenta que fístulas AV de alto gasto pueden ser un factor predisponente para el desarrollo de HTP [61] y algún estudio ha demostrado que la ligadura de estos accesos vasculares puede mejorar la misma [62].
El tratamiento de la HTP debe ir dirigida a evitar su aparición, mediante el manejo adecuado de todos aquellos factores de riesgo implicados en su aparición, destacando el control del estado hiperdinámico debido a la sobrecarga de volumen o a la anemia.