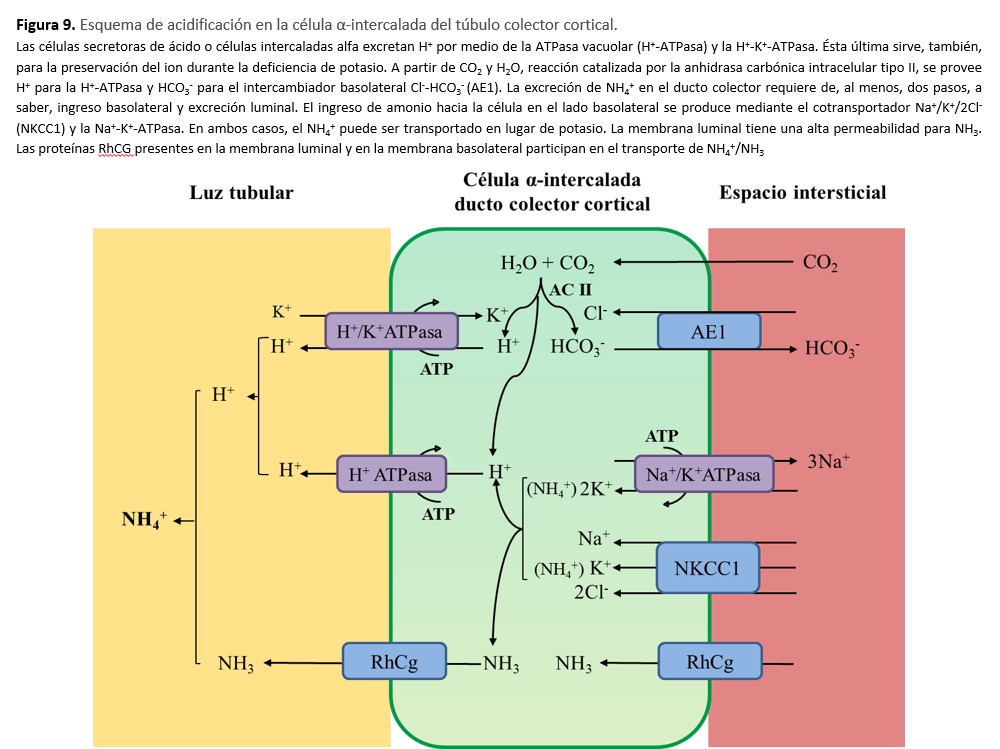
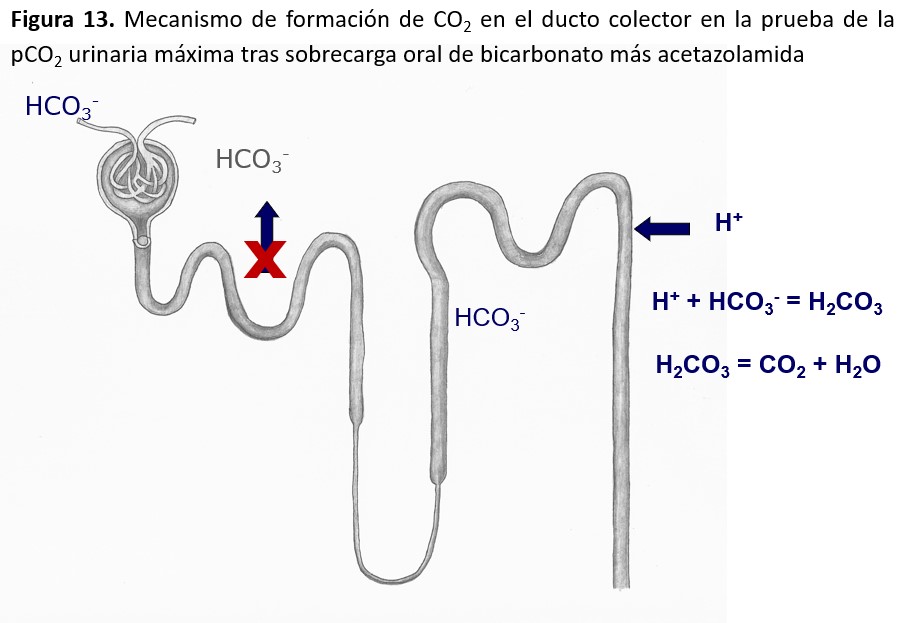
Pruebas de función renal. Glomerular y tubular
Índice
INTRODUCCIÓN
PRUEBAS DE FUNCIÓN GLOMERULAR
Generalidades
1. Valoración del filtrado glomerular
Medir o estimar, esa es la cuestión
1.1. ¿Cómo se mide el filtrado glomerular?
1.2. ¿Cómo se estima el filtrado glomerular renal?
Elaboración de las ecuaciones para estimar el filtrado glomerular
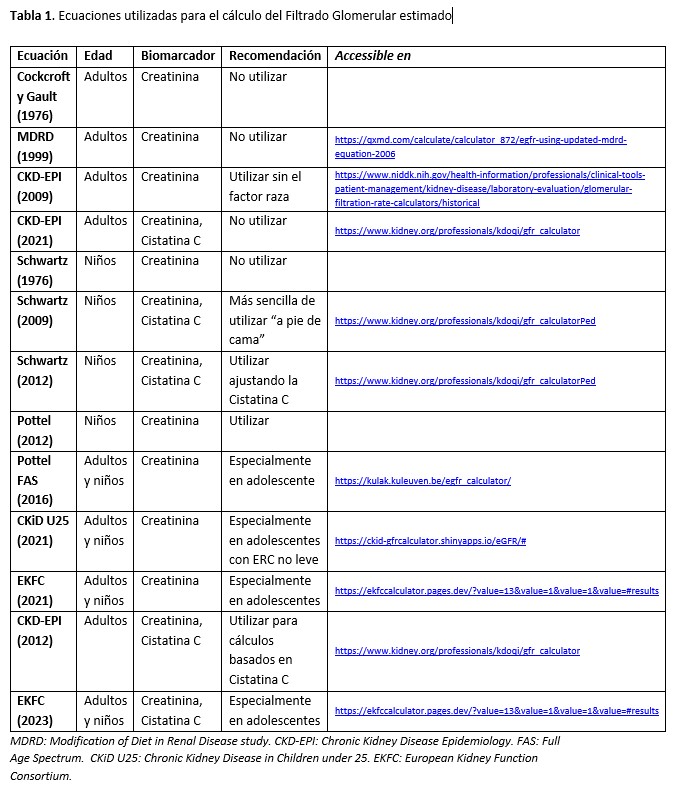
a) Ecuaciones que se basan en la creatinina
Realizadas para población adulta
Ecuación MDRD, Modification of Diet in Renal Disease study (1999) [10]
Fórmula: FGR (ml/min/1,73 m2) = 141 x min (Scr/kappa, 1)alfa x max(Scr/kappa, 1)-1.209 x 0,993Edad x 1,018 [si mujer] x 1,159 [si raza negra]
Fórmula: FGR (ml/min/1,73 m2) = 142 x min (Scr/kappa, 1)alfa x max (Scr/kappa, 1)-1.200 x 0,9938Edad x 1,012 [si mujer]
Realizadas para población pediátrica
Realizadas para un rango de edades que incluye población pediátrica y adulta
Fórmula: Para edad ≥2 años y ≤40 años: FGR (ml/min/1,73 m2) = (107,3 x SCr)/Q
Para edad >40 años: FGR (ml/min/1,73 m2) = (107,3 x Scr)/(Q x 0,988(Edad-40))
b) Ecuaciones que se basan en la cistatina C sola o en cistatina C combinada con creatinina
Realizadas para población adulta
Fórmula CKD-EPI cistatina 2012: FGR (ml/min/1,73 m2) = 133 x min (Scis/0,8, 1)-0,499 x max(Scis/0,8, 1)-1.328 x 0,996Edad x 0,932 [si mujer]
Fórmula CKD-EPI creatinina-cistatina 2012: FGR (ml/min/1,73 m2) = 135 × min (Scr/κ, 1)α × max(Scr/κ, 1)−0,601 × min(Scis/0,8, 1)−0,375 × max(Scis/0,8, 1)−0,711 × 0,995Edad [× 0,969 si mujer] [× 1,08 si raza negra]
Realizadas para población pediátrica
Fórmula: FGR (ml/min/1,73 m2) = 39,1 [talla (m)/Scr (mg/dl)]0.516 x [1,8/cistatina C (mg/L)]0.294 [30/BUN (mg/dl)]0.169[1,099]varón[talla (m)/1,4]0.188.
Fórmula CKiD cistatina: FGR (ml/min/1,73 m2) = 40,6 (1,8/cistatina C)0.93
Fórmula CKiD creatinina y cistatina: FGR (ml/min/1,73 m2) = 39,8 [talla (m)/Scr (mg/dl)]0.456 x [1,8/cistatina C (mg/L)]0.418 [30/BUN (mg/dl)]0.079[1,099]varón[talla (m)/1,4]0.179