Obesidad y Progresión de la Enfermedad Renal
Palabras clave
Obesidad, Sobrepeso
INDICE:
INTRODUCCIÓN
DEFINICIÓN Y MEDICIÓN DE LA OBESIDAD
OBESIDAD E INCIDENCIA DE ENFERMEDAD RENAL EN LA POBLACIÓN GENERAL
MECANISMOS FISIOPATOLÓGICOS DE DAÑO RENAL EN LA OBESIDAD
OBESIDAD Y MORTALIDAD EN LA ENFERMEDAD RENAL CRÓNICA
OBESIDAD Y PROGRESIÓN DE LA ENFERMEDAD RENAL CRÓNICA
TRATAMIENTO DE LA OBESIDAD EN PACIENTES CON ERC
PUNTOS CLAVE
INTRODUCCIÓN
La obesidad se ha convertido en la actualidad en una epidemia mundial. Su prevalencia va aumentando progresivamente desde el año 1995, y aunque este aumento es mayor en los países con alto nivel socioeconómico, en los últimos años, también se ha visto un incremento en países con menor nivel socioeconómico [1] [2]. En EEUU, la prevalencia de obesidad ajustada por edad en 2013–2014 fue del 35% en hombres y del 40,4% en mujeres [3]. Por lo tanto un tercio de la población americana es obesa, lo que implica un gasto sanitario anual de 140 billones de dólares. El problema de la obesidad no sólo afecta a adultos, también afecta a los niños. En EEUU en 2011–2014, la prevalencia de obesidad fue del 17% y la de obesidad extrema del 5,8% en niños de 2 a 19 años [4]. La preocupación por el aumento de prevalencia de obesidad en el mundo se ha convertido en un problema socio-sanitario. Las personas obesas tienen un mayor riesgo de desarrollar diabetes mellitus tipo 2, enfermedad cardiovascular y neoplasias, con una mayor mortalidad global y cardiovascular. Además, la obesidad es un componente principal del síndrome metabólico que se asocia a largo plazo con hipertensión, hiperglucemia y resistencia a la insulina. La obesidad es un importante factor de riesgo para el desarrollo de enfermedad renal [5] [6]. Por un lado, incrementa el riesgo de desarrollar los principales factores de riesgo de la enfermedad renal crónica (ERC), como son la diabetes y la hipertensión, y por otro lado, tiene un impacto directo en el desarrollo de ERC y enfermedad renal crónica terminal (ERCT) [7]. En individuos afectados por la obesidad, se produce un mecanismo de hiperfiltración, probablemente compensatorio, para satisfacer la alta demanda metabólica asociada al aumento del peso corporal. El aumento de la presión intraglomerular puede generar una lesión renal estructural e incrementar el riesgo de desarrollar ERC [8].
A lo largo de esta revisión, nos centraremos en analizar el papel de la obesidad en el desarrollo de enfermedad renal en población general, los mecanismos fisiopatológicos implicados y el papel de la obesidad en el pronóstico renal y en la progresión de la enfermedad renal.
DEFINICIÓN Y MEDICIÓN DE LA OBESIDAD
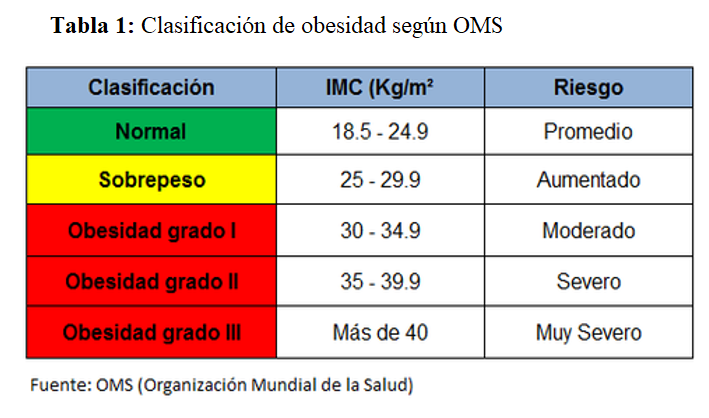
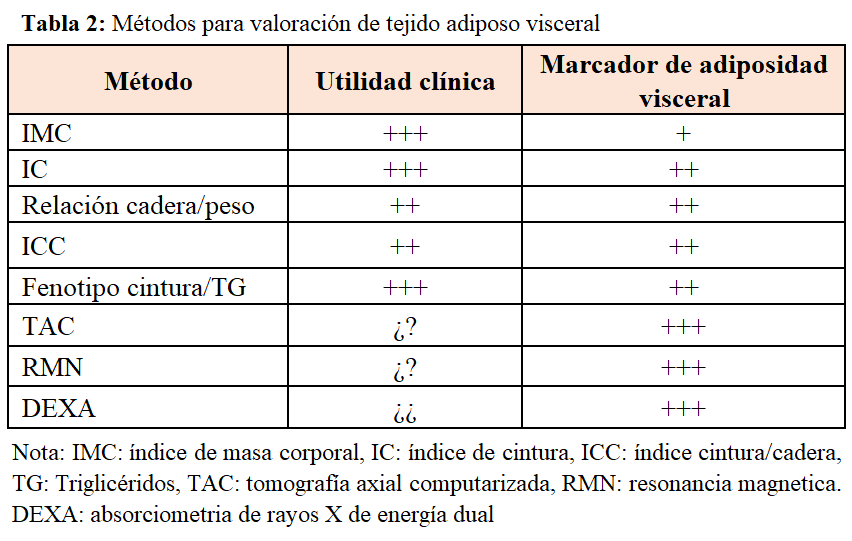
La OMS define la obesidad en función de un marcador clínico, fácil de medir, como es el índice de masa corporal (IMC), clasificándola en tres tipos (Tabla 1). El IMC es el (peso [kg] dividido por el cuadrado de la altura [metros]). Un IMC entre 18,5 y 25 kg/m2 es considerado por la Organización Mundial de la Salud como peso normal, entre 25 y 30 kg/m2 como sobrepeso, y un IMC > 30 kg/m2 como obesidad. A pesar de que el IMC es fácil de calcular, nos proporciona una pobre estimación de la distribución de la grasa corporal, ya que individuos musculosos o aquellos con más tejido graso subcutáneo pueden tener un IMC tan alto como aquellos individuos con mayor masa grasa visceral. El tejido adiposo blanco se divide en dos tipos: el tejido adiposo visceral y el tejido adiposo subcutáneo. El aumento de tejido adiposo visceral es propio de la obesidad tipo androide u obesidad central de los varones, que se asocia con mayor liberación de citoquinas como la resistina, aumento de resistencia a la insulina y mayor riesgo cardiovascular. Sin embargo el aumento de tejido adiposo subcutáneo es típico de la obesidad periférica o ginoide, más frecuente en las mujeres, que se relaciona con mayor secreción de adiponectina, que tiene propiedades antiinflamatorias y antiateroscleróticas, menor riesgo de diabetes y menor riesgo cardiovascular [9]. Los parámetros alternativos para medir de forma más precisa la grasa visceral incluyen la circunferencia de la cintura (CC) y el índice cintura/cadera (ICC) > 102 cm y 0,9, respectivamente para hombres, y > 88 cm y > 0,8 para mujeres. El ICC ha demostrado ser superior al IMC para la correcta clasificación de la obesidad en ERC [10]. En la actualidad, se están utilizando otros parámetros que evalúan mejor el tejido adiposo visceral como el fenotipo cintura/triglicéridos. En el año 2000 [11], publicaron por primera vez que el marcador aumento del IC y aumento de triglicéridos se relacionaba con el desarrollo de diabetes y enfermedad coronaria y era un excelente marcador de síndrome metabólico y riesgo de complicaciones aterogénicas. En la actualidad, la mayoría de los estudios establecen un punto de corte de IC mayor de 90 cm y triglicéridos en ayunas mayor de 2 mmol/l (177 mg/dl), aunque son necesarios más trabajos en diferentes grupos poblacionales para validar este punto de corte. Datos del estudio NEFRONA, utilizando un punto de corte con triglicéridos mayor de 143 mg/dl e IC mayor de 102 en hombres y mayor de 94 cm en mujeres, relacionan este marcador con un mayor riesgo de progresión de enfermedad aterosclerótica y riesgo cardiovascular [12]. Otras técnicas más sofisticadas como resonancia magnética, scanner o técnicas DEXA (absorciometría de rayos X de energía dual) para valoración de la composición corporal identifican de una forma mucho más precisa la obesidad visceral, pero son técnicas no aplicables a la práctica clínica diaria y con puntos de corte que todavía no han sido validados en los diferentes grupos poblacionales [13] [14] [15] (Tabla 2).
Además de las diferencias entre obesidad visceral y subcutánea, en los últimos años está cobrando gran relevancia el denominado tejido adiposo pardo. Hay diferentes tipos de adipocitos. El adipocito blanco con pocas mitocondrias y un núcleo periférico, que procede de las células mesenquimales progenitoras y es el responsable de la obesidad. El adipocito pardo que es fundamental en la termogénesis, y hace unos años se pensaba que solo estaba presente en el recién nacido, pero ahora se conoce que también está presente en el adulto, y el adipocito beige que puede aparecer procedente de la célula mesenquimal progenitora o por transición a partir del adipocito blanco. Tanto el adipocito pardo como el beige aumentan de forma importante el gasto calórico por lo que su proliferación ayudaría a frenar la obesidad. Se conoce que en algunas enfermedades, el aumento de transición del adipocito blanco al pardo son las responsables de la caquexia asociada, como en el cáncer, EPOC, insuficiencia cardiaca terminal e incluso en la desnutrición proteico-calórica que se asocia con la diálisis. Algunos factores que aumentan este tejido adiposo son los agonistas adrenérgicos y las hormonas tiroideas [16] [17].
OBESIDAD E INCIDENCIA DE ENFERMEDAD RENAL EN LA POBLACIÓN GENERAL
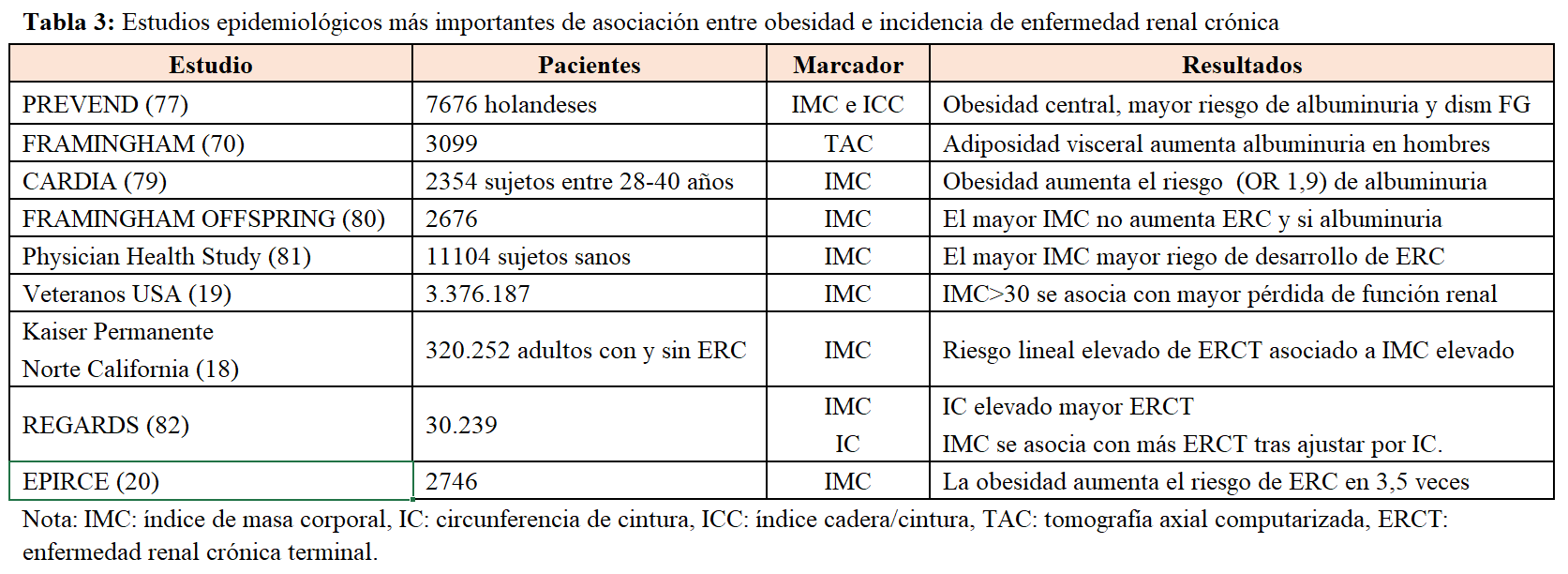
Muchos estudios epidemiológicos han mostrado que la obesidad aumenta el riesgo de desarrollo de enfermedad renal (Tabla 3).
En 320.252 sujetos de los miembros de la base del Kaiser Permanente del Norte de California, seguidos durante 25 años y partiendo de una función renal basal normal, el aumento de IMC aumentaba el riesgo de enfermedad renal. Los pacientes con obesidad clase I, II y III tuvieron un riesgo de desarrollo de enfermedad renal de 3,6, 6,2 y 7,1 respectivamente [18]. En un estudio epidemiológico reciente de más de 3 millones de sujetos de la base de datos de veteranos de USA, el riesgo de desarrollo de enfermedad renal aumentaba con el IMC, siendo este riesgo mayor en pacientes con edad avanzada [19]. El estudio EPIRCE [20] es un estudio observacional de una cohorte seleccionada española estratificado por hábitat, edad y sexo (n: 2.746) La prevalencia de obesidad (IMC>30kg/m2) fue del 26,1% y la odds ratio (OR) de desarrollo de la ERC fue de 3,5 (intervalo de confianza [IC] del 95%:2,0-6,0). Aparte de estos estudios epidemiológicos, datos más recientes han mostrado que el tratamiento de la obesidad mediante cirugía bariátrica puede revertir o retrasar la progresión de la enfermedad renal [21] [22]. Así, en una serie de casos de 233 pacientes con obesidad mórbida sometidos a cirugía bariátrica, los pacientes con ERC tuvieron un aumento de filtrado glomerular a los 12 meses [23]. En otra serie, de 255 pacientes con obesidad y diabetes, la disminución del IMC se asoció con una normalización del índice albúmina/creatinina en orina a los 12 meses [22].
En una amplia base de datos de 5,4 millones de adultos sanos publicada recientemente, el riesgo de disminución del filtrado glomerular aumenta progresivamente cuando el IMC supera los 25 Kg/m2 [24]. Estos datos son reproducibles en otro estudio realizado en población pediátrica [25]. En un 1,2 millones de adolescentes el sobrepeso u obesidad se asocian independientemente con el riesgo de desarrollar ERC a los 25 años, siendo esta asociación muy significativa para el desarrollo de nefropatía diabética con una HR de 39,95 en el percentil mayor de 95 del IMC.
Los efectos nocivos de la obesidad se extienden a otras enfermedades renales como el desarrollo de nefrolitiasis y neoplasias renales malignas. Un alto IMC se asocia con un aumento en la prevalencia e incidencia de nefrolitiasis. Un mayor peso corporal conlleva un pH ácido urinario, mayor excreción urinaria de ácido úrico, oxálico, sodio y fósforo [26] [27]. Las dietas proteicas disminuyen la concentración de citrato en orina, facilitando la precipitación de cristales de oxalato cálcico. Por otro lado la resistencia a la insulina que se asocia a la obesidad predispone a la nefrolitiasis, al modificar la amoniogénesis, el intercambio tubular Na-H y la acidificación de la orina. En otro sentido, la cirugía bariátrica se asocia a un riesgo elevado de oxaluria y por lo tanto de nefrolitiasis, ya que aumenta la absorción enteral de ácido oxálico.
La obesidad aumenta el riesgo de desarrollar hipertensión arterial e hiperaldosteronismo. Los pacientes obesos necesitan una tensión arterial más elevada para excretar la misma cantidad de sodio, desarrollando una hipertensión arterial sal sensible. Además la obesidad abdominal por diferentes mecanismos estimula la liberación de factores estimulantes de aldosterona como las adipocitoquinas CTRP1 (C1q-TNF related protein-1) [28]. Por eso, en los pacientes obesos con hipertensión arterial, el tratamiento con antagonistas de los receptores de aldosterona es de elección para el control tensional.
La obesidad aumenta también el riesgo de algunos tipos de neoplasias malignas, particularmente del cáncer renal. En un estudio poblacional del Reino Unido, que incluyó 5,24 millones de individuos, el incremento en el IMC de 5 kg/m2 se asoció con un riesgo mayor del 25% de desarrollo de cáncer renal, atribuyendo el 10% de todos los cánceres renales al exceso de peso [29]. En otro trabajo, se estimó que un 17 y un 26% de todos los cánceres renales en hombres y mujeres, respectivamente, fueron atribuibles al sobrepeso [30]. En un meta-análisis que incluyó datos de 221 estudios, de los cuales 17 evaluaron neoplasias renales, la obesidad aumentó el riesgo de cáncer renal un 24% (riesgo relativo por cada 5 kg/m2 de IMC de incremento: 1,24; IC 95%: 1,20-1,28; p<0,0001) [31]. Los mecanismos implicados en el mayor riesgo de aparición de neoplasias renales en individuos obesos son poco claros. Se especula que posibles mecanismos como la resistencia a la insulina, o el aumento de factor de crecimiento similar a insulina tipo 1 (IGF-1), estimularía factores de crecimiento de células tumorales, así como que alteraciones de las funciones endocrinas del tejido adiposo podrían tener efectos sobre la inmunidad [32].
MECANISMOS FISIOPATOLÓGICOS DE DAÑO RENAL EN LA OBESIDAD
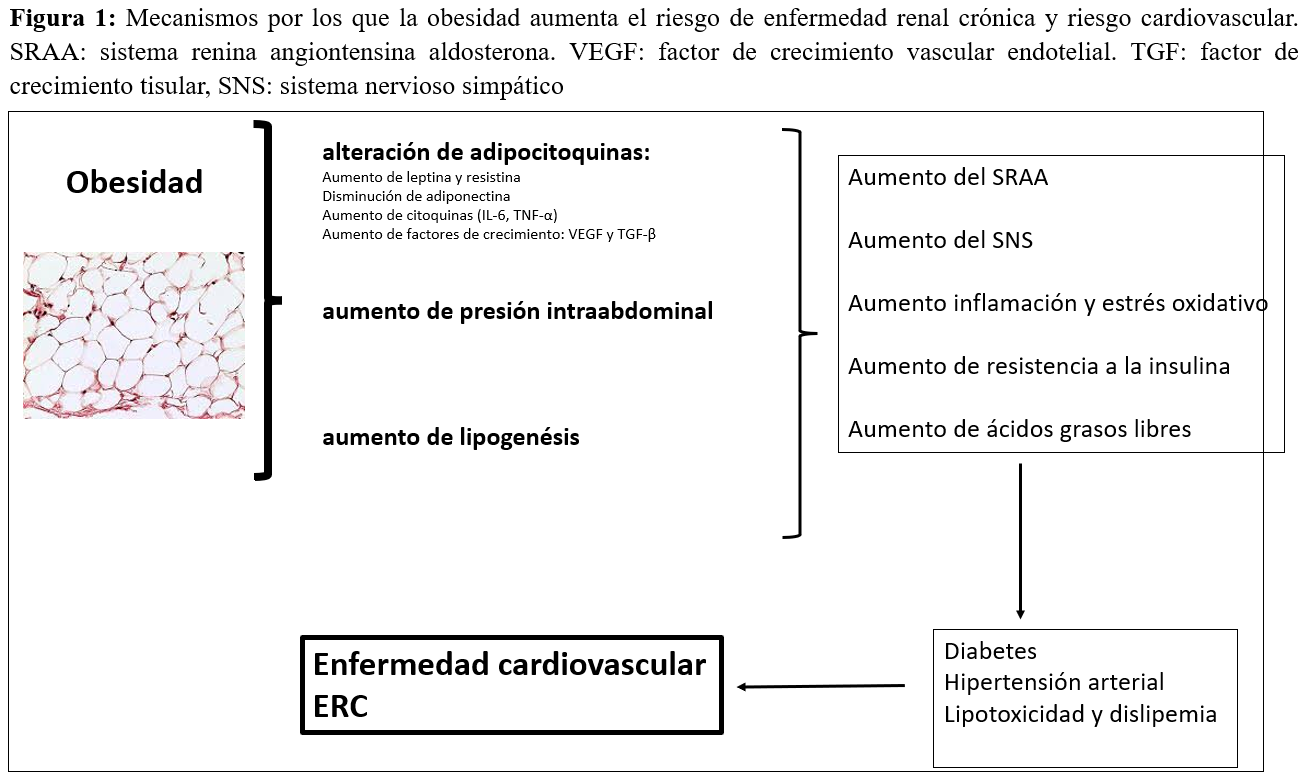
La obesidad produce anomalías metabólicas complejas que influyen en las diversas enfermedades que afectan a los riñones. El mecanismo exacto a través del cual la obesidad puede empeorar o generar ERC es aún poco claro. El hecho de que la mayoría de los individuos obesos nunca desarrollen ERC, indica que el aumento de peso por sí solo no es suficiente para inducir daño renal [33]. La obesidad produce daño renal de forma secundaria ya que aumenta el riesgo de diabetes mellitus, hipertensión y daño cardiovascular, pero también produce daño renal de forma directa a través de alteraciones hemodinámicas, inflamatorias, y disregulación de factores de crecimiento y adipocitoquinas [34]. La obesidad conlleva una disregulación de la secreción de adipocitoquinas, con aumento de leptina y disminución de adiponectina, que alteran el sistema simpático, el sistema renina-angiotensina, aumentan la inflamación, el estrés oxidativo y resistencia a insulina [35]. La obesidad conduce a una mayor producción de leptina, que aumenta el estrés oxidativo, estimula el sistema nervioso simpático, y aumenta glomeruloesclerosis, fibrosis renal y proteinuria. Por el contrario, la adiponectina protege al riñón reduciendo la disfunción de podocitos, estando la secreción de esta citoquina disminuida en pacientes obesos. Sin embargo, en pacientes en hemodiálisis los niveles más elevados de adiponectina se asocian paradójicamente con tres veces más riesgo de muerte, independientemente de la composición corporal y niveles lipídicos. El exceso de grasa visceral estimula factores de crecimiento como TGF-ß y sistema renina-angiotensina, que promueven la fibrosis renal (Figura 1).
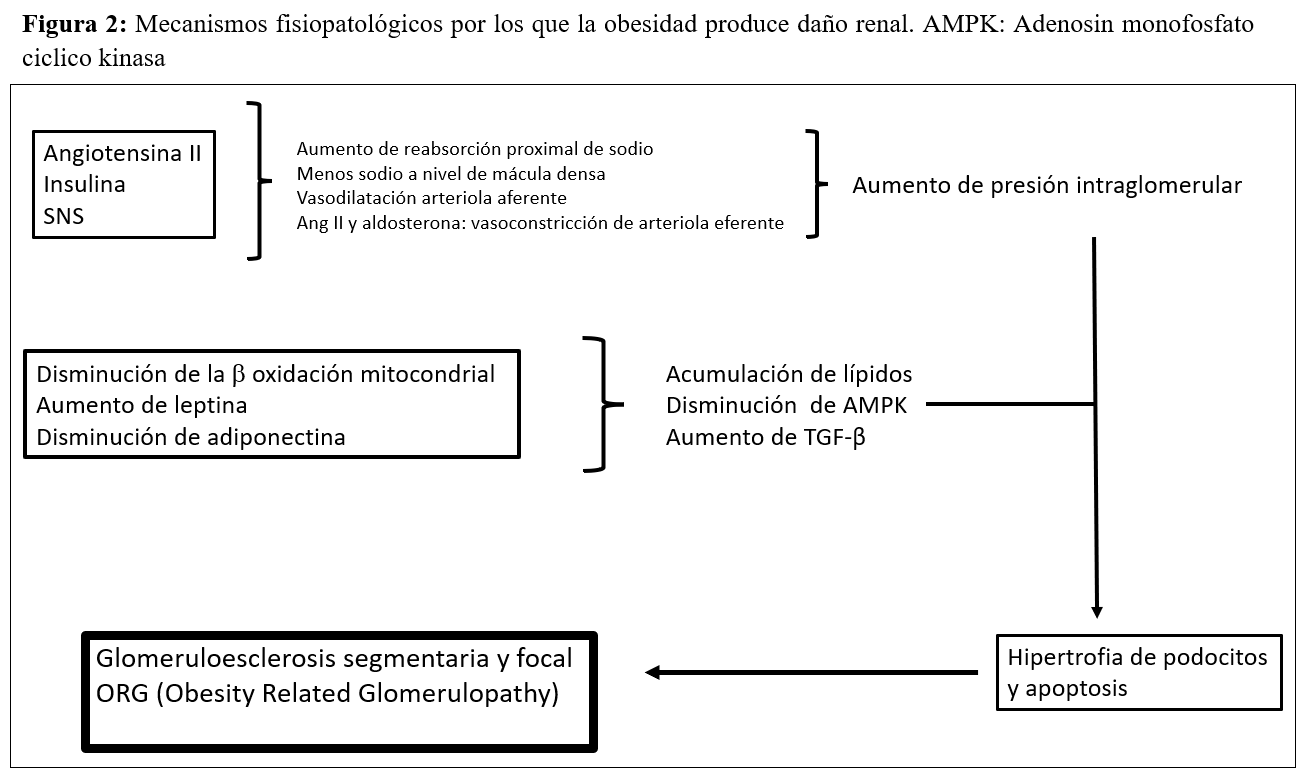
La obesidad aumenta la reabsorción de sodio a nivel del túbulo proximal, lo que implica una disminución de la entrega de sodio a nivel de la mácula densa, un aumento del feedback tubuloglomerular, vasodilatación de la arteriola aferente, aumento de presión intraglomerular, podocitopatía y proteinuria. En algunos casos, al final se desarrolla una glomeruloesclerosis segmentaria y focal denominada glomerulopatía relacionada con la obesidad (ORG) [36] (Figura 2). Se desconoce por qué algunos individuos obesos desarrollan este tipo de glomerulopatía y otros no. La incidencia de la llamada glomerulopatía relacionada con la obesidad se ha incrementado hasta 10 veces en el periodo comprendido entre 1986 y el año 2000. Es importante destacar que la ORG en ocasiones se presenta en conjunto con otros procesos fisiopatológicos propios de otras enfermedades o de la edad avanzada, perpetuando la generación de mayor lesión renal en pacientes con hipertensión o en ancianos [37]. Por otra parte, la obesidad se asocia con un aumento de receptores endocannabinoides tipo 1 que puede conducir a fibrosis e inflamación. El papel que pueden tener los antagonistas de los receptores cannabinoides en la protección del daño renal en la obesidad está por dilucidar [38].
En resumen, los cambios patológicos renales que se observan en el riñón de los pacientes obesos se pueden resumir en: acumulación ectópica de lípidos y aumento de los depósitos grasos en el seno renal [39], el desarrollo de hipertensión glomerular e incremento de la permeabilidad glomerular generada por un estado de hiperfiltración, el cual se asocia al daño en la barrera de filtración glomerular y finalmente, el desarrollo de glomerulomegalia y glomeruloesclerosis focal y segmentaria (Figura 2) [40] [41].
OBESIDAD Y MORTALIDAD EN PACIENTES CON ENFERMEDAD RENAL
Teniendo en cuenta la evidencia sobre los efectos deletéreos de la obesidad en varios procesos patológicos, es un contrasentido pensar que la obesidad se asocie a menores tasas de mortalidad en pacientes con ERC no en diálisis y en pacientes en diálisis [42]. Pero la realidad es que hay numerosos estudios epidemiológicos descritos en la literatura actual que así lo muestran. Esta asociación paradójica también se ha descrito en otras poblaciones como la insuficiencia cardiaca terminal o enfermedad pulmonar obstructiva crónica, que tienen en común un aumento del tejido adiposo pardo que se asocia con mayor gasto calórico y probable desnutrición proteico-calórica [43].
En el continuum de la ERC, la asociación obesidad/mortalidad también es variable: en el grupo de pacientes con ERC (estadio 1-5) no en diálisis, se mueren menos los pacientes con IMC 30-35 Kg/m2, y se mueren más los que tienen un IMC menor de 25 kg/m2 mostrando esta asociación una curva en "U". En pacientes en diálisis, los obesos, incluso aquellos con obesidad mórbida, se mueren menos y en pacientes portadores de trasplante renal se mueren más los obesos [44].
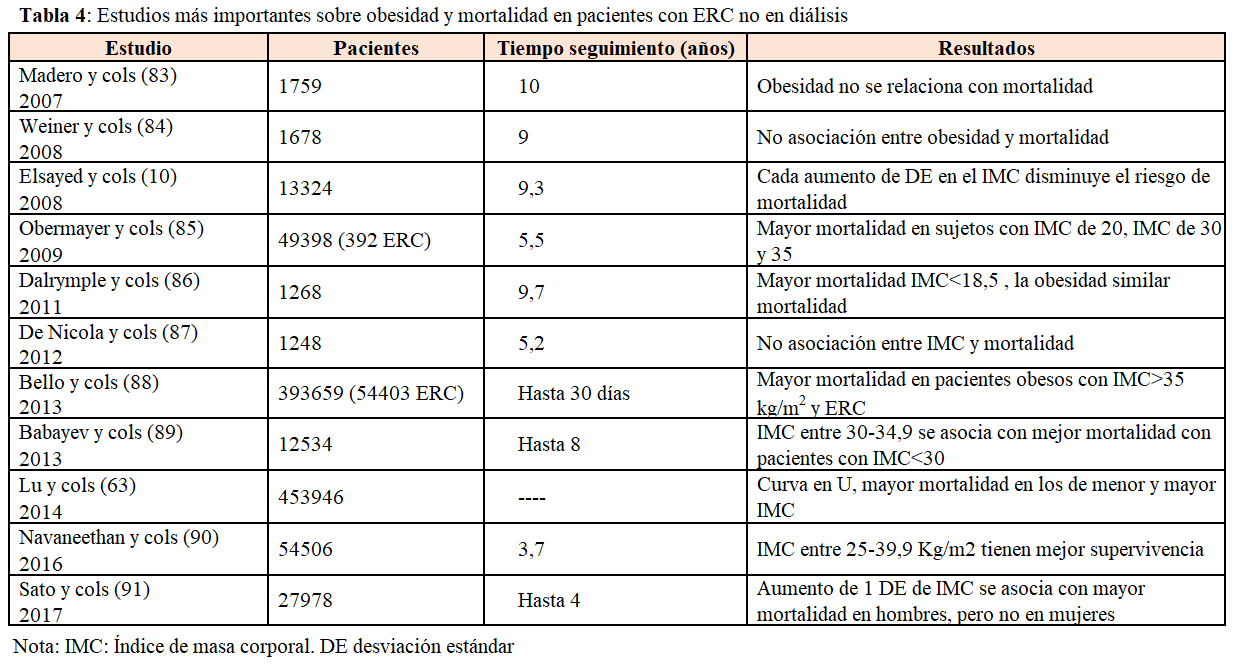
En pacientes con ERC no diálisis, los datos que relacionan mortalidad y obesidad son confusos, con datos contradictorios (Tabla 4). Ahmadi y cols realizaron un metanálisis que incluyó 4 estudios de pacientes con diferentes estadios de ERC (estadios 3-5), encontrando que los pacientes con IMC menor de 25 eran los que tenían mayor mortalidad, los que tenían sobrepeso u obesidad clase I se morían menos, y aquellos con obesidad clase II y III no tenían relación con la obesidad [45]. Sin embargo, en los estudios más recientes parece que la asociación depende del grupo de edad en que se valore. Así, en un gran estudio epidemiológico realizado en veteranos americanos, los sujetos con IMC < 25 y >30 kg/m2 eran los que mayor mortalidad tenían, mostrando una curva en U, pero tras ajustar por el índice albúmina/creatinina en orina, la asociación mayor IMC mayor mortalidad se mantenía en el grupo de pacientes jóvenes y se atenuaba en el grupo de pacientes con mayor edad [19].
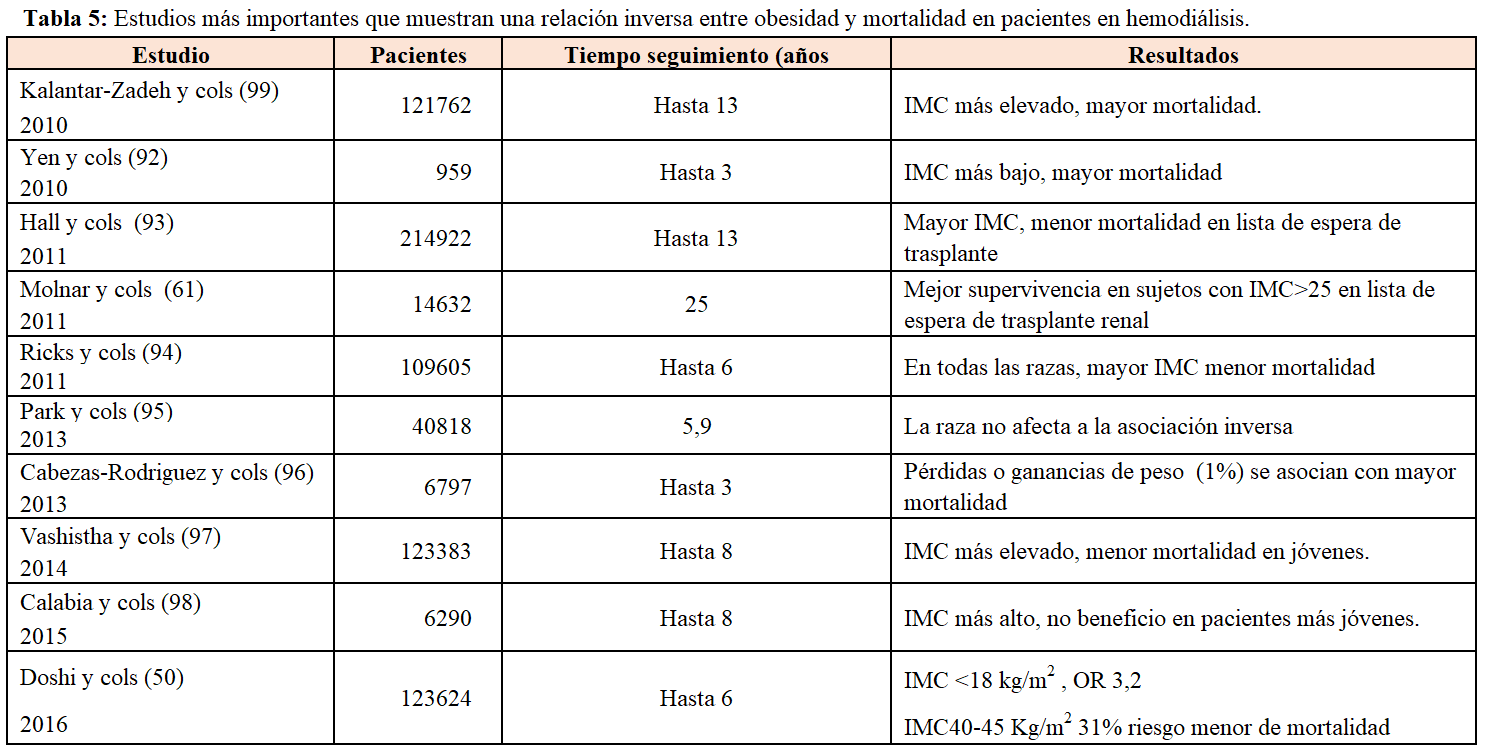
En contraste con los datos confusos de la asociación mortalidad y obesidad en pacientes con diferentes estadios de ERC, en pacientes en diálisis todos los estudios muestran una asociación paradójica, de tal forma que los pacientes obesos tienen menor mortalidad en todas las series estudiadas [46]. El estudio colaborativo DIAPHANE fue el primero en describir que en 1453 pacientes en diferentes unidades de diálisis francesas, aquellos con IMC elevado no tenían mayor mortalidad [47]. Estos datos fueron confirmados en 3607 pacientes de la base de datos de USRDS [48] y en un estudio realizado por Fleishman y cols [49], que confirmaron que no solo la obesidad no aumentaba la mortalidad, sino que la mortalidad era menor cuanto más aumentaba el IMC. Posteriormente, muchos estudios epidemiológicos han confirmado esta relación paradójica (Tabla 4). La mayoría de estos estudios se basan en una evaluación del IMC en un determinado momento y este parámetro se ve muy modificado a lo largo de la vida en diálisis. Recientemente, Doshi y cols [50] evaluaron 120000 pacientes en diálisis, midieron el IMC a lo largo del tiempo y realizaron un análisis de modelo marginal estructural. Los pacientes con IMC
Es posible que el efecto aparentemente protector de un alto IMC en pacientes en diálisis, sea el resultado de que el IMC no es un buen marcador de obesidad, ya que no distingue el efecto de la adiposidad y de otros tejidos no adiposos (músculo) sobre el IMC. En este sentido, los estudios que separaron los efectos de una mayor circunferencia de cintura de aquellos con mayor IMC demuestran una reversión en la asociación inversa con la mortalidad [52]. También se ha demostrado que una mayor masa muscular explica al menos algunos de los efectos positivos atribuidos al IMC elevado [53]. Sin embargo, existe evidencia que señala que mayores niveles de adiposidad, especialmente grasa subcutánea (no visceral), se asocian con mejores resultados en pacientes con ERCT [54]. Tales beneficios pueden estar presentes en pacientes que tienen una corta expectativa de vida, y ya hay trabajos que muestran que el IMC elevado tiene un efecto protector a corto plazo pero no a largo [55]. A corto plazo, una mayor masa corporal, sobre todo en individuos previamente enfermos, puede tener efectos beneficiosos sobre la mortalidad. Las mayores reservas energético-proteicas son beneficiosas ante una enfermedad aguda y una mayor masa muscular ofrece mayor capacidad antioxidante.
Por lo tanto las posibles explicaciones a esta asociación paradójica entre obesidad y mortalidad en diálisis se pueden resumir en estos puntos:
1) El IMC no define la obesidad visceral. Estudios que valoran otros parámetros como la circunferencia de la cintura, demuestran que este parámetro se correlaciona mejor con mortalidad global y cardiovascular en diálisis.
2) Los pacientes obesos son más resistentes al impacto de la caquexia y desnutrición proteico-calórica típica en el paciente en diálisis y sobre todo en el paciente inflamado, y por lo tanto a la transición del tejido adiposo blanco-marrón.
3) El tejido adiposo podrían secuestrar citoquinas inflamatorias, muy elevadas en el paciente en diálisis
4) Los pacientes obesos tienen menos alteraciones hemodinámicas, sufriendo menos hipotensiones intradialíticas, parámetro que aumenta la mortalidad .
5) El IMC elevado protege a corto plazo, pero cuando el tiempo de seguimiento es mayor la obesidad aumenta la mortalidad.
En los pacientes en diálisis peritoneal, también los estudios muestran resultados heterogéneos. En un trabajo que incluyó más de 40.000 pacientes incidentes en diálisis peritoneal [56], aquellos que tenían sobrepeso u obesidad clase I tuvieron mejor supervivencia que aquellos con IMC bajo. Sin embargo, en un estudio que incluyó 1.675 pacientes en hemodiálisis y 1.662 en diálisis peritoneal [57], un IMC mayor de 30 se asoció con menor mortalidad en los pacientes en HD pero no en pacientes en diálisis peritoneal. Similarmente en un estudio de 134.728 pacientes incidentes en diálisis de la base de datos de USRDS [58], el quintil más bajo de IMC se asoció con mayor mortalidad en HD y DP, sin embargo el quintil más alto se asoció con menor riesgo de mortalidad en hemodiálisis pero no en diálisis peritoneal. En un meta-análisis realizado en pacientes en diálisis peritoneal [59], de nuevo, el tiempo de seguimiento influía en la asociación obesidad-mortalidad. Así, si el seguimiento era de un año, los pacientes con IMC más bajo tuvieron el mayor riesgo de mortalidad mientras que los de sobrepeso y obesos tuvieron menor riesgo, pero si el intervalo de seguimiento se extendía a 2 o 3-5 años, no había relación con la mortalidad.
En el paciente trasplantado renal, los estudios muestran que el aumento de IMC aumenta el riesgo de mortalidad y pérdida del injerto [60]. Pero en un trabajo realizado por Molnar y cols [61] en 14.632 pacientes en hemodiálisis y en lista de espera de trasplante renal, el aumento en un punto del IMC pretrasplante se asoció con una menor mortalidad, mientras que pérdidas de peso de más de 5 kg en 6 meses se asociaron con un alto riesgo de mortalidad. Un meta-análisis que incluyó 4 estudios no encontró estos resultados [62], demostrando que la obesidad, el sobrepeso y el tener un IMC menor de 25 kg/m2 pretrasplante renal se asociaban con peor pronóstico: mayor mortalidad y pérdida de injerto renal. Estos hallazgos no apoyan la presencia de una asociación paradójica en pacientes portadores de trasplante renal. Los investigadores concluyen que en este grupo de pacientes respecto a los pacientes en hemodiálisis, la obesidad aumenta la mortalidad.
OBESIDAD Y PROGRESIÓN DE LA ERC
Muchos estudios han mostrado que la obesidad aumenta el riesgo de desarrollo de enfermedad renal a largo plazo. Sin embargo, si la obesidad empeora la función renal en pacientes con ERC previa, permanece sin clarificar. Lu y cols [63] realizaron un estudio epidemiológico en 453.496 sujetos con FGe menor de 60 ml/min/1,73 m2, y mostraron que un IMC mayor de 35 Kg/m2 se asocia con mayor progresión de la enfermedad renal en estadios iniciales, pero no en pacientes con FGe menor de 30 ml/min/1,73 m2. Un subanálisis del estudio HALT publicado recientemente, demuestra que la obesidad acelera el crecimiento de los quistes renales en pacientes con enfermedad poliquística del adulto [64]. Sin embargo, otros estudios no han demostrado esta asociación positiva. En el estudio CRISIS, realizado en 499 sujetos diabéticos y no diabéticos con ERC previa, el IMC como variable contínua y la obesidad no modificaron la progresión de la enfermedad renal ni en diabéticos ni en no diabéticos [65]. En otro trabajo que incluyó 214 pacientes con ERC previa, seguidos durante cuatro años y medio, la obesidad no aumentó la progresión de la enfermedad renal crónica [66].
Un meta-análisis reciente [45], que incluyó 4 estudios con una n de 484.906 pacientes con ERC estadio-3-5, demostró que solo en el grupo de pacientes con obesidad mórbida (clase III) se mantenía una asociación entre obesidad y progresión a enfermedad renal crónica terminal.
Una posible explicación a estos resultados contradictorios, es que estemos mezclando individuos obesos metabólicamente sanos y obesos metabólicamente no sanos, o lo que es lo mismo pacientes obesos con síndrome metabólico asociado o sin síndrome metabólico. El estudio REGARDS realizado en población coreana, dividió a 1.940 pacientes con ERC en dos grupos según fueran obesos con y síndrome metabólico, los pacientes obesos con síndrome metabólico asociado progresan más rápidamente, pero también lo hacen aquellos sin síndrome metabólico en relación con los no obesos, por lo tanto no parece que la explicación se base en que haya obesos metabólicamente sanos o no [67]. Estos hallazgos también fueron confirmados en un gran estudio epidemiológico que incluyó 62.249 sujetos metabólicamente sanos sin enfermedad renal previa, en los que la obesidad aumentó el riesgo de incidencia de ERC independientemente de que no tuvieran síndrome metabólico asociado [68].
En un meta-análisis de estudios experimentales en pacientes obesos con ERC, las intervenciones encaminadas a reducir el peso corporal mostraron beneficios en reducir la tensión arterial, hiperfiltración glomerular y proteinuria [69]. En un análisis post hoc del estudio REIN se demostró que el efecto nefroprotector de la inhibición de la ECA en pacientes con ERC y proteinuria es mayor en obesos con ERC, pero mínimo en pacientes con ERC e IMC normal o bajo [70]. Los resultados contradictorios en pacientes con obesidad y ERC avanzada o diálisis limitan las recomendaciones sobre la pérdida de peso en estos grupos poblacionales.
TRATAMIENTO DE LA OBESIDAD EN PACIENTES CON ERC
Independientemente del efecto de la obesidad en la incidencia y la progresión de la ERC, la obesidad es un factor asociado con morbilidad en los pacientes con ERC y que limita el cuidado de los mismos. Los pacientes obesos tienen más complicaciones para la realización de una fistula arterio-venosa, siendo en la mayoría portadores de un catéter permanente [71]. Además la obesidad impide el acceso al trasplante renal y se asocia con muchas más complicaciones cuando éste se realiza: infecciones de herida, mayor estancia hospitalaria e incluso mayor mortalidad. Aunque hay mucha discrepancia en los diferentes centros trasplantadores, en la mayoría el acceso al trasplante está contraindicado en pacientes con IMC≥ 35 kg/m2 [72].
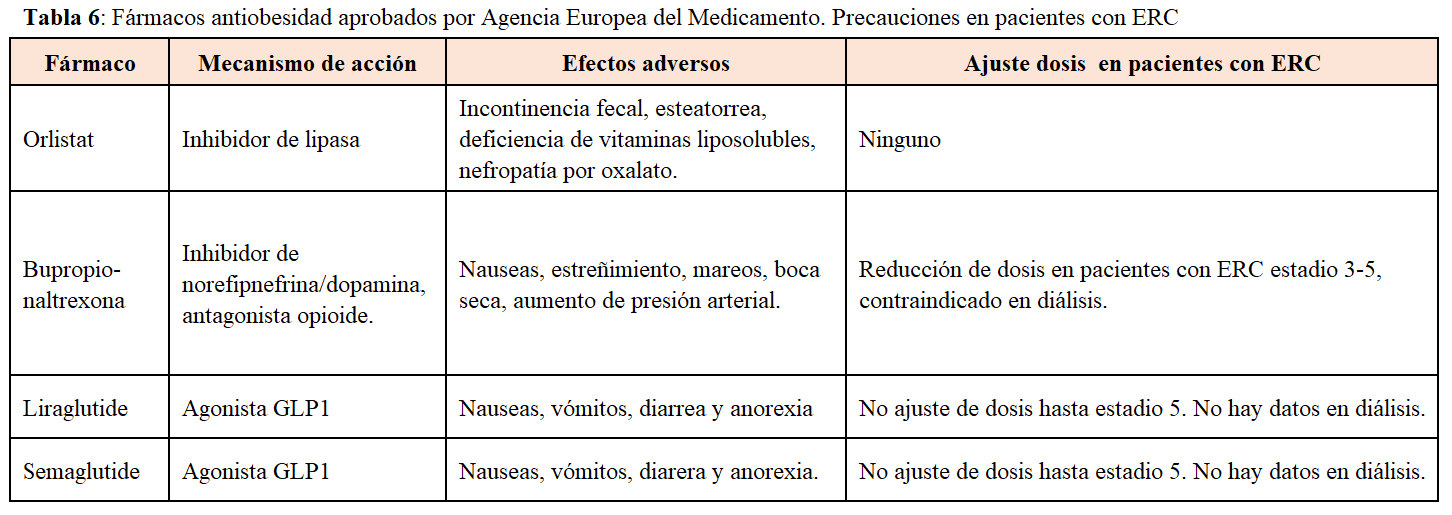
El tratamiento para la obesidad incluye cambios en el estilo de vida, fármacos y cirugía. Los cambios en el estilo de vida: dietas, ejercicio físico, reducción de estrés…etc, solo son capaces de lograr una reducción de peso sustancial en una minoría de pacientes [73]. Además, las recomendaciones dietéticas especificas de la ERC limitan la efectividad de las dietas antiobesidad. Los tratamientos antiobesidad que alteran la regulación neuroendocrina tienen importantes limitaciones en los pacientes con ERC [74]. Por ejemplo, orlistat no es recomendado por sus efectos secundarios como la esteatorrea e hiperoxaluria y su inefectividad a largo plazo). Ibupropion/naltrexona de liberación prolongada no está validado en pacientes con ERC y presenta importantes efectos secundarios que limitan su uso. Una clase de antidiabéticos con resultados prometedores en el campo de la obesidad son los agonistas de los receptores del péptido-glucagon tipo 1 (arGLP1) que además han mostrado un efecto renoprotector en pacientes con ERC disminuyendo la albuminuria. Liraglutide y semaglutide han sido aprobados por la FDA y EMA para el tratamiento de la obesidad en pacientes no diabéticos. Ambos fármacos pueden ser utilizados hasta filtrados de 15 ml/min, tienen escasos efectos secundarios y han mostrado como en el caso de semaglutide una disminución media de peso de 15% a las 68 semanas de tratamiento [75]. Otro grupo de fármacos antidiabéticos renoprotectores y que disminuyen peso, aunque en menor proporción que los arGLP1, son los inhibidores de los cotransportadores sodio-glucosa tipo 2. La asociación de ambos fármacos en los pacientes diabéticos con ERC es una alternativa terapéutica eficaz contra la obesidad (72). En la (Tabla 6) se muestran los fármacos aprobados por la EMA para el tratamiento de la obesidad, mecanismo de acción e indicación en pacientes con ERC.
La cirugía bariátrica puede ser una opción terapéutica eficaz en pacientes con ERC estadio 3 y 4 con importantes beneficios metabólicos y renoprotectores. Aunque las complicaciones y efectos adversos: fracaso renal agudo, reintervenciones, hiperoxaluria, complicaciones quirúrgicas…etc, son mucho más frecuentes en pacientes renales comparados con la población general, por lo que limita su indicaciones [76].
PUNTOS CLAVE:
1.-La epidemia mundial de obesidad afecta a toda la población del planeta, aumentando la morbimortalidad y el gasto sanitario.
2.- La obesidad no solo aumenta el riesgo de HTA, diabetes y síndrome metabólico, sino que también aumenta la incidencia de enfermedad renal, nefrolitiasis y neoplasias renales.
3.- El IMC no es un buen marcador clínico para evaluar la obesidad en los pacientes renales. Otros marcadores como el índice cintura-cadera o fenotipo cintura-hipertrigliceridemia, como marcadores de adiposidad visceral, necesitan ser validados en pacientes con ERC
4.-Existe una relación inversa (paradójica) en pacientes con ERC en diálisis (sobre todo en hemodiálisis) entre obesidad y mortalidad. Las explicaciones a esta asociación inversa podrían basarse en: la utilización como marcador de IMC, corto tiempo de seguimiento de los estudios, mejor tolerancia hemodinámica de los obesos, mayor secuestro de citoquinas o menor grado de inflamación.
5.- Un porcentaje de pacientes obesos desarrollan una glomerulopatía similar a la glomeruloesclerosis segmentaria y focal (ORG). El por qué unos la desarrollan y otros no está por investigar
6.- No hay estudios suficientes que demuestren que la obesidad aumenta la progresión de la enfermedad renal crónica. Sin embargo, estrategias que disminuyen la obesidad, disminuyen la proteinuria y aumentan el filtrado glomerular. A pesar de la falta de evidencia, siempre será mejor tener un IMC adecuado para evitar hipertensión, diabetes y aumento de albuminuria.
7.- El tratamiento de la obesidad en pacientes con ERC mejora las alteraciones metabólicas y disminuye la progresión renal. En la actualidad el grupo de fármacos agonistas de receptores GLP-1 podría ser una válida opción terapéutica para el control de la obesidad y la renoprotección en este grupo de pacientes.