Nomenclatura de la afectación renal en la diabetes mellitus
INTRODUCCIÓN
Desde la descripción inicial de las lesiones histológicas asociadas a la enfermedad renal (ER) de los pacientes diabéticos realizada por Kilmmestiel y Wilson [1] hasta la actualidad, hemos vivido una evolución tanto epidemiológica como clínica con la descripción de diversas formas de presentación de la enfermedad renal crónica (ERC) asociada a la diabetes (DM) con correlación histológica bien diferenciada.
Sin embargo; la nomenclatura de esta entidad no ha logrado adaptarse a dicha evolución y numerosos términos tales como “nefropatía diabética”, “enfermedad renal asociada a diabetes”, “enfermedad renal no diabética del paciente diabético”, etc… han convivido sin llegar a lograr un consenso. Más allá de la falta de uniformidad, la consecuencia más importante de esta terminología ambigua y confusa ha sido una alta tasa de infradiagnóstico de ER en el paciente diabético con implicaciones pronósticas y terapéuticas relevantes.
Las ultimas guías KDIGO sobre ER y diabetes han salido al paso de este problema proponiendo una terminología inclusiva para todo el espectro de esta entidad bajo el termino de “diabetes y enfermedad renal”.
Revisaremos en este capitulo las diversas formas fenotípicas de la diabetes con enfermedad renal que justifican esta terminología confusa, con sus correspondientes correlaciones histológicas, así como las implicaciones clínicas y epidemiológicas derivadas de utilizar una u otra terminología en la actualidad.
EVOLUCIÓN DE LA NOMENCLATURA DE LA ENFERMEDAD RENAL EN LA DIABETES
Describir la nomenclatura referente a la ER asociada a la DM equivale a hacer un repaso histórico del conocimiento sobre esta entidad. Descrita por primera vez en 1936 por Kilmmestiel y Wilson en las autopsias de ocho pacientes con diabetes, albuminuria, hipertensión e insuficiencia renal, su principal característica histológica era la presencia de “glomeruloesclerosis nodular”. Posteriormente, Bell et al en 1946 [2] describieron una forma de “glomeruloesclerosis difusa” con cierta controversia respecto a su especificidad para la DM y con prevalencia variable en los estudios realizados en autopsias.
El inicio de la biopsia percutánea, así como la microscopía electrónica promueven un importante avance en el conocimiento de la fisiopatología de esta entidad, diferenciando los cambios histológicos específicos de los distintos componentes renales tal y como los conocemos en la actualidad.
En los años 70-80, empiezaron a identificarse cambios histológicos en estadios precoces de afectación renal en el paciente diabético tales como aumento de la superficie de filtración capilar glomerular [3] y engrosamiento de la membrana basal glomerular (MBG) [4]. Además; empiezan a identificarse distintas formas histológicas de afectación renal del paciente DM con predominio de cambios isquémicos en algunos pacientes en contraposición a las formas nodulares clásicas. Modelos experimentales de estenosis de la arteria renal en ratas diabéticas demuestran que los riñones isquémicos no desarrollan las lesiones clásicas de glomeruloesclerosis nodular [5]. Por lo que se deduce, que es necesaria la presencia de aumento de la presión de perfusión renal y de la presión capilar glomerular para el desarrollo de la lesión histológica característica, a la que pasa a denominarse nefropatía diabética. No es hasta 1993 [6] cuando se demuestra que la DM tipo 1 y 2 tienen patrones de lesión renal indistinguibles con correlación clínico-histológica similar.
En las guías KDIGO de diabetes y ERC de 2007, se recogían los criterios para el diagnóstico de ER diabética del siguiente modo: microalbuminuria o macroalbuminuria en presencia de retinopatía diabética en DM tipo 2 y microalbuminuira y duración de la DM superior a 10 años en DM tipo 1. Siempre en ausencia de otra causa que justifique enfermedad renal y en ausencia de rasgos sugerentes de enfermedad no diabética (caída brusca de filtrado glomerular, aumento brusco de proteinuria, etc) [7]. Sin embargo, en 2010 Tervaert C et al [8] clasifican las lesiones histológicas de la ER del paciente DM incluyendo formas de predominio vascular y/o túbulo-intersticial. Se propone entonces el término “enfermedad renal diabética” para incluir la nefropatía diabética clásica de afectación predominantemente glomerular y estas otras formas histológicas con afectación vascular y tubulointersticial en cuya manifestación clínica suele faltar la presencia de albuminuria. Y se incluye además en la clasificación la posible presentación de otras entidades sobreimpuestas (enfermedad renal no-diabética en el paciente diabético) [9]. A pesar de ello, este fenotipo de enfermedad renal diabética no-proteinúrica ha quedado conceptualmente excluido en múltiples guías y algoritmos diagnósticos.
EL PROBLEMA DEL INFRADIAGNOSTICO DE LA ENFERMEDAD RENAL ASOCIADA A DIABETES
La alta variabilidad en la prevalencia de la ER en la población diabética atiende, además, de a diferencias socioeconómicas, a importantes sesgos en el cribado de la población de riesgo, así como a la inconsistencia terminológica que hemos expuesto. El resultado final, es una alta tasa de ERC no diagnosticada en el paciente diabético, fundamentalmente tipo 2.
Todas las guías de cribado de ER incluyen al menos una determinación anual de creatinina sérica, filtrado glomerular estimado (FGe) por fórmulas estandarizadas y cociente albúmina-creatinina en orina en todo paciente DM tipo 2 y tras cinco años del debut de DM tipo 1 [10]. A pesar de ello, el cumplimiento de estas recomendaciones está lejos de ser el ideal. Un estudio reciente en población estadounidense mostró que entre los pacientes adultos con DM tipo 2 solo un 52,6 % tenía una determinación anual de albuminuria. Este porcentaje de cribado era ampliamente variable dependiendo de tipo de organización y área geográfica, con un indiscutible impacto en la estimación de la prevalencia de albuminuria en la población con DM2. Así, en pacientes con DM2 y tasas de cribado de albuminuria de 20%, 50% y 100% la prevalencia de albuminuria fue, respectivamente, de 6%, 15% y 30% [11]. En nuestro país disponemos de casuística similar. El estudio RECORDYS en población del Departamento de Salud Valencia Clínico –Malvarrosa realizado en 2015 mostró que solo un 44,2% de los pacientes con DM tipo 2 tenían una determinación anual de cociente albúmina-creatinina en orina [12].
Aunque el incumplimiento de las indicaciones para el cribado de enfermedad renal en la población con DM es alarmante, aun lo es más la baja tasa de identificación del diagnóstico “enfermedad renal diabética” o incluso el más genérico “enfermedad renal crónica” en pacientes que reúnen criterios por determinación de FGe y/o de cociente albúmina-creatinina en orina.
El análisis de los registros de historia clínica electrónica de más de 15.000 pacientes DM2 atendidos en el Hospital Puerta de Hierro Majadahonda entre los años 2009-2019 detectó la presencia ERC atendiendo a la presencia de albuminuria y /o perdida de FG (estimado por CKD-EPI) en 4.526 pacientes de los cuales sólo 1.498 (33%) tenían el diagnóstico de “enfermedad renal crónica” y sólo 341 (7,5%) tenían el diagnóstico de enfermedad renal diabética (agrupando todos los términos en uso: “enfermedad renal diabética”, “nefropatía diabética” y “enfermedad renal crónica diabética”) [13]. La mayor tasa de infradiagnóstico aparecía en los pacientes con valores bajos de albuminuria, en mujeres y en ancianos, siendo este un hecho que se repite en otras series [14]. Esto pone de manifiesto que el problema no se limita sólo a realizar un correcto seguimiento del paciente DM2, sino a realizar una correcta interpretación de los resultados analíticos e incorporar el diagnostico de “enfermedad renal diabética” bajo cualquiera de sus acepciones, en los registros de salud.
Este infradiagnóstico origina no solo estimaciones epidemiológicas erróneas, sino que tiene evidentes implicaciones pronósticas para el paciente diabético. El bloqueo del sistema renina-angiotensina-aldosterona (SRAA) y los nuevos antihiperglucemiantes con efecto cardio- y nefroprotector (inhibidores del cotrasportador sodio glucosa tipo 2 -iSGLT2-, y agonistas del receptor del péptido similar al glucagón tipo 1 -arGLP-1-,) han modificado drásticamente el futuro del paciente DM2 con ER disminuyendo su mortalidad, frenando la caída de FGe y retrasando su entrada en diálisis. El infradiagnóstico de ERC provoca una pérdida de oportunidad de intervención, como demuestra el estudio de Swarling et al. en población sueca, con menores tasas de remisión al especialista en nefrología y/o retraso en el inicio de tratamiento con bloqueadores del SRAA o estatinas cuando estuviese indicado [14]. No disponemos de un análisis similar en población DM2, pero es de suponer un efecto similar: no identificar adecuadamente al paciente DM2 con ER podría estar limitando el acceso de estos pacientes a un tratamiento farmacológico que modifique su evolución de forma definitiva.
¿QUÉ TERMINOLOGÍA ADOPTAR EN EL PACIENTE DM CON ENFERMEDAD RENAL?
Las recientes guías KDIGO 2022 sobre ER y DM abordan este tema en su introducción. La mayor parte de la enfermedad renal presente en el paciente diabético es de etiología diabética (salvo la existencia de otras causas de deterioro de función renal evidentes). Aunque en algunos casos la enfermedad renal del paciente diabético es de causa heterogénea, no existe en la actualidad un claro consenso sobre el uso de biomarcadores o de la biopsia renal para diagnosticar y clasificar la ER diabética. Por ello, las guías KDIGO optan por tratar a todos los pacientes con diabetes y enfermedad renal del mismo modo, atendiendo únicamente a FGe y albuminuria. Y esta es la terminología que se adopta en adelante en este documento: diabetes y enfermedad renal [15].
Este posicionamiento se basa en la potencia de los ensayos clínicos realizados en los últimos años con iSGLT2 y arGLP-1 que han demostrado un beneficio clínicamente relevante en un amplio grupo de pacientes diabéticos tipo 2 con variado rango de FGe y diversas tasas de albuminuria. Optar por una terminología que incluya a la mayoría de los pacientes con DM y enfermedad renal con formas de presentación variadas, es sin duda un posicionamiento que trata de facilitar que el acceso a esta terapia sea universal, especialmente cuando hasta la fecha no parece haber grupos de pacientes renales con DM2 representados en los ensayos clínicos que no se beneficien de la inclusión de un iSGLT2 o un arGLP-1 en su régimen terapéutico [16] [17] [18] [19] .
En las guías KDIGO 2022 de diabetes y ER se desaconseja de forma explícita el uso del término “nefropatía diabética” por considerar que está obsoleto y carece de un claro consenso que lo defina. Sin embargo, considera adecuado el uso del término “enfermedad renal diabética”, clásicamente usado para incluir la mayoría de las formas histológicas de afectación renal del paciente diabético, cuando se reconoce esta limitación.
LIMITACIONES DE LA TERMINOLOGIA DM Y ENFERMEDAD RENAL: FENOTIPOS DE ENFERMEDAD RENAL EN LA DIABETES
A lo largo de este capítulo hemos revisado la evolución de la terminología de la ER del paciente diabético y la dificultad que ha entrañado encontrar términos que fuesen representativos de esta entidad. La explicación a este problema aún sin clara solución es la variabilidad fenotípica de la afectación renal del paciente diabético: desde las formas proteinúricas clásicas hasta las formas no albuminúricas de lenta evolución, hay un abanico de presentaciones clínicas con pronóstico renal claramente diferenciado, con rasgos histológicos específicos y en algunos casos con biomarcadores que podrían facilitar su identificación.
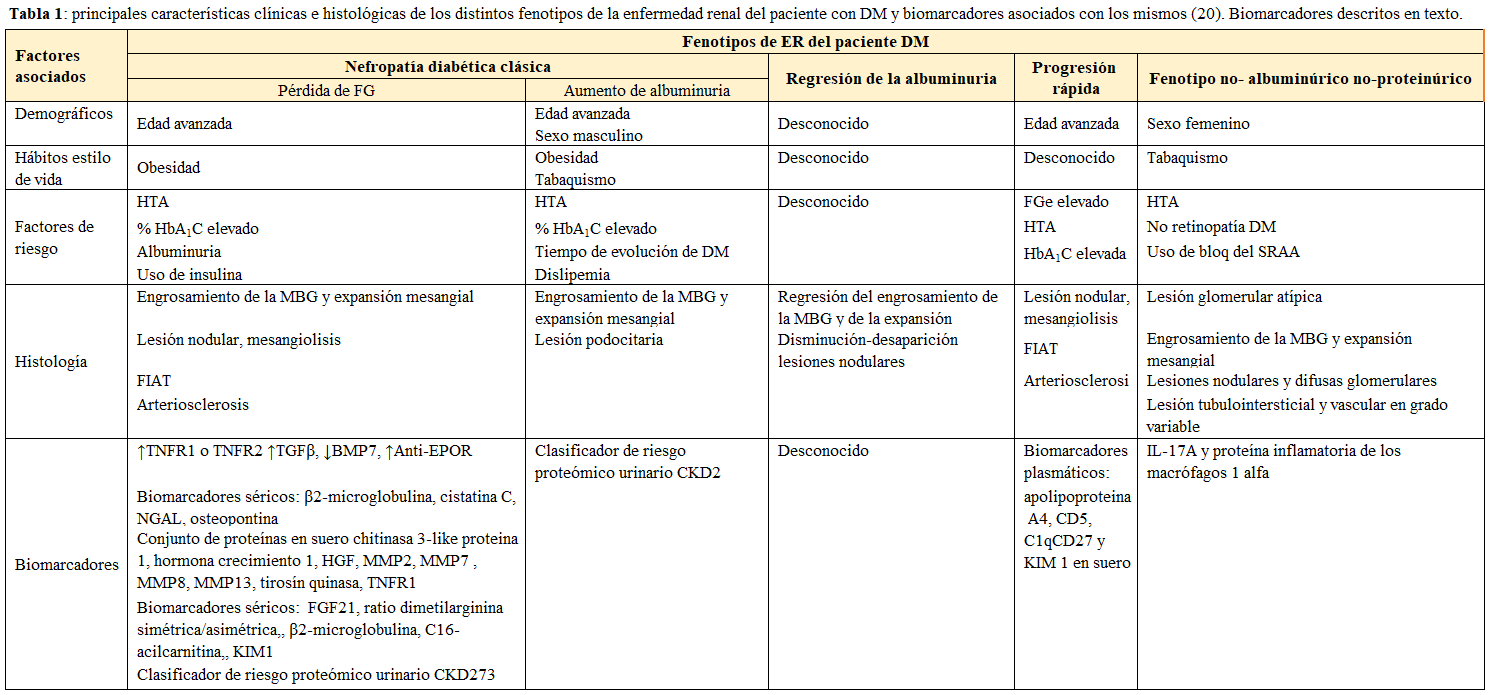
El tratamiento multidiana del paciente diabético con mejor control metabólico y con introducción de fármacos antiproteinúricos, así como la evolución de la comorbilidad del paciente DM2 con menor prevalencia de tabaquismo pero aumento de obesidad, HTA y envejecimiento, han sido cruciales en la modificación del fenotipo de la ER del paciente diabético. Todo ello explica la menor tasa de presentación de las formas clásicas en la actualidad frente a otros fenotipos más complejos de identificar como enfermedad renal diabética. Oshima et al [20], describe cuatro fenotipos bien diferenciados desde el punto de vista clínico con correlación histopatológica y con implicaciones pronósticas interesantes.
Nefropatía diabética clásica
La descripción de la “nefropatía diabética clásica” tal y como se sigue encontrando en la mayoría de los libros de texto se realiza mucho antes del desarrollo del arsenal terapéutico actual antihipertensivo y antihiperglucemiante.
Sin embargo, sigue siendo la forma de presentación predominante en pacientes con mal control metabólico y de la presión arterial: por lo que muchos autores consideran erróneo la decisión de evitar este término para identificar a estos pacientes.
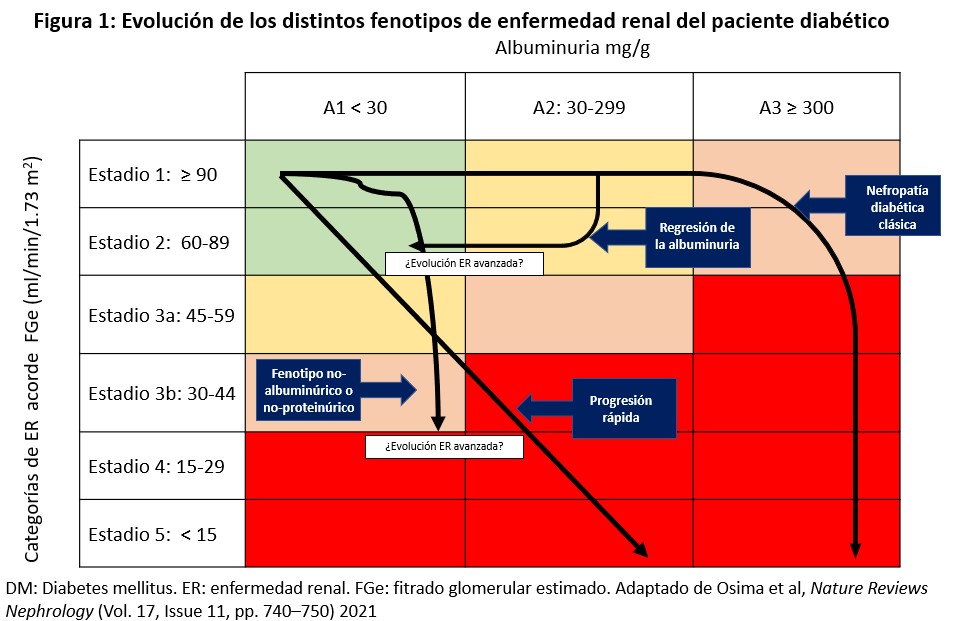
La historia natural de esta forma de enfermedad renal es la siguiente: incremento de FG inicial con aparición de albuminuria que progresa en el tiempo hasta alcanzar el rango de proteinuria, ocasionalmente en rango nefrótico. La pérdida de FGe aparece típicamente cuando la albuminuria ya está bien desarrollada y progresa, en ausencia de intervención, hasta estadios avanzados de ERC como se muestra en la (Figura 1) [21].
El patrón histológico de este fenotipo de enfermedad renal diabética es el originalmente descrito con afectación predominantemente glomerular que se clasifica en estadios evolutivos que enumeramos a continuación pero que se describe con mayor detalle en otro capítulo de esta publicación [22]:
-Clase I: engrosamiento de la MBG
-Clase II: expansión mesangial
-Clase III: esclerosis nodular
-Clase IV: glomeruloesclerosis diabética avanzada.
“Regresión de la albuminuria”
En algunos pacientes, la albuminuria no progresa o incluso remite. Esto se ha descrito como consecuencia de mejorar el control metabólico del paciente diabético y del tratamiento con bloqueantes del SRAA, iSGLT2 o arGLP1 [17] [23]. Este grupo de pacientes tiene una evolución más favorable comparado con el grupo anterior de “nefropatía diabética clásica”, como han demostrado diversos estudios de intervención, salvo en pacientes con DM tipo 1 donde esta correlación no está tan clara [24] [25].
El seguimiento histológico de este tipo de pacientes demuestra regresión de las lesiones diabéticas típicas (engrosamiento de la MBG, expansión mesangial, etc..) tanto en la DM tipo 1 como en la DM tipo 2 [26] [27] lo que demuestra la potencial reversibilidad de la enfermedad renal del diabético y la importancia del control integral del mismo.
Progresión rápida
En la ER asociada a DM entendemos por progresión rápida una caída anual de FGe ≥ 5 ml/min/1,73 m2 [28]. La prevalencia de este fenotipo es muy variable dependiendo de las series, entre 14 y 61% [29] [30] y los factores de riesgo para presentarlo parecen ser un FG elevado, presión arterial sistólica elevada y la presencia de albuminuria [21]. La principal diferencia respecto al fenotipo “clásico” es que la caída de FG es precoz e incluso puede aparecer en pacientes sin albuminuria [31]. El conocimiento sobre la lesión histológica de este tipo de pacientes es más escaso. Un estudio realizado sobre biopsias de pacientes DM tipo 2 demostró que el índice de hialinosis arteriolar era más elevado en pacientes con tasas de caída de FGe ≥ 3 ml/min/1.73m2. Sin embargo; otra serie identifica la esclerosis nodular glomerular y la mesangiolisis como las lesiones histológicas que mejor se correlacionaban con este fenotipo clínico [21].
Formas no proteinuricas o no albuminúricas
La prevalencia de estas formas en la actualidad es elevada, estimando que alcanzan un 20-40% de pacientes con ER y DM tipo 1 o DM tipo 2 respectivamente. Las características clínicas asociadas con este fenotipo son: sexo femenino, HTA, tabaquismo, ausencia de retinopatía diabética y uso de bloqueadores del SRAA. Varios estudios han demostrado que este grupo de pacientes presentan una caída más lenta de FG con menor riesgo de progresión de la ER, aunque en algunas series hasta un 20% progresan a estadios avanzados [32]. La presencia de enfermedad cardiovascular previa parece estar asociado con mal pronóstico en este grupo de pacientes sugiriendo que la patología macrovascular es la que determina la progresión en este fenotipo de ER asociada a diabetes.
Las lesiones histológicas asociadas a este fenotipo son diversas: desde las propias de la “forma clásica” hasta lesiones inespecíficas de la nefropatía hipertensiva con esclerosis glomerular, fibrosis intersticial y atrofia tubular (FIAT) y arteriosclerosis.
La relevancia de identificar el fenotipo del paciente con ER y DM es en este momento puramente pronóstica, toda vez que no implica diferencias terapéuticas tal y como recogen las ultimas guías KDIGO [16]. Sin embargo; el grado de respuesta a la intervención terapéutica no es homogéneo como ya demostró el estudio STENO, y aunque hasta la fecha los iSGLT2 y arGLP-1 parecen beneficiar por igual a todos los pacientes con ER y DM, algunos subgrupos de FGe y albuminuria-proteinuria están infra-representados en los principales ensayos clínicos por lo que habrá que analizar con algo más de detalle el beneficio esperable de la intervención terapéutica en grupos específicos de paciente como son los progresadores rápidos o los fenotipos no albuminúricos.
Aunque el interés de categorizar el fenotipo de ER asociada a DM no redunde en el momento actual en indicaciones terapéuticas específicas, la categorización pronóstica sí puede ser relevante para individualizar la forma de seguimiento de estos pacientes. El FGe y la albuminuria-proteinuria nos orientan sobre la situación del paciente en un momento aislado en el tiempo, pero no sobre su trayectoria pasada, ni futura. Y como hemos visto, la histología puede no ser demasiado precisa a este fin, siendo la biopsia renal una prueba que no está exenta de riesgos.
Sin embargo, algunos marcadores en sangre y orina podrían ser de utilidad para este fin, siendo casi todos ellos biomarcadores de procesos fisiopatológicos involucrados en la génesis o progresión de la enfermedad renal asociada a DM como son inflamación y/o fibrosis. Entre los biomarcadores con buena correlación clínico-histológica y con potencial utilidad clínica destacan:
- Receptores del factor de necrosis tumoral (tumour necrosis factor, TNF) TNFR1 y/o TNFR2: sus niveles circulantes predicen la caída de FGe y riesgo de progresión a ER avanzada en pacientes con ER y DM [33].
- Factor trasformador de crecimiento beta (transforming growth factor-β, TGF-β) y su antagonista natural proteína morfogenética ósea 7 (bone morphogenetic protein 7, BMP7) [21].
- Anticuerpos anti-receptores de eritropoyetina (anti-EPOr): se ha descrito la presencia de estos autoanticuerpos con efecto bloqueador de la respuesta a EPO en pacientes con ERC. En la ER asociada a DM, los niveles de anticuerpos anti-EPOr tienen buena correlación con el riesgo de progresión incluso en pacientes sin albuminuria [34].
- Análisis conjunto de varios biomarcadores: la evolución de la metodología de laboratorio ha permitido realizar análisis simultáneos de varias moléculas mejorando el valor predictivo respecto al de los análisis individuales. Se han descrito varios conjuntos de biomarcadores en sangre y orina que cumplen esta capacidad y que se enumeran en la (Tabla 1).
Al igual que en el caso de los hallazgos histológicos, los biomarcadores no guardan una correlación demasiado especifica con los distintos fenotipos de enfermedad renal del paciente diabético. Sin embargo, cuando todos estos elementos se combinan tal y como se representa en la (Tabla 1), la capacidad para identificar fenotipos mejora considerablemente. En ausencia de datos histológicos esta caracterización es bastante mas compleja, motivo por el que en muchos foros se defiende en la necesidad de ampliar las indicaciones de realización de biopsia renal en el paciente DM con ER.
CONCLUSIONES
La terminología de la ER del paciente diabético ha evolucionado hacia una nomenclatura más inclusiva que evite el infradiagnóstico de esta entidad. Así, los términos “diabetes y enfermedad renal” y “enfermedad renal diabética” son los propuestos en las ultimas guías KDIGO 2022 para denominar todo el espectro de pacientes que se pueden beneficiar de un abordaje terapéutico integral únicamente diferenciado en función de rango de FGe y albuminuria.
El consenso en la nomenclatura de esta enfermedad frecuente y multidisciplinar puede suponer una revolución similar a la que se inició con la clasificación de la ERC en 5 estadios, promovida por la National Kidney Foundation hace más de 20 años, contribuyendo a la correcta codificación de la ER de la DM, la concienciación de los especialistas, la armonización de la evidencia en guías clínicas y la implementación precoz de medidas de nefroprotección y tratamientos específicos en todos los niveles asistenciales.
La forma de presentación de la ER asociada a diabetes es variada y la identificación del fenotipo de la ER del paciente diabético tiene implicaciones fisiopatológicas y pronósticas, pero está limitada, salvo cuando se determina retrospectivamente, por la necesidad de realizar biopsia renal.
Aunque en el contexto actual el balance riesgo-beneficio de la biopsia renal pueda estar limitado por la ausencia de rentabilidad terapéutica, es necesario avanzar en el conocimiento de estos subgrupos de pacientes con el objetivo de individualizar no solo la intervención farmacológica sino también la forma de seguimiento. Los cuatro fenotipos de ER del paciente diabético detallados en este texto y el algoritmo para su identificación conjugando datos clínicos histológico y serológicos parece de utilidad para avanzar en el conocimiento de esta patología y es posible que en el futuro tengamos que recuperar estos términos en la nomenclatura de esta entidad para mejorar la precisión en el conocimiento y manejo del paciente diabético con ER.