Nefropatías Intersticiales
Palabras clave
Nefritis Intersticial aguda, Nefritis Intersticial crónica, Nefropatía por analgésicos, AINE, nefropatía por plomo, Uveítis, TINU
NEFRITIS INTERSTICIAL AGUDA
Definición
La NIA es un tipo de lesión renal caracterizada por la presencia de infiltrados inflamatorios, edema y tubulitis en el compartimento intersticial, con frecuencia acompañado de un deterioro agudo de la función renal [1].
La incidencia reportada de NIA en biopsias renales realizadas por fracaso renal agudo oscila entre un 5–27% [2] [3] [4], representando la tercera causa más frecuente de deterioro agudo de función renal en pacientes hospitalizados [5]. Diferentes series de casos y registros han mostrado un incremento progresivo de la incidencia de NIA, especialmente en pacientes ancianos [3] [4] [6]. Sin embargo, se desconoce si este incremento en la incidencia sería debido a un incremento real de la patología, o a un cambio en la política de realización de biopsias renales en los diferentes hospitales [7].
En los últimos años se han realizado importantes avances en el conocimiento de los mecanismos etiopatogénicos subyacentes en el desarrollo de NIA, así como sus principales determinantes pronósticos, que se sintetizan en los siguientes apartados.
Etiologías
Fármacos
La reacción inmunoalérgica a fármacos representa la etiología más frecuente de NIA [3], siendo responsable de aproximadamente un 60-70% de los casos [5] [8]. Sin embargo, la correcta identificación del fármaco responsable constituye un difícil reto desde el punto de vista clínico, especialmente en pacientes polimedicados. De hecho, en una serie de NIA recientemente publicada, no se pudo identificar de forma precisa el fármaco causante en hasta un 30% de los pacientes [9].
Un gran número de fármacos se han implicado en el desarrollo de NIA [10], algunos de los más frecuentes se muestran en la (Tabla 1). Sin embargo, potencialmente cualquier fármaco podría inducir el desarrollo de una NIA [3].
Los antiinflamatorios no esteroideos (AINEs) son una causa frecuente de NIA tanto en pacientes pediátricos como adultos. Se ha descrito que las manifestaciones extrarrenales de NIA, como la presencia de fiebre, rash cutáneo o eosinofilia, pueden ser menos frecuentes en las formas asociadas a AINEs en comparación con otras etiologías [8] [11]. Esa pobre expresividad clínica puede condicionar un retraso en el diagnóstico.
Los antibióticos constituyen otro de los grandes grupos de fármacos implicados en el desarrollo de NIA, siendo las fluorquinolonas una de las principales responsables [10]. A diferencia del grupo farmacológico anterior, la aparición de reacciones de hipersensibilidad es más frecuente en las NIA asociadas a antibióticos [8].
Sin embargo, en los últimos años se ha observado un cambio epidemiológico en los fármacos implicados en la patología. La prescripción casi generalizada de inhibidores de la bomba de protones (IBP) en la población o su toma subrepticia se han planteado como posibles causas de este incremento de casos de NIA [3] [12]. De acuerdo a algunas series, los IBP serían responsable de entre un 18–64% de los casos de NIA, especialmente en pacientes ancianos [13] [14] [15]. La presentación clínica de las NIA asociadas a IBP con frecuencia es inespecífica y larvada, condicionando así una exposición más prolongada al fármaco y una consecuente menor probabilidad de recuperación del daño renal [3] [13].
El empleo de 5-aminosalicilatos en pacientes con enfermedad inflamatoria intestinal también se ha asociado con el desarrollo de NIA, por lo que resulta importante la monitorización de la función renal en este perfil de pacientes [3].
Por otra parte, el creciente empleo de nuevas terapias contra el cáncer también ha condicionado un incremento del desarrollo de reacciones adversas, como la NIA [16] [17] [18]. Los fármacos inhibidores de los puntos de control inmunitarios (immune checkpoint inhibitors) como ipilimumab, nivolumab o pembrolizumab, pueden inducir fracaso renal agudo entre el 1–29% de los pacientes, aunque se postula que esta incidencia podría estar infraestimada [19] [20]. El diagnóstico diferencial del deterioro de función renal en la población oncológica es amplio, y por este motivo, la realización de una biopsia renal en estos casos es recomendable si la situación del enfermo lo permite. El intervalo reportado el inicio de estos fármacos y el desarrollo de manifestaciones renales es variable entre 1–24 meses [17] [19] [21] [22], aunque en ocasiones puede ser precedido por otras complicaciones extrarrenales como la hipofisitis o colitis [17].
Finalmente, el síndrome DRESS (del inglés, Drug Reaction with Eosinophilia and Systemic Symptoms), también puede asociarse a NIA [23] [24]. Algunos fármacos relacionados con la enfermedad incluyen el alopurinol, antiepilépticos o antibióticos.
Infecciones
Diferentes procesos infecciosos tanto bacterianos como víricos pueden precipitar el desarrollo de una NIA (Tabla 1) [25]. Aunque se desconoce el mecanismo patogénico responsable, se especula con el posible efecto citopático directo de los microorganismos, o la liberación de citocinas proinflamatorias en el seno de la infección, como factores inductores del daño renal [3] [26].
Por otra parte, algunos estudios han sugerido que la presentación clínica característica de la tuberculosis renal podría estar cambiando hacia un patrón de NIA con menor grado de expresividad clínico-radiográfico [27].
Enfermedades sistémicas
Un gran número de enfermedades sistémicas pueden asociarse a NIA, como el lupus eritematoso sistémico, síndrome de Sjögren, esclerodermia, nefritis intersticial y uveitis (TINU), enfermedad relacionada con IgG4 o vasculitis, entre otras [28]. Sin embargo, a diferencia de las etiologías anteriormente descritas, estos procesos sistémicos suelen afectar a pacientes en edades más jóvenes y con frecuencia se acompañan de otras manifestaciones extrarrenales características, facilitando así el diagnóstico. Los casos de NIA asociados a enfermedades sistémicas en ocasiones pueden presentar recurrencias, lo que supone un verdadero reto desde el punto de vista clínico y terapéutico [29].
Los infiltrados inflamatorios presentes en las biopsias de estos pacientes con frecuencia evolucionan hacia fibrosis intersticial, por lo que no es infrecuente detectar diferentes grados de cronicidad en el estudio histológico [28].
Otros procesos patológicos sistémicos que pueden manifestarse con NIA incluyen la denominada NIA secundaria a anticuerpos contra la membrana basal tubular, asociado o no a anticuerpos anti-membrana basal glomerular [30]. Asimismo, se han descrito formas de NIA asociada a depósito de cadenas ligeras monoclonales, con o sin tubulopatía [31].
Finalmente, lesiones tempranas de NIA han sido reportadas también en la denominada nefropatía mesoamericana o de los agricultores, cuya patogenia aún no se conoce de manera precisa [32].
Patogenia
La NIA asociada a fármacos es una reacción de hipersensibilidad idiosincrática (dosis independiente) que suele desarrollarse en un plazo de entre 7–10 días tras la exposición al fármaco causante, aunque el rango puede dilatarse hasta meses después del inicio de algunos fármacos como ocurre por ejemplo con los IBP [5].
Se han postulado diferentes posibles mecanismos patogénicos en el desarrollo de NIA asociada a fármacos, que se exponen a continuación [5]:
1) La unión de un hapteno farmacológico a la membrana basal tubular (MBT) que desencadenaría la respuesta inmune.
2) La liberación de un antígeno del fármaco con estructura bioquímica similar a componentes de la MBT, que generaría así una reacción cruzada contra la MBT.
3) La liberación de un antígeno del fármaco que quedaría atrapado en el intersticio, desencadenando así una respuesta inmunitaria.
4) La formación de complejos antígeno-anticuerpo que quedarían atrapados en el espacio intersticial, desencadenando la respuesta inmune.
En el caso de la inmunoterapia contra el cáncer, los fármacos inhibidores de los puntos de control inmunitarios o las técnicas de transferencia celular adoptiva (como las denominadas Chimeric Antigen Receptor T-Cells), también pueden inducir intolerancia inmunológica a determinados antígenos endógenos y a otros derivados del metabolismo de fármacos [17] [33] [34].
La patogenia de la NIA en el seno de enfermedades sistémicas es más heterogénea, incluyendo tanto la producción de autoanticuerpos, depósito de inmunocomplejos en el intersticio y la activación de vías inflamatorias [35].
Presentación clínica
En la mayor parte de los casos, los síntomas asociados a una NIA son inespecíficos, incluyendo malestar general, náuseas o vómitos. La triada clásica consistente en la presencia de fiebre, rash y eosinofilia es más frecuente en las reacciones de hipersensibilidad, especialmente cuando están implicados antibióticos beta-lactámicos [1], aunque en conjunto aparece en menos del 10% de los pacientes [2] [8] [9]. En la (Tabla 2), se muestras las principales características clínicas según las principales etiologías de NIA.
La fiebre puede ser de bajo grado o intermitente, aunque puede no estar presente en algunos casos de NIA [8]. Por otro lado, las erupciones cutáneas suele ser maculopapulares o morbiliformes, aunque también puede desarrollarse eritrodermia difusa o necrolisis epidérmica tóxica [2] [8].
Desde el punto de vista renal, la manifestación más frecuente es el deterioro paulatino de la función renal en ausencia de proteinuria significativa, aunque también puede haber formas rápidamente progresivas [8]. La presencia de edema o hipertensión arterial son poco frecuentes.
Diagnóstico
Laboratorio
Como se ha mencionado previamente, el deterioro agudo de la función renal es un hallazgo frecuente en la NIA y por tanto, en la analítica se observará un aumento de productos nitrogenados [8].
En el momento actual no existen pruebas analíticas específicas que permitan establecer el diagnóstico de NIA, aunque recientemente se ha estudiado el empleo de un panel de biomarcadores urinarios incluyendo la proteína quimiotáctica de monocitos 1 (MCP-1), la lipocalina asociada con la gelatinasa de neutrófilos (NGAL), así como factor de necrosis tumoral alfa (TNF-α), o la interleucina 9 (IL9) [36] [37]. La presencia de eosinofilia, cuando está presente, debe hacer sospechar la patología [38]. Sin embargo, la eosinofilia puede aparecer en otros procesos patológicos como el embolismo de colesterol, vasculitis o neoplasias, entre otros. Por este motivo, estas patologías deben ser incluidas en el diagnóstico diferencial de todo fracaso renal agudo de etiología no bien determinada, especialmente en pacientes ancianos [3] [39].
En todos los casos de NIA, debe realizarse un estudio analítico completo para descartar posibles infecciones o enfermedades sistémicas subyacentes, incluyendo serología de hepatitis B, C o VIH, anticuerpos antinucleares, anticuerpos anticitoplasma de neutrófilos (ANCA), complemento sérico, anticuerpos anti-Ro y anti-La, enzima convertidora de la angiotensina (ECA), así como espectro electroforético e inmunofijación en suero. Además, en casos concretos puede resultar interesante completar el estudio con tinción de Ziehl-Neelsen en orina y urocultivo [1].
El examen de orina puede mostrar eosinofiluria, definida como la presencia de un porcentaje de eosinófilos >1% del total de leucocitos urinarios, aunque diferentes estudios han puesto en cuestión la fiabilidad de este hallazgos en el diagnóstico de NIA [38] [39].
Es frecuente encontrar diferentes grados de proteinuria, que en raras ocasiones alcanza el rango nefrótico, y cuyo origen es una proteinuria de origen tubular [2] [9] [39].
Histología
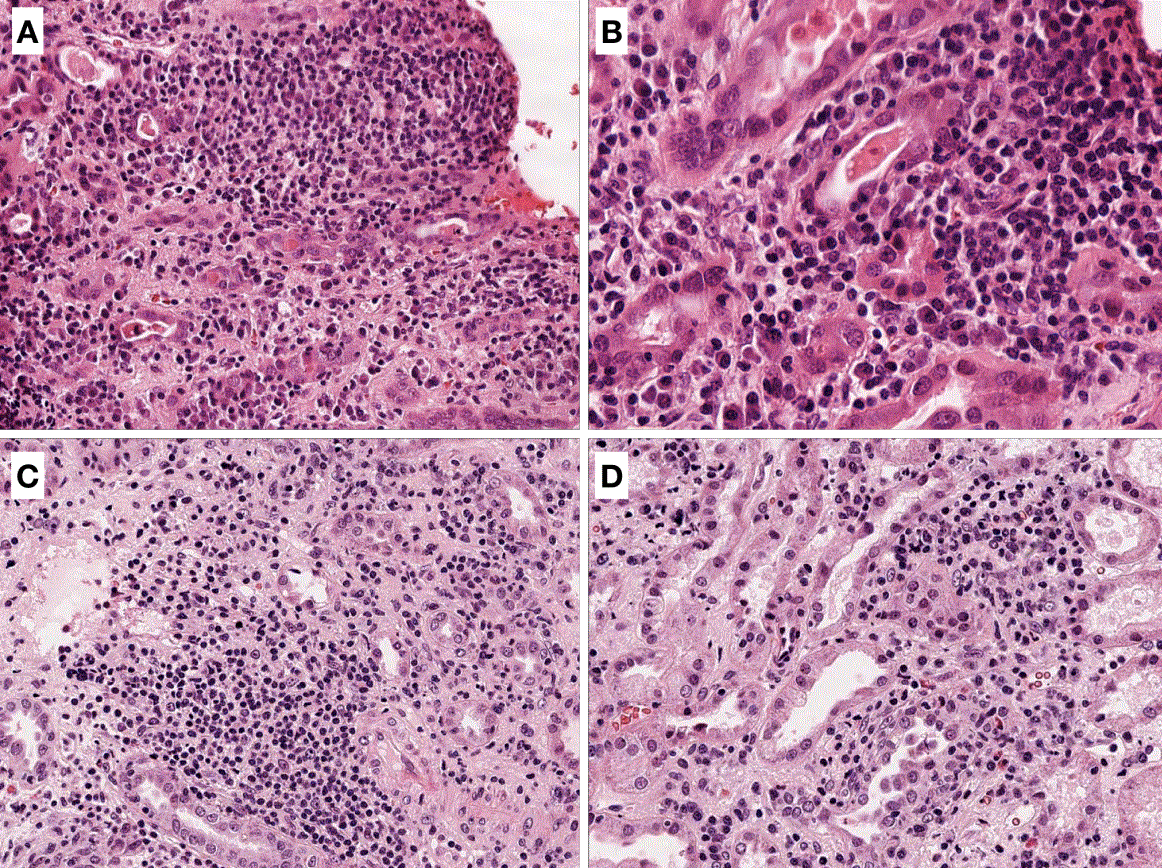
El estudio histológico de la biopsia proporciona el diagnóstico definitivo de NIA [2] [7] [40]. En la (Figura 1), se muestran cuatro imágenes histológicas de NIA.
El infiltrado intersticial característico de esta patología está compuesto por linfocitos y monocitos, y se acompaña de un número variable de eosinófilos, células plasmáticas y neutrófilos [39]. El predominio de infiltrados eosinofílicos debe hacer sospechar una NIA inducida por fármacos, mientras que el predominio neutrofílico es sugestivo de una infección bacteriana [39]. La presencia de edema intersticial también es frecuente en el curso de la patología.
La invasión de la membrana basal tubular por células inflamatorias da lugar a la lesión clásica de tubulitis [8]. También es posible encontrar la presencia de granulomas en algunos pacientes [2]. Las formas de NIA granulomatosa pueden aparecer tras la exposición a determinados fármacos como la vancomicina, ciprofloxacino, penicilinas o cefalosporinas, y también en el seno de enfermedades granulomatosas sistémicas como la sarcoidosis y tuberculosis, entre otras [26].
Tratamiento y pronóstico
El tratamiento de la NIA va a depender de la etiología subyacente [1]. En el caso de NIA secundarias a fármacos, la rápida identificación y suspensión del agente causante de la patología es esencial en el tratamiento. Sin embargo, esto puede resultar problemático en pacientes polimedicados, aunque la relación temporal entre el inicio de un determinado fármaco y el desarrollo de la patología puede ayudar a su sospecha [8].
La probabilidad de una recuperación espontánea de la función renal tras la suspensión del agente causante de la NIA dependerá del tiempo de exposición [8]. Aunque el posible beneficio terapéutico de la inmunosupresión en casos de NIA no ha sido evaluada en ensayos clínicos prospectivos, diferentes estudios de observación han encontrado que un tratamiento precoz con corticosteroides se asocia con una mayor probabilidad de recuperación de la función renal [4] [9] [41] [42].
En un estudio multicéntrico reciente, que incluyó 182 pacientes con NIA inducida por fármacos diagnosticados mediante biopsia renal y tratados con corticosteroides, el 41% presentó recuperación de >75% de su función renal a los 6 meses del episodio, mientras que sólo el 13% de los casos recuperó <25% de la función renal [9]. La dosis media de esteroides recibida fue de 0,8±0,2 mg/kg/día, sin encontrarse diferencias significativas entre los pacientes que recibieron inicialmente bolus de esteroides y los que no lo recibieron. En el análisis multivariable, los mejores determinantes de una recuperación incompleta de función renal fueron el grado de fibrosis intersticial y el retraso en el inicio de tratamiento esteroideo. Otro hallazgo reseñable en el citado estudio fue que la prescripción de dosis altas de esteroides durante más de 3 semanas o un descenso de dosis progresiva durante más de 5 semanas no se asoció con una mejor evolución de la función renal.
Aunque estos estudios están sujetos a importantes limitaciones (principalmente sesgos por indicación), el balance riesgo-beneficio del tratamiento esteroideo ante la sospecha de una NIA parece ir en favor de su empleo, salvo que exista una recuperación rápida de la función renal tras la suspensión del agente causante [3].
Un posible régimen terapéutico podría ser el siguiente: pulsos intravenosos de metilprednisolona 125-250 mg/día durante 3 días seguido de prednisona oral a dosis entre 0,5-1 mg/kg/día desde el cuarto día, durante 1–2 semanas. Posteriormente, dosis descendente durante 4–6 semanas. Sin embargo, se debería considerar una suspensión más precoz del tratamiento esteroideo en caso de no objetivarse una mejoría analítica a las dos semanas de iniciarlo, con el fin de evitar posibles efectos adversos [1].
Por otra parte, los casos de NIA en el seno de procesos infecciosos o enfermedades sistémicas requerirán tratamiento dirigido contra la etiología subyacente [3] [28].
El pronóstico reportado de las NIA es variable. De acuerdo a las últimas series de casos publicadas, es frecuente una recuperación incompleta de función renal en casos de NIA asociada a fármacos, cuya incidencia puede estar en torno al 40–50% de los casos [4] [9] [14] [41] [42]. Sin embargo, el pronóstico renal de NIA en el seno de otras enfermedades sistémicas es menos conocido.
Conclusiones
La posibilidad de una NIA debe ser considerada en todo paciente con deterioro de función renal de curso agudo o subagudo sin una clara etiología, y en particular, en pacientes ancianos polimedicados. Sin embargo, a pesar de que los fármacos son su principal etiología, se deben descartar otros procesos patológicos sistémicos o infecciosos. A pesar de que no se dispone de estudios aleatorizados que evalúen el tratamiento de las NIA, diferentes estudios de observación han mostrado el beneficio terapéutico de los corticosteroides en esta entidad, especialmente cuando se administran de forma precoz.
NEFRITIS INTERSTICIAL CRÓNICA
Definición y patogenia
La nefritis intersticial crónica (NIC) representa un patrón inespecífico de daño renal que puede ocurrir como resultado de múltiples etiologías, en cuyos estadios iniciales predominen lesiones de NIA [43].
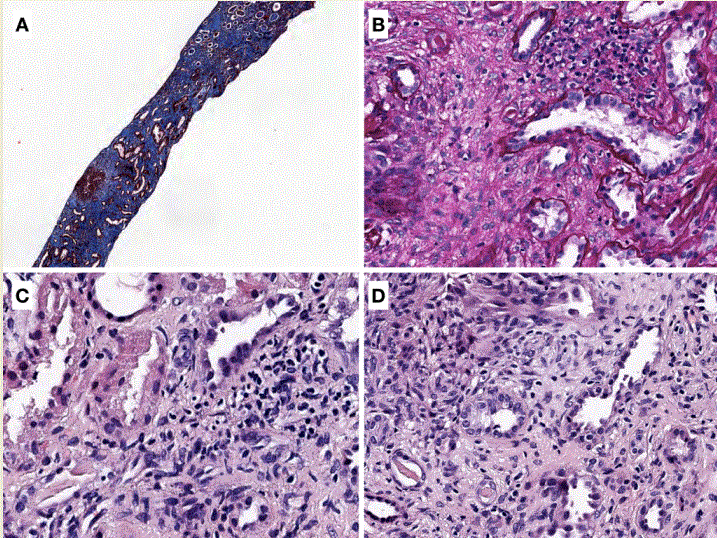
A diferencia de las NIA, en las NIC, el daño se desarrolla en meses o años, manifestándose así con un descenso progresivo de la función renal. En las biopsias renales predominan las lesiones de atrofia tubular y fibrosis intersticial, siendo los focos de infiltrados celulares intersticiales muchos más aislados que en las formas agudas. Según va progresando la severidad de las lesiones tubulointersticiales, son más frecuentes las alteraciones glomerulares: fibrosis periglomerular y glomeruloesclerosis global. Los vasos presentan un engrosamiento fibrointimal progresivo. En la (Figura 2), se muestran cuatro imágenes histológicas de NIC.
Características según la etiología
Existe una gran variedad de causas responsables del desarrollo de NIC, algunas de las cuales se resumen en la (Tabla 3), y se desarrollan con más detalle en los siguientes apartados:
Nefropatía por analgésicos
La nefropatía por consumo crónico de analgésicos representa una causa frecuente de NIC y necrosis papilar, como resultado de la toma de analgésicos durante periodos prolongados [44]. Sin embargo, su prevalencia habría disminuido en las últimas décadas como consecuencia de la restricción en la dispensación de este grupo de fármacos [45].
Aunque se desconoce de manera exacta el fármaco que con más frecuencia se asocia a esta patología, algunos estudios sugieren que la combinación de fenacetina, paracetamol, ácido acetilsalicílico, codeína o AINEs, incrementarían el riesgo de desarrollar enfermedad renal crónica (ERC) [44].
La patogenia estaría mediada por el efecto tóxico de algunos metabolitos, que inducirían la producción de radicales libres de oxígeno, generando isquemia y toxicidad celular.
La nefropatía por analgésicos afecta de manera más predominante a mujeres con edades >45 años, y con frecuencia, asocian antecedentes de migrañas o dolores articulares como causa para la toma de estos medicamentos [46]. El deterioro de función renal se suele diagnosticar de manera incidental, siendo infrecuente la existencia de sintomatología urinaria, salvo hematuria o dolor lumbar de forma excepcional. La progresión de la insuficiencia renal suele ser lenta, consiguiéndose estabilizar cuando se erradica el consumo de analgésicos [44].
Nefropatía por plomo
La exposición prolongada al plomo (niveles persistentes >60 mcg/dl) produce toxicidad a nivel de diferentes órganos y sistemas, incluido el riñón. La nefropatía crónica por plomo se caracteriza por una NIC, con deterioro paulatino de la función renal [47].
Las manifestaciones clínicas y analíticas son variables según el grado de exposición. Las intoxicaciones agudas (niveles séricos >100 mcg/dl) producen toxicidad a nivel del túbulo proximal, pudiendo manifestarse con síndrome de Fanconi [48]. Aunque suele ser reversible tras el cese de la exposición, en ocasiones puede persistir glucosuria y aminoaciduria. Sin embargo, en la nefropatía crónica por plomo es característica la existencia de hiperuricemia, como consecuencia de una absorción aumentada a nivel tubular [48]. Por este motivo, esta entidad debe incluirse en el diagnóstico diferencial de determinados pacientes con ERC e historia de hiperuricemia.
La biopsia renal suele mostrar el patrón característico de NIC con grados variables de fibrosis intersticial y atrofia tubular. En ocasiones, se pueden evidenciar inclusiones intranucleares en las células del túbulo proximal.
El diagnóstico se establece midiendo los niveles de plomo séricos cuando se trata de una intoxicación aguda, o valorando su excreción urinaria tras la movilización de los depósitos de plomo en los huesos mediante la administración de etilendiaminotetraacetato de calcio (EDTA), cuando la exposición fue más prolongada [49]. Una excreción urinaria >600 mcg a las 72 horas es indicativo de que puede haber existido una intoxicación crónica.
El tratamiento se basa en la suspensión de la exposición y el empleo de quelantes.
Otros fármacos y tóxicos
El tratamiento crónico con litio, utilizado en trastornos psiquiátricos, puede producir una NIC que se manifiesta con poliuria, polidipsia y desarrollo de ERC lentamente progresiva si no se suspende el fármaco [50]. También es frecuente la asociación de diabetes insípida nefrogénica.
Los fármacos inmunosupresores ciclosporina A y tacrolimus, ampliamente utilizados en los trasplantes de órganos y en procesos con base inmunológica, pueden producir nefrotoxicidad crónica si se mantienen niveles sanguíneos elevados [51]. En la histología es frecuente encontrar fibrosis intersticial parcheada, atrofia tubular y lesiones vasculares que afectan a las arteriolas aferentes de manera preferente [51]. Si no se revierten a tiempo, estas lesiones pueden llegar a causar ERC avanzada.
Otro grupo de fármacos que pueden asociarse con NIC son los inhibidores de los nucleósidos como tenofovir, cidofovir o adefovir, que pueden producir síndrome de Fanconi [52].
Por otra parte, metales pesados como el cadmio y el mercurio pueden causar también NIC en trabajadores de la fundición expuestos a estos agentes.
La denominada nefropatía por hierbas chinas se trata de una NIC inducida por hierbas adelgazantes de curso ilegal, procedentes de China, siendo mujeres las pacientes afectas de manera predominante [53]. El componente responsable del daño renal es el ácido aristolóquico, que condiciona una NIC con una progresión rápida y necesidad de inicio de diálisis en pocos meses o años si no se interrumpe su administración [53]. Además, en estos pacientes existe un riesgo elevado de desarrollar posteriormente neoplasias uroteliales.
Finalmente, los platinos (especialmente el cisplatino), agentes quimioterápicos usados con frecuencia en pacientes oncológicos, pueden dar lugar a una disfunción tubular y un deterioro progresivo de la función renal [54]. La lesión está mediada por toxicidad directa sobre las células epiteliales tubulares y efectos proinflamatorios directos. Su efecto es dosis-dependiente. Clínicamente puede aparecer hipomagnesemia sintomática, síndrome de Fanconi o un síndrome pierde-sal. En pacientes con ERC, se puede valorar la administración de otros análogos (carboplatino, oxaliplatino) con menor efecto nefrotóxico.
Alteraciones metabólicas
La hipercalcemia crónica mantenida, de cualquier etiología, puede producir NIC con infiltrados celulares focales, fibrosis túbulo-intersticial y depósito de calcio a nivel intersticial, tubular y vascular. Clínicamente, el aspecto más relevante es la alteración en la concentración urinaria, manifestada por la presencia de poliuria y nicturia.
La hiperuricemia crónica también se ha asociado a NIC y ERC progresiva por depósitos cristalinos de ácido úrico y de sales de urato monosódico en los túbulos e intersticio. Estos depósitos provocan obstrucción tubular y desencadenan una inflamación linfocitaria con reacción de células gigantes por cuerpo extraño, generando fibrosis intersticial a largo plazo. El tratamiento con alopurinol ha demostrado reducir la tasa de progresión de la ERC y reducir el riesgo cardiovascular [55].
La hipopotasemia crónica – secundaria a patologías como hiperaldosteronismo primario, síndrome de Bartter, uso crónico de diuréticos o laxantes – produce lesiones de vacuolización en células tubulares y acidosis intracelular que provoca migración de células inflamatorias y la producción de fibrosis tubulo-intersticial extensa. Las manifestaciones clínicas más frecuentes son la poliuria, polidipsia y nicturia y, más raramente, ERC de lenta progresión.
La hiperoxaluria primaria y secundaria se caracterizan por una excreción urinaria excesiva de oxalato, con el consiguiente depósito intratubular del mismo, formación de litiasis, nefrocalcinosis y ERC progresiva.
La cistinosis es un defecto genético autosómico recesivo que origina un acúmulo intralisosomal de cistina y en la que se observa una tubulopatía consistente en un síndrome de Fanconi y en un defecto de la reabsorción proximal de los aminoácidos dibásicos cistina, arginina, lisina y ornitina. La enfermedad se caracteriza por recurrencia de cálculos de cistina y en el sedimento urinario hay unos cristales típicamente hexagonales. Esta entidad puede desarrollar una NIC que puede evolucionar hacia la ERC.
NIC de base inmunológica o en el seno de patología glomerular
La sarcoidosis puede asociarse con el desarrollo de NIC [28] [56]. Las manifestaciones clínicas características incluyen la formación de nefrolitiasis y nefrocalcinosis como resultado del metabolismo anormal del calcio. Los hallazgos histológicos típicos incluyen NIC con o sin granulomas no caseificantes. La respuesta a glucocorticoides es menos evidente en estos casos de presentación crónica, sobre todo si existe fibrosis intersticial avanzada. El micofenolato mofetil puede mejorar la respuesta y disminuir los efectos secundarios de una administración prolongada de glucocorticoides.
El síndrome de Sjögren se caracteriza por la formación de infiltrados linfoplasmocitarios a nivel de las glándulas salivares, parótidas y lacrimales, dando lugar al denominado síndrome seco [28]. Sin embargo, también se puede producir afectación de otros órganos como el riñón, con el desarrollo de NIC en un rango variable entre el 2–67% de los casos [57] [58]. Además, hasta un 25% de los pacientes pueden asociar acidosis tubular renal distal, cuyo mecanismo patogénico se desconoce [59].
Por otra parte, cualquier patología glomerular puede asociar un daño túbulo-intersticial cuya gravedad tiene una importancia pronostica decisiva. La proteinuria de los procesos glomerulares ejerce un efecto nocivo directo sobre las células tubulares, estimulando la síntesis de numerosas sustancias proinflamatorias, profibróticas y quimiotácticas que atraen macrófagos y linfocitos al intersticio renal, promoviendo así el desarrollo de fibrosis [60]. Por este motivo, la cuantía de la proteinuria en cualquier tipo de enfermedad renal es un factor de gran importancia pronóstica y toda medida terapéutica que la disminuya contrarresta la progresión de la insuficiencia renal.
Nefropatía de los Balcanes y Mesoamericana
La denominada nefropatía de los Balcanes es una NIC endémica de los países del sureste de Europa, cuya causa más probable es una exposición de bajo grado, pero prolongada al ácido aristolóquico, condicionando así un deterioro lentamente progresivo de la función renal [61]. También se especula con la posible contribución de algunos factores de susceptibilidad genética. Las características clínicas son las propias de una NIC, y no existe un tratamiento específico para revertirla.
La denominada nefropatía Mesoamericana corresponde a un tipo de NIC que afecta de manera predominante a trabajadores jóvenes de la agricultura, habiéndose descrito también en otras regiones como Sri Lanka [62] [63]. Aunque existe controversia en cuanto a su posible etiopatogenia, se considera que podría ser resultado de las condiciones laborales de los pacientes, sometidos a altas temperaturas, con la consecuente deshidratación y pérdida de minerales.
Tratamiento y pronóstico
La mayor parte de NIC muestran un deterioro lentamente progresivo de función renal. El tratamiento principal se basa en abordar las enfermedades subyacentes, así como identificar y eliminar cualquier fármaco o agente tóxico causante. Sin embargo, no es infrecuente que en el momento del diagnóstico los pacientes presenten una ERC moderada o avanzada, limitando así las opciones terapéuticas. Aunque se están estudiando posibles estrategias de reparación o reversión de la fibrosis [64], en el momento actual, los avances no se han trasladado a la práctica clínica habitual



![Tabla 1. Etiologías de nefritis intersticial aguda (adaptado de Nast et al.[10]) Tabla 1. Etiologías de nefritis intersticial aguda (adaptado de Nast et al.[10])](https://static.elsevier.es/nefro/monografias/1/252/1354.jpg)
![Tabla 2. Características clínicas de las principales etiologías de nefritis intersticial aguda (adaptado de Praga et al.[3]) Tabla 2. Características clínicas de las principales etiologías de nefritis intersticial aguda (adaptado de Praga et al.[3])](https://static.elsevier.es/nefro/monografias/1/252/1355.jpg)
![Tabla 3. Etiologías de nefritis intersticial crónica (adaptado de Perazella et al.[39]) Tabla 3. Etiologías de nefritis intersticial crónica (adaptado de Perazella et al.[39])](https://static.elsevier.es/nefro/monografias/1/252/1366.jpg)