Litiasis Renal
Palabras clave
litogénesis, cálculos urinarios, urolitiasis, hipercalciuria idiopática, hiperuricosuria, hiperoxaluria, cistinuria, hipocitraturia, hiperuricosuria, estruvita, Cacchi-Ricci.
INTRODUCCIÓN. LITOGÉNESIS
La litiasis renal (también llamada nefrolitiasis o urolitiasis) es una patología sumamente frecuente, de tal manera que, aproximadamente, del 5-12% de la población de los países industrializados padece algún episodio sintomático antes de los 70 años de edad, con una incidencia algo inferior en Asia (1-5%) [1].
En países industrializados como Estados Unidos se ha producido un aumento progresivo en la prevalencia de litiasis durante las últimas 4 décadas [2]. El síndrome metabólico afecta al 25% de adultos en EEUU y se asocia con un incremento del riesgo de litiasis en un 30% [3]. Además de las potenciales secuelas asociadas a la litiasis renal, como el dolor, la infección, la obstrucción o la toma de antiinflamatorios, la nefrolitiasis es considerada un factor de riesgo de enfermedad renal crónica (ERC) [2].
Sin entrar en los complejos mecanismos físico-químicos necesarios para la formación de los cálculos, la litiasis pasa necesariamente por una sucesión de etapas que concurren en la formación y crecimiento del cálculo. La primera etapa es la de sobresaturación de la orina. La segunda fase es la de germinación cristalina. La siguiente es la de aumento de tamaño de las partículas formadas, ya sea por el crecimiento de los cristales o por la agregación de éstos entre sí. Finalmente, la cuarta etapa es la de nucleación del cálculo, se produce la retención de una o varias de las partículas formadas en un túbulo renal, en la pared de una papila o en las vías urinarias. A partir del núcleo así constituido el cálculo crecerá por cristalización local o por aumento de tamaño de los cristales formados por encima del grado de sobresaturación urinaria.
Se han identificado tres vías que conducen a la formación de los cálculos:
- Sobrecrecimiento de las placas intersticiales de apatita: Cristales de CaP y sustratos orgánicos se depositan a lo largo de las membranas basales de las ramas delgadas del asa de Henle y se extienden hacia el compartimento intersticial y el urotelio, formando las placas de Randall [4]. Es la teoría principal del origen de los cálculos de oxalato cálcico y el hiperparatiroidismo. en el caso de la formación idiopática de cálculos de oxalato cálcico, el hiperparatiroidismo primario, o en la oxalosis) [4]:
- Depósitos en forma de cristales en los túbulos (casi todas las causas de litiasis) [5]
- Cristalización libre en solución (como en el caso de la cistinuria e hiperoxaluria) [6].
En el caso de la cristalización libre en solución, la saturación urinaria puede elevarse hasta el punto de permitir la formación espontánea de cristales y finalmente cálculos, por alguno de los siguientes mecanismos:
- Aumento de la concentración urinaria de los componentes del cristal (calcio, oxalato, fosfato, ácido úrico o cistina) o disminución de la diuresis.
- Modificaciones en el pH urinario: un pH urinario bajo favorece la formación de cálculos de ácido úrico pues su pK en orina es 5,5. Sin embargo, un pH alcalino favorece la génesis de los de fosfato cálcico.
- Disminución o cambios en la concentración de inhibidores urinarios de la cristalización o de la agregación cristalina (hipocitraturia).
DIAGNÓSTICO Y DETECCIÓN DE LOS CÁLCULOS
El diagnóstico se realiza ante la presencia de uno o varios cólicos nefríticos. No obstante, el diagnóstico de urolitiasis no se puede confirmar si no se tiene la evidencia de la formación o expulsión de un cálculo. En niños, se puede detectar la existencia de anomalías metabólicas causantes de cálculos antes de que exista evidencia de la formación de los mismos. Esta situación se denomina prelitiasis.
La ecografía ha supuesto un gran avance en el diagnóstico de los cálculos, especialmente en niños, en los que suelen ser de pequeño tamaño. El aspecto típico es el de una imagen hiperecogénica con sombra acústica posterior. Además, La Manna et al. apreciaron que en niños estudiados por dolor abdominal, disuria o hematuria podían observarse puntos hiperecogénicos en los cálices renales, incluso sin la sombra acústica característica y con un diámetro menor de 3 mm. En su serie, existían antecedentes familiares de urolitiasis en el 70% de los niños e hipercalciuria en el 38% de ellos [7]. La ecografía renal es más sensible (84%) que la radiografía simple de abdomen (54%) para detectar cálculos, aunque ésta es superior para el diagnóstico de los que localizan a nivel ureteral.
El aspecto radiológico de los cálculos suele ser de ayuda para establecer el diagnóstico etiológico [8]:
- Un aspecto francamente radiopaco indica una composición preponderantemente cálcica [Oxalato cálcico monohidrato (whewelita) y dihidrato (whedelita), fosfato cálcico y carbonato].
- Los cálculos ligeramente radio opacos son habitualmente de cistina, fosfato amónico magnésico (estruvita) o ácido úrico con cantidades variables de calcio.
- Los cálculos mixtos, con estratos alternativos opacos y claros, sugieren una litiasis mixta úrico-cálcica.
- Los cálculos radiotransparentes están compuestos de ácido úrico, xantina, 2,8dihidroxiadenina o son causados por fármacos.
- Los cálculos coraliformes están formados a menudo por estruvita o cistina.
- La existencia de nefrocalcinosis, o depósito intenso de calcio en el parénquima renal, orienta hacia una hiperoxaluria primaria, una acidosis tubular, un riñón en esponja medular (o enfermedad de Cacchi-Ricci), un hiperparatiroidismo primario u otros estados hipercalcémicos.
En el cólico nefrítico “complicado”, la urografía fue durante décadas la prueba diagnóstica de referencia. Sin embargo, en los últimos años, la tomografía computarizada (TC) helicoidal sin contraste se ha introducido como una alternativa rápida sin requerir contrastes iodados.
CLASIFICACIÓN METABÓLICA DE LA UROLITIASIS
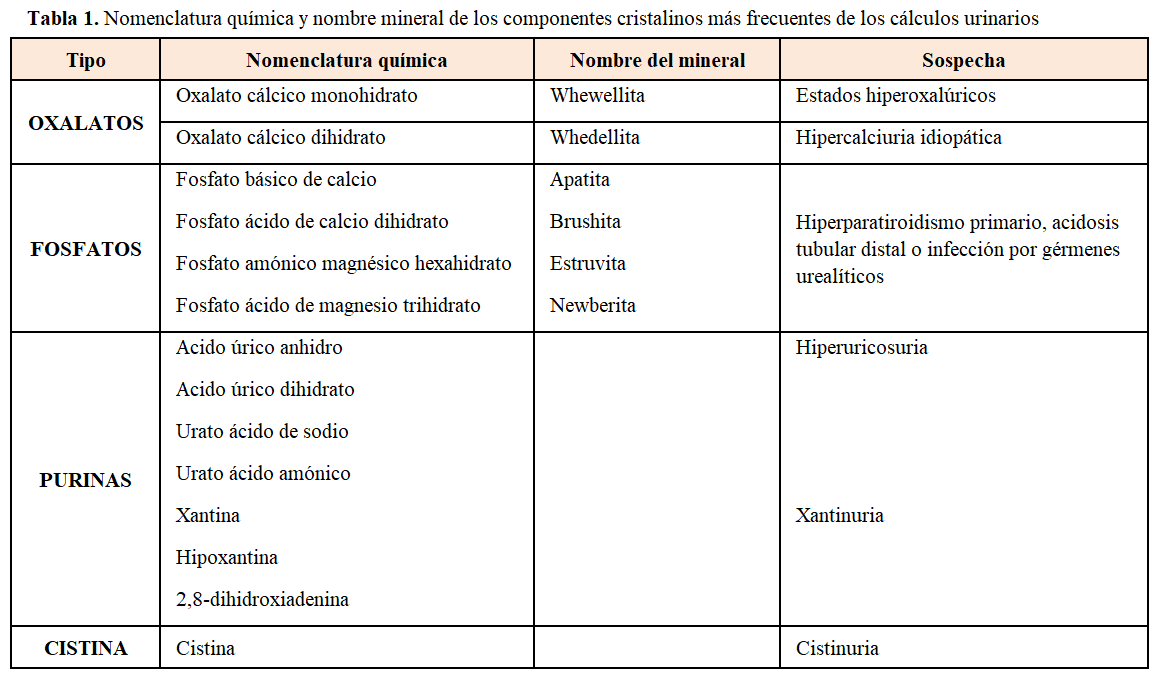
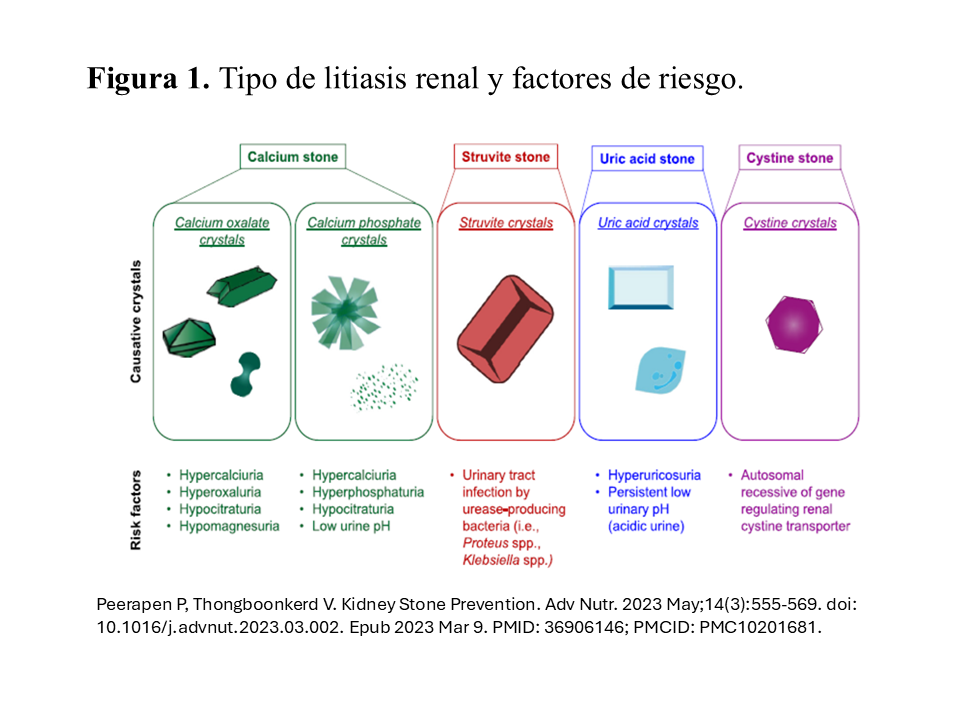
La urolitiasis es un cuadro complejo en el que intervienen factores genéticos y ambientales, especialmente dietéticos. Los pacientes litiásicos se pueden clasificar según la composición cristalina de los cálculos o según la anomalía metabólica responsable. Según la composición de los cálculos, el 60-70% de todos los cálculos están constituidos por oxalato cálcico (sólo o con apatita), seguidos por los de ácido úrico en el 10-15%, los de fosfato-amónico-magnésico (estruvita) en el 10% de los casos, los de fosfato cálcico, apatita 7% y brushita 1%, y los de cistina en el 1%. Los componentes cristalinos más importantes observados en los cálculos urinarios figuran en la (Tabla 1)[9]y (Figura 1) [10] El oxalato cálcico tiene 3 formas cristalinas basado en su estado de hidratación: oxalato cálcico monohidrato (CaC2O4⋅H2O o whewellita), oxalato cálcico dihidrato (CaC2O4⋅2H2O o whedellita) y oxalato cálcico trihidrato (CaC2O4⋅3H2O)
Por otra parte, se puede clasificar la litiasis según la anomalía metabólica subyacente. Las anomalías metabólicas pueden clasificarse de forma sencilla en dos tipos: En primer lugar, aquellas que favorecen la formación de cristales cuando están en situación de sobresaturación urinaria (es el caso del calcio, ácido úrico, oxalato y cistina) y, en segundo lugar, aquellas que favorecen la litogénesis cuando sus niveles están reducidos, al ser inhibidores de la cristalización. Éstos pueden dividirse en dos subgrupos según su masa molecular. Los inferiores a 5.000 daltons son zinc, aluminio, magnesio, citrato, isocitrato, fosfocitrato, complejos citrometálicos y pirofosfato. Los de masa molecular elevada son nefrocalcina, glucosaminoglicanos y proteínas como la de Tamm-Horsfall (uromodulina) y el human trefoil factor TFF1.
Se puede establecer una cierta relación entre la composición del cálculo y la anomalía metabólica subyacente [11]. Así, una litiasis por whewelita (oxalato cálcico monohidrato) debe hacer sospechar una hiperoxaluria primaria u otros estados hiperoxalúricos. En la hipercalciuria idiopática suele ser más frecuente la litiasis por whedelita (oxalato cálcico dihidrato) o mixta de whedelita y whewelita. Los cálculos con elevado contenido en fosfato cálcico deben hacer sospechar un hiperparatiroidismo primario, una acidosis tubular distal completa o incompleta o una infección por gérmenes urealíticos. Los cálculos de purinas se observarán en los casos de hiperuricosuria, xantinuria, déficit de adenina fosforibosil transferasa y en los de pH urinario repetidamente ácido. En la cistinuria los cálculos son de cistina.
Para el diagnóstico de la anomalía metabólica causante de la litiasis se requiere una detallada historia clínica para identificar condiciones asociadas, como el hiperparatiroidismo primario, la acidosis tubular renal distal, gota, síndrome metabólico, diabetes mellitus tipo 2, obesidad o trastornos malabsortivos gastrointestinales que cursan con diarrea crónica.
Por otro lado, algunos fármacos pueden inducir litiasis, ya sea por alterar la composición urinaria o el pH de forma desfavorable como por precipitación directa del fármaco o sus metabolitos en orina. Además, se requiere una historia dietética detallada, que refleje la ingesta hídrica, el consumo de sal y proteínas animales, la toma de suplementos, así como la exposición ambiental o laboral a tóxicos (cadmio o ácido oxálico, presentes en pinturas) o agentes de calor excesivo que favorezcan la deshidratación.
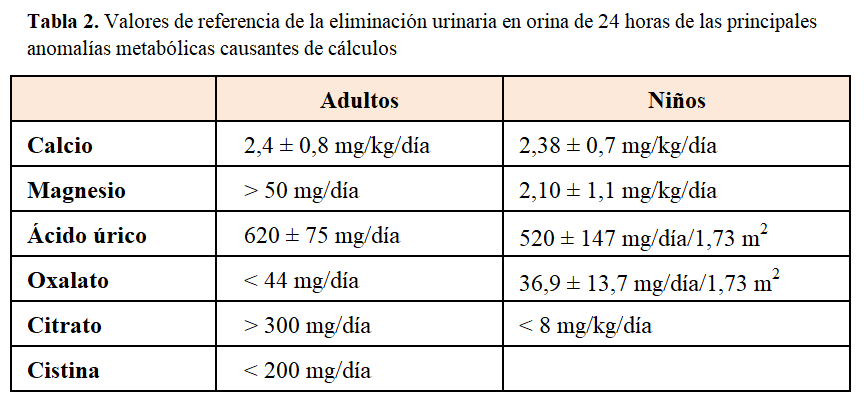
Un pH urinario ácido (pH<5.5) favorece la litiasis de ácido úrico, mientras que un pH urinario alcalino (pH>7) favorece la litiasis por estruvita. En la práctica clínica suelen determinarse calcio, ácido úrico, oxalato, cistina, citrato y magnesio. Se miden en orina de 24 horas (Tabla 2), aunque se puede hacer un estudio inicial de despistaje por medio de los cocientes urinarios [11]. Se debe confirmar que la recogida urinaria es correcta mediante el cálculo de la eliminación urinaria de creatinina (normal: 15-25 mg/kg/día).
En cuanto a los factores genéticos, la utilización de técnicas de secuenciación masiva, ha permitido detectar causa genética monogénica de litiasis hasta en el 30% de niños y en 10% de adultos, con unos 35 diferentes genes implicados, muchos de ellos relacionados con el manejo tubular renal de sustratos litogénicos y de inhibidores de la cristalización [12], (como por ejemplo, CLCN5, CLDN16, CLDN19, CaSR). Para más información de litiasis de causa genética, consulte el capítulo “Litiasis Urinaria de Causa Genética”.
HIPERCALCIURIA IDIOPÁTICA (HI)
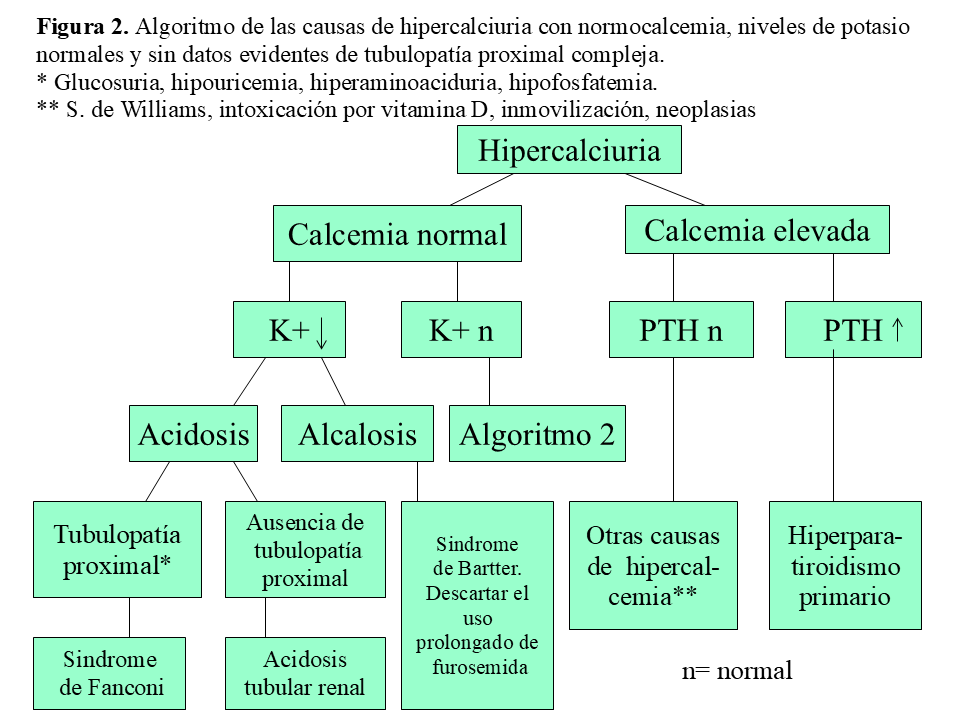
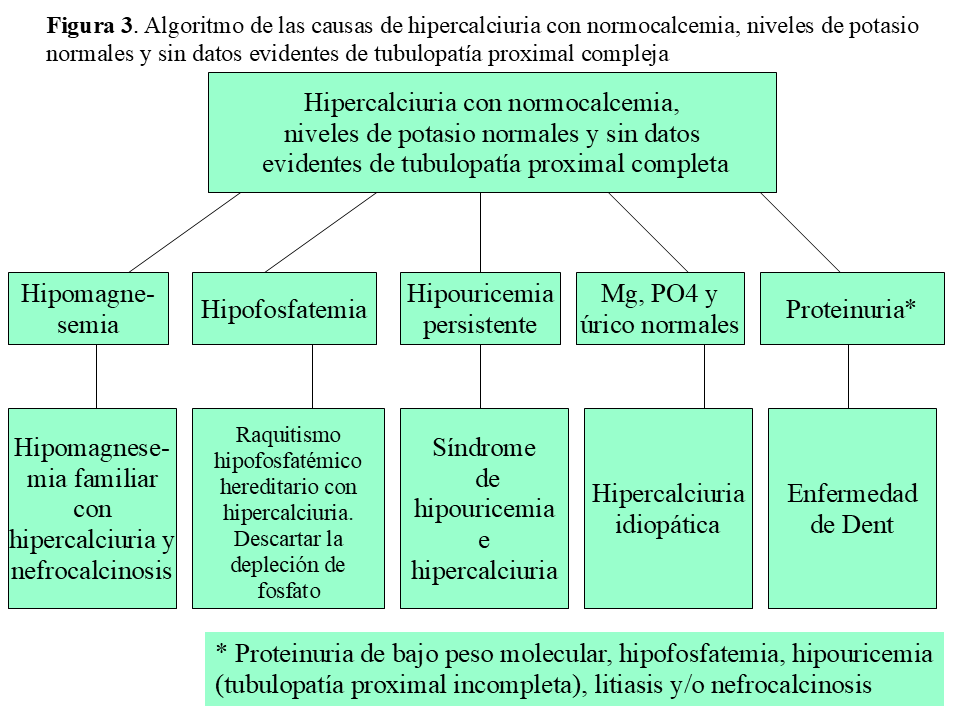
La HI se define por un aumento mantenido en la eliminación urinaria de calcio, en ausencia de hipercalcemia y de otras causas conocidas de hipercalciuria. Antes de establecer este último diagnóstico, se deben descartar otras causas, la mayoría tubulopatías de origen genético (que suelen cursar con alteraciones del equilibrio ácido-base, hipopotasemia, hipercloremia, hipomagnesemia o hipofosfatemia) o situaciones como la diabetes mellitus, la artritis reumatoide infantil o el uso prolongado de furosemida (Figura 2) y (Figura 3). La HI es la causa más frecuente de litiasis renal tanto en la edad pediátrica como en la adulta (alrededor del 40% en series de niños y del 60% en las de adultos) y es una de las anomalías metabólicas más frecuentes en el ser humano, de tal modo que se han descrito tasas de prevalencia en población sana, según los países, entre 0.6 y 12.5% [13].
La HI se define como una excreción urinaria>300 mg/día en hombres o >250 mg/día en mujeres, o >200 mg/día en una dieta restringida de calcio, magnesio y proteínas animales, o una excreción urinaria superior a 4 mg/kg/día en dos muestras de orina consecutivas (válido tanto para adultos como para niños). También, puede admitirse el diagnóstico de HI un valor de cociente calcio (mg)/creatinina (mg) superior a 0,20 en una muestra de orina no recogida en ayunas (en niños, válido para mayores de 4 años). No obstante, para confirmar que una hipercalciuria se trata de una HI, deben ser normales los niveles de calcemia, PTH intacta, iones (incluido el cloro) y equilibrio ácido base. En el seguimiento, para simplificar el manejo de los pacientes con HI se ha postulado determinar calcio, citrato y creatinina en orina aislada en dos momentos del día (antes de la cena y en la primera orina de la mañana), por lo que no sería necesario recoger orina de 24h. Si el cociente calcio/citrato en cualquiera de las dos orinas es superior a 0,33mg/mg existe riesgo de cristalización urinaria [14].
En los últimos años, el diagnóstico de la HI es más frecuente debido a que puede comenzar en la edad pediátrica con síntomas muy diversos, en ausencia inicial de cálculos renales. Esta situación, casi propia de la edad pediátrica, se ha denominado prelitiasis [13] y puede debutar en niños con síntomas diversos. En 1981, se describió cómo la hematuria macroscópica indolora podía ser una forma de presentación en niños, y actualmente está descrito que entre el 25-42% de los niños remitidos a centros de referencia por hematuria tienen HI. En 1981 Moore mencionó otros nuevos síntomas y signos de inicio hasta entonces no reconocidos, como disuria, polaquiuria, urgencia miccional, enuresis nocturna y leucocituria estéril [15]. La presencia de dolor abdominal recurrente "no típico de cólico renal" se ha asociado, asimismo con HI, e incluso proteinuria discreta. Por otro lado, la frecuencia de infección de vías urinarias es mucho más elevada en estos niños que en controles. En el adulto, la presentación más frecuente de la HI es el cólico nefrítico, si bien algunos pacientes pueden debutar con hematuria macroscópica.
En el momento actual, existen algunos aspectos de la fisiopatología de la HI que no se conocen adecuadamente, así como tampoco la causa final que origina la hipercalciuria. Clásicamente se usaba el Test de Pak para diferenciar 2 subtipos de HI, según las variaciones de la calciuria producidas tras restringir el aporte de calcio durante 7 días: HI absortiva o HI renal, pero esta prueba ha quedado en desuso [16]. Actualmente, se reconoce que la calciuria en la HI tiene un triple origen simultáneo: intestinal, renal y óseo. Inicialmente, se sospechó que la HI era de origen renal pero cuando se pudo determinar la PTH en 1974, se observó que en la HI los niveles de PTH eran normales, por lo que se descartó dicho origen. En 1976 se observaron valores significativamente inferiores de densidad mineral ósea en estos pacientes y posteriormente este hallazgo fue confirmado en niños por García-Nieto et al. [17]. Por otro lado, Pacifici et al. demostraron que los monocitos sanguíneos aislados de pacientes con HI producían una cantidad incrementada de diversas citoquinas, tales como la interleucina-1a (IL-1), el factor estimulante de colonias de los granulocitos-macrófagos o el factor de necrosis tumoral-a (TNF) [18]. Estas citoquinas tienen la capacidad de incrementar la actividad osteoclástica y en consecuencia de reducir la densidad mineral ósea. Actualmente, se desconoce la causa que estimula la producción de citoquinas por parte de las células monocitarias en pacientes con HI. Weissinger postuló una teoría que aúna los diferentes hallazgos previamente descritos [19]. IL-1 estimularía la producción de prostaglandina E2 (PGE2) que, secundariamente, incrementaría la de calcitriol. La hipercalciuria se ocasionaría, por tanto, por un incremento de resorción ósea y reabsorción intestinal de calcio debido a la acción del calcitriol. Una dieta rica en sal o en proteínas acrecentaría, por otra parte, la calciuria. García Nieto et al. describieron mediante sobrecarga hiposalina la existencia de una discreta pérdida salina distal en algunos pacientes adultos con HI [20]. En efecto, los mediadores inflamatorios como IL-1 y TNF reducen el transporte epitelial de sodio a través de un incremento de la síntesis de PGE2 y por medio de una reducción de la expresión y la función del canal epitelial de sodio (ENAC) y/o de la Na/K ATPasa de la membrana basolateral. Esta pérdida renal de sodio, incrementaría, asimismo, la calciuria, por lo que en algunos pacientes con HI, ésta podría, al menos en teoría, tener un triple origen, intestinal, renal y óseo.
En 1979, se describieron ratas con hipercalciuria espontánea (genetic hypercalciuric stone-forming, GHS). En 1993, se demostró que en estos animales existía un incremento en el número de receptores de la vitamina D (VDR) en el intestino, lo que inducía un incremento de la capacidad funcional de los complejos calcitriol-VDR que explicaba el incremento en el transporte intestinal de calcio previamente descrito. Posteriormente, se comprobó en ratas GHS un incremento de la resorción ósea y un defecto en la reabsorción tubular renal de calcio. Además, los niveles de calcitriol son normales en estos animales del mismo modo que en el 30-50% de los pacientes con HI. En 2004, Favus et al. demostraron que los monocitos periféricos de los pacientes con HI muestran un incremento de receptores de la vitamina D, es decir, lo mismo que se había descrito previamente en las ratas GHS [21].
La HI es más frecuente en lugares con alta consanguinidad como ocurre en algunas islas.
En resumen, la HI es una anomalía metabólica de origen genético que predispone a la formación de cálculos renales, a la aparición de infecciones urinarias y al desarrollo de osteoporosis. No obstante, existen personas que transmiten la condición a su descendencia pero que son asintomáticas, por lo que la HI no debe ser considerada una enfermedad. Ésta es la razón por la que el uso de tratamiento farmacológico debe ser seleccionado y se debe hacer énfasis en el uso de normas dietéticas protectoras.
HIPERURICOSURIA. CÁLCULOS DE PURINAS
El ácido úrico es el producto final del metabolismo de las purinas y los cálculos de urato son radiotransparentes. Al igual que en el caso de la hipercalciuria, deben considerarse inicialmente los niveles plasmáticos de ácido úrico para diferenciar los estados en los que existe sobreproducción de ácido úrico, en general asociados con hiperuricemia, de aquellos en los que existe disminución de su reabsorción tubular, en los que habitualmente se detecta hipouricemia. La hiperuricosuria se define como una excreción superior a 800 mg/día en el hombre y 750 mg/día en las mujeres.
Las circunstancias más comunes asociadas a hiperuricemia, además de la ingesta excesiva de purinas, son la gota primaria, los síndromes mieloproliferativos y el síndrome de lisis tumoral. La hiperuricemia primaria en niños debe hacer pensar en la existencia de alguna anomalía enzimática de la síntesis de nucleótidos purínicos, como la sobreactividad de la fosforribosilpirofosfato sintetasa (PRPPs) o la deficiencia de la hipoxantina-guanina fosforribosiltransferasa (HGPRT) (síndrome de Lesch-Nyhan, cuando el déficit es completo).
La hipouricemia por defecto de reabsorción tubular puede observarse tanto en las tubulopatías proximales complejas, generalmente dentro del síndrome de "de Toni-Debré-Fanconi" como en forma de defecto único (hipouricemia renal hereditaria). En estos casos, la excreción de ácido úrico en valores absolutos (orina de 24 horas) puede ser normal, pero la excreción fraccional siempre estará elevada.
Los conocimientos sobre el metabolismo del ácido úrico se basan en estudios de biología molecular que han identificado varios transportadores y proteínas que muestran la complejidad del manejo del ácido úrico en el túbulo proximal.
El transportador URAT1 que reabsorbe el urato filtrado fue identificado por Enomoto et al. en 2002 [22]. Está localizado en la membrana apical de las células del túbulo proximal y es codificado por el gen SLC22A12 (OMIM#607096). URAT1 pertenece a la familia de transportadores de aniones orgánicos (OAT). El urato es transportado por medio del URAT1 a través de la membrana apical de las células tubulares proximales, en un intercambio con aniones que son transportados hacia la luz tubular para mantener un balance eléctrico adecuado. Se han descrito mutaciones en el gen SLC22A12 que codifica URAT1, en pacientes japoneses afectos de hipouricemia tubular renal. También, se han descrito mutaciones en ese gen en paciente coreanos y en tres familias israelitas de origen iraquí. Estos pacientes se caracterizan por niveles muy bajos de ácido úrico con una excreción fraccional del mismo elevada (alrededor de 40-90%) y una respuesta atenuada de la uricosuria al probenecid y la pirazinamida. Tanto losartán como benzbromarona ejercen su acción uricosúrica inhibiendo la acción de URAT1 [23].
La salida del ácido úrico hacia el espacio peritubular se realiza mediante los transportadores basolaterales. En 2003, se identificó un nuevo transportador de iones orgánicos voltaje sensible, URATv1 (OATv1), que facilita la salida de urato de la célula. Es codificado por el gen SLC2A9. Posteriormente, fue renominado como GLUT9 (OMIM# 606142) al conocerse que pertenece a una familia de proteínas facilitadoras del transporte de hexosas (fructosa, glucosa). Se han descrito dos variantes de la proteína, una isoforma GLUT9L que se expresa fundamentalmente en la membrana basolateral de las células del túbulo proximal y una isoforma GLUT9S que se expresa exclusivamente en la membrana apical de dichas células, por lo que en los pacientes con esta otra variante de hipouricemia tubular renal la reducción en la reabsorción de urato ocurre en ambos lados de las células de los túbulos proximales renales. En estos pacientes, la excreción fraccional de urato es superior a 150%. Los portadores heterocigotos tienen niveles de urato moderadamente reducidos.
Por otra parte, deben hacerse algunas consideraciones sobre otra causa de litiasis úrica, la normouricosúrica. Los cristales de ácido úrico se forman en pH ácido. Por tanto, ese tipo de cristales puede formarse, incluso en presencia de normouricemia, en situaciones de pH urinario repetidamente ácido, especialmente, en aquellos pacientes con un exceso de ingesta de proteínas de origen animal. Cuando el pH urinario está persistentemente por debajo de 5.5, el ácido úrico se halla en forma no disociada y altamente insoluble, por lo que puede cristalizar como forma pura. Se ha descrito un trastorno, generalmente de origen familiar, consistente en una disminución de la síntesis de amoníaco por parte de la célula tubular proximal renal y, por consiguiente, de la amoniuria. El déficit de este tampón urinario condicionaría la aparición de un exceso de iones hidrógeno libres en la orina que reducirían su pH [24].
Otra causa de litiasis úrica es el uso de fármacos uricosúricos (probenecid, altas dosis de salicilatos) o de extractos pancreáticos en niños con fibrosis quística.
Por otro lado, la xantinuria o litiasis por xantina, se caracteriza por hipouricemia llamativa, hipouricosuria y EF normal. Otra causa de formación de cálculos de xantina es el tratamiento con alopurinol.
Finalmente, una causa rara de formación de cálculos de purinas, que son radiolúcidos radiotransparentes como los de uratos, es el déficit de la enzima adenina fosforibosil transferasa (APRT), que condiciona la formación de cálculos de 2,8-dihidroxiadenina (DHA), un compuesto poco soluble, que se deposita a nivel renal causando nefrolitiasis, FRA o ERC por depósito por cristales [25]. El diagnóstico de esta entidad es complejo debido a la naturaleza radiotransparente de los cristales de DHA, que en ocasiones es confundida con litiasis de uratos. Por otro lado, en biopsia renal los cristales de DHA tienen una apariencia similar a los cristales de oxalato, por lo que puede confundirse con una oxalosis. Además, puede recidivar tras el trasplante renal, por lo que un adecuado diagnóstico es fundamental [26].
HIPEROXALURIA
La hiperoxaluria se define como una eliminación urinaria de oxalato superior a 50 mg/día/1,73 m2. En niños, suele utilizarse el cociente oxalato/creatinina en muestra de orina aislada, cuyos valores de referencia varían según la edad [11].
La hiperoxaluria primaria es el resultado de tres defectos genéticos bioquímicos de herencia autosómica recesiva en la síntesis endógena del oxalato [27]. La hiperproducción de oxalato en el hígado produce una hiperoxaluria marcada y su depósito en diversos órganos del cuerpo. La hiperoxaluria primaria tipo I se debe al déficit de la alanina:glioxilato aminotransferasa, que convierte el ácido glicoxílico en glicina. El déficit de esta enzima ocasiona que el ácido glicoxílico se oxide a oxalato. El oxalato es excretado por los riñones pero dado que produce litiasis recurrente y nefrocalcinosis desde la edad pediátrica, depósitos sistémicos de oxalato e insuficiencia renal crónica. Se identifica por un incremento en la excreción urinaria de oxalato, de ácido glioxílico y de ácido glicólico.
Los pacientes con hiperoxaluria primaria tipo II son deficitarios en la actividad de la enzima D-glicérico deshidrogenasa. La orina contiene cantidades elevadas de oxalato y de ácido L-glicérico. Los pacientes tienen cálculos de repetición. Es muy rara, aunque es posible la progresión a la insuficiencia renal terminal.
La hiperoxaluria tipo III causado por mutaciones en el gen DHDPSL que codifica la 4-hidroxi-2-oxoglutarato aldolasa que cataliza el paso final en la ruta metabólica de la hidroxiprolina.
Los defectos enzimáticos de la síntesis de oxalato, conlleva a un depósito agresivo de litiasis de oxalato cálcico y oxalosis. La insuficiencia renal secundaria a depósito de oxalato es más típico de la tipo 1.
La hiperoxaluria secundaria se ha descrito, especialmente, en pacientes con trastornos gastrointestinales que se asocian con malabsorción y diarrea crónica, como resección intestinal, insuficiencia pancreática, fibrosis quística, enfermedad celíaca, enfermedad inflamatoria intestinal (enfermedad de Crohn o colitis ulcerosa) o tratamiento con orlistat [28] y análogos de la somatostatina. Los ácidos grasos libres en alta concentración quelan el calcio y reducen su concentración intraluminal. De este modo, se reduce la formación normal de oxalato cálcico insoluble y existe más oxalato soluble disponible para su absorción intestinal. En algunos pacientes formadores recurrentes de cálculos de oxalato de calcio, se han descrito concentraciones muy reducidas o ausentes de la bacteria anaerobia Oxalobacter formigenes que tiene la capacidad de degradar el oxalato.
Para más información, ver: https://www.nefrologiaaldia.org/es-articulo-hiperoxaluria-primaria-596
CISTINURIA
La cistinuria es una tubulopatía consistente en un defecto de reabsorción tubular proximal de cistina y de los aminoácidos dibásicos, arginina, lisina y ornitina. Un defecto de transporte similar existe a nivel intestinal. Es la aminoaciduria hereditaria más frecuente. La prevalencia mundial de cistinuria se estima en 1:7000, aunque varía según regiones [29]. La enfermedad se hereda de modo autosómico recesivo. Puede presentarse a cualquier edad pero la edad media de aparición es a los 12 años.
Se caracteriza por la agresiva y recurrente formación de cálculos de cistina cuya solubilidad es muy baja cuando el pH urinario es menor de 7.5. En el sedimento urinario, los cristales de cistina son típicamente hexagonales. Se consideran valores normales de eliminación urinaria de cistina una excreción inferior a 200 mg/día o un cociente menor de 18 mg/g de creatinina. La cistinuria es la responsable de aproximadamente el 1-3% de los cálculos renales en adultos y el 6-10% en niños. Más de un 50% de los pacientes cistinúricos desarrollaran litiasis durante su vida y de ellos, un 75% en ambos riñones. Es la enfermedad litiásica más compleja de tratar con una alto índice de recidiva. Su diagnóstico intraútero puede sospecharse por la presencia típica de una hiperecogenicidad del colon secundaria a la presencia de cristales que pasan, por deglución, del líquido amniótico al intestino.
En 1994 se describió el primer gen implicado en esta enfermedad, el gen SLC3A1 (OMIM#220100), localizado en el cromosoma 22p16.3, codificador de la proteina rBAT [29]. En 1999 se describió un segundo gen SLC7A9 (OMIM#604144), localizado en el cromosoma 19, que codifica la proteína b0,+AT [30]. Este segundo gen codifica la subunidad que se asocia con la proteína rBAT para formar el transportador activo. Se trasmite de forma autosómico dominante o recesiva. Se transmite de forma autosómico dominante o recesiva. Los pacientes pueden clasificarse en tres tipos:
-Tipo A (38%) causado por mutaciones en ambos alelos del gen SLC3A1. En este tipo los heterocigotos muestran una aminoaciduria normal.
-Tipo B (47%) originado por mutaciones de ambos alelos del gen SLC7A9. En este tipo los heterocigotos normalmente presentan un incremento de cistina y de aminoácidos dibásicos en orina pero se ha observado que, hasta un 14%, pueden presentar una aminoaciduria normal.
-Tipo AB (15%) causado por una mutación en SLC3A1 y otra en SLC7A9.
Para más información, dirigirse al capítulo de Nefrología al Día: https://www.nefrologiaaldia.org/es-articulo-cistinuria-272
HIPOCITRATURIA
La hipocitraturia está presente en el 15-63% de los pacientes con litiasis y en ocasiones coexiste con otras anomalías metabólicas. El citrato inhibe la nucleación espontánea del oxalato cálcico y retarda la aglomeración de los cristales preformados del mismo. Es un potente inhibidor del crecimiento de los cristales de fosfato cálcico. Además, reduce la saturación urinaria de las sales cálcicas al formar complejos con el calcio y reducir la concentración del calcio iónico. La excreción renal de citrato está modulada principalmente por el equilibrio ácido base: la acidosis intracelular incrementa la reabsorción de citrato y la alcalosis potencia la producción y excreción de citrato en el túbulo proximal [2].
Los valores de eliminación urinaria de citrato en situación de normalidad son muy dispersos. En adultos, se considera hipocitraturia unos valores inferiores a 300 mg/día para ambos sexos y/o un valor del cociente citrato/creatinina inferior a 250 mg/g. En niños, se considera hipocitraturia valores inferiores a 8 mg/kg/día y/o un cociente citrato/creatinina menor de 400 mg/g.
Las principales causas de eliminación urinaria reducida de citrato son la acidosis tubular renal y la insuficiencia renal crónica. Otras causas son el tratamiento con acetazolamida o tiazidas, la depleción de potasio, la inanición y la malabsorción intestinal. Con cierta frecuencia, se observa hipocitraturia asociada a HI, en ausencia de acidosis tubular renal.
Asimismo, se ha descrito la presencia de hipocitraturia en pacientes con fibrosis quística. La ingesta excesiva de proteínas también favorece su aparición por la sobrecarga ácida que ocasiona. No obstante, en ocasiones, no se detecta ninguna causa conocida (hipocitraturia idiopática). En la enfermedad renal crónica, la reducción de la citraturia puede ser debida a acidosis intracelular y podría ser indicativa de la instauración precoz de un tratamiento alcalinizante.
En los últimos tiempos, se está dando una gran importancia al valor del cociente calcio/citrato en primera orina del día. Un cociente calcio/citrato superior a 0.33 indica un riesgo elevado de cristalización [16]. García-Nieto V et al [31] observaron en niños con prelitiasis que valores elevados de ese cociente en primera orina del día se relacionan directamente con la presencia de antecedentes familiares de litiasis.
HIPOMAGNESURIA
El magnesio forma complejos con el oxalato con lo que se reduce la supersaturación del oxalato cálcico. Además, los complejos de oxalato magnésico reducen la absorción intestinal de oxalato. A concentraciones fisiológicas de oxalato, el magnesio reduce tanto las tasas de nucleación como de crecimiento de los cálculos [32]. Se ha descrito hipomagnesuria en pacientes con diarrea crónica, malabsorción intestinal, enfermedad inflamatoria intestinal y resección intestinal. Se define como hipomagnesuria una eliminación urinaria de magnesio inferior a 50 mg/día.
OTRAS CAUSAS DE UROLITIASIS
LITIASIS DE ESTRUVITA
Se forman como consecuencia de infecciones repetidas por organismos productores de ureasa. Estas bacterias, llamadas urealíticas, tienen la capacidad de hidrolizar la urea con liberación de amoníaco y de dióxido de carbono con lo que se incrementa el pH de la orina y se favorece la cristalización, a menudo mixta, de fosfato de amonio y magnesio (estruvita), de fosfato de calcio y de urato de amonio. Estas bacterias son los Proteus, Ureaplasma urealyticum o ciertas cepas de Klebsiella o Serratia.
LITIASIS RELACIONADA CON FÁRMACOS
Ciertos fármacos se asocian con el desarrollo de litiasis. Los fármacos más frecuentemente involucrados en la litiasis son la glafenina y sus derivados, el triamtereno, las sulfamidas, indinavir y otros). Por otro lado, algunos fármacos pueden inducir litiasis, ya sea por alterar los componentes urinarios de forma desfavorable (topiramato, acetazolamida, zonisamida, inhibidores de la bomba de protones), como por precipitación directa del fármaco o sus metabolitos en orina (triamterene, ciprofloxacino) [2]. Por ejemplo, los inhibidores de la bomba de protones se han relacionado con aumento del riesgo de litiasis, a expensas de disminuir el magnesio y el citrato urinario [33].
LITIASIS ASOCIADA A MALFORMACIONES CONGÉNITAS DEL TRACTO URINARIO
La asociación entre urolitiasis y malformaciones congénitas del tracto urinario es bien conocida y se relaciona con la infección y el estasis de la orina. Esto último es más evidente en la obstrucción de la unión pieloureteral, en pacientes con esta malformación la incidencia de litiasis se ha situado entre 16 y 44%. Desde los estudios de Husmann et al., en 1995, se sabe que el 76% de los pacientes con obstrucción de la unión pieloureteral y cálculos renales distintos de la estruvita, son portadores de anomalías metabólicas causantes de cálculos, especialmente hipocitraturia e hipercalciuria. García-Nieto et al. observaron que en el 88% de pacientes con esta malformación existían antecedentes familiares de urolitiasis, al igual que en niños diagnosticados de reflujo vesicoureteral. Esto apoya la hipótesis de que la hipercalciuria de los niños con malformaciones urinarias es de origen genético heredado de uno de sus padres [34].
La enfermedad de Cacchi-Ricci o riñón con "médula en esponja" es una anomalía congénita caracterizada por la dilatación de los túbulos colectores en una o varias pirámides renales, de forma uni o bilateral. Fue descrito en los años 30 y denominado así, por el aspecto quístico que adquiría la médula renal de estos pacientes en situaciones avanzadas. En fases iniciales, el riñón carece de ese aspecto, por lo que la entidad se ha denominado también “ectasia canalicular precalicial”. Es una entidad benigna que suele manifestarse hacia la segunda o tercera década de la vida en forma de litiasis renal, infección urinaria o hematuria. Son comunes las calcificaciones intraductales. El diagnóstico suele realizarse mediante una urografía excretora que muestra la presencia de unas características proyecciones “en cepillo” a partir de los cálices debido a la dilatación de los túbulos colectores.
Para más información, ir al capítulo de Litiasis de causa genética: https://www.nefrologiaaldia.org/es-articulo-litiasis-urinaria-de-causa-genetica-621
TRATAMIENTO DEL CÓLICO NEFRÍTICO. TRATAMIENTO EXPULSIVO. EXTRACCIÓN ACTIVA DE LOS CÁLCULOS
La mayoría de los cálculos ureterales se expulsan de manera espontánea. En los pacientes con un episodio agudo de litiasis, la medida terapéutica más urgente es la analgesia. Los estudios clínicos han demostrado que los AINEs (diclofenaco, indometacina, ibuprofeno) proporcionan un alivio eficaz en los pacientes con cólicos nefríticos agudos. Se recomienda iniciar la analgesia con diclofenaco siempre que sea posible y utilizar un medicamento alternativo cuando persista el dolor (metamizol, pentazocina, tramadol). Sin embargo, los AINEs debe usarse con precaución cuando la función renal está alterada.
El tratamiento expulsivo médico se basa en los efectos beneficiosos de ciertos medicamentos que contribuyen a la relajación del músculo liso ureteral mediante la inhibición de las bombas de los canales de calcio o el bloqueo de los receptores alfa1 simpáticos [35]. Entre los calcioantagonistas más utilizados, se encuentran el nifepidino. Por otro lado, se ha demostrado que los alfabloqueantes facilitan la expulsión de los cálculos, siendo tamsulosina (0.4 mg) el alfabloqueante más utilizado en la práctica diaria. Asimismo, existen estudios en los que se ha demostrado la eficacia de terazosina, doxazosina, alfuzosina y naftopidilo.
Al disminuir el edema local, se ha descrito que una combinación con corticosteroides (metilprednisolona 0.5-1 mg/Kg/día por vía i.m. o i.v., 1-2 dosis) podría acelerar la expulsión de los cálculos en comparación con el tratamiento exclusivo con antagonistas de los receptores alfa. Sin embargo, no se recomienda el uso aislado de corticosteroides.
Es importante evaluar el tamaño, la localización y la forma de los cálculos en el momento de la presentación inicial, la probabilidad de expulsión espontánea, la presunta composición de los cálculos, los síntomas y la asociación con infección urinaria u obstrucción. En la Guía Clínica sobre Urolitiasis (European Association of Urology) [36] se expresa que las indicaciones de la extracción activa de los cálculos son las siguientes: cuando el diámetro del cálculo es = 7 mm (pues la tasa de expulsión espontánea con ese tamaño, es baja), cuando no se logra un alivio suficiente del dolor, cuando existe una obstrucción causada por la propia litiasis acompañada de infección, cuando existe riesgo de pionefrosis o sepsis urinaria, en riñones únicos con obstrucción y en la obstrucción bilateral.
Dependiendo de la localización y tamaño del cálculo, su eliminación puede realizarse mediante litotricia extracorpórea mediante ondas de choque (LEOC), litofragmentación endourológica con energía ultrasónica, electrohidráulica o laser a través de ureterorrenoscopio, endourología percutánea y cirugía convencional. La LEOC puede eliminar más del 90 % de los cálculos en los adultos. Con esta técnica, se han comunicado tasas de ausencia de cálculos del 66-99 % en pacientes con cálculos = 20 mm de diámetro y del 45-60 % con cálculos > 20 mm de diámetro. Una endoprotesis en “doble J” reduce las complicaciones obstructivas e infecciosas que pueden aparecer tras el uso de LEOC cuando el diámetro de los cálculos es = 20 mm.
PREVENCIÓN DE LAS RECIDIVAS. TRATAMIENTO DIETÉTICO Y FARMACOLÓGICO
La formación de cálculos está influenciada por factores genéticos y factores extrínsecos, como dieta, estilo de vida o infecciones. Reducir los factores de riesgo para el desarrollo de litiasis es el modo más eficaz de prevenir esta enfermedad. La mayoría de las anomalías metabólicas causantes de cálculos tienen un origen genético, por lo que la predisposición litiásica dura toda la vida. Por tanto, debe intentarse un control dietético y reservarse el tratamiento farmacológico para los casos complicados. El tratamiento dietético, cuando se realiza bien, es muy útil para evitar la formación de cálculos. El tratamiento farmacológico está indicado en casos de litiasis de repetición, disuria persistente, hematuria macroscópica frecuente, nefrocalcinosis u osteopenia progresiva.
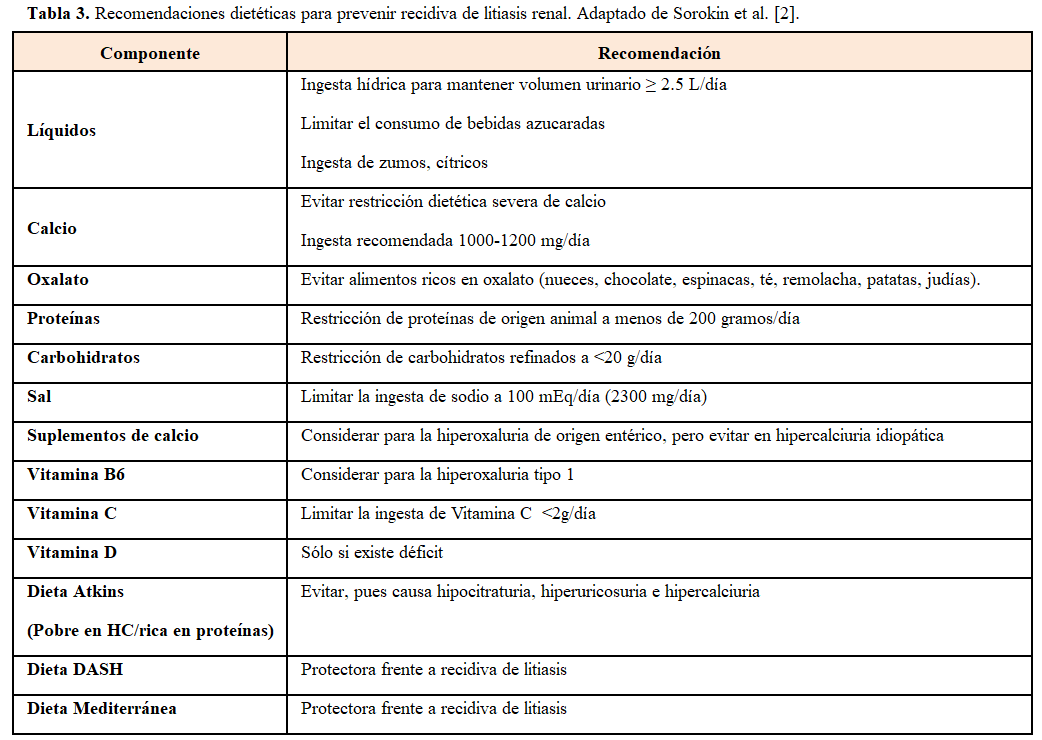
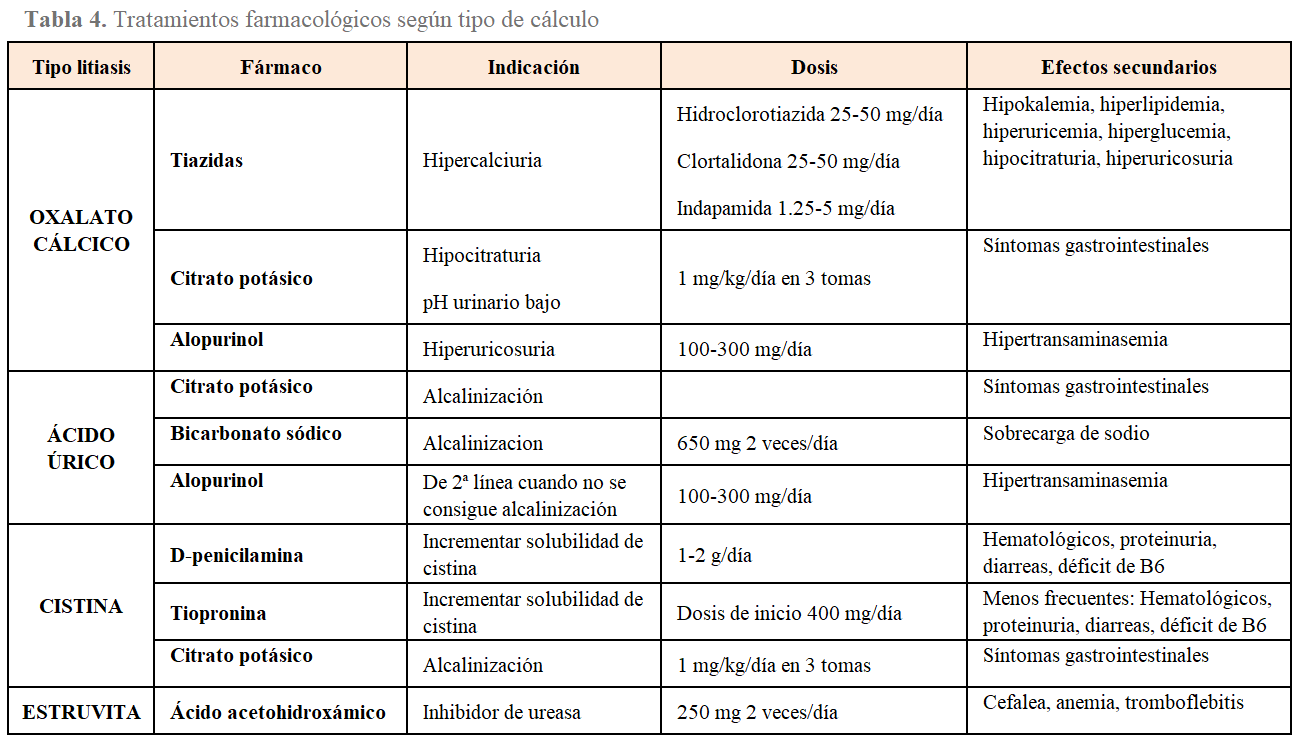
Las recomendaciones dietéticas incluyen recomendaciones generales para cualquier tipo de litiasis, y una serie de recomendaciones que varían en función de la anomalía metabólica presente (Tabla 3) y (Tabla 4) [2].
Independientemente del tipo de litiasis, la ingesta elevada de agua (2.000-3.000 ml/1,73 m2) ha mostrado ser beneficiosa y coste efectiva [37], con reducción de un 56% del riesgo de recurrencia [38]. En algunos grupos de mayor riesgo como la cistinuria, se recomienda incluso una ingesta superior a 3 litros al día [39].
El consumo de otras bebidas no está tan bien estudiado. Estudios epidemiológicos y un metaanálisis [40]. han mostrado un riesgo reducido de formación de cálculos con café, té, cerveza, vino tinto y zumo de naranja mientras que las bebidas azucaradas se asocian con un incremento del riesgo de litiasis, por lo que se recomienda evitar estas bebidas [41].
El consumo de frutas y verduras también es beneficioso, independientemente del tipo de litiasis. debido al elevado contenido natural de citrato y de álcali.
La obesidad y sobrepeso se consideran factores de riesgo de litiasis, por lo que la Asociación Europea de Urología, recomienda bajar de peso hasta un IMC normal. [42]
Los fármacos específicos para la prevención y tratamiento de las litiasis son limitados. La ausencia de un modelo animal que exhiba un proceso de litogénesis similar al depósito de oxalato cálcico en el riñón humano, ha supuesto limitaciones para el desarrollo de estos fármacos. Recientemente, estudios animales, epidemiológicos a gran escala y observacionales han encontrado que los pacientes en tratamiento con inhibidores SGLT-2 (Sodio glucosa cotransportador 2), un fármaco antidiabético, presentan una menor incidencia de litiasis [43][44] , por mecanismos aún no estudiados, pero puede estar en relación con una alteración del perfil litogénico de la orina. Se requieren ensayos clínicos prospectivos para confirmar estas observaciones. Por otro lado, metformina puede atenuar el depósito de cristales y el daño renal asociado, especialmente en pacientes con litiasis diabéticos [45].
Hipercalciuria idiopática:
Se recomienda una ingesta de calcio normal (1000-1200 mg/día de calcio elemental, o aproximadamente 3 raciones diarias de lácteos), pues una restricción severa de calcio puede acelerar la pérdida de masa ósea y producir una hiperoxaluria debido a la interacción entre el calcio y el oxalato en la luz intestinal formando un complejo de oxalato cálcico, de modo que en situaciones de pobre ingesta de calcio, el oxalato queda libre y aumenta su absorción [46].
A diferencia del calcio de la dieta, la suplementación con calcio sí se ha relacionado con aumento del riesgo de litiasis [47] y también la suplementación con calcio y vitamina D [48], pues aumenta la absoción intestinal de calcio. Un estudio in vivo confirmó que la coadministración de calcio y vitamina D agrava la formación de la placa de Randall[49]. Sin embargo un metaanálisis ha reportado que la suplementación de vitamina D incrementa el riesgo de hipercalciuria pero sin incrementar el riesgo de litiasis [50] y esto ha sido también observado en otros estudios [51].
En caso de ser necesarios, se recomienda que se tomen junto con las comidas, pues de esta forma, el calcio quela el oxalato intestinal y no se produce aumento de oxalato urinario [52] [53].
Se recomienda una restricción moderada de sal y de proteínas de origen animal. El consumo excesivo de sal, además de elevar la calciuria, desciende la citraturia por lo que es recomendable mantener una dieta con unos 100-150 mEq/día de sodio (equivalente a 2300 mg/día).
Es conveniente una ingesta adecuada de frutas y verduras (por su contenido en agua y magnesio). Sin embargo, no todas las frutas tienen el mismo efecto citratúrico. Se recomiendan especialmente los cítricos, las frutas con un mayor contenido en citrato son los pomelos y los limones.
También se recomienda la ingesta de cereales integrales, pues a través de su contenido en fitatos, reducen la absorción intestinal de calcio. El propio fitato tiene un efecto directo inhibidor de la cristalización [54]. Por otro lado, también se recomienda el pescado azul y el aceite de pescado, pues su alto contenido en ácidos grasos Ω-3, tiene un efecto protector en la formación de cálculos [55], al sustituir los ácidos grasos poliinsaturados Ω-6 (precursores de la PGE2) por los Ω-3, con lo que se cambia el espectro de los prostanoides biológicamente activos en una dirección favorable.
Los diuréticos tiazídicos se recomiendan tanto por las guías americanas [39] como europeas [56] en el tratamiento de las litiasis cálcicas recurrentes e hipercalciuria. Las tiazidas potencian la reabsorción de calcio de forma directa en el túbulo distal, y de forma indirecta en el túbulo proximal. Un metaanálisis de 6 estudios controlados randomizados mostró que las tiazidas disminuyeron un 47% la recurrencia de cálculos comparados con placebo o no tratamiento [57]. Las dosis y regímenes usados en estos estudios fueron: hidroclorotiazida 25 mg 2 veces al día, clortalidona 25 mg diario o indapamida 2.5 mg diario. La causa más frecuente de su fracaso es la ingesta excesiva de sal. Los efectos secundarios más frecuentes fueron la hipokalemia, por lo que en ocasiones es necesaria la suplementación de K, preferiblemente en forma de citrato potásico, en caso de pH bajo o hipocitraturia conconmitante.
En muchos centros se prefiere iniciar el tratamiento con citrato potásico por su efecto inhibidor de la cristalización, por los efectos adversos de las tiazidas y dado que se ha descrito que con el paso del tiempo el efecto hipocalciúrico de esos fármacos se reduce progresivamente. Sin embargo, un reciente estudio prospectivo randomizado [58] no encontraron efecto protector de las tiazidas en la recurrencia de litiasis, a pesar de conseguirse reducción de la excreción urinaria de calcio. entre pacientes que tomaban distintas dosis de hidroclorotiazida versus placebo, y sí se asociaban con efectos adversos como hipokalemia, gota, diabetes o alteraciones cutáneas.
Dado que la HI ha mostrado ser un riesgo para desarrollar osteoporosis, se recomienda realizar una densitometría a estos pacientes [59]. Las tiazidas tienen un efecto directo positivo en la densidad mineral ósea [60].
En los casos en los que se asocia osteoporosis a la hipercalciuria puede contemplarse el uso de bisfosfonatos (alendronato, ácido zoledrónico, ibandronato, etc).
Hipocitraturia
La dieta DASH, como ejemplo global de dieta sana, ha demostrado disminuir la tasa de litiasis [61].
Al igual que en la HI, es conveniente una ingesta adecuada de frutas y verduras, por su contenido en agua y magnesio, y por su efecto citratúrico especialmente los cítricos. Además, se recomienda la ingesta de cereales integrales, pues su contenido en fitatos tiene un efecto directo inhibidor de la cristalización [54].
La hipocitraturia se trata con citrato potásico oral, 1 mEq/Kg/día. La dosis se reparte en tres tomas, dando la mayor parte por la noche al acostarse, momento del día en el que se incrementa el riesgo litógeno por estar la orina más concentrada. En los casos en los que la citraturia es normal durante el día y desciende solo por la noche, puede iniciarse el tratamiento con una única dosis nocturna.
Hiperuricosuria
Debe evitarse el consumo excesivo de proteínas de origen animal, pues incrementa el riesgo de litiasis por aumento de la producción de ácido úrico y oxalato, aumenta la carga ácida (por el alto contenido en aminoácidos ricos en sulfuro) por lo que se produce un estado de acidosis metabólica crónica ligera, que reduce el pH urinario así como el citrato urinario. Se recomienda una ingesta de hasta 0.8 g de proteína/kg/día. Conseguir un pH urinario entre 6-6.5 puede prevenir y disolver los cálculos de ácido úrico [2], por lo que se debe administrar citrato potásico para alcanzar este pH diana, reservando el bicarbonato para aquellos que no toleren el citrato o que presenten insuficiencia renal o hiperpotasemia.
Además, las dietas ricas en proteínas suelen ser deficitarias en frutas y verduras, lo que potencia aún más la hipocitraturia. En el caso de la hiperuricosuria, un consumo abundante de frutas y verduras es beneficioso porque incrementa el pH urinario, con lo que se reduce el riesgo de formación de cálculos de ácido úrico.
Un 20% de los pacientes con litiasis cálcica, tienen hiperuricemia. En estos pacientes que no consiguen normalizar las cifras de ácido úrico con medidas dietéticas, se recomienda alopurinol (100-300 mg/día), un inhibidor de la xantina oxidasa. Además, alopurinol podría también tener efecto antioxidante, que contribuya a la prevención de la formación de cálculos, independientemente de la inhibición de la xantina oxidasa. En la litiasis úrica con pH urinario persistentemente ácido, el tratamiento de elección es el citrato potásico. El alopurinol se recomienda en pacientes que continúan formando cálculos de ácido úrico a pesar de una buena alcalinización urinaria. También puede utilizarse febuxostat, otro inhibidor de la xantina oxidasa más reciente [62]. Se recomiendan asimismo cambios del estilo de vida como pérdida de peso y ejercicio.
Cistinuria
La cistina es un producto intermedio del metabolismo de la metionina. La mayor parte de la metionina ingerida se usa para la síntesis proteica. Su restricción en la dieta es difícil. El objetivo de tratamiento en la cistinuria es reducir la concentración de cistina o aumentar la solubilidad de la cistina por encima del límite de solubilidad de 205 mg/L. Para ello se recomienda una abundante ingesta hídrica, al menos 3 litros al día. Además, en la cistinuria se recomienda evitar dietas hiperproteicas y dieta pobre en sal, pues la restricción de sodio reduce la excreción de cistina.
La solubilidad de la cistina está influenciada por el pH urinario y la presencia de macromoléculas urinarias. Dado que la solubilidad de la cistina se incrementa con pH urinario>7.5, se debe alcalinizar la orina para conseguir un pH urinario entre 7 y 7.5, preferentemente con citrato potásico o bicarbonato potásico, y nunca con sales sódicas, dado que el sodio potencia la excreción urinaria de cistina. Sin embargo, la alcalinización urinaria tiene un papel limitado.
Cuando no se consigue reducir la concentración de cistina a menos de 300 mg/l o 500 mg/día, se recomiendan los fármacos tioles CBTD (cystine binding thiol drug), que son fármacos que contienen grupos sulfidrilos, que sufren reacción de intercambio de disulfuro con cistina, para producir dos moléculas de cisteína unido al CBTD, un complejo que es 50 veces más soluble que la cistina. El más utilizado es la D-penicilamina (a dosis de 1-2 g/día), que al unirse con la cistina forma un complejo 50 veces más soluble, si bien, tiene muchas reacciones adversas (como síndrome nefrótico) [63]. Precisa aporte de piridoxina (vitamina B6) a razón de 50 mg/día. Los efectos son dosis dependiente. Otro fármaco con una acción similar al anterior y con menos efectos secundarios es la a-mercaptopropionilglicina (alfa-MPG; tiopronina), siendo su dosis en adultos de 300 a 1.200 mg/día. El captopril (25-50 mg/día) forma un complejo 200 veces más soluble y sería el fármaco de elección en hipertensos aunque existen estudios contradictorios con este fármaco. Dados los efectos secundarios de los tioles, deben administrarse por ciclos, recurriendo al captopril en los períodos intermedios.
Recientemente un suplemento nutricional, el ácido alipoico ha sido estudiado en modelos animales como tratamiento de la cistinuria [64], atenuando la formación de cálculos y disminuyendo los ya existentes, si bien se requieren ensayos clínicos en humanos.
Para más información, ver: https://www.nefrologiaaldia.org/es-articulo-cistinuria-272
Hiperoxaluria
Una excreción urinaria de oxalato puede ocurrir como consecuencia de una excesiva ingesta de oxalato, una sobreproducción endógena de oxalato o una absorción intestinal de oxalato aumentada. La absorción intestinal de oxalato depende no solamente de la ingesta de oxalato sino también de la ingesta de calcio. Una dieta rica en calcio conlleva una reducción de la absorción de oxalato, mientras que una dieta restringida en calcio se asocia con una absorción aumentada, y por tanto, una excreción urinaria aumentada.
En pacientes con hiperoxaluria se recomienda una dieta normal en calcio con restricción de la ingesta de oxalato. Son alimentos ricos en oxalato: espinacas, ruibarbo, remolacha, chocolate, nueces, almendas, soja, patatas y legumbres, aguacates, frambuesas y carambolas (star fruit). La restricción estricta de oxalato es recomendada en todas las formas de hiperoxaluria primaria.
El oxalato es producido endógenamente por el hígado y además consumido en la dieta. La producción de oxalato endógena es modulada por la hidroxiprolina (que se encuentra en productos cárnicos con contenido de colágeno y alimentos que contienen gelatina) y por la vitamina C (que también es influenciada por la dieta) [65]. La suplementación con 2 gramos de vitamina C se ha relacionado con un aumento del 20% del oxalato urinario en sujetos normales y del 33% en pacientes litiásicos [65], y en otro estudio la administración de 1000 mg se asoció con un 41% de riesgo de litiasis [66].
En los pacientes con trastornos malabsortivos intestinales, se recomienda restricción de oxalato junto con una dieta pobre en grasas y suplementos de calcio para quelar el oxalato intestinal.
Oxalobacter formigenes es una bacteria anaerobia Gram negativa que se encuentra en el intestino y que utiliza el oxalato como su única fuente de energía [67]. Modelos animales han mostrado una relación inversa entre la colonización por esta bacteria y el riesgo de litiasis recurrente [68]. sin embargo, en humanos no ha podido demostrarse y los intentos de tratar la oxalosis primaria con esta bacteria no han dado resultados. El uso de probióticos, como Oxalobacter formigenes y otras bacterias que degradan oxalato, como Lactobacilus spp y Bifidobacterium spp, tienen un papel protector en el desarrollo de litiasis (referencia). [69]. Recientemente, un estudio mostró la relativa menor colonización de Oxalobacter formigenes en el intestino de pacientes litiásticos respecto a individuos sanos. La mayor colonización por O formigenes se correlaciona inversamente con la concentración urinaria de oxalato [70]. Sin embargo, se requieren mayores estudios prospectivos para definir el efecto protector de los probióticos en el desarrollo de litiasis.
La ingesta de líquidos debe superar los 3 Lts/m2/día y el pH urinario debe mantenerse entre 6,2 y 6,8. Debe evitarse la deshidratación, el uso de los diuréticos de asa, y las dosis elevadas de AINE. Estas medidas generales son aplicables a todos los estados hiperoxalúricos. En la hiperoxaluria primaria el tratamiento debe ser precoz y se dirige a disminuir la saturación urinaria de oxalato cálcico, aumentando la ingesta de líquidos y utilizando inhibidores urinarios de la cristalización. El tratamiento es decepcionante, aunque en algunos enfermos el uso de 300-1200 mg/día de piridoxina reduce la oxaluria. Deben asociarse, además, citrato potásico y sales de magnesio.
En la hiperoxaluria de origen intestinal, además de intentar corregir la malabsorción, debe realizarse un aporte oral de calcio que tras unirse al oxalato en la luz intestinal ayuda a que se elimine por las heces.
El oxalato urinario que no procede de la dieta, es derivado de la conversión del glioxilato a oxalato, por la enzima lactato deshidrogenasa. Piridoxina, un componente de vitamina B6 es un cofactor necesario para la alanina:glioxilato aminotransferasa (AGT), implicada en la conversión metabólica alternativa del glioxilato a la glicina.
Los pacientes con hiperoxaluria primaria tipo I tienen déficit de AGT, por lo que no pueden desviar el metabolismo del glioxilato a la vía alternativa. La piridoxina puede utilizarse para disminuir el oxalato urinario, pues algunos estudios pequeños han mostrado una reducción del oxalato urinario hasta en un 25% [71].
También se ha propuesto la piridoxina como tratamiento en la hiperoxaluria primaria, si bien no existe suficiente evidencia.
En caso de usarse, debería iniciarse a la dosis más baja y no superar los 200 mg/día. Dosis superiores a 500 mg/día podrían causar neuropatía sensitiva severa.
Los pacientes con enfermedad avanzada que no pueden eliminar el exceso de oxalato debido a función renal alterada o fallo renal, requieren sesiones de hemodiálisis intensivas (6 sesiones a la semana) en ocasiones con diálisis peritoneal suplementaria. El único tratamiento curativo es el trasplante de hígado, que restablece el defecto metabólico y ha mostrado normalizar los niveles de oxalato, y si se realiza de forma preventiva, prevenir la progresión de la insuficiencia renal crónica. Sin embargo, el trasplante de hígado se asocia con una significativa morbimortalidad y con un tratamiento inmunosupresor de por vida. El trasplante doble hígado-riñón es realizado frecuentemente para restablecer tanto el defecto metabólico hepático como la función renal [72].
Nuevos fármacos han aparecido recientemente en los últimos años para el tratamiento de la hiperoxaluria primaria. Lumasirán es un agente terapéutico basado en RNA de interferencia (RNAi) que bloquea la síntesis de oxalato glicolato oxidasa, y reduce la oxidación de glicolato a glioxilato, el precursor inmediato del oxalato. En pacientes con hiperoxaluria primaria ha mostrado reducir sustancialmente el oxalato urinario y plasmático, en comparación con grupo placebo [73] en el ensayo ILLUMINATE-A. y se encuentran activos nuevos ensayos clínicos de eficacia y seguridad. Posteriormente nuevos ensayos (ILLUMINATE- B) han mostrado eficacia y seguridad en niños obteniéndose reducciones sostenidas de oxalato en plasma y orina a 30 meses, así como una función renal estable, una baja incidencia de eventos litiásicos, una mejoría del grado de nefrocalcinosis, con un aceptable perfil de seguridad a 24 meses [74] . Además, en el ensayo ILLUMINATE-C lumasirán también ha mostrado eficacia y seguridad en pacientes de cualquier edad con ERC avanzada [75].
La US Food and Drug Administration y la European Medicines Agency han aprobado recientemente lumasirán para el tratamiento de niños y adultos con hiperoxaluria primaria, y podría tratarse se trata de una esperanzadora terapia para estos pacientes.
Por otro lado, Nedosirán, también una terapia de RNAi dirigida frente a lactato deshidrogenasa, reduce la conversión de glioxilato a oxalato (referencia), y está siendo probada en un ensayo fase 3 (clinicaltrials.gov/ct2/show/NCT04042402). )También ha sido aprobada por la FDA para el tratamiento de la hiperoxaluria primaria para disminuir los niveles de oxalato en mayores de 9 años y adultos con FG >30 ml/min/1.73 m2, pero no se encuentra aprobado en Europa [76].
Para más información acerca de Hiperoxaluria primaria, dirigirse al capítulo específico de Nefrología Al Día: https://www.nefrologiaaldia.org/es-articulo-hiperoxaluria-primaria-596
Estruvita
Debido a que los cálculos incorporan bacterias en su interior, requieren extracción quirúrgica agresiva. Se recomienda antibioterapia específica tanto pre como postoperatoria para esterilizar la orina y prevenir la recidiva. La bacteria más frecuente es la E Coli (referencia), pero también se asocian con Klebsiella pneumoniae, Pseudomona aeruginosa y S. Aureus (referencia) [77].. La alta prevalencia de Enterococos, sugiere que las cefalosporinas de 1ª y 2ª generación pueden no ser eficaces. Sin embargo, no existe evidencia acerca del tipo de tratamiento antibiótico o duración [2].
EL uso de antibióticos basados en cultivos puede prevenir la recidiva pero puede desarrollar resistencias bacterianas.
Por otro lado, un estudio reciente ha encontrado que el uso de antibióticos puede suprimir Oxalobacter formigenes de la flora intestinal [78].
El ácido acetohidroxámico (AHA) es un potente inhibidor de ureasa, y disminuye el riesgo de formación de cálculos de estruvita, alterando el pH urinario. Además, reduce el crecimiento del cálculo . Sin embargo, produce efectos secundarios importantes como temblor, palpitaciones, proteinuria, edema, cefalea, y riesgo de tromboembolismo, por lo que sólo se reserva para pacientes en alto riesgo de recurrencia de litiasis de estruvita.
OTRAS ESTRATEGIAS TERAPÉUTICAS EN INVESTIGACIÓN
Existen múltiples investigaciones actuales sobre otros aspectos implicados en el desarrollo de litiasis, que se citan a continuación [80].
El estrés oxidativo es un factor relacionado con la litiasis renal. Varios estudios han demostrado que la respuesta inflamatoria inducida por el oxalato y los cristales a las células epiteliales tubulares renales se asocia con la formación de cálculos y que las especies reactivas de oxígeno (ROS) juegan un papel importante. En general, el daño mitocondrial es el clásico origen de generación de ROS en las células epiteliales renales, estimuladas por el ácido oxálico y/o cristales de oxalato cálcico. Algunos estudios han demostrado que la oxidasa nicotinamida adenina dinucleotido fosfato (NADPH) está relacionado con la producción de ROS y la generación de cálculos, y puede ser la base fisiopatológica común entre la litiasis y las enfermedades metabólicas sistémicas [81]. La NADPH oxidasa podría usarse como una diana terapéutica emergente.
Por otro lado, se está estudiando cómo la inflamación causada por macrófagos en las células tubulares se relaciona con la formación de cristales de oxalato cálcico, pues a través de mecanismos específicos, estos cristales promueven la diferenciación de los macrófagos M1 y la producción de citoquinas inflamatorias[82].
El metabolismo de la vitamina K1 podría ser otra diana terapéutica pues la vitamina K1 influye en el desarrollo de cálculos a través de la expresión incrementada de Matrix Gla Protein, una proteína implicada en inhibir la calcificación [83].
Otro factor relacionado con litiasis renal es la influencia hormonal. Es conocida la mayor frecuencia de litiasis renal en el género masculino, y cómo aumenta la prevalencia de litiasis renal en mujeres tras la menopausia. Diversos estudios han mostrado cómo los andrógenos y los estrógenos influyen en el desarrollo de litiasis renal [84]. La suplementación estrogénica podría ser también una diana terapéutica para prevenir el desarrollo de litiasis en mujeres.
Estudios recientes se centran en las proteinas de las “tight junction”, especialmente las Claudinas 2, 12 y 14 [85] [86] y cómo contribuyen al manejo del calcio a nivel del túbulo proximal renal y también intestinal. Por lo tanto, la claudina 2, claudina 12 y claudina 14 pueden ser potenciales dianas para la prevención de la litiasis.
Otros estudios actuales se centran en transportadores epiteliales como el transportador de oxalato SLC26A6. Es un transportador conservador de aniones que juega un papel crítico en la homeostasis del equilibrio ácido base. Se expresa en el intestino y riñón como el principal transportador de la absorción y excreción de oxalato. Los ácidos grasos de cadena corta, un producto de la dieta con fibra, disminuyen el oxalato en orina y los cálculos de oxalato cálcico vía SLC26A6 [87].
En definitiva, existen múltiples líneas de investigación centradas en diferentes aspectos del desarrollo de litiasis pero se necesitan mayores estudios para definir su efecto en la prevención y tratamiento de la litiasis.