Insuficiencia Renal Aguda
ÍNDICE:
1. Concepto y definición
2. Epidemiología
3. Formas clínicas (subfenotipos de IRA) y fisiopatología
3.1 IRA posquirúrgica
3.2 IRA en la sepsis
3.3 IRA tóxica
3.4 IRA en la insuficiencia cardíaca
3.5 IRA en la cirrosis hepática
3.6 IRA en el embarazo
3.7 IRA obstructiva
4. Diagnóstico
4.1 Cuadro clínico
4.2 Pruebas de laboratorio
4.3 Test funcionales (prueba de respuesta a la furosemida)
4.4 Biomarcadores no convencionales
4.5 Pruebas de imagen
4.6 Biopsia renal
5. Complicaciones de la IRA
6. Tratamiento médico de la IRA
7. Tratamiento renal sustitutivo en la IRA
7.1 Inicio
7.2 Modalidades de tratamiento renal sustitutivo en la IRA
7.3 Dosis de diálisis en pacientes con IRA
7.4 Anticoagulación
7.5 Finalización del tratamiento renal sustitutivo en el paciente con IRA
8. Predicción y prevención de la IRA
9. Evolución y pronóstico de la IRA
10. Seguimiento ambulatorio de la IRA
Referencias bibliográficas
1. Concepto y definición
La insuficiencia renal aguda (IRA) es un síndrome clínico caracterizado por un descenso de la tasa de filtración glomerular (TFG) que acontece en horas o en días y que puede ser producido por múltiples causas, que a menudo coinciden (origen multifactorial). Se define por incrementos en la creatinina sérica (Crs) o por el descenso de la diuresis, ambos considerados marcadores de función renal. La IRA puede acontecer tanto sobre riñones sanos como sobre riñones con diversos grados de enfermedad renal crónica (ERC). Desde un punto de vista operativo, el consenso de la Kidney Disease Improving Global Outcomes (KDIGO) [1] la define como una elevación de la Crs ≥ 0,3 mg/dl en un periodo de 48 horas, un incremento ≥ 1,5 veces la Crs basal en los primeros 7 días, o una diuresis menor de 0,5 ml/kg/h durante 6 horas o más. Además, se clasifica en estadios según la magnitud del incremento de la cifra de Crs o del descenso de la diuresis (Tabla 1).
Esta definición adolece de algunos inconvenientes prácticos:
1. El uso del criterio de diuresis está restringido a los pacientes de UCI.
2. Para detectar incrementos de la Crs, se necesita saber el valor basal de la misma que con frecuencia no se conoce o se dispone de valores fluctuantes. Si no se dispone de Crs basal, se han sugerido diversas aproximaciones: considerar la Crs al ingreso y si se dispone de varias, considerar la Crs más baja. También se podría inferir la cifra basal calculando la Crs mediante la fórmula de MDRD-6, asumiendo una TFG de 75 ml/min por 1,73 m2. El problema es que todos estos métodos pueden llevar a la sobreestimación o infraestimación de la IRA y por lo tanto, en estos casos, el juicio clínico ha de prevalecer [2].
3. La cifra de Crs puede estar afectada por factores ajenos a la TFG, como la masa muscular, uso de determinados fármacos, el embarazo y la dilución o concentración del plasma [3].
4. La cifra de Crs es un balance entre producción y eliminación renal y un cambio en la TFG, que debe ser superior al 50% para alterar la cifra de Crs, tarda 24-48h en verse reflejado, por lo que se considera un marcador poco sensible y tardío.
La definición KDIGO de la IRA es puramente funcional ya que no tiene en cuenta marcadores de lesión de la estructura renal (por ejemplo, proteinuria o biomarcadores de lesión renal aguda, ver más adelante). Consensos más recientes de la ADQI (Acute Disease Quality Initiative) han recomendado incorporar estos biomarcadores para afinar la clasificación de IRA [4]. Así, se propone dividir cada estadio KDIGO de IRA en 2 subestadios según la positividad o no de biomarcadores de lesión renal y añade un estadio en el que no hay incremento de Crs o descenso de la diuresis, pero si positividad de biomarcadores de lesión, lo que se conoce como IRA subclínica. Se ha demostrado que la IRA subclínica se asocia a un elevado riesgo de IRA clínica, necesidad de terapia sustitutiva renal aguda y mayor mortalidad [5].
La IRA está englobada dentro de lo que se conoce como acute kidney disease (AKD), traducible a enfermedad renal aguda (ERA), que se define como alteraciones en la TFG estimada (TFGe), concretamente, una TFGe < 60 ml/min/1,73 m2, o un descenso de TFGe ≥ 35% o un incremento de la Crs >50%, que persisten más de 7 días y menos de 3 meses [6]. La definición incluye también marcadores de lesión renal como aparición de proteinuria de novo o empeoramiento de una proteinuria preexistente. Si las reducciones en la TFGe o las alteraciones de la estructura del riñón persisten más de 3 meses, se define como ERC. Así, dentro de los primeros 7 días del evento agudo, se hablará de IRA, si el aumento de creatinina cumple los criterios KDIGO definidos anteriormente, pudiendo, con posterioridad, evolucionar a ERA o ERC. Pero también puede darse el caso de una ERA sin criterios KDIGO de IRA en los primeros 7 días. Estos pacientes “subagudos” presentan, típicamente, un deterioro lento y persistente de la función renal. Se ha demostrado que tienen un riesgo de mortalidad, de ERC progresiva o de novo y de ERC terminal similar al de los pacientes con IRA [7].
2. Epidemiología
La IRA es una patología relativamente frecuente y su incidencia depende del contexto en donde se presente. Los principales factores de riesgo de IRA hospitalaria son la edad, la ERC, la diabetes, la hipertensión, la insuficiencia cardíaca, la cirrosis y la EPOC [8]. Estudios antiguos reportan una incidencia muy dispar según los criterios de IRA que emplean. En Europa, la incidencia anual de IRA está entre 200 y 500 casos por 100.000 personas/año y aproximadamente, entre 7 y 30 casos por 100.000 personas/año requieren tratamiento sustitutivo renal agudo [4]. Un metaanálisis de estudios globales usando los criterios KDIGO reporta una incidencia del 22% en adultos y del 34% en edad pediátrica [9]. En cuanto a todo el espectro de AKD, un estudio poblacional ha reportado una incidencia de AKD sin IRA de 3,8 por 100 habitantes evaluados, cifra que duplica a la de IRA, 1,4 por 100 habitantes evaluados [7].
A nivel de la comunidad, las causas más frecuentes son enfermedades agudas que comportan inflamación, depleción de volumen y nefrotoxicidad. En el ámbito hospitalario, la incidencia más elevada se da en pacientes críticos y en pacientes sometidos a cirugía mayor. En pacientes críticos, la incidencia oscila entre un 19,2% a un 57,3% según se usen los criterios KDIGO de Crs únicamente, de diuresis o ambos. Se detectan más casos combinando ambos criterios [8][10]. En los pacientes críticos, la mayor parte de los casos de IRA son producidos o asociados con la sepsis. En un metaanálisis de 189 estudios con 150.978 pacientes, la IRA asociada a sepsis ocurría en un 40% de pacientes, con una mortalidad de 48%, daño renal persistente del 40% y dependencia de la diálisis en un 10% [11].
En cuanto a la IRA poscirugía mayor, un estudio prospectivo multinacional reciente, que se basaba en criterios KDIGO de IRA, reportó una incidencia dentro de los 3 primeros días posoperatorios del 25% [12], siendo la mayoría de estadio 1 (63,5%), seguido por el estadio 2 (25,7%) y el estadio 3 (10,7%). Además, un 33,8% cumplía el criterio de IRA persistente (más de 48 horas de evolución). Las cirugías más frecuentemente asociadas a IRA fueron las urológicas, cardiacas, vasculares y generales.
3. Formas clínicas (subfenotipos de IRA) y Fisiopatología.
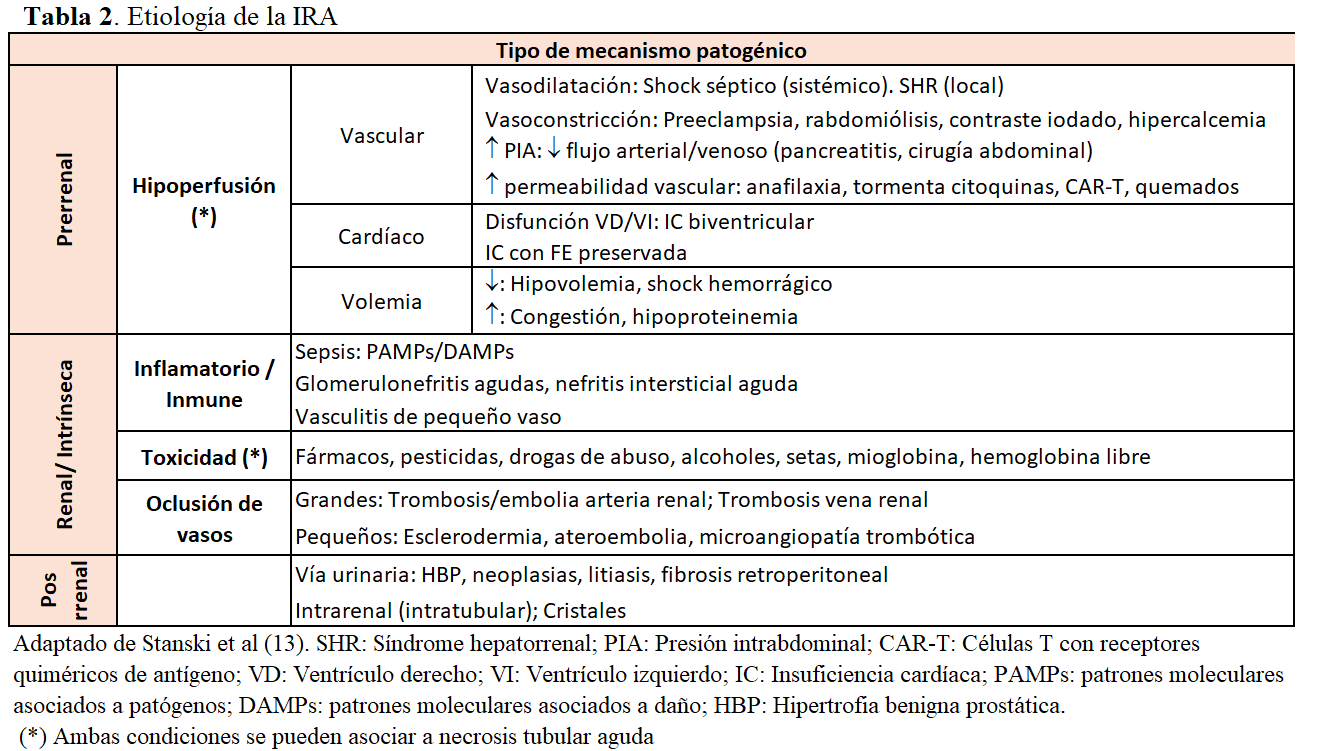
La fisiopatología de la IRA es compleja y varía en función del escenario clínico en el que suceda. Clásicamente, se clasifica en prerrenal, intrínseca o posrenal según el lugar de actuación del mecanismo patogénico implicado en su desarrollo. La entidad más frecuente a nivel hospitalario es la necrosis tubular aguda (NTA), que puede producirse, principalmente, por hipoperfusión grave o persistente que provoque isquemia tisular. También puede ser consecuencia de la exposición a nefrotoxinas o estar asociada o ser consecuencia de una sepsis.
En revisiones más actualizadas, se intenta clasificar la IRA por mecanismos patogénicos más precisos que permitan, por un lado, entender mejor su fisiopatología y, por otro, identificar posibles dianas terapéuticas con el objetivo de mejorar su pronóstico [13]. Además, clasificar por mecanismos más específicos ha permitido la descripción de los diferentes subfenotipos que se podrán incluir en la clasificación previa (Tabla 2).
A continuación, se describen los subfenotipos más característicos que se pueden encontrar en la práctica clínica habitual.
3.1 IRA posquirúrgica
Es una complicación relativamente frecuente, con una importante repercusión en la morbimortalidad hospitalaria. El factor inicial en su patogenia es la hipoperfusión renal, que puede ir asociada a hipovolemia (sangrado, pérdidas insensibles, terceros espacios), al descenso del gasto cardiaco o a la vasodilatación sistémica que se produce por la anestesia o por la propia cirugía, como consecuencia de la activación de respuestas neurohormonales. La hipoperfusión renal mantenida asociada a un fallo en los mecanismos de autorregulación renal pueden conducir a isquemia tubular y necrosis tubular aguda (NTA). Además, se produce la liberación de patrones moleculares asociados a patógenos (PAMPs) que a su vez activan la respuesta inflamatoria y oxidativa, la cascada de la coagulación y producen daño endotelial, aumento de la permeabilidad capilar, microtrombosis y alteración del flujo intrarrenal.
Existen diferentes factores favorecedores de la IRA posquirúrgica como son la exposición a fármacos potencialmente nefrotóxicos o el daño de isquemia y reperfusión. En casos de cirugías por laparoscopia, el aumento de la presión intrabdominal secundario al neumoperitoneo es otro factor sobreañadido [14][15]. En pacientes sometidos a cirugía cardíaca, hay que añadir el efecto de la hemólisis y la producción de microémbolos así como la activación de la respuesta inflamatoria severa tras tiempos prolongados en circulación extracorpórea [16].
Hasta la actualidad, se recomendaba sistemáticamente la suspensión de los tratamientos bloqueadores del sistema renina-angiotensina-aldosterona. Hoy en día, esta recomendación no está tan clara, dado que existe alguna evidencia según la cual su uso no implica un mayor riesgo de IRA [17]. Actualmente, se recomienda la suspensión, previa a la cirugía, de los inhibidores del cotransportador de sodio-glucosa tipo 2 (iSGLT2). Sin embargo, Dimitriadis K et al concluyen en su estudio que el uso crónico de iSGLT2 puede tener un efecto nefroprotector frente al contraste en pacientes diabéticos sometidos a procedimientos de revascularización percutánea cardíaca [18]. Se requerirán más estudios similares al previo para conocer el impacto que su suspensión vs mantenimiento pueda tener tanto en el desarrollo de un episodio de IRA, como en la mortalidad [19].
En cuanto a su manejo, no existe ningún tratamiento específico, sólo etiológico y de soporte. Es fundamental aplicar las medidas preventivas recomendadas en las KDIGO para pacientes de riesgo
3.2 IRA en la sepsis
Como se ha comentado en el apartado de epidemiología, en la UCI, la sepsis suele ser la causa más frecuente de IRA, pudiendo afectar al 45-70% de los pacientes. Alrededor de un 10% de ellos llegaran a requerir un tratamiento renal sustitutivo y verán incrementada su mortalidad hasta en un 60% [20]. Su aparición además comporta un aumento de la estancia hospitalaria, aumento de comorbilidad cardiovascular y mayor riesgo de ERC, que dependerá, al igual que ocurre en otros escenarios, de la comorbilidad previa del paciente [21].
En la actualidad, se distinguen 2 situaciones clínicas:
• IRA asociada a sepsis, cuando ambas situaciones concurren simultáneamente y la IRA se diagnostica dentro de los 7 días tras el diagnóstico de sepsis. Se relaciona con la presencia de otros factores como congestión venosa, síndrome compartimental abdominal o nefrotoxicidad por fármacos, otras causas de IRA que no dependen de la sepsis.
• IRA inducida por la sepsis cuando el mecanismo principal del daño renal es consecuencia de la misma. Se clasifica en temprana, si se produce en las primeras 48h y tardía, si tiene lugar entre las 48h y el séptimo día. Representa un subfenotipo en sí mismo [12].
No se conoce con exactitud la incidencia de IRA asociada a sepsis. Esto es debido por un lado a la gran variabilidad de definiciones empleadas en los diferentes estudios analizados y por otro, a la diversidad de comorbilidades previas al episodio de IRA que presentan los pacientes incluidos en estos estudios [12].
En la fisiopatología de la IRA inducida por la sepsis se han implicado diferentes mecanismos patogénicos [21]. Inicialmente, se produce un incremento de los PAMPs y en función de la susceptibilidad individual (dependiente de características genéticas) y de la disfunción orgánica que se produzca, se determinará el mecanismo patogénico predominante:
• Alteraciones micro y macrocirculatorias
• Inflamación
• Inmunomodulación
• Activación del complemento
• Disfunción del SRAA
• Reprogramación del metabolismo
• Disfunción mitocondrial
La heterogeneidad de su forma de presentación ha hecho que aún no se disponga de un tratamiento específico a pesar de los diferentes ensayos realizados [12]. De cualquier modo, el pronóstico de la IRA estará ligado, estrechamente, al pronóstico de la sepsis, donde el tratamiento fundamental va dirigido al control del foco infeccioso.
3.3 IRA tóxica
La IRA debida a tóxicos varía dependiendo del agente implicado. Su incidencia será diferente en función del lugar donde se produzca la exposición:
• A nivel hospitalario, la causa principal de la IRA tóxica son los fármacos, representando alrededor del 16-29% de todas las causas de IRA [22].
• A nivel extrahospitalario se añadirá el uso de drogas de abuso, hierbas medicinales, metales pesados, pesticidas y alcoholes. Su incidencia puede oscilar entre el 59 y el 72%, aumentando con la edad y la presencia de la polifarmacia [23].
Los mecanismos implicados en el daño renal por toxicidad son diversos:
• Toxicidad tubular directa
• Toxicidad por los componentes eliminados por secreción tubular desde la membrana basolateral, determinando interferencias metabólicas que conllevan necrosis y apoptosis.
• Depósito de cristales intratubulares con obstrucción y lesión celular.
• Formación de cilindros intratubulares.
• Alteraciones de la hemodinámica intrarrenal.
• Reacciones inmunoalérgicas como la nefritis inmunoalérgica.
• Rabdomiólisis.
• Daño endotelial directo incluyendo la microangiopatía trombótica (MAT).
• Isquemia crónica
En algunos casos, la lesión renal depende, exclusivamente, del mecanismo de acción del tóxico, pero en otras ocasiones, intervienen, además, factores de riesgo tanto no modificables: la edad, el sexo o las alteraciones farmacogenéticas, como modificables: el estado de hidratación, las alteraciones metabólicas y del equilibrio ácido base. La IRA tóxica también se puede ver influenciada por factores dependientes de la comorbilidad del paciente [15][24].
El tratamiento específico será la retirada del tóxico o fármaco implicado, así como la terapia de soporte
3.4 IRA en la insuficiencia cardíaca.
El Síndrome Cardiorrenal tipo I se define como la aparición de IRA que ocurre en el contexto de una insuficiencia cardíaca descompensada. Su incidencia se estima entre el 25-30%, incrementándose hasta el 60% en los pacientes que presentan ERC [25]. Como en otras situaciones clínicas, el desarrollo de IRA aumenta la morbimortalidad de estos pacientes.
Los mecanismos patogénicos descritos incluyen:
• Hipoperfusión renal debida a la incapacidad de mantener el gasto cardiaco. En muchas ocasiones se acompaña de congestión venosa sistémica, que aumenta la presión en las venas renales y produce congestión glomerular y edema intersticial renal. Ambas situaciones derivan en una reducción del flujo intrarrenal.
• La disminución del flujo intrarrenal promueve la activación del sistema nervioso simpático y del eje SRAA que, a su vez, aumentan la retención hidrosalina, con el objeto de aumentar la precarga del ventrículo derecho e izquierdo, empeorando la congestión.
• Finalmente, se genera un estado inflamatorio con aumento del estrés oxidativo, que incrementa la disfunción renal y miocárdica [26] [27][28].
Este tipo de síndrome cardiorrenal lo podemos clasificar de acuerdo a la disfunción cardíaca evaluada por la fracción de eyección del ventrículo izquierdo (FEVI). Así, tendremos pacientes con insuficiencia cardiaca y FEVI preservada (FEVI>50%), FEVI moderadamente disminuida (40-49%) y FEVI deprimida (<40%). En ellos, se deberá evaluar el aumento de las presiones a nivel de ventrículo derecho, que se puede traducir, a su vez, en un aumento de las presiones a nivel del compartimento venoso renal, reduciendo el gradiente entre la presión arterial y venosa renal y disminuyendo el flujo intrarrenal. Estos datos, que se pueden obtener de forma sencilla a través de exploraciones como la ecocardiografía y la realización de VExUS a pie de cama, nos permiten dirigir la terapia de descongestión [29].
En el caso específico de la IRA asociada a insuficiencia cardiaca, en la que con frecuencia podemos encontrar una nefropatía por congestión, está especialmente indicado el tratamiento diurético, que puede ser monitorizado, como comentamos en el párrafo anterior, por ecografía.
3.5 IRA en la cirrosis hepática
La incidencia de IRA en pacientes con cirrosis hepática (CH) puede llegar a alcanzar al 50% de los casos, con un importante impacto negativo en el pronóstico [30].
En la definición de IRA en la CiH, el International Club of Ascites (ICA), añadió a las definiciones clásicas de la KDIGO, los conceptos de progresión (a estadios IRA más graves) y regresión (a estadios IRA menos graves), no respuesta (sin regresión), respuesta parcial (regresión a creatinina ≥ 0,3 mg/dL por encima de la basal) y respuesta total (regresión a creatinina < 0,3 mg/dL por encima del valor basal).
Una característica a tener en cuenta en los pacientes con CiH es que la función renal puede encontrarse infraestimada, ya sea por una menor producción de creatinina asociada a la disfunción hepática, a la presencia de sarcopenia y desnutrición o bien, por la interferencia de la bilirrubina en su medición. No obstante, sigue siendo una medición clínica útil. De hecho, el estadio 1 se ha subclasificado en dos estadios : 1A (Crs <1,5 mg/dl) y 1B (Crs ≥1,5 mg/dl), debido que los pacientes de este segundo grupo presentan peor pronóstico [30]. A pesar de que la diuresis es un criterio para el diagnóstico de la IRA en general, la oliguria habitual de estos pacientes (debido a la ávida retención de sodio y agua), su influencia por los diuréticos y los defectos de cuantificación de la orina en las plantas de hospitalización, han condicionado que, en las guías actuales, la diuresis se halla suprimido de los criterios diagnósticos de la IRA asociada a CiH.
Actualmente, la mayoría de las causas de IRA en el paciente con CiH son las prerrenales (70%), seguidas del síndrome hepatorrenal (SHR-IRA) y la NTA. El diagnóstico de SHR-IRA, conlleva la persistencia de disfunción renal de más de 48h, con un incremento de más del doble de la creatinina basal, en un paciente con ascitis, sin respuesta a la retirada de diuréticos y a la expansión de volumen con albúmina. Además, se debe haber descartado la presencia de shock, nefrotóxicos, proteinuria > 500 mg/dl, hematuria y constatarse la existencia de una exploración ecográfica renal normal [31].
Los mecanismos fisiopatogénicos implicados en la IRA asociada a la CiH son:
1. Alteraciones hemodinámicas
• Vasodilatación esplácnica: debida la producción de mediadores como el óxido nítrico y el factor de necrosis tumoral (TNF), especialmente en pacientes con hipertensión portal grave. Esta vasodilatación conlleva, de forma secundaria, hipoperfusión sistémica y la disminución del volumen circulante efectivo (VCE) a pesar de una volemia normal o aumentada.
• Vasoconstricción renal: La disminución del VCE produce una activación del SRAA y del sistema nervioso simpático como mecanismo compensador. La producción elevada de noradrenalina y angiotensina II promueve a su vez la vasoconstricción renal.
• Rarefacción de la circulación en córtex renal: A diferencia de otras causas de IRA por hipoperfusión, donde se preserva la circulación medular, en el síndrome hepatorrenal hay una preservación de las nefronas yuxtamedulares, lo que condiciona que, junto con una hipertrofia del asa de Henle, se produzca una elevada retención hidrosalina característica de esta situación clínica. Si esta situación no se corrige, puede conllevar a producir un daño irreversible.
• Reactividad vascular aumentada en las arteriolas renales del córtex como respuesta a la presencia de endotoxemia: Es uno de los mecanismos propuestos para la perpetuación del daño
• Reflejo hepatorrenal: Como consecuencia de la hipertensión portal, se produce la activación del sistema simpático a nivel hepático, con una vasoconstricción renal secundaria, independientemente de la volemia del paciente.
• Cardiomiopatía cirrótica: Inicialmente, se mantiene el gasto cardíaco por una situación hiperdinámica, pero a medida que avanza la enfermedad, se produce una disfunción cardíaca con deterioro de la relajación diastólica que comporta una disfunción del gasto cardíaco
• Hipertensión intrabdominal secundaria a ascitis a tensión.
• Hipertensión porto-pulmonar [31].
2. Alteraciones no hemodinámicas
• Necrosis Tubular aguda.
• Nefropatía colémica o por cilindros biliares.
• Inflamación.
En el caso específico de SHR-AKI, el uso de terlipresina junto con albúmina revierte la vasodilatación esplácnica con optimización de la volemia intravascular y consigue la mejoría de la función renal [32].
3.6 IRA en el embarazo
La IRA durante el embarazo presenta un elevado impacto en la morbimortalidad maternoperinatal. Se asocia con un mayor riesgo de complicaciones obstétricas: hemorragia uterina, síndrome HELLP, abruptio placentae y parto mediante cesárea. De forma común a otras causas de IRA, aumenta tanto el riesgo cardiovascular, como el riesgo de desarrollar una ERC a largo plazo. En países en vías de desarrollo se relaciona principalmente con la hemorragia uterina, el aborto séptico y la sepsis puerperal, mientras que en países desarrollados se asocia a hipertensión y a las patologías relacionadas con la misma. Su frecuencia es sensiblemente mayor en los países en vías de desarrollo respecto a los países del primer mundo (3,1% vs 0,3%) [33][34].
A la hora de evaluar la etiología de una IRA en el embarazo, debemos tener en cuenta que cualquier causa de IRA que pueda acontecer en la población general, lo puede hacer también en una mujer gestante. Sin embargo, existen otras causas de IRA que se asocian, específicamente, al embarazo. Muchas de estas causas comparten mecanismos fisiopatogénicos comunes con las causas habituales de IRA, pudiéndose clasificar en función de los mismos en tres grupos:
• Prerrenal o por hipoperfusión:
Hiperemesis gravídica, fundamentalmente, en el primer trimestre
Sepsis: abortos sépticos y sepsis urinarias, más frecuentes durante el primer trimestre. Sepsis puerperales.
Hemorragias uterinas: abruptio placentae, placenta previa, placenta acreta, abortos, atonía o rotura uterina. Pueden acontecer en cualquier momento del embarazo, principalmente en el primer y último trimestre. La hemorragia posparto, por su intensidad y severidad puede condicionar la aparición de una necrosis cortical.
Insuficiencia cardíaca congestiva
• Renal o parenquimatosa:
Necrosis tubular aguda, secundaria a hipoperfusión renal mantenida o asociada a nefrotoxicidad
Necrosis cortical, pueden llegar a representar hasta el 5-10% de todas las causas de IRA en el embarazo. Se asocia fundamentalmente a sepsis puerperal, abruptio placentae, hemorragias uterinas graves, muerte intraútero o microangiopatía trombótica.
Glomerulonefritis: LES, síndrome antifosfolípido
Microangiopatía trombótica (MAT): Púrpura trombótica trombocitopénica (PTT) y síndrome hemolítico urémico (SHU). Típicamente, el SHU se diagnostica en el periparto o posparto. Con frecuencia se trata de un SHUa mediado por el complemento y precipitado por el embarazo. Se produce lesión endotelial, con trombosis intracapilar e isquemia.
Hígado agudo graso del embarazo
Preeclampsia/Síndrome HELLP. Se produce en el 3-4% de las gestaciones. Puede desarrollarse a partir de la semana 20 de gestación. Suele recuperarse en las 48-72 h después del parto. La lesión histológica más común es una endoteliosis a nivel glomerular. En un 25-30% puede manifestarse como una MAT [35].
• Posrenal:
Hidronefrosis por compresión de útero gravídico
Nefrolitiasis
Lesiones de uréter y/o vejiga: complicaciones raras que pueden acontecer tanto en partos vaginales como en cesáreas.
El tratamiento incluye medidas generales, de soporte, comunes a las empleadas en la población general (sueroterapia, antibioterapia, transfusiones, diuréticos, corrección de las alteraciones hidroelectrolíticas y del equilibrio ácido base y diálisis en los casos en los que el manejo conservador no sea suficiente) y, por otro lado, medidas específicas, dirigidas a la causa concreta de la IRA: En caso de tratarse de una IRA asociada a GN, tratamiento inmunosupresor compatible con la gestación. En casos de MAT, preeclampsia con criterios de gravedad, síndrome HELLP, hígado agudo graso del embarazo o abruptio placentae, el único tratamiento eficaz es la inducción del parto. Tras el parto, en la PTT se recurrirá al uso de plasmaféresis (a la que también se podrá recurrir durante la gestación), esteroides, caplacizumab y Rituximab y en el SHUa, eculizumab/ravulizumab. En los casos de IRA posrenal, se procederá a la derivación de la vía urinaria [36].
3.7 IRA obstructiva
La IRA de causa obstructiva se produce por la interrupción del flujo urinario en cualquier nivel del tracto de salida de la orina. La fisiopatología es compleja y dinámica y depende de su duración, severidad y localización. Constituye el 10% de las causas de IRA y aumenta su incidencia con la edad [37].
Los mecanismos patogénicos implicados derivan de un aumento de la presión en la vía urinaria que se transmitirá de forma retrograda hacia el parénquima [38]. Según el tiempo transcurrido desde su instauración, podremos establecer diferentes mecanismos patogénicos. Inicialmente, se producirá una disminución del filtrado glomerular secundaria al aumento de la presión intratubular que, posteriormente, se perpetuará por la vasoconstricción de las arteriolas eferente y aferente, secundaria a la activación del SRAA y del sistema nervioso simpático. Si no se resuelve la obstrucción, la inflamación intersticial conducirá a la fibrosis a nivel tubular con una pérdida de la capacidad de concentración y acidificación de la orina.
El tratamiento específico de los pacientes con IRA obstructiva consiste en realizar la derivación de la vía urinaria de la forma más precozmente posible.
4. Diagnóstico.
4.1. Cuadro clínico
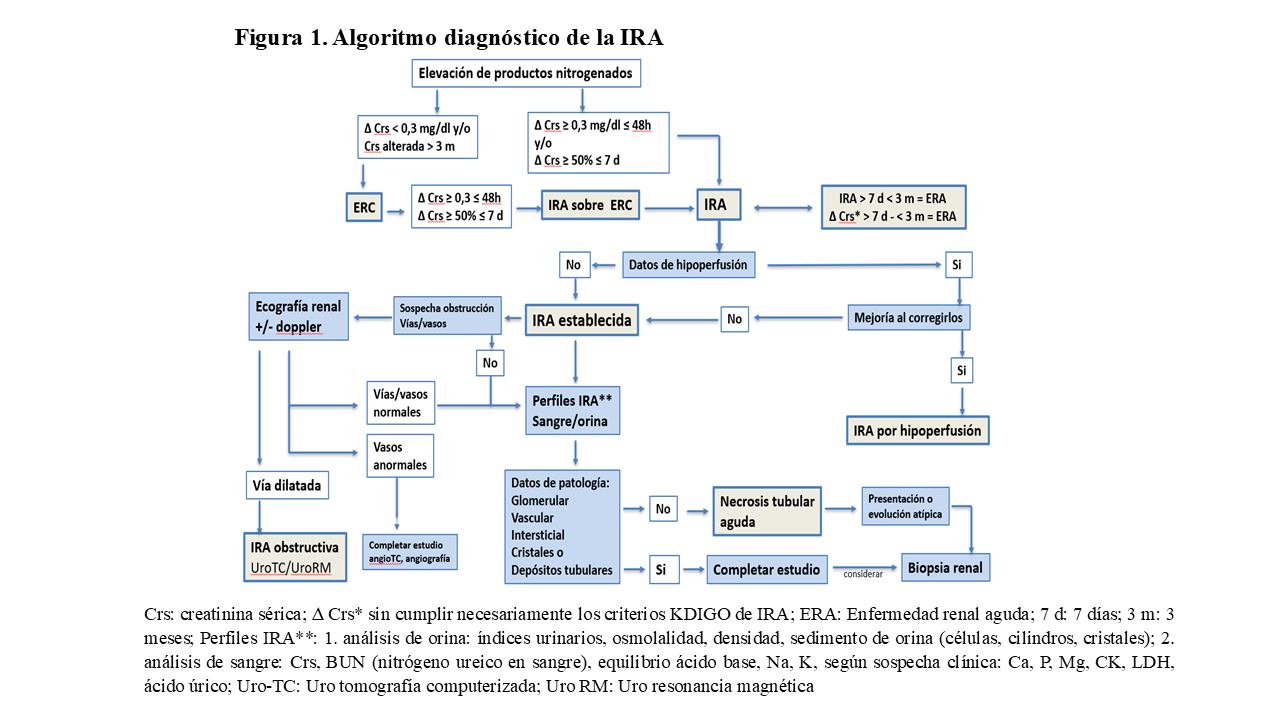
La clínica es fundamental en el diagnóstico etiológico de la IRA. De entrada, es importante cuestionarse: 1) si se trata de una IRA en un riñón previamente normal o sobre una ERC preexistente, o si se trata, por el contrario, de una ERC; 2) si es probable que exista una obstrucción de la vía urinaria; 3) si existen causas de hipoperfusión renal; 4) si hay sospecha de oclusión de grandes vasos renales (arteria o vena) y 5) si hay indicios de enfermedad glomerular o inflamatoria intersticial, (Figura 1).
En el enfoque diagnóstico de la IRA es particularmente importante realizar una buena anamnesis que incluya balance de fluidos, alteraciones en la micción, exposición a nefrotóxicos, síntomas de enfermedad sistémica, rash (nefritis intersticial), livedo reticularis (ateroembolia), púrpura (vasculitis, microangiopatías) y afectación de otros órganos. Las manifestaciones clínicas propias de la IRA son las de sus complicaciones (síndrome urémico, alteraciones hidroelectrolíticas, hipervolemia), ver apartado 5.
El volumen de la diuresis puede dar algunas claves diagnósticas. En la IRA por hipoperfusión, suele estar reducido, excepto si la causa es una depleción de origen renal (diuresis osmótica, diabetes insípida, insuficiencia suprarrenal), en cuyo caso, la diuresis se mantendrá hasta que la tasa de FG caiga de forma crítica. En la IRA parenquimatosa, la diuresis suele estar preservada en la necrosis tubular aguda (NTA) y suele haber oliguria (diuresis <400 mL/d) o anuria (diuresis < 100 mL/d) en las glomerulonefritis rápidamente progresivas (GNRP), en la uropatía obstructiva completa y en la oclusión bilateral de grades vasos o unilateral sobre riñón único.
4.2. Pruebas de laboratorio
Como se ha mencionado anteriormente, la Crs es un marcador de función renal relativamente pobre, sobre todo en la IRA, donde la TFG puede ser cambiante, dificultando un equilibrio entre producción y eliminación. La medición del aclaramiento de creatinina puede ayudar a conocer mejor la función renal en estas situaciones. Para ello, se necesita la medida de la Crs y de la Cr en una muestra de orina cronometrada. En la práctica ambulatoria, es habitual realizarla en orina de 24h, pero en pacientes ingresados en UCI, se ha demostrado que una recogida de 4h es fiable [39]. Hay que recordar que la creatinina además de filtrarse se secreta en lo túbulos, por lo que el aclaramiento sobreestima la TFG en un 10-20%.
Otra alternativa o complemento a la Crs es la medida de la cistatina C. Este marcador se sintetiza de forma constante en todas las células nucleadas, su producción no se afecta por la masa muscular y se elimina, prácticamente, por filtración glomerular. No obstante, puede influenciarse por el tratamiento con corticoides, por modificaciones en la proteína C reactiva y por otras situaciones como la ERC, la diabetes o estados inflamatorios. De ahí, que no se haya implementado en los criterios diagnósticos de la IRA y que su medición estandarizada no se haya generalizado [40]. Sin embargo, es de utilidad para evaluar la función renal en pacientes con IRA recuperada después de ingresos prolongados, en los que se haya producido una pérdida de masa muscular [41].
En el diagnóstico diferencial de las causas de IRA pueden ser de utilidad un hemograma (anemia, trombopenia, eosinofilia), un frotis (esquistocitos en anemia microangiopática), la determinación de la calcemia, de la creatinin quinasa (CK), de la lactato deshidrogenasa (LDH) y del ácido úrico. En el caso de que exista sospecha clínica, la determinación de inmunología e inmunoquímica (complemento, anticuerpos anticitoplasma del neutrófilo (ANCA), anticuerpos antimembrana basal glomerular (anti-GBM), cadenas ligeras de inmunoglobulinas, etc.) puede ser de gran ayuda. El análisis del equilibrio ácido-base es esencial para monitorizar las complicaciones de la IRA, pero también para diagnosticar trastornos ácido-base primarios que desembocan en una IRA. El gap osmolar (diferencia entre la osmolalidad medida y la calculada) puede ayudar en el diagnóstico de las intoxicaciones por alcoholes.
El análisis de la orina es crucial para el diagnóstico diferencial de la IRA y deberá incluir la proteinuria, el análisis bioquímico y el sedimento:
1. El análisis de la proteinuria es importante. La albuminuria es un marcador de patología glomerular o endotelial. La excreción de proteínas de bajo peso molecular (proteinuria sin albuminuria) puede indicar exceso de producción (hemopatías) o déficit de reabsorción tubular (lesión tubular). Es importante recordar que la evaluación correcta de la proteinuria y de la albuminuria en la IRA, se debe basar en la excreción urinaria. La concentración simple puede condicionar errores y los cocientes proteína/creatinina y albúmina/creatinina pueden sobreestimar los valores reales, debido a una excreción urinaria reducida de creatinina en la IRA.
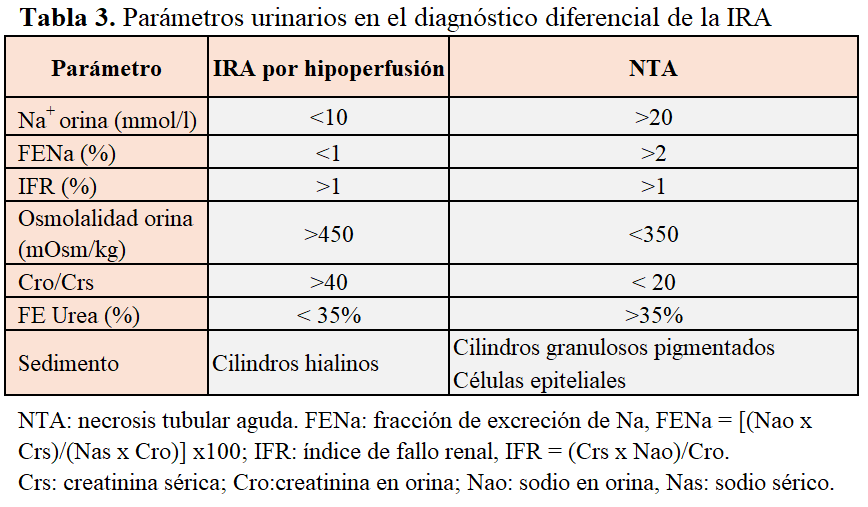
2. El análisis bioquímico de la orina puede ayudar en el diagnóstico diferencial de la IRA por hipoperfusión (también conocida como “prerrenal”) con la IRA por lesión tubular (NTA), (Tabla 3). En este sentido, el sodio en orina y la excreción fraccional de sodio (FENa) son los parámetros más útiles, siempre y cuando el paciente no esté bajo los efectos de diuréticos. En situaciones de IRA por hipoperfusión, la indemnidad inicial del parénquima renal permite la respuesta apropiada del riñón, que consiste en una conservación de agua y sal (Na), lo que dará lugar a una orina concentrada, pobre en electrolitos, urea y creatinina. No obstante, hay que tener en cuenta que parámetros que sugieren IRA por hipoperfusión, también se pueden encontrar en la glomerulonefritis, en las fases iniciales de la obstrucción urinaria, en la nefropatía por contraste y en diferentes patologías caracterizadas por vasoconstricción renal intensa (rabdomiólisis, sepsis, hemólisis y síndrome hepatorrenal). Por el contrario, parámetros de IRA intrínseca pueden observarse en casos de IRA por hipoperfusión en ancianos, en casos de ERC previa o en pacientes tratados con diuréticos. Entre los índices más útiles para el diagnóstico diferencial, se encuentran la FENa y el índice de fallo renal, con una especificidad y sensibilidad del 90%, en ausencia de ERC previa o tratamiento con diuréticos [42]. Se ha propuesto la FE de urea como sustituto de la FENa para pacientes bajo tratamiento con diuréticos, aunque su eficacia diagnóstica no es muy buena.
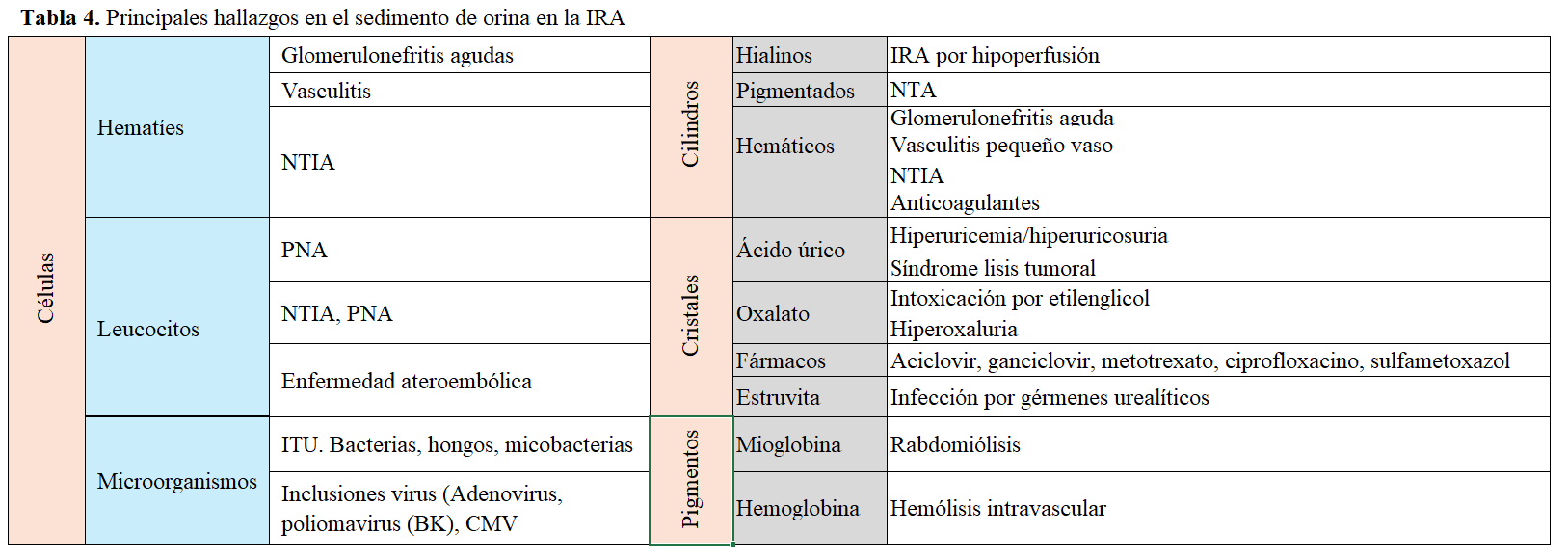
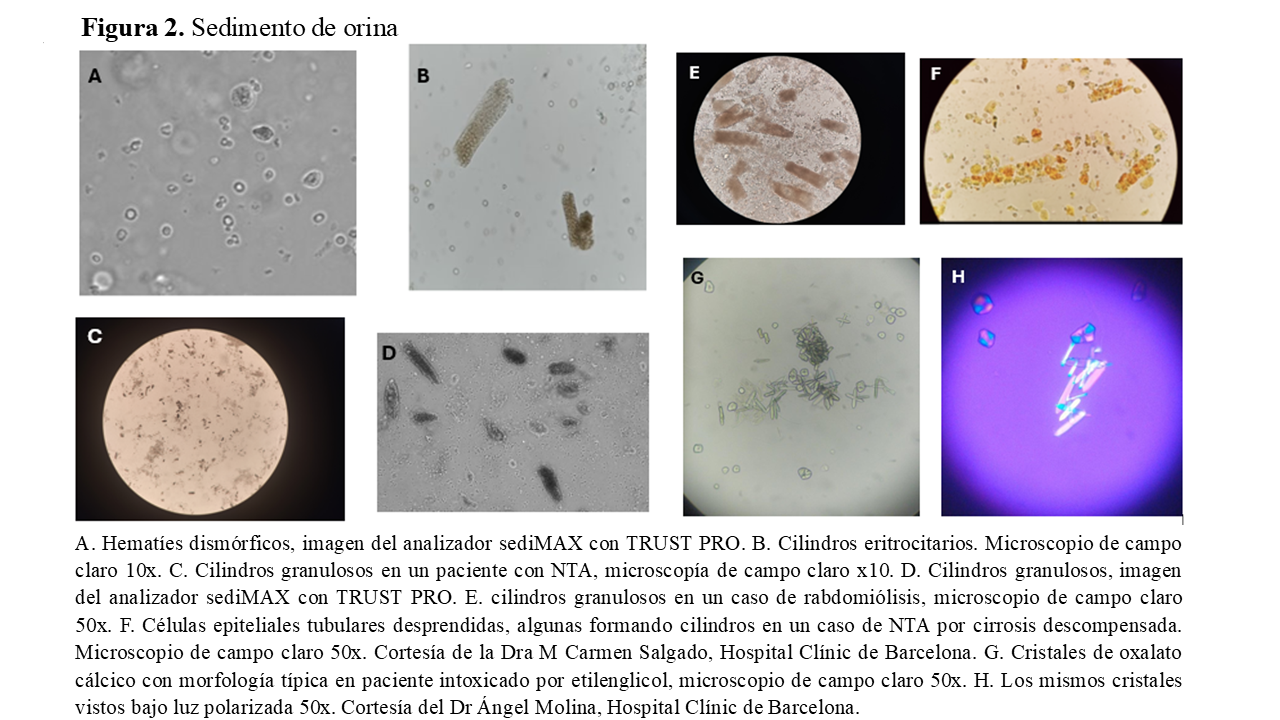
3. El examen del sedimento de orina es muy importante. En él, debe buscarse la presencia de células, cilindros y cristales, (Tabla 4) [43][44]. En la IRA por hipoperfusión, el sedimento suele ser normal o bien contener cilindros hialinos. En la NTA isquémica o nefrotóxica se observan, hasta en un 80% de los casos, cilindros granulosos de color marrón o cilindros de células epiteliales desprendidas. Se pueden encontrar células epiteliales tubulares aisladas y puede haber microhematuria. Se ha desarrollado una escala basada en el número de cilindros granulosos y en el número de células epiteliales desprendidas, que tiene una fiabilidad alta en predecir IRA intrínseca [45]. Los cilindros hemáticos son patognomónicos de enfermedad glomerular aguda y a menudo, se asocian con la presencia de hematíes dismórficos. En la nefritis intersticial se suelen observar cilindros leucocitarios y granulosos no pigmentados. Aunque la presencia de eosinofiluria sugiere nefritis intersticial inmunoalérgica, también se puede hallar en la enfermedad ateroembólica y, en menor cuantía (inferior al 5%), en las glomerulonefritis proliferativas, pielonefritis, cistitis y prostatitis. En cuanto a los cristales, los de ácido úrico sugieren IRA por hipoperfusión y nefropatía por uratos. Los cristales de oxalatos y de hipurato sugieren intoxicación por etilenglicol. También puede haber cristaluria por fármacos. La hemoglobinuria y la mioglobinuria orientan hacia estados de hemólisis o rabdomiólisis. A pesar de la importancia del sedimento en el estudio de la IRA, publicaciones recientes reportan, como problema, una gran variabilidad interobservador [46]. En la (Figura 2) se recogen algunas imágenes representativas de sedimentos de orina correspondientes a pacientes con IRA.
4.3. Test funcionales (prueba de respuesta a furosemida)
La respuesta diurética a la furosemida es una medida de la integridad de los túbulos renales. En esto se basa la prueba de respuesta a la furosemida (PRF), que consiste en la administración de 1 mg/kg de furosemida, por vía intravenosa, en pacientes sin tratamiento diurético previo o de 1,5 mg/kg en pacientes expuestos a furosemida en los siete días anteriores, monitorizando la diuresis a las 2h. Una diuresis < 200 ml predice la progresión de la IRA a estadio 3 o la necesidad de terapia de sustitución renal (TSR) con una elevada sensibilidad y especificidad [47][48].
4.4. Biomarcadores no convencionales
En los últimos años, han surgido diversos biomarcadores de lesión estructural del riñón, que complementan la información funcional que aporta la Crs. Estos biomarcadores se han evaluado para la predicción, prevención y pronóstico de la IRA como se comenta en el apartado 8.
4.5. Pruebas de imagen
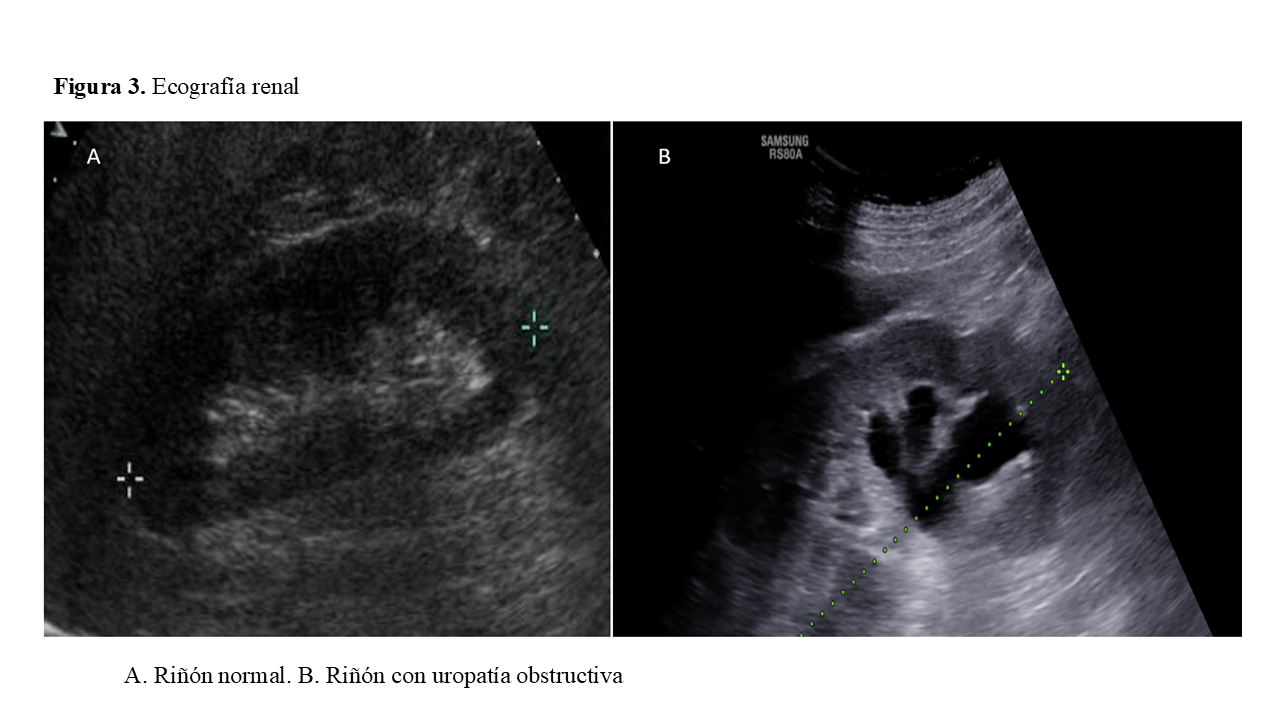
La ecografía renal está encaminada, por un lado, a descartar una causa obstructiva de vías urinarias en pacientes con factores de riesgo y por otro, a evaluar el tamaño y la morfología renal (Figura 3). Hay que recordar respecto a la primera indicación, que algunos casos de IRA obstructiva pueden cursar sin dilatación de vías (fibrosis retroperitoneal, infiltración por neoplasias). En cuanto al tamaño renal, unos riñones pequeños delatan una ERC avanzada (o IRA sobre ERC avanzada) y múltiples quistes con riñones grandes serán indicativos de una poliquistosis renal. La ecografía renal a pie de cama se ha demostrado útil como primera evaluación de una posible obstrucción de vías. Además, permite evaluar la perfusión renal y la congestión como evaluación inicial y realizar un seguimiento de la respuesta a diuréticos. En caso de IRA parenquimatosa puede haber aumento de la ecogenicidad renal, aunque es un signo inespecífico. Una ecografía doppler nos permite verificar la perfusión renal y descartar una obstrucción de arteria o venal renal.
En algunas ocasiones, se precisará afinar más en las pruebas de imagen con la realización de una uroRM para detectar el nivel de una obstrucción urinaria o un angio TC, una gammagrafía renal o una angiografía, para confirmar la sospecha de estenosis de arteria renal.
4.6. Biopsia renal
Dado que la mayoría de los episodios de IRA hospitalaria son producidos por NTA o por sepsis y que no tienen un tratamiento específico además del etiológico, la biopsia renal no se suele realizar en este contexto. De hecho, el presunto diagnóstico de IRA por NTA o por sepsis es por exclusión de otras causas. Sin embargo, en los pacientes con IRA atribuida a NTA que tenga un patrón atípico, como puede ser una duración superior a 2-3 semanas, sin una causa clara que lo justifique, sí podría estar indicada. Por otro lado, es crucial realizarla a tiempo en los casos en los que se sospeche una glomerulonefritis u otra enfermedad renal primaria, ya que el tratamiento precoz puede prevenir o retrasar la fibrosis renal. De ahí, la importancia de mantener un alto índice de sospecha de IRA diferente a la NTA e indicar las pruebas necesarias (sedimento de orina, serologías, proteínas, etc) para su diagnóstico. La biopsia renal también estaría indicada cuando la causa de la IRA no esté clara, habiéndose descartado hipoperfusión y causas obstructivas de vías o de vasos principales.
En general, la biopsia renal es un procedimiento seguro, con una incidencia de complicaciones mayores (básicamente sangrado) entre el 2 y el 8%, siendo la necesidad de realizar una embolización en sólo un 0,3% de los procedimientos. Sin embargo, esta incidencia es más elevada en pacientes con IRA, al existir factores de riesgo concomitantes, como la uremia y la anemia [49][50]. Así, en la decisión de practicar una biopsia renal en la IRA, se ha de balancear el riesgo de complicaciones frente al beneficio de obtener una información que determine un tratamiento diferente.
5. Complicaciones de la IRA.
La IRA puede condicionar complicaciones a corto y a largo plazo. Entre las primeras, destacan: 1. Sobrecarga de volumen (responsable de gran parte de las manifestaciones sistémicas de la IRA), 2. Acumulación de toxinas urémicas, 3. Alteraciones electrolíticas (hiperpotasemia, hiponatremia, fundamentalmente) y del equilibrio ácidobase (acidosis metabólica), 4. Desregulación del sistema inmune, con mayor riesgo de infección y 5. Alteración de la farmacocinética de los fármacos.
La IRA puede asociarse a disfunción de otros órganos [51][52]. En ocasiones, este hecho acontece en el contexto de una patología que produce fracaso multiorgánico como puede ser el caso de la sepsis. En otras ocasiones, es la propia IRA la que, de forma secundaria, produce esta disfunción multiorgánica. Ya sea a través de un mecanismo proinflamatorio, mediante alteraciones metabólicas (uremia, acidosis), hemodinámicas (sobrecarga de volumen y aumento de la permeabilidad vascular, fundamentalmente) o por activación neurohormonal (SRAA, SNS, ADH), la IRA puede producir lesiones de órganos a distancia. Así, puede verse afectado el corazón, con aparición de arritmias, o insuficiencia cardíaca, el pulmón (edema agudo de pulmón), el hígado, con resultado de congestión hepática y alteración del metabolismo de fármacos, el cerebro (encefalopatía urémica) o el intestino, con desarrollo de congestión intestinal, disbiosis y traslocación intestinal. Todas estas manifestaciones sistémicas, contribuyen a la morbimortalidad asociada a la IRA [51].
Junto a estas complicaciones que se producen de forma más inmediata, existen otras que se manifiestan a largo plazo y que contribuyen a condicionar su mal pronóstico: evolución a enfermedad renal crónica, incluida la necesidad de entrar en programa de diálisis, el desarrollo de patología cardiovascular y mayor mortalidad [51][52]. Todas ellas serán tratadas, posteriormente, en el apartado 9, Evolución y pronóstico de la IRA.
6. Tratamiento médico de la IRA:
El ajuste del balance de fluidos es un aspecto crítico ya que se ha demostrado que un exceso de volemia, más allá de la fase de resucitación de una hipovolemia intravascular, se asocia a fracaso multiorgánico y a mayor mortalidad [53]. Las guías KDIGO recomiendan el uso de diuréticos en la IRA, exclusivamente, para la regulación del balance de fluidos [1]. La monitorización de la volemia, con parámetros dinámicos y con ecografía a pie de cama, ha demostrado que mejora su manejo, sobre todo en aquellos pacientes con insuficiencia cardiaca.
La hiperpotasemia es, junto a la hipervolemia, la complicación potencialmente más grave de la IRA. Si bien los niveles de potasio sérico previos a un episodio de hiperkalemia no predicen mayor mortalidad, sí que lo pueden hacer después del mismo [54]. El tratamiento activo se suele iniciar con niveles de potasio ≥ 6,5 mmol/L, asociados a cambios electrocardiográficos. Se comienza, habitualmente, con gluconato cálcico, como estabilizador de las membrana miocárdica e insulina-glucosa y/o agonistas beta2, como promotores de la entrada de potasio a las células. El bicarbonato, otro potenciador de la entrada de potasio a las células, se reserva para los pacientes con acidosis metabólica. La eliminación de potasio del organismo se realiza con diuréticos, con resinas o diálisis [55]. El uso de sulfonato de poliestireno cálcico (resincalcio®) en pacientes críticos o agudos está limitado por sus frecuentes efectos secundarios digestivos. Las nuevas resinas como el ciclosilicato de sodio y zirconio y el patirómero se han mostrado eficaces en reducir de forma rápida y segura las cifras de potasio en pacientes agudos, sobre todo el primero, con mejor tolerancia y mayor seguridad que el resincalcio [56].
La acidosis metabólica es muy frecuente en la IRA y se asocia a mayor morbi- mortalidad. Un pH sérico < 7,1 condiciona inestabilidad hemodinámica por depresión miocárdica, vasodilatación arterial y respuesta alterada a drogas vasopresoras. La propia insuficiencia renal es la causa principal de la acidosis, aunque con frecuencia se asocia a hiperlactacidemia. Diversas patologías como la cetoacidosis o intoxicaciones causan acidosis metabólica que acaban en IRA. En general, se debe tratar la causa que produce la acidosis ya que la administración indiscriminada de bicarbonato sódico no aumenta la supervivencia en la acidosis láctica o en la cetoacidosis y no está exenta de efectos adversos, como hipervolemia, hiperosmolalidad o acidosis intracelular [57]. Así, en la IRA, el uso de bicarbonato para corregir la acidosis metabólica, fundamentalmente en los casos de anion gap aumentado, es controvertido y requiere más estudios.
La hipocalcemia es frecuente en la IRA. Diversos mecanismos intervienen en su aparición, entre los que se incluyen: una reducción en la síntesis de 1,25-vitamina D, la hiperfosfatemia y la reducción de la reabsorción renal de calcio. Dados los potenciales efectos de la hipocalcemia sobre la hemodinámica y la predisposición a la aparición de arritmias, se recomienda su corrección en caso de asociarse a manifestaciones clínicas (QT largo en el ECG, síntomas musculares).
La hiperfosfatemia en la IRA tiene lugar por reducción de la excreción renal, aunque también puede provenir de la liberación intracelular en los síndromes de lisis tumoral, rabdomiólisis o más raramente, en la acidosis láctica y la cetoacidosis. La hiperfosfatemia en la IRA se asocia a mayor morbimortalidad [58]. En pacientes sin otros criterios de diálisis, la hiperfosfatemia se puede corregir con captores de fósforo y dieta. Por el contrario, en pacientes con TRS continuo, la hipofosfatemia se ha asociado a mayor morbilidad y estancia hospitalaria [59].
La hiperuricemia, aunque frecuente en la IRA, sólo plantea tratamiento o profilaxis en el síndrome de lisis tumoral. Para ello, se puede recurrir al uso de alopurinol, febuxostat o rasburicasa según el riesgo [60]. La rasburicasa, enzima que metaboliza el ácido úrico a un metabolito soluble es de efecto inmediato y se reserva a los pacientes de mayor riesgo.
En cuanto a los aspectos de nutrición de los pacientes con IRA, la KDIGO recomienda un aporte calórico de 20-30 kcal/Kg/día. Hay que evitar la restricción de proteínas con el fin de retrasar la diálisis y aportar 0,8-1,0 g/kg/día en pacientes no catabólicos y 1,0-1,5 g/kg/día en pacientes catabólicos o con tratamiento renal sustitutivo (TRS), hasta un máximo de 1,7 g/kg/día en pacientes con TSR continuo e hipercatabolismo. Se administrará, con preferencia, por vía enteral para preservar las funciones digestivas. Las calorías deberían provenir de carbohidratos 3-5 g/kg/d y lípidos 0,8-1,0 g/kg/d. La recomendación es aportar el 80% del objetivo en las primeras 48-72h.
7. Tratamiento renal sustitutivo en la IRA.
7.1. Inicio del tratamiento renal sustitutivo en la IRA
Cuando todas las medidas anteriores resultan insuficientes para un adecuado manejo del paciente con IRA, debemos plantear el inicio del tratamiento renal sustitutivo (TRS). Existe controversia sobre cuando es el momento óptimo para iniciar la técnica y, sobre todo, si éste tiene algún impacto en el pronóstico del paciente.
La decisión de iniciar diálisis está clara cuando existe alguna de las siguientes indicaciones urgentes:
1. Oliguria/anuria que no responda al tratamiento médico habitual: expansión de volumen, diuréticos, drogas vasoactivas, agentes inotrópicos.
2. Edema agudo de pulmón que no responda a tratamiento diurético
3. Hiperpotasemia > 6,5 mmol/L y acidosis metabólica con pH <7,2, refractarias a tratamiento médico
4. Retención de productos nitrogenados, con complicaciones urémicas secundarias: encefalopatía, pericarditis, diátesis hemorrágica o derrame pericárdico, fundamentalmente.
Por el contrario, en ausencia de estas situaciones, no existen evidencias que permitan establecer una recomendación definitiva sobre cuándo iniciar el TRS [61][62]. En el ámbito del paciente crítico, es tal el interés despertado en este sentido, que, en la última década, se han publicado cinco importantes ensayos clínicos dirigidos a esclarecer este hecho. En estos estudios, el inicio precoz se define como TRS dentro de las primeras 6-12 h tras detectar una IRA estadio 2-3. Sólo el ELAIN, estudio unicéntrico realizado en Alemania, concluía que el inicio precoz de la técnica se asociaba a una supervivencia a los 90 días de seguimiento significativamente superior con respecto al inicio retrasado [63]. Los estudios AKIKI, IDEAL-ICU y el STARRT-AKI no encontraron diferencias [64][65][66]. Además, todos pusieron en evidencia un hecho trascendente y es que había un porcentaje elevado de pacientes que habían sido randomizados a la rama de inicio tardío y que finalmente no precisaban TRS. Más recientemente, el AKIKI 2 concluye que en pacientes críticos con IRA estadio 3 de KDIGO, ante una oliguria mayor de 72 horas y un nitrógeno ureico mayor de 140 mg/dl, el retrasar el inicio de diálisis se puede asociar con mayor mortalidad a los 60 días [67]. En 2022, se publica un metaanálisis que incluye 5193 pacientes críticos con IRA y que tiene como objetivo primario evaluar la mortalidad a los 28 días. Se concluye que el inicio precoz del TRS no supone un beneficio ni en cuanto a supervivencia del paciente ni en cuanto a recuperación de la función renal e incrementa el riesgo de eventos adversos asociados a la técnica [68]. En una revisión de la Cochrane publicada también en 2022, los autores concluyen, con un nivel de evidencia bajo a moderado, que el inicio precoz del TRS en el paciente con IRA, no supone ningún beneficio en cuanto a la supervivencia. Puede tener un ligero beneficio en la recuperación de la función renal y probablemente, reduzca la estancia media en UCI, así como la estancia hospitalaria, pero aumenta el riesgo de eventos adversos [69].
En resumen, debemos individualizar, utilizando criterios clínicos, hemodinámicos y bioquímicos, poniendo en una balanza los beneficios derivados de un inicio precoz de la técnica: un mejor control metabólico, nutricional, hemodinámico y de volumen, frente al riesgo de precipitarnos y someter al paciente a un tratamiento innecesario, no exento de complicaciones [62].
7.2. Modalidades del tratamiento renal sustitutivo en la IRA
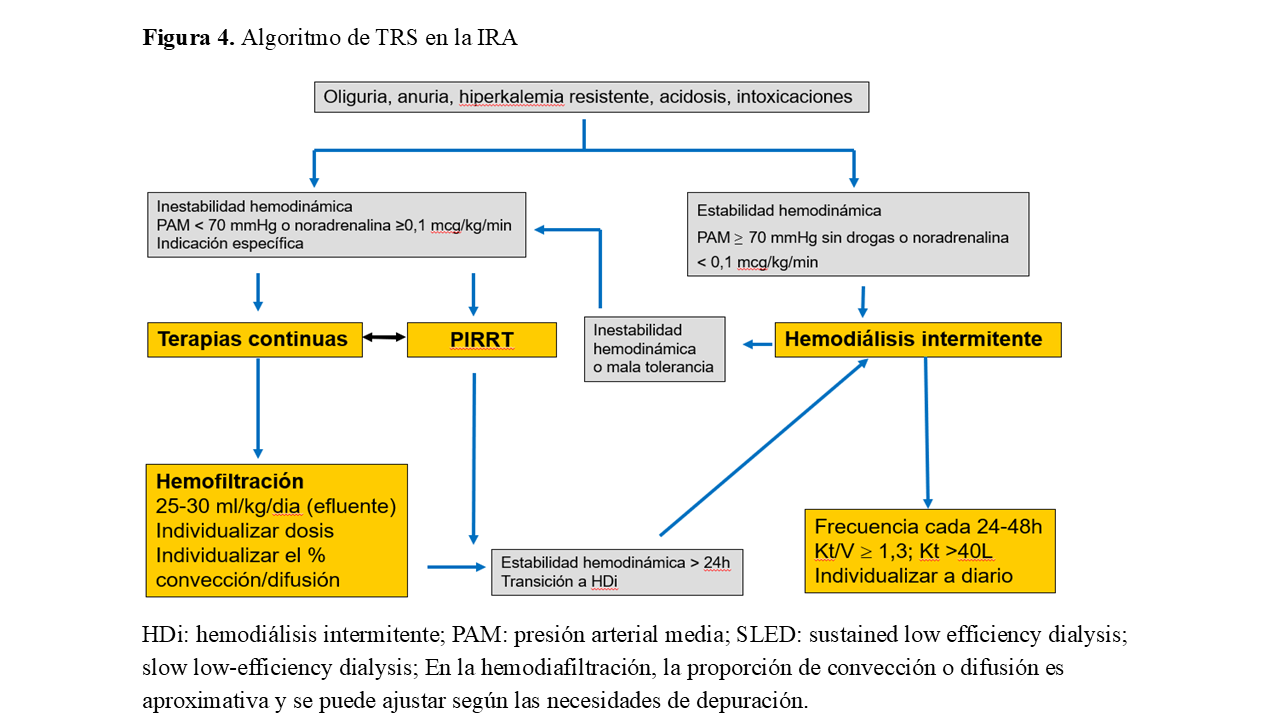
No existe un TRS ideal para todos los pacientes con IRA. Todas las técnicas de diálisis tienen ventajas e inconvenientes, siendo importante individualizar en cada caso. La elección del TRS dependerá de la situación clínica y hemodinámica del paciente, de la disponibilidad de técnicas en cada hospital y de la experiencia del médico con cada modalidad terapéutica [70]. En el paciente hemodinámicamente estable, sin lugar a duda, la terapia de elección será la hemodiálisis intermitente (HDI) con una frecuencia variable según la situación clínica del mismo. En España, el uso de la diálisis peritoneal en el paciente con IRA es anecdótico. Sin embargo, puede ser una técnica válida. De hecho, un reciente ensayo clínico mostró resultados comparables, respecto a mortalidad, con la HDI [71]. En el paciente crítico, hemodinámicamente inestable, el TRS continuo es, por lo general, mejor tolerado. La menor tasa de ultrafiltración y la eliminación más lenta y continuada de solutos, sin grandes fluctuaciones en la osmolaridad, se asocia a un mejor relleno vascular, con menor riesgo de hipovolemia y una mejor tolerancia hemodinámica. Además, el TRS continuo tiene un efecto positivo en la microcirculación, debido a la eliminación preferente de líquido del espacio intersticial, con mejoría respiratoria secundaria y un potencial papel inmunomodulador sobre la respuesta inflamatoria en la sepsis. En cuanto a la recuperación de la función renal o la supervivencia del paciente con IRA, no se ha conseguido demostrar la superioridad de una técnica respecto a la otra [72][73]. La guía KDIGO de manejo de la IRA sugiere que el TRS continuo puede ser preferible a la HDI en dos grupos de población: pacientes neurocríticos, con lesión cerebral aguda, edema cerebral generalizado y otras causas de aumento de presión intracraneal y en pacientes hemodinámicamente inestables (PAM < 70 mmHg, con necesidad de soporte vasoactivo y/o dosis de noradrenalina ≥ 0,1 mcg/kg/min). En el resto de los casos, incluidos pacientes críticos hemodinámicamente estables, la HDI será la técnica de elección [1][4] (Figura 4).
Cuando se recurra a la HDI, hay que poner el máximo empeño en evitar la hipotensión, dado que ésta se asocia a mayor mortalidad y es el principal factor determinante del retraso de la recuperación de la función renal. Para ello, disponemos de diversas estrategias: a) Conexión isovolémica (simultánea) de las líneas, con circuito cebado con salino; b) Evaluar a diario la volemia, aumentando la frecuencia de las diálisis si la ultrafiltración requerida pone en riesgo la estabilidad hemodinámica; c) Concentración de sodio alta en el líquido de diálisis (LD) (conductividad total ≥14 mS/cm); d) Usar perfiles de sodio (descendentes a lo largo de la sesión) y de ultrafiltración; e) Concentración de calcio en el LD de 3 mEq/l y de potasio ≥ 2 mEq/l; f) Temperatura baja del LD (<37ºC) y g) Limitación del flujo de sangre en los pacientes de riesgo [74].
Los monitores empleados para realizar HDI en pacientes con IRA son los mismos que para los pacientes en programa crónico de diálisis. La diferencia radica en la prescripción de la diálisis, que, en el caso de los pacientes agudos, debe individualizarse en cada sesión para maximizar, en lo posible, la tolerancia hemodinámica. Debido a que en la mayoría de Unidades de Cuidados Intensivos, no se dispone de agua ultrapura, es razonable recomendar que los monitores dispongan de un filtro de endotoxinas, aunque no hay evidencia sólida para recomendarlo. Se deberán utilizar dializadores de alto flujo con membranas sintéticas, biocompatibles, evitando las celulósicas no modificadas [62].
Existen técnicas de diálisis intermedias entre la HDI y las técnicas continuas, son las llamadas técnicas híbridas o PIRRT (terapia de reemplazo renal intermitente prolongada), que incluyen distintas nomenclaturas: diálisis extendida (ED), diálisis diaria extendida (EDD), hemodiálisis lenta de baja eficiencia (SLED), hemodiálisis de alto flujo extendida (E-HDF). Su uso estaría indicado en tres escenarios: a) como sustitución al TRS continuo; b) como paso intermedio en el “destete” desde un TRS continuo a una HDI convencional y c) como alternativa a la HDI convencional. Lo más habitual es realizarlas con monitores de HDI, aunque también se pueden utilizar los monitores de terapias continuas.
La diferencia fundamental de las técnicas híbridas con la HDI convencional está en la duración, dado que se trata de sesiones de 8-12 horas. Los flujos son menores que en la HDI convencional: flujos de sangre de 150 a 200 ml/min y de LD de hasta 200 ml/min. Con estos flujos y una duración prolongada, que permite una ultrafiltración horaria más modesta, se consigue que la tolerancia hemodinámica sea mejor que con la HDI convencional. La frecuencia óptima sería de 4 a 7 sesiones por semana [75]. Comparadas con el TRS continuo, no existen diferencias en la estabilidad hemodinámica ni en la mortalidad [75] y, además, ofrecen ciertas ventajas que radican en una mayor disponibilidad del paciente para la movilización, terapia física, o desplazamientos para la realización de pruebas fuera de la UCI, sobre todo si la técnica mixta se realiza por las noches, como es de preferencia en muchos centros. Otras ventajas de las PIRRT serían la menor exposición a la anticoagulación y el menor coste económico, independientemente del personal necesario. Teniendo en cuenta lo anterior, la National Kidney Foundation KDOQI la recomienda como una alternativa válida a las terapias continuas [4].
De cualquier modo, las tres técnicas deben ser consideradas complementarias y nunca excluyentes en el manejo del paciente crítico con IRA (Figura 4).
7.3. Dosis de diálisis en pacientes con IRA
Se desconoce cuál es la dosis de diálisis más apropiada que permita reducir la mortalidad del paciente con IRA. La idea general que se tiene al respecto es que esta dosis no debe ser fija, sino que se deberá ajustar a las necesidades del paciente, en cada momento de su evolución, para mantener un medio interno y un balance de fluidos óptimos, es decir, se deberá individualizar [62].
Tras los resultados de los ensayos clínicos ATN y RENAL, se aprendió que existe una dosis de diálisis por encima de la cual no se observan beneficios en cuanto a supervivencia del paciente y aumenta el riesgo de efectos secundarios [76][77]. Así, en la actualidad, en TRS continuo, se recomienda una dosis de diálisis de 25–30 ml/kg/h y en HDI, se recomiendan un KT/V semanal de 3,9 [78]. Si se dispone de monitores con biosensores de dialisancia iónica, se recomienda realizar el seguimiento de la dosis de diálisis por el KT ajustado a la superficie corporal [79]. En las técnicas híbridas, la dosis de diálisis no está bien establecida. Al igual que en la HDI convencional, se basa en la cinética de la urea, con los inconvenientes que tiene su aplicación en el paciente crítico. El KT/V por sesión dependerá de la frecuencia. Así, para una frecuencia de 6 sesiones por semana, el KT/V monocompartimental recomendado por sesión sería de 0,9 para lograr un KT/V estándar semanal de 3,5 [80].
7.4. Anticoagulación
La elección de la anticoagulación en el paciente con IRA se debe individualizar. En las técnicas intermitentes, la anticoagulación con heparina sódica, no fraccionada, predomina como método de elección, seguida de la heparina de bajo peso molecular. En los casos en los que exista contraindicación para su uso, es relativamente frecuente realizar las sesiones sin anticoagulación y con éxito. Respecto a las técnicas continuas, la necesidad de anticoagular al paciente durante tiempos prolongados, para prevenir la coagulación del circuito extracorpóreo (CEC), constituye uno de sus principales problemas. La heparina sódica, prefiltro, a dosis de 5-10 U/kg hora, sigue siendo un método de anticoagulación válido. Sin embargo, puede asociarse a complicaciones potencialmente graves como la hemorragia y la trombocitopenia inducida por heparina. Por este motivo, hace algunos años, se desarrolló un método de anticoagulación regional con citrato (ARC), que sólo afecta al CEC. De hecho, a partir de la recomendación de la guía KDIGO de 2012, que lo establece como el método de anticoagulación de elección, su uso se ha ido generalizando [1] [81]. La base de la recomendación de la ARC es su eficacia, pues alarga la vida de los filtros y su seguridad, ya que, comparada con la heparina, reduce el riesgo de sangrado. De esta manera, la ARC se posiciona como una terapia recomendada en el paciente crítico con alto riesgo de sangrado y con necesidad de TRS continuo. En caso de existir riesgo de sangrado y estar contraindicada la ARC, se puede proceder a realizar la terapia sin anticoagulación [82].
7.5. Finalización del tratamiento renal sustitutivo en el paciente con IRA
Existen pocas evidencias sobre cuando finalizar un TRS en el paciente con IRA. En principio, se debería retirar cuando ya no se requiera, bien porque la función renal esté en fase de recuperación y permita una depuración de solutos y unos balances suficientes para un adecuado manejo del paciente o bien porque continuar con ella no esté acorde a los objetivos terapéuticos generales. En el primero de los casos, la decisión de suspender un TRS es importante, ya que la necesidad de reiniciarla precozmente, en el espacio de una semana, se ha asociado a un aumento de la mortalidad. Sin embargo, es difícil discernir si existe una relación directa de causalidad o bien, es un marcador de enfermedad más grave [83]. La dificultad viene dada por el parámetro clínico o analítico que determine esta decisión. Aunque la evidencia proviene de estudios retrospectivos u observacionales, una diuresis espontánea (en ausencia de diuréticos) igual o superior a 430 ml/día predice una retirada exitosa del TRS con un área bajo la curva de 0,845 (83). En cuanto a parámetros depurativos, Fröhlich S. et al observaron que un aclaramiento de creatinina de 2 horas mayor de 23 ml/min, realizado dentro de las 12 horas previas a la retirada del TRS continuo, predice la no necesidad de TRS en los días siguientes, con un valor predictivo positivo de 88,8% [84]. Otros autores proponen diuresis espontánea superior a 500 ml/día o superior a 2500 ml/día en presencia de diuréticos y un aclaramiento de creatinina superior a 15 ml/min medido en orina de 24 horas [85]. La prueba de respuesta a la furosemida, descrita en el apartado 4.3, resulta de gran utilidad para retirar con éxito un TRS [47][48][86].
Está claro que faltan más estudios para determinar qué parámetros deben guiar la suspensión del TRS, pero los datos apuntados más arriba pueden servir como orientación mientras no se disponga de más evidencia. En lo que sí hay consenso, es en que no se deben administrar diuréticos para prevenir o acelerar la recuperación de la función renal ni para tratar la IRA, estando sólo indicados para el tratamiento de la sobrecarga hídrica. Falta evidencia sobre si el uso de diuréticos puede reducir la duración y la frecuencia del TSR [4].
8. Predicción y prevención de la IRA.
La identificación precoz de los pacientes en riesgo de desarrollar una IRA constituye un desafío clínico relevante. Hasta la actualidad, la determinación de creatinina sérica había sido la herramienta principal para su detección. No obstante, como se comenta en el apartado 1, este marcador presenta limitaciones importantes, dado que su elevación puede ser tardía y su concentración está influida por factores como la masa muscular, el volumen de distribución o interferencias analíticas, como ocurre en pacientes con hiperbilirrubinemia [87].
En los últimos años, se han identificado diversos biomarcadores séricos y urinarios con potencial utilidad para la detección temprana del daño renal. Estos biomarcadores están implicados en diferentes procesos fisiopatológicos relacionados con la lesión tubular, la inflamación, la integridad glomerular o el estrés celular [88]. Entre los más estudiados se encuentran:
• KIM-1 (Kidney Injury Molecule-1)
• NGAL (Neutrophil Gelatinase-Associated Lipocalin)
• L-FABP (Liver-type Fatty Acid Binding Protein)
• Cistatina C
• Hemojuvelina
• NAG (N-acetil-β-D-glucosaminidasa)
• Netrina-1
• GGT (Gamma-glutamil transferasa)
• GST (Glutatión-S-transferasa)
• TIMP-2 (Tissue Inhibitor of Metalloproteinases-2)
• IGFBP7 (Insulin-like Growth Factor Binding Protein 7)
La descripción de todos ellos sobrepasa el objetivo de este capítulo, por lo que nos centraremos en los 4 que han producido más impacto y que se miden en orina. En primer lugar, IGFBP7 (insulin-like growth factor-binding protein 7) y TIMP-2 (tissue inhibitor of metlloproteinase-2) se analizan de forma combinada en un parámetro conocido como Nephrocheck©, aprobado por la FDA en 2012 como herramientas para la estratificación del riesgo de IRA, especialmente en pacientes críticos. Es un marcador de arresto del ciclo celular en los túbulos renales y se ha demostrado eficaz en la predicción de IRA moderada y severa [89]. Sin embargo, su aplicación en la práctica clínica habitual aún no se ha generalizado, probablemente, debido a la heterogeneidad de los resultados obtenidos en distintos estudios y a la falta de consenso sobre los puntos de corte más adecuados. A pesar de ello, existen estudios positivos como el estudio PrevAKI, que usó el TIMP-2*IGFBP7 para discriminar a los pacientes de alto riesgo, a quienes se les implementaron las medidas recomendadas por la KDIGO, presentado menos eventos de IRA que el grupo control [90].
Otro marcador es el NGAL (neutrophil gelatinase-associated lipocalin), que se sobreexpresa en los túbulos después de un daño isquémico y es capaz de incrementarse de forma precoz en la IRA [91]. Además, se ha mostrado útil en el diagnóstico diferencial de la IRA en el paciente con cirrosis hepática, discriminando entre síndrome hepatorrenal, tributario de tratamiento con terlipresina y la necrosis tubular aguda, de manejo conservador [92]. La capacidad predictiva en cuanto a evolución de estos y otros biomarcadores ha motivado la propuesta de la ADQI de subdividir cada estadio de IRA en marcador (+) y marcador (-) dada la diferencia pronóstica que conllevan [93]. CCL14 (C-C motif chemokine ligand 14) se ha mostrado útil como marcador de IRA estadio 3 persistente (más de 72h) [94]. Finalmente, la CXCL9 (chemokine C-X-C motif ligand 9) es altamente sugestiva de nefritis intersticial aguda [95].
En los últimos años, se han diseñado modelos de predicción basados en la Inteligencia Artificial y el aprendizaje automático (Machine Learning), dirigidos a identificar a los pacientes con alto riesgo de desarrollar IRA y una vez identificados, llevar a cabo una intervención temprana que permita prevenir su aparición, mejorar su pronóstico y reducir costes. Hasta la actualidad, la experiencia publicada al respecto no muestra un impacto en la prevención de la IRA ni en una disminución de la mortalidad a corto plazo o en la necesidad de tratamiento sustitutivo, pero sí que parece haber un beneficio en cuanto al manejo clínico, acortando la estancia hospitalaria [96].
La guía KDIGO, en 2012, recomendó la implementación de estrategias orientadas a la prevención y atenuación de los episodios de IRA. Dentro de estas medidas se encuentran el correcto control del volumen y el control hemodinámico, manteniendo una presión arterial media superior a 65 mmHg [1]. También es importante monitorizar la reposición hídrica para evitar la hiperhidratación [97]. Las soluciones balanceadas parecen ser las más seguras, sobre todo en aquellas situaciones en las que se requiera el uso de volúmenes superiores a 2 litros. En estos casos, las soluciones salinas aumentan el riesgo de IRA a consecuencia de la acidosis hiperclorémica [98]. En situaciones de sepsis, el uso de coloides, a excepción de la albúmina, presenta un aumento de IRA con necesidad de hemodiálisis, así como de mortalidad [99]. En todo caso, se deberá evitar el uso de nefrotóxicos y llevar a cabo un manejo óptimo de la glucemia. En la actualidad, el uso de diuréticos no ha demostrado ser eficaz en la prevención ni en el tratamiento de la IRA, a no ser que se encuentre asociado a estados congestivos [100].
9. Evolución y pronóstico de la IRA.
Tras un episodio de IRA pueden contemplarse diversos escenarios:
1. Recuperación de la función renal: que puede ser completa cuando la creatinina retorna a su situación basal y parcial, si no alcanza este nivel [78]. De cualquier modo, hay que tener en cuenta que aun cuando la creatinina y el filtrado glomerular vuelvan a sus valores basales, puede haberse producido una reducción significativa en la reserva funcional renal, lo que expondrá al paciente a una mayor susceptibilidad a sufrir nuevos episodios de IRA [101]. La no recuperación de la función renal tiene implicaciones pronósticas, favoreciendo, entre otros eventos adversos, el desarrollo de una ERC.
2. Desarrollo de enfermedad renal crónica (ERC): diferentes factores relacionados con la IRA pueden favorecer la progresión a una ERC: a) severidad de la IRA y necesidad de diálisis para su manejo, b) ámbito en que se produce (intrahospitalario vs adquirido en la comunidad), c) etiología, d) duración (una IRA persistente, >48 horas, se asocia a mayor morbimortalidad) e) grado de recuperación de la función renal tras el episodio de IRA, f) recurrencia de la IRA, g) reserva funcional renal y h) edad y comorbilidad del paciente en el que se produce la IRA (fundamentalmente ERC preexistente, pero también HTA, DM o patología cardiovascular) [52][78][102].
Es importante destacar que el grado de proteinuria tras un episodio de IRA es una valiosa herramienta de estratificación del riesgo de progresión de enfermedad renal. El estudio ASSESS-AKI evidenció que valores más elevados de albuminuria, a los tres meses del alta, se asociaban a mayor riesgo de progresión a ERC [103].
3. Desarrollo de enfermedad cardiovascular: mayor riesgo de eventos cardíacos: cardiopatía isquémica, insuficiencia cardíaca, accidente cerebrovascular agudo [104].
4. Mortalidad: La mortalidad de la IRA es alta, en gran parte condicionada por las complicaciones, tanto a corto, como a largo plazo, ver apartado 5 [51][52]. Varía según las circunstancias en que acontece el episodio de IRA y sus características. En 2013, un metaanálisis aportaba una tasa de mortalidad global de un 23% [9]. Esta cifra aumenta con la severidad de la IRA, pudiendo alcanzar hasta un 50% en pacientes críticos con necesidad de tratamiento renal sustitutivo [105].
10. Seguimiento ambulatorio de la IRA.
No existe una pauta estandarizada sobre el seguimiento que debería realizarse al paciente que ha presentado una IRA. Sólo un pequeño porcentaje de los pacientes que la presentan son seguidos después del alta hospitalaria y, con frecuencia, se lleva a cabo un manejo inadecuado [106]. Tampoco hay un consenso sobre cuál es el momento óptimo para llevar a cabo este seguimiento ni durante cuánto tiempo realizarlo. La guía KDIGO de 2012 recomienda un seguimiento a los tres meses del alta para ver la evolución de la función renal: resolución de la IRA vs persistencia con progresión a ERC [1]. En las nuevas recomendaciones de KDIGO sobre controversias en IRA, publicadas en 2020, se sugiere que el seguimiento de la función renal sea más estrecho y precoz conforme mayor sea la duración y la gravedad de la IRA (fundamentalmente, en los casos que requieran TRS) [4].
Es importante identificar los factores de progresión a ERC, descritos en el apartado 9, para establecer el esquema de seguimiento más idóneo en cada paciente, porque no todas las personas que desarrollan una IRA tienen una mala evolución. En esta línea, el grupo de trabajo de FRA de la Sociedad Española de Nefrología (FRASEN) recomienda valorar, en el momento del alta hospitalaria, el grado de recuperación de la función renal mediante la determinación de la Crs, acompañada de la determinación del cociente albúmina/creatinina en orina y considerar, de forma individualizada, la realización del aclaramiento de creatinina medido en orina de 24 horas [62].
Hay que establecer las diferentes funciones que se deberán llevar a cabo durante el seguimiento y entre las que se incluyen:
1. Monitorizar la función renal y la proteinuria: la creatinina plasmática y el filtrado glomerular (FG) estimado por CKD-EPI, son los parámetros más utilizados. Sin embargo, tienen limitaciones, sobre todo en pacientes con ingresos prolongados y pérdida de masa muscular. En estos casos, podría ser de utilidad el uso de la cistatina [107]. En cada determinación se deberá monitorizar la albuminuria mediante el cociente albúmina/creatinina.
2. Implementar cuidados y medidas de prevención para evitar la recurrencia de nuevos episodios de IRA en la fase de ERA y el desarrollo de ERC, prestando especial interés al control de la hipertensión, la proteinuria, la diabetes mellitus y las enfermedades cardiovasculares [108].
3. Evitar el uso de fármacos nefrotóxicos (educar en nefroprotección) y propiciar el uso de fármacos nefroprotectores: iniciar o restablecer el tratamiento (en caso de que se hubiera suspendido durante el ingreso) de IECAS, ARA 2, antialdosterónicos, iSGLT2, que pueden ayudar a prevenir el desarrollo de una ERC [109][110].
Lo ideal sería que este seguimiento se llevara a cabo por un nefrólogo, fundamentalmente en casos de: a) IRA estadio 2 de KDIGO y duración mayor a 7 días, con historia previa de IRA o ERC o sin recuperación de la función renal al alta y b) todos los casos de IRA estadio 3 o que requieran diálisis, independientemente de que se haya producido o no, la recuperación de la función renal. Los casos más leves, con duración del episodio inferior a 7 días y con recuperación completa de función renal al alta, podrían ser remitidos a Atención Primaria para su seguimiento. De cualquier modo, siempre que sea posible, se debería intentar un seguimiento por un equipo multidisciplinar (nefrólogo, atención primaria, enfermería, farmacia, entre otros). Se ha propuesto que la atención multidisciplinar de la IRA tras el alta, puede mejorar la evolución de estos pacientes, ya sea a través de una mejor calidad de la atención, con monitorización más estrecha de la función renal, a través de una mayor educación del paciente en salud renal y/o, a través de la conciliación de la medicación [111].
Los pacientes que continúen necesitando diálisis en el momento del alta hospitalaria, deberán ser monitorizados durante las sesiones. Se deberá controlar, estrechamente, el estado hemodinámico y las variaciones del volumen intravascular durante la diálisis. Tasas de ultrafiltración más altas y más episodios de hipotensión intradiálisis, podrían interferir en la recuperación de la función renal. También se debería controlar periódicamente la diuresis residual [4][112].
En los pacientes con una alta probabilidad de recuperación de la función renal: TFG normal previamente al episodio de IRA, pacientes jóvenes con ERC, pero sin otras comorbilidades o pacientes con dependencia de diálisis menor de 30 días, sería adecuado mantener un seguimiento más estrecho durante al menos 90 días después del alta. En aquellos pacientes con baja probabilidad de recuperación: >75 años, con ERC avanzada o con comorbilidad grave (insuficiencia hepática o cardíaca descompensada) y con dependencia de diálisis después de 90 días, se sugiere considerarlos en situación de ERC terminal establecida y acelerar la implantación de un adecuado acceso vascular así como el estudio pretrasplante renal si fueran candidatos al mismo [113].
Referencias bibliográficas
1
.
National Kidney Foundation. KDIGO clinical [practice guideline foracute kidney injury [Internet]. Disponible a: https://kdigo.org/wp-content/uploads/ 2016/10/KDIGO-2012-AKI-Guideline-English.pdf
http://www.ncbi.nlm.nih.gov/pubmed/?term=pdf
2
.
Siew ED, Davenport A. The growth of acute kidney injury: a rising tide or just closer attention to detail? Kidney Int. 2015;87(1):46-61.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2015%3B87%281%29%3A46-61
3
.
Kashani K, Rosner MH, Ostermann M. Creatinine: From physiology to clinical application. Eur J Intern Med. 2020;72:9-14.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2020%3B72%3A9-14
4
.
Ostermann M, Bellomo R, Burdmann EA, Doi K, Endre ZH, Goldstein SL, et al. Controversies in acute kidney injury: conclusions from a Kidney Disease: Improving Global Outcomes (KDIGO) Conference. Kidney Int. 2020;98(2):294-309.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2020%3B98%282%29%3A294-309
5
.
Haase M, Devarajan P, Haase-Fielitz A, Bellomo R, Cruz DN, Wagener G, et al. The outcome of neutrophil gelatinase-associated lipocalin-positive subclinical acute kidney injury: a multicenter pooled analysis of prospective studies. J Am Coll Cardiol. 2011;57(17):1752-61.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2011%3B57%2817%29%3A1752-61
6
.
Lameire NH, Levin A, Kellum JA, Cheung M, Jadoul M, Winkelmayer WC, et al. Harmonizing acute and chronic kidney disease definition and classification: report of a Kidney Disease: Improving Global Outcomes (KDIGO) Consensus Conference. Kidney Int. 2021;100(3):516-26.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2021%3B100%283%29%3A516-26
7
.
James MT, Levey AS, Tonelli M, Tan Z, Barry R, Pannu N, et al. Incidence and Prognosis of Acute Kidney Diseases and Disorders Using an Integrated Approach to Laboratory Measurements in a Universal Health Care System. JAMA. 2019;2(4):e191795.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2019%3B2%284%29%3Ae191795
8
.
Hoste EAJ, Bagshaw SM, Bellomo R, Cely CM, Colman R, Cruz DN, et al. Epidemiology of acute kidney injury in critically ill patients: the multinational AKI-EPI study. Intensive Care Med. 2015;41(8):1411-23.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2015%3B41%288%29%3A1411-23
9
.
Susantitaphong P, Cruz DN, Cerda J, Abulfaraj M, Alqahtani F, Koulouridis I, et al. World incidence of AKI: a meta-analysis. CJASN. 2013;8(9):1482-93.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2013%3B8%289%29%3A1482-93
10
.
Bouchard J, Acharya A, Cerda J, Maccariello ER, Madarasu RC, Tolwani AJ, et al. A Prospective International Multicenter Study of AKI in the Intensive Care Unit. CJASN. 2015;10(8):1324-31.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2015%3B10%288%29%3A1324-31
11
.
Donaldson LH, Vlok R, Sakurai K, Burrows M, McDonald G, Venkatesh K, et al. Quantifying the Impact of Alternative Definitions of Sepsis-Associated Acute Kidney Injury on its Incidence and Outcomes: A Systematic Review and Meta-Analysis. Crit Care Med. 2024;52(8):1264-74.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2024%3B52%288%29%3A1264-74
12
.
Zarbock A, Nadim MK, Pickkers P, Gomez H, Bell S, Joannidis M, et al. Sepsis-associated acute kidney injury: consensus report of the 28th Acute Disease Quality Initiative workgroup. Nat Rev Nephrol. 2023;19(6):401-17.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2023%3B19%286%29%3A401-17
13
.
Stanski NL, Rodrigues CE, Strader M, Murray PT, Endre ZH, Bagshaw SM. Precision management of acute kidney injury in the intensive care unit: current state of the art. Intensive Care Med. 2023;49(9):1049-61.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2023%3B49%289%29%3A1049-61
14
.
Prowle JR, Forni LG, Bell M, Chew MS, Edwards M, Grams ME, et al. Postoperative acute kidney injury in adult non-cardiac surgery: joint consensus report of the Acute Disease Quality Initiative and PeriOperative Quality Initiative. Nat Rev Nephrol. 2021;17(9):605-18.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2021%3B17%289%29%3A605-18
15
.
Kellum JA, Prowle JR. Paradigms of acute kidney injury in the intensive care setting. Nat Rev Nephrol. 2018;14(4):217-30.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2018%3B14%284%29%3A217-30
16
.
Quintana E, Ibañez C, Perdomo J, Molina Andújar A, Poch E. Kidney injury in cardiopulmonary bypass. In: Cardiopulmonary Bypass Advances in Extracorporeal Life Support. Elsevier; 2022. p.699-721.
http://www.ncbi.nlm.nih.gov/pubmed/?term=699-721
17
.
Legrand M, Falcone J, Cholley B, Charbonneau H, Delaporte A, Lemoine A, et al. Continuation vs Discontinuation of Renin-Angiotensin System Inhibitors Before Major Noncardiac Surgery: The Stop-or-Not Randomized Clinical Trial. JAMA. 2024;332(12):970-8.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2024%3B332%2812%29%3A970-8
18
.
Dimitriadis K, Vakka A, Pyrpyris N, Apostolos A, Beneki E, Stathopoulou E, et al. Efficacy of Chronic Use of Sodium-Glucose Co-transporter 2 Inhibitors on the Prevention of Contrast-Induced Acute Kidney Injury in Patients with Type 2 Diabetes Mellitus Following Coronary Procedures: A Systematic Review and Meta-Analysis. Am J Cardiovasc Drugs Drugs Devices Interv. 2025;25(1):57-69.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2025%3B25%281%29%3A57-69
19
.
Nuffield Department of Population Health Renal Studies Group, SGLT2 inhibitor Meta-Analysis Cardio-Renal Trialists¿ Consortium. Impact of diabetes on the effects of sodium glucose co-transporter-2 inhibitors on kidney outcomes: collaborative meta-analysis of large placebo-controlled trials. Lancet. 2022;400(10365):1788-801.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2022%3B400%2810365%29%3A1788-801
20
.
Poston JT, Koyner JL. Sepsis associated acute kidney injury. BMJ. 2019;364:k4891.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2019%3B364%3Ak4891
21
.
Pais T, Jorge S, Lopes JA. Acute Kidney Injury in Sepsis. Int J Mol Sci. 2024;25(11):5924.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2024%3B25%2811%29%3A5924
22
.
Kwiatkowska E, Doma¿ski L, Dziedziejko V, Kajdy A, Stefa¿ska K, Kwiatkowski S. The Mechanism of Drug Nephrotoxicity and the Methods for Preventing Kidney Damage. Int J Mol Sci. 2021;22(11):6109.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2021%3B22%2811%29%3A6109
23
.
Robert L, Ficheur G, Gautier S, Servais A, Luyckx M, Soula J, et al. Community-Acquired Acute Kidney Injury Induced By Drugs In Older Patients: A Multifactorial Event. Clin Interv Aging. 2019;14:2105-13.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2019%3B14%3A2105-13
24
.
Petejova N, Martinek A, Zadrazil J, Teplan V. Acute toxic kidney injury. Ren Fail. 2019;41(1):576-94.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2019%3B41%281%29%3A576-94
25
.
Mitsas AC, Elzawawi M, Mavrogeni S, Boekels M, Khan A, Eldawy M, et al. Heart Failure and Cardiorenal Syndrome: A Narrative Review on Pathophysiology, Diagnostic and Therapeutic Regimens-From a Cardiologist¿s View. J Clin Med. 2022;11(23):7041.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2022%3B11%2823%29%3A7041
26
.
Ronco C, Bellomo R, Kellum JA. Acute kidney injury. Lancet. 2019;394(10212):1949-64.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2019%3B394%2810212%29%3A1949-64
27
.
Llàcer P, Gallardo MÁ, Palau P, Moreno MC, Castillo C, Fernández C, et al. Comparison between CA125 and NT-proBNP for evaluating congestion in acute heart failure. Med Clin (Barc). 2021;156(12):589-94.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2021%3B156%2812%29%3A589-94
28
.
Ricci Z, Romagnoli S, Ronco C. Cardiorenal Syndrome. Crit Care Clin. 2021;37(2):335-47.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2021%3B37%282%29%3A335-47
29
.
Romero-González G, Manrique J, Slon-Roblero MF, Husain-Syed F, De la Espriella R, Ferrari F, et al. PoCUS in nephrology: a new tool to improve our diagnostic skills. Clin Kidney J. 2023;16(2):218-29.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2023%3B16%282%29%3A218-29
30
.
Fagundes C, Barreto R, Guevara M, Garcia E, Solà E, Rodríguez E, et al. A modified acute kidney injury classification for diagnosis and risk stratification of impairment of kidney function in cirrhosis. J Hepatol. 2013;59(3):474-81.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2013%3B59%283%29%3A474-81
31
.
Velez JCQ, Therapondos G, Juncos LA. Reappraising the spectrum of AKI and hepatorenal syndrome in patients with cirrhosis. Nat Rev Nephrol. 2020;16(3):137-55.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2020%3B16%283%29%3A137-55
32
.
Ortega R, Ginès P, Uriz J, Cárdenas A, Calahorra B, De Las Heras D, et al. Terlipressin therapy with and without albumin for patients with hepatorenal syndrome: results of a prospective, nonrandomized study. Hepatol Baltim Md. 2002;36(4 Pt 1):941-8.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2002%3B36%284+Pt+1%29%3A941-8
33
.
Taber-Hight E, Shah S. Acute Kidney Injury in Pregnancy. Adv Chronic Kidney Dis. 2020;27(6):455-60.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2020%3B27%286%29%3A455-60
34
.
Rodríguez-Benitez P, Aracil Moreno I, Oliver Barrecheguren C, Cuñarro López Y, Yllana F, Pintado Recarte P, et al. Maternal-Perinatal Variables in Patients with Severe Preeclampsia Who Develop Acute Kidney Injury. J Clin Med. 2021;10(23):5629.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2021%3B10%2823%29%3A5629
35
.
Phipps EA, Thadhani R, Benzing T, Karumanchi SA. Pre-eclampsia: pathogenesis, novel diagnostics and therapies. Nat Rev Nephrol. 2019;15(5):275-89.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2019%3B15%285%29%3A275-89
36
.
Rondeau E, Ardissino G, Caby-Tosi MP, Al-Dakkak I, Fakhouri F, Miller B, et al. Pregnancy in Women with Atypical Hemolytic Uremic Syndrome. Nephron. 2022;146(1):1-10.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2022%3B146%281%29%3A1-10
37
.
Hamdi A, Hajage D, Van Glabeke E, Belenfant X, Vincent F, Gonzalez F, et al. Severe post-renal acute kidney injury, post-obstructive diuresis and renal recovery. BJU Int. 2012;110(11 Pt C):E1027-1034.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2012%3B110%2811+Pt+C%29%3AE1027-1034
38
.
Molitoris BA. Low-Flow Acute Kidney Injury: The Pathophysiology of Prerenal Azotemia, Abdominal Compartment Syndrome, and Obstructive Uropathy. CJASN. 2022;17(7):1039-49.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2022%3B17%287%29%3A1039-49
39
.
Pickering JW, Frampton CM, Walker RJ, Shaw GM, Endre ZH. Four hour creatinine clearance is better than plasma creatinine for monitoring renal function in critically ill patients. Crit Care. 2012;16(3):R107.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2012%3B16%283%29%3AR107
40
.
Knight EL, Verhave JC, Spiegelman D, Hillege HL, de Zeeuw D, Curhan GC, et al. Factors influencing serum cystatin C levels other than renal function and the impact on renal function measurement. Kidney Int. 2004;65(4):1416-21.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2004%3B65%284%29%3A1416-21
41
.
Nateghi Haredasht F, Viaene L, Vens C, Callewaert N, De Corte W, Pottel H. Comparison between Cystatin C- and Creatinine-Based Estimated Glomerular Filtration Rate in the Follow-Up of Patients Recovering from a Stage-3 AKI in ICU. J Clin Med. 2022;11(24):7264.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2022%3B11%2824%29%3A7264
42
.
Abdelhafez M, Nayfeh T, Atieh A, AbuShamma O, Babaa B, Baniowda M, et al. Diagnostic Performance of Fractional Excretion of Sodium for the Differential Diagnosis of Acute Kidney Injury: A Systematic Review and Meta-Analysis. CJASN. 2022;17(6):785-97.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2022%3B17%286%29%3A785-97
43
.
Perazella MA, Coca SG, Kanbay M, Brewster UC, Parikh CR. Diagnostic value of urine microscopy for differential diagnosis of acute kidney injury in hospitalized patients. CJASN. 2008;3(6):1615-9.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2008%3B3%286%29%3A1615-9
44
.
Perazella MA, Coca SG, Hall IE, Iyanam U, Koraishy M, Parikh CR. Urine microscopy is associated with severity and worsening of acute kidney injury in hospitalized patients. CJASN. 2010;5(3):402-8.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2010%3B5%283%29%3A402-8
45
.
Chawla LS, Dommu A, Berger A, Shih S, Patel SS. Urinary sediment cast scoring index for acute kidney injury: a pilot study. Nephron Clin Pract. 2008;110(3):c145-150.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2008%3B110%283%29%3Ac145-150
46
.
Palsson R, Colona MR, Hoenig MP, Lundquist AL, Novak JE, Perazella MA, et al. Assessment of Interobserver Reliability of Nephrologist Examination of Urine Sediment. JAMA. 2020;3(8):e2013959.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2020%3B3%288%29%3Ae2013959
47
.
Chawla LS, Davison DL, Brasha-Mitchell E, Koyner JL, Arthur JM, Shaw AD, et al. Development and standardization of a furosemide stress test to predict the severity of acute kidney injury. Crit Care. 2013;17(5):R207.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2013%3B17%285%29%3AR207
48
.
Chen JJ, Chang CH, Huang YT, Kuo G. Furosemide stress test as a predictive marker of acute kidney injury progression or renal replacement therapy: a systemic review and meta-analysis. Crit Care. 2020;24(1):202.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2020%3B24%281%29%3A202
49
.
Waikar SS, McMahon GM. Expanding the Role for Kidney Biopsies in Acute Kidney Injury. Semin Nephrol. 2018;38(1):12-20.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2018%3B38%281%29%3A12-20
50
.
Poggio ED, McClelland RL, Blank KN, Hansen S, Bansal S, Bomback AS, et al. Systematic Review and Meta-Analysis of Native Kidney Biopsy Complications. CJASN. 2020;15(11):1595-602.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2020%3B15%2811%29%3A1595-602
51
.
Monard C, Meersch-Dini M, Joannidis M. When the kidneys hurt, the other organs suffer. Intensive Care Med. 2023;49(2):233-6.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2023%3B49%282%29%3A233-6
52
.
Kellum JA, Romagnani P, Ashuntantang G, Ronco C, Zarbock A, Anders HJ. Acute kidney injury. Nat Rev Dis Primer. 2021;7(1):52.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2021%3B7%281%29%3A52
53
.
Payen D, de Pont AC, Sakr Y, Spies C, Reinhart K, Vincent JL, et al. A positive fluid balance is associated with a worse outcome in patients with acute renal failure. Crit Care. 2008;12(3):R74.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2008%3B12%283%29%3AR74
54
.
Gorriz JL, D¿Marco L, Pastor-González A, Molina P, Gonzalez-Rico M, Puchades MJ, et al. Long-term mortality and trajectory of potassium measurements following an episode of acute severe hyperkalaemia. Nephrol Dial Transplant. 2022;37(3):522-30.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2022%3B37%283%29%3A522-30
55
.
Liu M, Rafique Z. Acute Management of Hyperkalemia. Curr Heart Fail Rep. 2019;16(3):67-74.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2019%3B16%283%29%3A67-74
56
.
Lindner G, Burdmann EA, Clase CM, Hemmelgarn BR, Herzog CA, Ma¿yszko J, et al. Acute hyperkalemia in the emergency department: a summary from a Kidney Disease: Improving Global Outcomes conference. Eur J Emerg Med. 2020;27(5):329-37.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2020%3B27%285%29%3A329-37
57
.
Kraut JA, Kurtz I. Use of base in the treatment of severe acidemic states. Am J Kidney Dis. 2001;38(4):703-27.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2001%3B38%284%29%3A703-27
58
.
Leaf DE, Christov M. Dysregulated Mineral Metabolism in AKI. Semin Nephrol. 2019;39(1):41-56.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2019%3B39%281%29%3A41-56
59
.
Yang Y, Zhang P, Cui Y, Lang X, Yuan J, Jiang H, et al. Hypophosphatemia during continuous veno-venous hemofiltration is associated with mortality in critically ill patients with acute kidney injury. Crit Care. 2013;17(5):R205.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2013%3B17%285%29%3AR205
60
.
Matuszkiewicz-Rowinska J, Malyszko J. Prevention and Treatment of Tumor Lysis Syndrome in the Era of Onco-Nephrology Progress. Kidney Blood Press Res. 2020;45(5):645-60.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2020%3B45%285%29%3A645-60
61
.
Cove ME, MacLaren G, Brodie D, Kellum JA. Optimising the timing of renal replacement therapy in acute kidney injury. Crit Care. 2021;25(1):184.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2021%3B25%281%29%3A184
62
.
Ramos Terrades N, Rodríguez Benítez P, Urbizu Gallardo JM, Valdenebro M de, Salgueira M, Molina Andujar A, et al. Documento de consenso para el diagnóstico y tratamiento de la insuficiencia renal aguda. Nefrología [Internet]. Disponible a: https://www.revistanefrologia.com/es-documento-consenso-el-diagnostico-tratamiento-avance-S0211699525000700
http://www.ncbi.nlm.nih.gov/pubmed/?term=com%2Fes-documento-consenso-el-diagnostico-tratamiento-avance-S0211699525000700
63
.
Zarbock A, Kellum JA, Schmidt C, Van Aken H, Wempe C, Pavenstädt H, et al. Effect of Early vs Delayed Initiation of Renal Replacement Therapy on Mortality in Critically Ill Patients With Acute Kidney Injury: The ELAIN Randomized Clinical Trial. JAMA. 2016;315(20):2190-9.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2016%3B315%2820%29%3A2190-9
64
.
Gaudry S, Hajage D, Schortgen F, Martin-Lefevre L, Pons B, Boulet E, et al. Initiation Strategies for Renal-Replacement Therapy in the Intensive Care Unit. N Engl J Med. 2016;375(2):122-33.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2016%3B375%282%29%3A122-33
65
.
Barbar SD, Clere-Jehl R, Bourredjem A, Hernu R, Montini F, Bruyère R, et al. Timing of Renal-Replacement Therapy in Patients with Acute Kidney Injury and Sepsis. N Engl J Med. 2018;379(15):1431-42.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2018%3B379%2815%29%3A1431-42
66
.
STARRT-AKI Investigators, Canadian Critical Care Trials Group, Australian and New Zealand Intensive Care Society Clinical Trials Group, United Kingdom Critical Care Research Group, Canadian Nephrology Trials Network, Irish Critical Care Trials Group, et al. Timing of Initiation of Renal-Replacement Therapy in Acute Kidney Injury. N Engl J Med. 2020;383(3):240-51.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2020%3B383%283%29%3A240-51
67
.
Gaudry S, Hajage D, Martin-Lefevre L, Lebbah S, Louis G, Moschietto S, et al. Comparison of two delayed strategies for renal replacement therapy initiation for severe acute kidney injury (AKIKI 2): a multicentre, open-label, randomised, controlled trial. Lancet. 2021;397(10281):1293-300.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2021%3B397%2810281%29%3A1293-300
68
.
Castro I, Relvas M, Gameiro J, Lopes JA, Monteiro-Soares M, Coentrão L. The impact of early versus late initiation of renal replacement therapy in critically ill patients with acute kidney injury on mortality and clinical outcomes: a meta-analysis. Clin Kidney J. 2022;15(10):1932-45.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2022%3B15%2810%29%3A1932-45
69
.
Fayad AI, Buamscha DG, Ciapponi A. Timing of kidney replacement therapy initiation for acute kidney injury. Cochrane Database Syst Rev. 2022;11(11):CD010612.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2022%3B11%2811%29%3ACD010612
70
.
Wald R, Gaudry S, da Costa BR, Adhikari NKJ, Bellomo R, Du B, et al. Initiation of continuous renal replacement therapy versus intermittent hemodialysis in critically ill patients with severe acute kidney injury: a secondary analysis of STARRT-AKI trial. Intensive Care Med. 2023;49(11):1305-16.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2023%3B49%2811%29%3A1305-16
71
.
Parapiboon W, Tatiyanupanwong S, Khositrangsikun K, Phulkerd T, Kaewdoungtien P, Pichitporn W, et al. Lower-Dosage Acute Peritoneal Dialysis versus Acute Intermittent Hemodialysis in Acute Kidney Injury: A Randomized Controlled Trial. CJASN. 2024;19(8):970-7.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2024%3B19%288%29%3A970-7
72
.
Zhou X, Dong P, Pan J, Wang H, Xu Z, Chen B. Renal replacement therapy modality in critically ill patients with acute kidney injury - A network meta-analysis of randomized controlled trials. J Crit Care. 2021;64:82-90.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2021%3B64%3A82-90
73
.
Gaudry S, Grolleau F, Barbar S, Martin-Lefevre L, Pons B, Boulet É, et al. Continuous renal replacement therapy versus intermittent hemodialysis as first modality for renal replacement therapy in severe acute kidney injury: a secondary analysis of AKIKI and IDEAL-ICU studies. Crit Care. 2022;26(1):93.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2022%3B26%281%29%3A93
74
.
Douvris A, Malhi G, Hiremath S, McIntyre L, Silver SA, Bagshaw SM, et al. Interventions to prevent hemodynamic instability during renal replacement therapy in critically ill patients: a systematic review. Crit Care.2018;22(1):41.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2018%3B22%281%29%3A41
75
.
Levine Z, Vijayan A. Prolonged Intermittent Kidney Replacement Therapy. CJASN. 2023;18(3):383-91.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2023%3B18%283%29%3A383-91
76
.
VA/NIH Acute Renal Failure Trial Network, Palevsky PM, Zhang JH, O¿Connor TZ, Chertow GM, Crowley ST, et al. Intensity of renal support in critically ill patients with acute kidney injury. N Engl J Med. 2008;359(1):7-20.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2008%3B359%281%29%3A7-20
77
.
RENAL Replacement Therapy Study Investigators, Bellomo R, Cass A, Cole L, Finfer S, Gallagher M, et al. Intensity of continuous renal-replacement therapy in critically ill patients. N Engl J Med. 2009;361(17):1627-38.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2009%3B361%2817%29%3A1627-38
78
.
Ostermann M, Lumlertgul N, Jeong R, See E, Joannidis M, James M. Acute kidney injury. Lancet. 2025;405(10474):241-56.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2025%3B405%2810474%29%3A241-56
79
.
Alcalde-Bezhold G, Alcázar-Arroyo R, Angoso-de-Guzmán M, Arenas MD, Arias-Guillén M, Arribas-Cobo P, et al. Guía de unidades de hemodiálisis 2020. Nefrología. 2021;41:1-77.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2021%3B41%3A1-77
80
.
Molina-Andújar A, Alcubilla P, Santiago P, Blasco M, Cucchiari D, Piñeiro G, et al. Impact of the intensity of intermittent renal replacement therapy in critically ill patients. J Nephrol. 2021;34(1):105-12.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2021%3B34%281%29%3A105-12
81
.
Kellum JA, Lameire N, KDIGO AKI Guideline Work Group. Diagnosis, evaluation, and management of acute kidney injury: a KDIGO summary (Part 1). Crit Care 2013;17(1):204.
http://www.ncbi.nlm.nih.gov/pubmed/?term=Crit+Care+2013%3B17%281%29%3A204
82
.
Zhang W, Bai M, Yu Y, Li L, Zhao L, Sun S, et al. Safety and efficacy of regional citrate anticoagulation for continuous renal replacement therapy in liver failure patients: a systematic review and meta-analysis. Crit Care. 2019;23(1):22.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2019%3B23%281%29%3A22
83
.
Uchino S, Bellomo R, Morimatsu H, Morgera S, Schetz M, Tan I, et al. Discontinuation of continuous renal replacement therapy: a post hoc analysis of a prospective multicenter observational study. Crit Care Med. 2009;37(9):2576-82.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2009%3B37%289%29%3A2576-82
84
.
Fröhlich S, Donnelly A, Solymos O, Conlon N. Use of 2-hour creatinine clearance to guide cessation of continuous renal replacement therapy. J Crit Care. 2012;27(6):744.e1-5.
http://www.ncbi.nlm.nih.gov/pubmed/?term=e1-5
85
.
Hsu CM, Gupta S, Tighiouart H, Goyal N, Faugno AJ, Tariq A, et al. Kidney Recovery and Death in Critically Ill Patients With COVID-19-Associated Acute Kidney Injury Treated With Dialysis: The STOP-COVID Cohort Study. Am J Kidney Dis. 2022;79(3):404-416.e1.
http://www.ncbi.nlm.nih.gov/pubmed/?term=e1
86
.
Xu L, Chen L, Jiang X, Hu W, Gong S, Fang J. The furosemide stress test predicts successful discontinuation of continuous renal replacement therapy in critically ill patients with acute kidney injury. J Crit Care. 2025;85:154929.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2025%3B85%3A154929
87
.
Thomas ME, Blaine C, Dawnay A, Devonald MAJ, Ftouh S, Laing C, et al. The definition of acute kidney injury and its use in practice. Kidney Int. 2015;87(1):62-73.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2015%3B87%281%29%3A62-73
88
.
Ostermann M, Legrand M, Meersch M, Srisawat N, Zarbock A, Kellum JA. Biomarkers in acute kidney injury. Ann Intensive Care. 2024;14(1):145.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2024%3B14%281%29%3A145
89
.
Kashani K, Al-Khafaji A, Ardiles T, Artigas A, Bagshaw SM, Bell M, et al. Discovery and validation of cell cycle arrest biomarkers in human acute kidney injury. Crit Care. 2013;17(1):R25.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2013%3B17%281%29%3AR25
90
.
Meersch M, Schmidt C, Hoffmeier A, Van Aken H, Wempe C, Gerss J, et al. Prevention of cardiac surgery-associated AKI by implementing the KDIGO guidelines in high risk patients identified by biomarkers: the PrevAKI randomized controlled trial. Intensive Care Med. 2017;43(11):1551-61.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2017%3B43%2811%29%3A1551-61
91
.
Mishra J, Dent C, Tarabishi R, Mitsnefes MM, Ma Q, Kelly C, et al. Neutrophil gelatinase-associated lipocalin (NGAL) as a biomarker for acute renal injury after cardiac surgery. Lancet. 2005;365(9466):1231-8.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2005%3B365%289466%29%3A1231-8
92
.
Huelin P, Solà E, Elia C, Solé C, Risso A, Moreira R, et al. Neutrophil Gelatinase-Associated Lipocalin for Assessment of Acute Kidney Injury in Cirrhosis: A Prospective Study. Hepatol Baltim Md. 2019;70(1):319-33.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2019%3B70%281%29%3A319-33
93
.
Murray PT, Mehta RL, Shaw A, Ronco C, Endre Z, Kellum JA, et al. Potential use of biomarkers in acute kidney injury: report and summary of recommendations from the 10th Acute Dialysis Quality Initiative consensus conference. Kidney Int. 2014;85(3):513-21.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2014%3B85%283%29%3A513-21
94
.
Hoste E, Bihorac A, Al-Khafaji A, Ortega LM, Ostermann M, Haase M, et al. Identification and validation of biomarkers of persistent acute kidney injury: the RUBY study. Intensive Care Med. 2020;46(5):943-53.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2020%3B46%285%29%3A943-53
95
.
Moledina DG, Wilson FP, Kukova L, Obeid W, Luciano R, Kuperman M, et al. Urine interleukin-9 and tumor necrosis factor-¿ for prognosis of human acute interstitial nephritis. Nephrol Dial Transplant. 2021;36(10):1851-8.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2021%3B36%2810%29%3A1851-8
96
.
Tran TT, Yun G, Kim S. Artificial intelligence and predictive models for early detection of acute kidney injury: transforming clinical practice. BMC Nephrol. 2024;25(1):353.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2024%3B25%281%29%3A353
97
.
Perner A, Prowle J, Joannidis M, Young P, Hjortrup PB, Pettilä V. Fluid management in acute kidney injury. Intensive Care Med. 2017;43(6):807-15.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2017%3B43%286%29%3A807-15
98
.
Yunos NM, Bellomo R, Hegarty C, Story D, Ho L, Bailey M. Association between a chloride-liberal vs chloride-restrictive intravenous fluid administration strategy and kidney injury in critically ill adults. JAMA. 2012;308(15):1566-72.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2012%3B308%2815%29%3A1566-72
99
.
Caironi P, Tognoni G, Masson S, Fumagalli R, Pesenti A, Romero M, et al. Albumin replacement in patients with severe sepsis or septic shock. N Engl J Med. 2014;370(15):1412-21.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2014%3B370%2815%29%3A1412-21
100
.
Vanmassenhove J, Kielstein J, Jörres A, Biesen WV. Management of patients at risk of acute kidney injury. Lancet. 2017;389(10084):2139-51.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2017%3B389%2810084%29%3A2139-51
101
.
Liu KD, Yang J, Tan TC, Glidden DV, Zheng S, Pravoverov L, et al. Risk Factors for Recurrent Acute Kidney Injury in a Large Population-Based Cohort. Am J Kidney Dis .2019;73(2):163-73.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2019%3B73%282%29%3A163-73
102
.
Muiru AN, Hsu JY, Zhang X, Appel LJ, Chen J, Cohen DL, et al. Risk for Chronic Kidney Disease Progression After Acute Kidney Injury: Findings From the Chronic Renal Insufficiency Cohort Study. Ann Intern Med. 2023;176(7):961-8.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2023%3B176%287%29%3A961-8
103
.
Hsu CY, Chinchilli VM, Coca S, Devarajan P, Ghahramani N, Go AS, et al. Post-Acute Kidney Injury Proteinuria and Subsequent Kidney Disease Progression: The Assessment, Serial Evaluation, and Subsequent Sequelae in Acute Kidney Injury (ASSESS-AKI) Study. JAMA Intern Med. 2020;180(3):402-10.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2020%3B180%283%29%3A402-10
104
.
Jensen SK, Heide-Jørgensen U, Gammelager H, Birn H, Christiansen CF. Acute Kidney Injury Duration and 20-Year Risks of CKD and Cardiovascular Disease. Kidney Int Rep. 2024;9(4):817-29.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2024%3B9%284%29%3A817-29
105
.
Mehta RL, Burdmann EA, Cerdá J, Feehally J, Finkelstein F, García-García G, et al. Recognition and management of acute kidney injury in the International Society of Nephrology 0by25 Global Snapshot: a multinational cross-sectional study. Lancet. 2016;387(10032):2017-25.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2016%3B387%2810032%29%3A2017-25
106
.
Choon XY, Lumlertgul N, Cameron L, Jones A, Meyer J, Slack A, et al. Discharge Documentation and Follow-Up of Critically Ill Patients With Acute Kidney Injury Treated With Kidney Replacement Therapy: A Retrospective Cohort Study. Front Med. 2021;8:710228.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2021%3B8%3A710228
107
.
Nishimoto M, Murashima M, Kokubu M, Matsui M, Eriguchi M, Samejima KI, et al. Kidney function at 3 months after acute kidney injury is an unreliable indicator of subsequent kidney dysfunction: the NARA-AKI Cohort Study. Nephrol Dial Transplant. 2023;38(3):664-70.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2023%3B38%283%29%3A664-70
108
.
Gameiro J, Marques F, Lopes JA. Long-term consequences of acute kidney injury: a narrative review. Clin Kidney J. 2021;14(3):789-804.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2021%3B14%283%29%3A789-804
109
.
Barreto EF, Cerda J, Freshly B, Gewin L, Kwong YD, McCoy IE, et al. Optimum Care of AKI Survivors Not Requiring Dialysis after Discharge: An AKINow Recovery Workgroup Report. Kidney360. 2024;5(1):124-32.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2024%3B5%281%29%3A124-32
110
.
Murphy DP, Wolfson J, Reule S, Johansen KL, Ishani A, Drawz PE. Kidney Outcomes with Sodium-Glucose Cotransporter-2 Inhibitor Initiation after AKI among Veterans with Diabetic Kidney Disease. Kidney360. 2024;5(3):335-43.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2024%3B5%283%29%3A335-43
111
.
Manis MM, Wallace JL, Boyd EF, Abebe KZ, Fried L, Palevsky PM, et al. Postdischarge Care of Acute Kidney Injury Survivors: An Opportunity for Targeted Nurse and Pharmacist Interventions. Adv Kidney Dis Health. 2025;32(2):154-61.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2025%3B32%282%29%3A154-61
112
.
Alwagdani A, Awad AS, Abdel-Rahman EM. Optimum Post-Discharge Care of Acute Kidney Injury (AKI) Survivors. J Clin Med. 2022;11(21):6277.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2022%3B11%2821%29%3A6277
113
.
Vijayan A, Heung M, Awdishu L, Babroudi S, Green GB, Koester L, et al. ASN Kidney Health Guidance on the Outpatient Management of Patients with Dialysis-Requiring Acute Kidney Injury. JASN. 2025;36(5):926-39.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2025%3B36%285%29%3A926-39