Insuficiencia Renal Aguda
Palabras clave
Insuficiencia renal aguda prerrenal, Insuficiencia renal aguda posrrenal, Oliguria, Anuria, uropatía obstructiva, insuficiencia renal aguda parenquimatosa, AKI, técnicas depuración continuas. inuas
INDICE
1. Conceptos generales (Definición, Fisiopatología y Clasificación)
1.1. Definición
1.2. Oliguria y Anuria
1.3. Fisiopatología y Clasificación
1.3.1. IRA Prerrenal
1.3.2. IRA Parenquimatosa o Intrínseca
1.3.3. IRA Postrrenal u Obstructivo
2. Epidemiología y pronóstico
3. Etiología
4. Diagnóstico
4.1. La clínica en el diagnóstico de la IRA
4.2 Análisis bioquímicos de urgencia.
4.2.1. Análisis básicos
4.2.2. Parámetros de funcionalidad.
4.3. Ecografía abdominal
4.4. Pruebas de laboratorio y otras exploraciones complementarias.
4.4.1. El análisis urinario
4.4.2. Pruebas serológicas
4.4.3. Análisis de proteínas
4.4.4. Análisis hematológicos
4.4.5. Estudios microbiológicos.
4.4.6. El gap osmolar en las intoxicaciones
4.4.7. El examen de fondo de ojo
4.5. Pruebas de imagen diferentes a la ecografía
4.5.1. Para el despistaje de la uropatía obstructiva.
4.5.2. Para el despistaje de patología vascular
4.6. Biopsia Renal
4.7. Nuevos Marcadores de Daño Renal
5. Tratamiento
5.1. Tratamiento Médico
5.2. Tratamiento Renal Substitutivo
5.2.1. Indicaciones para el inicio de la terapia de sustitución
5.2.2. Variantes Técnicas de Tratamientos Renal Substitutivo
5.2.2.1. Diálisis Peritoneal (DP)
5.2.2.2. Hemodiálisis Intermitente (HDI)
5.2.2.3. Técnicas de Depuración Continuas (TDC)
5.2.2.3.1. Historia y generalidades
5.2.2.3.2. Monitores de TDC
5.2.3. Selección de la terapia de depuración
5.2.4. Dosis de depuración y supervivencia
5.2.5. Problemas de aplicación y complicaciones de uso
1. Conceptos generales (Definición, Fisiopatología y Epidemiología de la Insuficiencia Renal Aguda)
1.1. Definición
La Insuficiencia Renal Aguda (IRA) es un síndrome clínico que de forma brusca altera la homeostasis del organismo. Una multitud de causas provocan disminución en la capacidad que poseen los riñones para eliminar productos nitrogenados de desecho y alteran además el equilibrio hidroelectrolítico. Con frecuencia se manifiesta con una diuresis insuficiente. Su presentación es en horas o en días y la elevación por encima de las cifras basales de la concentración sérica de creatinina y de urea (o nitrógeno ureico) sirve para el diagnóstico, hasta la consolidación de nuevos marcadores de daño renal. Los límites para definir el fracaso renal agudo son muy variables entre autores y marcar una barrera es totalmente artificial y arbitrario pero necesario.
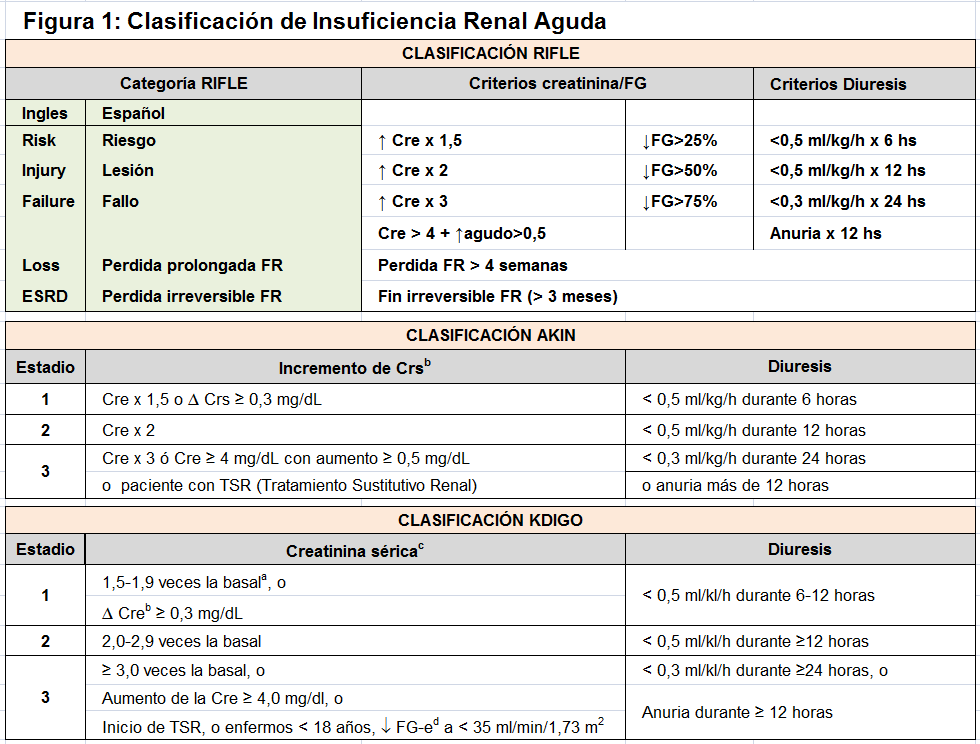
En los últimos años, se ha intentado poner orden a la definición y estadiaje (Figura 1): Bajo el acrónimo RIFLE correspondiente a las palabras inglesas riesgo (Risk), daño (Injury), fallo (Failure), pérdida prolongada de la función renal (Loss) y fin irreversible de la función renal- (End) se ha pretendido unificar los criterios diagnósticos y se ha validado en múltiples trabajos. Este es un sistema desarrollado durante la 2ª conferencia de consenso de la Adequate Dialysis Quality Initiative (ADQI) celebrada en Vicenza en el año 2002 [1] [2] [3] [4] [5]. Posteriormente, han aparecido dos modificaciones importantes de esta clasificación: la del grupo Acute Kidney Injury Network (AKIN) en 2007 [6], donde se obvian los criterios de caída del filtrado glomerular (fundamentado en la inconveniencia de emplear ecuaciones de regresión para estimar el filtrado glomerular en situaciones en las que no exista una situación de equilibrio) y sólo se mantienen la elevación de la creatinina y la disminución en la diuresis; y la propuesta en 2012 por la Kidney Disease Improving Global Outcomes (K-DIGO) en su guía de práctica clínica de la IRA [7]. Es posiblemente la mas utilizada; define la IRA en función del aumento de la creatinina sérica en el tiempo o del volumen de diuresis. Mantiene tres niveles de gravedad. Recupera el concepto de síndrome, recomendando determinar la causa y tipología. Recientemente, ADQI ha matizado el significado de Enfermedad Renal Aguda (ERA); cuando el deterioro de función renal provocado por una IRA dura más de 7 días y si perdurase más de 90 días, se debería hablar de Enfermedad Renal Crónica (ERC).
En la 5ª edición del Libro Nefrología Clínica de Hernando detallamos en profundidad estos y otros conceptos que aparecen en el presente capítulo [8].
1.2. Oliguria y anuria
El volumen normal de diuresis se mueve en un amplio rango en función de las necesidades del organismo para regular primariamente volemia y osmolalidad plasmática. Cuando se orina menos de 400 mL/día hablamos de oliguria y una cantidad inferior a 100 mL/día se conoce como anuria. Si la podemos monitorizar de forma horaria (paciente sondado, nefrostomía, cistostomía, catéter ureteral) <0,5 ml/(kg·h) para estadíos 1 y 2 o <0,3 ml/(kg·h) para estadios 3 de las clasificaciones de AKIN y KDIGO
1.3. Fisiopatología y clasificación
1.3.1. IRA Prerrenal
En determinadas situaciones clínicas en las que la perfusión renal se encuentre comprometida, existirá una respuesta fisiopatológica mediada por reacciones hormonales y estímulos nerviosos simpáticos, que condicionará la disminución del flujo de orina y la eliminación de cloro y sodio por los riñones. Sin embargo, esta orina se encontrará más concentrada en solutos de desecho (urea, creatinina, fosfatos, amonio) por lo que presentará una osmolalidad relativamente elevada en relación con la plasmática. La necesidad diaria de desembarazarse de unos solutos, que representan aproximadamente 800 miliosmoles, se consigue eliminando una orina tan concentrada como 1.200 mOsm/kg o tan diluida como 100 mOsm/kg, según nos convenga ahorrar agua (el osmostato hipotalámico habrá disparado la secreción de vasopresina, la cual activará los canales del agua, acuaporina-2, en la vertiente apical de las células del túbulo colector renal) o eliminar agua (aclarar agua libre de solutos), respectivamente.
Es por todo ello, que si el volumen de orina baja de 500 mL/día, aunque los riñones funcionen correctamente y concentren al máximo de su capacidad, no se conseguirán eliminar todas las sustancias de desecho y se producirá una retención de productos nitrogenados (azotemia). En este caso hablaremos de insuficiencia renal aguda funcional o prerrenal, por cuanto la respuesta del riñón se desarrolla con fines compensadores y al revertir la causa éste volverá a la situación de normalidad. Por lo general, este tipo de insuficiencia renal se asocia a oliguria: eliminación diaria de menos de 400 mL de orina por día, de 200 mL en 12 horas o en paciente sondado menor de 20 mL/hora. El síndrome hepatorrenal [9] constituye un modelo fisiopatológico de insuficiencia renal aguda funcional.
1.3.2. IRA Parenquimatosa o intrínseca
También podríamos referirnos a ella como Renal propiamente dicha para contraponernos a los otros dos tipos fisiopatológicos. La IRA intrínseca (con daño parenquimatoso) puede ser oligúrica, anúrica o con diuresis conservada. En este último caso, la orina es de “mala calidad”, poco concentrada en productos nitrogenados.
Debemos puntualizar que, si la causa que ha provocado la hipoperfusión renal se prolonga en el tiempo o ésta es muy severa, puede desencadenar un daño hipóxico y oxidativo en las células tubulares renales, con pérdida de polaridad, necrosis y apoptosis celular, que abocaría en un fracaso renal establecido. Las porciones más susceptibles a este daño son las células de la parte recta del túbulo proximal (S3), ricas en peroxisomas, y las del túbulo colector. Este fallo puede requerir días o semanas para recuperar su función, a partir de haberse reinstaurado la adecuada perfusión renal. Dicha lesión se conoce como Necrosis Tubular Aguda (NTA), que, aunque es un término en origen anatomo-patológico se ha utilizado con criterio clínico y apoyado en la exclusión de otras causas. Por otro lado, a una IRA intrínseca se puede llegar por otras causas que no son directamente la hipoperfusión renal como, por ejemplo: causas inmunológicas sistémicas o locales, como pueden ser vasculitis o nefritis intersticial aguda inmunoalérgica por fármacos; problemas vasculares como la enfermedad ateroembólica, embolismos o trombosis en arteria o vena renales.
Junto con la hipoperfusión renal la otra causa más frecuente la constituyen los nefrotóxicos directos. Un grupo importante de éstos está constituido por xenobióticos como los aminoglucósidos o los contrastes yodados, con toxicidad directa sobre las células tubulares. Otros actúan modificando la hemodinámica renal, como los fármacos bloqueantes del sistema renina angiotensina y los antiinflamatorios no esteroideos. En este sentido la asociación de antiinflamatorios, bloqueantes del sistema renina angiotensina y diuréticos supone un incremento de factor de riesgo para desencadenar IRA en el paciente añoso (el triple “Whammy” o golpe). En un estudio de casos y controles de casi medio millón de pacientes hipertensos, el riesgo de IRA aumentó 30% en los que combinaban los tres fármacos en comparación con dos y de un 80% en los primeros 30 días de tratamiento [10].
Además del daño renal que provocan los xenobióticos, se han descrito otros tóxicos producidos de forma endógena, como el que desarrollan las proteínas HEME, que contienen hierro: La mioglobina (proteína de 17 kDa) se libera por daño muscular del sarcolema por trauma, infección, tóxicos o menos frecuente por miopatías estructurales de causa genética, provocando rabdomiolisis [11]. Cuando la concentración plasmática supera 100 mg/dL, la carga filtrada excede la capacidad tubular renal proximal de catabolizar esta proteína, con lo que alcanza una concentración elevada a lo largo del túbulo, lo obstruye, interactúa con la uroproteina de Tammm-Hosrsfall y en presencia de pH urinario ácido ejerce toxicidad sobre la célula tubular. En casos severos de rabdomiolisis, como en el síndrome de aplastamiento, se asocian otros factores patogénicos que agravan el cuadro, especialmente, la hipovolemia y la vasoconstricción renal por otros mediadores, como el tromboxano A2 y la endotelina. Los trastornos electrolíticos –hipocalcemia, hiperkalemia, acidosis e hiperfosforemia- limitan el gasto cardiaco y consecuentemente la perfusión renal. Además de la rabdomiolisis, la hemoglobinuria que aparece en una hemólisis masiva ejerce un papel similar, pero su presentación es menos frecuente porque su peso molecular es muy superior al de la mioglobina, similar al de la albúmina, con lo que se filtra con mayor dificultad y en menor proporción. Otro ejemplo de tóxico endógeno lo representa la sobreproducción de cadenas ligeras de inmunoglobulinas en una discrasia de células plasmáticas, como el mieloma múltiple, que es causa frecuente de IRA y de deterioro subagudo de la función renal en pacientes mayores.
Algunas otras sustancias pueden causar daño a nivel tubular por cristalización como aciclovir intravenoso, metotrexato o sustancias endógenas como el urato, que precipita en forma de cristales de ácido úrico cuando el pH urinario es ácido (síndrome de lisis tumoral -en donde el fosfato también juega un papel patogénico- e hiperuricosurias con deshidratación).
Como adelantábamos anteriormente, además de por insultos isquémicos y tóxicos el riñón se puede dañar por otras causas que no producen daño directo isquémico o tóxico, sino un mecanismo en que la inflamación local juega un papel más predominante. Así hablamos de causas inmunológicas sistémicas o locales, como pueden ser las vasculitis o la nefritis intersticial aguda inmunoalérgica por fármacos; o problemas vasculares como la enfermedad ateroembólica, los embolismos o las trombosis en arterias o venas renales. En muchos casos, son varios los mecanismos que conducen al fallo renal, sumándose compromisos en la perfusión y una lesión renal directa por tóxicos, como comentábamos que suele ocurrir en la rabdomiolisis.
1.3.3. IRA postrenal u obstructiva
Por último, aunque los riñones cumplan inicialmente bien sus misiones de filtrar, reabsorber y secretar, una obstrucción al flujo urinario acaba repercutiendo en estas funciones y puede llegar, si es bilateral (o unilateral sobre un único riñón que funcione) a provocar anuria (definida como la emisión de orina menor de 100 mL/día). En este caso, se habla de fracaso renal agudo obstructivo o postrenal. El grado de reversibilidad es alto y la función renal retorna con rapidez a sus valores iníciales al corregirse la causa o facilitar simplemente que la orina salga (mediante sondaje, cateterización o nefrostomía).
2. Epidemiología y pronóstico
Los datos epidemiológicos son muy variados debido a la metodología y definición empleadas. Desde el año 2004, se ha estandarizado más la definición y han surgido datos de grandes registros y bases de datos estatales. La incidencia e EEUU es de 2.880 pmp/año según datos estatales y 5.000 según datos de una aseguradora californiana. Otra consideración importante es matizar si el ámbito es comunitario u hospitalario, e incluso si se trata de unidades de críticos. La IRA adquirida en la comunidad se debe en un 70% a causas prerrenales y en un 17% a obstructivas [12] [13] [14] [15] [16]. La IRA complica más del 5% de todos los ingresos hospitalarios y hasta una tercera parte de los pacientes que ingresan en unidades críticas. Si utilizamos los criterios RIFLE, el porcentaje puede elevarse hasta un 20% de todos los pacientes hospitalizados; casi siempre en el contexto de isquemia, sepsis, fármacos y contrastes yodados. En unidades de críticos, la causa suele ser multifactorial y se relaciona con fallo multiorgánico. En conjunto, más de la mitad de los casos se deben a IRA prerrenal, un 40% a IRA renal o parenquimatosa y un 5% a IRA postrenal. La mortalidad es muy variable: oscila desde el 15% en la IRA de la comunidad a más del 50% de los que precisan tratamiento sustitutivo en UCI.
Si el paciente sobrevive, casi siempre recuperará total o parcialmente la función renal. Sin embargo, un porcentaje de IRA severa (10-20%) continuará precisando tratamiento sustitutivo renal al alta. De ellos, alguno recuperara función para abandonar la diálisis, aunque de entre estos sea frecuente que progresen con el tiempo a insuficiencia renal crónica terminal (estadio 5).
3. Etiología
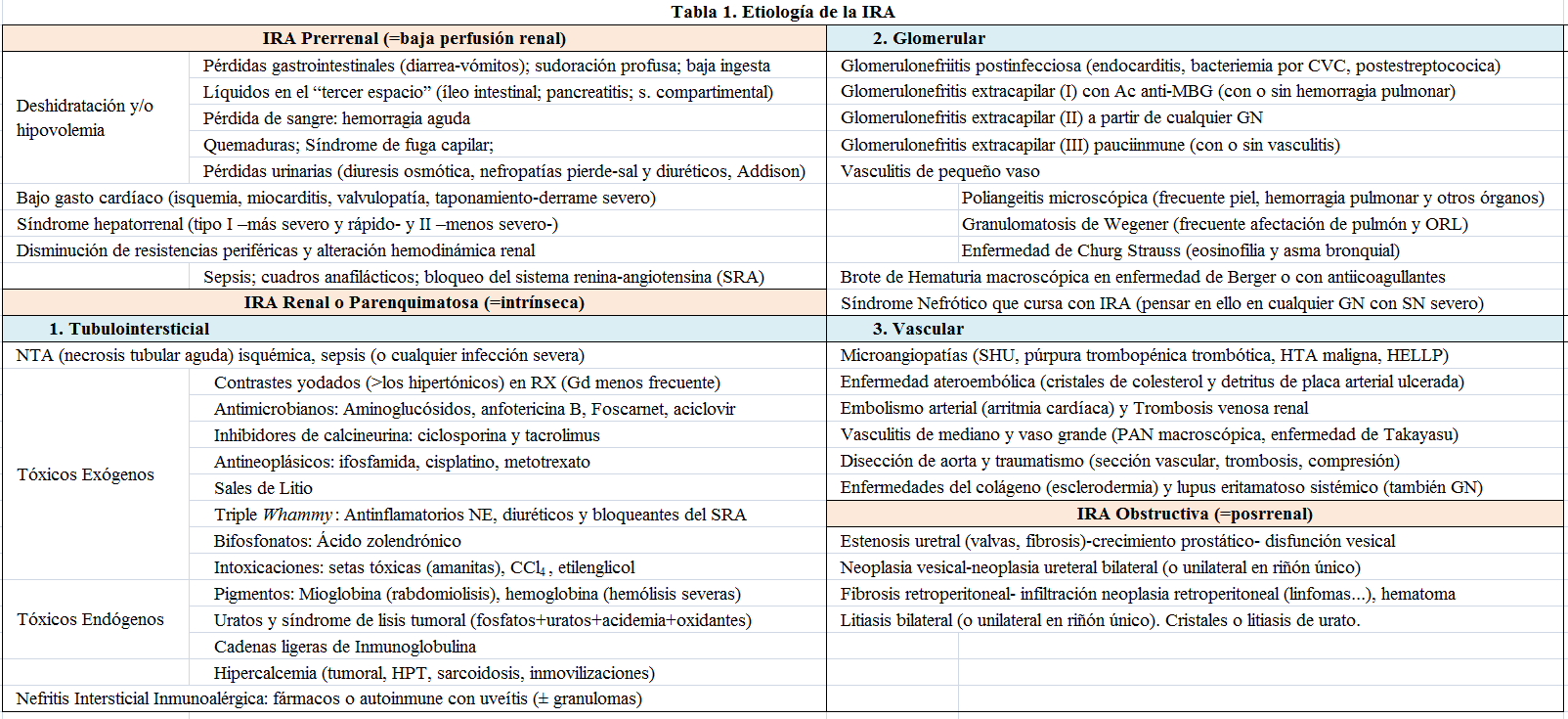
Las causas de IRA quedan resumidas en la (Tabla 1). Merece la pena detenerse en la IRA asociada a sepsis, que se presenta con elevada frecuencia en los cuadros infecciosos, en ocasiones antecediendo a la infección (ya que incrementa el riesgo de esta), acompañando frecuentemente a la sepsis desde prácticamente el inicio, o apareciendo de forma más diferida. Las respuestas hemodinámicas, la inflamación, el daño endotelial, la agregación de células de la sangre en el vaso pequeño, la isquemia y los cambios en el metabolismo (desde un metabolismo aeróbico hacia una fosforilación oxidativa terminada en lactato) provocados tanto por la isquemia como por el daño mitocondrial, condicionan una respuesta que provoca no solo la muerte celular, sino que en ocasiones supone una parada funcional de las células tubulares que desarrollan para preservar su vida. La llegada de mediadores inflamatorios y de productos derivados de los gérmenes patógenos a dichas células; la utilización de antibióticos y de medios de contraste iodado para exploraciones radiológicas -con potencial nefrotoxicidad- agravan el daño renal. La resucitación inicial mediante grandes cantidades de líquidos intravenosos produce en una segunda fase sobrecarga de volumen con edema intersticial, lo que agrava el ya iniciado por el aumento en la permeabilidad vascular que condicionó la inflamación y el daño endotelial.
La sepsis (infección más fallo de un órgano) es la causa de IRA más frecuente en unidades de pacientes críticos y más de la mitad de aquellos que la desarrollan presentará IRA de mayor o menor severidad. La respuesta hemodinámica, la inflamación, el daño endotelial, la agregación de células de la sangre en vasos pequeños. la isquemia y los cambios en el metabolismo mitocondrial -desde un metabolismo aeróbico hasta una fosforilización oxidativa terminada en lactato- condicionan la muerte celular o en el mejor de los casos una parada funcional que ejercen las células para preservar su vida.
En el contexto de la más devastadora pandemia que hemos vivido por COVID-19, el SARS- Cov2 provoca daño directo sobre células endoteliales, epiteliales, tubulares y podocitos; provoca también una tormenta por citocinas, activación de angiotensina II, desregulación del complemento, hipercoagulabilidad y microangiopatía [17]. Pero además, también se producen daños indirectos por la enfermedad pulmonar grave y yatrogénicos por los tratamientos que se han venido empleando para yugularla.
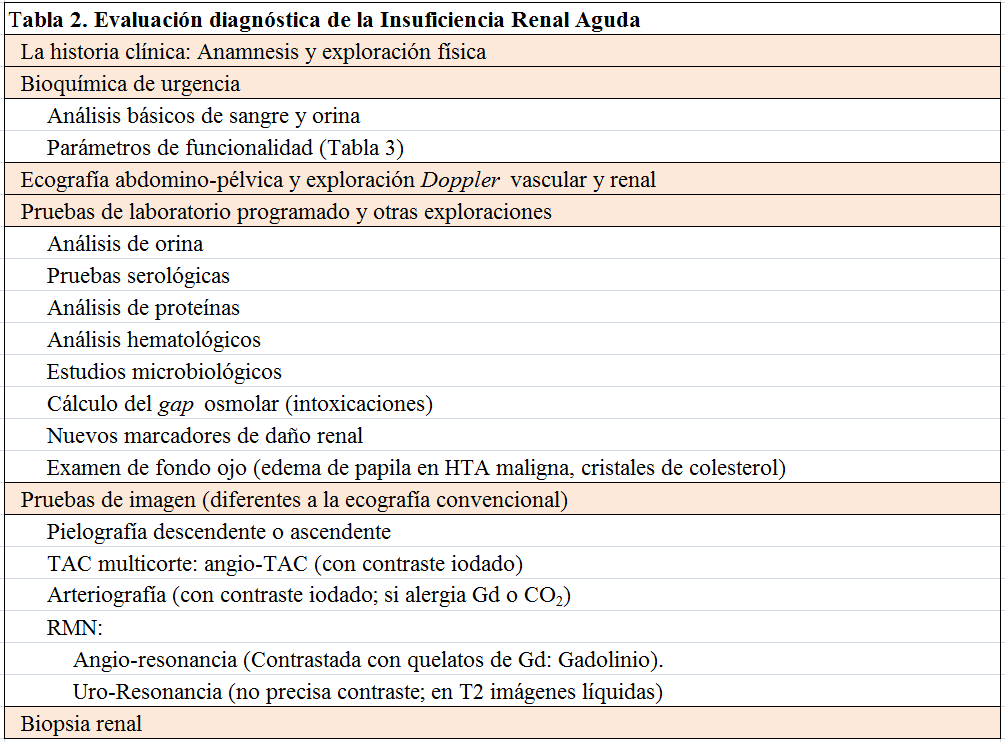
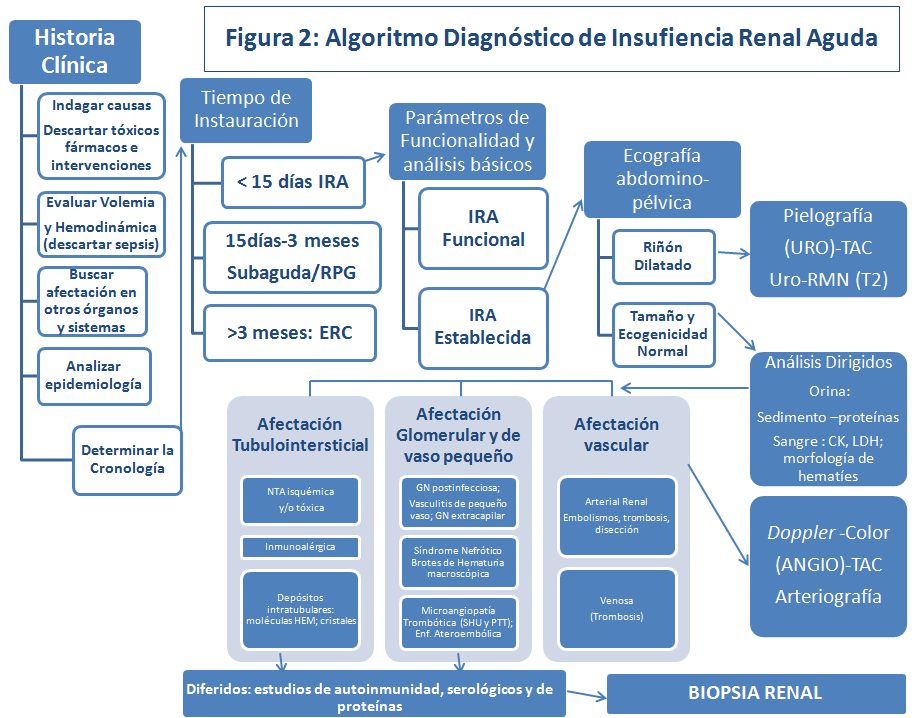
El algoritmo del diagnóstico diferencial del fracaso renal agudo queda esquematizado en la (Figura 2). Los pasos diagnósticos deberán seguir una sistemática lógica, que comprenda una batería que vaya, de lo más simple a lo más sofisticado, de lo menos agresivo a lo más cruento y que considere inicialmente lo más frecuente para llegar si es preciso a descartar lo raro. En la (Tabla 2), se enumeran los 6 pasos a los que se suele acceder para el correcto diagnóstico etiológico y diferencial de la IRA. Por otro lado, conviene recordar que se pueden presentar varios factores simultánea o consecutivamente como consecuencia de la evolución de la enfermedad o de nuestra intervención (yatrogenia).
4.1. La clínica en el diagnóstico de la IRA
La historia clínica constituye el eslabón más rentable en el correcto abordaje de la IRA y en todos los síndromes clínicos. La anamnesis, junto a una exhaustiva exploración física, nos alertarán y orientarán sobre un gran número de posibles etiologías. Interesa conocer antecedentes alérgicos y toma de fármacos o tóxicos; contactos con productos tóxicos; existencia de gastroenteritis, drenajes abundantes, sangrados o signos o síntomas de un tercer espacio. Deberemos ahondar en antecedentes vasculares, como arteriosclerosis, exploraciones radiológicas invasivas o con contraste yodado, arritmia cardíaca, etc. Además de indagar sobre cirugía reciente, posibles gestaciones o complicaciones obstétricas recientes, clínica prostática, hematuria macroscópica, cólicos renales o expulsión de piedras o arenillas. También escrutar sobre datos que sugieran procesos linfoproliferativos o tumorales, traumatismos recientes, signos o síntomas de patología infecciosa y si procede análisis epidemiológico.
Cabe recordar que los casos más frecuentes de IRA se producirán por hipoperfusión renal (tras deshidratación por pérdidas digestivas, etc.) y por tóxicos como antibióticos o contrastes yodados. Otros fármacos menos frecuentemente utilizados, como antimicrobianos (anfotericina B, vancomicina, aciclovir y ganciclovir, pentamidina, foscarnet, etc.), bifosfonatos como el ácido zolendrónico o antineoplásicos (cisplatino, ifosfamida) producen con elevada frecuencia fracaso renal agudo. Los inhibidores del punto de control inmunitario (checkpoint) producen IRA por vía inmunoalérgica. Por otro lado, son infrecuentes las IRA producidas por anestésicos (enflurano). Las intoxicaciones por tetracloruro de carbono (CCl4), etilenglicol o setas, aunque raras, deben tenerse en mente ya que la premura en el diagnóstico puede ser la única esperanza para salvar la vida del paciente.
La hemoptisis u otros datos de hemorragia o condensación pulmonar no aclarada nos orientará hacia un cuadro “pulmón-riñón”, de etiología infecciosa o autoinmune (síndrome de Goodpasture, LES, angeítis granulomatosa o poliangeitis microscópica) o simplemente tratarse de un edema agudo de pulmón o proceso neoplásico. La angeítis granulomatosa presenta afectación pulmonar en un 90% de los casos, la poliangeitis microscópica en un 50% y en la granulomatosis alérgica en el 70%, mientras que la afectación renal se presenta en el 80, 90 y 45%, respectivamente. Las vasculitis se suelen manifestar frecuentemente de forma subaguda, pero la experiencia nos hace incluirlas en este capítulo porque han sido muchos los casos que se han presentado como un cuadro de IRA.
La exploración física comenzará por la valoración general del paciente. Es decir, estado de conciencia, hidratación, coloración de la piel y perfusión distal, así como frecuencia y facilidad respiratoria y temperatura. Seguida de su situación hemodinámica, frecuencia cardíaca, tensión arterial y situación venosa, seguido de auscultación cardiopulmonar. La valoración abdominal intentará determinar el tamaño de los órganos, localizar posibles puntos dolorosos o inflamados, descartar la irritación peritoneal y estimar la motilidad intestinal. Deberemos buscar adenopatías cervicales, axilares e inguinales y descartar la existencia de hernias complicadas. Inspeccionar las extremidades en busca de heridas, mordeduras, picaduras o pinchazos que hayan dado lugar a la entrada directa de toxinas o microorganismos o a sustancias que indirectamente hayan causado daño renal tras producir por ejemplo rabdomiolisis. Determinadas lesiones cutáneas pueden aparecer en enfermedades alérgicas (nefritis por fármacos), autoinmunes (vasculitis, lupus eritematoso sistémico, púrpura de Schönlein Henoch), en enfermedades infecciosas (endocarditis, meningitis, etc.) o vasculares (livedo reticularis en enfermedad ateroembólica o síndrome antifosfolípido catastrófico). La enfermedad ateroembólica está producida por detritus procedentes de una placa ulcerada, que incluye pequeñas partículas y cristales de colesterol que impactan en pequeños vasos, arteriolas y capilares (las partículas de 40 µm impactarán en las arteriolas aferentes y los cristales de colesterol pueden llegar hasta los capilares).
Es importante igualmente en este estadio clínico, no contentarse con el diagnóstico de IRA. Muchas veces detrás de este síndrome hay algo mucho más grave, como una pancreatitis severa, una colecistitis, un taponamiento cardíaco, una sepsis con fallo multiorgánico, un infarto de miocardio complicado, una fuente embolígena, una enfermedad ateroembólica, un proceso linfoproliferativo o neoplásico con invasión retroperitoneal, un mieloma múltiple, etc.
Por último, deberíamos hacer una mención especial al fracaso renal que aparece en el estadio final de muchos pacientes terminales y de lo fútil que resulta aplicar medios diagnósticos y terapéuticos más allá de lo meramente paliativo para mejorar su confort.
4.2 Análisis bioquímicos de urgencia.
4.2.1. Análisis básicos.
Incluyen la determinación en suero o plasma de creatinina, urea o nitrógeno ureico, iones mono y divalentes, pH y gasometría (venosa, capilar o arterial según el cuadro clínico), hematimetría con recuento leucocitario, además de una tira reactiva de orina. Dependiendo de las manifestaciones clínicas, también de urgencia se pueden solicitar las enzimas creatin-fosfocinasa (CK), lactodeshidrogenasa (LDH), amilasa o transaminasas. El estudio de coagulación se solicitará si prevemos la realización de una intervención quirúrgica, canalización de vía central o biopsia renal. Igualmente estará indicada si existe trombopenia, fallo hepático o sepsis.
4.2.2. Parámetros de funcionalidad.
Están encaminados a determinar si el riñón está respondiendo fisiopatológicamente a la inadecuada perfusión renal o si realmente existe daño en este órgano que impide su correcta función. La correcta interpretación de estos parámetros se enmarca en el escenario del paciente con oliguria que no se encuentra bajo la acción de diuréticos. En el fracaso renal agudo prerrenal traducen fundamentalmente el hiperaldosteronismo secundario y el estímulo de la hormona antidiurética o vasopresina (ADH). El primero, al actuar sobre los receptores inespecíficos para los mineralocorticoides, ubicados en las células principales del túbulo colector de la nefrona distal y del túbulo colector, favorece la reabsorción electrogénica de Na+ a través del canal epitelial de sodio (generando un potencial eléctrico negativo en la luz tubular) y favoreciendo indirectamente la secreción tubular de H+ y K+. El estímulo de la ADH actuando sobre sus receptores de las células de los túbulos colectores favorece la salida de agua a través de la acuaporina-2 desde la luz tubular a la célula y a través de acuoporina-3 y de la 4 desde el túbulo al intersticio y de aquí al torrente circulatorio. De toda esta respuesta fisiopatológica se da como resultado una orina con escaso contenido en sodio, con relativo elevado contenido en potasio y relativamente concentrada (con osmolalidad elevada).
La descripción de los parámetros que expresan funcionalidad queda detallada en la (Tabla 3). Para su cálculo debemos solicitar al laboratorio, además de los parámetros arriba mencionados, una determinación simultánea de iones urinarios (Na+, K+, Cl-), urea y creatinina. La osmolalidad en suero y orina (medida de forma indirecta por la variación en el punto de congelación y su comparación con unas soluciones de osmolalidad conocida a diferentes concentraciones, y expresada en miliosmoles por kilogramo) podrá ayudarnos en la categorización del fracaso renal. Su estimación a partir de las moléculas e iones más representativos puede ser sencillo en suero o plasma, pero más complicado en orina (ver luego). Si no se dispone de osmolalidad, la densidad relativa de la orina puede proporcionarnos una orientación: una densidad mayor de 1.018 se correlaciona con una orina concentrada y aquella próxima a 1.010 revela que la orina es isostenúrica (de osmolalidad similar al plasma).
Una vez llegado a este punto y si hemos descartado razonablemente la existencia de IRA prerrenal deberemos solicitar una prueba de imagen. De elección: ecografía abdominal.
4.3. Ecografía abdominal.
Al ser una prueba incruenta, relativamente económica e incluso realizable en la propia cabecera del paciente, se convierte en una “pepita de oro” en el algoritmo del diagnóstico diferencial de la insuficiencia renal. Los patrones con los que nos podemos encontrar se enumeran en la (Tabla 4) y se pueden apreciar en la (Figura 3) (paneles a, b, c y d).
En los casos de riñones pequeños e hiperecogénicos y de riñones con grandes quistes bilaterales y disminución del parénquima renal, nos encontraremos ante una enfermedad renal crónica que se encuentra en su estadio evolutivo de deterioro progresivo o bien, ante una reagudización de su insuficiencia renal. No es infrecuente enfrentarnos a un paciente por primera vez con la sospecha de IRA y tratarse de un enfermo con nefropatía crónica evolucionada desconocida por todos o ante un caso de poliquistosis renal autosómica dominante (desconocimiento de antecedentes familiares, padre legal diferente del natural o mutación de novo).
La dilatación de la vía excretora, para que ocasione IRA, deberá afectar a ambos riñones, a la vía excretora común o a un riñón siempre que este proporcione la mayoría o toda la función renal (por ser el otro riñón aplásico o hipoplásico, isquémico, anulado por un proceso inflamatorio u obstructivo, extirpado por causa tumoral, infecciosa, vascular o traumática). Aunque infrecuente, una obstrucción renal puede cursar sin dilatación significativa de sistemas. Esto se ha descrito en monorrenos funcionales de muchos años de evolución y en algún paciente añoso. Quizá esto se explique por la falta de distensibilidad de estos órganos.
La disminución en la ecogenicidad de las papilas renales se ha descrito en alguna nefropatía como en la nefritis intersticial inmunoalérgica. Sin embargo, consideramos a este signo como algo inespecífico.
La existencia de IRA parenquimatosa sin que encontremos una causa isquémica clara o tóxica exógena o endógena nos debe hacer contar con otras pruebas de laboratorio e incluso con el análisis histológico del riñón.
4.4. Pruebas de laboratorio y otras exploraciones complementarias.
4.4.1. El análisis urinario.
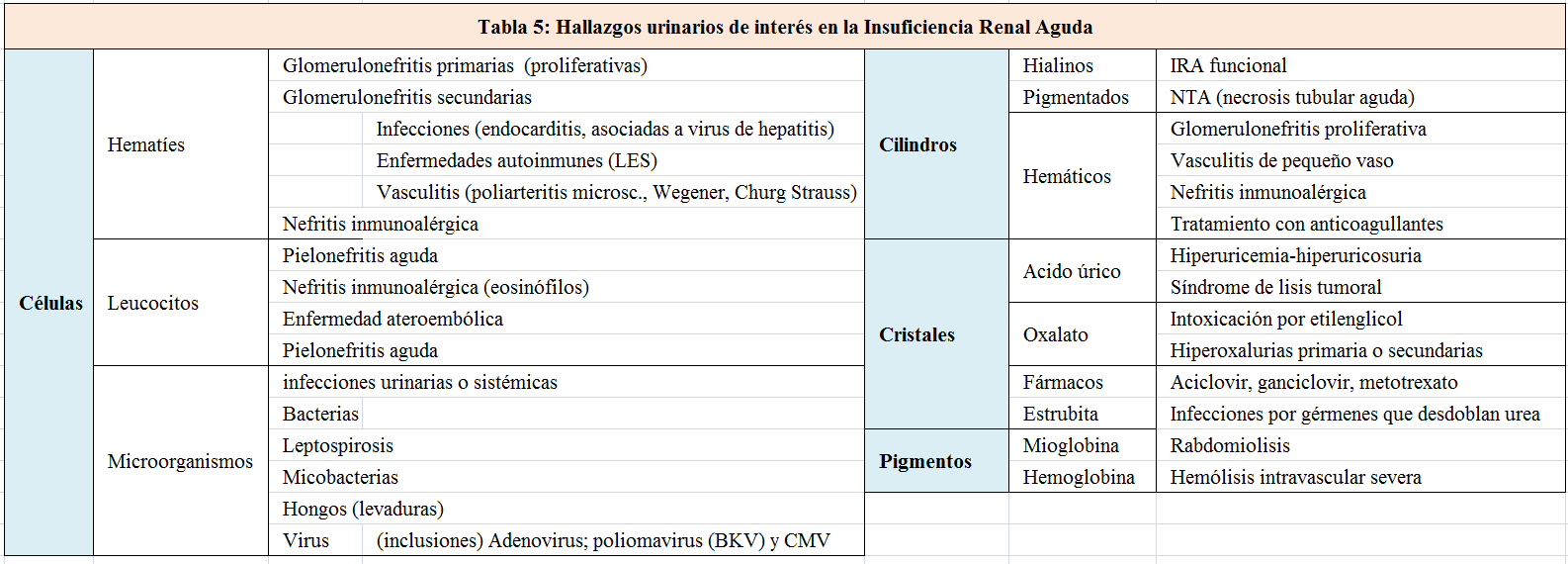
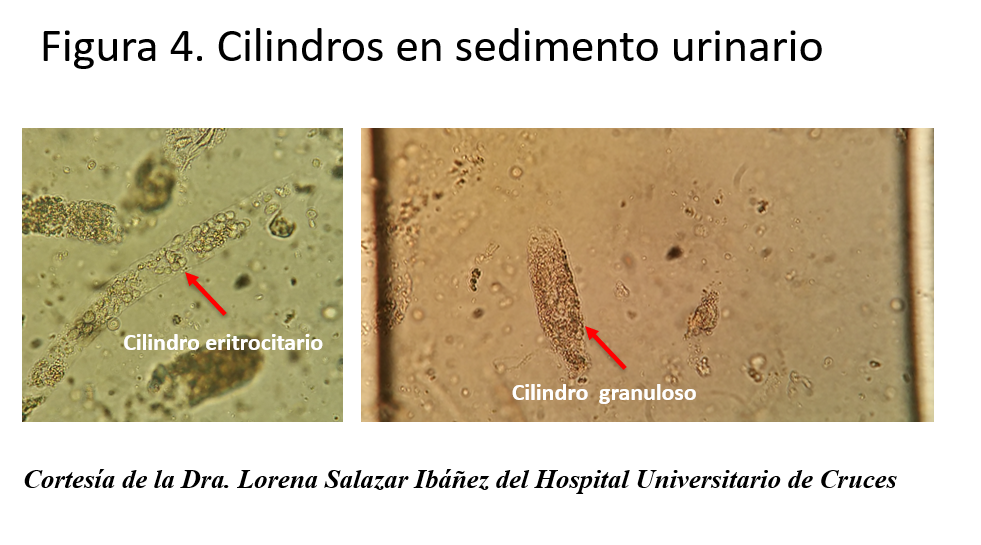
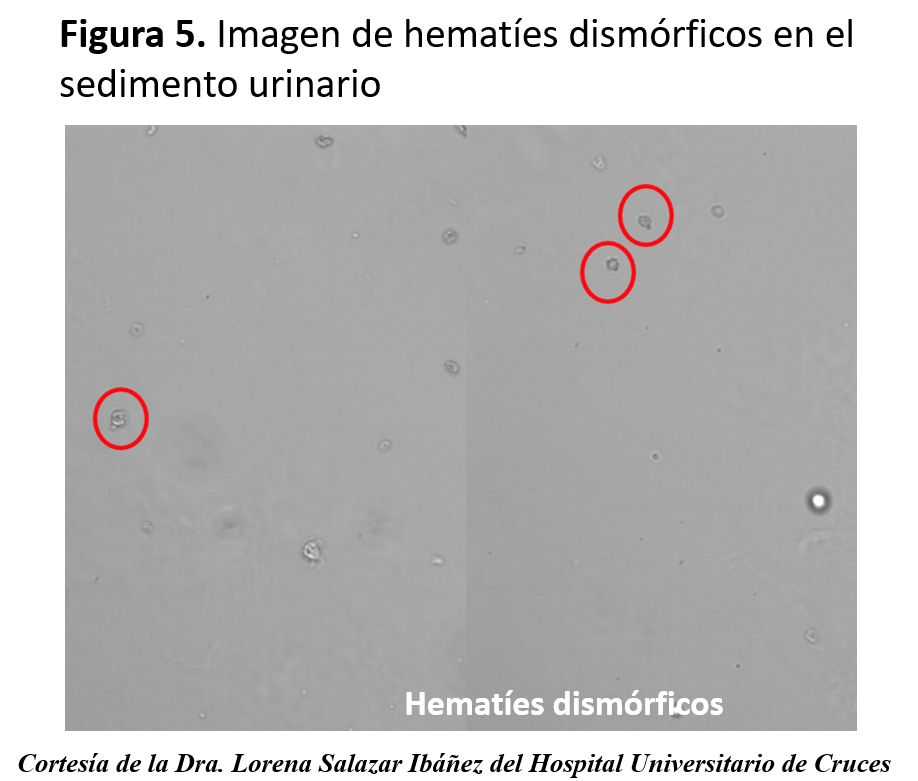
Los diferentes elementos que podemos encontrar en la orina se resumen en la (Tabla 5). El análisis microscópico de la orina nos puede alertar sobre la presencia de hematíes. Si éstos se acompañan de proteinuria significativa, de cilindros hemáticos y de una morfología alterada (con microscopía de contraste de fases), nos orienta hacia el origen glomerular de la enfermedad, como por ejemplo una glomerulonefritis primaria o secundaria a vasculitis, enfermedad del tejido conectivo o proceso infeccioso. La presencia de eosinófilos en orina (con la correspondiente tinción de Wright, tras tamponar la orina) puede apoyar el diagnóstico de una nefropatía intersticial alérgica. Sin embargo, los eosinófilos en orina se pueden observar en la enfermedad ateroembóloica y en la pielonefritis aguda. La existencia de cristales de oxalato puede orientarnos, según el contexto, a una intoxicación por etilenglicol. Los cilindros renales en IRA funcional son claros, hialinos, y se producen por la precipitación del uromucoide de Tamm Horsfall en una orina concentrada; mientras que en una NTA son pigmentados, marronáceos y con células epiteliales de descamación. Los cilindros pueden contener hematíes en las glomerulonefritis proliferativas y leucocitos en la nefritis intersticial alérgica. En la (Figura 4) se pueden observar imágenes de cilindros y en y la (Figura 5) hematíes dismórficos.
4.4.2. Pruebas serológicas.
La detección de anticuerpos anticitoplasma de neutrófilo (ANCA) asociados con determinadas vasculitis de pequeño vaso, como la poliangeitis microscópica, la angeítis granulomatosa o la granulomatosis alérgica puede ser de utilidad en su diagnóstico y en la evolución y respuesta al tratamiento. Se objetivan por inmunofluorescencia indirecta de los sueros con neutrófilos normales o mediante ELISA contra el antígeno específico: El patrón C-ANCA (citoplasmática granular) es el de la inmunofluorescencia cuya especificidad antigénica casi siempre corresponde a la proteinasa 3 (PR3); mientras que la del patrón P-ANCA (perinuclear) lo suele hacer con la mieloperoxidasa (MPO). El primer patrón es positivo en el 80% de la angeítis granulomatosa, en el 30% de la poliangeitis microscópica, en el 30% de la glomerulonefritis extracapilar idiopática pauci-inmune y en el 35% de granulomatosis alérgicas. Mientras que el segundo patrón lo es en el 50% de la poliangeitis microscópica, 50% de la glomerulonefritis extracapilar, 35% granulomatosis alérgicas y en otros procesos autoinmunes como la artritis reumatoide, hepatopatías autoinmunes y enfermedades intestinales inflamatorias. Los anticuerpos antinucleares, especialmente anti-DNA, y anti-Scl70 (antitopoisomeraasa I) y anti RNA polimerasa III, se analizan para la evaluación del LES y de la esclerodermia, respectivamente. El síndrome antifosfolípido, raramente causará fracaso renal agudo, pero existe una presentación catastrófica que presenta necrosis distales, miocárdicas y fallo renal. Lo sospecharemos ante antecedentes de trombosis, abortos repetidos u otras alteraciones más inespecíficas y un tiempo parcial de tromboplastina alargado: La sospecha clínica justificará solicitar títulos de anticardiolipina, Beta-2 glicoproteína y anticoagulante lúpico. Los anticuerpos anti-membrana basal glomerular ante la sospecha de síndrome de Goodpasture, completarán el estudio. Algunas pruebas serológicas en relación con procesos infecciosos como la legionella o leptospirosis, o serología de virus, pueden solicitarse según el contexto clínico o epidemiológico del paciente con IRA.
4.4.3. Análisis de proteínas.
La electroforesis del plasma e inmunofijación y la cuantificación de cadenas ligeras en orina (búsqueda de proteinuria de Bence-Jones) estarán indicadas ante un fracaso renal de causa no aclarada o ante aquel que se presenta con hipercalcemia o anemia desproporcionada. En algunos mielomas, especialmente en los de cadenas ligeras, podemos no observar pico monoclonal en suero y solamente aparecer la cadena ligera en orina. Ya que si esta no circula polimerizada y lo hace como monómero o como dímero (22 o 44 kDa, respectivamente) atraviesa con facilidad el filtro glomérulo-capilar. El ensayo Freelite® está compuesto de dos pruebas inmunodiagnósticas sensibles y específicas para medir cadenas ligeras libres kappa (κ) y lambda (λ). Su utilización ha mejorado el diagnóstico de gammapatías de cadenas ligeras y de amiloidosis primaria y la utilizamos para monitorizar el tratamiento cuando empleamos dializadores con membrana de alto poro en hemodiálisis para su tratamiento.
4.4.4. Análisis hematológicos.
Un frotis de sangre nos puede identificar la existencia de esquistocitos, propios de un síndrome hemolítico urémico (SHU) o púrpura trombocitopénica (PTT), o hipertensión arterial maligna. Trombopenia, anemia (con reticulocitosis y haptoglobina disminuida) y elevación de LDH en suero, se presentan en estas enfermedades microangiopáticas. En este sentido el antecedente de infección gastrointestinal por Escherichia coli enteropatógeno O157 o Shigella (síndrome Hemolítico Urémico típico), antecedentes familiares (mutaciones relacionadas con la cadena del complemento o anticuerpos contra factores reguladores –Síndrome Hemolítico Urémico atípico primario-) y causas de SHU atípico secundario a infecciones (neumococo, gripe A- H1N1, citomegalovirus, VIH), neoplasias, embarazo (síndrome de HELLP, hígado graso del embarazo) o la toma de determinados fármacos inmunosupresores como tacrólimus, nos pondrán sobre aviso. Una actividad disminuida (<5-10%) de la enzima metaloproteinasa ADAMS-13 apoyará el diagnóstico de púrpura trombopénica trombótica (PTT).
Por último, en ocasiones se requerirá buscar la existencia en sangre periférica y médula ósea de células tumorales para llegar al diagnóstico de leucemias, linfomas y de mieloma múltiple mediante análisis citológico, de inmunofenotipo, genético e histológico.
4.4.5. Estudios microbiológicos.
Estudios encaminados a confirmar determinadas infecciones como leptospira, legionella, enterobacterias (y serotipo de E. coli si procede), hemocultivos seriados ante sepsis evidente o infecciones más larvadas como endocarditis o absceso oculto, y pruebas serológicas víricas y de cultivo según la clínica concomitante.
4.4.6. El gap osmolar.
El gap osmolar en suero nos podrá ayudar ante la sospecha de intoxicaciones con moléculas de peso molecular bajo, como es el caso del etilenglicol (presente en líquidos anticongelantes y de refrigeración), isopropanol, acetona, etanol y metanol (alcohol de quemar). Consiste en calcular la diferencia entre la osmolalidad medida con un osmómetro y la estimada a través del cálculo con las moléculas más abundantes y de bajo peso molecular que habitualmente analizamos. La osmolalidad se suele medir bien por la variación del punto de congelación (a más osmolalidad disminuirá el punto crioscópico) o por la variación en la presión de evaporación. La estimación de la osmolalidad se calcula de la siguiente forma:
Osm (mOsm/Kg)= 2[Na (mEq/L)]+[glucosa (mMol/L)] +[Urea (mMol/L)]
Osm (mOsm/Kg)= 2[Na (mEq/L)]+[glucosa (mg/dL)]/18 +[Urea (mg/dL)]/6
Osm (mOsm/Kg)= 2[Na (mEq/L)]+[glucosa (mg/dL)]/18 +[BUN (mg/dL)]/2,8
Se multiplica por 2 la concentración de Na+; el cloro y el sodio son iones fuertes. Se considera tanto el NaCl no disociado (15% a pH 7,40) como cada ión de Cl- y cada ion de Na+ disociados (85%). Es decir, por cada átomo de Na+ habrá: 0,15[NaCl]+0,85[Na+]+0,85[Cl-]. Lo que resulta en 1,85 partículas (iones más moléculas). Como la concentración de una sustancia en el agua plasmática es igual a su concentración en plasma entre 1 - Φ (siendo Φ=0,0107*proteínas plasmáticas totales en gr/dL), resultando para una concentración de proteínas de 7 g/dL el siguiente ajuste: 1,85·[Na]/0,925=2·[Na].
Donde, CwA es la concentración de una sustancia “A” en el agua plasmática y CpA su concentración medida en plasma. El valor normal de la osmolalidad es 280-295 mOsm/Kg
Si incluyésemos en la fórmula el etanol dividiríamos por 4,6 su concentración en mg/dL (p.m. del etanol 46 Da), la de etilenglicol por 6,2 (p.m. 62 Da), la de isopropanol por 6 (p.m. 60 Da) y la de metanol por 3,2 (p.m. 32 Da). Esto nos permite si no conocemos la concentración del tóxico deducirla a partir del gap osmolar o bien sospechar la implicación de más de un tóxico si no nos cuadran las cuentas tras haber identificado un tóxico.
4.4.7. El examen de fondo de ojo.
El examen de fondo de ojo nos ayudará a la hora valorar una posible enfermedad ateroembólica (al visualizar émbolos de colesterol si la suelta de cristales y detritus de la placa de ateroma se producen en la aorta ascendente o callado antes de la salida de algún tronco braquiocefálico) o una posible endocarditis o la afectación vascular y de la papila en una hipertensión arterial con sospecha de hipertensión acelerada o maligna.
4.5. Pruebas de imagen diferentes a la ecografía.
Además de la ecografía, radiografía simple de abdomen y de tórax, y de huesos si procede, debemos considerar aquellas pruebas encaminadas a descartar o a demostrar patología vascular y uropatía obstructiva.
4.5.1. Para el despistaje de la uropatía obstructiva.
Están encaminadas fundamentalmente a descartar la existencia de una obstrucción urinaria no detectada por la ecografía, o a la localización topográfica o diagnóstico etiológico de la uropatía obstructiva. En este sentido, la tomografía axial computarizada, la pielografía descendente (si se dispone de catéter de nefrostomía), la pielografía retrógrada y la cistografía nos facilitarán esta aproximación. La uro-resonancia magnética (en T2 apreciamos nítidamente el líquido) es una buena opción, ya que no precisa de la administración de ningún tipo de medio de contraste.
4.5.2. Para el despistaje de patología vascular.
Ante la sospecha de infarto renal, la arteriografía renal será la prueba de elección. Si se confirma la existencia de trombo o émbolos se puede mantener el catéter en la arteria renal e infundir fibrinolíticos localmente durante las primeras 24 horas. La flebografía estará indicada ante la difícil sospecha de trombosis venosa renal. La tomografía axial computarizada helicoidal, actualmente con los multi-detectores de 64 cabezales, puede igualmente proporcionar valiosa información, sin los riesgos de las anteriores pruebas. La ecografía Doppler puede en ocasiones ayudarnos en la toma de decisiones de indicar una arteriografía o una flebografía. Los estudios isotópicos pueden aportar datos diagnósticos de patología vascular de forma incruenta, pero hay que considerar que nos pueden hacer perder tiempo. Es recomendable ser enérgico en la solicitud de la prueba complementaria, procurando que ésta se realice de forma rápida y fiable con alta sensibilidad y especificidad; ya que la actitud terapéutica debe instaurarse de forma precoz. La arteriografía renal y abdominal puede poner de manifiesto pequeños aneurismas en el caso de la panarteritis clásica macroscópica.
4.6. Biopsia Renal
La biopsia renal es una práctica poco cruenta en la actualidad, pero no exenta de riesgos. La modalidad preferida es la biopsia percutánea. Actualmente se realiza con control ecográfico y dirigida a través de guía, efectuando el disparo de forma automática. Con todo ello se ha conseguido una importante reducción de las complicaciones con buena rentabilidad diagnóstica. En ocasiones especiales se puede optar por la biopsia quirúrgica –a cielo abierto- o incluso por la biopsia transyugular. Esta última se reserva para pacientes con alteraciones de la coagulación, muy obesos o cuando se quiera realizar concomitantemente una biopsia hepática.
La muestra deberá incluir fragmentos de corteza y de médula, fijando el fragmento mayor en formol e incluyéndolo en parafina; para después teñir cortes con hematoxilina eosina, PAS, plata metenamina de Jones (para resaltar membranas basales), tricromico de Masson (que tiñe en azul/verde el colágeno y en rojo la fibrina) y Rojo Congo y tioflavina (para amiloide). Un fragmento (de corteza) se congelará para las técnicas de inmunofluorescencia con inmunoglobulinas, cadenas ligeras, complementos, fibrinógeno y properdina. Un tercer fragmento también de cortical se fijará con glutaraldehído, seguido de postfijación en osmio e inclusión con resina epoxi para el corte ultrafino y observación a microscopía electrónica. A la muestra de parafina se pueden añadir técnicas de inmunohistoquímica como el componente P del amiloide, antígeno SV-40 de poliomavirus, C4d del complemento y otros muchos antígenos más.
La biopsia en el paciente intubado y conectado a respirador puede ser algo más complicada. Se ha descrito una técnica que comprende la desconexión del respirador. En nuestra experiencia, creemos que con la técnica que hemos descrito arriba y colocando al paciente en decúbito lateral, se puede obviar la desconexión del respirador, ya que la oscilación del riñón es mínima.
La indicación de la biopsia renal en fracaso renal agudo no se debe limitar a la curiosidad diagnóstica y debe conllevar implicaciones terapéuticas. Recordemos que en la mayoría de los casos nos enfrentamos a una necrosis tubular aguda. Por lo tanto, está indicada cuando sospechemos otra etiología (vasculitis de pequeño vaso, glomerulonefritis, nefritis intersticial inmunoalérgica, amiloidosis, etc). O bien, la orientemos hacia el pronóstico analizando el grado de afectación –y la variante histológica- de determinada enfermedad sistémica (v. gr. LES). En ocasiones se indica ante la sospecha de NTA prolongada en el tiempo que no recupera. En este último caso nos podremos encontrar con un diagnóstico inesperado, con una necrosis cortical o con una necrosis tubular en resolución. No es infrecuente ver (sobre todo en el contexto del paciente crítico) NTA que se recuperan tras dos o incluso tres meses de evolución. Períodos más prolongados sólo excepcionalmente darán lugar a recuperación funcional. La biopsia está especialmente indicada en IRA del paciente con trasplante renal para establecer la diferencia entre NTA, toxicidad por inmunosupresores y rechazo, y en este último caso, para clasificar el estadio de rechazo celular o humoral, utilizando los criterios de la clasificación de Banff.
4.7. Nuevos Marcadores de Daño Renal
En los últimos años se está avanzando en la detección de marcadores de daño renal que permitan: 1) realizar un diagnóstico precoz del daño renal para permitir anticipadamente una actuación; 2) establecer un diagnóstico diferencial entre diferentes patologías; y 3) establecer una estratificación pronóstica. Entre estos marcadores se encuentran moléculas que se producen en otras células del organismo y que son filtradas, como la cistatina C y la beta-2 microglobulina , o bien otras que se liberan por el tejido renal a la sangre o la orina. La cistatina-C es una proteína que se produce por todas las células nucleadas del organismo, que se filtra libremente en riñón y se reabsorbe completamente en los túbulos proximales. Se mide mejor por inmuno-nefelometría. No depende de la masa muscular como la creatinina y con filtrados elevados se correlaciona mejor que ésta con el filtrado glomerular. No se utiliza de forma rutinaria y puede tener especial interés en pacientes cirróticos. Moléculas como la lipocalina asociada a la gelatinasa de neutrófilo (NAGL), molécula de daño renal (Kim-1) y la Interleucina-18 urinaria y la 6 en plasma, Netrina-1 en orina, NHE 3 en orina y enzimas citosólicas (GST) en orina, se están evaluando en diferentes contextos de IRA, pero es todavía pronto para concluir su utilización universal [18] [19]. En el 2020, se publicaron por la ADQI las recomendaciones para utilizar biomarcadores en la IRA [20]. La asociación de marcadores de daño renal para estratificar el riesgo y poder actúar como son tissue inhibitor of metalloproteinases 2 (TIMP-2) e insulin-like growth factor binding protein 7 (IGFBP7) resultaron efectivos para prevenir la IRA en grupos de riesgo en cirugía mayor y cardiaca. Los biomarcadores que disponen de ensayos comerciales validados para su uso son: NGAL, cistatina C, L-FABP, TIMP-2/GFBP-[21].
5. Tratamiento de la IRA
El tratamiento en su conjunto se encuentra revisado en las Guías de Actuación del Fracaso Renal Agudo promovidas por la Sociedad Española de Nefrología y dirigidas por FJ Gainza y F Liaño [22]
5.1. Tratamiento Médico
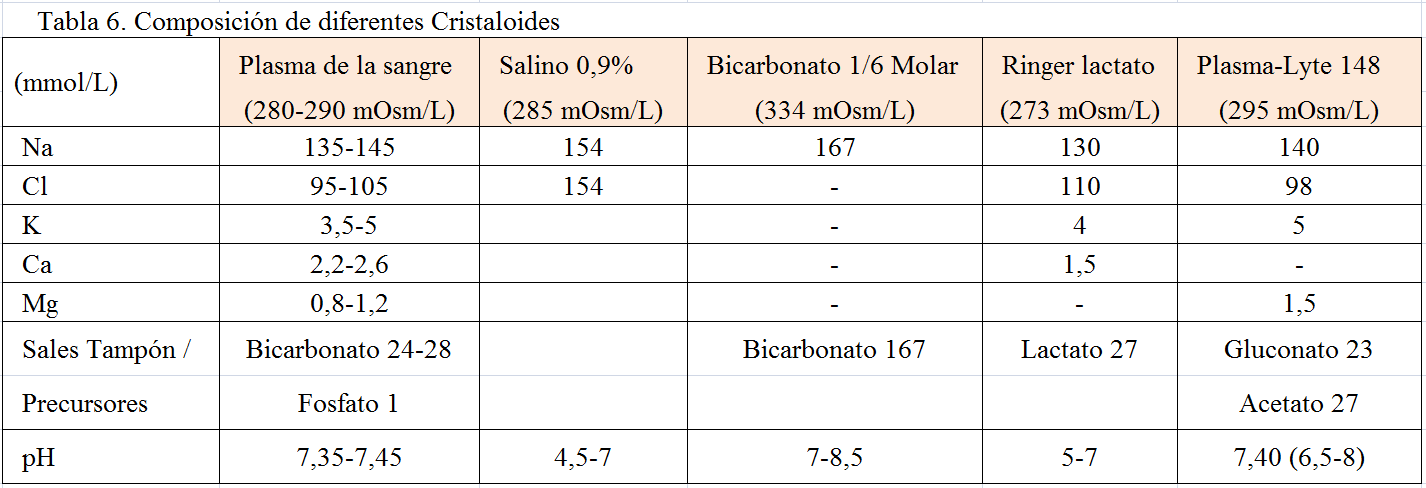
El primer eslabón en el tratamiento de la IRA es actuar sobre la causa. En el fallo prerrenal producido por deshidratación conviene la administración de cristaloides (Tabla 6) (suero salino fisiológico a concentración 0,9% o hipotónica al 0,45% o soluciones balanceadas como Ringer® lactato o Plasmalyte®) o con concentrado de hematíes en hemorragias severas. Es importante analizar frecuentemente iones en sangre y pH, con especial atención en el potasio. En hidrataciones cuantiosas se recomienda monitorizar la presión venosa central (siendo una buena diana: 8 mm Hg= 10 cm H2O).
El cuadro de sepsis se presenta desde las unidades de urgencia y plantas de hospitalización, por lo que los equipos sanitarios deben estar alerta y actuar con celeridad, ya que la antibioterapia empírica dirigida, la resucitación volumétrica y la elevación de la tensión arterial media [(TAS+2TAD)/3] por encima de 70 o posiblemente incluso por encima de 80 mmHg mejorarán la supervivencia del paciente. No obstante la necesidad de tratamiento renal sustitutivo es alta y en aquellos pacientes que la necesitan la mortalidad es más elevada. El pronóstico depende de la severidad del cuadro y de la reversibilidad de la IRA. En casos severos que precisan tratamiento sustitutivo y sin recuperación la mortalidad puede aproximarse al 50% [23].
En el fallo hepatorrenal [8], la paracentesis para disminuir la presión intraabdominal junto con administración de albúmina y terlipresina presentan los mejores resultados. En casos refractarios, puede estar indicada la colocación de un shunt Transyugular Portosistémico Intrahepático (TIP).
En la IRA parenquimatosa por NTA se ha ensayado con mayor menor éxito en animales un sinfín de tratamientos, que en el ser humano no han resultado ventajosos como son los antagonistas de la endotelina, péptido natriurético atrial, dopamina, calcio-antagonistas, diuréticos del asa, anticuerpos, etc. En las enfermedades autoinmunes (vasculitis, glomerulonefritis extracapilar pauci-inmune, LES) está indicada la utilización de inmunosupresores (glucocorticoides y ciclofosfamida). En la nefritis inmunoalérgica por fármacos el empleo de esteroides parece recortar la evolución y disminuir la fibrosis residual que puede quedar después de ceder la actividad inflamatoria.
En la IRA obstructiva o posrrenal debe entrar el urólogo (con o sin la ayuda del radiológo) para resolver o paliar la obstrucción con sondaje uretral, cateterización ureteral, nefrostomía, litotomía o lo que proceda. Conviene vigilar el estado volémico y electrolítico que sigue a la desobstrucción, ya que en el caso de azotemia marcada se suele producir una poliuria osmótica que puede acabar en deshidratación e hipokalemia. Otras veces se ha producido un daño tubulointersticial que puede hacer perder agua y/o sal de forma inconveniente.
5.2.Tratamiento Renal Sustitutivo
5.2.1.Indicaciones para el inicio de la terapia de sustitución
Existen situaciones en que la depuración extracorpórea está claramente indicada, como son el manejo de los líquidos (oliguria/anuria, necesidad de aporte elevado –nutrición- u otras situaciones de sobrecarga hidrosalina o edema de pulmón), los problemas del medio interno (hiperpotasemia -K>6,5 mEq/L-, alteraciones del sodio y acidosis metabólica severa -pH < 7,2-) y la aparición de alteraciones clínicas secundarias a la uremia (miopatía, encefalopatía o pericarditis). Sin embargo, aun cuando es evidente que los problemas mencionados requieren por su severidad una actuación decidida para su corrección, existen varios estudios retrospectivos y no aleatorizados en la literatura que apuntan a la posibilidad de que un inicio precoz del tratamiento pudiera tener un efecto positivo sobre la evolución de la IRA, lo que nos lleva a plantear la depuración no como mantenimiento del paciente sino como tratamiento que pueda acortar su duración y mejorar el pronóstico del paciente.
5.2.2. Variantes Técnicas de Tratamientos Renal Sustitutivo
5.2.2.1. Diálisis Peritoneal (DP)
La DP, aunque de gran simplicidad, ha topado con el escollo de incrementar la presión intra-abdominal (comprometiendo así la función respiratoria). Esta modalidad está contraindicada ante la existencia de cirugía abdominal previa y en numerosas ocasiones resulta insuficiente para controlar el volumen o la situación metabólica del paciente crítico. Ha quedado por tanto relegada al manejo de la IRA en pediatría (síndrome hemolítico urémico, etc.) y en países sin recursos económicos o en vías de desarrollo. La pandemia del 2020 de la COVID-19 ha vuelto a poner sobre la mesa esta alternativa cuando no se dispone en las unidades de críticos, sobrecargadas y repentinamente ampliadas, de otras posibilidades terapéuticas.
5.2.2.2. Hemodiálisis Intermitente (HDI)
La HDI hace décadas utilizaba un líquido de diálisis (baño) cuyo precursor de tampón era el acetato, así que la inestabilidad hemodinámica en el paciente grave estaba casi garantizada. Hoy en día, se ha generalizado la utilización de tampón bicarbonato. Los monitores de HDI poseen reguladores de conductividad, permitiendo subir la conductividad a 14,5-15 mS/cm para elevar la concentración de Na+ y así mejorar la tolerabilidad hemodinámica del paciente. Descender moderadamente la temperatura del baño de diálisis (35,5ºC) permite igualmente mejorar la estabilidad al favorecer el rellenado vascular. Los modernos monitores permiten realizar técnicas convectivas, incluso generando líquido de reposición de suficiente calidad en línea. Un avance de los más modernos monitores es la posibilidad de medir la dosis de diálisis (Kt y Kt/VUREA) mediante la incorporación del cálculo de dialisancia iónica y del cálculo de las variaciones de la volemia por variaciones en el hematocrito. Hoy en día, existen unidades de tratamiento de agua (filtración+decalcificación+decloración+ósmosis inversa) portátiles que se pueden acercar a pie de cama en cualquier lugar que disponga tan solo de agua de red potable y desagüe.
5.2.2.3. Técnicas de Depuración Continuas (TDC)
5.2.2.3.1. Historia y generalidades
La primera técnica continua en emerger fue la hemofiltración arteriovenosa continua (HFAVC), que no precisaba bomba de sangre, al circular ésta a través de un dializador con una membrana de alta permeabilidad al agua. La sangre discurría de una manera similar a como lo hace por nuestros tejidos. La depuración se basaba en la ultrafiltración espontánea no controlada. Esta modalidad de tratamiento supuso una revolución, pero adolecía de dos importantes problemas: 1) el ultrafiltrado dependía de la presión arterial media del paciente y cuando ésta era insuficiente (hipotensión) el tratamiento no era eficaz; 2) la depuración se basaba en la convención (remedando a nuestros glomérulos) pero al no existir túbulos que recuperen -desde lo filtrado- lo valioso, debemos reponer parte de lo que se ultrafiltraba con líquidos lo más fisiológicos posibles. El Ringer lactato resultó durante casi una década una alternativa útil.
El segundo paso fue el empleo de bombas para mantener un circuito de vena a vena. Inicialmente se emplearon bombas aisladas, pero pronto se pasó a utilizar parte de los equipos de HDI, de los que se detraían los sistemas hidráulicos que aquí no interesaban. Aprovechando alguna de sus alarmas y sistemas de seguridad, como los medidores de presión, detectores de fuga de sangre o de entrada de aire al circuito. La reposición del ultrafiltrado continuó siendo un problema, produciéndose retrasos obligados y multitud de errores, con lo que los episodios de inestabilidad hemodinámica (precisamente el problema que teóricamente pretendíamos evitar con su uso) eran frecuentes. Se comenzó a utilizar de forma opcional la diálisis lenta y así se complementó la hemofiltración veno-venosa continua (HFVVC) con la hemodiafiltración veno-venosa continua (HDFVVC).
El tratamiento renal sustitutivo de la IRA en las unidades críticas (UCI) no debería diferir de aquel que es aplicado en las unidades médicas y sin embargo, dada su especial vulnerabilidad, estos pacientes presentan una baja tolerancia a tratamientos de depuración extracorpóreos. La inestabilidad hemodinámica ha sido tradicionalmente un serio escollo debido a la escasa tolerancia a modificaciones rápidas de volumen y del medio interno que caracterizan una sesión de HDI. En ocasiones, la única alternativa para el tratamiento era la DP. Sin embargo, la extensión de las TDC en la década de los ochenta y noventa ha cambiado totalmente el escenario y no solo desde el punto de vista técnico, sino también sobre las indicaciones, momento de inicio o incluso quien realiza la indicación y el control del tratamiento.
5.2.2.3.2. Monitores de TDC
Los modernos monitores permiten cualquier modalidad terapéutica, disponen de control de volumen gravimétrico, tomas de presiones (entrada, filtro, retorno y efluente) y alarmas homologadas (aire, espuma, fuga de sangre, horquilla de presiones y alerta de riesgo de coagulación de sangre en el circuito). Todo ello junto con un software que las convierte en amigables para los profesionales que las manejan. En conjunto disponen al menos de 4 bombas peristálticas y una de émbolo (para heparina como anticoagulante). Además, las más modernas incorporan otras para poder utilizar citratos como anticoagulante. En nuestro medio las de mayor implantación (por orden alfabético) son: AQUARIUS (Baxter- Edwards), MULTIFILTRATE (Fresenius) y PRISMA FLEX (Baxter).
Gracias a estos avances, el uso de las TDC ha desplazado en las unidades de críticos a la HDI y relegado a la DP a un papel casi anecdótico. Esta realidad queda reflejada en el gran estudio multicéntrico internacional publicado Uchino et al en el que se muestra que a los pacientes de UCI que padecen IRA se les trataba en un 80% de los casos con TDC, en un 17% con HDI y tan solo en un 3% con DP.
Posteriormente, se han descrito un conjunto de modalidades terapéuticas, a caballo entre las TDC y las intermitentes, como son las técnicas mixtas, que en la literatura podemos identificar como diálisis de baja eficiencia y sostenida (SLED: sustained low efficiency dialysis), diálisis diaria ampliada (EDD: extended daily dialysis) y también como diálisis lenta continua (SCD: slow continuous dialysis).
5.2.3. Selección de la terapia de depuración
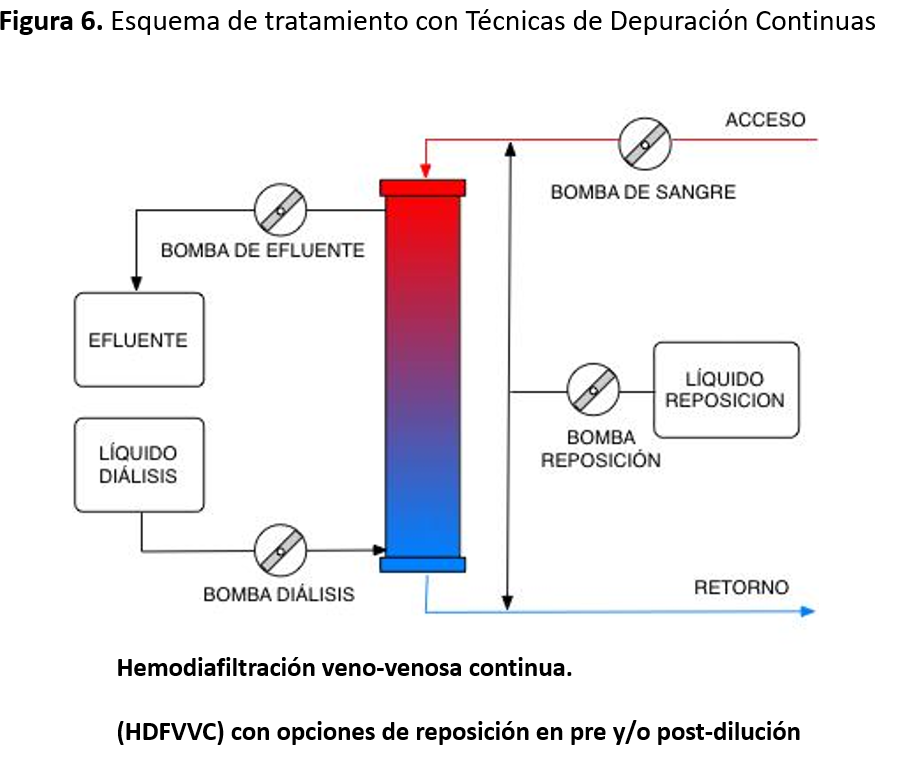
La HDI es capaz de eliminar moléculas pequeñas (como urea, creatinina o gentamicina), mediante la diálisis sustentada en el principio de la difusión, explicado por la primera ley de Adolf Fick y la fórmula de Einstein-Stokes para la difusión Browniana. Las TDC, representadas principalmente por la hemofiltración (HFVVC), son capaces de eliminar además moléculas de tamaño medio (varios miles de peso molecular) mediante un proceso de arrastre con el ultrafiltrado producido por un juego de presiones (convección) a través de la membrana del hemofiltro. Podemos combinar diálisis y filtración añadiendo difusión en la hemodiafiltración (HDFVVC-) como se muestra en la (Figura 6), con lo que aumentamos la eliminación de moléculas pequeñas. Merece la pena destacar que, si aplicamos modalidades sólo con diálisis y utilizamos membranas alto flujo, de medio (middle cut off) y de alto punto de corte (las denominadas HCO- High-Cut-Off)) se produce una filtración interna a la entrada del hemofiltro y una retrofiltración a la salida de éste, con lo que se consigue aclaramiento convectivo (no controlable) además del difusivo.
Aunque estas modalidades pueden eliminar algunas sustancias mediante adsorción, existen otras técnicas más específicas para potenciar este mecanismo físico, como la hemoadsorción de con citosorbentes o de endotoxinas a través de un cartucho, como por ejemplo polimixina o la plasma-filtración con adsorción (CPFA), modalidad de depuración en la que el plasma del paciente obtenido por plasma-filtración se hace pasar por un cartucho de resinas hidrófobas.
Son varios los indicios y la base teórica para pensar que las técnicas continuas son mejor toleradas que las intermitentes desde el punto de vista bioquímico y hemodinámico y que, además, también mejoran la tasa de supervivencia del paciente. En algunos estudios se encuentre una supervivencia similar entre TDC y HDI [24][25], pero la primera puede resultar ventajosa en los pacientes más graves si consideramos: a) su mayor capacidad para eliminar grandes volúmenes sin alterar la estabilidad hemodinámica del paciente, b) el hecho de que la dosis total aplicada sea más fácilmente conseguible; c) el que su aplicación sea menos demandante en términos de tecnología y d) finalmente el que, al añadir convección como mecanismo de depuración, proporcionemos eliminación de moléculas de tamaño medio, entre las que se encuentran algunos mediadores de la respuesta inflamatoria sistémica. En este escenario, las técnicas mixtas (SLEDD o SCD) se destacan como la solución más prometedora, dado que combinan lo mejor de las técnicas contínuas y de las intermitentes, aunque por el momento no existen trabajos que aborden la comparación de estas variantes.
5.2.4. Dosis de depuración y supervivencia
Otro aspecto fundamental en el avance científico ha perseguido definir la dosis mínima para disminuir la alta tasa de mortalidad de los pacientes con fallo multiorgánico. En el clásico trabajo de Ronco et al [26], se estableció la “cifra mágica” de convección de 35 mL·kg-1·h-1. Aquí, se analizó la supervivencia a los 14 días de finalizada la hemofiltración, utilizando membrana de polisulfona y reposición con líquido con lactato en post-dilución (post-filtro) y se pasó de una supervivencia del 41% al 57 y 58% con 20, 35 y 45 mL·kg-1·h-1, respectivamente. Sin embargo, en este estudio, existían pocos pacientes sépticos (entre un 11 y 14%, por grupos aleatorizados) y el análisis en este subgrupo de pacientes no resultó estadística ni clínicamente significativo. En el estudio de Saudan et al [27] se demostró un aumento en la supervivencia cuando a una dosis de ultrafiltrado normal (no de alto volumen) se le añadía difusión (HDFVVC), concluyendo que la supervivencia mejora, no ya con la convección, sino con la dosis de aclaramiento de pequeñas moléculas.
El estudio multicéntrico Norteaméricano (ATN) [28] no ha conseguido demostrar ventajas con mayores dosis (20 vs. 35 mL·kg-1·h-1 en continuas o HDI 3 sesiones por semana vs. 6 sesiones), aunque ya ha sido contestado por diferentes grupos, entre ellos por el grupo español, quienes recomiendan una aproximación dinámica que ajuste la dosis en cada momento de la situación evolutiva del paciente. Más recientemente se ha concluido el estudio Australiano y Neozelandés (RENAL) [29] en el que la supervivencia a 60 días y a 90 es idéntica si se aplica una dosis estándar (25 mL·kg-1·h-1 ) frente a una dosis intensiva (40 mL·kg-1·h-1)
En este sentido, también destacamos el elegante trabajo de Helmut Schiffl et al donde la HDI diaria mejoraba la supervivencia en comparación con la aplicada en esquema clásico cada dos días. Resultando ésta un 72 y 54% a las dos semanas, respectivamente. En la primera, la dosis de aclaramiento ajustado al tiempo y al volumen de distribución de la urea (Kt/V) prácticamente dobló a la pauta convencional. También, si optamos por HDI, parece que la diálisis más intensiva, con mayor concentración de sodio, mayor Kt/V y aplicada con más frecuencia puede dar buenos resultados [30]. Un Kt de 40L para mujeres y de 45L para varones.
5.2.5. Problemas de aplicación y complicaciones de uso
Para garantizar una buena realización de estas técnicas se hace necesario un buen acceso vascular. Es necesaria una adecuada terapia anticoagulante y que sea individualizada para cada paciente. En concreto que permita, en la medida de lo posible, mantener el filtro sin coágulos, así como las líneas extracorpóreas y los catéteres, y evitar una anticoagulación sistémica que pueda favorecer hemorragias. La alternativa más utilizada es la Heparina sódica a dosis bajas (5-10 U por kg de peso y hora), pero debemos aprender a manejar otras alternativas como la prostaciclina [31] y los citratos.
Otro aspecto crucial a la hora de asegurar el buen funcionamiento de la técnica y la ausencia de problemas es una adecuada formación del personal que se encargue de su cuidado; debemos considerar que en numerosas ocasiones será el personal de enfermería de la UCI (sin formación previa en técnicas de depuración renal) quién sustente esta función y, en estas condiciones, un programa de entrenamiento adecuado debería ser contemplado.
Las complicaciones potenciales son diversas lo que obliga a ajustes frecuentes de tratamiento y a sopesar con rigor las indicaciones de estas técnicas. Aprovechando el término de reciente cuño, debemos evitar el “dialtrauma” [32].
Para completar el estudio de este capítulo recomendamos las siguientes fuentes: [33][34][35][36][37][38][39][40].