Infecciones de la Vías Urinarias y de Trasmisión Sexual
Palabras clave
Pielonefritis, microbiota urinaria, cistitis, bactiriuria, prostatitis, epididimitis, infecciones por cateter urinario, transmisión sexual
INDICE
1. Introducción
2. Microbiota urinaria
3. Epidemiología. Factores de riesgo.
4. Clasificación.
5. Etiología.
6. Bacteriuria asintomática en adultos.
7. Cistitis no complicada
8. ITU recurrente
9. Pielonefritis aguda no complicada
10. Complicaciones de la pielonefritis aguda
11. ITU complicada
12. ITU en gestantes
13. ITU en ancianos
14. Prostatitis
15. Epididimitis
16. ITU asociada a catéter urinario.
17. Profilaxis antiinfecciosa en procedimientos urológicos
18. Infecciones de transmisión sexual
1. INTRODUCCIÓN
La relevancia de las infecciones bacterianas del tracto urinario (ITU) viene determinada por los siguientes hechos:
- Son infecciones de elevada prevalencia, pueden afectar a cualquier persona en cualquier rango de edad y género, tanto a nivel comunitario como hospitalario.
- Su diagnóstico es clínico, confirmable por tira reactiva o urocultivo, lo que hace posible iniciar un tratamiento antibiótico inmediato de forma empírica. La elección del antibiótico adecuado en el escenario actual de resistencias bacterianas, unido a la falta de desarrollo y comercialización de nuevos antibióticos, hacen clave la correcta toma de decisiones basadas en el conocimiento de la flora local y sus patrones de resistencia.
- Se conocen los principales factores de riesgo para su aparición y recurrencia, así como las medidas preventivas más eficaces.
2. MICROBIOTA URINARIA
En contra de lo que se pensaba hasta hace unos años, la orina humana en condiciones normales no es estéril: posee su propia microbiota o conjunto de microorganismos residentes, que pueden ser comensales, mutualistas o patógenos. Si bien la microbiota urinaria es menos abundante y diversa que en otras localizaciones de nuestro organismo (microbiota intestinal, vaginal, cutánea, etc), también se le atribuye un efecto beneficioso protector frente a determinados patógenos, a través de constituir una barrera física y contribuir al desarrollo de inmunidad.
La aplicación de nuevas técnicas de secuenciación genómica, que estudian el genoma microbiano o urobioma, y la utilización de medios de urocultivo no convencionales (por ejemplo, los que facilitan el crecimiento de anaerobios, bacterias de crecimiento más lento, etc), está permitiendo caracterizar de una forma más detallada la composición de la microbiota urinaria. Hoy en día se puede afirmar que la microbiota urinaria la componen principalmente bacterias, pero también hongos, virus y arqueas [1][2][3][4]:
- Bacterias. Existe un amplio rango de 20-500 especies bacterianas de los filos Firmicutes, Actinobacteria, Fusobacteria, Bacteroidetes, Proteobacteria, Chloroflexi, Spirochaetes, Synergistetes y Fibrobacteres. Los géneros más frecuentes en adultos sanos, tanto hombre como mujeres, son Prevotella, Escherichia, Enterococcus, Estreptococcus y Citrobacter.
- Hongos. La comunidad fúngica de la microbiota urinaria no ha sido tan bien caracterizada como la bacteriana en individuos sanos. No obstante, se han identificado Dothiodeomycetes, Saccharomycetes (Candida), Eurotiomycetes, Exobasidiomycetes y Microbotryomycetes.
- Virus. La mayoría de los virus identificados son bacteriófagos (virus que infectan bacterias), aunque también se han encontrado virus eucarióticos. Algunos ejemplos son el papilomavirus, el virus del moluscum contagioso, los poliomavirus JC y BK, algunos herpesvirus y anellovirus.
- Arqueas. La especie Methanobrevibacter smithii ha sido identificada como componente de la microbiota urinaria en algunos sujetos.
En la población general, esta microbiota urinaria sufre cambios “fisiológicos” en función de la edad y género, por ejemplo, predominan Lactobacillus en mujeres y Corynebacterium y Estreptococos en hombres. Hay un cuerpo creciente de evidencia que relaciona la “disbiosis” (cambios en la diversidad o cantidad de microbiota urinaria normal) con algunas patologías urológicas. Un ejemplo es la incontinencia urinaria de urgencia, donde hay una clara disminución de Lactobacillus frente a un aumento de Gardnerella, siendo más graves los síntomas en los pacientes que muestran menor diversidad microbiótica en su orina. También se está avanzando en el conocimiento del efecto de alteraciones de la microbiota y la aparición de otras patologías urológicas tan prevalentes como cáncer de próstata, cáncer de vejiga, cistitis intersticial, infecciones de transmisión sexual, prostatitis crónica, etc…[2][4].
Las especies bacterianas Lactobacillus y Estreptococos, que son bacterias ácido lácticas, se encuentran con frecuencia en íntima relación con el tracto urinario, y parecen ejercer un papel protector frente a las especies patógenas. El uso de antibióticos de amplio espectro puede afectar negativamente a esta microbiota urinaria, disminuyendo la flora beneficiosa y favoreciendo una selección de flora patógena, que podrá ocasionar síntomas de infección del tracto urinario (ITU).
3. EPIDEMIOLOGÍA. FACTORES DE RIESGO.
Las ITUs son las infecciones bacterianas más prevalentes, por lo que suponen una carga económica considerable. En Estados Unidos justifican el 15% de la prescripción antibiótica ambulatoria y aproximadamente 7 millones de visitas anuales al médico de atención primaria. Entre un 50-60% de mujeres adultas padecerán algún episodio de ITU sintomática a lo largo de su vida. Son la causa más frecuente de bacteriemia de origen comunitario, y responsables del 5-7% de las sepsis graves que requieren ingreso en UCI, con posible evolución a fallo multiorgánico. En Europa, cada año, 4 millones de personas contraen una infección “evitable” como consecuencia de procedimientos médicos (healthcare-associated infection), siendo las ITUs también el grupo más numeroso (19.6%). En el medio hospitalario, representan hasta el 40% de las infecciones nosocomiales, y son el reservorio institucional más importante de patógenos resistentes. En las UCI hospitalarias, son las segundas infecciones más frecuentes, después de las neumonías asociadas a la ventilación mecánica [5] [6] [7] [8].
La prevalencia de ITUs sintomáticas es mayor en mujeres, con un pico a los 14-24 años relacionado con la actividad sexual, con una resolución espontánea de los síntomas en 1 de cada 4 casos. Posteriormente la prevalencia en mujeres aumenta con la edad (20% en mujeres mayores de 65 años, en comparación con 11% en la población general). La prevalencia es menor en hombres, ocurriendo principalmente en presencia de alteraciones de la vía urinaria y en ancianos. En mujeres jóvenes sexualmente activas, también es más frecuente la recurrencia. Tras un primer episodio de ITU sintomática, 27% presentan una recurrencia confirmada en los 6 meses posteriores, y el 2.7% una segunda recurrencia en el mismo periodo [5] [6] [7] [8] [9].
Las Guías Europeas sobre Infecciones Urológicas [10], clasifican los factores de riesgo de ITUs en 6 categorías con el acrónimo “O R E N U C”:
- O: Sin factor de riesgo conocido, por ejemplo, las mujeres premenopaúsicas no gestantes.
- R: Factores de riesgo de ITUs Recurrentes: actividad sexual, dispositivos anticonceptivos, espermicidas, diabetes mellitus controlada, déficits hormonales tras la menopausia, algunos grupos sanguíneos.
- E: Factores de riesgo Extra-urogenitales, que conllevan riesgo de peor evolución: inmunosupresión, enfermedades autoinmune o conectivopatías, hombres, gestación, diabetes mellitus mal controlada, prematuridad, neonatos.
- N: Factores de riesgo Nefrológicos, con mayor riesgo de peor evolución: poliquistosis renal, insuficiencia renal.
- U: Factores de riesgo Urológicos, corregibles, pero con mayor riesgo de peor evolución: bacteriuria asintomática combinada con otro factor de riesgo de las demás categorías, obstrucción ureteral por litiasis u otras causas, catéter urinario transitorio, disfunción vesical neurogénica controlada, cirugía urológica.
- C: Factores de riesgo urológicos, no corregibles, y Catéter urinario permanente, con mayor riesgo de peor evolución: catéter urinario a largo plazo (sondaje permanente, talla vesical permanente, etc…), obstrucción urinaria irresoluble, vejiga neurógena no controlada.
Por grupos de edad y género, los factores predisponentes más frecuentes son:
- Mujeres premenopaúsicas: actividad sexual, uso de diafragmas, espermicidas, diabetes, historia de ITU o ITU durante la infancia, antecedentes familiares de ITU.
- Mujeres postmenopaúsicas y ancianas: deficiencia estrogénica, historia de ITU antes de la menopausia, estado funcional o mental alterado, incontinencia urinaria, cateterización urinaria.
- Hombres y mujeres con alteraciones anatómicas o obstrucción extrarrenal (anomalías congénitas de uréter o uretra, cálculos, compresión ureteral extrínseca, hiperplasia prostática benigna) o obstrucción intrarrenal (nefrocalcinosis, nefropatía por ácido úrico, poliquistosis renal, nefropatía por analgésicos, lesiones renales de la drepanocitosis).
4. CLASIFICACIÓN DE LAS ITUS
Las infecciones urinarias se pueden clasificar en función de su evolución y la coexistencia de factores de riesgo, o de su localización anatómica concreta en el tracto urinario.
- ITU no complicada: las que ocurren en mujeres sanas no gestantes con síntomas de vía urinaria baja (cistitis: disuria, polaquiuria, urgencia miccional, dolor suprapúbico), o de vía urinaria alta (pielonefritis: fiebre, dolor en fosa renal, puñopercusión positiva). Pueden ser esporádicas o recurrentes.
- ITU complicada: ITU en pacientes que presentan alguna de las condiciones que determinan mayor riesgo de evolución desfavorable. Son las que ocurren en mujeres gestantes, hombres, obstrucción, inmunosuprimidos, insuficiencia renal, trasplante renal, uropatía obstructiva de causa neurológica, personas con factores de riesgo de ITU recurrente o persistente (litiasis, sondaje vesical, talla vesical, nefrostomías u otros tipos de drenaje de la vía urinaria).
- ITU asociada a catéter: ITU en presencia de catéter urinario permanente, sin evidencia de otras fuentes de infección. Se define por = 105 UFC/mL en una muestra de orina de catéter, o en muestra de orina obtenida 48h después de retirado el catéter.
- ITU recurrente: recurrencias de ITU (no complicada o complicada), con una frecuencia de = 3 ITUs/año o = 2 ITUs en los últimos 6 meses.
- Urosepsis: disfunción orgánica que causa riesgo vital debido a una ITU.
Por su localización anatómica, nos encontraremos con:
- ITU de vía urinaria baja: uretritis, cistitis, prostatitis.
- ITU de vía urinaria alta: pielonefritis, absceso intrarrenal, absceso perinéfrico.
5. ETIOLOGÍA DE LAS INFECCIONES URINARIAS.
Las ITUs pueden estar causadas por una gran variedad de patógenos, incluyendo bacterias gram negativas, bacterias gram positivas y hongos [9].
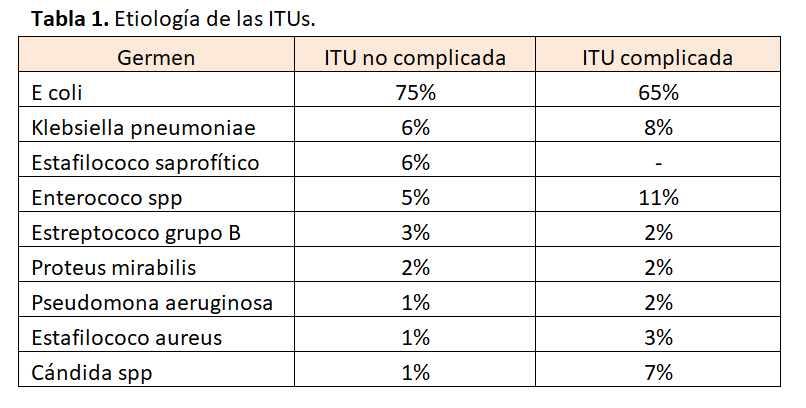
En general, se suele aislar un único patógeno en la mayoría de los casos, excepto en casos de anomalías estructurales del aparato urinario o en pacientes con cateterización crónica de la vía urinaria (polibacterianas). La bacteria más frecuentemente aislada es la E. coli uropatógena, tanto en ITUs no complicadas (75%) como en ITUs complicadas (65%). La infección por E. coli aumenta la probabilidad de recurrencia en 6 meses. Proteus, Klebsiella y Corynebacteria urealyticum son bacterias productoras de ureasa, por lo que favorecen la aparición de litiasis infecciosa (Tabla 1).
En ITUs no complicadas otros gérmenes causantes son: Klebsiella pneumoniae, Staphylococcus saprophyticus, Enterococcus faecalis, Streptococcus del grupo B, Proteus mirabilis, Pseudomona aeruginosa, Staphylococcus aureus y Candida spp.
En ITUs complicadas, por detrás de E. Coli (65%), los patógenos más frecuentes son: Enterococcus spp, K. pneumoniae, Candida spp, S. aureus, P. mirabilis, P. aeruginosa y Streptococcus del grupo B.
A nivel mundial, se ha observado un incremento alarmante de resistencia antibacteriana especialmente prominente para los uropatógenos Gram negativos y los enterococos [11].
A nivel local, en nuestro hospital o zona de salud, las bacterias aisladas pueden variar en frecuencia y patrón de resistencias. Por este motivo es conveniente estar informados y familiarizados con las tasas locales de aislamientos que proporcionan los Servicios de Microbiología y Medicina Preventiva, que se actualizan periódicamente, así como seguir las recomendaciones particulares de los Programas de Optimización de Uso de Antibióticos (PROA, https://seimc.org/documentos-cientificos/antimicrobianos-y-tratamientos-antibioticos/programas-de-optimizacion-de-uso-de-antimicrobianos-proa). La implementación de estos PROA persigue tres objetivos básicos: mejorar los resultados clínicos de los pacientes con infecciones, minimizar los efectos adversos asociados al uso de antibióticos (entre ellos, la aparición y diseminación de resistencias) y garantizar el uso de tratamientos costo-eficaces. En España, la implementación de los PROA es una de las acciones que se llevan a cabo en el ámbito del Programa Nacional frente a la Resistencia a los Antibióticos (PRAN), http://resistenciaantibioticos.es/es. En esta web también está disponible de forma gratuita la Guía Terapeútica Antimicrobiana del SNS (salud humana).
Las fluoroquinolonas se han empleado de una forma extensa en el tratamiento de infecciones por E. coli, sobre todo en las ITUs. Son antibióticos de amplio espectro, con potente actividad bactericida de bacterias gram-negativas y que alcanzan altas concentraciones en orina. Su uso se ha relacionado con la aparición y selección de microorganismos resistentes, incluso a otras familias de antibióticos, como las enterobacterias betalactamasas de expectro extendido (BLEE) o los S. aureus resistentes a meticilina (SARM). La OMS las ha clasificado como antibióticos críticamente importantes por su alta frecuencia de uso, impacto ecológico y relevancia estratégica en infecciones graves. En 2019, la Comisión Europea implementó condiciones regulatorias estrictas con respecto al uso de fluoroquinolonas debido a sus efectos secundarios incapacitantes y potencialmente duraderos (https://www.ema.europa.eu/en/medicines/human/referrals/quinolone-fluoroquinolone-containing-medicinal-products#all-documents-section). Todo ello ha condicionado que las quinolonas sean eliminadas como fármacos de primera o segunda línea en el tratamiento de las ITUs. Se puede consultar en https://www.who.int/foodsafety/publications/quinolones/en/
Para usar cualquier antibiótico como tratamiento empírico de las ITUs, se acepta que la resistencia local al mismo debe ser:
- En ITU de vía urinaria baja: < 20 %
- En ITU de vía urinaria alta: < 10 %
6. BACTERIURIA ASINTOMÁTICA EN ADULTOS.
Se define como la presencia en orina de una o más especies de bacterias comensales, también llamadas bacterias urinarias residentes, que no ocasionan síntomas (microbiota urinaria). Se trata de una colonización, no de una infección, por lo que no requiere tratamiento antibiótico [10] [12][15] [16].
Cuantitativamente se puede considerar bacteriuria asintomática si se aíslan en urocultivo:
- ≥ 105 UFC/mL en 2 muestras de orina evacuada separadas por varios días en mujeres, o en 1 muestra en hombres. La presencia de bacteriuria asintomática en hombres jóvenes es infrecuente, por lo que cuando se detecta, se recomienda descartar prostatitis bacteriana crónica.
- ≥ 105 UFC/mL en muestras de pacientes con cateterización crónica de la vía urinaria.
- ≥ 102 UFC/mL en muestras de pacientes con cateterización intermitente de la vía urinaria (por ejemplo, sonda vesical transitoria).
Es un hallazgo común en mujeres sanas (1-5% en mujeres jóvenes premenopaúsicas); así como en otros grupos de pacientes: 4-19% en ancianos, 0.7-27% diabéticos, 2-10% en gestantes, hasta 50% en ancianos institucionalizados y en pacientes con lesiones medulares, y en el 100% de pacientes con catéter crónico en la vía urinaria [13].
El uso indiscriminado de antibióticos como tratamiento de las bacteriurias asintomáticas ha contribuido a la creación de resistencias bacterianas, sin que se haya obtenido un claro beneficio en términos de evitar la aparición de ITU sintomática, hipertensión arterial, deterioro de función renal, pielografía anormal o mortalidad en distintos subgrupos de pacientes. En este sentido, actualmente existe evidencia para considerar que la bacteriuria asintomática podría tener un efecto protector frente al desarrollo de ITU sintomática posterior por competencia entre distintas cepas o especies [13] [14].
Hoy en día hay consenso sobre evitar realizar screening y tratamiento de la bacteriuria asintomática [10] [15] [16][17], recomendándose únicamente en dos escenarios clínicos en los cuales el beneficio ha sido probado: gestantes y antes de procedimientos urológicos invasivos.
Bacteriuria asintomática en gestantes.
Tratar la bacteriuria asintomática durante el embarazo reduce el desarrollo de ITU sintomática posterior (cistitis, pielonefritis), preeclampsia, y algunas complicaciones fetales (recién nacido de bajo peso, prematuridad) [18]. Se recomienda un tratamiento corto (4-7 días), en función del germen aislado y su antibiograma. Se consideran seguros los betalactámicos (ampicilina, cefalexina), nitrofurantoína en el segundo trimestre (evitar en el primer trimestre ya que interfiere con la organogénesis, y entre las semanas 38-42 por el riesgo de anemia hemolítica en el feto), o fosfomicina. Se debe evitar la ceftriaxona en los días anteriores al parto, ya que puede provocar kernicterus (daño cerebral en recién nacido por ictericia grave) por desplazamiento de la bilirrubina; así como las fluoroquinolonas que se han relacionado con una alta tasa de abortos. La piperacilina/tazobactam y los carbapenemes no deberían usarse para el tratamiento de las bacteriurias asintomáticas, sino quedar reservados para casos de pielonefritis grave. También se debe evitar el uso de imipenem/cilastatina durante el embarazo (efectos adversos fetales).
Bacteriuria asintomática antes de procedimientos urológicos invasivos.
Con lesión de mucosa urotelial: cirugía urológica endoscópica, resección transuretral de tumores prostáticos o vesicales, etc… El tratamiento dirigido por antibiograma ha demostrado disminuir la aparición de ITU sintomática, fiebre y septicemia tras el procedimiento. No obstante, independientemente de la presencia o no de bacteriuria, las guías clínicas recomiendan profilaxis antibiótica en este tipo de intervenciones (ureteroscopia, nefrolitotomía percutánea, resección transuretral de próstata o vejiga).
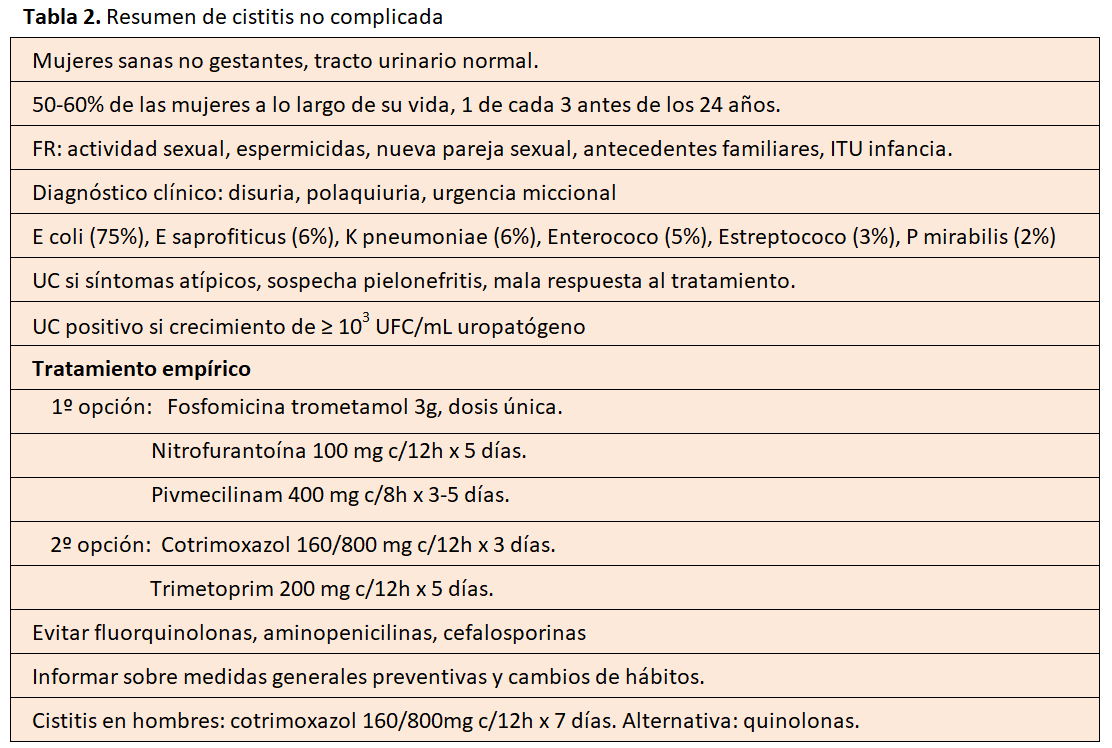
7. CISTITIS NO COMPLICADA
Es la ITU de vía urinaria baja que ocurre de forma aguda (esporádica o recurrente) en mujeres sanas, no gestantes, con un tracto genitourinario anatómica y funcionalmente normal. Los síntomas que la caracterizan son disuria, polaquiuria y urgencia miccional, con poca afectación del estado general y sin fiebre. También puede aparecer molestia suprapúbica, hematuria macroscópica, orina turbia o maloliente. Es preciso descartar vaginitis, que puede producir síndrome uretral externo (disuria), con prurito vaginal o vulvar y leucorrea. La aparición de fiebre o importante afectación del estado general, naúseas, vómitos, dolor en fosa renal, etc… debe hacer sospechar pielonefritis aguda.
Generalmente la presentación clínica es suficiente para establecer un diagnóstico, aunque puede ser corroborado mediante tira reactiva de orina (positividad de nitritos, leucocitos o sangre). Conviene recordar que la presencia de nitritos positivos en la orina se debe a la presencia de bacterias gram negativas, que transforman los nitratos urinarios en nitritos. Por tanto, una tira reactiva negativa en nitritos no indica ausencia de bacterias gram positivas como Estafilococos o Estreptococos.
No se precisa urocultivo, salvo en los casos dudosos, con síntomas atípicos, si se sospecha pielonefritis, o en aquellos que presenten mala respuesta al tratamiento (no se resuelven o recurren dentro de las 4 semanas de finalizado el tratamiento). En urocultivo, un contaje de ≥ 103 UFC/mL de un uropatógeno en orina evacuada confirmará microbiológicamente la infección. En estos casos es conveniente realizar una prueba de imagen, como la ecografía renal y de vías urinarias.
Los factores de riesgo más frecuentes son la actividad sexual, el uso de espermicidas, nueva pareja sexual, historia familiar (madre tuvo ITUs) y antecedente de ITU en la infancia.
Las bacterias causantes son más frecuentemente: E. coli (75%), Estafilococo saprofíticus, Enterococo faecalis, Klebsiella pneumoniae y Proteus mirabilis.
En las guías clínicas Europeas y Españolas [10] [19], debido al aumento en la resistencia de E. coli a fluorquinolonas y betalactámicos aminopenicilinas [20], no se recomiendan como tratamiento empírico. Tampoco se debe recurrir a aminopenicilinas con inhibidor de betalactamasa (ampicilina/sulbactam, amoxicilina/clavulánico) ni cefalosporinas orales, ya que son poco eficaces en tratamientos cortos (Tabla 2).
Antes de comenzar el tratamiento antibiótico empírico, conviene estar familiarizado con el perfil de resistencias de los gérmenes más frecuentemente aislados en nuestra zona de salud.
Como tratamiento empírico de cistitis no complicada, recordando que solo se debe usar una fluoroquinolona cuando se considere inapropiado usar otros agentes antibacterianos (último recurso), se recomienda:
1º Opción:
- Fosfomicina trometamol 3g en dosis única.
- Nitrofurantoína macrocristal 50-100 mg c/6h x5 días
- Nitrofurantoína monohidrato o macrocristal 100 mg c/12h x 5 días.
- Pivmecilinam 400 mg c/8h x 3-5 días.
2º Opción: Si la tasa local de resistencia de E. coli es <20% a cotrimoxazol, se pueden utilizar:
- Cotrimoxazol 160/800 mg c/12h x 3 días.
- Trimetoprim 200 mg c/12h x 5 días.
Alternativamente, con la premisa de evitar su uso como primera o segunda opción, en caso de alergias o intolerancias a los antibióticos anteriores, se podría optar por:
- Cefadroxilo 500 mg c/12h x 3 días.
- Cefixima 400 mg c/24h x 3 días.
Como queda reflejado en las Guías Europeas [12], si bien no se dispone de evidencia suficiente para establecer una recomendación fuerte, podría resultar útil informar a las pacientes que sufren un primer episodio de cistitis sobre medidas generales y cambios de hábitos con el fin de disminuir recurrencias (Tabla 3):
La cistitis en hombres suele aparecer en combinación con prostatitis (cistoprostatitis), por lo que se hace necesario usar antibióticos que penetren en próstata y mayor duración del tratamiento. Es recomendable realizar urocultivo. Las opciones empíricas pueden ser:
- Cotrimoxazol 160/800 mg c/12h x 7 días.
- Quinolonas como alternativa, si el patrón de resistencias locales lo permite.
8. ITU RECURRENTE
Son recurrencias de ITU (no complicada o complicada) aquellas que aparecen con una frecuencia de ≥ 3 ITUs/año o ≥ 2 ITUs en los últimos 6 meses.
Pueden aparecer como recidivas (se aisla el mismo germen después del tratamiento), o como reinfecciones (aparece un germen distinto después del tratamiento). No son ITU recurrentes aquellas en las que las bacterias no son erradicadas tras 7-14 días de tratamiento controlado, en estos casos se trataría de ITU persistentes.
Con mayor frecuencia se manifiestan como cistitis. En mujeres, tras un primer episodio de ITU sintomática, la tasa de recurrencia a los 6 meses es del 27% y de una segunda recurrencia del 2.7%. En caso de pielonefritis recurrentes es necesario sospechar y descartar un factor etiológico de complicación.
El diagnóstico de ITU recurrente debe ser confirmado con urocultivo.
Los factores de riesgo de ITU recurrente son:
- En jóvenes y mujeres premenopaúsicas: los mismos que en caso de cistitis no complicada (actividad sexual, el uso de espermicidas, nueva pareja sexual, madre con historia familiar de ITU y antecedente de ITU en la infancia).
- En mujeres postmenopaúsicas y ancianas: antecedente de ITU antes de la menopausia, residuo postmiccional, cistocele, vaginitis atrófica por deficiencia estrogénica, incontinencia urinaria. En mujeres institucionalizadas, también los catéteres urinarios y el deterioro funcional.
En algunos casos, las ITUs recurrentes pueden ser la manifestación clínica de otra condición o patología (especialmente en hombres), por lo que estaría indicado profundizar en el estudio urológico bajo sospecha clínica de uropatía obstructiva, litiasis, cistitis intersticial, carcinoma urotelial, etc... La prueba de imagen de elección es la ecografía renal y de vías urinarias. En algunos casos podría ser necesario realizar urografía excretora, cistoscopia, cistografía, TAC, gammagrafía, urodinamia, etc…pero son estudios que no están indicados de forma rutinaria [10][12][19].
En mujeres con ITU recurrente, sin condiciones médicas o anatómicas subyacentes, se recomienda realizar ecografía en casos de recurrencias no coitales, hematuria persistente asociada a ITU, pielonefritis aguda, alteración de la función renal o en mujeres gestantes. En general, en mujeres con ITU recurrente menores de 40 años y sin factores de riesgo, no es preciso realizar ecografía abdominal ni otros estudios urológicos [10] [12] [19]; aunque algunos autores defienden el uso de estudio urodinámico y descartar residuo postmiccional [21].
Para el tratamiento de cada recurrencia, se recomienda utilizar las mismas opciones antibióticas que para la cistitis aguda no complicada.
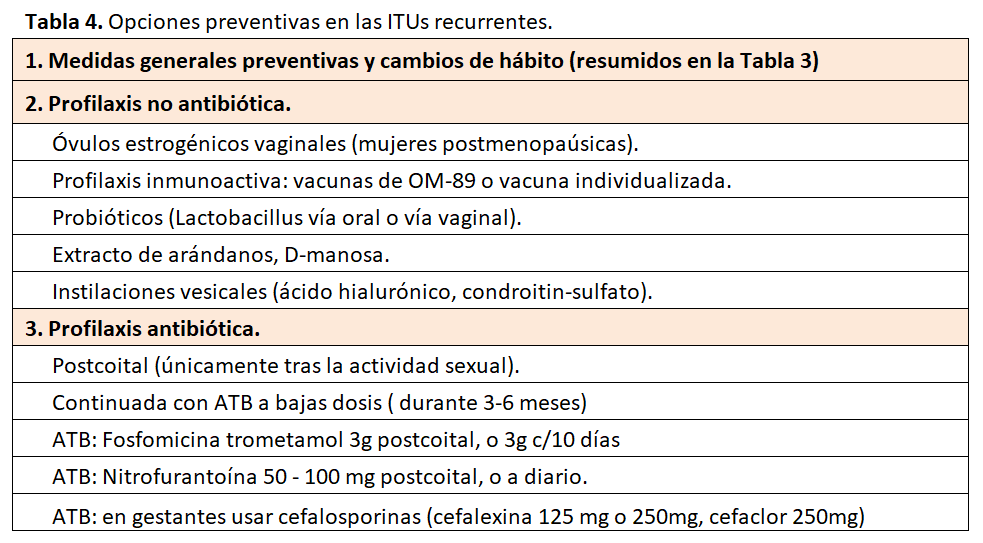
El manejo preventivo de las ITUs recurrentes (Tabla 4) es el siguiente:
1. Cambios en los hábitos y medidas generales (Tabla 3). Aunque no se dispone de evidencia de alto nivel en este sentido, parece razonable aconsejar a las pacientes con ITUs recurrentes tener en cuenta estas medidas.
2. Profilaxis no antibiótica [10] [12] [22] [23] [24] [25]:
- Estrógenos vaginales en óvulos (no orales) en mujeres postmenopaúsicas, que contribuyen a restaurar y mantener la integridad del urotelio. La administración vaginal evita los efectos secundarios sistémicos, si bien puede aparecer irritación local y leve sangrado.
- Profilaxis inmunoactiva (vacunas). Consiste en la estimulación de la inmunidad innata (sistema inmune asociado a mucosas, sistema mononuclear fagocítico) y adaptativa utilizando extractos de antígenos bacterianos (inmunomodulación). Presentan un buen perfil de seguridad. Han demostrado reducir el número de recurrencias, y pueden administrarse a cualquier grupo de edad. Están disponibles varios tipos [24]:
- * OM-89. Contiene lisados bacterianos liofilizados de E. Coli (18 cepas de E. Coli), vía oral, en cápsulas de 6 mg que se comercializa como Uro-Vaxom®. Dosis de 1 cápsula al día, en ayunas, durante 3 meses. Ha sido la más estudiada mediante ensayos clínicos, y ha demostrado ser eficaz en disminuir del 30-50% la frecuencia de las recurrencias, y hasta un 15% la necesidad de prescripción antibiótica.
-* MV140. Uromune®. Consiste en un preparado bacteriano polivalente estándar de bacterias inactivadas (E. Coli, Klebsiella pneumoniae, Proteus vulgaris, Enterococo faecalis). También se puede fabricar de forma individualizada, elaborada a partir de la identificación del uropatógeno aislado en la propia orina de la paciente o diseñada específicamente en función de los gérmenes aislados con mayor frecuencia. Se administra de forma sublingual, 2 pulsaciones al día, durante 3 meses.
-* Urovac®. Se trata de una vacuna vía vaginal en forma de supositorio que contiene extractos bacterianos de diferentes uropatógenos (E. Coli, Proteus vulgaris, Klebsiella pneumoniae, Morganella morganii, Enterococo faecalis). La pauta original consiste en una dosis semanal durante 3 semanas y posteriormente mensual durante 3 meses.
- Profilaxis con probióticos (Lactobacillus spp). Restauran los Lactobacillus vaginales y urinarios que compiten con los uropatógenos, impidiendo su adherencia, crecimiento y colonización. Tienen un efecto inhibitorio potente sobre E. Coli. Existen preparados de uso vaginal (aplicar 1 óvulo, 1 ó 2 días por semana) y de uso oral (diario). Especies de Lactobacillus beneficiosas son: L. rhamnosus GR-1, L. reuteri RC-14, L. reuteri B-54, L. crispatus CTV-05 y L. casei shirota.
- Extracto de arándanos y D-manosa [26]. Su papel en la prevención de las ITU recurrentes no está claro, por lo que no se recomiendan hasta disponer de más evidencia. Actuarían impidiendo la adhesión de algunos uropatógenos a la mucosa urotelial.
- Instilaciones vesicales de ácido hialurónico o de condroitinsulfato. Se usan con la idea de reparar la capa de glucosaminoglicanos del urotelio (reforzar la defensa mucosa), y han sido usados en ITU recurrentes, cistitis intersticial, cistitis de radiación o actínica, y vejiga hiperactiva. No se dispone de suficiente evidencia en la actualidad para recomendar su uso de forma sistemática.
3. Profilaxis antibiótica
Cuando las medidas generales y la profilaxis no antibiótica han fallado y continúan apareciendo recurrencias, especialmente en mujeres con clara relación con la actividad sexual, se puede optar por la administración de antibióticos. Hay dos pautas de similar eficacia: utilizar una dosis antibiótica tras el coito (profilaxis postcoital), o una dosis baja de antibiótico diario durante 3-6 meses (profilaxis continua de baja dosis). Es conveniente ofrecer las dos opciones indistintamente y someterlo a la decisión de la paciente, además de insistir en el cumplimiento de las medidas generales mencionadas. Los fármacos y pautas a considerar como primera línea serían:
- Nitrofurantoína 50 - 100 mg una vez al día (o postcoital). Al usar esta profilaxis se deberán tener en cuenta los posibles efectos adversos descritos de hepatotoxicidad, toxicidad pulmonar aguda o crónica (neumonitis intersticial, fibrosis pulmonar), y reacciones de hipersensibilidad. No sobrepasar los 6 meses de profilaxis.
- Fosfomicina trometamol 3 g cada 10 días (o postcoital)
- En las gestantes es preferible usar cefalosporinas (cefalexina 125 mg o 250 mg; o cefaclor 250 mg al día).
9. PIELONEFRITIS AGUDA NO COMPLICADA.
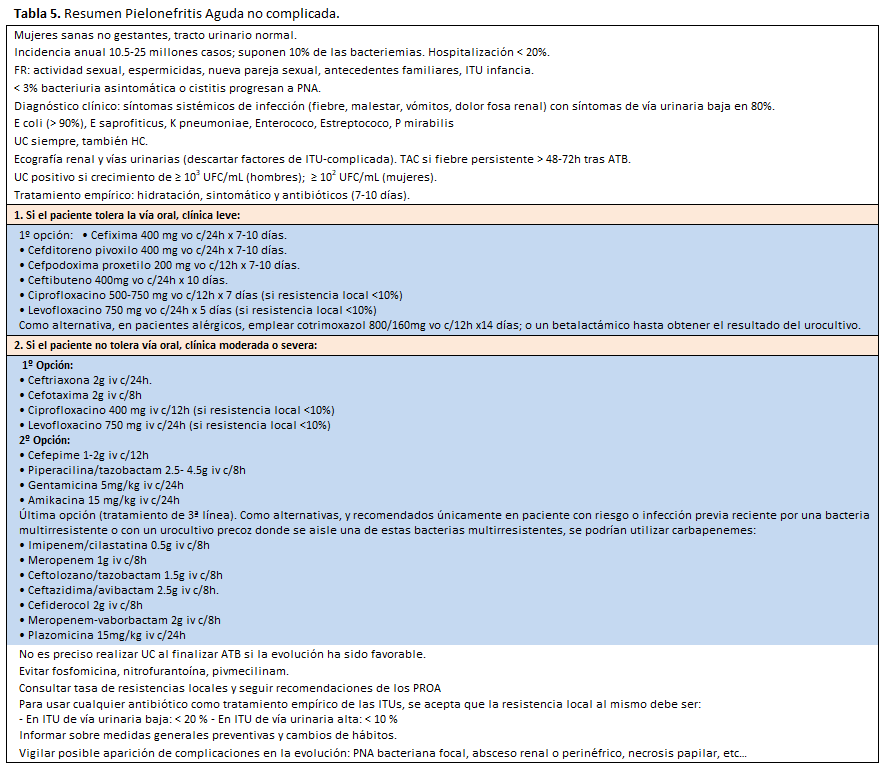
La pielonefritis aguda no complicada (PNA) es la ITU de vía urinaria alta (pelvis y parénquima renal) que ocurre de forma aguda en mujeres sanas, no gestantes, con un tracto genitourinario anatómica y funcionalmente normal.
Se estima una incidencia anual de PNA en el mundo de 10.5 a 25 millones de casos, siendo el origen del 10% de las bacteriemias. La tasa de hospitalización de PNA es inferior al 20%. Los factores de riesgo de cistitis (actividad sexual, nueva pareja sexual, uso de espermicidas, antecedentes personales o familiares de ITU), también predisponen a padecer PNA, aunque menos del 3% de las bacteriurias asintomáticas y cistitis progresan a PNA.
Clínicamente se caracteriza por aparición de síntomas sistémicos como fiebre, escalofríos, malestar general, naúseas, vómitos y dolor en fosa renal, con puñopercusión positiva. En un 20% de los casos no aparecen síntomas de infección de vía urinaria baja (disuria, polaquiuria, urgencia miccional). Es frecuente encontrar una alteración leve de la función renal, por factores inflamatorios o hemodinámicos, que suele revertir precozmente con el tratamiento, y elevación de los reactantes de fase aguda (RFA). La PNA puede evolucionar a bacteriemia (10-50%), sepsis grave y shock séptico, si bien esta evolución es más frecuente en las formas complicadas.
Con un tratamiento antibiótico efectivo, la mejoría clínica aparece desde las primeras 24-48h y la completa remisión del cuadro clínico-analítico en unos 5 días. Cuando los síntomas no mejoren en los primeros días, se iniciará la búsqueda activa de complicaciones (PNA focal o lobar, absceso renal, absceso perirrenal, PNA enfisematosa) o de alteraciones anatómicas o funcionales que estén agravando el cuadro clínico (PNA complicada: uropatía obstructiva, litiasis, inmunosupresión, etc…) [27] [28]. La tasa de recurrencia de la PNA es baja (<10%), y también debe hacer sospechar la existencia de factores predisponentes.
En pacientes ancianos o portadores de sonda urinaria, habitualmente cursa con menos expresividad clínica, apareciendo síntomas como fiebre sin claro foco clínico, dolor abdominal difuso, letargia, afectación del estado general, etc…
En presencia de síntomas, el urocultivo es diagnóstico si se aíslan ≥102 UFC/mL en mujeres, o ≥103 UFC/mL en hombres. Los gérmenes causantes suelen ser Enterobacterias (como las que ocasionan cistitis), predominando E. Coli enteropatógena en >90% de los casos, que alcanzan el riñón por vía ascendente desde la vejiga. Algunos gérmenes como S aureus y Candida spp pueden infectar el riñón por diseminación hematógena desde un foco infeccioso a distancia.
Ante la sospecha clínica de PNA se debe realizar análisis sanguíneo (hemograma, bioquímica), sedimento y tira reactiva de orina (piuria, cilindros leucocitarios), urocultivo con antibiograma previo al inicio de tratamiento antibiótico, y hemocultivos de sangre periférica. Además, se debe descartar lo antes posible factores de complicación usando técnicas de imagen (ecografía renal y de vías urinarias), urgente ante aquellos casos de presentación más grave, con sepsis, insuficiencia renal, etc…En caso de fiebre persistente con duración superior a 48-72h a pesar de tratamiento antibiótico, considerar realización de TAC helicoidal y nuevo urocultivo.
El tratamiento inicial de la PNA requiere abundante hidratación, tratamiento sintomático de la fiebre y dolor (analgésicos, antipiréticos, antieméticos), así como tratamiento antibiótico precoz [10] [12] [27] [29]. La elección del antibiótico empírico y su vía de administración, dependerá de la situación clínica del paciente, de los gérmenes más frecuentemente aislados en nuestro medio y su perfil de resistencias. Posteriormente, será posible dirigir la terapia antibiótica en función del resultado del urocultivo y antibiograma hasta completar el periodo de tratamiento. En casos seleccionados de presentaciones leves, con pacientes adherentes al tratamiento farmacológico y las recomendaciones, se puede optar por un tratamiento ambulatorio vía oral con monitorización estrecha por su médico de atención primaria. No es preciso urocultivo de control postratamiento si la evolución clínica ha sido favorable [27] (Tabla 5).
- Tratamiento de PNA leve en pacientes que toleren la vía oral.
En casos seleccionados por su forma de presentación leve o precoz, es posible instaurar un tratamiento ambulatorio vía oral con cefalosporinas o fluorquinolonas (si la resistencia local a quinolonas se conoce y es inferior al 10% [30]). Si no se conoce la tasa de resistencias, se recomienda iniciar con una dosis parenteral de antibiótico de amplio espectro y larga duración, como cefalosporinas (ceftriaxona 2g iv) o aminoglucósidos (amikacina o gentamicina), para posteriormente continuar con el tratamiento oral elegido de las opciones que se describen más abajo. Conviene tener en cuenta que con las cefalosporinas orales se logran menores concentraciones que con las cefalosporinas intravenosas. No deben usarse fosfomicina, nitrofurantoína o pivmecilinam, debido a que estos antibióticos no penetran bien en el tejido renal.
1º Opción:
• Cefixima 400 mg vo c/24h x 7-10 días.
• Cefditoreno pivoxilo 400 mg vo c/24h x 7-10 días.
• Cefpodoxima proxetilo 200 mg vo c/12h x 7-10 días.
• Ceftibuteno 400mg vo c/24h x 10 días.
• Ciprofloxacino 500-750 mg vo c/12h x 7 días (si resistencia local <10%)
• Levofloxacino 750 mg vo c/24h x 5 días (si resistencia local <10%)
Como alternativa, en pacientes alérgicos, se podría emplear cotrimoxazol 800/160mg vo c/12h x14 días; o un betalactámico hasta obtener el resultado del urocultivo.
- Tratamiento de PNA moderada-severa, o con intolerancia a la vía oral
Estos casos requerirán ingreso hospitalario, sueroterapia y antibioterapia intravenosa empírica, que será modificada en función del antibiograma. A las 48-72h, si se observa mejoría significativa clínica se podrá cambiar a un fármaco vía oral y completar el tratamiento (7-10 días).
1º Opción:
• Ceftriaxona 2g iv c/24h.
• Cefotaxima 2g iv c/8h
• Ciprofloxacino 400 mg iv c/12h (si resistencia local <10%)
• Levofloxacino 750 mg iv c/24h (si resistencia local <10%)
2º Opción:
• Cefepime 1-2g iv c/12h
• Piperacilina/tazobactam 2.5- 4.5g iv c/8h
• Gentamicina 5mg/kg iv c/24h
• Amikacina 15 mg/kg iv c/24h
Última opción (tratamiento de 3ª línea). Como alternativas, y recomendados únicamente en paciente con riesgo o infección previa reciente por una bacteria multirresistente o con un urocultivo precoz donde se aisle una de estas bacterias multirresistentes, se podrían utilizar carbapenemes:
• Imipenem/cilastatina 0.5g iv c/8h
• Meropenem 1g iv c/8h
• Ceftolozano/tazobactam 1.5g iv c/8h
• Ceftazidima/avibactam 2.5g iv c/8h.
• Cefiderocol 2g iv c/8h
• Meropenem-vaborbactam 2g iv c/8h
• Plazomicina 15mg/kg iv c/24h
10. COMPLICACIONES DE LA PIELONEFRITIS AGUDA.
En ocasiones, la PNA no evoluciona favorablemente por aparición de alguna de las siguientes complicaciones:
- PNA bacteriana focal.
Es una forma intermedia entre la PNA típica y el absceso renal. Se caracteriza por la aparición de áreas focales de necrosis no licuefactiva en la cortical renal. Ha sido más frecuentemente descrita en niños, y en mujeres sanas que toman anticonceptivos hormonales orales. También puede aparecer en pacientes con factores predisponentes (diabetes, cirrosis, trasplante renal, litiasis, reflujo vesicoureteral, vejiga neurogénica). Clínicamente es similar a la PNA, pero de una forma más agresiva, con vómitos, dolor abdominal periumbilical, signos de irritación peritoneal, ileo paralítico, intensa elevación de RFA, etc… y con fiebre persistente a pesar de un tratamiento antibiótico inicial correcto. La piuria puede ser negativa en un 6-25% de los casos. Las pruebas microbiológicas pueden resultar negativas (urocultivo negativo hasta en un 40%, HC negativos hasta 81% de los casos). La ecografía renal muestra una masa focal sin márgenes definidos, avascular, y con frecuencia aparece líquido perirrenal. La técnica diagnóstica gold-standard es el TAC con contraste, que muestra lesiones en forma de cuña que no se realzan con contraste en uno o varios (multifocal) lóbulos renales. Suele requerir tratamiento antibiótico más prolongado (21 días) [28] [31].
- Formación de absceso renal o perinéfrico.
Es una complicación grave. Se debe sospechar ante una PNA sin respuesta a tratamiento, con persistencia de fiebre y RFA elevados más allá de 72h. Puede aparecer insuficiencia respiratoria, inestabilidad hemodinámica o íleo paralítico reflejo. Debe ser confirmado con pruebas de imagen (eco renal, TAC con contraste). El urocultivo puede ser negativo hasta en 20% de los casos. Los gérmenes causantes por vía ascendente suelen ser E. Coli, Klebsiella pneumoniae, Proteus; y por vía hematógena Estafilococo aureus. Si se afecta la grasa perirrenal (absceso perinéfrico), puede diseminarse distalmente hacia la grasa perivesical o inguinal, o hacia el lado contralateral penetrando en el peritoneo. Además del tratamiento antibiótico, precisarán drenaje quirúrgico o, en última instancia, nefrectomía y limpieza quirúrgica [31] [32].
- Necrosis papilar.
Está ocasionada por lesiones túbulointersticiales que afecten a la médula interna, originando isquemia y necrosis de los segmentos distales de las pirámides renales. Es frecuente en diabéticos, nefropatía por analgésicos, anemia de células falciformes (sickle cell disease), trombosis de vena renal, tuberculosis genitourinaria, uropatía obstructiva, riñones trasplantados (donante fallecido) y PNA. Otras causas más raras son el alcoholismo crónico, la necrosis tubular aguda y el síndrome diarreico infantil. Clínicamente aparece hematuria macroscópica y dolor. La obstrucción ureteral del segmento papilar desprendido hacia la vía urinaria puede ocasionar un cuadro similar a la crisis renoureteral por litiasis (cólico nefrítico). Se confirma el diagnóstico con TAC multicorte [33].
- PNA enfisematosa.
Se trata de una de las presentaciones más graves de PNA, constituye una emergencia urológica por lo que requiere un alto grado de sospecha y tratamiento precoz. Clásicamente se ha descrito una elevada mortalidad (80% con tratamiento médico), que ha disminuido a 18% en publicaciones más recientes (con tratamiento combinado médico y quirúrgico). Está producida por enteropatógenos gram-negativos que en situaciones de baja concentración de oxígeno se comportan como anaerobios facultativos formadores de gas. Afecta con más frecuencia a mujeres que a hombres (4:1), a pacientes diabéticos mal controlados (principal factor de riesgo identificado), inmunosuprimidos o con uropatía obstructiva. La presentación clínica habitual es la de una PNA grave que no responde a tratamiento. Está ocasionada por uropatógenos típicos como E. coli (más frecuente), Klebsiella, Proteus y más raramente por Pseudomonas u hongos. Se ha descrito hasta en un 16% origen polibacteriano. En el TAC se podrá confirmar la presencia de aire intraparequimatoso o perinéfrico, con zonas de necrosis y pus coleccionada, de aspecto multiloculado. Condiciona la infección submasiva o masiva de parénquima renal, por lo que frecuentemente precisan no solo tratamiento médico de soporte y antibioterapia de amplio expectro prolongado, sino drenaje percutáneo y habitualmente nefrectomía quirúrgica [34] [35] [36].
- Daño crónico residual de PNA recurrentes.
En algunos pacientes, especialmente aquellos que han presentado ITUs recurrentes en la infancia, el proceso inflamatorio parenquimatoso renal puede dejar secuelas en forma de cicatrices corticales visibles con técnicas de imagen (ecografía, gammagrafía renal DMSA). También puede aparecer enfermedad renal crónica de patrón túbulointersticial crónico (grados variables de insuficiencia renal, anemia, acidosis metabólica, leucocituria y proteinuria media). Este daño se denomina pielonefritis crónica (PNC) [37].
- Pielonefritis Xantogranulomatosa.
Es un proceso inflamatorio renal crónico que se caracteriza por la destrucción y sustitución del parénquima renal normal por macrófagos cargados de lípidos (histiocitos espumosos). Puede aparecer de forma focal (15%) o generalizada afectando a todo el parénquima renal (85%). Se ha encontrado hasta en el 18% de las nefrectomías realizadas por PNA. Produce un cuadro clínico insidioso, de instauración progresiva e inespecífico, con fiebre, afectación del estado general, pérdida de peso, elevación moderada de RFA persistente, dolor en fosa lumbar, piuria, microhematuria, etc…por lo que, en numerosas ocasiones, se diagnostica tras la nefrectomía y examen de la pieza anatómica. Es más frecuente en mujeres, en pacientes con sobrepeso-obesidad, litiasis e infecciones recurrentes, y en aquellos de bajo nivel educacional (bajo estatus socioeconómico). Los gérmenes causantes son E. Coli, Proteus, Klebsiella, Pseudomona y Estenotrofomona, pudiendo ser polibacterianas hasta en un 20% de los casos. Afectan al tejido circundante, peri y paranéfrico, por lo que es frecuente el hallazgo concomitante de absceso perirrenal, absceso de psoas o retroperitoneal y fístulas nefrocutáneas o nefrocolónicas. El riñón afecto muestra atrofia e hipofunción cortical. En el TAC con contraste se aprecia aumento del tamaño renal, con parénquima hipocaptante, litiasis simple o litiasis en “cuerno de ciervo” (staghorn calculi). El parénquima renal aparece reemplazado por múltiples áreas hipodensas, en forma de huevo, que son cavidades abscesificadas con pus y detritus, y cálices dilatados. Se encuentra aire intraparenquimatoso en hasta el 13% de los casos, lo que ocasiona confusión con la PNA enfisematosa. El tratamiento es la nefrectomía [38] [39] [40].
11. ITUS COMPLICADAS.
Las ITU complicadas (ITU-c) son las ITUs que ocurren en presencia de un factor predisponente, que puede ser una condición del huésped o una alteración anatómica o funcional de la vía urinaria. Estos factores pueden condicionar una peor evolución ya que son más difíciles de erradicar. Pueden cursar con afectación tanto de vía urinaria baja como alta, aunque es más frecuente la presentación como PNA, con fiebre y afectación del estado general.
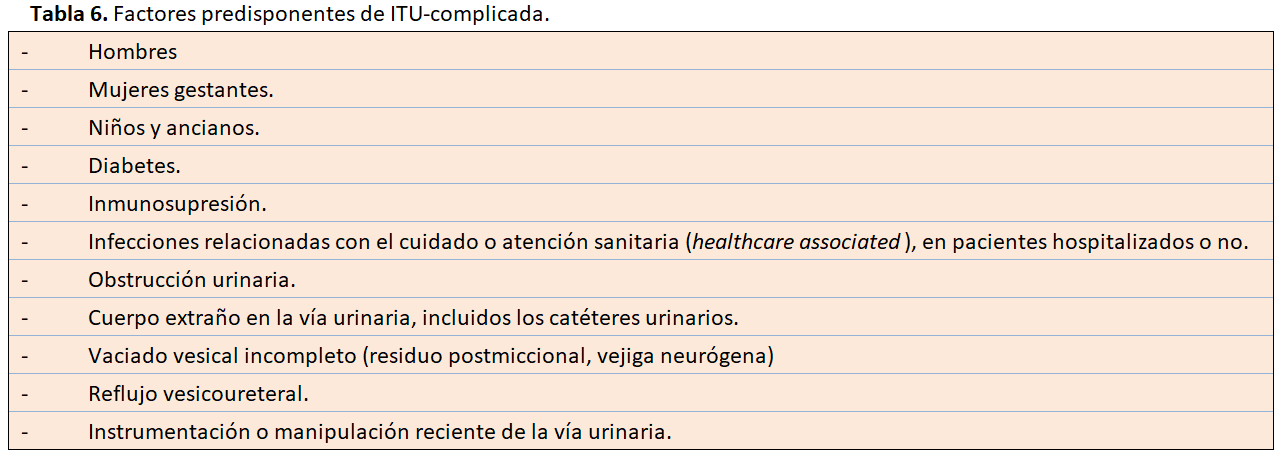
Los factores predisponentes de las ITUs complicadas son (Tabla 6):
Los enteropatógenos más frecuentes causantes de ITU-c son las enterobacterias (60-75%) como E. Coli, Proteus y Klebsiella, siendo también frecuentes Pseudomonas, Serratia y Enterococos.
En el medio hospitalario es habitual encontrar gérmenes multirresistentes (enterobacterias BLEE, SAMR, etc), por lo que se deben considerar como posibles causantes de ITU-c en pacientes hospitalizados, así como aquellos sometidos a manipulación reciente de la vía urinaria, pacientes portadores de sonda vesical permanente, pacientes con antecedente de infección o colonización por gérmenes multirresistentes y pacientes que hayan recibido tratamientos antibióticos en los últimos 3 meses.
Ante una ITU-c es mandatorio realizar urocultivo y prueba de imagen (ecografía y/o TAC), con el fin de identificar posibles factores predisponentes anatómicos o complicaciones del proceso infeccioso.
El manejo terapeútico incluye la corrección de la alteración subyacente si es posible (litiasis, obstrucción urinaria, etc…) y tratamiento antibiótico empírico inicial. La elección del antibiótico dependerá de la severidad de la presentación clínica, del patrón de resistencias de la flora local en nuestro medio y de los factores específicos del huésped. Posteriormente, tras la obtención del resultado del urocultivo y antibiograma, se instaurará la antibioterapia dirigida contra el patógeno específico. En las situaciones clínicas que requiren tratamiento inicial parenteral, si la infección evoluciona favorablemente posteriormente se podrá pasar a vía oral con los fármacos encontrados más sensibles en el antibiograma. La duración del tratamiento debe ser 7-14 días.
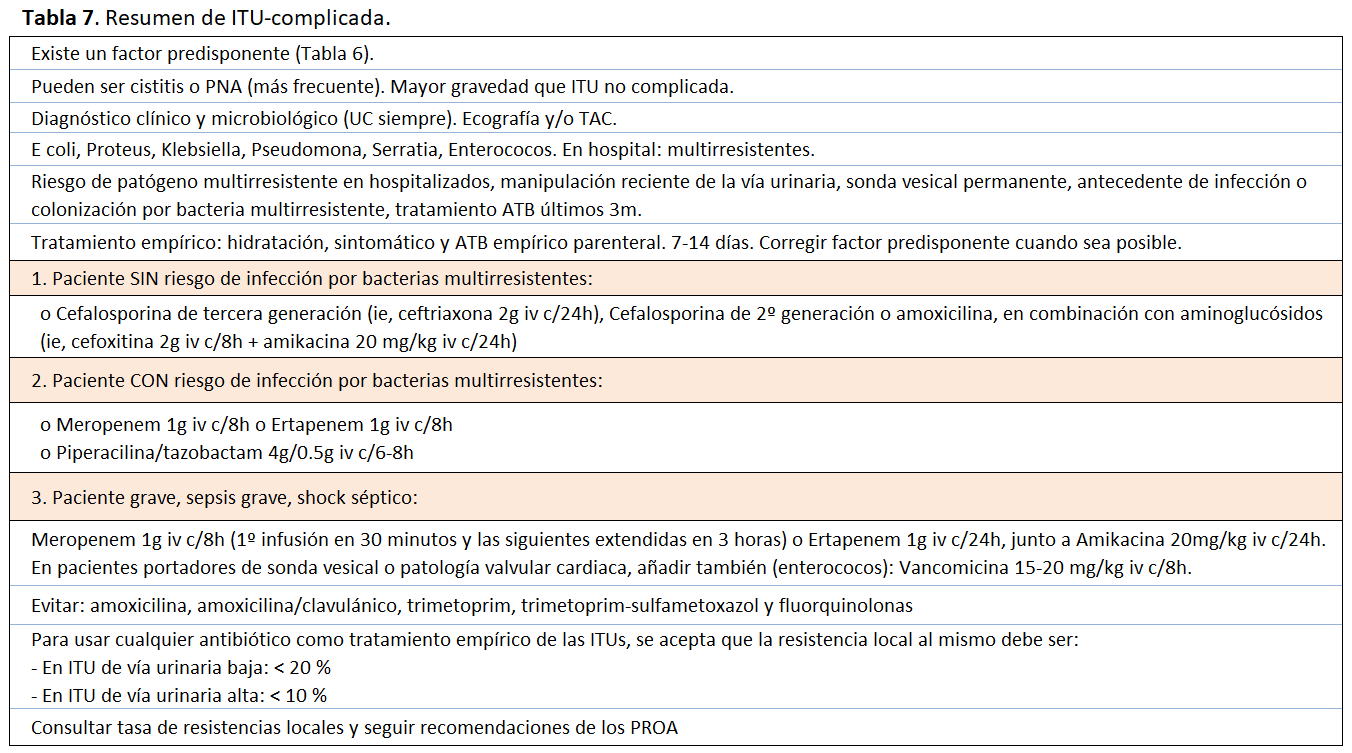
Como antibióticos empíricos, debido al aumento de las resistencias mundiales [10] [12], se deben evitar: amoxicilina, amoxicilina/clavulánico, trimetoprim, trimetoprim-sulfametoxazol y fluorquinolonas. Se recomienda además, estar informados y familiarizados con los PROA locales (Programas de Optimización del Uso de Antibióticos). Es conveniente recordar que para usar cualquier antibiótico como tratamiento empírico de las ITUs, se acepta que la resistencia local al mismo debe ser:
- En ITU de vía urinaria baja: < 20 %
- En ITU de vía urinaria alta: < 10 %
Las opciones empíricas para el tratamiento antibiótico parenteral de las ITU-c son [10] [12] [27] [30] [32] (Tabla 7):
- En pacientes sin riesgo de infecciones por gérmenes multirresistentes:
* Cefalosporina de tercera generación, por ejemplo, ceftriaxona 2g iv c/24h
* Cefalosporina de 2º generación o amoxicilina, en combinación con aminoglucósidos. Por ejemplo, cefoxitina 2g iv c/8h + amikacina 20 mg/kg iv c/24h.
- En pacientes con riesgo de infección por gérmenes multirresistentes (hospitalizados, manipulación reciente de la vía urinaria, sonda vesical permanente, infección o colonización previa por gérmenes multirresistentes, tratamientos antibióticos en los últimos 3 meses): m eropenem 1g iv c/8h o ertapenem 1g iv c/8h o piperacilina/tazobactam 4g/0.5g iv c/6-8h
- En casos graves, con sepsis grave o shock séptico, se puede recurrir a la combinación de meropenem 1g iv c/8h (1º infusión en 30 minutos y las siguientes extendidas en 3 horas) o ertapenem 1g iv c/24h, junto a amikacina 20mg/kg iv c/24h. En pacientes portadores de sonda vesical o patología valvular cardiaca, añadir también un fármaco que cubra enterococos, por ejemplo, vancomicina 15-20 mg/kg iv c/8h.
En el caso concreto de ITU-c causada por bacterias multirresistentes, se están llevando a cabo ensayos clínicos con otros agentes antibacterianos, como ceftolozano/tazobactam, cefiderocol, imipenem/cilastatina, plazomicina o ceftazidima/avibactam.
Se recomienda mantener el tratamiento durante 7-14 días, considerando que si evoluciona favorablemente, se mantiene hemodinámicamente estable y afebril durante 48h, y se corrige el factor predisponente, podría optarse por la duración más corta para evitar efectos secundarios de los antibióticos (7 días). Por otro lado, si no es posible descartar prostatitis, es recomendable mantener el tratamiento 14 días. [12]
12. ITU EN GESTANTES.
La ITU es la infección bacteriana más común durante la gestación, y tiene un impacto negativo en la morbimortalidad materno-fetal. Algunos cambios funcionales y estructurales que ocurren durante la gestación, favorecen la aparición de ITU:
- Cambios estructurales de la vía urinaria, que favorecen el éstasis urinario y la presencia de reflujo vésico-ureteral. Desde la 7º semana de gestación, los uréteres comienzan a dilatarse debido a la acción hormonal de la progesterona sobre el músculo liso (hidrouréter). A partir de las semanas 22-26 de gestación, el efecto compresivo del útero grávido favorece la hidronefrosis. Además, el aumento de volemia durante el embarazo lleva a una reducción de la concentración urinaria y a un aumento del volumen vesical.
- Cambios en la composición urinaria, que favorecen el crecimiento bacteriano. Son los cambios en el pH urinario, osmolaridad y la glucosuria inducida por la gestación.
La bacteriuria asintomática es muy frecuente (2-15%), siendo un factor de riesgo determinante en la aparición de ITU sintomática (sin tratamiento, un 20-40% progresarán a ITU sintomática). La ITU sintomática aparece en 1-2% de las gestaciones, ya sea en forma de cistitis o de pielonefritis. Otro factor de riesgo importante es el antecedente de ITU previa a la gestación.
Los gérmenes más frecuentemente aislados son similares a los de la población general, predominando E. Coli (86%), aunque también Estafilococo saprofítico, Klebsiella, Enterobacter, Proteus, Enterococo, Estreptococo del grupo B.
Debido al impacto negativo en términos de morbimortalidad materno-fetal, en la gestación es mandatorio realizar screening con urocultivo y tratamiento de la bacteriuria asintomática [10] [12] [41], así como confirmar la negatividad del urocultivo 1-2 semanas tras finalizar el tratamiento de cualquier ITU que ocurra durante la gestación.
En las mujeres gestantes se deben prescribir antibióticos con especial precaución, debido a los posibles efectos indeseables fetales:
- Evitar fluorquinolonas, por elevada tasa de abortos.
- Evitar nitrofurantoína en el primer trimestre, por interferencia por la organogénesis; y entre las semanas 38-42 por anemia hemolítica fetal. Es segura en el 2º trimestre.
- Evitar trimetoprim en el primer trimestre, por ser antagonista de folatos necesarios para el correcto desarrollo del tubo neural.
- Evitar ceftriaxona en los días anteriores al parto, por kernícterus fetal.
- Evitar imipenem-cilastatina, por efectos adversos fetales.
- Son fármacos seguros los betalactámicos (ampicilina, amoxicilina, cefalexina, cefazolina, etc…) y la fosfomicina para bacteriuria asintomática e ITU leves. Para casos graves, con necesidad de antibióticos parenterales también se podrán usar piperacilina/tazobactam y los carbapenemes (excepto imipenem).
Se recomienda una duración del tratamiento corta, de 2-7 días, para bacteriuria asintomática e ITU sintomática leve (cistitis), y ciclo largo de 8-14 días para ITU sintomática más severas (pielonefritis, urosepsis). En caso de infecciones recurrentes en embarazadas en relación a la actividad sexual, también se puede recurrir a una profilaxis postcoital [10] [12] [41].
13. ITU EN ANCIANOS.
En la población geriátrica las ITUs representan un problema clínico relevante [43] [44]. Suponen el 25% de las infecciones, un 15% de las hospitalizaciones y un 6% de las muertes atribuidas a infección en este subgrupo de pacientes. La edad avanzada, en sí misma, representa un factor de riesgo de padecer ITU debido a:
- Mayor comorbilidad: diabetes, deterioro cognitivo, atrofia vaginal y disminución de Lactobacillus en mujeres postmenopaúsicas, etc…
- Mayor tasa de hospitalizaciones, que generalmente conllevan cateterización de vía urinaria
- Alta frecuencia de patología vesical: incontinencia, retención urinaria, hiperplasia prostática, cistocele, residuo postmiccional, divertículos vesicales, etc…
- Senescencia inmunológica
- Institucionalización de población geriátrica.
En pacientes ancianos es frecuente la bacteriuria asintomática (20% en ancianas >80 años, 5-10% en ancianos >80 años), llegando al 15-50% en institucionalizados. El tratamiento de la bacteriuria asintomática en ancianos no ha demostrado beneficios, y paradójicamente puede aumentar el riesgo de ITU sintomática. También aumenta la aparición de resistencias a antibióticos, la aparición de infección por Clostridium difficile y de otros efectos adversos farmacológicos.
Los gérmenes causantes de ITU más frecuentemente aislados son las bacterias gram negativas: E. Coli (60%), Klebsiella oxytoca (15%), Proteus mirabilis (7%). En ancianos son más altas las tasas de resistencia antibiótica y más frecuente la colonización e infección por gérmenes multirresistentes.
La forma de presentación clínica de ITU comunitaria en ancianos independientes, con sus habilidades comunicativas preservadas, suele ser la clásica (disuria, polaquiuria, urgencia miccional, molestias suprapúbicas, nicturia y ocasionalmente hematuria). En estos casos no debe retrasarse el comienzo de un antibiótico empírico, ya que aumenta el riesgo de bacteriemia y mortalidad [42].
Mayor confusión se produce en el diagnóstico de ITU en ancianos institucionalizados o en aquellos con deterioro cognitivo, incapaces de comunicar los síntomas. Para ello se requieren tres condiciones [43]:
- Síntomas localizadores de foco infeccioso urinario, o síntomas inespecíficos de infección en ausencia de otros focos.
- Evidencia de piuria y bacteriuria.
- Ausencia de otro proceso infeccioso o no infeccioso que pueda explicar los síntomas.
Hoy en día se acepta por consenso la actitud de iniciar tratamiento antibiótico empírico en presencia de disuria aguda (como único síntoma), o si aparece fiebre, confusión aguda o tiritona en presencia de, al menos, 1 síntoma urinario nuevo o empeoramiento del síntoma ya existente (urgencia, frecuencia, dolor suprapúbico, hematuria macroscópica, dolor en fosa lumbar, incontinencia urinaria). Si el diagnóstico no está claro, por ejemplo cuando el paciente presenta únicamente síntomas inespecíficos como deterioro mental, decaimiento, disminución de la funcionalidad, confusión, etc… pero sin síntomas localizadores urinarios, se recomienda hidratación abundante y vigilancia evolutiva.
Si el análisis de orina no demuestra piuria o bacteriuria, no se debe comenzar un tratamiento antibiótico (ITU improbable). Cuando la presentación clínica es infección severa, pero el paciente no presenta un claro foco urinario, se recomienda manejar como una sepsis de foco desconocido [43] [44].
Las opciones antibióticas son similares a las descritas para cistitis y PNA en población general [10] [12].
14. PROSTATITIS.
14.A. Definición. Clasificación
El término prostatitis hace referencia a la inflamación de la glándula prostática. El National Institute of Health americano, estableció en el NIDDK (National Institute of Diabetes and Digestive and Kidney Diseases) Chronic Prostatitis Workshop en 1995, la clasificación más aceptada de las prostatitis [45]:
- Tipo I: Prostatitis aguda bacteriana. Se trata de una infección prostática aguda, en general producida por bacterias.
- Tipo II: Prostatitis bacteriana crónica. Es una infección bacteriana persistente o recurrente.
- Tipo III: Prostatitis no bacteriana crónica (síndrome del dolor pélvico crónico). Se caracteriza por ausencia de infección demostrable en los cultivos recogidos y se subdivide en:
Tipo IIIA: Síndrome del dolor pélvico crónico inflamatorio. Se caracteriza por la presencia de células inflamatorias en el semen o las secreciones prostáticas.
Tipo IIIB: Síndrome del dolor pélvico crónico no inflamatorio. Se caracteriza por la ausencia de células inflamatorias en el semen o las secreciones prostáticas.
- Tipo IV: Prostatitis inflamatoria asintomática. Es aquella que se diagnostica mediante anatomía patológica sin que el paciente presente síntomas clínicos.
En la práctica clínica, esta clasificación es clave para poder diagnosticar y tratar correctamente una prostatitis (Tabla 8).
14.B Prevalencia
La prostatitis tiene una incidencia de 3 - 40 pacientes por 1000 personas-año y aumenta ligeramente con la edad [46] [47] [48]. Algunos estudios han encontrado prevalencias de en torno al 10% [47] [49]. Las prostatitis de origen infeccioso (tipo I y tipo II) son menos frecuentes que la tipo III [50]. Numerosos estudios sugieren que un porcentaje de las tipo I puede evolucionar a tipo II y éstas a tipo III [46] [49] [51] [52], lo que podría estar en relación con posibles reservorios intracelulares como se ha demostrado en las cistitis [53] [54]. El uso de un correcto régimen antibiótico en las prostatitis infecciosas podría reducir esta cronificación de la infección y/o de los síntomas [55] [56].
Algunos pacientes pueden desarrollar abscesos prostáticos, especialmente aquellos con factores de riesgo, como uso de catéteres urinarios permanentes, obstrucción a la salida del tracto urinario inferior o disfunciones de vaciado, pacientes inmunodeprimidos, con enfermedad renal crónica, VIH, diabetes mellitus o instrumentación urológica reciente (especialmente tras biopsia prostática) [57] [58].
14.C. Etiología de las prostatitis.
En condiciones normales, el lavado mecánico de los conductos prostáticos con la micción y la eyaculación, así como la producción de sustancias antibacterianas, son los principales mecanismos naturales que impiden que se produzcan infecciones [59] [60]. Se sabe, sin embargo, que en condiciones de estasis urinario en la uretra prostática por obstrucción, puede producirse reflujo urinario en la próstata [61] y éste dar lugar a una prostatitis [59] [62]. De hecho, es bien conocido que la mayor parte de las ITUs bajas en varones afectan a la próstata [63]. Los factores de riesgo de prostatitis bacteriana son por tanto la estenosis de uretra y la manipulación de la vía urinaria, especialmente la biopsia prostática [62] [64] [65]. Además, los factores de virulencia de los patógenos también condicionan la posibilidad o no de una infección [66].
Otro mecanismo patogénico a considerar en las prostatitis es el ascendente [67], principal fundamento que explica las prostatitis secundarias a infecciones de transmisión sexual [59] [62] [64] [65]. En este sentido, este mecanismo ascendente podría explicar un mayor riesgo de prostatitis en pacientes con relaciones coitales anales sin uso de métodos de barrera [68].
Por otro lado, algunos estudios clásicos mostraron que en pacientes con prostatitis crónica, la capacidad bactericida del semen podría estar reducida en comparación con la de controles sanos [69] [70] [71], por lo que podría existir una predisposición individual. Asimismo, existen estudios en gemelos que muestran asociación genética [72].
Todo esto confirma que en la patofisiología de la prostatitis infecciosa juega un papel muy importante no sólo el microorganismo, sino también determinadas condiciones relativas al huésped.
Los patógenos implicados en la prostatitis aguda bacteriana (tipo I) son especialmente de la familia Enterobacteriaceae [50]. En la prostatitis crónica, además de E. coli y otras enterobacterias, también aparecen con cierta frecuencia otros géneros como Enterococcus, Staphylococcus y Streptococcus (S. faecalis, S. epidermidis, S. hemolyticus, S. aureus). Asimismo son frecuentes Chlamydia trachomatis, Micoplasmataceae y Trichomonas vaginalis [50] [73] [74]. En pacientes inmunocomprometidos, las prostatitis pueden ser originadas por patógenos oportunistas como Mycobacterium tuberculosis, y hongos como Candida spp., Coccidioides, Blastomyces e Histoplasma [12].
14.D Manifestaciones clínicas de prostatitis.
Los síntomas de la prostatitis aguda suelen aparecer de manera repentina, por lo que son mucho más floridos, mientras que los de la prostatitis crónica son más larvados y deben haber estado presentes durante al menos 3 meses por definición [12], ya sea de forma recurrente o intermitente [75].
Son típicos el dolor o las molestias de difícil localización a nivel perineal, suprapúbico, rectal y/o en pene y escroto [76], junto a síntomas miccionales, ya sean síntomas de vaciado (chorro miccional débil, lento e intermitente) o de llenado (aumento de frecuencia miccional y/o urgencia miccional), y disuria [12] [77] [78]. La prostatitis aguda suele asociar fiebre y malestar general [12] [78], y ocasionar retención aguda de orina en un pequeño porcentaje de pacientes [79] [80] [81] [82]. En ocasiones también están presentes síntomas sexuales como orgasmo doloroso o hemospermia [83].
14.E. Diagnóstico de las prostatitis.
El diagnóstico debe basarse en una adecuada historia clínica y exploración física. Las pruebas microbiológicas son obligatorias para dirigir el tratamiento antibiótico en caso de prostatitis infecciosas.
En la anamnesis conviene indagar sobre la existencia de patologías urogenitales, contactos sexuales de riesgo, instrumentación de la vía urinaria reciente o historia de ITUs de repetición [75]. Las ITUs bajas de repetición (cistoprostatitis, orquitis y/o epididimitis) pueden ser un signo de prostatitis tipo II. La forma de inicio y el curso de los síntomas nos permitirá discernir entre prostatitis agudas (inicio más o menos brusco y habitualmente reciente) y crónicas (de mayor tiempo de evolución y curso en general fluctuante) [84].
En la exploración física es importante verificar la presencia o no de fiebre o febrícula y la estabilidad hemodinámica, ya que en ocasiones las prostatitis agudas pueden desembocar en una sepsis [75] [85] [86] [87].
En la prostatitis aguda, en el tacto rectal se palpa una próstata congestiva y dolorosa. El masaje prostático está contraindicado por riesgo teórico de bacteriemia [88]. Sin embargo, en la prostatitis crónica, un tacto rectal normal no excluye el diagnóstico [78].
En un varón con síntomas miccionales, el sedimento negativo no descarta ITU ya que éste tiene un bajo valor predictivo negativo [89] [90] [91].
En la prostatitis aguda, el diagnóstico microbiológico se realiza mediante urocultivo. Es conveniente realizar hemocultivo si el paciente tiene signos clínicos de bacteriemia o sepsis, y PCR de orina de primer chorro miccional si se sospecha infección de trasmisión sexual (ITS) [12] [62] [75].
En caso de ITUs de repetición con urocultivos positivos para la misma cepa bacteriana, puede sospecharse prostatitis crónica bacteriana con bastante certeza; sin embargo, se trata de un hallazgo que aparece en menos de la mitad de los casos [59].
En la prostatitis crónica bacteriana, el diagnóstico microbiológico ha de realizarse mediante el test de Stamey-Meares [12] [92] [93], también conocido como el ’4-glass test’. Consiste en la recolección de 4 muestras para su estudio microbiológico: una muestra de orina del primer chorro (muestra 1), que nos permite estudiar infecciones de transmisión sexual que pueden dar lugar a prostatitis crónica como clamidia o micoplasma; una muestra de orina del chorro medio (muestra 2); una muestra de secreción prostática tras masaje prostático (muestra 3); y una muestra de orina tras masaje (muestra 4) [12]. Otros autores han demostrado posteriormente que el estudio de únicamente la orina de chorro medio (muestra 2) y la orina tras masaje (muestra 4) (conocido como ‘2-glass test’) tiene una sensibilidad equivalente [94].
Aunque existe controversia al respecto, algunos estudios han demostrado que los cultivos de semen son capaces de detectar sólo un 50% de las infecciones (aunque su especificidad es muy alta, su sensibilidad no tanto), por lo que no se deben utilizar como prueba aislada [95].
El PSA suele elevarse en las prostatitis, especialmente en las agudas [96], por lo que no se recomienda su determinación en estas condiciones [12].
La ecografía transrectal no permite diagnosticar una prostatitis y sólo debe indicarse si se sospecha la existencia de un absceso prostático [12] por mala respuesta al tratamiento en las primeras 36h [62] [89].
El Chronic Prostatitis Symptom Index (CPSI) es un cuestionario desarrollado por el Chronic Prostatitis Collaborative Research Network [97], validado en español [98], que evalúa la severidad de los síntomas, el impacto en la calidad de vida de los pacientes, y fundamentalmente, la respuesta al tratamiento. Sin embargo, se emplea con más frecuencia en la prostatitis crónica abacteriana (tipo III), y su utilidad en la práctica clínica está en discusión [12].
Otras pruebas como la flujometría, la medición de residuo postmiccional, o los estudios urodinámicos sólo son necesarias en casos seleccionados [99].
En el diagnóstico diferencial de la prostatitis crónica se debe considerar el síndrome del dolor pélvico crónico, la patología del suelo pélvico o entidades de causa neurológica, que pueden ser causas de dolor crónico sin infección bacteriana [100]. Es importante tener en cuenta que la prostatitis tipo III se asocia a pacientes con diagnóstico previo de síndrome ansioso [101].
14.F. Tratamiento de las prostatitis.
Indudablemente, las prostatitis de causa infecciosa han de tratarse con antibioterapia. Sin embargo, existen estudios que demuestran que el tratamiento antibiótico en aquellas prostatitis en las que no se identifica infección (tipo III) puede mejorar en algún grado los síntomas en al menos la mitad de los casos [102], aunque este aspecto es controvertido.
La elección del tipo de antibiótico depende de la severidad de la infección, de los patrones de resistencia local y de factores del huésped (como ITUs o tratamientos antibióticos previos, alergias etc.) [12].
En pacientes con afectación del estado general y cuadros clínicos severos (en general por prostatitis tipo I), debe iniciarse antibiótico empírico intravenoso con cobertura para bacterias multirresistentes (sobre todo en casos de alta prevalencia de estas cepas en la comunidad, en urocultivos previos o en pacientes con antibioterapia previa) [103]. Posteriormente debe rotarse a un tratamiento dirigido según antibiograma [12].
En pacientes con síntomas más larvados (por prostatitis tipo II), es posible esperar a los resultados de los cultivos para escoger el antimicrobiano más idóneo [89].
En el momento de seleccionar el antibiótico es preciso considerar la capacidad de penetración en tejido prostático del mismo, lo que requiere ciertas características farmacocinéticas [104]. Las penicilinas y las cefalosporinas penetran mal en el tejido prostático salvo excepciones como la ceftriaxona o la cefuroxima. Ni los aminoglucósidos ni nitrofurantoína alcanzan buenas concentraciones intraprostáticas. Son clindamicina, macrólidos, trimetoprim-sulfametoxazol, imipenem, y quinolonas los antibióticos que alcanzan mejores concentraciones en tejido prostático [105].
En la prostatitis aguda bacteriana, según el estado del paciente, puede ser necesario usar inicialmente penicilinas de amplio espectro, cefalosporinas de 3ª generación o fluoroquinolonas intravenosas a altas dosis [12] [62] [75] [88] [89]. Pese a que las guías clínicas europeas de Urología recomiendan valorar la adición de un aminoglucósido en infecciones graves, como se ha mencionado, la penetrancia de estos fármacos en el parénquima prostático es muy baja y distintas revisiones sistemáticas desaconsejan esta práctica por aumentar la nefrotoxicidad sin mejorar la supervivencia [106] [107].
Es necesario tener en cuenta las tasas locales de resistencia a las fluoroquinolonas, que deben hacer al clínico replantearse su uso en el tratamiento empírico de pacientes con prostatitis aguda bacteriana, especialmente en aquellos que las han usado en los últimos 6 meses [108].
En infecciones por Chlamydia puede usarse también la azitromicina (que consigue incluso tasas de curación superiores a las fluoroquinolonas) [109] [110] o la claritromicina. En prostatitis ocasionadas por micoplasma puede usarse azitromicina o doxiciclina [109]. En prostatitis por T. vaginalis, metronizadol es de elección [111].
El tratamiento antibiótico debe mantenerse al menos durante 14 días si se usa una fluoroquinolona o metronidazol. Se requiere un tratamiento más prolongado (3-4 semanas) si se usa azitromicina o doxiciclina [12] [110] [112].
En la prostatitis crónica bacteriana, los antibióticos de primera línea siguen siendo las fluoroquinolonas por su excelente perfil farmacocinético y su actividad contra bacilos gram negativos y C. trachomatis [12] [89] [109] [113]. En una revisión sistemática reciente no se observaron diferencias significativas entre los diferentes fármacos de esta familia (levofloxacino, ciprofloxacino y prulifloxacino) [109]. La duración del tratamiento debe ser 4-6 semanas [12][59][75][114]. Debe monitorizarse la aparición de reacciones adversas neurológicas, tendinosas (especialmente en pacientes añosos), o diarrea asociada a Clostridioides [115]. Igualmente, para casos de C. trachomatis se puede usar la azitromicina (3 semanas), o doxiciclina (10 días). Si el germen causante es T. vaginalis el metronidazol es el fármaco de elección (14 días) [12] [109] [110].
Como coadyuvantes en el tratamiento de la prostatitis, especialmente las tipos II y III pueden emplearse también alfa-bloqueantes [88] [116], inhibidores de la fosfodiesterasa 5 [117], fitoterapia [118] y/o probióticos [119].
Si el paciente desarrolla retención aguda de orina es preferible la colocación de un catéter suprapúbico frente al uretral, ya que estos últimos [12] [59] [88] pueden aumentar el riesgo de bacteriemia en pacientes con prostatitis tipo I [120] [121], y supone además un factor de riesgo de cronificación [122].
En caso de absceso prostático, el manejo dependerá de las dimensiones del mismo [12]: los abscesos 1 cm requieren además tratamiento intervencionista, ya sea mediante aspiración o drenaje (abordaje transuretral o transperineal) [123] [124] [125] [126] [127].
Una revisión sistemática reciente que evaluó la opción quirúrgica como tratamiento de segunda línea en la prostatitis crónica refractaria a antibioterapia, se evidenciaba que hasta el 85% de los pacientes tratados mediante resección transuretral prostática referían al menos una mejora de los síntomas [128]. Sin embargo, no existe suficiente evidencia en la actualidad para recomendarla excepto en casos muy seleccionados [12].
14.G. Seguimiento de las prostatitis.
La desaparición de los síntomas tras el tratamiento es suficiente para determinar la curación. No se requiere la realización de cultivos de control [12] [89], que pueden diagnosticar bacteriuria asintomática cuyo tratamiento esta contraindicado [24].
En la prostatitis tipo II, la tasa de recidivas puede ascender hasta el 50% [115], más frecuente en pacientes con mayores volúmenes prostáticos, residuos postmiccionales considerables [129] o calcificaciones prostáticas [130], probablemente por mayor dificultad para conseguir un efecto completo del antibiótico o por formación de biofilm en la calcificación [131]. En estos casos, conviene descartar la coexistencia de alguno de estos factores que justifiquen la mala evolución, así como repetir el test microbiológico. Si el tratamiento inicial fue efectivo, y la bacteria responsable continúa siendo sensible, se recomienda retratar durante más tiempo [89] [115].
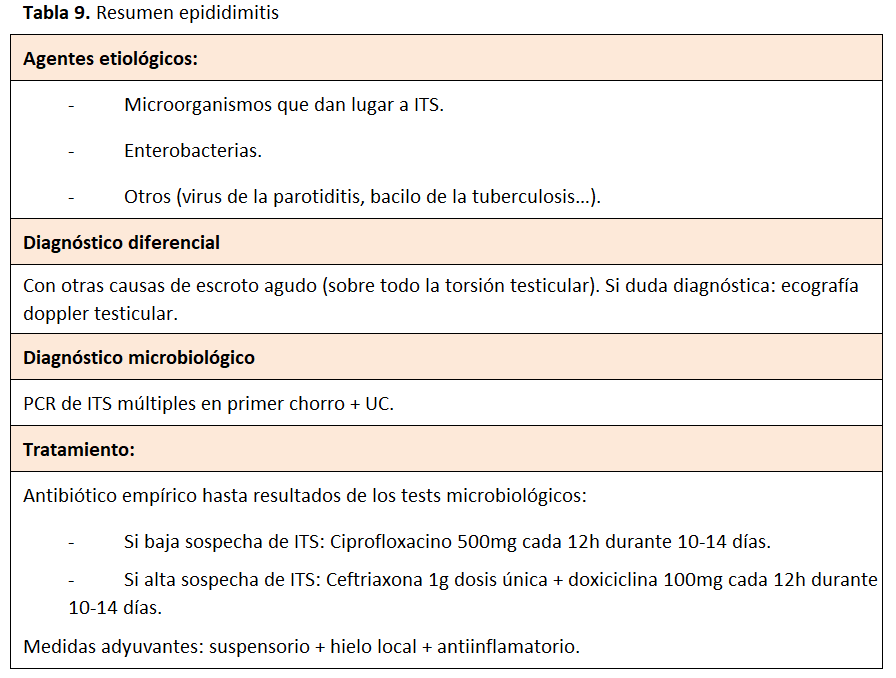
15. EPIDIDIMITIS
El epidídimo es la zona del testículo encargada de la maduración y almacenaje de los espermatozoides, y por proximidad al testículo, su inflamación puede dar lugar también la inflamación testicular (orquiepididimitis). La epididimitis puede ser aguda, crónica (en ocasiones por tuberculosis) o recidivante, y en general es unilateral [132] (Tabla 9).
15.A. Epidemiología
Es la causa más habitual de dolor escrotal. Puede aparecer a cualquier edad, siendo más frecuente entre los 20 y los 45 años [133], cuando suele estar ocasionada por una infección de transmisión sexual (ITS). En mayores de 40 años en general se produce por bacterias intestinales, aunque también conviene considerar la posibilidad de origen trasmisible.
15.B. Etiología de la epididimitis.
La mayoría de las epididimitis son de causa infecciosa bacteriana por microorganismos procedentes de la vejiga o la uretra [134]. Otros posibles orígenes de epididimitis son traumatismos (microtraumatismos repetitivos en deportistas), químico, farmacológico (amiodarona), o vírico (parotiditis, virus respiratorios, enterovirus, o Covid-19) [135] [136] [137].
Los microorganismos que se aíslan con mayor frecuencia en orquiepididimitis bacterianas son las enterobacterias (E. coli), y los gérmenes responsables de las infecciones de trasmisión sexual (ITS), especialmente Chlamydia trachomatis (más frecuentes en jóvenes) [136] [138].
15.C. Diagnóstico
La mayoría de las epididimitis producen escroto agudo. El diagnóstico diferencial más relevante es con la torsión testicular, dado que ésta es una urgencia quirúrgica [12] [135].
En la anamnesis indagaremos sobre contactos sexuales de riesgo [132], antecedentes de patología prostática u otros síntomas urinarios o instrumentación de la vía urinaria. Los pacientes suelen aquejar dolor testicular de inicio más o menos gradual (si el inicio es súbito, descartar torsión testicular). En ocasiones se asocia a secreción uretral [135], y en un 25% de los pacientes aparece fiebre [136] y/o disuria [139].
Exploratoriamente es común la palpación del epidídimo inflamado, doloroso y aumentado de temperatura, acompañado en ocasiones de síntomas inflamatorios testiculares o escrotales [12]. También puede observarse inflamación prostática al tacto rectal [139]. La sepsis, los abscesos epididimarios o testiculares, o la isquemia testicular son infrecuentes [140].
Un sedimento urinario patológico puede orientar un escroto agudo a favor de una epididimitis [141] (la torsión testicular no produce leucocituria ni microhematuria), aunque no es un hallazgo específico. La PCR de ITS múltiples en primer chorro miccional permite valorar si la causa es una de ITS, mientras que el urocultivo servirá para valorar la presencia de ITU [12] [135]. En caso de sospechar origen tuberculoso, la confirmación diagnóstica se realiza mediante cultivo específico o PCR [142].
En caso de duda diagnóstica, está indicada la ecografía escrotal ya que aporta alta rentabilidad diagnóstica y permite el diagnóstico diferencial con otras causas de escroto agudo [143].
15.E. Tratamiento
El tratamiento de las epididimitis u orquiepididimitis de origen bacteriano es el antibiótico. Debe iniciarse antibiótico empírico que cubra al menos Clamidia trachomatis y enterobacterias hasta obtener los resultados de los tests microbiológicos realizados [12].
La cobertura de la ITS debe realizarse mediante ceftriaxona 500 mg-1g y doxiciclina 100 mg oral cada 12h durante 10-14 días, mientras que la de las enterobacterias con fluoroquinolona durante 10-14 días [12] [141] [144].
La elevación escrotal mediante el uso de suspensorios, aplicación de hielo local y antiinflamatorios son medidas adyuvantes que contribuyen a la mejora de los síntomas [145].
16. ITU ASOCIADA A CATÉTER URINARIO.
16A. Definición
Se define como ITU asociada a catéter urinario a toda aquella infección del tracto urinario que ocurre en un paciente portador de catéter urinario (sonda vesical, catéter suprapúbico, catéter doble J o nefrostomía) o dentro de las 48 horas tras su retirada [12]. Es muy importante distinguirla de la bacteriuria asintomática en portadores de catéter, que aparece en todos los portadores con el tiempo y no se asocia con mayor riesgo de ITU sintomáticas [146] [147] [148]. Existe confusión en la literatura en relación a este tema, ya que algunos autores hablan de “infección asintomática”. Téngase en cuenta la importantísima distinción entre bacteriuria asintomática e infección, que es sintomática.
16B. Epidemiología
Prevalencia
Hasta un 25% de los pacientes hospitalizados [149] [150] y hasta un 5% de pacientes ingresados en residencias [151] portan un catéter urinario en algún momento de su estancia.
Más del 50% de las infecciones urinarias están asociadas a un catéter urinario [152] [153] [154]. Las ITUs asociadas a catéter son una de las causas de infección nosocomial más frecuentes [155] [156].
Las tasas de infección urinaria por 1000 días de cateterización varían sustancialmente de un estudio a otro y de una población a otra, oscilando entre 1.04-15.10 [157] [158] [159] [160] [161] [162] [163] [164]. Aunque la mortalidad no es elevada [165] [166] [167], puede llegar hasta el 5.4% de los casos de ITU asociada a catéter [168] [169] [170], representando un importante incremento en la estancia hospitalaria y los costes asociados [171] [172] [173].
La ITU asociada a catéter se considera una ITU complicada. El tiempo que permanezca la vía urinaria cateterizada es el factor de riesgo más importante para el desarrollo de ITU. Además de la infección de la vía urinaria baja, los portadores crónicos de catéteres urinarios pueden sufrir obstrucción del catéter y uropatía obstructiva, con riesgo de infecciones del tracto urinario superior (PNA) y deterioro de la función renal [174] [175]. Si la colonización del catéter se produce por gérmenes productores de ureasa (responsables de la hidrólisis de la urea en amonio), puede ocasionar litiasis infectivas e incrustación del catéter [176]. También puede aparecer reflujo de bacterias desde la uretra prostática, favoreciendo la aparición de prostatitis, epididimitis e incluso abscesos escrotales [175] [177]. Por último, la cateterización uretral supone un factor de riesgo importante de estenosis y traumatismos uretrales [178] [179] [180]. Los portadores de catéter urinario durante más de 10 años presentan mayor riesgo de cáncer vesical [179] [181].
Prevención de las ITU asociadas a catéter urinario.
Debido a las posibles complicaciones antes mencionadas, es fundamental que el uso de los catéteres urinarios quede restringido a aquellas situaciones en las que éstos sean imprescindibles (la incontinencia urinaria no debe tratarse mediante catéter urinario en pacientes en residencias de ancianos, no debe realizarse sondaje vesical a todos los pacientes quirúrgicos, etc.) y durante el menor tiempo posible [12] [182] [183] [184] [185] [186] [187] [188] [189] [190] [191].
En caso de indicarse la colocación de un catéter urinario, la técnica de inserción debe ser aséptica, usando material estéril (guantes, lubricante y sonda) [182] [183] [184] [185] [187] [189] [191] [192]. Debe realizarse una limpieza cutánea periuretral, siendo controvertido si debe o no usarse antisépticos [12] [183] [185] [189] [193] [194]. Asimismo, el catéter debe mantenerse conectado a una bolsa en todo momento para asegurar un sistema de drenaje cerrado [182] [183] [184] [185] [186] [187] [189] [191] [192] [195] [196] y recambiarse en caso de obstrucción o infección [183] [184] [185] [188] [189] [197].
Las sondas hidrofílicas son de elección en cateterización intermitente [198] [199] [200] [201], mientras que las sondas de silicona parecen reducir el riesgo de irritación de la mucosa vesical y adherencia microbiana en periodos largos de cateterización [185] [188] [202] [203] [204]. Existe controversia sobre si los catéteres recubiertos de aleación de plata son capaces de disminuir la frecuencia de ITU sintomática [205] [206] [207] [208] 209]. Los catéteres recubiertos con antibiótico no parecen reducir las tasas de ITUs [12] [185] [192] [205] [210].
Siempre que sea posible, se prefiere el uso de colectores externos en lugar de catéteres [211], pero en caso de no poder usarse, puede emplearse la cateterización intermitente [12] [182] [183] [185] [192], aunque no está claro que ésta disminuya las tasas de infección [212] [213] [214]. Si ninguna de estas dos opciones es factible y es necesario colocar un catéter urinario durante un período prolongado, parece que las tasas de ITU podrían ser algo menores con un catéter suprapúbico que con uno uretral [213] [214] [215] [216].
No está del todo claro si la administración profiláctica de antibióticos durante el tiempo que el paciente porte el catéter reduce o no el riesgo de ITU [217] [218], pero sí que es una práctica que contribuye a aumentar las resistencias bacterianas [219], el riesgo de infección por Clostridium difficile [220], los efectos adversos y los costes, por lo que no está recomendada [12] [182] [184] [185] [192].
Aunque los estudios disponibles son contradictorios [221] [222], es posible que la administración de una dosis única de antibiótico en el momento de la inserción, retirada o recambio del catéter reduzca las complicaciones infecciosas [223][224], en general bien toleradas y de resolución espontánea [225] [226]. La recomendación mayoritaria de las guías de práctica clínicas actuales es la de no usar antibióticos en la manipulación del catéter. [12] [16] [182] [192].
Se hace necesario, por tanto, la instauración de protocolos locales intrahospitalarios que establezcan medidas preventivas de las ITUs asociadas a catéter, las indicaciones de colocación de catéter urinario, las medidas de inserción y manipulación, así como protocolos de reevaluación de la necesidad de mantener el catéter [182].
16C Fisiopatología.
Etiología
Las ITUs asociadas a catéter son habitualmente polimicrobianas y/o por gérmenes multirresistentes, capaces de producir biofilm [146] [227] [228]. Los microorganismos más frecuentemente implicados en estas infecciones son contaminantes fecales o flora cutánea del propio paciente, o bien microflora transitoria proveniente del personal sanitario que coloniza el área periuretral [188] [229].
Los microorganismos más frecuentemente implicados son E. Coli y Candida spp, seguidos de Enterococcus spp, Pseudomonas aeruginosa, Klebsiella pneumoniae, Proteus spp y Enterobacter spp. En ocasiones también se observan Staphylococcus spp [227] [230] [231]. Los microorganismos causantes pueden variar en función del tiempo que el paciente haya portado el catéter urinario [232]. Es importante tener en cuenta que la mayoría de las veces que se aísla una levadura de la orina, es una bacteriuria asintomática y no implica infección [152].
Fisiopatología
Los gérmenes ascienden a través del catéter vesical extraluminalmente, entre el catéter y la mucosa uretral, o intraluminalmente desde una manipulación no estéril del sistema [188] [229]. Con la introducción de los sistemas de drenaje cerrado en los años 60 [195], el riesgo de bacteriuria descendió marcadamente, lo que indica la importancia de la vía intraluminal. En la actualidad, no obstante, continúa identificándose bacteriuria pese a estas medidas, por lo que es evidente que la vía extraluminal es también relevante [233] [234].
La formación de biofilm favorece la resistencia de los microorganismos al sistema inmune del paciente y a la antibioterapia, por lo que estas infecciones son prácticamente imposibles de erradicar sin retirar el catéter [188] [235] [236] [237].
Las bacterias que colonizan el catéter son capaces de adherirse a la mucosa vesical e invadir el epitelio superficial [238] por varios factores: por un lado, los factores de virulencia bacterianos (fimbrias, flagelos, adhesinas, producción de sustancias o sistemas de secreción [239] [240] [241] [242]), y por otro, por la propia irritación mecánica sobre la mucosa que produce el catéter [243] y la alteración de la capa mucosa de glicosaminoglicanos [244] [245], favorecido por el éstasis urinario que se produce por debajo de los orificios de salida del catéter [246] y a la presencia de biofilm en el catéter. Estos últimos factores hacen que bacterias que en condiciones normales no tendrían capacidad de producir ITUs, sean capaces de hacerlo en pacientes portadores de catéteres urinarios [247] [248].
Las proteínas del huésped que se secretan en la orina, especialmente el fibrinógeno que se vierte debido al daño mucoso que produce el catéter [249], se adhieren a la superficie del catéter urinario y serán reconocidas por las adhesinas bacterianas y utilizadas para construir su biofilm [250] [251]. Posteriormente, las adhesinas bacterianas reconocerán residuos de manosa de las uroplaquinas uroteliales superficiales [252] o de capas más profundas expuestas por el daño mucoso que produce el catéter, para colonizar la mucosa.
Factores de riesgo de las ITU asociadas a catéter urinario
Se ha identificado que los pacientes con mayor riesgo de infección urinaria asociada a catéter son:
- Mujeres [161] [162] [163] [253] [254] [255].
- Diabéticos [161] [162] [255] [256] y con otras comorbilidades como la hipertensión [162], la enfermedad cerebrovascular [253] [256] o la paraplejía [253]. A mayor número de comorbilidades según el índice de Charlson, o a peor estado funcional, mayor riesgo [255] [257].
- De mayor edad [162] [163] [164] [255] [256].
- Mayor duración de la cateterización [161] [164] [253] [254] [255] [257] [258] [259] [260].
- Aquellos que habían portado catéteres urinarios previamente [161] [258].
- Mayor estancia hospitalaria o en UCI [161] [162] [163] [164] [255] [259].
- Pacientes con incontinencia fecal [162].
Los factores de riesgo para que los pacientes con ITU asociada a catéter desarrollen una bacteriemia, por su parte, son:
- Sexo masculino [261] [262] [263].
- Tratamiento inmunosupresor [261] [262] [263].
- Enfermedad renal crónica [263] [264].
- Comorbilidades, según el índice de Charlson [264].
- Demencia [264].
- Historia oncológica [262].
- Diabetes mellitus [262] [263].
- Ser fumador o exfumador de menos de 5 años [262].
- Manipulación del tracto urinario [261].
- Duración de la estancia hospitalaria [154] [261] [262].
16D. Diagnóstico
Dado que todos los pacientes portadores de catéter urinario muestran bacteriuria tras un tiempo de su inserción, sólo podemos diagnosticar una ITU cuando además de observar un cultivo positivo, aparecen síntomas [12] [182] [185] [186].
Los síntomas más comunes son fiebre, malestar general, deterioro cognitivo o letargia, rigidez muscular, dolor lumbar, dolor suprapúbico y/o uretral o hematuria. En pacientes en los que se ha retirado el catéter urinario en las últimas horas también pueden aparecer los síntomas miccionales clásicos de las ITUs (aumento de frecuencia miccional, urgencia y disuria). En lesionados medulares puede observarse aumento de espasticidad o disreflexia autonómica [182] [192]. La mera presencia de orina maloliente o turbia no debe considerarse como un signo de ITU en estos pacientes [12] [182].
Dada la alta prevalencia de bacteriuria asintomática y la poca especificidad de los síntomas, es relativamente sencillo que pueda asumirse el diagnóstico de ITU asociada a catéter cuando el foco infeccioso sea otro. Por ello deben descartarse siempre otros signos de infección en distintas localizaciones [182] [183] [185]. En este sentido, Loeb y colaboradores desarrollaron una serie de criterios para considerar que un paciente portador de catéter urinario ingresado en un centro de crónicos tiene una ITU (y por tanto es subsidiario de tratamiento antibiótico). Los pacientes deben cumplir al menos uno de los siguientes criterios: fiebre (>37.9ºC o un aumento de 1.5ºC por encima de su temperatura basal), dolor lumbar de nueva aparición, rigidez o tiritona, o delirio de nueva aparición [265].
Ante síntomas sospechosos de ITU en un paciente portador de catéter urinario es mandatorio realizar urocultivo, dado que se considera una ITU complicada, con participación polimicrobiana y/o por gérmenes multirresistentes [12]. No debemos guiarnos por el sedimento en el diagnóstico de estos pacientes [182] [184]. Para realizar el urocultivo, la muestra de orina debe obtenerse del puerto previsto a tal efecto en el catéter mediante una técnica aséptica; y si el catéter no tiene puerto, mediante la punción directa con aguja y jeringa de la sonda, aspirando hasta la salida de orina suficiente [182] [189]. Si el catéter urinario es de larga duración, lo aconsejable es recambiarlo antes de recoger el urocultivo [182] [192]. Nunca debe recogerse la orina de la bolsa colectora.
Se barajan distintas cifras de UFC necesarias para diagnosticar una ITU asociada a catéter. Algunas guías consideran como positivo un cultivo recolectado de manera estéril desde el catéter urinario en el que se observen ≥103 UFC/ml [12] [182] [192], y otras estiman que debe haber al menos 105 UFC/ml [186] [183] [184] [191] [266]. Probablemente pueda considerarse urocultivo positivo en un paciente sintomático cuando el recuento sea >103 UFC/ml, mientras que debe considerarse diagnóstico de bacteriuria asintomática cuando el recuento sea >105 UFC/ml [16] [182] [192].
No está indicado realizar urocultivo rutinarios en pacientes asintomáticos [12] [16] [182] [183] [185] [186] [192] dado que, como hemos mencionado, el tratamiento de la bacteriuria asintomática en estos pacientes no procede [185].
En pacientes con evolución a sepsis urinaria, debe solicitarse también hemocultivos [185].
16.E. Tratamiento de las ITU asociadas a catéter.
Está contraindicado el tratamiento de la bacteriuria asintomática salvo previamente a cirugías que rompan la mucosa del tracto urinario [12] [16] [183] [184] [185] [191]. En caso de candiduria asintomática, pese a que los antifúngicos no están indicados, puede considerarse reemplazar el catéter [185].
En presencia de infección sintomática, el antibiótico se elegirá en base al antibiograma del urocultivo obtenido antes de iniciar el tratamiento [12] [184] [185] [186] [192], y, si no se ha hecho ya antes de la recogida del urocultivo, el catéter urinario debe retirarse o reemplazarse antes de iniciar el antibiótico [12] [185] [267].
Cuando la situación clínica del paciente no permita retrasar el inicio del antibiótico, se emplearán empíricamente antibióticos de amplio espectro teniendo en cuenta las tasas crecientes de resistencias locales [12] [182] [184] [185] [268]. Una vez obtenido el antibiograma, se podrá modificar el tratamiento o se desescalará cuando sea posible [185] [186]. Tendremos en cuenta si recientemente el paciente ha usado quinolonas [269] [270] [271], o si ha estado hospitalizado [272], dado que el riesgo de gérmenes multirresistentes es mayor en estos casos [182].
Se puede emplear empíricamente un antibiótico betalactámico con inhibidor de betalactamasas (piperacilina-tazobactam), si se sospecha que el origen en un bacilo gram negativo. En función de las tasas de resistencia locales y los antecedentes del paciente pueden preferirse otros antibióticos como las cefalosporinas o las quinolonas [184].
En caso de sospecha epidemiológica de coco gram positivo como agente etiológico, estaría indicado el tratamiento con ampicilina, teicoplanina o vancomicina (según patrones de resistencia local o alergias del paciente) [184].
La duración recomendada del tratamiento antibiótico será 5-14 días dependiendo de la respuesta clínica del paciente, de las comorbilidades y del patógeno responsable [12] [182] [184] [185] [186] [192] [273] [274] [275]. Lo ideal es reducir la duración del tratamiento, especialmente en infecciones leves o con respuesta clínica inmediata, para evitar seleccionar microorganismos resistentes [182].
En mujeres que desarrollan una ITU tras la retirada del catéter y que no muestran signos de infección del tracto urinario superior, puede emplearse una pauta de sólo 3 días [12] [182] [192].
17. PROFILAXIS INFECCIOSA EN PROCEDIMIENTOS UROLÓGICOS
Profilaxis básica: asepsia.
Todo procedimiento intervencionista aumenta el riesgo de colonización bacteriana del órgano cuya integridad se irrumpe, bien por patógenos del propio paciente (microbioma), bien del entorno sanitario (nosocomial). Las tasas de infección tras un procedimiento endourológico se sitúan en general por debajo del 2.5% [276], mientras que en casos de cirugías mayores este porcentaje asciende hasta cifras superiores al 30% [277] [278] [279]. Además del evidente aumento de la morbilidad que estas infecciones suponen para el paciente, entrañan un incremento importante de los costes y de la estancia hospitalaria [280] [281].
La primera medida, por tanto, es evitar que el intervencionismo introduzca bacterias mediante la implementación de medidas de asepsia [282] [283], que incluyen la correcta limpieza y esterilización de los instrumentos [284], de las salas de exploraciones y quirófanos, lavado de manos apropiado [285], uso de material estéril de protección (guantes, bata etc. cuando su uso esté indicado), etc…. Las complicaciones infecciosas disminuyen si el paciente se ducha antes de una intervención quirúrgica, si se corta el vello en vez de rasurarlo justo antes de la incisión [286], si se usa una solución antiséptica de clorhexidina o alcohólica (esta última nunca en mucosas) o si se usa doble guante [287]. Algunas medidas que no han demostrado un claro beneficio en la prevención de la infección son: la preparación intestinal prequirúrgica [288] [289] [290], el baño prequirúrgico con clorhexidina frente al uso de otros jabones [291], el control estricto de la glucemia frente al control convencional [292], o el uso de cobertura adhesiva cutánea durante la cirugía [293].
Es conveniente seguir el procedimiento aconsejado por la OMS tanto en lo relativo al correcto lavado de manos como al uso apropiado de los guantes estériles [294] [295].
Detección de bacteriuria asintomática antes de procedimientos urológicos.
Dado que la mayoría de los procedimientos urológicos se realizan en el tracto urinario, en casos de bacteriuria asintomática, clásicamente se ha presupuesto que estos microorganismos podrían pasar al torrente circulatorio [296] [297]. No obstante, actualmente es conocido que esto sólo ocurre cuando se interrumpe la mucosa urotelial (resecciones transuretrales de vejiga o próstata, por ejemplo) o cuando desde el tracto urinario inferior se asciende al superior, sobretodo en pacientes con litiasis (mayor carga infectiva [298]) o cuando se emplean altas presiones endoluminales [299].
Distintos estudios no han observado mayor riesgo de infección postoperatoria en pacientes con bacteriuria asintomática [299] [300] [301]. Otros factores, en cambio, como el índice de comorbilidad de Charlson [301], el diagnóstico de cáncer urológico o cirugías y antibioterapia recientes [300] [302] sí mostraron asociación con la infección postoperatoria.
Las guías actuales recomiendan hacer screening de bacteriuria asintomática sólo antes de intervenciones endourológicas que rompan la mucosa o de alto riesgo infeccioso [12] [16] [192].
Profilaxis antibiótica empleada en procedimientos urológicos
Se recomienda administrar antibioterapia antes de comenzar el procedimiento (Tabla 10), de modo que los niveles del antimicrobiano en el tejido sean suficientes en el momento en que se realiza la intervención [303] [304]. El antibiótico a emplear se decidirá en función de [12] [303] [304] [305] [306]:
- Tipo de cirugía: se empleará profilaxis antibiótica en cirugías limpias sólo si se va a insertar material protésico o implante; en las limpias-contaminadas y en las contaminadas. Se entiende por cirugía limpia aquella que se realiza sobre tejidos no infectados ni inflamados y sin entrada al tracto gastrointestinal, urinario o vagina.
- Especies de bacterias contaminantes más frecuentes del sitio quirúrgico.
- Penetrancia del antibiótico en el órgano o tejido en el que queremos evitar la infección.
- Factores del paciente (como alergias, función renal o peso).
- Bacterias aisladas en cultivos previos.
- Exposición previa a antibióticos.
- Patrones de resistencia bacteriana locales.
- Necesidad o no de repetir la administración del antimicrobiano según el tiempo de cirugía y la vida media del antibiótico (de modo que exista siempre una dosis mínima efectiva del mismo en el tejido diana).
La profilaxis antibiótica no debe prolongarse más allá de 24 h salvo que el paciente requiera tratamiento antibiótico por infección de la herida u otros motivos [303] [304] [305] [307] [308] [309] [310] [311], dado que se asocia con un mayor riesgo de inducir resistencias bacterianas sin reducir el riesgo de infección del sitio quirúrgico [312].
Sólo los procedimientos que interrumpen la mucosa urotelial o con alto riesgo de complicaciones infecciosas tienen indicación de profilaxis antibiótica. El sobreuso de antibioterapia da lugar a efectos adversos en el paciente y la aparición de patógenos multirresistentes, por lo que debe usarse la menor cantidad necesaria para disminuir el riesgo de infección [303].
No se recomienda realizar profilaxis antibiótica en [12] [304]:
- Cistoscopias [313],
- Estudios urodinámicos [314]. Se puede considerar la profilaxis a dosis única en casos seleccionados: pacientes con patología neurógena, inmunosuprimidos, alteraciones anatómicas, instrumentación genitourinaria o antibioterapia reciente [304],
- Litotricia extracorpórea [315] [316],
- Cirugía mínimamente invasiva de tumores renales o adrenales.
En otros procedimientos, existe discusión sobre la conveniencia de usar profilaxis. Este es el caso de los siguientes:
- Ureteroscopias. La profilaxis parece no disminuir el riesgo de infección del tracto urinario [317], a pesar de lo cual la Asociación Europea de Urología recomienda la administración de una dosis única de antimicrobiano previo al procedimiento, justificada por el alto riesgo de sepsis consiguiente [12].
- Resecciones transuretrales de vejiga. Una revisión sistemática no encontró disminución de las infecciones del tracto urinario clínicas con la profliaxis antibiótica [318]. La Asociación Europea de Urología recomienda la profilaxis únicamente en pacientes de alto riesgo [12].
Está bien establecida la recomendación de aplicar profilaxis antimicrobiana en los siguientes supuestos:
- Pacientes sometidos a cirugía limpia con implante de material protésico (esfínter urinario artificial, prótesis de pene, prótesis de testículo).
- Cirugía limpia-contaminada: si se realiza una incisión cutánea en el área genital, perineal o incluso inguinal [319] [320], o en procedimientos endourológicos en los que se interrumpe la mucosa (especialmente resecciones transuretrales de próstata [321]).
- Cirugía contaminada: si ocurre apertura del tracto gastrointestinal, urinario o la vagina [322] [323] [324] [325] o existen litiasis infectivas o grandes [316] [326] [327].
- Cirugía sucia: si se realiza en áreas infectadas. Un claro ejemplo es la gangrena de Fournier. En estos casos se recomienda antibioterapia profiláctica y terapeútica.
18. INFECCIONES DE TRANSMISIÓN SEXUAL (ITS)
1. Generalidades
Las ITS son de las infecciones de declaración obligatoria más frecuentes del mundo [328], afectando anualmente a 70 - 110 millones de personas. Representan casi 20 millones de infecciones incidentes en EEUU [329] [330] [331], cifra que va en claro aumento en los últimos años [332], cuantificándose en > 15 billones de dólares anuales los costes médicos directos de estas infecciones en EEUU [333].
Las ITS más frecuentes son clamidia, gonorrea, trichomoniasis, genital herpes y virus del papiloma humano [331] [334]. Aunque su presentación urogenital es la más frecuente, no son raras la afectación orofaríngea, recto-anal u ocular [335] [336]. Además de la vía genital, también se ha descrito trasmisión a través de la saliva en pacientes con infección orofaríngea [337].
Las ITS por sífilis, gonorrea y clamidia aumentan el riesgo de adquirir VIH [338], bien por la presencia de úlceras que facilitan la invasión del tejido por el VIH, o bien por una respuesta inmune local que da lugar a la proliferación de CD4 [339].
Además, las ITS se asocian a un riesgo elevado de esterilidad y malos resultados gestacionales [340] [341].
La educación sexual, junto a las estrategias de diagnóstico y tratamiento precoz, disminuyen la trasmisión y las complicaciones, por lo que todos nuestros esfuerzos deben centrarse en la prevención (primaria, secundaria y terciaria) [342].
2. Tipos de infecciones de trasmisión sexual
ITS por Virus
Virus de inmunodeficiencia humana (VIH)
Es un retrovirus linfotropo, del que se conocen dos subtipos (tipos 1 -el más común- y 2). La infección por VIH ocasiona la disminución del recuento de linfocitos T CD4, resultando en una inmunodeficiencia severa si no se instaura tratamiento [343]. Cuando el recuento de linfocitos T CD4 es < 200 células/µl o aparecen infecciones oportunistas, podemos hablar de SIDA (síndrome de inmunodeficiencia adquirida) [344].
El virus puede contagiarse por contacto sexual, por contacto sanguíneo (en adictos a drogas por vía parenteral que comparten jeringas y agujas, por accidente laboral en sanitarios, y antiguamente mediante transfusiones sanguíneas) o por vía materno-fetal tanto durante el parto como durante la lactancia [345] [346] [347] [348].
El tratamiento anti-retroviral permite controlar la infección sin erradicarla.
Virus del papiloma humano (VPH)
Es un virus de DNA que infecta las células basales epiteliales por contacto directo, siendo la transmisión sexual la más frecuente. Existen más de 180 subtipos, los cuales pueden clasificarse en no-oncogénicos, y oncogénicos, y dentro de éstos, de bajo y alto riesgo (el serotipo 16 es el más oncogénico) [12].
Produce lesiones genitales/anales (condilomas acuminados) o no genitales (verrugas en manos y pies), que son en general de tipo verrucoso, aunque pueden darse infecciones asintomáticas. Los condilomas acuminados son lesiones verrucosas que tienden a crecer y que aparecen varios meses tras el contagio [349].
La infección por VPH se asocia a cáncer ano-genital, oral, laríngeo y pulmonar cuando existen factores asociados como el tabaquismo, la inmunosupresión, el embarazo o la exposición a radiación ultravioleta [350] [351] [352].
Se han comercializado distintas vacunas que pueden emplearse no sólo antes del contacto con el virus, sino tras la aparición de lesiones de alto grado, aunque la evidencia al respecto de esta última indicación es aún débil [12].
Virus del herpes simple (VHS)
El VHS produce el herpes labial y genital. En general, el serotipo 1 es responsable del herpes labial y el tipo 2 del herpes genital, aunque cada vez se observan más infecciones genitales por el VHS-1 [353] [354] [355].
El VHS da lugar a episodios recurrentes de lesiones características. Las lesiones de la primoinfección aparecen en < 1 semana tras el contagio, son inicialmente vesiculadas, < 1mm de diámetro, agrupadas sobre una base eritematosa. Evolucionan hacia la ulceración con la posterior aparición de costras que se resuelven en < 3 semanas. Estos episodios suelen ir precedidos o acompañados por síntomas neuropáticos en la zona (especialmente quemor) [355] [356].
El diagnóstico, además de la historia clínica y la exploración física, debe obligatoriamente incluir la confirmación mediante serología realizada preferiblemente tras 3 semanas de la primoinfección, o PCR de la lesión [357] [358].
No existe tratamiento erradicador. Los brotes se tratan con tratamiento antiviral oral (aciclovir, valaciclovir, o famciclovir) para disminuir la intensidad de los síntomas [358] [359] [360]. La vacunación de los pacientes seropositivos podría reducir la trasmisión y las recurrencias [361].
Virus de la hepatitis A, B y C (VHA, VHB y VHC)
La infección por virus hepatotropos puede ocasionar hepatitis aguda (VHA, VHB), o infecciones crónicas (VHB, VHC) [362]. Se trasmiten mediante contacto sanguíneo y por otros medios. El VHB es el más contagioso por prácticas sexuales de cualquier tipo [363] [364] [365]. El VHA se trasmite por vía fecal-oral, y puede contagiarse mediante coito anal u otras prácticas anales [366] [367]. El VHC se trasmite eminentemente por vía sanguínea, siendo su contagiosidad muy baja por vía sexual [368], aunque de forma similar al VHA, la trasmisión es mayor en relaciones coitales anales, especialmente en presencia de coinfección por otras ITS como el VIH u otras infecciones ulcerativas [369] [370] [371] [372].
Existe vacuna eficaz frente a los virus hepatotropos VHA y VHB [373] [374]. En el caso de VHC, por contra, tenemos disponible actualmente un tratamiento curativo [375] [376].
Virus del molusco contagioso
Es un virus de la familia de los Poxvirus que se trasmite por contacto directo. El contacto sexual en adultos da lugar a lesiones localizadas en genitales, mientras que el contacto no sexual suele producir lesiones cutáneas en niños (tronco, axilas y cara) [377].
El virus produce unas pápulas características con una típica umbilicación central [378]. El diagnóstico es habitualmente clínico, mediante la observación de las pápulas [378]. Tradicionalmente el tratamiento ha consistido en el curetaje de las lesiones, aunque actualmente disponemos de otras opciones [379]. El hecho de que las pápulas se resuelvan espontáneamente tras un periodo de tiempo variable, hace que debamos considerar el balance riesgo-beneficio de estas nuevas terapias [380].
ITS por Bacterias
Neisseria gonorrhoeae
También denominado gonococo. Produce la gonorrea, una de las infecciones de declaración obligatoria más frecuentes en los países industrializados [381]. Aunque la infección puede cursar asintomática (>50% en mujeres, >20% en hombres), es frecuente la secreción purulenta en el lugar de la colonización (tracto urogenital, recto o faringe). También se puede presentar disuria, dolor suprapúbico o metrorragias [382]. Para el diagnóstico se prefiere la realización de PCR del exudado (vaginal, endocervical, uretral en varones, faríngeo o rectal), o del primer chorro de orina, ya que el cultivo tradicional tiene menor sensibilidad [357]. El tratamiento de elección es ceftriaxona (500mg – 1g), en ocasiones combinada con azitromicina [357] [383] [384] por las tasas crecientes de resistencias que se están detectando [334] [385] [386].
Chlamydia trachomatis
Es la causa más frecuente de ITS en los países industrializados [381]. En más de la mitad de los casos la infección es asintomática, pero los serotipos D-K (los más frecuentes) pueden ocasionar uretritis, prostatitis u orquitis-epididimitis en varones, cervicitis, endometritis o salpingitis en mujeres o inflamación anorrectal en ambos. Por su parte, los serotipos L1-L3 producen linfogranuloma venéreo, un cuadro más severo caracterizado por una úlcera genital acompañada de una adenopatía inguinal dolorosa (o bubón). En ambos casos, la ausencia de tratamiento da lugar a progresión de la infección y aparición de patologías más graves como esterilidad o destrucción tisular y manifestaciones extragenitales [387].
Todos los serotipos de clamidia pueden producir esterilidad, siendo más frecuente con los serotipos D, E, F, G, H, I, J, K. Del mismo modo, todos los serotipos pueden producir manifestaciones extragenitales. Los serotipos que causan más destrucción celular son L1, L2, L2a y L3.
El diagnóstico se basa en PCR (de elección) de muestras de exudado cervical o vaginal en la mujer, uretral en el hombre, o rectal o faríngeo en ambos, o bien una muestra de orina de primer chorro [388].
Para el tratamiento de la infección aguda se recomienda: doxiciclina (100mg x 7 días), o azitromicina (1g en dosis única) [357]. La doxiciclina podría dar mejores resultados, especialmente en casos de C. trachomatis rectal [389] [390] [391] [392].
Treponema pallidum
El treponema pallidum es la bacteria responsable de la sífilis.
La infección trascurre por distintos estadios [393] [394]:
- En el estadío primario aparece, en el sitio del contagio, una lesión ulcerada, indurada e indolora, de base limpia y color asalmonado, denominada chancro. A la semana suele aparecer una adenopatía también indurada e indolora.
- Sin tratamiento, tras 2-4 semanas, estas lesiones desaparecen y puede pasarse a un período asintomático de latencia, tras el cual aparecerá el estadío secundario de la sífilis (o bien puede pasarse directamente a este período secundario). En este momento aparece un rash cutáneo, especialmente en las palmas y las plantas de los pies, adenopatías generalizadas, lesiones mucosas y alopecia parcheada, que en ocasiones se acompañan de afectación visceral (hepatitis, nefritis o meningitis). Tras 2-3 años desaparece esta clínica y aparece un período latente en el cual se mantienen asintomáticos la mayor parte de los pacientes.
- Sin embargo, un pequeño porcentaje desarrolla síntomas de un estadío terciario de la infección, que se caracteriza por nuevas lesiones generalizadas hipodérmicas gomosas que se ulceran, enfermedad coronaria y valvulopatía aórtica, y afectación del SNC (llamada neurosífilis: meningitis, meningomielitis, parálisis cerebral progresiva, tabes dorsal). Se ha descrito que la neurosífilis puede aparecer en cualquier estadío dado que algunos serotipos de T.pallidum tienen mayor trofismo por el SNC [395].
Para su diagnóstico, habitualmente se emplean tests serológicos, que pueden ser treponémicos y no treponémicos:
- Los test treponémicos (TPPA, FTA-Abs, CLIA, entre otros) utilizan antígenos recombinantes de la bacteria para detectar IgG o IgM, y en general no negativizan nunca pese a que se haya tratado la enfermedad [396]. Son más sensibles en los primeros momentos de la infección, pero tienen una considerable tasa de falsos positivos [397].
- Los test no treponémicos (VDRL, RPR), por su parte, detectan anticuerpos dirigidos contra antígenos de la bacteria (cardiolipina, lecitina) tras la dilución seriada de suero del enfermo, y sí que permiten monitorizar la evolución de la enfermedad con tratamiento mediante la cuantificación de sus niveles [398].
El algoritmo diagnóstico tradicional consiste en realizar un test no treponémico, y, si resulta positivo, entonces proceder a realizar un test treponémico. Sin embargo, también puede usarse un algoritmo reverso [396] [399].
Para el tratamiento se recomienda emplear penicilina benzatina 2.4 millones en dosis única parenteral [397].
Haemophilus ducreyi
Su infección ocasiona el cancroide o chancro blando, cuya prevalencia es baja [400]. Produce típicamente varias úlceras dolorosas, de base sucia y profunda, que coexisten en la mitad de los casos con una adenopatía inguinal supurativa (bubón) [401].
Su diagnóstico es clínico, una vez descartada la infección por T. pallidum o VHS. El diagnóstico microbiológico requiere el cultivo en medios especiales [402], aunque algunos laboratorios han desarrollado sus propias técnicas de PCR [403]. Para su tratamiento, suele ser suficiente con una dosis única de azitromicina [357].
Klebsiella granulomatis
Es la responsable del granuloma inguinal o donovanosis, que se inicia como un granuloma subcutáneo que termina dando lugar a una úlcera genital no dolorosa, sangrante, con bordes muy bien delimitados, con tendencia a crecer sin tratamiento [404]. Su prevalencia es baja [405] y su diagnóstico es dificultoso, ya que requiere la visualización directa mediante microscopía de células mononucleares con quistes intracitoplásmicos conteniendo estas bacterias (cuerpos de Donovan) [404]. El tratamiento se basa en la azitromicina en régimen prolongado (>3 semanas) [357].
Gardnerella vaginalis
Se trata de una bacteria anaerobia comensal que reside en la vagina y cuyo sobrecrecimiento da lugar a vaginosis. No queda claro si se adquiere o no por contacto sexual, pero es conocido que algunos subtipos pueden ser trasmisibles sexualmente [406] [407] [408] [409] y ocasionar infecciones genitourinarias en varones [410] [411]. Como tratamiento se emplea metronidazol o clindamicina [412] [413].
Mycoplasma genitalium
Aunque la infección por esta bacteria a veces es asintomática, puede dar lugar a uretritis y cervicitis [414] [415] [416]. Se diagnostica mediante PCR y su tratamiento se basa en azitromicina 500mg como dosis inicial y posteriormente 250mg diarios durante 5 días [417]. Sin embargo, existen resistencias crecientes a macrólidos en la literatura [418], por lo que se recomienda evaluar estas resistencias antes del tratamiento [417] [418].
Mycoplasma hominis
Aunque hay controversia sobre la capacidad patogénica de esta bacteria [419] [420], en ocasiones puede verse asociada a otros patógenos en casos de uretritis [421] [422]. Puede detectarse mediante PCR, aunque actualmente no está ampliamente aceptado testar a los pacientes para este microorganismo [420].
Ureaplasma urealyticum
Puede causar uretritis [423] [424] y prostatitis, pero se desconoce con exactitud su efecto en el tracto genital femenino [425] [426]. Su diagnóstico se realiza mediante PCR [427] y no se recomienda su tratamiento salvo si la carga bacteriana es alta [420].
Ureaplasma parvum
No queda clara su asociación con ITS [419] [420] [423] [428], por lo que su diagnóstico y tratamiento no se recomiendan [357] [420].
ITS por Protozoos
Trichomonas vaginalis
Este microorganismo es con frecuencia asintomático en hombres [429], aunque en ocasiones da lugar a uretritis [430], o con menor frecuencia prostatitis o epididimitis [431]. En mujeres suele producir vulvovaginitis con flujo maloliente y espumoso, dispareunia e inflamación vulvar y síntomas miccionales [432].
El diagnóstico puede hacerse en fresco a través de observación directa en el microscopio (microscopía de preparación húmeda) de un frotis vaginal [433], o idealmente mediante PCR en orina de primer chorro (especialmente en hombres), ya que tiene mayor sensibilidad y especificidad [434]. El tratamiento de elección es el metronidazol o tinidazol oral [357].
ITS por Hongos
Candida albicans
Se trata de un hongo comensal de la vagina, que se piensa que en ocasiones puede trasmitirse sexualmente [435] [436] [437] y dar lugar a balanitis y balanopostitis y vulvovaginitis [438] [439]. El diagnóstico se realiza mediante cultivo, y el tratamiento se basa en el uso de azoles [440].
Manifestaciones clínicas de las ITS.
En general las ITS pueden dar lugar a úlceras genitales, uretritis o prostatitis en hombres, cerviticitis en mujeres y proctitis o faringitis en ambos, según las prácticas sexuales que han producido el contagio [441] [442] [443] [444]. Sin embargo, al menos un tercio de los infectados se mantiene asintomático [445] [446] [447] [448].
En mujeres, muchas ITS pueden dar lugar a enfermedad inflamatoria pélvica y esterilidad [449] [450] [451]. En embarazadas también pueden producir corioamnionitis, parto prematuro [452] [453] o infección neonatal si el bebé, que atraviesa el canal del parto, entra en contacto con las lesiones [454]. Las infecciones neonatales son sobretodo oculares [455]. Algunas ITS pueden, además, atravesar la placenta y dar lugar a infección fetal [394] [456] [457].
Diagnóstico de las ITS
La técnica más sensible y específica para el diagnóstico de estas infecciones es la PCR [357], especialmente en localizaciones extragenitales [458]. Es fundamental, ante un paciente con diagnóstico de ITS, descartar otras coinfecciones, ya que son muy frecuentes [12] [459] [460].
Tratamiento de las ITS.
Las infecciones bacterianas, fúngicas y por protozoos son curables; sin embargo, sólo algunas víricas tienen tratamiento.
Es muy importante, en las infecciones tratables, tratar también a todas las parejas sexuales que el paciente haya tenido en los 60 días previos al diagnóstico [12] [357].
Existe controversia sobre la realización o no de test que confirmen la erradicación de la infección tras el tratamiento [12] [357], que puede ser necesario sobre todo cuando la infección asienta en localizaciones extragenitales [357].