Fármacos antidiabéticos en la Enfermedad Renal Crónica
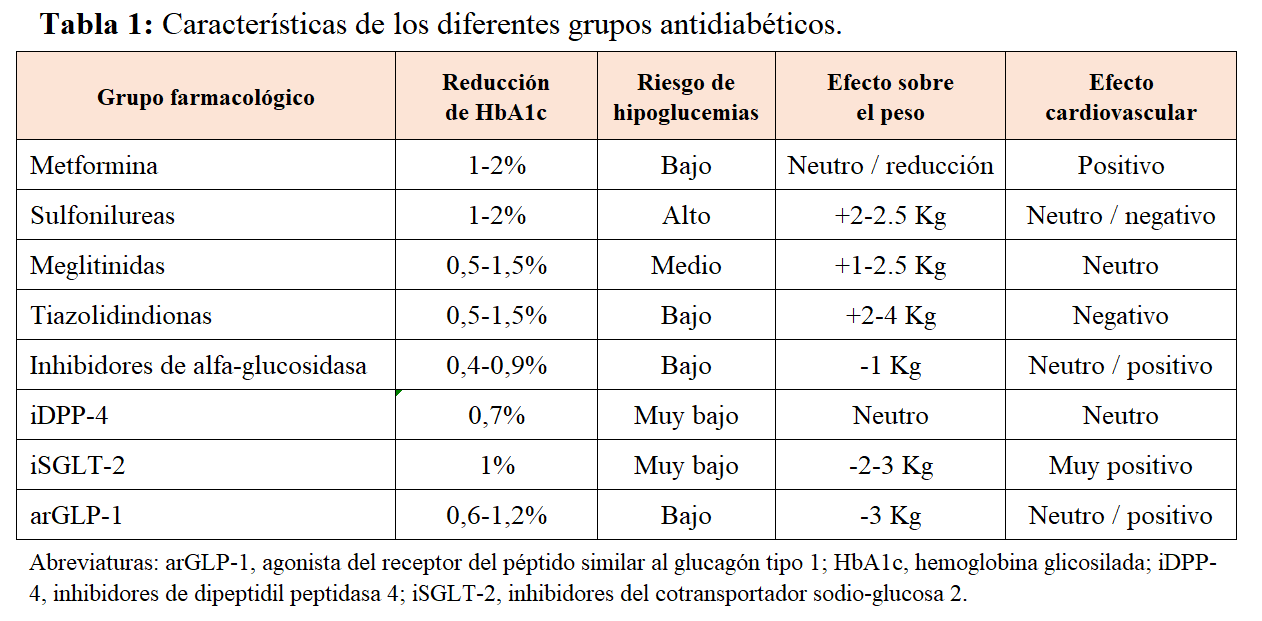
A lo largo de los años se han desarrollado diferentes familias de fármacos antidiabéticos, cada una de las cuales tiene diferentes dianas terapéuticas. Ello conlleva que tengan diferente potencia antidiabética, efecto sobre el peso y consecuencias sobre la salud cardiovascular (Tabla 1).
Las sulfonilureas, las meglitinidas, los inhibidores de la dipeptidil peptidasa 4 (DPP-4) y los análogos del péptido similar al glucagón tipo 1 (GLP-1) promueven la liberación de insulina por parte del páncreas. La metformina y los inhibidores de la alfa-glucosidasa reducen la absorción de glucosa a nivel intestinal. Además, tanto la metformina como las glitazonas aumentan el uso de glucosa y la sensibilidad a la insulina en los tejidos periféricos. Los análogos de la amilina reducen la cantidad de glucosa ingerida, puesto que aumenta la saciedad a través de una regulación gástrica. Los inhibidores del cotransportador sodio-glucosa tipo 2 (SGLT-2) bloquean la reabsorción de glucosa a nivel del túbulo renal aumentando su excreción por la orina.
1. BIGUANIDAS
La metformina es la biguanida más conocida, más usada y el antidiabético oral recomendado de primera elección en todas las guías clínicas de pacientes diabéticos desde que fue comercializado. Las principales características que lo avalan son su bajo coste, seguridad clínica, bajo riesgo de hipoglucemia y buen perfil cardiovascular [1].
Mecanismo de acción
La metformina suprime la gluconeogénesis al inhibir la enzima glicerol-fosfato-deshidrogenasa, que es la responsable de convertir el glicerol fosfato en dihidroxiacetona fosfato, impidiendo la participación del glicerol a la gluconeogénesis. Por otra parte, la inhibición de esta enzima disminuye la conversión de lactato a piruvato, limitando la contribución de lactato en la gluconeogénesis y produciendo un exceso de lactato y glicerol en el plasma [2]. Además, activa la proteína cinasa dependiente de adenosin monofosfato (AMPK), que inhibe la producción hepática de glucosa. En el hígado, la activación de AMPK suprime la gluconeogénesis y disminuye la biosíntesis de ácidos grasos y colesterol [3].
A nivel muscular, la metformina mejora la captación de insulina y glucosa mediante la estimulación de los receptores de insulina tirosincinasa y de los transportadores-4 de glucosa [4]. Por último, la metformina tiene un efecto intestinal más limitado, disminuyendo la absorción de glucosa.
Eficacia clínica
La metformina es uno de los fármacos antidiabéticos metabólicamente más eficaces: en monoterapia, disminuye la hemoglobina glicosilada (HbA1c) en un 1-2%. Tiene un efecto neutro sobre el peso y en algunos estudios se ha visto que incluso puede disminuirlo.
A nivel cardiovascular, algunos estudios han demostrado un beneficio de la metformina. En el estudio UKPDS (United Kingdom Prospective Diabetes Study), los pacientes asignados a metformina tuvieron menos complicaciones cardiovasculares y mortalidad que los asignados a recibir sulfonilurea o insulina [5]. Estos hallazgos fueron confirmados a largo plazo en el periodo post-observacional del estudio [6]. En otro ensayo clínico con 390 pacientes tratados con insulina fueron aleatorizados a recibir metformina o placebo: el grupo tratado con metformina tuvo una reducción de complicaciones macrovasculares de un 40% (HR 0,6 [IC95% 0,4-0,9]) [7]. En un metaanálisis de 170 ensayos clínicos y 25 estudios observacionales, el tratamiento con metformina redujo la mortalidad cardiovascular comparada con sulfonilureas [8].
En otros aspectos, también tiene un efecto beneficioso sobre los lípidos: disminuye los niveles de triglicéridos y discretamente los de LDL-colesterol, y aumenta el HDL-colesterol [9]. Además, un metaanálisis de estudios observacionales mostró que el tratamiento con metformina podría disminuir la incidencia de cáncer, sobre todo colorrectal [10], aunque estos datos no fueron confirmados en otro metaanálisis que incluyó ensayos clínicos [11]. La hipótesis sobre el mecanismo por el que la metformina puede tener un efecto beneficioso sobre la incidencia de cáncer es a través de la regulación de AMPK vía LKB1 (Peutz-Jeghers protein), que es un inhibidor de las células tumorales [12].
Efectos adversos
Los efectos secundarios gastrointestinales (náuseas, vómitos y diarrea) son los más frecuentes que comporta el tratamiento con metformina. Dichos efectos se pueden minimizar iniciando el tratamiento a dosis bajas, incrementándolo lentamente y haciendo coincidir la toma de medicación con las comidas. En los ensayos clínicos, sólo el 5% de los pacientes tuvieron alteraciones gastrointestinales asociadas al tratamiento con metformina.
La acidosis láctica es una complicación potencialmente letal, aunque tiene una baja incidencia (5/100.000 pacientes/año), y se asocia habitualmente a situaciones de hipoxia y procesos concomitantes. En un metaanálisis que incluyó 347 estudios con 70940 pacientes que tomaban metformina, no se registró ningún caso de acidosis láctica, aunque probablemente no se incluyeron pacientes con insuficiencia hepática o enfermedad renal crónica avanzada, población susceptible de desarrollar esta complicación. En un estudio retrospectivo, se ha comprobado que el riesgo de acidosis láctica es similar entre los pacientes que toman metformina y los que no cuando el FGe es >30 mL/min/1.73m2, incrementándose en los pacientes con enfermedad renal crónica (ERC) estadios 4 y 5 [16]. Por todo ello, se recomienda la suspensión temporal en los pacientes que padezcan vómitos, diarrea u otras causas potenciales de deshidratación, hipoxemia o sepsis, y ante procedimientos quirúrgicos o radiológicos con administración de contrastes yodados.
Por último, la metformina se asocia a hipovitaminosis B12, pues reduce la absorción intestinal de esta vitamina hasta en un 30% y disminuye la concentración en un 5-10%, pero raramente produce anemia megaloblástica. La dosis y la duración del tratamiento con metformina se asocian con el déficit de vitamina B12 [17].
Metformina en enfermedad renal diabética
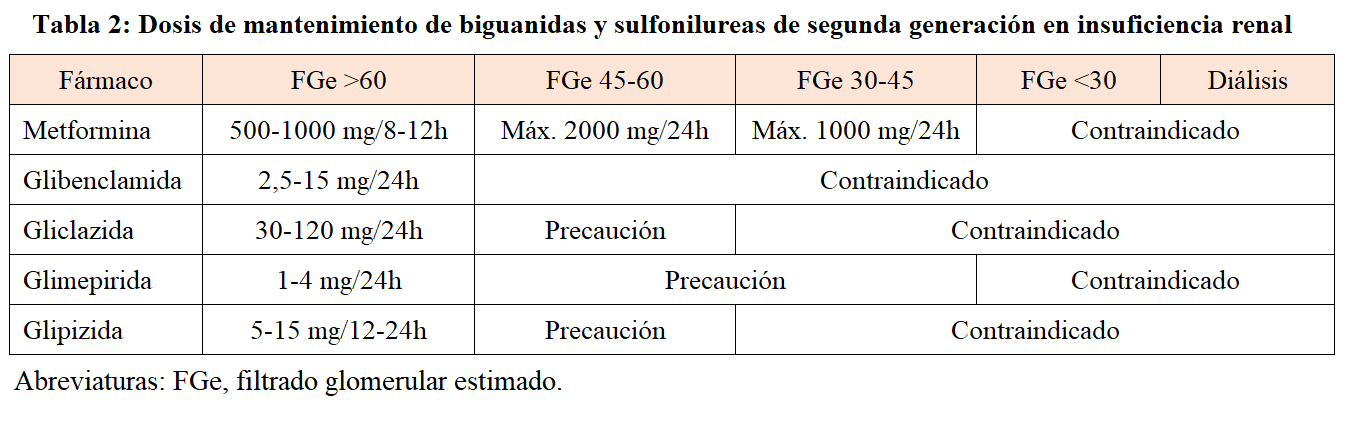
La metformina se elimina fundamentalmente a nivel renal, mediante filtración glomerular y secreción tubular. Por ello, requiere ajuste de dosis en pacientes afectados de ERC (Tabla 2). Se puede utilizar con seguridad incluso en pacientes con filtrado glomerular estimado (FGe) de hasta 30 mL/min/1,73m2, siempre con ajuste de dosis en FGe de 60-30 mL/min/1,73m2 [13]. Se debe aconsejar a los pacientes en tratamiento con metformina y estadio 3 de ERC que suspendan el tratamiento en situaciones con riesgo de sepsis, deshidratación o hipoxemia hasta que la patología desaparezca. En pacientes con riesgo de padecer deterioro de la función renal, por estar bajo tratamiento con diuréticos, antiinflamatorios no esteroideos o con riesgo de deshidratación, es importante evaluar la función renal de forma periódica. Se recomienda suspender el tratamiento con metformina en pacientes a los que se va a administrar contrastes radiológicos intravenosos independientemente de su función renal basal. Los datos de la literatura muestran que pacientes con inestabilidad vascular, hipotensión arterial, hipoperfusión o FGe <45 mL/min/1,73m2 son los que tienen más riesgo de desarrollar acidosis láctica y fracaso renal agudo tras la administración de contrastes yodados [14].
En la actualidad no hay evidencia de que el tratamiento con metformina tenga un efecto específico a nivel de progresión de la ERC, aunque no existen ensayos clínicos recientes realizados en este sentido.
2. SULFONILUREAS
La primera generación de sulfonilureas (acetohexamida, clorpropamida, tolazamida y tolbutamida) ha sido reemplazada por la segunda generación, que incluye gliclazida, glimepirida, gliquidona, glipizida y glibenclamida. Las sulfonilureas, en general, tienen una buena tolerancia y su coste es bajo.
Mecanismo de acción
Las sulfonilureas actúan sobre el canal de potasio sensible a ATP (KATP) situado en la célula beta pancreática. Este canal regula la liberación de insulina por parte de la célula pancreática, por lo que las sulfonilureas estimulan la secreción de insulina en respuesta tanto a la glucosa como a otros secretagogos como los aminoácidos. Además, tienen efectos extrapancreáticos, aumentando la sensibilidad tisular a la insulina.
Eficacia clínica
La potencia metabólica de las sulfonilureas es buena: en monoterapia disminuyen la HbA1c en 1-2%. Uno de sus efectos más negativos es que se asocian a una ganancia ponderal significativa de 2-2,5 Kg. En un ensayo clínico de 6033 pacientes con DM tipo 2 y elevado riesgo cardiovascular, el aumento de peso con glimepirida comparado con linagliptina fue de 1,54 Kg en 6 años [18].
Al contrario que las de primera generación, las sulfonilureas de segunda generación no parece que aumenten el riesgo cardiovascular. En algunos ensayos, cuando se comparan con metformina, el pronóstico es peor en relación con el uso de sulfonilureas, pero probablemente sea por el efecto beneficioso de la metformina. En un metaanálisis de 115 ensayos de al menos 6 meses de duración, la comparación de sulfonilureas con otro fármaco antidiabético no mostró diferencias en la incidencia de eventos cardiovasculares, aunque sí aumentó la mortalidad (OR 1.22 [IC 95% 1.01-1.49]) [19]. Otro metaanálisis de 47 estudios de al menos un año de duración que comparó sulfonilureas de segunda generación con dieta, placebo u otro antidiabético no demostró un aumento de mortalidad cardiovascular [20].
Efectos secundarios
La hipoglucemia es el efecto secundario más frecuente, aunque no suele ser grave. Es menos común cuando utilizamos sulfonilureas de acción corta como gliclazida o glipizida. En un metaanálisis, la gliclazida fue la sulfonilurea asociada a menor riesgo de hipoglucemia [21]. La aparición de hipoglucemias es más frecuente en los siguientes casos: después del ejercicio físico, con dosis elevadas, con sulfonilureas de acción larga, en pacientes malnutridos, con intoxicación alcohólica y en paciente con insuficiencia renal, cardiaca o alteraciones gastrointestinales. Otros efectos adversos poco frecuentes incluyen náuseas, reacciones cutáneas o aumento de transaminasas.
Un aspecto importante de las sulfonilureas es que tienen una fuerte unión a proteínas plasmáticas (particularmente albúmina), por lo que no se pueden eliminar mediante hemodiálisis. Asimismo, es importante conocer que el tratamiento concomitante con otros fármacos (bloqueadores beta, warfarina, salicilatos, gemfibrozilo, sulfamidas y tiazidas) puede desplazar las sulfonilureas de su unión con la albúmina aumentando sus valores plasmáticos, y como consecuencia, aumentando el riesgo de hipoglucemia.
Sulfonilureas en enfermedad renal diabética
Entre las sulfonilureas, la glibenclamida y la glimepirida se metabolizan en el hígado a metabolitos activos que conservan la acción hipoglucemiante y se eliminan por la orina, por lo que se acumulan en caso de ERC y pueden producir hipoglucemias graves de duración prolongada. La glimepirida necesita ajuste de dosis hasta ERC estadio 4; sin embargo, es recomendable que su uso se limite a pacientes con FGe >60 mL/min/1,73 m2. El empleo de glibenclamida debe evitarse en pacientes con ERC de cualquier grado, puesto que su metabolito (el gliburide) es muy activo, y el riesgo de hipoglucemia es muy elevado. La gliclazida y la glipizida, tras su metabolización hepática generan metabolitos inactivos que se eliminan en su mayor parte a través de la orina, de ahí que el riesgo de producir hipoglucemias graves sea menor. Pueden utilizarse en pacientes con insuficiencia renal leve o moderada (FG >45 mL/min/1,73m2) ajustando la dosis y monitorizando cuidadosamente la función renal. La gliquidona se metaboliza en el hígado y sus metabolitos inactivos se excretan por la bilis, por lo que no requiere ajuste de dosis ni está contraindicada en pacientes con ERC, pero actualmente no se comercializa en nuestro país. La dosificación de las sulfonilureas en ERC se puede consultar en la (Tabla 2).
No se han demostrado efectos específicos de las sulfonilureas a nivel renal. En resumen, existen pocas evidencias que avalen el empleo de estos antidiabéticos en pacientes con ERC, por lo que la recomendación de las diferentes guías es limitar su uso en pacientes con FG >45 mL/min/1,73m2.
3. MEGLITINIDAS
Mecanismo de acción
Las meglitinidas (repaglinida y nateglinida) estimulan la secreción de insulina en el páncreas mediante el cierre de los canales de KATP en la membrana de las células beta pancreáticas. Dicho mecanismo es similar al de las sulfonilureas, pero en un lugar de unión diferente.
Eficacia clínica
Como antidiabético, la repaglinida tiene una eficacia algo superior a la nateglinida. En un metaanálisis de 15 ensayos que midieron la eficacia de meglitinidas comparadas con placebo, metformina o combinación con insulina, la reducción de HbA1c fue mayor con repaglinida (0,1-2,1) que con nateglinida (0,2-0,6) [22].
Aunque la evidencia es escasa, las meglitinidas se asocian a un aumento de peso 1-2,5 Kg. No existen estudios sobre el efecto cardiovascular de las meglitinidas en pacientes diabéticos
Efectos secundarios
El efecto secundario más importante es la hipoglucemia. Sin embargo, se acepta que este riesgo es menor que el que se presenta con las sulfonilureas. El metabolismo de las meglitinidas es hepático, con una eliminación renal del 10%, y tienen una semivida corta, por lo que requieren una dosificación más frecuente que las sulfonilureas.
Meglitinidas en enfermedad renal diabética
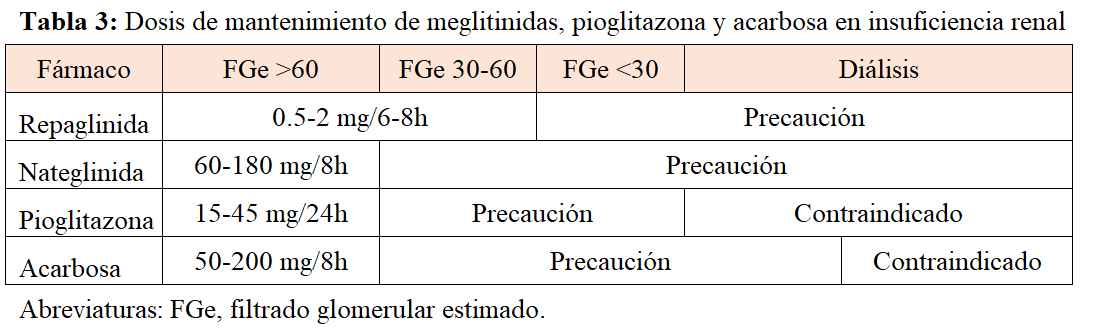
La repaglinida se puede usar en cualquier estadio de ERC, incluso en diálisis, recomendándose iniciar el tratamiento con una dosis baja (Tabla 3). Aunque se puede utilizar en todos los estadios de ERC, no hay análisis de su eficacia en pacientes con FGe <20 mL/min/1.73m2. La nateglinida, sin embargo, no está recomendada en la ERC avanzada, dado que tiene un metabolito activo que se elimina a nivel renal.
4. TIAZOLINEDIONAS (GLITAZONAS)
En el año 2010, la Agencia Europea de Medicamentos (EMA) desautorizó el uso de rosiglitazona, por lo que la única glitazona comercializada en Europa es la pioglitazona.
Mecanismo de acción
Las glitazonas se unen y activan los receptores PPARγ (receptor de peroxisoma proliferador activado gamma) modificando la transcripción de múltiples genes implicados en el metabolismo de la glucosa y de los lípidos [23]. También aumentan la sensibilidad a la insulina, ya que reducen la resistencia periférica, aumentan la captación de glucosa en los músculos y en el tejido adiposo, y disminuyen la secreción de glucosa a nivel hepático. Finalmente, preservan la función de las células beta pancreáticas: aumentan la adipogénesis, favorecen la entrada de ácidos grasos y la lipogénesis, y reducen la neoglucogénesis y el valor de ácidos grasos en plasma.
Eficacia clínica
La potencia antidiabética de las glitazonas es moderada. En monoterapia, disminuye la HbA1c entre 0,5 y 1,4%, por lo que no se prescriben como antidiabéticos de primera o segunda línea. Su indicación está limitada a casos de intolerancia a otros antidiabéticos, pacientes con alto riesgo de hipoglucemia, resistencia tisular a la insulina, hígado graso o ictus reciente. Además, se asocian a una marcada ganancia de peso, de hasta 2-4 Kg.
En 2010, se suspendió la comercialización de rosiglitazona, siendo contraindicado por la EMA debido a un aumento de riesgo de infarto agudo de miocardio y mortalidad cardiovascular [24]. La pioglitazona no se ha asociado con un aumento de riesgo de mortalidad cardiovascular. Así se demostró en el ensayo clínico PROactive (The Prospective Pioglitazone Clinical Trial in Macrovascular Events trial), que evaluó el efecto de pioglitazona en 5228 diabéticos tipo 2. A pesar de no aumentar el riesgo de eventos cardiovasculares ateroscleróticos, dada su capacidad de retención hidrosalina, tanto pioglitazona como rosiglitazona aumentan significativamente el riesgo de insuficiencia cardíaca en todos los estudios realizados [25].
El efecto de rosiglitazona y pioglitazona sobre los lípidos es diferente. La pioglitazona tiene un efecto más beneficioso sobre LDL-colesterol y triglicéridos, aunque ambas moléculas aumentan los niveles de HDL-colesterol alrededor de un 10% [26].
Efectos secundarios
Sus efectos secundarios sobre la volemia limitan las indicaciones de este grupo de fármacos. La retención hidrosalina y los edemas son los efectos secundarios más importantes. Se deben a un aumento de la reabsorción de sodio por la activación de receptores PPARγ en los túbulos colectores. El edema periférico ocurre en un 4-6% de pacientes que toman estos fármacos, y es más frecuente cuando se asocia a insulina [27]. La retención hidrosalina puede precipitar episodios de insuficiencia cardíaca.
En algunos estudios se ha asociado el uso de pioglitazona con menor densidad ósea y mayor riesgo de fracturas óseas, sobre todo en mujeres. Aunque es un efecto raro, se debe limitar su uso en mujeres con osteoporosis [28].
Los resultados de diferentes estudios no son concluyentes, pero se ha descrito una asociación entre cáncer de vejiga y pioglitazona [29]. Se debe limitar su uso en pacientes con antecedentes.
La troglitazona, comercializada en Estados Unidos y Reino Unido, fue retirada del mercado por un grave riesgo de toxicidad hepática. Aunque pioglitazona no se ha asociado con mayor hepatotoxicidad, se recomienda la monitorización de enzimas hepáticas. Por otro lado, pioglitazona disminuye la grasa hepática, por lo que está indicada en pacientes con hígado graso [30].
Por último, algunos estudios muestran un aumento de riesgo de edema macular asociado al tratamiento con pioglitazona, aunque otros no. Parece que se asocia con la duración y la severidad de la diabetes, pero en cualquier caso, el riesgo es bajo [31].
Pioglitazona en enfermedad renal diabética
La pioglitazona no aumenta el riesgo de padecer hipoglucemia, mejora el perfil lipídico y ha aportado beneficios cardiovasculares y de nefroprotección en ERC. La pioglitazona se puede utilizar en todos los estadios de ERC sin ajuste de dosis, aunque se debe evitar su prescripción con FGe <30 mL/min/1,73m2 por el riesgo aumentado de retención hidrosalina (Tabla 3).
5. INHIBIDORES DE LA ALFA-GLUCOSIDASA
Mecanismo de acción
Los inhibidores de la alfa-glucosidasa (acarbosa y miglitol) bloquean una enzima del epitelio intestinal encargada de la hidrólisis de los oligosacáridos, trisacáridos y disacáridos en glucosa y otros monosacáridos. Con ello se logra una disminución de la absorción intestinal de glucosa sin inducir riesgo de hipoglucemias.
Eficacia clínica
Su potencia metabólica es reducida (disminución de HbA1c entre 0,4-0,9%), con un efecto más marcado sobre la glucemia posprandial. Se asocia a una ligera reducción del peso corporal en torno a 1 Kg.
Algún estudio ha mostrado un efecto beneficioso de acarbosa sobre el riesgo cardiovascular, que todavía no ha sido confirmado [32]. Su efecto sobre el perfil lipídico es controvertido: algún estudio ha mostrado un efecto beneficioso, aún no confirmado en un metaanálisis [33]
Efectos secundarios
El efecto secundario más frecuente es la diarrea y las flatulencias, que aparecen en un 79% de los casos. Además, presentan necesidad de una dosificación frecuente a lo largo del día.
Inhibidores de la alfa-glucosidasa en enfermedad renal diabética
En los pacientes con ERC se produce un acúmulo de metabolitos derivados tanto de acarbosa como de miglitol, por lo cual su uso está limitado (Tabla 3). La acarbosa se podría utilizar hasta estadios de ERC con FGe >25 mL/min/1,73m2. El miglitol debería evitarse en cualquier estadio de ERC; no se comercializa actualmente en España.
6. ANÁLOGOS DE LA AMILINA
La pramlintida es un análogo de la amilina, una hormona neuroendocrina sintetizada y almacenada en la célula beta pancreática que se secreta junto con insulina. Pramlintida regula los niveles de glucosa posprandial al enlentecer el vaciado gástrico, promover la saciedad y disminuir el aumento de glucagón posprandial en pacientes diabéticos. Sus efectos secundarios son básicamente gastrointestinales, tiene un alto coste y tiene una eficacia moderada para disminuir la HbA1c. Su uso está solo aprobado en pacientes con diabetes tipo 1 y tipo 2 en tratamiento con insulina, si bien no se comercializa en España. La dosis de pramlintida no hay que modificarla en los estadios de ERC 2 a 4, y no existe una evidencia del uso de este fármaco en pacientes con ERC avanzada.
7. INHIBIDORES DE DPP-4
Mecanismo de acción
Las incretinas son hormonas secretadas por el intestino en respuesta a la ingesta, que tienen como efecto principal un aumento en la secreción insulínica por la célula beta pancreática (además de otros efectos metabólicos) [34]. Las dos incretinas más estudiadas son el péptido similar al glucagón tipo 1 o GLP-1, y el péptido inhibitorio gástrico. La proteína DPP-4 es una enzima que degrada las incretinas. Existen varios grupos de fármacos que actúan en la vía de las incretinas, siendo los que primero aparecieron los inhibidores de la DPP-4 (iDPP-4) o gliptinas. Estos antidiabéticos orales inhiben la enzima catabolizante, con lo que se aumentan los niveles de incretinas, y con ello, aumenta la insulinemia y se reduce la glucemia tanto en ayunas como posprandial. La experiencia de uso con estos fármacos es ya prolongada, desde la aprobación de la sitagliptina en 2006.
Eficacia clínica
Entre sus características beneficiosas destacan una eficacia metabólica razonable (reducción media de HbA1c de 0,7%), y un perfil de seguridad bastante positivo, con un riesgo muy reducido de hipoglucemias [35][36]. Se pueden administrar en monoterapia, o combinados con otros antidiabéticos (incluyendo insulinas) con la excepción de los arGLP-1. Actualmente se suelen utilizar como tercer o cuarto escalón de tratamiento. No modifican sustancialmente el peso.
Tienen un efecto neutro sobre la salud cardiovascular y la mortalidad, con la excepción de saxagliptina (y quizás alogliptina) que parece aumentar el riesgo de reingreso por insuficiencia cardíaca [37].
Efectos secundarios
No presentan efectos adversos notables. Ha habido reportes de pancreatitis aguda y artritis, y datos epidemiológicos sugestivos de mayor riesgo de enfermedad inflamatoria intestinal, que no han podido ser adecuadamente confirmados hasta la fecha.
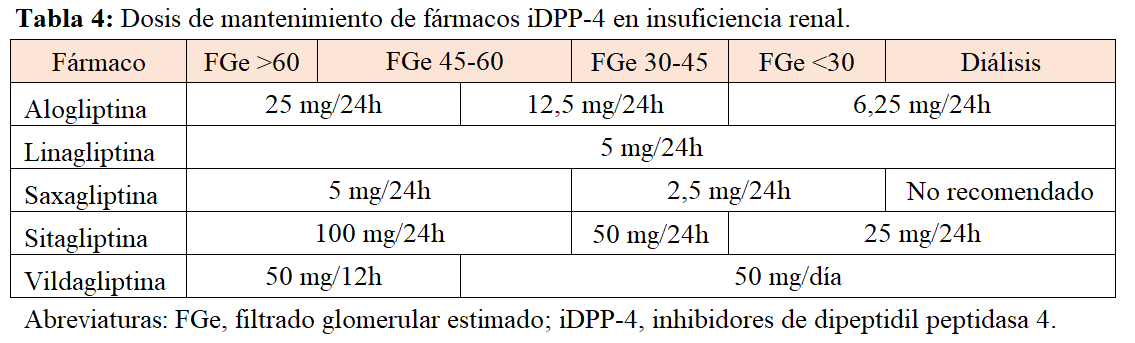
Inhibidores de DPP-4 en enfermedad renal diabética
Todos los iDPP-4 se pueden administrar en pacientes con insuficiencia renal moderada a avanzada. La linagliptina tiene metabolismo fundamentalmente hepático (>90 %), por lo que no requiere ajuste de dosis. Para el resto de iDPP-4 se deben ajustar las dosis en pacientes con reducción del filtrado glomerular (Tabla 4).
Además de su utilidad puramente antidiabética, algunos iDPP4 han demostrado una ligera reducción de la proteinuria en pacientes con enfermedad renal diabética [37][38][39]. Pese a ello, no han conseguido demostrar una reducción de la progresión de enfermedad renal.
8. INHIBIDORES DE SGLT-2
Mecanismo de acción
El cotransportador sodio-glucosa tipo 2 (SGLT-2) es una de las dos proteínas responsables de la reabsorción en el túbulo proximal de la glucosa filtrada por el glomérulo. Los inhibidores de este transportador (iSGLT-2) generan una pérdida urinaria de 50-100 gramos diarios de glucosa, lo que explica su eficacia antidiabética [40]. Concomitantemente, aumentan la eliminación urinaria de sodio con cierto grado de poliuria asociada.
Eficacia clínica
Los iSGLT-2 tienen una potencia antidiabética razonable, con una reducción de HbA1c en torno al 1% [41], dependiendo fundamentalmente del control glucémico (más potencia en pacientes con peor control basal) y de la función renal (su potencia disminuye a medida que se reduce el filtrado glomerular).
Tienen un buen perfil de seguridad, con un riesgo de hipoglucemias prácticamente inexistente, salvo uso concomitante de sulfonilureas o insulina [40]. Además, se asocian a una reducción ponderal significativa en los primeros meses de tratamiento (2-3 Kg), y su efecto natriurético conlleva una reducción de la presión arterial de unos 5 mmHg.
Los diferentes iSGLT-2 (canagliflozina, dapagliflozina y empagliflozina) han demostrado en varios ensayos que aportan importantes beneficios cardiovasculares que superan con creces su impacto metabólico. En concreto, se observaron reducciones relativas del riesgo de eventos cardiovasculares del 14-17%, aunque el evento compuesto no fue homogéneo entre estudios [42][43][44]. En el caso de empagliflozina, se demostró una reducción de la mortalidad del 32%. Se ha probado que estos efectos son independientes de la dosis administrada y de la reducción de HbA1c. Cabe destacar que se trata del único grupo de fármacos antidiabéticos que ha demostrado reducir los ingresos por insuficiencia cardíaca (en torno a un 30%). De hecho, tras la publicación de ensayos clínicos en pacientes con insuficiencia cardíaca (dapagliflozina con FEVI reducida, y empagliflozina con FEVI reducida y preservada), se ha aprobado su uso en ficha técnica con esta indicación independientemente de la presencia de diabetes mellitus [45][46][47]. El mecanismo que explica los beneficios cardiovasculares no está completamente dilucidado, pero parecen influir el aumento en la diuresis y la natriuresis, y un potencial efecto antiinflamatorio y antioxidante directo.
Los iSGLT-2 estaban considerados fármacos de segundo escalón de tratamiento tras metformina, al menos en determinados grupos de pacientes. Sin embargo, a la vista de sus marcados beneficios cardiovasculares y renales (ver más adelante), cada vez más guías clínicas y consensos internacionales propugnan utilizarlo como primer escalón en combinación con metformina o incluso en monoterapia. Es el caso de la Asociación Americana de Diabetes [1], la Asociación Renal Europea [48] y la guía KDIGO de 2020 [49], cuya actualización ha salido a revisión pública y se espera su publicación definitiva a finales de 2022. Esta indicación está aún más justificada en pacientes con mayor riesgo cardiovascular o lesión establecida de órgano diana.
Efectos secundarios
El efecto adverso más destacable es un aumento en el riesgo de infecciones genitales micóticas. Estos episodios suelen ser leves y resolverse con tratamiento antifúngico tópico o sistémico, sin necesidad de interrumpir el fármaco en la mayoría de los casos. También se ha visto una tendencia a estados de hipovolemia en pacientes de alto riesgo (ancianos frágiles, tratamiento diurético intensivo), que se pueden evitar con un seguimiento clínico estrecho y un ajuste en la dosis de diuréticos. Finalmente, aumentan los niveles de LDL-colesterol en un 5-10%, aunque por otra parte se asocian a un ligero aumento de HDL-colesterol y reducción de triglicéridos. Otros eventos adversos son extremadamente infrecuentes (cetoacidosis euglucémica) o aparecieron en los estudios iniciales y no han sido confirmados en ensayos posteriores (fracturas óseas, amputaciones, gangrena de Fournier).
Inhibidores de SGLT-2 en enfermedad renal diabética
La irrupción de los iSGLT-2 ha supuesto un verdadero cambio de paradigma en el tratamiento de la enfermedad renal diabética. En cuanto a su eficacia metabólica, hay que tener en cuenta que la pérdida de función renal limita su capacidad glucosúrica, y por ello la disminución de HbA1c puede verse reducida hasta en un 50%. Este hecho provocó que la indicación oficial como tratamiento antidiabético se limitara a pacientes con filtrado glomerular normal o levemente reducido (Tabla 5). Sin embargo, el efecto beneficioso de este grupo farmacológico va mucho más allá del control metabólico. Los resultados que se están publicando han motivado cambios en las indicaciones y menores restricciones en función del filtrado glomerular por parte de los organismos internacionales. Estos cambios ya se reflejan en las fichas técnicas de los fármacos, de forma que actualmente se pueden prescribir con FGe de hasta 20-25 mL/min/1,73m2, y mantenerse hasta el inicio de la diálisis.
Estos efectos renales incluyen una reducción de la proteinuria del 30-50% y un enlentecimiento en la progresión de enfermedad renal. En los diferentes estudios de seguridad cardiovascular se vio una reducción homogénea del riesgo relativo de evento compuesto (reducción de proteinuria, progresión de ERC y muerte) que oscila entre 24-39% [50][51][52]. Estos beneficios se demostraron inicialmente en pacientes con FGe normal, con escasa representación de pacientes con insuficiencia renal. Igual que los beneficios cardiovasculares, las ventajas renales se obtienen independientemente de la dosis y del control metabólico conseguido. Posteriormente, los resultados del ensayo clínico CREDENCE demostraron con canagliflozina una reducción relativa del evento compuesto renal del 30% en pacientes con insuficiencia renal moderada [53]. Además, obtuvieron un mayor beneficio (tanto renal como cardiovascular) aquellos pacientes con mayor grado de disfunción renal o proteinuria más elevada. Estos resultados se confirmaron en el ensayo DAPA-CKD, que incluyó pacientes con y sin diabetes, y en estadios más avanzados de ERC [54]. Se espera que estos resultados se confirmen también en pacientes con normoalbuminuria cuando se publique el ensayo EMPA-KIDNEY a finales de 2022 [55].
Los mecanismos por los que se producen los beneficios renales aún están en estudio, entre ellos el aumento de la natriuresis o los efectos antiinflamatorios locales de los fármacos. Asimismo, se piensa que el aumento de sodio que llega al túbulo distal produce una vasoconstricción de la arteriola aferente a través del mecanismo de retroalimentación túbulo-glomerular [56]. Con ello se genera una reducción de la presión intraglomerular que explicaría la reducción de la proteinuria, que además es independiente del tratamiento con bloqueantes del sistema renina-angiotensina-aldosterona (cuyo efecto es fundamentalmente a nivel de la arteriola eferente).
Este mecanismo hemodinámico intrarrenal explica que se observe una leve caída inicial del filtrado glomerular con el inicio del fármaco (similar a la que se ve con IECA o ARA-II). Esa disminución del filtrado es funcional y transitoria, y se da justamente en los pacientes que perderán menos función renal a largo plazo [57][54].
Un estudio muy reciente ha demostrado que el tratamiento con iSGLT2 incrementa significativamente los niveles séricos y urinarios de Klotho en pacientes con diabetes tipo 2, mientras que a nivel experimental, el cultivo de células tubulares renales con iSGLT2 es capaz de prevenir, tanto a nivel de RNA mensajero como de proteína, el descenso en la expresión de Klotho inducida por condiciones estresantes para dichas células observadas en la diabetes y la ERC [58].
9. AGONISTAS DEL RECEPTOR GLP-1
Mecanismo de acción
Como se mencionó en el apartado relativo a iDPP-4, la proteína GLP-1 es una incretina intestinal que aumenta la secreción pancreática de insulina en respuesta a la ingesta, enlentece el vaciamiento gástrico y reduce el apetito. Como GLP-1 se degrada en minutos, los esfuerzos terapéuticos se han centrado en inhibir su degradación vía DPP-4 y en activar su receptor con agonistas específicos (arGLP-1).
Los arGLP-1 son fármacos de administración subcutánea, con la excepción de semaglutida, que tiene también formulación oral. Se clasifican en los de vida media corta y administración diaria (exenatida de liberación inmediata y lixisenatida), y los de vida media larga y administración semanal (exenatida de liberación prolongada, liraglutida, dulaglutida y semaglutida).
Eficacia clínica
Su potencia antidiabética es variable entre los diferentes agentes y en función de varias características del paciente, con una reducción de HbA1c que oscila de 0,6 a 1,2% [59]. El riesgo de hipoglucemia es mínimo, salvo en combinaciones con insulina o sulfonilureas. Otra de sus ventajas es una marcada reducción de peso [60], hasta el punto de que varios de estos fármacos tienen indicación como tratamiento de la obesidad en pacientes no diabéticos.
Los efectos cardiovasculares de los arGLP-1 son variables: lixisenatida y exenatida mostraron resultados neutros, mientras que liraglutida, semaglutida y dulaglutida tuvieron un efecto positivo [61][62][63]. La reducción relativa del riesgo de evento cardiovascular compuesto en estos últimos se situó en torno al 12% (siendo el efecto principal sobre ictus isquémico en los casos de semaglutida y dulaglutida), con una reducción más controvertida en la mortalidad global [64][65].
Efectos secundarios
Los efectos adversos más frecuentes son reacciones cutáneas en el punto de inyección y síntomas gastrointestinales que afectan al 10-50% de los pacientes. Se han reportado casos de pancreatitis aguda y crónica y de tumores neuroendocrinos, sin haberse establecido por el momento una relación causal.
Agonistas del receptor de GLP-1 en enfermedad renal diabética
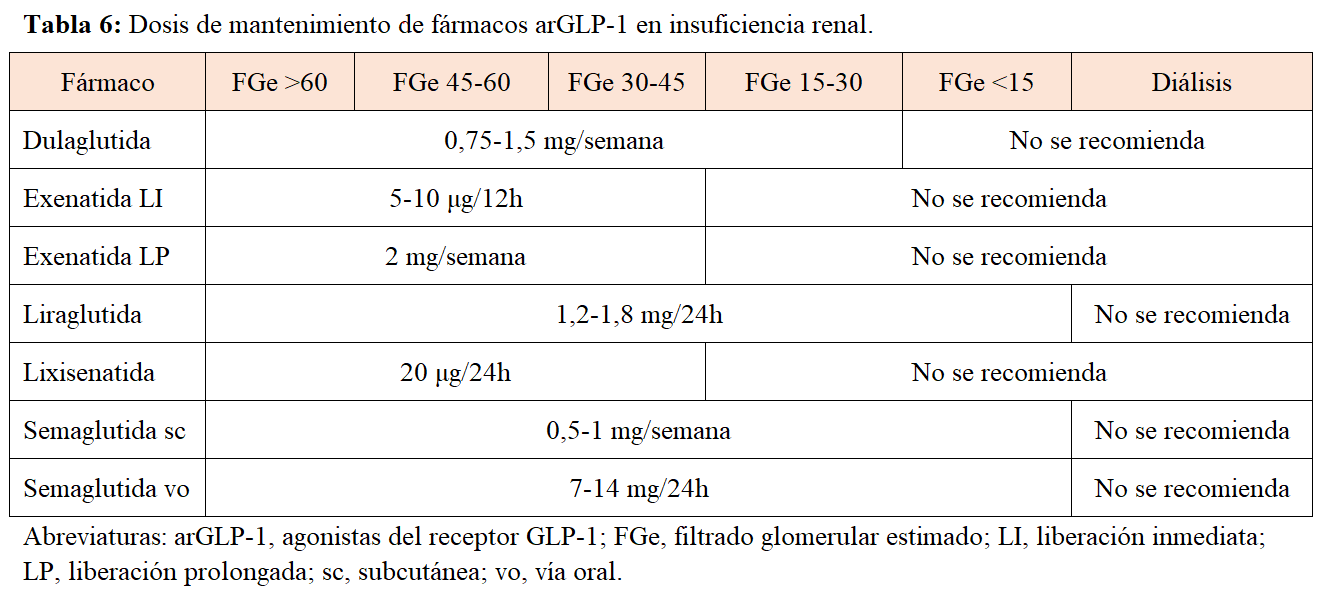
Al tratarse de proteínas grandes que no tienen metabolismo renal predominante, no es de esperar que la disminución del filtrado glomerular afecte a la farmacocinética o a la potencia del efecto de los arGLP-2. Sin embargo, dada la escasa evidencia de uso en población con enfermedad renal avanzada, existen ciertas restricciones de dosificación y uso según ficha técnica (Tabla 6).
Los potenciales beneficios renales de los arGLP-1 se han explorado únicamente como objetivos secundarios en los ensayos de seguridad cardiovascular de algunos de los fármacos. En concreto, liraglutida, dulaglutida y semaglutida subcutánea han demostrado una reducción significativa en el evento compuesto renal, si bien debida fundamentalmente a un menor número de pacientes con aparición de macroalbuminuria [64]. No se han publicado por el momento ensayos robustos que exploren el impacto renal de estos fármacos, por lo que su indicación en pacientes renales vendrá guiada por sus efectos específicos a nivel antidiabético, ponderal y cardiovascular. Está en desarrollo el ensayo clínico FLOW con semaglutida subcutánea, cuyo objetivo principal es el impacto sobre los eventos renales.
10. INSULINAS
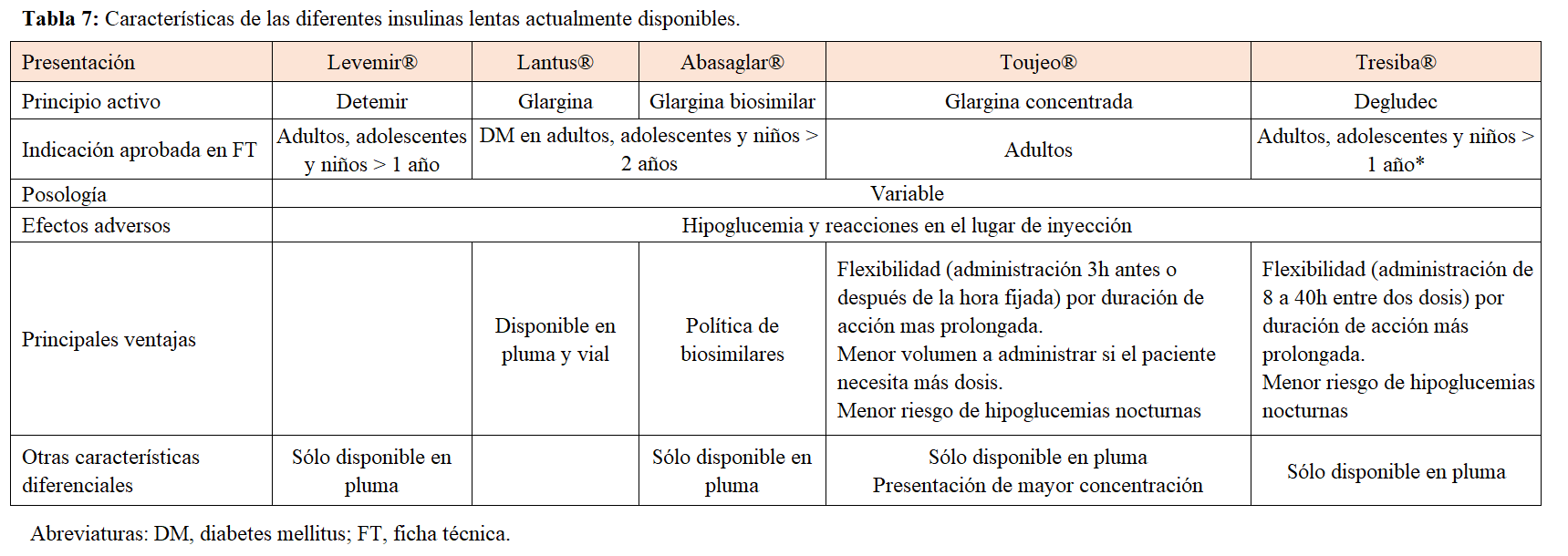
Tipos de insulinas basales
Estas formulaciones intentan simular el patrón basal endógeno de insulina, para mantener al paciente cerca de la normoglucemia en ayunas. La elección de la insulina basal de inicio se basará en el riesgo de hipoglucemia, el perfil del paciente y el balance coste-eficacia del tratamiento. Todas las insulinas basales son iguales en eficacia, pero tienen diferentes riesgos de hipoglucemia.
1)Insulina NPH: presenta un pico de acción máxima entre las 4 y 6 horas, y su duración efectiva es de 12 horas. Se puede administrar en una o dos dosis diarias, y es posible la combinación con otros fármacos antidiabéticos.
2)Insulina detemir: es un análogo soluble de insulina. La duración de acción depende de la dosis: 12 horas para dosis de 0,2 UI/Kg y 20 horas para dosis de 0,4 UI/Kg. En un tercio de los pacientes será preciso administrar dos dosis para cubrir las 24 horas.
3)Insulina glargina U-100: es un análogo con inicio de acción más lento que la NPH, con un perfil de acción más suave, sin picos y una duración de acción de hasta 18-24 horas. Debe administrarse una vez al día, todos los días a la misma hora.
4)Insulina glargina biosimilar: equivalente a insulina glargina U-100.
5)Insulina glargina U-300: es una formulación de glargina con concentración de 300 UI/mL. Tiene un perfil farmacodinámico y farmacocinético más plano y prolongado que glargina U-100, y por ello, menor riesgo de hipoglucemias con similar reducción de HbA1c en pacientes con diabetes tipo 2. En los ensayos clínicos se necesitó de media una dosis basal de glargina U-300 un 10-18% más alta que con glargina U-100.
6)Insulina degludec: es un análogo con una duración de acción superior a las 42 horas, con una variabilidad intrapaciente 4 veces menor que glargina U-100, y con la misma eficacia, pero menos hipoglucemias nocturnas. Se aconseja su administración diaria, y permite una alta flexibilidad en su administración, con períodos entre dosis de 8 a 40 horas. En España, su uso financiado se limita a pacientes con hipoglucemias de repetición tras ajuste adecuado con otras insulinas basales.
En la (Tabla 7) se muestran las principales características y diferencias entre las distintas insulinas
Pautas de insulinización
Existen varias opciones de inicio de insulinización:
1)Insulina basal: una o dos dosis de insulina NPH, o una dosis de análogo basal (glargina, detemir o degludec).
2)Insulina prandial: se realiza con tres dosis de insulina rápida o análogo ultrarrápido antes de las comidas.
3)Mezclas de insulinas: dos o más dosis de mezclas fijas de insulina rápida o ultrarrápida con insulina intermedia.
En la actualidad, la primera opción es la de elección. En pacientes asintomáticos, se puede optar por una dosis de insulina basal antes de acostarse de 10 UI (o 0,2 UI/Kg en caso de obesidad). El ajuste de dosis se realiza cada 3 días en función de las glucemias basales.
Insulinización en el paciente con diabetes tipo 2 y enfermedad renal crónica
Los requerimientos de insulina muestran un curso bifásico en los pacientes diabéticos con ERC. En etapas iniciales, el control glucémico se deteriora por un aumento a la resistencia a la insulina, requiriendo mayores dosis de insulina, mientras que en estadios avanzados de ERC la disminución del aclaramiento de insulina conduce a una mejoría en la tolerancia a la glucosa, pudiendo disminuir los requerimientos de insulina e incluso ser posible suspenderla. La disminución de la ingesta calórica por la anorexia asociada a la uremia también puede contribuir a disminuir las necesidades de insulina.
En la ERC, el riesgo de hipoglucemia grave es del doble que en población con función renal normal. El objetivo de HbA1c en pacientes sin diálisis será igual al de la población general (entre 7-7,5%), teniendo en cuenta el riesgo de hipoglucemia y de comorbilidades, y siendo en estos casos un objetivo menos estricto (7,5-8%). En general, se recomienda un control glucémico menos intensivo salvo que se usen fármacos sin riesgo de hipoglucemia. En pacientes en diálisis con importantes comorbilidades asociadas, se recomienda un objetivo de HbA1C de 7-8%.
En general, se recomienda el siguiente ajuste de dosis en pacientes con ERC: FGe mayor de 60 ml/min/1,73 m2 no se necesita reducción; FGe entre 15-60 ml/min/1,73 m2, reducción de un 25%; FGe menor de 15 ml/min/1,73 m2: reducción de un 50%. Las recomendaciones de insulinización en función del filtrado glomerular y el peso corporal serían:
FGe (ml/min/1,73 m2) DM TIPO 1 DM TIPO 2
. Dosis de insulina (UI/Kg/día) Dosis de insulina (UI/Kg/día)
> 60 1 0,5
15-60 0,75 0,3 – 0,4
< 15 0,5 0,25
Recomendaciones de insulinización en paciente hospitalizado: se recomienda sumar la dosis total de insulina que recibe el paciente (por ejemplo, si el paciente recibe 16 UI de Toujeo® y 5-6-5 UI de Novorapid® = 32 UI).
En pacientes diabéticos tratados de manera ambulatoria con antidiabéticos no insulínicos e insulina: el cálculo se realiza igual que en el punto anterior, pero se ha de sumar un 20% a la dosis total de insulina calculada. La dosis total de insulina diaria se tiene que distribuir entre insulina basal y rápida (REGLA 50/50): 50% de las unidades basal y 50% insulina rápida en bolus (30% en desayuno, 40% en comida y 30% en la cena) + pauta de corrección a la insulina en bolus en función de la glucemia preprandial.
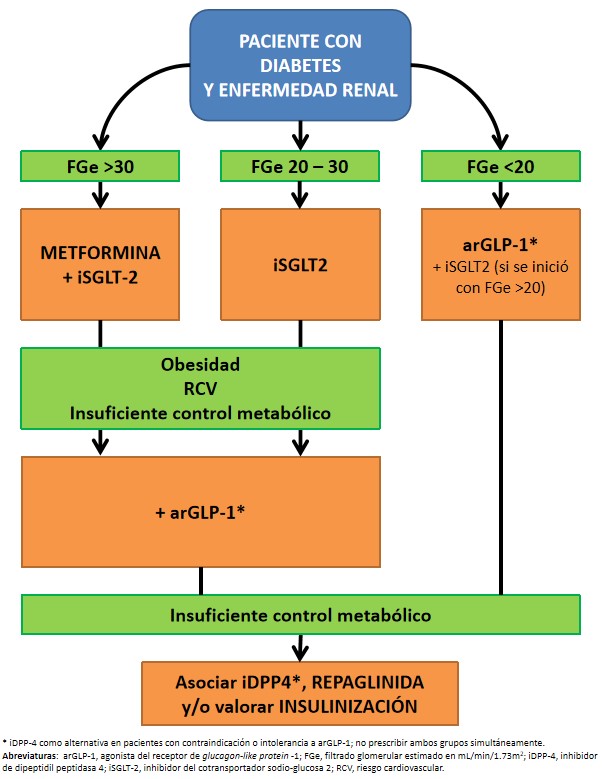
10. PRESCRIPCIÓN DE FÁRMACOS ANTIDIABÉTICOS EN EL PACIENTE RENAL
En el momento actual, las diversas guías clínicas han enfocado la elección del tratamiento antidiabético en función de las comorbilidades asociadas y circunstancias clínicas del paciente (Figura 1). Además, no existe suficiente evidencia ni ensayos comparativos directos entre iSGLT-2 y metformina para poder diferir el uso de esta última, que además cuenta con demostrados beneficios a largo plazo. En cualquier caso, e independientemente del control glucémico, en el paciente renal la evidencia actual recomienda iniciar con doble terapia que combine ambos grupos de fármacos, especialmente en aquellos que presenten proteinuria, alto riesgo cardiovascular o insuficiencia cardíaca. En pacientes diabéticos sin albuminuria, habrá que esperar a los resultados del ensayo EMPA-KIDNEY, pero resultados indirectos de otros ensayos sugieren que también se benefician de su prescripción.
En caso de pacientes de alto riesgo cardiovascular, especialmente si se benefician de pérdida ponderal, se recomienda añadir como siguiente escalón un arGLP-1. En pacientes con mayor fragilidad o una esperanza de vida más limitada con un control glucémico insuficiente, se preferiría un iDPP-4. En caso de requerir un fármaco adicional, las meglitinidas son eficaces y seguras, si bien con una posología más incómoda. Otros antidiabéticos, como las glitazonas o las sulfonilureas, presentan mayor riesgo de hipoglucemia con menores beneficios clínicos, por lo que quedan relegadas para casos puntuales.
Con el tiempo, a menudo es necesario plantear el uso de insulinas. La elección del tipo o la combinación de las mismas se hará de forma individualizada según cada paciente. Conviene valorar la combinación de la insulina con otros antidiabéticos, que por ejemplo puedan aportar beneficios cardiovasculares a medio plazo (iSGLT-2) o contrarrestar algunos efectos adversos de la insulina (como la ganancia ponderal con los arGLP-1). En este grupo de pacientes complejos con diabetes de difícil control metabólico, es imprescindible el trabajo multidisciplinar con Enfermería, Endocrinología, Nefrología, Atención Primaria, etc.
Es importante recalcar el beneficio renal y cardiovascular que ofrecen los nuevos fármacos antidiabéticos, iSGLT2 y arGLP-1, cada uno con sus características y particularidades [66].