Datos epidemiológicos. Historia natural. Aspectos clínicos.
Concepto de Enfermedad Renal Diabética (ERD) y de nefropatía diabética (ND). Datos epidemiológicos.
Clásicamente se ha venido considerando como ND la afectación renal en el enfermo con Diabetes Mellitus (DM), es decir, la presencia de proteinuria igual o superior a 300 mg/día, en el contexto de DM. Generalmente se acompaña de lesión retiniana, - fondo de ojo compatible con retinopatía diabética-, y también de hipertensión arterial (HTA), hechos que a lo largo de su evolución conducirán hacia la aparición de insuficiencia renal crónica (IRC) progresiva [1].
La definición clásica de ND realmente incluía un concepto histológico de afectación preferentemente glomerular. En época reciente, la clasificación actualizada por Tervaert C et al [2] 2010, añadió la afectación túbulo-intersticial y/o vascular como formas de lesión renal en el contexto de la DM, por lo que hoy día parece más apropiado hablar genéricamente de ”Enfermedad Renal Diabética (ERD)” y reservar el concepto de ND cuando hay documentación histológica de afectación preferentemente glomerular [3].
Por otra parte, hasta fechas recientes se consideraba la presencia de lesión renal la detección de albuminuria o proteinuria, pero en los últimos años de forma creciente, se están refiriendo casos de pacientes con DM en los que no se desarrolla proteinuria, - o su presencia se constata en mínimas cantidades-, y. sin embargo, evolucionan hacia la IRC avanzada. Por ello se considera que existe probablemente un fenotipo de paciente diabético “no proteinúrico” [4].
La DM ha incrementado su incidencia y prevalencia de forma progresiva en los últimos años. En el año 2004 Wild et al [5] calcularon que el número global de pacientes diabéticos en el mundo en el año 2025 podrían llegar a 366 millones de personas, a expensas de la DM tipo 2 (DM-2). Los últimos datos publicados por la International Diabetes Federation (IDF) estimaban ya en 2017 que la población diabética mundial conocida se acercaría a 425 millones de personas, y que esta cifra podrá elevarse a 629 millones de personas en el año 2045 [6].
Existen algunas subpoblaciones especiales en las que la incidencia y la prevalencia de DM es superior a las de la población general. Así, en un reciente estudio presentado en la ID Week en USA en octubre de 2019, Birabaharan M y cols [7] han realizado un estudio transversal en una población de 90.900 pacientes con virus de la inmunodeficiencia humana (VIH), en el que han constatado que la incidencia de DM, estimada entre abril de 2014 y abril de 2019, fue del 21,1%, cuando la misma fue del 14,9% en la población general. La incidencia en los pacientes que recibieron tratamiento antirretroviral fue del 17,6%, mientras que en los no tratados fue del 24,9 %.
Las repercusiones de la DM sobre la salud de la población se basan en una alta prevalencia, que implica un coste socioeconómico muy elevado, por la aparición a lo largo del tiempo de numerosas complicaciones micro y macrovasculares conforme avanza la historia natural de la enfermedad.
Todo ello implicará un incremento de la comorbilidad, especialmente cardio-vascular (CV), que desembocará en tasas de mortalidad muy elevadas.
Conviene señalar, no obstante, que la mortalidad global por causas cardio-vasculares (CV) en el paciente con DM ha disminuido en la última década. Un análisis del National Health Interview Survey Linked Mortality en USA desde 1985 hasta 2015 ha estimado una reducción en la mortalidad de causa CV en los pacientes con DM desde el 47,8% hasta el 34,1% entre 2010 y 2015 [8].
En España, estudios recientes han estimado que la prevalencia de la población con DM tipo 1 (DM-1) puede fijarse en alrededor del 0,3% de la población total, pero es mayor la de DM-2, próxima a dos millones de personas. La distribución de la DM por comunidades autónomas no es uniforme y varia, con datos ajustados, desde un 2,8% en La Rioja o un 3,4% en Asturias hasta un 7,3% en Andalucía y un 8,1% en Canarias [9].
Algunos estudios han evaluado la prevalencia global de la DM en alrededor del 7% de la población española, dependiendo del criterio diagnóstico de DM. En la comunidad canaria, la prevalencia está próxima al 12% [10].
El Estudio Di&bet.es, transversal de base poblacional, en el que han participado 5.072 pacientes seleccionados de forma aleatorizada en 100 centros de toda España, con probabilidad en base al tamaño proporcional en todas las comunidades autónomas, ha mostrado que un 30% de la población evaluada padece algún tipo de trastorno del metabolismo hidrocarbonado y que la prevalencia de DM ajustada por edad y sexo es del 13,8%. Además en cerca del 50% la DM no está diagnosticada [11].
La Enfermedad Renal Diabética (ERD) es una de las complicaciones microangiopáticas más severas de la DM, entendiendo como tal la afección renal en el paciente diabético, que se manifestará habitualmente por proteinuria y se acompañará de hipertensión arterial (HTA) y disminución progresiva de la función renal. La presencia de retinopatía diabética es un criterio de diagnóstico de ERD, pero su ausencia no excluye la existencia de nefropatía [1]
La ERD es en la actualidad la primera causa de insuficiencia renal crónica terminal o Enfermedad Renal Crónica Avanzada (ERCA) con requerimiento de tratamiento sustitutivo renal (TSR). En USA, hasta un 44,4 % de todos los nuevos pacientes que inician TSR son diabéticos [12]. En nuestras propias estimaciones en el año 2005 calculábamos que podría haber en España cerca de 33.000 pacientes con DM-1 y entre 600.000 y 1.200.000 pacientes con DM-2 con ERD de diverso grado, desde microalbuminuria hasta ERC estadio 5 KDOQI [13].
Los datos de nuestro Registro de la S.E.N.- ONT (REER) correspondientes a 2012, mostraron que la DM fue la causa de inicio de TSR en el 24,91 % de pacientes [14]. Hemos observado en los últimos años que la DM como causa de ERC-5 se ha estabilizado, - 24,74 % en 2009, 24,97 % en 2011, 24,91% en 2013-, probablemente debido a un mejor diagnóstico de la propia DM y a una mejor aplicación de las medidas preventivas y de las recomendaciones de guías de práctica clínica y documentos de consenso existentes.
Esa tendencia a la estabilización se recoge en los dos últimos informes anuales del Registro S.E.N.-ONT correspondientes a los años 2017 y 2018, en los que el porcentaje de pacientes con DM y ERC-5 que iniciaron TSR fue del 23,9% [15] y del 24,67 % [16], respectivamente.
Mecanismos patogénicos de la afectación renal en el paciente con DM
La patogenia de la afectación renal en el paciente con DM es multifactorial, siendo la presencia de hiperglucemia crónica el principal determinante del inicio y progresión del daño renal. Los mecanismos patogénicos que participan en el desarrollo de la enfermedad renal diabética son múltiples, - factores metabólicos, hemodinámicos, profibróticos, inflamatorios-, lo que junto a la influencia genética, conduce finalmente al desarrollo de la lesión renal. Estos mecanismos han sido extensamente analizados por Juan F. Navarro y cols. [17] y serán expuestos en el capítulo correspondiente.
Historia natural y manifestaciones clínicas de la ERD en la DM-1.
Las características anatomopatológicas de la Nefropatía van ligadas a la evolución o historia natural de la enfermedad, que no es similar en la DM-1 y en la DM-2
La lesión glomerular característica de la DM-1 es la glomeruloesclerosis nodular o nefropatía de Kimmelstiel-Wilson, con la presencia de lesiones nodulares entre los capilares glomerulares, que colapsan progresivamente las luces vasculares. No obstante la lesión más frecuente es la glomeruloesclerosis difusa [18].
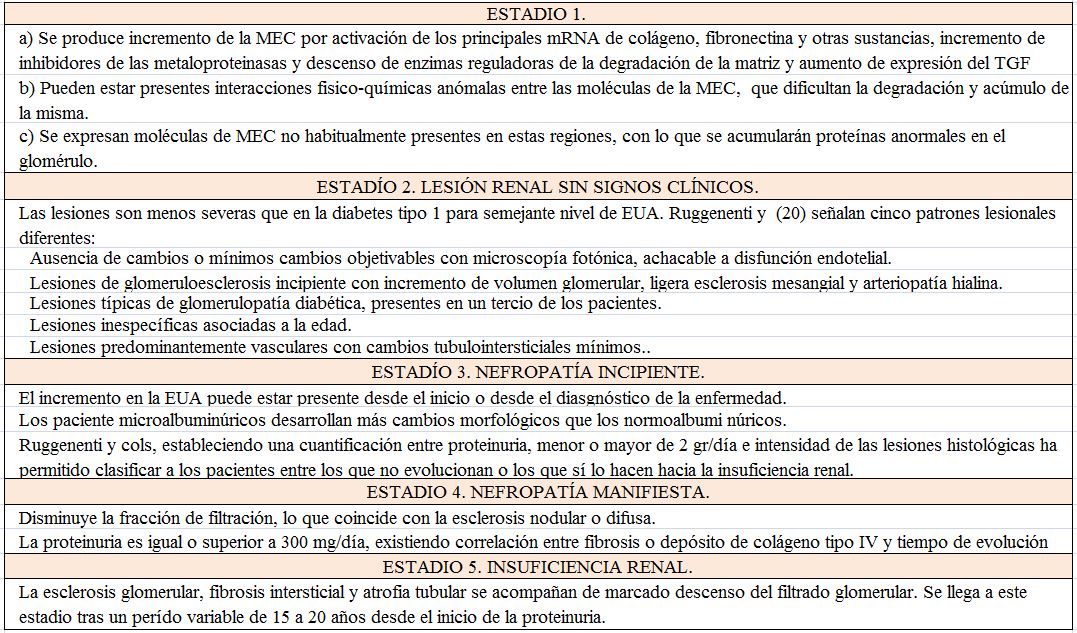
Historia natural de la nefropatía en la DM-1 (Tabla 1).
Tras una primera fase preclínica, a partir de los cinco años de evolución aparece microalbuminuria, que es la señal de alarma que lanza el riñón acerca de la presencia de disfunción endotelial. Se produce hiperfiltación glomerular. El incremento en la excreción Urinaria de Albúmina (EUA) y otras proteínas marca la progresión hacia la proteinuria establecida y el inicio de la nefropatía, que en la DM-1 puede ir precedida de la aparición de HTA, pues en la DM-2 suele ya estar presente. Ello es debido a los cambios estructurales que han ido sucediéndose, - engrosamiento de las membranas basales capilares y expansión mesangial-, y que continuarán acentuándose. La progresión vendrá marcada por el incremento de la proteinuria y descenso progresivo del Filtrado Glomerular (FG), con elevación de la creatinina plasmática, es decir, aparición de insuficiencia renal. La Insuficiencia Renal Crónica Terminal (IRCT) suele llegar después de 20 a 30 años de evolución de la DM-1 [18].
Evolución de la nefropatía en la DM-2
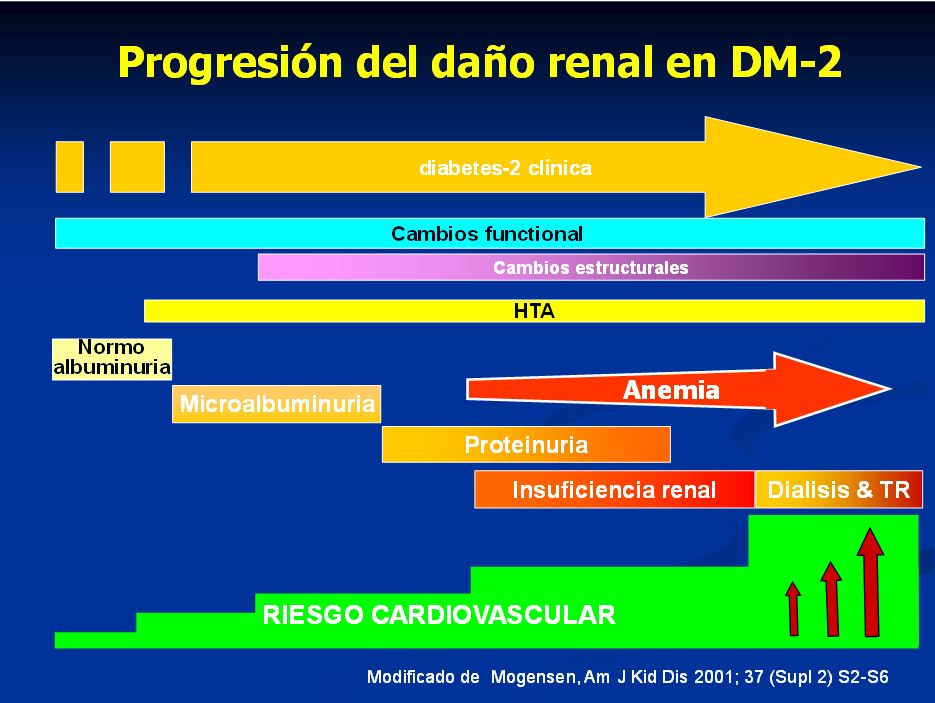
En la DM-2 la evolución puede ser muy diferente (Figura 1) y (Tabla 2). Podemos diagnosticar la DM a través de la HTA o, incluso, la DM a través de la detección de la nefropatía [19].
Un elevado porcentaje de pacientes con DM-2 presenta lesiones vasculares inespecíficas y lesiones intersticiales con mínima afectación glomerular o, incluso, sin ella. El patrón de afectación histológica del diabético tipo 2 puede corresponder a lesiones típicas de diabetes o bien a lesiones túbulo-intersticiales, con o sin hialinosis arteriolar, o esclerosis glomerular global. Ruggenenti y cols [20] establecen tres categorías: Clase I: lesiones histológicas de glomerulopatía diabética típica. Clase II: lesiones predominantes de nefroangioesclerosis. Clase III: lesiones glomerulares diferentes de la diabetes.
La más reciente clasificación de Tervaert y cols [2] ha unificado y completado todas estas diferentes apreciaciones de los distintos autores de una forma que parece más completa y coherente.
Progresión de la ERD: Proteinuria. Sindrome nefrótico. Insuficiencia Renal.
En los pacientes con DM que desarrollan albuminuria-proteinuria, reducir la proteinuria debe ser un objetivo prioritario de tratamiento. El estudio de Lewis y cols [21] demostró ya en 1993 que el tratamiento con captopril en DM-1 frenaba la progresión de la ND. Estudios posteriores, -IRMA II [22] e IDNT con irbesartán [23] y RENAAL con losartán [24]-, han mostrado que reducir la proteinuria puede frenar la progresión del daño renal, si bien la eficacia de inhibir el SRAA y de otros efectos concomitantes se muestra sobre todo en los estadios iniciales de la ERD.
La acentuación de la proteinuria puede alcanzar rango nefrótico. Antes de que ello suceda debemos intensificar el tratamiento con inhibidores del enzima conversor de angiotnsina (IECA), antagonistas del receptor de angiotensina (ARA II) o combinación de ambos -individualizando en este caso el tratamiento, con vigilancia estricta de la función renal y del potasio-, en los casos en que dicho doble bloqueo pudiera estar indicado [25].
La HTA es otro factor de progresión de las complicaciones micro y macrovasculares. La reducción de la Presión Arterial (PA) disminuye la microalbuminuria y endentece la velocidad de descenso del FG, aunque no la detiene en las fases avanzadas.
En ese momento más del 50 % de pacientes con DM1 desarrollan HTA. En la DM2, la HTA puede preceder al diagnóstico de la ND e incluso al diagnóstico de la propia DM.
Si el daño renal progresa, también lo hace paralelamente el daño vascular, con incremento progresivo del riesgo cardio-vascular (Figura 1).
Insistimos en que en fechas recientes, diversos autores están refiriendo casos de enfermos con DM en los que el deterioro del FG progresa, con mímina proteinuria o incluso si ella. Es el que se viene denominando “fenotipo no proteinúrico” de paciente y que podría explicar hasta el 50% de casos de ERCA sin proteinuria [4].
Otras manifestaciones clínicas concomitantes. Dislipemia, Obesidad. Riesgo vascular. Anemia. Malnutrición. Alteraciones del Metabolismo Oseo y Mineral.
La obesidad se asocia con ambos tipos de DM, especialmente con la DM 2.
En la dislipemia que acompaña a la DM-2 predominan las lipoproteínas ricas en triglicéridos, que son más aterogénicas y de ahí la relación con las complicaciones cardiovasculares de la DM. El Multiple Risk Factor Intervention Trial, MRFIT [25] ha mostrado que el riesgo CV está aumentado 2 a 4 veces en el enfermo diabético con respecto al no diabético.
La dislipemia induce el desarrollo de daño renal en la experimentación animal. Algunos estudios en clínica muestran que la inhibición de proteínas implicadas en la geranilización y fosforilización pueden ser frenadas bajo tratamiento con sinvastatina. Se trataría de efectos pleiotrópicos de las estatinas, no ligados al descenso de las lipoproteínas aterogénicas, que podrían inducir renoprotección. En cualquier caso el manejo de la dislipemia del paciente diabético ha de ser objetivo prioritario de tratamiento [26].
La enfermedad cardio-vascular constituye la primera causa de mortalidad en estos pacientes. En el estudio MERENA [27] mostramos cómo la mortalidad a los 3 años de seguimiento es elevada, 13.2 %, y de ella, el 50% es de origen CV [28]. La prevención del riesgo vascular es primordial desde las etapas más precoces de la enfermedad diabética.
La anemia suele ser más precoz en el diabético con IRC que en el no diabético y debe ser detectada y tratada tempranamente, dado que puede contribuir a mejorar la cardiopatía isquémica y a frenar la progresión de la hipertrofia ventricular izquierda (HVI), la progresión de la nefropatía, de la retinopatía y mejorar la calidad de vida del diabético. Los agentes eritropoyéticos externos han cambiado profundamente la problemática en estas situaciones y pueden contribuir desde fases precoces a mejorar la HVI y aminorar los factores de riesgo vascular. Sin embargo su aplicación ha sido muy cuestionada y debatida en el diabético, a raíz de los hallazgos del Estudio TREAT [29], que han marcado un punto de inflexión en el manejo de la anemia en el paciente con DM en particular y en el paciente con ERC en general.
Debemos prevenir la malnutrición en las fases avanzadas de insuficiencia renal, que es más frecuente en el paciente con DM, por la dificultad de armonizar una dieta baja en Na, grasas, ajustada en proteínas, rica en fibra y pobre en K.
Las alteraciones del metabolismo óseo y mineral en el paciente diabético pueden mostrar el patrón clásico de hiperparatiroidismo secundario a la ERC, pero también con relativa frecuencia signos de bajo remodelado óseo o hipoparatiroidismo dependiendo del manejo más o menos adecuado de la vitamina D y análogos en estos pacientes. También está en amplio debate cuáles son los niveles adecuados de 25 OH colecalciferol y cómo debe manejarse su déficit, tanto en la población con ERC diabética como no diabética. Recientemente Fernández Juárez et al (análisis post hoc del estudio PRONEDI [30] han mostrado que los niveles insuficientes de 1,25 OH vitamina D pueden influir en la progresión de la lesión renal en el paciente diabético.
La ERD puede progresar a ERCA.
Si a pesar de todo ello no somos capaces de frenar la progresión del daño renal, hemos de intentar preparar al paciente con ERD lo más tempranamente posible para individualizar la técnica de Tratamiento Renal Sustitutivo [31].
Ello requerirá una adecuada información al paciente y sus familiares, - consultas ERCA, proyecto ELECCION [32], para ayudar a la toma de decisión del TRS más idóneo en cada caso: Hemodiálisis ,-lo que requerirá la adecuada planificación a tiempo del acceso vascular, habitualmente complicado en el paciente con DM por la presencia de vasculopatía-. Diálisis Peritoneal,- con la implantación del catéter peritoneal y la preparación para un programa de Diálisis Peritoneal Continua Ambulatoria, (DPCA) o más adelante Diálisis Peritoneal Automática (DPA), la información adecuada sobre la posibilidad de Trasplante Renal si es posible anticipado -donante vivo-, o de cadáver. En la DM-1 podría estar indicado valorar la posibilidad de un trasplante doble pancreático y renal. En la DM-2 el trasplante doble, - aunque existen algunas experiencias clínicas-, no tiene una indicación reconocida.
También debe valorarse un tratamiento conservador paliativo si éste fuera el caso del paciente, tal como recogemos en el documento de Consenso sobre manejo del paciente con DM-2 y ERC [33] y en el Documento de consenso de diez sociedades sobre el manejo del paciente con ERC [34].
Comentario final.
La historia natural de la evolución de la ERD y del riesgo CV en el paciente con DM ya está cambiando, en parte debido a la aplicación más precoz y multidisciplinar de documentos de consenso y recomendaciones de guías de práctica clínica, y en parte debido a las numerosas nuevas moléculas para el manejo de la hiperglucemia y con efectos beneficiosos tanto CV como renales. Algunas de esas moléculas ya han aportado nuevas evidencias en ensayos clínicos randomizados (RCT), - fundamentalmente los Inhibidores de dipeptidil-Peptidasa 4 (iDPPP-4), los Inhibidores del co-transportador renal Na-glucosa (ISGLT2) los agonistas del Receptor de Glucagón-like-peptide-1 (arGLP1), o los inhibidores de la endotelina (atrasentán)-. Otras muchas están siendo estudiadas en RCT en fase 2 y 3, - bloqueantes del receptor mineralocorticoide, finerenona y esaxerenona-, vascular adhesion protein (VASP) y otras que irán apareciendo en un futuro próximo y que , sin duda, van a mejorar el pronóstico evolutivo de las complicaciones micro y macroangiopáticas de la DM y, en definitiva, la morbilidad, la calidad de vida y la mortalidad en nuestros enfermos.



![Tabla 1. Historia natural de la Nefropatía Diabética en la DM-1. Mogensen y cols. [19] estratificaron la progresión de la ND de la diabetes tipo 1 en cinco estadíos. No son estrictamente extrapolables a la diabetes tipo 2, que puede seguir una evolución natural muy diferente. Tabla 1. Historia natural de la Nefropatía Diabética en la DM-1. Mogensen y cols. [19] estratificaron la progresión de la ND de la diabetes tipo 1 en cinco estadíos. No son estrictamente extrapolables a la diabetes tipo 2, que puede seguir una evolución natural muy diferente.](https://static.elsevier.es/nefro/monografias/1/246/1346.jpg)