Bioimpedanciometría en la Enfermedad Renal Crónica y en Hemodiálisis
Palabras clave
Bioimpedancia vectorial, bioimpedancia espectroscópica
INTRODUCCIÓN
En los últimos años se ha incrementado el uso del análisis de bioimpedancia (BIA) para la evaluación del estado de hidratación y nutricional en la ERC [1] estando actualmente apoyado por diferentes guías clínicas a nivel internacional [2][3]. Existen diferentes dispositivos de BIA en el mercado que están siendo incorporados progresivamente a las consultas de ERC avanzada y diálisis, al ser un método validado, exacto, no invasivo, fácil de realizar y económico que permite aportar importante información sobre la composición corporal, el estado nutricional y de hidratación [4]. Los dispositivos más recientes incluyen incluso información relacionada con densidad y composición minerales y están adquiriendo cada vez más relevancia en el seguimiento de no sólo de pacientes ambulatorios en diálisis, sino también en pacientes críticos en Unidades de Cuidados Intensivos [5], pacientes con síndrome cardiorrenal [6], así como pacientes embarazadas o neonatos.
A pesar de la creciente evidencia científica al respecto, de su recomendación por primera vez en las guías KDOQI de nutrición [8] y de que un porcentaje cada vez más elevado de profesionales lo usan regularmente en la evaluación del peso seco, muchos todavía son cautelosos al aplicar resultados de cualquier herramienta técnica y aunque motivados, creen que todavía hay poca información sobre cómo se realiza la gestión del estado de volemia y nutricional en la práctica clínica y sobre las limitaciones y restricciones de uso [9]. Por ese motivo en esta actualización se abordarán asimismo aspectos prácticos y limitaciones de estos dispositivos.
UTILIDAD DE LA BIOIMPEDANCIOMETRÍA EN PACIENTES EN ENFERMEDAD RENAL CRÓNICA AVANZADA (ERCA)
1. BASES DE LA BIOIMPEDANCIOMETRÍA
En revisiones anteriores de Nefrología al día, los fundamentos, bases biofísicas y eléctricas y tipos de Bioimpedanciometría han quedado descritas, por lo que en esta actualización nos centraremos en entender las características limitaciones de los diferentes dispositivos, así como el significado de los principales indicadores que nos proporcionan.
Como ya se ha comentado previamente, su aplicación está basada en la resistencia que el organismo ofrece al paso de una corriente eléctrica alterna y tiene dos componentes vectoriales: la resistencia (R) y la reactancia (Xc). Los dispositivos monofrecuencia o single-frequency (SF-BIA) realizan una medición generalmente a 50 kHz, donde se asume que la membrana celular actúa como aislante y evita que la corriente eléctrica penetre en la célula, de forma que fluye predominantemente a través del espacio extracelular (ECW) de los tejidos. Los dispositivos multifrecuencia (MF-BIA) miden de 3 a 8 frecuencias entre 5-500 kHz. En este caso la corriente sí penetraría en la membrana celular permitiéndole pasar a través de los espacios tanto ECW como intracelular (ICW). En ambos casos para calcular el agua corporal total (TBW), ICW y ECW utilizan modelos de regresión logística.
Una interesante modificación del SF-BIA es el llamado enfoque vectorial (BIVA), que está basado en la representación gráfica directa de la R y Xc obteniendo una valoración semicuantitativa (escala de percentiles) del estado de hidratación de un sujeto en cualquier condición clínica, confrontando el vector impedancia medio con la variabilidad de la población de referencia, descrita por elipses de tolerancia, específicas por género y raza. El método no necesita asumir ningún modelo de composición corporal, o de hidratación y es independiente del peso corporal. BIA asume un modelo bicompartimental (masa grasa (FM) y masa libre de grasa (FFM)) y se deriva del agua corporal total bajo el supuesto de que la FFM tiene una composición hídrica constante del 73,2% [10].
Por otro lado, en la bioimpedancia espectroscópica (BIS, 5-1000kHz) se parte de la mismas premisas que en la MF-BIA, pero utiliza un modelo matemático y ecuaciones validadas en poblaciones de pacientes (representación Cole-Cole y ecuaciones de Hanai) para determinar la resistencia eléctrica de ICW y ECW primero, y el volumen de sus respectivos compartimentos después; de esta forma es capaz de identificar la sobrehidratación (OH) en litros. Se basa en un modelo de tres compartimentos que consiste en masa de tejido magro normohidratado (LTM), masa de tejido adiposo normohidratada (ATM) y el volumen de sobrehidratación (OH) (agua extracelular (ECW) en exceso a la esperada en una persona normal).
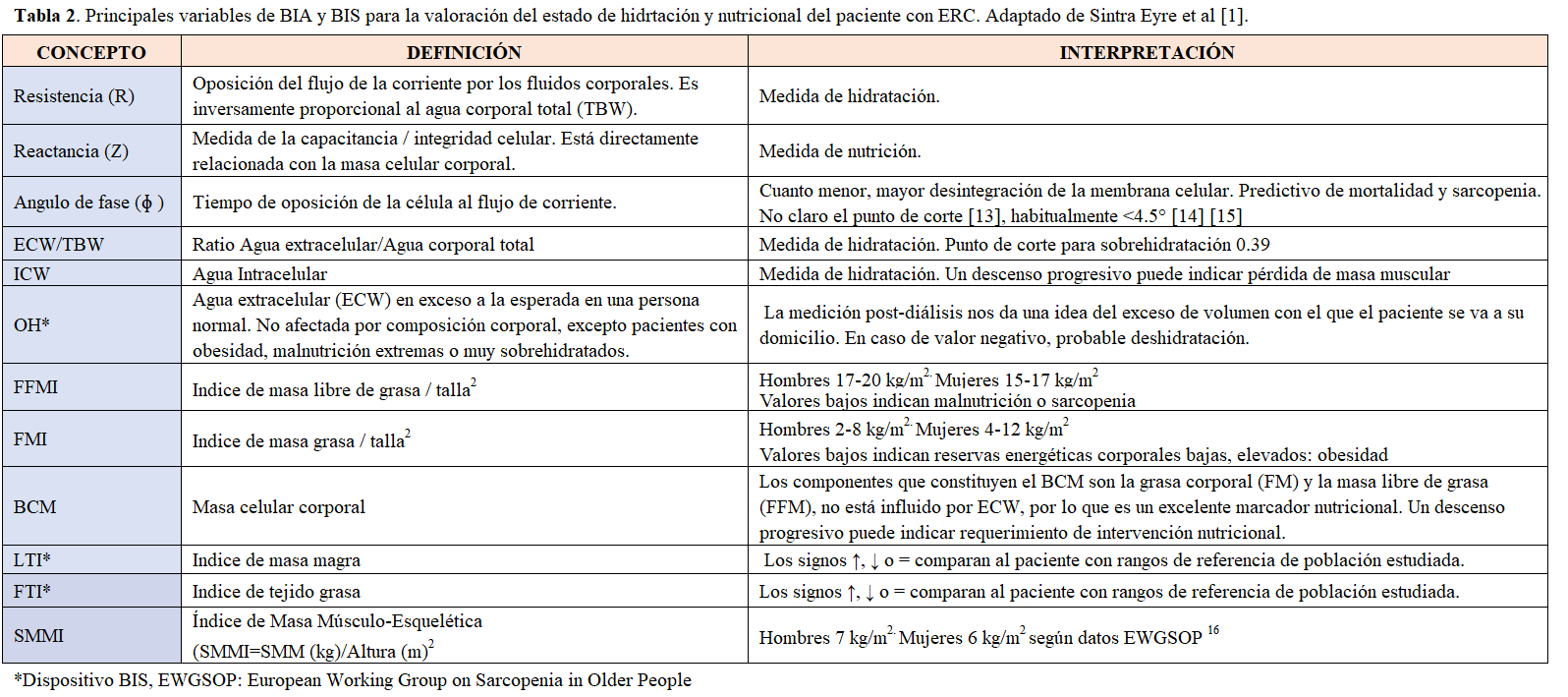
La BIA global (SF-BIA, MF-BIA, BIVA o BIS) mide la resistencia de todo el cuerpo asemejándolo a un cilindro homogéneo, considerando algunos autores que se trata esto de una simplificación excesiva. La BIA segmental puede considerarse un método más exacto, pero un solo segmento (p. ej una pierna) no es muy representativo de todo el cuerpo, por lo que se están produciendo avances técnicos en este sentido. En concreto, la bioimpedanciometría segmental octopolar, con una correlación del 98% con DEXA [11], es un dispositivo de bioimpedancia multifrecuencia que permite medir la impedancia de cada segmento corporal y el tronco de forma independiente, y al disponer de electrodos táctiles de 8 puntos con tecnología de pulgar, permiten una alta reproducibilidad de los resultados obtenidos, en comparación con los dispositivos bi o tetrapolares (Tabla 1).
Las variables más corrientemente utilizadas y su significado se detallan en la (Tabla 2).
2. APLICACIONES CLÍNICAS
a) CONTROL DEL ESTADO DE HIDRATACIÓN
La evaluación y el logro de este peso seco o teórico es un proceso reiterativo que a menudo provoca síntomas intradialíticos incómodos que conducen a intervenciones como el cese de la ultrafiltración, la administración de solución salina, el cese prematuro de la diálisis o la colocación del paciente en posición de Trendelenburg, y posteriormente a un ajuste del peso seco al alza e incremento del tratamiento antihipertensivo [16]. Diversos estudios han confirmado la bioimpedancia espectroscópica como una herramienta validada, rápida, segura y de fácil uso que permite el ajuste del peso seco, lo que la convierte en una opción valiosa en el seguimiento de estado de hidratación en pacientes en diálisis debido a la reproducibilidad del método. Esto puede ser especialmente importante en pacientes en diálisis con eventos agudos frecuentes dada su comorbilidad, y en los que una pérdida catabólica de la masa corporal magra puede conducir a una rápida sobrehidratación si el peso seco no se ajusta adecuadamente.
La sobrecarga hídrica sostenida daña el sistema cardiovascular y conduce a hipertensión e hipertrofia ventricular izquierda, habiéndose demostrado un aumento de mortalidad cuando la sobrecarga de fluido (OH) prediálisis es superior a 2.5 litros. Mantener la volemia dentro de un rango óptimo es, por lo tanto, crucial para mejorar la tolerancia cardiovascular, la calidad de vida y la supervivencia de los pacientes en diálisis
El ajuste de volumen por BIS se ha realizado generalmente guiándose por los estudios publicados que demostraban una mayor mortalidad en aquellos pacientes que presentaban un FO pre >2.5L, equivalente a un exceso de agua extracelular (ECW%) >15% [7][17] utilizando el dato de OHpre u OHpost aislado e intentando modificar el peso del paciente hasta que OHpost quedara en rango (+/- 1.1L). El utilizar el dato de OH aislado limita al no poder comparar mediciones realizadas en periodos interdiáliticos diferentes por lo que es recomendable medidas repetidas, a ser posible el mismo día de diálisis, para ver la evolución del estado de hidratación.
En otros estudios realizados para ajuste de peso seco por BIS, como el de Macheck y cols [18], utilizaron como marcador de volumen el ECW/TBW (ECW%), dividiendo los pacientes (N=52) en sobrehidratados (ECW >15%), aquellos que presentaron más de 2 síntomas intradiálisis el último mes y el resto de pacientes. El objetivo fue la normohidratación (ECW <15%) prediálisis, y como objetivo secundario un FO post entre -6 y +6% (rango de ± 1.1 L).
Para evaluar el estado cardiovascular de un paciente, la sobrecarga de líquido promedia (Time Average Fluid Overload o TAFO) parece reflejar mejor la carga cardiovascular a largo plazo [19]. Representa el promedio de la sobrecarga cardiaca de volumen en una semana completa, asumiendo una acumulación de líquido lineal en el período interdialítico. Se define como el promedio entre los tres valores de FO pre-diálisis (FOpre) y los 3 valores post-diálisis (FOpost) de la semana
TAFO promedio semanal = (FOpre1 + FOpre2 + FOpre3 + FOpost1 + FOpost2 + FOpost3) / 6
Estimación de FO = FOBCM + peso pre-diálisis día_estimado - peso pre-diálisis día_BCM
De esta forma, pacientes deshidratados tendrían un TAFO <0,25 L, normohidratados TAFO entre -0,25 y +1,25L. y sobrehidratados TAFO>1,25L.
b) CONTROL DEL ESTADO DE NUTRICIÓN
La evaluación del estado nutricional de los pacientes con ERC en hemodiálisis por parte de nefrólogos, sin un dietista renal disponible y siguiendo las recomendaciones actuales (a intervalos de 3 a 6 meses y requiriendo el uso de múltiples herramientas) puede resultar un desafío debido al tiempo requerido para ello.
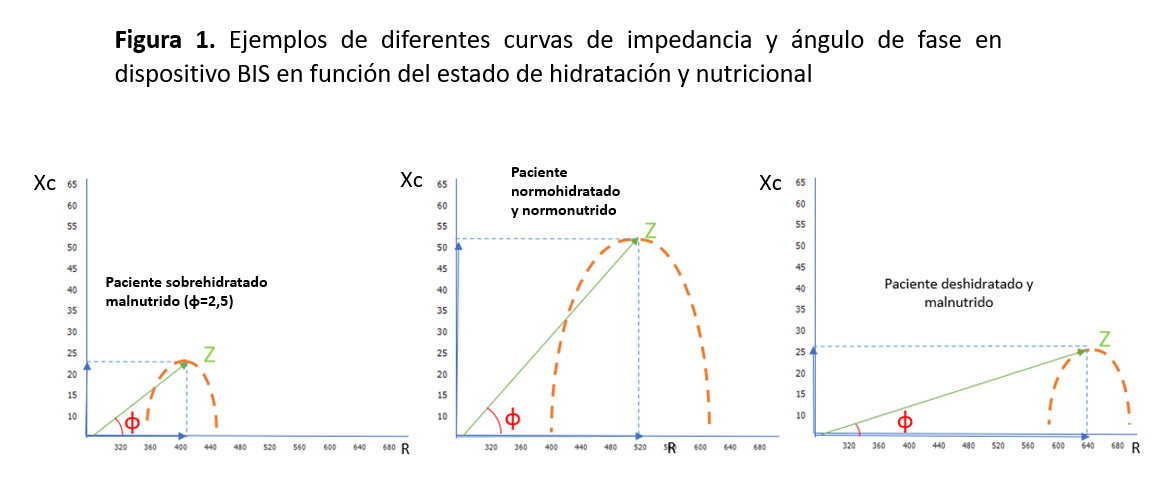
La bioimpedancia eléctrica ha sido utilizada en la valoración de la composición corporal en pacientes en diálisis de forma más limitada. La R es la oposición pura de un conductor biológico al flujo de una corriente eléctrica alterna, mientras que la Xc es el efecto de la resistencia debida a la capacitancia (almacenamiento de carga eléctrica en un condensador) producida por las interfaces de los tejidos y las membranas celulares. La capacitancia hace que la corriente deje atrás la tensión, creando un cambio de fase. Este cambio se cuantifica geométricamente como la transformación angular de la relación de la Xc a la R, o el ángulo de fase. Este parámetro, medido generalmente a 50 kHz, refleja la calidad de las células del organismo y ha sido relacionada con el estado de nutrición de pacientes en hemodiálisis, orientándose un ángulo de fase menor de 4.5° a paciente malnutrido (Figura 1).
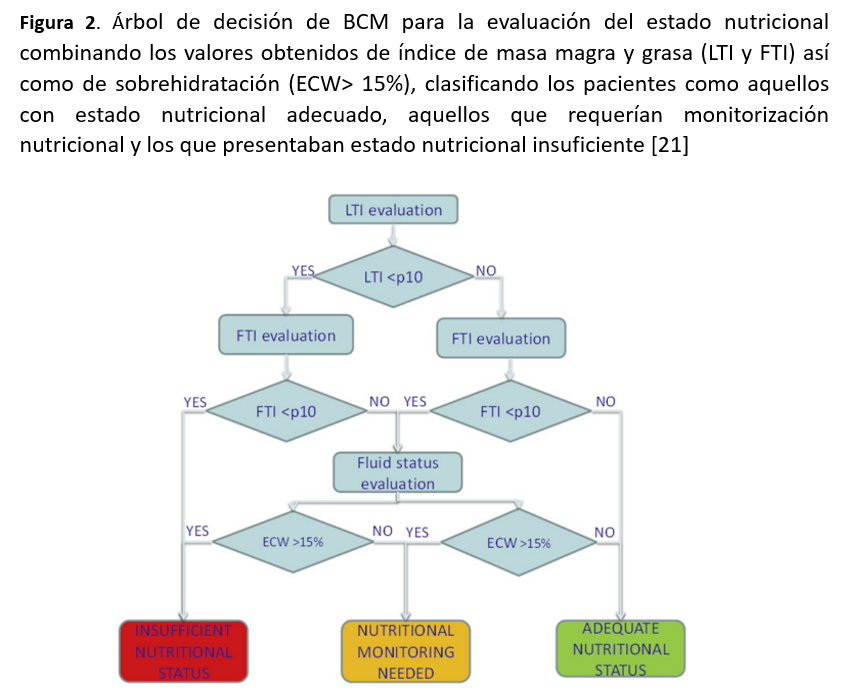
Por otro lado, el índice de tejido magro (LTI), permite la evaluación de la masa celular activa y por lo tanto aporta información sobre el posible déficit de proteínas, y el índice de tejido graso (FTI), representa el contenido de grasa del cuerpo por lo que proporciona información útil sobre el almacenamiento de energía del paciente. En el caso de BIS, los resultados de LTI y FTI se dan no sólo numéricamente sino también en percentiles para así permitir que la medición de un paciente individual se compare con una población de referencia, dado que la composición corporal varía a lo largo de la vida y en función del sexo, siendo el contenido relativo de grasa, por ejemplo, mayor en las mujeres y ancianos. La población de referencia en el dispositivo de BCM se derivó de 1000 sujetos sanos de edades comprendidas entre 18 y 75 años. El 80% de los sujetos de referencia medidos se posicionan dentro de los rangos de referencia (p10-p90, símbolo =), mientras que sujetos con un resultado inferior al 10% (p10, símbolo ↓) de la población de referencia se consideran significativamente diferentes.
Los pacientes sometidos a hemodiálisis crónica presentan una importante alteración en los parámetros antropométricos como el peso, la masa muscular y la grasa corporal. Por otro lado, se conoce que la hipervolemia oculta, antes de que sea manifiesta en estos pacientes, causa anomalías funcionales y estructurales en varios órganos, siendo otro factor que contribuye a la desnutrición. Por este motivo, algunos parámetros de composición corporal obtenidos por BIS como el LTI, el FTI y la sobrehidratación (ECW > 15%) podrían ser considerados de forma combinada como herramientas potenciales para evaluar el estado nutricional del paciente en diálisis.
El riesgo al utilizar este tipo de indicadores de masa magra (LTI) y masa grasa (FTI) puede estar en hacer las comparaciones con poblaciones de referencia distintas a la nuestra. A este respecto, un estudio español multicéntrico de 6395 pacientes en diálisis recientemente confirmó el efecto de algunos factores como la edad, el sexo y la diabetes mellitus sobre la composición corporal y determinaron valores de referencia adecuados de LTI y FTI a partir de esa cohorte española [21]. Detectaron que aquellos pacientes con LTI por debajo del percentil 10 tenían un mayor riesgo relativo de muerte (OR 1.57) después del ajuste por otros factores de riesgo, como la sobrecarga de volumen.
c) CONTROL DE LA DOSIS DE DIÁLISIS
La hemodiálisis, como cualquier otro tratamiento necesita una dosificación y una pauta de administración. Alcanzar una dosis mínima de diálisis es responsabilidad de los nefrólogos y representa un área abierta a la mejora. El Kt/V se calcula generalmente de forma mensual utilizando el modelo cinético de la urea (MCU) que requiere la extracción de muestras sanguíneas pre y post-diálisis. Si consideramos que para calcular la dosis de diálisis anualmente se realizan tan sólo determinaciones mensuales, bimestrales o trimestrales, estaremos extrapolando el resultado de estas 4, 6 o 12 mediciones (3 al 7% de las sesiones) a todo lo que ocurre en las 156 sesiones anuales. Si tenemos en consideración que, en cada hemodiálisis intervienen múltiples factores que pueden influir en la eficacia dialítica fundamentalmente relacionados con disfunción del acceso vascular o hemoconcentración del circuito o del filtro de diálisis, parece lógico que se hayan desarrollado sistemas de control que cuantifiquen en cada sesión y en tiempo real la dosis que el paciente recibe para poder prevenir y solucionar los posibles problemas que están causando infradiálisis. Los dispositivos que miden la dialisancia iónica intradiálisis requieren introducir un valor preciso de volumen de distribución de urea (V) para calcular el Kt/V. Esto contrasta con el MCU, que es relativamente insensible a los errores en V ya que el Kt/V se calcula a partir de la proporción de urea en sangre extraída pre y post-diálisis. Esta V puede ser obtenida por fórmulas antropométricas como la de Watson [22] o por bioimpedanciometría. Recientemente, la popularidad de la bioimpedanciometría eléctrica ha aumentado en las unidades de diálisis tanto para pacientes de hemodiálisis como de diálisis peritoneal, ya que también proporciona información sobre el volumen de distribución de la urea (V) [23]. Dado que existen distintos dispositivos de bioimpedanciometría, es necesario tener en cuenta que puede que los resultados en la distribución del volumen (V) muestren una aceptable correlación pero que debido a las diferencias intermétodos los dispositivos no pueden ser comparables. Los centros de diálisis que utilicen SF-BIVA obtendrán una dosis de diálisis mucho menor, diferencia que desaparece al utilizar una fórmula en caso de que quieran comparar resultados con aquellos centros que utilicen dispositivos de BCM [24].
NOVEDADES EN LA APLICACIÓN CLÍNICA DE LA BIOIMPEDACIOMETRÍA EN PACIENTES EN DIÁLISIS
1. Pacientes en Unidades de Cuidados Intensivos (UCI).
El estado de hidratación se ha descrito repetidamente como un predictor de supervivencia en pacientes críticos [25], sobre todo en los pacientes con sepsis. En las UCI, los riesgos clínicos y las dificultades de pesar a un paciente sedado e intubado a menudo dificultan su evaluación. La sobrecarga hídrica representa un factor de riesgo potencialmente modificable, independientemente del momento en que se inicie el tratamiento renal sustitutivo continuo. La información del estado de hidratación aportado mediante la bioimpedanciometría puede proporcionar una comprensión rápida y sencilla del estado de volemia en este tipo de pacientes y ajustar el tratamiento en consecuencia o retirar el soporte ventilatorio. En un estudio reciente en 480 adultos críticos con lesión renal aguda que requirieron terapia renal sustitutiva continua en UCI se observó que una sobrecarga hídrica superior al 10% se asoció de forma independiente con un aumento del 82% en las probabilidades de mortalidad hospitalaria y 2,5 días menos sin ventilador, en comparación con una sobrecarga hídrica ≤al 10%, así como un mayor riesgo de eventos renales adversos mayores y disminución de la recuperación renal [26].
Por otro lado, los pacientes críticos en contexto de una respuesta aguda al estrés desarrollan un estado hipercatabólico que resulte en una rápida pérdida de masa corporal magra la cual puede enmascararse por el desarrollo de edema y/o la recepción de grandes volúmenes de líquido intravenoso que enmascara cambios netos en el peso corporal. Asimismo, estos pacientes pueden llegar a perder un 1% de su proteína corporal total por día, empeorando la debilidad muscular y retrasando el destete y la rehabilitación. Un metaanálisis reciente de 27 estudios (4872 pacientes críticos) demostró que los pacientes con un ángulo de fase bajo pasaron más días en la UCI y tuvieron un mayor riesgo de muerte [27].
2. Pacientes embarazadas con Enfermedad Renal Crónica (ERC) o en diálisis.
El embarazo es infrecuente en pacientes en diálisis, pero se asocia con una elevada morbimortalidad materna y fetal. Se estima que el aumento de peso gestacional saludable es de 300 g/semana durante el segundo trimestre y de 300-500 g/semana durante el tercer trimestre, pero esto es menos predecible en una paciente de diálisis. El ajuste del peso seco y el control del volumen para evitar la hipervolemia y la hipovolemia es crucial para prevenir el estrés hemodinámico placentario y garantizar la estabilidad cardiovascular de madre y feto en diálisis. Existe referencias de seguimiento semanal con BIA segmental ajustando el peso seco por ECW/TBW utilizando 0,39 como objetivo en las extremidades superiores, pero permitiendo una mayor ECW/TBW en el tronco y las extremidades inferiores al considerar el crecimiento del feto, líquido amniótico acumulado y edema periférico en las extremidades inferiores [28]. Por otro lado, la adaptación cardiovascular durante el embarazo se ve alterada en mujeres con riesgo de preeclampsia o reducción del peso al nacer. La BIA, en concreto la cardiotorácica [29], asimismo puede ser de utilidad para diferenciar aquellas pacientes que desarrollan preeclampsia de las que tienen hipertensión inducida por el embarazo, mostrando una buena precisión y un alto valor predictivo negativo [30] e identificar a aquellas en riesgo de tener fetos pequeños para la edad gestacional en una etapa gestacional más temprana [31].
3. Detección de osteosarcopenia
La osteosarcopenia implica la combinación de baja densidad ósea y masa muscular, fuerza y/o función [32]. La presencia simultánea de osteoporosis y sarcopenia puede afectarse mutuamente y provocar un mayor riesgo de caídas, fracturas y mortalidad. La prevalencia de trastornos del metabolismo óseo y el agravamiento de la atrofia muscular en pacientes con enfermedad renal crónica conduce a una alta incidencia de osteosarcopenia [33] y tiene un mayor riesgo de mortalidad que la sarcopenia o la osteoporosis sola, especialmente las mujeres [34]. Algunos dispositivos de bioimpedanciometría segmental o monofrecuencia nos ofrecen actualmente indicadores como el índice de masa muscular esquelética apendicular (SSMI) o datos de densidad ósea y composición mineral que nos puede orientar en el diagnóstico con el objetivo de establecer un tratamiento integral temprano de los trastornos óseos y la masa muscular. Asimismo, también se ha observado una relación entre ángulo de fase y densidad mineral ósea en pacientes enfermedad renal crónica avanzada [35].
En el caso de la bioimpedanciometría espectroscópica (BIS) en 2021, tomando como referencia la absorciometría de rayos X de doble energía, Lim et al. establecieron y validaron una ecuación de predicción del BIS para estimar la masa muscular esquelética apendicular (ASM) en pacientes en hemodiálisis y encontraron que la ASM baja calculada con la ecuación del BIS se asoció con una supervivencia global significativamente peor [36]. Posteriormente, en un estudio observacional multicéntrico de cohortes, se utilizó esta ecuación para evaluar la capacidad de la ASM combinada con la fuerza de prensión manual (HGS) para predecir el riesgo de deterioro cognitivo incidente en más de 3000 pacientes con un seguimiento prospectivo de 3 años, observándose que el nivel educativo tuvo un papel interactivo en la asociación entre ASM combinada con la HGS y la incidencia de deterioro cognitivo [37].
4. Obesidad visceral y riesgo cardiovascular:
La obesidad visceral se ha convertido en un fenómeno central en el síndrome metabólico y se ha demostrado que está fuertemente asociada con la aterosclerosis en la población general y aterosclerosis carotídea y mayor riesgo de enfermedades cardiovasculares (ECV) en pacientes en hemodiálisis [38]. Algunos dispositivos de bioimpedanciometría segmental calculan el área de grasa visceral, que recientemente se ha correlacionado de forma significativa con niveles elevados de trimethylamine N-oxide (TMAO) en pacientes en hemodiálisis [39], biomarcador que ya ha demostrado su asociación en diferentes estudios en cohortes de ERC con efectos adversos cardiovasculares [40][41].
Asimismo, es posible detectar específicamente por bioimpedanciometría la presencia de esteatosis hepática pudiendo clasificarla en 4 estadios de afectación (normal, esteatosis leve, moderada, ligeramente-severa y severa).
En un estudio reciente en 315 pacientes, se determinó la prevalencia de esteatosis hepática mediante bioimpedancia multifrecuencia y su correlación con parámetros analíticos, antropométricos, ecográficos ó por tomografía computarizada (TAC) en pacientes con ERC con ERCA y HD. Se observó hígado sano en 37,9% y esteatosis en 61,3% de los pacientes (leve 13,4%, moderado 11,8%, ligero-alto 11,4% y alto 24,5%). No se detectaron diferencias significativas a nivel analítico en valores de enzimas hepáticas entre hígado sano y esteatosis a nivel global pero sí una concordancia elevada entre ecografía/TAC y BIA hígado sano [42].
5. Seguimiento de pacientes con síndrome cardiorrenal
Tanto desde la Sociedad Española de Nefrología como de Cardiología y dado el reto que supone desde el punto de visto clínico la atención de los pacientes con síndrome cardiorrenal, se está impulsando de forma significativa la implantación progresiva de Unidades Cardiorrenales a nivel nacional [43][44].
Los dispositivos de bioimpedanciometría son generalmente portátiles y pueden usarse en evaluaciones clínicas ambulatorias de insuficiencia cardíaca en pacientes con ERC al proporcionar evaluaciones seriadas y objetivas del estado de volemia con diferencias mínimas entre los operadores. Estos dispositivos pueden detectar sobrecarga subclínica y apoyar las decisiones clínicas sobre cuándo intensificar el tratamiento diurético [43]. En una revisión sistemática reciente de 31 estudios (20 cohortes de insuficiencia cardíaca y 11 de ERC) que utilizaron 10 parámetros diferentes de sobrecarga de volumen derivados del análisis de bioimpedancia para evaluar su asociación con resultados a nivel cardiorrenal. Como indicador se observó mayor asociación en el caso de exceso de líquido extravascular (%ECW) y ángulo de fase que con sobrecarga total de volumen corporal (TBW) con el riesgo de mortalidad por todas las causas, observándose con el dispositivo de bioimpedancia espectroscópica una mayor facilidad de interpretar estos datos por su capacidad para cuantificar la sobrecarga de líquidos independientemente de la composición corporal. Por otro lado, se observó en aquellos pacientes con mayor sobrecarga de volumen un inicio más rápido de terapia de reemplazo renal [45].
Con dispositivos de bioimpedancia segmental se ha observado que aquellos pacientes con una mayor relación ECW/ICW y un menor porcentaje de grasa tienen niveles significativamente más altos de péptido natriurético [46]. Por otro lado, el CA125 es un biomarcador prometedor para monitorizar la insuficiencia cardiaca y guiar el tratamiento diurético [47], y aunque datos preliminares han aparecido respecto a su relación con la bioimpedanciometría, son necesarios estudios a mayor escala para corroborarla [48][49]. Asimismo, se ha observado en un estudio (datos presentados en el 53 congreso de la SEN) que el ángulo de fase, los niveles de NTproBNP y el índice neutrófilo-linfocito (marcador inflamatorio de valor pronóstico en enfermedades cardiovasculares) son predictores independientes de reingreso en pacientes con insuficiencia de novo o con descompensación aguda de la misma, aunque son necesarios más estudios sobre este tema con mayor muestra poblacional [50].
6. Inteligencia artificial y Bioimpedanciometría
Dadas las características de este tipo de tecnología es más factible desarrollar algoritmos que puedan manejar datos volumétricos y dados los avances tecnológicos introducidos por la inteligencia artificial (IA) (machine learning) es posible contribuir a que los datos de composición corporal estén más fácilmente disponibles, y permitir a los nefrólogos una mejor atención, así como un mayor avance en la investigación científica con grandes cohortes [51]. Ya existen datos preliminares en la evaluación de biomarcadores de sarcopenia en pacientes oncológicos [52] en donde se ha comprobado la capacidad de los enfoques de la IA para analizar series de big data y extraer características más allá de las habilidades manuales. Sin duda en breve nos proporcionará información impactante y refinará en gran medida asimismo el estándar para evaluar el riesgo de sarcopenia en pacientes en diálisis.
ASPECTOS PRÁCTICOS EN LA APLICACIÓN CLÍNICA DE LA BIOIMPEDACIOMETRÍA EN PACIENTES EN ERC DIÁLISIS
1. Posición de los cables / electrodos.
Dado que el cuerpo humano no es un elemento uniforme, ni en longitud, ni en sus áreas transversales de sección, ni en su composición iónica, la precisión de la BIA puede verse afectada por múltiples y diferentes situaciones que se deberán tener en cuenta: la posición del cuerpo, la hidratación, la ingestión de comida y bebida, el aire ambiente y la temperatura de la piel, la actividad física reciente y la conductancia del lugar donde se realiza (la superficie de la camilla) así como la etnia del paciente [53]. Una de las preocupaciones al realizar una medición correcta de bioimpedanciometría debe ser el posicionamiento de los electrodos con la mayor exactitud posible dada la posible variabilidad de los resultados en función de esto [54], aunque existe evidencia contradictoria en la literatura sobre el impacto que tienen las ubicaciones alternativas de electrodos en las variables de BIS. La colocación de los electrodos debe realizarse de acuerdo con las recomendaciones del fabricante para el dispositivo específico, pero en general se coloca a nivel de muñeca y tobillo con una separación de al menos 4-5cm con el electrodo distal que se situará encima del metacarpo y metatarso.
Los electrodos deben estar colocados al menos 5 minutos antes de medición y se limpiará la piel con alcohol o suero fisiológico, dependiendo del dispositivo y dejar secar antes de aplicar los electrodos. Nunca situarlos sobre la piel dañada o erupciones cutáneas y no reutilizarlos
Está descrito que mover los electrodos de forma proximal y distal podría dar lugar a mediciones poco fiables del BIS, pero moverlos medial y lateralmente puede no afectar. Los electrodos deben situarse en la parte. Los electrodos no utilizados deben almacenarse en un embalaje que se pueda sellar para evitar que el gel se seque en el punto de contacto.
Los cables de conexión de los electrodos no deben retorcerse ni enredarse ni en contacto con el catéter, el suelo, los objetos metálicos, los equipos eléctricos, incluidos los teléfonos u otra persona.
2. Actualización de la talla: La medición correcta de la longitud del cuerpo puede llegar a ser más importante que el peso corporal introducido, debe medirse sin zapatos. Hay que tener en cuente que en un paciente que lleve un tiempo prolongado en diálisis, la altura, debido a la presencia de osteoporosis, compresiones vertebrales o el envejecimiento natural, se recomienda anualmente repetir la medición de la talla.
3. Cálculo en pacientes amputados: Existen recomendaciones para la corrección de los valores de sobrehidratación inicial (OH) en pacientes amputados en el caso de BIS, reflejado en el manual con una tabla que indica la corrección dependiendo si la amputación es infra-supracondílea, por encima o debajo de codo, o de miembro completo, así como sugerencias para la colocación alternativa de electrodos con medición de mano a mano en la amputación (que no requiere corrección de los valores) [55].
4. Pacientes portadores de prótesis metálicas y marcapasos: Algunas BIA monofrecuencia y multifrecuencia hasta 200 khz, así como la BIS permiten realizar mediciones en pacientes con marcapasos bicamerales, nunca en pacientes con dispositivos autoimplantables. Algunos monofrecuencia también permiten en pacientes portadores de prótesis metálicas. Los dispositivos multifrecuencia segmentales por lo general no permiten ni en caso de marcapasos ni de prótesis metálicas. Siempre consultar el manual del dispositivo.
5. Medidas aisladas o repetidas: Una sola medición proporciona información muy limitada, pero mediciones repetidas a lo largo del tiempo proporcionar la información más valiosa.
6. Medidas pre-intra-postdiálisis: Lo más adecuado es realizar la medición post-diálisis en situación de euvolemia. En la mayoría de los dispositivos es necesario esperar 30 minutos, que empezarían a contar desde que se para la ultrafiltración (UF) en el monitor. En caso de realizarse prediálisis es necesario asumir que el resultado se basará en la UF inicial introducida al restar el peso de entrada menos el peso teórico y que cambios posteriores en la misma no quedarán reflejados en el resultado de la medición. Algunos dispositivos permiten la realización de la medición intradiálisis, en este caso será necesario restar la UF que lleve hasta el momento del peso de entrada.
7. Factores que pueden alterar la medición:
- BMI <16 y >35 Kg/m2: los datos de bioimpedanciometría en estos grupos no están validados, , Los resultados pueden ser difíciles de interpretar, especialmente el estado de hidratación. Una alta proporción de masa grasa influye en la relación de agua extra e intracelular y esto puede aumentar la incertidumbre de la medición de OH en casos extremos de obesidad. Sin embargo, los cambios en la masa magra y grasa probablemente se reflejarán en el tiempo.
- Fiebre: la Resistencia tisular cambia en estos casos por lo que puede alterar los resultados.
- Sexo y raza: La proporción corporal varía entre los diferentes sexos y las diferentes razas motivo por el que siempre solicita especificar el sexo y en algunos dispositivos se puede especificar la raza.
- Posición de las piernas y brazos: Asegúrese de que los brazos y las piernas estén ligeramente separados. Se puede colocar una almohada entre las piernas para separlas en caso de pacientes obesos.
- Vejiga llena: es preferible realizar la medición con la vejiga vacía.