Fisiología Renal
Bibliografía recomendada
Renal Pathophysiology. The Essentials. 5ª Edición WOLTERS KLUWER
Rennke, H. - Denker, B. ISBN-13: 9781975109592
Fisiología Humana. Un Enfoque Integrado 8ª Edición. Editorial Medica Panamericana S.A.Silverthorn, D ISBN-13: 9786078546220
Ganong Fisiología Médica. 26ª Edición LANGE MCGRAW HILL
Barrett, K. - Barman, N. - Brooks, H. - Yuan, J.
Medical Physiology. Principles for Clinical Medicine 5ª Edición WOLTERS KLUWER
Rhoades, R. - Bell, D. ISBN-13: 9781496388186
ÍNDICE
1. GENERALIDADES SOBRE LA FUNCIÓN RENAL
2. CARACTERISTICAS MORFO-FUNCIONALES DE LOS RIÑONES. LA NEFRONA
3. FISIOLOGÍA RENAL Y MANTENIMIENTO DEL AMBIENTE INTERNO.
4. FORMACIÓN DE LA ORINA. FILTRADO GLOMERULAR
4.1 Proceso de filtración
4.2 Presiones que afectan al filtrado glomerular.
4.3 Regulación del filtrado glomerular
4.4 Tasa de filtración glomerular
5. FORMACIÓN DE LA ORINA. INTERCAMBIO TUBULAR
5.1 Mecanismos de reabsorción y secreción tubulares.
5.2 Transporte en el túbulo contorneado distal y conducto colector
5.3 Secreción de substancias en la formación de la orina
6. FUNCION ENDOCRINA DEL RIÑON
6.1 Eritropoyetina y hematopoyesis
6.2 Producción de renina, regulación de la presión sanguínea y el pH
6.3 Hormona paratiroidea y calcitriol
6.4 Otros mediadores asociados a la actividad renal con función vascular y/o presora
6.5 Otras funciones endocrinas del riñón
7. REFLEXIÓN SOBRE LA FISIOLOGÍA RENAL
1. GENERALIDADES DE LA FUNCIÓN RENAL
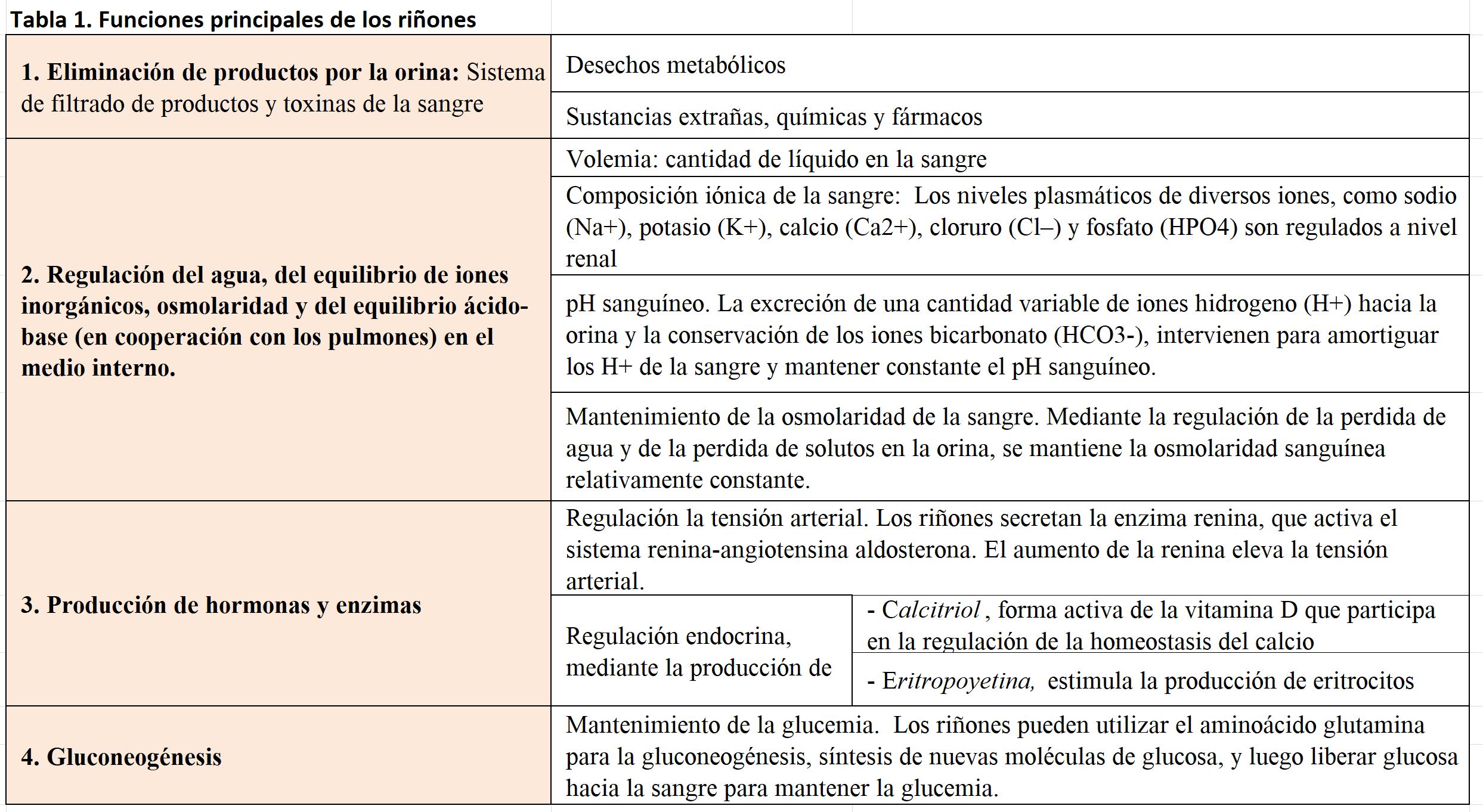
Los riñones son órganos esenciales que, además de actuar a modo de filtro eliminando productos metabólicos y toxinas de la sangre, participan en el control integrado del líquido extracelular, del equilibrio electrolítico y del equilibrio acido-básico. Producen hormonas como el calcitriol o la eritropoyetina, y en ellos se activan metabolitos como la enzima renina. Por ello, al describir la fisiología renal, hay que recordar que va mucho más allá del estudio del órgano que regula la excreción de productos de desecho (Tabla 1). Esto es especialmente relevante en el ámbito de la Nefrología, donde en ocasiones, la valoración de mantener, aunque solo sea de forma parcial esta funcionalidad renal, alcanza una gran importancia.
Como ocurre con el resto de nuestro organismo, la fisiología renal está ligada a la estructura del aparato excretor renal, diseñada para mantener un flujo unidireccional. Este flujo hará que la orina, que inicia su formación en los riñones, órganos principales del sistema, pase a través de los uréteres a la vejiga urinaria para su almacenamiento, para que posteriormente pueda ser eliminada a través de la uretra. Para que esta actividad se lleve a cabo, los riñones cuentan con una vascularización muy significativa, que facilita que, a pesar de su pequeño tamaño, reciban aproximadamente un 20% del gasto cardiaco. Además, una destacada inervación por fibras nerviosas simpáticas, regula entre otras actividades la liberación de renina, el flujo sanguíneo renal o la reabsorción de Na+ en las células tubulares.
2. CARACTERISTICAS MORFO-FUNCIONALES DE LOS RIÑONES. LA NEFRONA
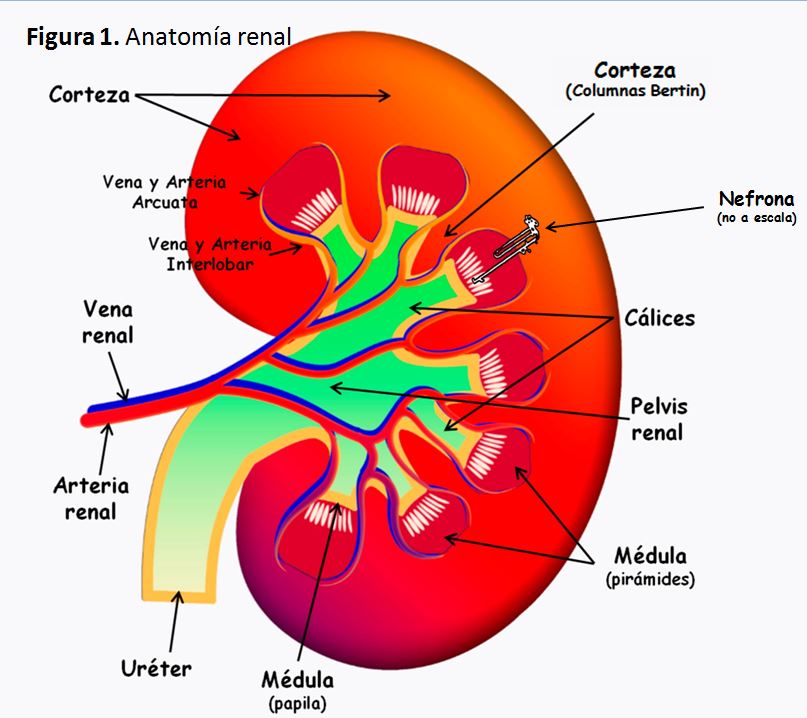
Desde un punto de vista macroscópico (Figura 1), los riñones son dos órganos ovalados con una indentación medial. Miden aproximadamente 11 x 7 x 3 cm y pesan unos 150 g, siendo normalmente el riñón izquierdo algo mayor que el derecho. Los riñones se localizan en la zona retroperitoneal, en la pared posterior del abdomen a ambos lados de la columna vertebral, desde la altura de la última vértebra dorsal hasta por encima de la tercera vértebra lumbar. El riñón derecho suele estar algo más bajo que el izquierdo, debido a la ocupación del espacio derecho por otros órganos abdominales, como el hígado. La cara medial de cada riñón contiene una región con una muesca, llamada hilio, por la que pasan la arteria y la vena renales, los vasos linfáticos, la inervación y el uréter.
En un corte sagital del riñón pueden observarse las estructuras que conforman el órgano y que clásicamente se conocen como corteza externa y regiones internas de la médula. La médula se divide en 8-10 masas de tejido en forma de cono llamadas pirámides renales. La base de cada pirámide se origina en el borde entre la corteza y termina en la papila, que se proyecta en el espacio de la pelvis renal. El borde externo de la pelvis renal se divide en los cálices mayores, que se extienden hacia abajo y se dividen en los cálices menores, que recogen la orina de los túbulos de cada papila.
A nivel microscópico, se establece una unidad funcional renal, la nefrona (Figura 2). Cada riñón humano contiene alrededor de 800.000 a 1.000.000 nefronas, cada una de las cuales es capaz de formar orina. A lo largo del envejecimiento renal normal, por lesión o por enfermedad, el número de nefronas se puede reducir gradualmente debido a que no se pueden regenerar. Sin embargo, la pérdida de nefronas no suele comprometer la función renal porque se producen cambios adaptativos que suplen la funcionalidad en el resto del sistema.
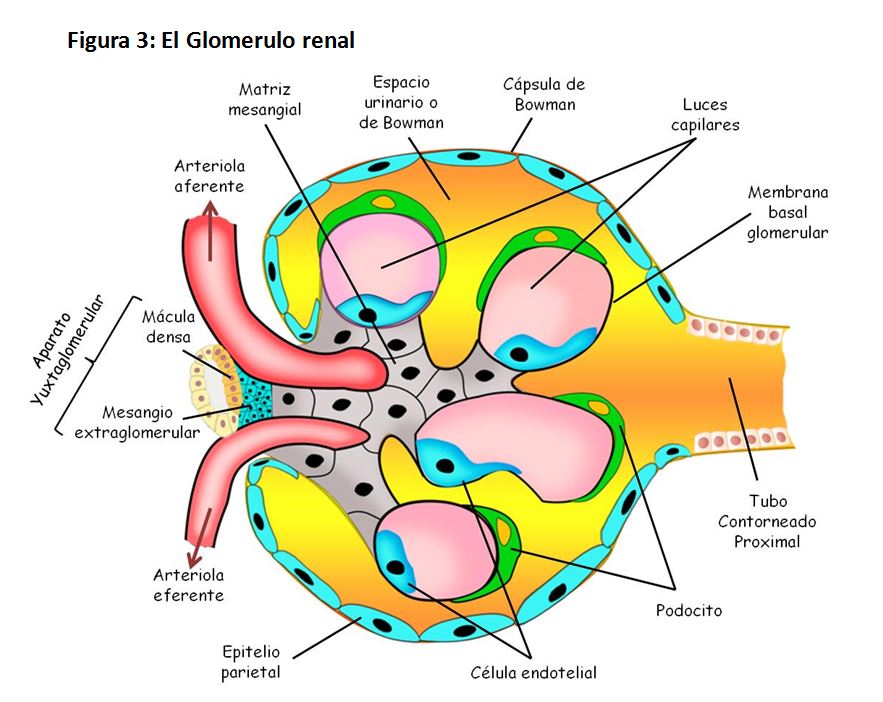
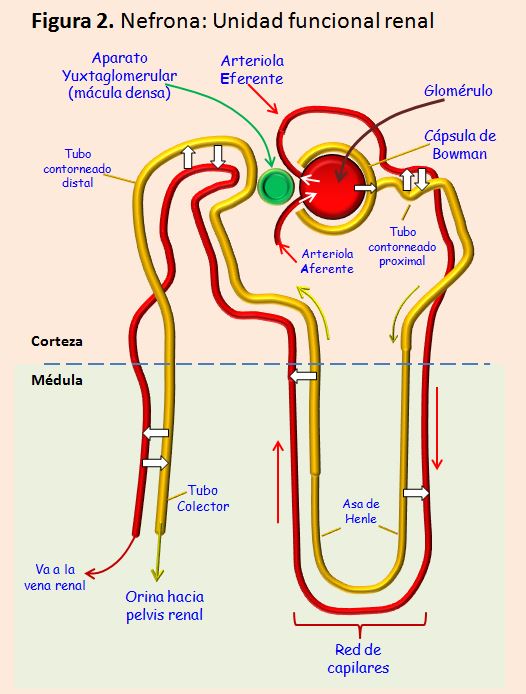
Cada nefrona está formada por un agrupamiento de vasos capilares llamado glomérulo (Figura 3), por el que se filtran grandes cantidades de líquido desde la sangre, y por un túbulo largo en el que el líquido filtrado se convierte en orina en su trayecto hacia la pelvis renal.
Los capilares glomerulares se ramifican y anastomosan y, comparados con otros capilares de otros sistemas, tienen una presión hidrostática elevada (alrededor de 60 mmHg). Todo el glomérulo está cubierto por la denominada cápsula de Bowman. El líquido filtrado desde los capilares glomerulares circula hacia la cápsula de Bowman y después al túbulo proximal. Estas estructuras de la nefrona se encuentran en la corteza del riñón. Desde el túbulo proximal, el líquido filtrado discurre hacia el asa de Henle, que desciende hasta la médula renal. El asa de Henle está constituida por una rama descendente y otra ascendente. Las paredes de la rama descendente y el segmento inferior de la rama ascendente del asa de Henle son muy finas, y se llaman segmento fino del asa de Henle. Una vez la rama ascendente del asa de Henle vuelve a la corteza renal, la pared se engruesa denominándose segmento grueso del asa ascendente. En la zona final del segmento grueso de la rama ascendente del asa de Henle, se localiza una placa de células epiteliales especializadas que es la mácula densa, cuya función es fundamental como veremos más adelante. A continuación del asa de Henle, el líquido llega al túbulo distal que se localiza en la corteza renal.
Al túbulo distal le siguen el túbulo colector cortical. Hay de 8 a 10 conductos colectores corticales que se unen para formar un solo conducto colector mayor que discurre hacia el interior de la médula y se convierte en el conducto colector medular. Los conductos colectores se van uniendo y formando progresivamente conductos cada vez mayores que vacían su contenido en la pelvis renal.
Dentro de las características anatómo-funcionales del riñón hay que destacar la importancia de la vasculatura. La arteria renal entra en el riñón a través del hilio y después se ramifica hasta formar las arterias interlobulares, las arterias arciformes, las arterias interlobulillares y las arteriolas aferentes, que terminan en los capilares glomerulares, donde se produce la filtración de grandes cantidades de líquido y solutos para comenzar la formación de orina. Los extremos distales de los capilares glomerulares coalescen hasta formar la arteriola eferente, que llega a la segunda red capilar formando los capilares peritubulares, que rodean a los túbulos renales. En definitiva, se puede afirmar que la circulación renal tiene dos lechos capilares, los capilares glomerulares y los capilares peritubulares, que están dispuestos en serie y están separados por las arteriolas eferentes. Estas arteriolas participan en la regulación de la presión hidrostática en los dos grupos de capilares, ajustando la resistencia de las arteriolas aferente y eferente. Los capilares peritubulares continúan hacia los vasos del sistema venoso, que discurren paralelos a los vasos arteriolares, abandonando la sangre el riñón junto a la arteria renal y el uréter.
3. FISIOLOGÍA RENAL Y MANTENIMIENTO DEL AMBIENTE INTERNO.
Si bien el concepto de "función renal" incluye todas las actividades desarrolladas en el riñón para el mantenimiento de la homeostasis (Tabla 1), si tuviésemos que elegir un concepto que refleje la función renal, este sería su capacidad para mantener la homeostasis liquida en nuestro organismo a través de la capacidad para depurar sustancias circulantes en el plasma sanguíneo. Esta es una actividad estrechamente relacionada con la capacidad de los riñones para regular la concentración de agua, la composición de iones inorgánicos, y mantener el equilibrio ácido-base.
Como una consecuencia de esta actividad reguladora del medio líquido, los riñones excretan productos como la urea, generada del catabolismo de proteínas, el ácido úrico producido a partir de ácidos nucleicos, la creatinina, derivada en gran medida de la actividad muscular, o productos finales de la degradación de la hemoglobina. También a través de los riñones, se eliminan drogas y otras sustancias químicas, como los aditivos utilizados en alimentación.
Proceso renal básico: Formación de orina
Los riñones procesan un volumen enorme de sangre cada día. Cada minuto, el flujo sanguíneo que llega a los glomérulos renales es de unos 1200 mililitros de sangre, de los cuales, 650 ml corresponden a plasma sanguíneo y de este, una quinta parte aproximadamente será filtrado en el glomérulo. Esto implica que cada 24 horas, los riñones filtran más de 60 veces todo el plasma sanguíneo.
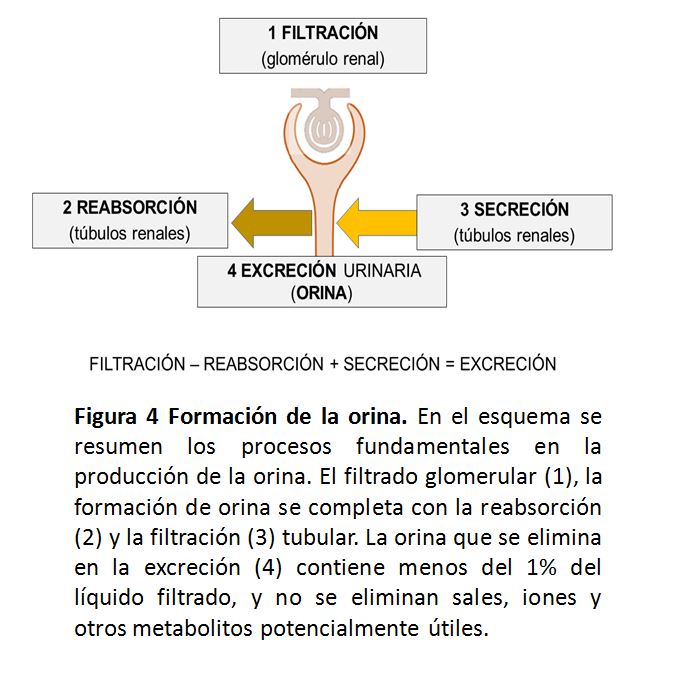
Para evitar el enorme coste que la perdida de líquidos y otros elementos esenciales puedan derivarse del proceso de depuración renal; tras el filtrado glomerular, la formación de orina se completa con la reabsorción y filtración tubular, de forma que la orina contenga finalmente menos del 1% de la parte liquida filtrada, y no se eliminen sales, iones y otros metabolitos que puedan ser útiles (Figura 4).
4. FORMACIÓN DE LA ORINA. FILTRADO GLOMERULAR
Desde una perspectiva funcional, la formación de la orina se inicia en la cavidad glomerular, en la que se puede distinguir una capa parietal externa de epitelio escamoso simple, que contribuye a su mantenimiento estructural pero no participa en la formación de la orina; y una capa visceral, en la que la red capilar vascular y las estructuras glomerulares prácticamente forman una unidad funcional gracias a la actividad de células epiteliales ramificadas altamente modificadas llamadas podocitos, que literalmente, van a abrazar a los capilares glomerulares.
4.1 Proceso de filtración
La filtración glomerular es un proceso pasivo. De hecho, este proceso de filtración no tiene apenas gasto energético para el organismo, por lo que podríamos considerarlo un proceso meramente mecánico en el que la presión hidrostática de la arteria aferente empuja literalmente a la sangre contra la membrana de filtración glomerular.
4.1.1 Membrana de filtración glomerular. Esta membrana constituye una barrera que evita el paso al túbulo renal de células y de la mayor parte de las proteínas plasmáticas, generando un "ultrafiltrado" compuesto fundamentalmente por agua y elementos de pequeño tamaño circulantes en la sangre. Para realizar esta función, la membrana de filtración consta de un endotelio capilar fenestrado, es decir, con poros capilares cuyo tamaño impide el paso de células o la mayor parte de las proteínas.
4.1.2 Membrana basal. Situada entra la capa endotelial y la epitelial. Presenta un grosor de 240 a 340 nm. Está constituida fundamentalmente por colágenos de tipo IV y V, glicoproteínas, y proteoglicanos como el heparán sulfato. Esta composición hace que presente una carga electro-negativa que repele a pequeñas proteínas y otros elementos cargados negativamente que hubiesen atravesado la barrera endotelial fenestrada.
4.1.3 Membrana podocitaria. Los podocitos son células polarizadas, con una parte apical orientada hacia el espacio de la cápsula de Bowman y otra hacia la lámina basal del endotelio. Presentan un citoplasma aplanado, que emite multitud de prolongaciones a modo de dedos que literalmente abrazan a la lámina basal del endotelio, constituyendo los "pies interdigitados". Estos pies, suelen contactar con otros "pies" de podocitos vecinos mediante complejos moleculares para formar diafragmas de ranura, a través de los cuales moléculas de pequeño tamaño y elementos líquidos pasaran de la estructura glomerular al túbulo.
Los podocitos mantienen una baja actividad mitótica, y su número permanece prácticamente invariable al estar reprimida su capacidad replicativa. Pero esto no quiere decir que sean células funcionalmente inactivas. De hecho, sintetizan y liberan entre otras moléculas colágeno de tipo IV, fibronectina, laminina, o heparán sulfato, que hacen que presenten una carga electro-negativa muy importante y colaboren en la actividad funcional de las células de la membrana basal.
Pero quizás la actividad más relevante de los podocitos en el filtrado glomerular sea la ligada a su función en la arquitectura de la capsula glomerular. De una parte, al abrazar mediante los pies interdigitados a los capilares glomerulares, contribuyen a que estos soporten la presión hidrostática, ya que los podocitos tienen un citoesqueleto formado sobre todo por filamentos de actina que al formar el complejo actina-miosina modulan la respuesta de los capilares a la presión hidrostática. Por otra parte, a través de las ranuras que dejan estos pies podocitarios, el líquido y las pequeñas moléculas que atraviesan las membranas precedentes salen del glomérulo renal. Para ello, resulta clave la distribución homogénea de las podocitos mantenida gracias a su baja actividad replicativa, y también que en las ranuras podocitarias se expresen moléculas de adhesión y proteínas de superficie que mantienen una constante interacción entre podocitos vecinos.
Como resultado del proceso de filtración en la estructura glomerular, las moléculas de menos de 3 nm de diámetro, como el agua, la glucosa, aminoácidos y desechos nitrogenados, atraviesan este filtro; mientras que las moléculas más complejas y con cargas eléctricas como proteínas o ciertos oligoelementos, permanecen en la sangre, lo que resulta clave para el mantenimiento de la presión coloidal osmótica en la misma, entre otras ventajas.
4.2 Presiones que afectan al filtrado glomerular.
Al tratarse de un proceso físico dependiente de presiones, los principios que rigen la filtración glomerular no difieren de los establecidos para cualquier otro lecho vascular, y por tanto depende de los siguientes factores:
4.2.1 Presión hidrostática sanguínea: La presión hidrostática en capilares glomerulares es esencialmente la fuerza principal que empuja a la sangre contra la barrera de filtración glomerular. Por esta razón, la presión sanguínea en el glomérulo renal es excepcionalmente elevada (aproximadamente 55 mmHg) en comparación con la observada en otros lechos capilares que es de 26 mmHg. Para mantener esta elevada presión hidrostática sanguínea, arteriolas aferentes y eferentes en el glomérulo presentan unas diferencias en su diámetro importantes. Esto hace que se dificulte el drenaje capilar por la arteriola eferente, y se mantenga en todo el lecho capilar glomerular una elevada presión hidrostática, generándose a nivel de arteria eferente una presión promedio de 30 mmHg.
4.2.2 Presión hidrostática capsular: es la presión hidrostática ejercida contra la membrana de filtración por el líquido del espacio capsular. Esta presión se opone a la filtración hacia el túbulo renal y oscila alrededor de 15 mm Hg.
4.2.3 Presión osmótica coloidal en los capilares glomerulares: es la presión ejercida por las proteínas en la sangre, que tiende a recuperar el agua filtrada. A nivel de la capsula glomerular se mantiene de forma más o menos constante una presión coloidal de aproximadamente 30 mmHg.
Como se muestra en la (Figura 5), las presiones anteriores determinan la presión de filtración neta. Esta representa el resultado de la suma de las presiones que favorecen o se oponen al filtrado glomerular. En definitiva, a nivel capilar renal se genera una fuerza de empuje extremadamente elevada y constante de unos 10 mmHg.
4.3 Regulación del filtrado glomerular
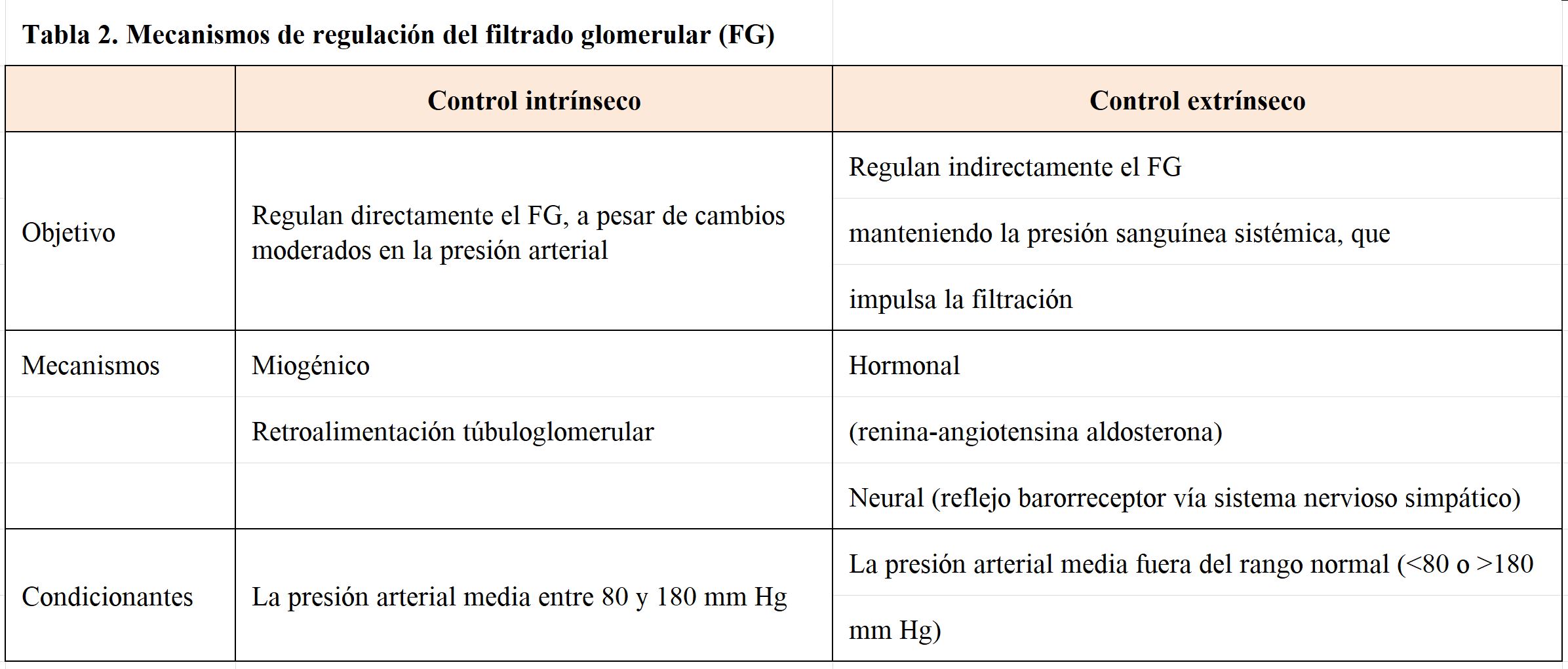
Como hemos comentado con anterioridad, el proceso de filtrado glomerular está condicionado por la presión hidrostática capilar, que tiene que ser constante para garantizar una actividad funcional eficaz de los riñones. Pero la presión sanguínea glomerular depende de la presión sanguínea sistémica, y ambas presiones no siempre van a ir paralelas. Por ejemplo, si aumenta la presión hidrostática glomerular, se producirá más filtrado y en consecuencia, más orina y una reducción en la volemia con el consiguiente descenso de la presión sistémica. Por lo tanto, el mantenimiento de la presión capilar renal depende de la regulación nerviosa y endocrina que regula la presión sistémica, pero también cuenta con un sistema de autorregulación local o intrínseco que garantiza su mantenimiento (Tabla 2):
4.3.1 Controles intrínsecos.
La arquitectura glomerular requiere que, para mantener una tasa de filtración casi constante, la presión hidrostática capilar presente mínimas diferencias. Para ello, la red capilar glomerular cuenta con un sistema de autorregulación que compensa las fluctuaciones que pueda sufrir la presión sistémica. La autorregulación renal utiliza dos mecanismos diferentes de control:
a) Control miogénico. Depende de las células musculares lisas presentes en la pared de los capilares aferentes. Estas células poseen canales de sodio/calcios sensibles al estiramiento, de forma que, frente a un aumento de presión sistémica, las células musculares se contraen disminuyendo la luz capilar y con ello, el flujo vascular. Por el contrario, un descenso en la presión sistémica provoca la dilatación de las arteriolas aferentes.
b) El sistema de retroalimentación túbulo-glomerular actúa cuando las células de la mácula densa en el túbulo distal detectan un incremento en sodio y/o cloruro. En respuesta a este incremento de electrolitos, las células de la macula densa secretan sustancias vasoconstrictoras como adenosina, ATP y/o tromboxano, que por mecanismos mal conocidos llegan a la arteria aferente provocando vasoconstricción y con ello un descenso de la presión capilar glomerular y de la filtración glomerular.
Estos mecanismos de autorregulación son muy eficaces para mantener la presión hidrostática glomerular prácticamente constante, con independencia de las fluctuaciones que sufra la presión sistémica; en consecuencia, mantienen el flujo renal sin estar condicionados por mecanismos sistémicos cuando la presión arterial sistémica se mantiene en rangos entre 80 y 180 mmHg, Sin embargo, son incapaces de compensar grandes fluctuaciones de presión. Cuando la presión arterial cae por debajo de 80 mm Hg, cesa la autorregulación intrínseca, y se activan los mecanismos reguladores sistémicos que tienden a preservar la actividad de elementos fundamentales como el corazón o el sistema nervioso central.
4.3.2 Mecanismos de regulación extrínsecos o sistémicos
a) Mecanismos neurogénicos. El control del sistema nervioso simpático mantiene la homeostasis vascular sistémica independiente de lo que ocurra a nivel renal. Sin embargo, cuando el volumen de líquido extracelular es extremadamente bajo (como en el shock hipovolémico durante una hemorragia severa), la actividad del sistema simpático provoca una vasoconstricción general, que hace que se limite el flujo sanguíneo glomerular hasta el punto de dañar los riñones, con independencia de la actividad del control intrínseco renal.
b) Sistema renina-angiotensina-aldosterona. Frente a una caída importante de la presión sistémica, la secreción de renina hace que se pierda la capacidad de regulación intrínseca por diferentes vías:
- La actividad de retroalimentación con el sistema nerviosos simpático.
- Un efecto sobre las células de mácula densa que, frente al descenso de filtrado glomerular, dejan de producir elementos vasoconstrictores.
4.4 Tasa de filtración glomerular
La cantidad de filtrado glomerular que se forma en todos los corpúsculos renales de ambos riñones por minuto es la tasa de filtración glomerular (TFG), que suele ser de unos 125 mL/min, en los hombres, y algo menor, unos de 105 mL/min, en las mujeres. Esta TFG se mantiene relativamente constante. Si se eleva de forma importante, el ultrafiltrado glomerular sería tan alto que se dificultaría la actividad de reabsorción tubular que veremos a continuación. Si es muy baja, un exceso de reabsorción en el túbulo dificultaría la excreción de productos a este nivel.
La TFG depende básicamente de tres condicionantes (Figura 5). La presión hidrostática sanguínea con la que el agua y los solutos son empujados contra la membrana de filtración; la longitud o extensión de esta membrana de filtración, y la permeabilidad de la misma. En condiciones fisiológicas, la membrana glomerular presenta muy pocas diferencias en su extensión o en su permeabilidad, por lo que la presión de filtración neta, es decir, la presión total que promueve la filtración, es regulada fundamentalmente por:
- La presión hidrostática sanguínea en los capilares glomerulares. Su valor suele ser alto, en torno a los 55 mm Hg.
- La presión hidrostática capsular ejercida contra la membrana de filtración por el líquido que ha penetrado en el espacio capsular. Esta presión se opone a la filtración y su, valor promedio es de 15 mm Hg.
- La presión osmótica coloidal de la sangre. También se opone a la filtración, y es de unos 30 mm Hg.
Así pues, la presión neta es de unos 10 mm Hg, y mantenerla estable hace que el filtrado glomerular sea continuo y eficaz. Por ejemplo, una pérdida importante de sangre reduce la tensión arterial media, y con ello, la presión hidrostática glomerular. Si esta desciende por debajo de 45 mm Hg, cesa el filtrado, y con él la actividad renal en gran medida. Sin embargo, en el sentido contrario los elementos de regulación de la presión glomerular son muy eficaces. Cuando la tensión arterial sistémica se eleva por encima de lo normal, la presión de filtración neta y la TFG aumentan muy poco, y en la práctica, son capaces de trabajar con rangos de presión sanguínea entre 80 y 180 mm Hg.
Aspectos relevantes en el proceso de filtración renal
Se realiza en el corpúsculo renal en la nefrona. Su principal característica es poseer un dintel máximo de filtración de aproximadamente 4,5 nm de diámetro, y mantener una carga electrostática que repele a proteínas y otros elementos.
Para ello cuenta con: a) Un endotelio capilar capaz de mantener estable el flujo y a presión sanguínea, con poros de 50 a 100 µm de diámetro que permita la salida de elementos del plasma; b) Una membrana basal glomerular, con células cargadas electronegativamente; c) Una capa de células podocitarias, contráctiles, que envuelven a los capilares regulando la actividad capilar y dejando a su vez entre ellas espacios libres que permitan el paso de pequeñas substancias.
Cuantificación del proceso de filtración: Se consigue calculando la depuración de un soluto indicador que se filtre totalmente a su paso por el riñón. Por ejemplo, la inulina o la creatinina, utilizada habitualmente en clínica que, aunque es secretada parcialmente en los túbulos (entre un 10 y un 15%), se compensa con la sobrevaloración entre un 10 y 15% en el método colorimétrico de su medida. Se calcula que cada glomérulo mantiene una TFG media de 125 ml/ min., que va disminuyendo a medida que aumenta la edad.
La filtración glomerular sigue fundamentalmente leyes físicas reguladas por presiones que afectan al flujo plasmático, estando implicadas:
Presión hidrostática del capilar glomerular, se mantiene muy estable por la capacidad de regulación de la resistencia de la arteriola aferente como en la de la eferente. Su valor promedio es de 55 mm de Hg
Presión hidrostática en la cápsula de Bowman, con un valor prácticamente despreciable en condiciones fisiológicas ya que el líquido filtrado pasa inmediatamente al túbulo.
Presión oncótica de las proteínas plasmáticas, que, aunque crece ligeramente hacia el final del glomérulo por la disminución de volumen líquido filtrado, suele mantenerse estable salvo en estados de deshidratación, hipoproteinemia, etc.
5. FORMACIÓN DE LA ORINA. INTERCAMBIO TUBULAR
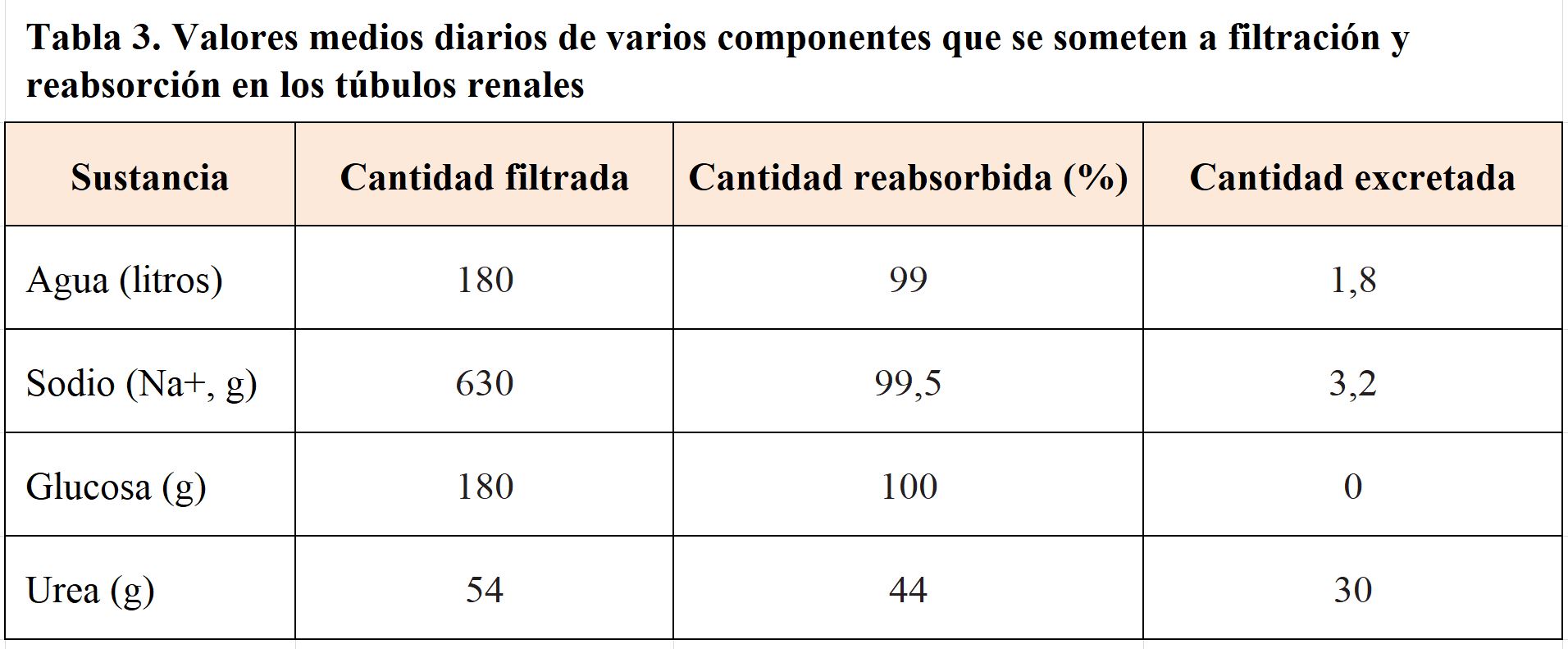
Aproximadamente cada 22 minutos, la totalidad del plasma sanguíneo ha sido filtrado en los glomérulos. Esto quiere decir que los riñones filtran aproximadamente 180 L/día de plasma. Sin embargo, el volumen de orina en 24 horas suele ser algo inferior a 1,5 litros, de los que aproximadamente el 95 % es agua y el 5% restante son sustancias de desecho. Por tanto, la composición del ultrafiltrado glomerular, durante su paso por los túbulos renales es modificado para que gran parte del agua y los oligoelementos filtrados sean reabsorbidos y transportados a los capilares peritubulares para ser reutilizados. Pero a nivel tubular no solo se produce un proceso de reabsorción. En sentido contrario, es decir, desde los capilares peritubulares hacia la luz del túbulo renal, algunas substancias son secretadas.
Estos procesos de reabsorción y secreción permiten por ejemplo que, solutos importantes como la glucosa se recuperen completamente, mientras que la mayoría de las toxinas son secretadas y no reabsorbidas. Por lo tanto, son procesos adaptativos que varían en función de las necesidades fisiológicas. En este sentido, prácticamente todos los nutrientes orgánicos como la glucosa y los aminoácidos se reabsorben por completo para mantener o restaurar concentraciones plasmáticas dentro de un rango de normalidad (Tabla 3).
En el túbulo, se reabsorbe más del 90% del agua y el cloruro sódico filtrados y aproximadamente el 70% del potasio y el 80% del bicarbonato. A pesar de que todo el túbulo está involucrado en la reabsorción de los diferentes productos, existen diferencias estructurales en el mismo que condicionan esta reabsorción. En particular, la reabsorción de Na+ y agua se verá condicionada por mecanismos de ajuste en las regiones terminales del túbulo, que permitirán de manera precisa regular la cantidad de estos elementos reabsorbidos en función de las necesidades hídricas del organismo; mientras que, en la región proximal, más del 65% de Na+ será reabsorbido y con él, gran parte del agua, aminoácidos o la glucosa (Tabla 3). La actividad de hormonas en los túbulos distal y colector condicionará que pequeñas cantidades de agua y algunos iones que han llegado hasta aquí (en torno al 10% de sales), se reabsorban en caso necesario.
5.1 Mecanismos de reabsorción y secreción tubulares.
5.1.1 Reabsorción de grandes moléculas
A pesar del dintel de filtración glomerular, unos 30 g de proteínas con peso molecular inferior a 70.000 atraviesan diariamente el glomérulo. Estas proteínas, junto con otros elementos como pequeñas hormonas peptídicas, se recuperan en su totalidad en el túbulo proximal mediante un proceso de endocitosis que tiene lugar en el borde en cepillo de la cara apical del túbulo proximal.
5.1.2 Reabsorción de glucosa y otras moléculas importantes para el organismo
Glucosa, aminoácidos y vitaminas, son también reabsorbidos en su práctica totalidad en el túbulo proximal por un mecanismo de transporte activo secundario, mediante cotransporte con el Na+. Este mecanismo de transporte utiliza bombas y otras unidades de transporte específicas situadas principalmente en la membrana luminal de la célula tubular, que son diferentes a las encontradas en la membrana basolateral. Esta distribución polarizada de transportadores permite un desplazamiento transcelular neto de substancias.
En general, la máxima absorción de estos elementos se produce en la primera porción del túbulo contorneado proximal. En la cara apical de las células del túbulo, y más concretamente, a nivel del borde en cepillo de las mismas, transportadores de Na+ ionizado cotransportan estos elementos al interior de la célula tubular. Desde aquí, los aminoácidos salen por difusión pasiva o facilitada hacia el líquido intersticial.
Otros elementos utilizaran bombas de transporte como la Na, K-ATPasa, o canales de cloro para ser extraídos al espacio intersticial. Quizás el elemento de esta familia mejor estudiado es el transporte de glucosa. Aproximadamente se filtran 180g de glucosa cada día, de los que más del 99% es reabsorbida a nivel tubular. Este proceso ocurre a diferentes niveles en el túbulo y dado que la glucosa no difunde a través de la bicapa lipídica celular, se hace a expensas de los transportadores de membrana de sodio y glucosa SGLT (sodium-glucose transporters). El 90% de la glucosa se reabsorbe en el segmento contorneado del túbulo proximal utilizando transportadores SGLT2, mientras que el 10% restante se reabsorbe en el segmento recto del túbulo proximal descendente mediante transportadores SGLT1.
Como indica su nombre, estos transportadores son proteínas situadas en la membrana luminal de las células tubulares, que utilizan el movimiento de Na+ por gradiente electroquímico para que glucosa entre en la célula del túbulo. La unión del Na+ que estaba en el interior de la célula al SGLT genera un cambio de conformación que permite la unión de la glucosa al mismo. El Na+ saldrá de la célula por gradiente electroquímico para permitir que la glucosa unida a los SGLT penetre en la célula, y desde allí, de nuevo los transportadores de glucosa la extraerán hacia el compartimiento intravascular para que entre por difusión a los capilares.
De esta manera se genera un balance a través de SGLT de dos moléculas de Na+, una de glucosa y 260 moléculas de agua, lo que hace que estos transportadores soporten una alta tasa de actividad. De hecho, el valor máximo de transporte de glucosa es de aproximadamente 320 mg/min. Aunque no todas las nefronas tienen un mismo índice de saturación, por lo que el umbral de glucosa se sitúa en una carga tubular de 220 mg/min, equivalente a una concentración plasmática de 180 mg/dL (Umbral renal de glucosa); cifra a partir de la cual comienzan a aparecer cantidades significativas de glucosa en orina. La glucosa plasmática es filtrada y recuperada por completo. La reabsorción de glucosa está sujeta a un máximo de transporte tubular y la cantidad reabsorbida por unidad de tiempo constituye el transporte de glucosa (Tg), expresado en mg/min, hasta que se alcanza el máximo de transporte tubular (Tmg), a partir del cual el transporte se hace constante y concentraciones superiores conllevan la eliminación del exceso por la orina. El valor de Tmg es de 320 mg/min e indica el máximo de glucosa que puede transportar el sistema. Sin embargo, debido a que unas nefronas difieren de otras en su capacidad de saturación, el umbral de glucosa se sitúa en una carga mg/dL, (Umbral renal) a partir de la cual comienzan a aparecer cantidades significativas de glucosa en orina.
Transporte Máximo
Los sistemas de transporte transcelular para los diversos solutos requieren un funcionamiento coordinado y aunque presentan cierta especificidad para la sustancia que transportan, son saturables. De ahí que se establezca un transporte máximo para casi todas las sustancias que se reabsorben utilizando transportadores de membrana, que se determina como los mg/min de sustancia trasportada, y que presenta diferencias para los diferentes solutos. Por ejemplo, la necesidad de reabsorber casi toda la glucosa que se filtra hace que el transporte máximo para esta sustancia sea alto, ya que dispone de muchos transportadores. Por el contrario, los elementos de desecho que no tienen transportadores son excretados en su mayor parte.
El hecho de que la glucosa tenga un transporte máximo elevado no quiere decir que no pueda saturarse. En general, cuando los niveles de glucosa exceden de 80 mg/dl, los trasportadores se saturan y aparece glucosuria a pesar de que los túbulos renales siguen funcionando normalmente.
5.1.3 Reabsorción de iones y agua:
Agua, iones y algunos nutrientes son reabsorbidos fundamentalmente a nivel del túbulo proximal por diferentes mecanismos. El agua, seguirá un proceso de transporte pasivo por arrastre osmótico. Por el contrario, iones y algunos pequeños nutrientes no reabsorbidos utilizarán trasportadores que necesitan energía. Esta energía, será aportada en gran medida por intercambiadores ligados al sodio.
Al igual que ocurría con los restantes elementos útiles para el organismo, el agua, y la mayor parte de los iones son recuperados. De hecho, más del 90% del agua y del cloruro sódico filtrado son reabsorbidos. El 10% restante tendrá una reabsorción condicionada a las necesidades del organismo. La actividad del túbulo depende en gran medida de mantener una presión osmótica del fluido similar a la del plasma. Puesto que proteínas y otros elementos que participan en el mantenimiento de la presión osmótica plasmática no atraviesan la barrera glomerular, en el túbulo, la presión isoosmótica con el plasma está condicionada fundamentalmente por el contenido de agua y sal (disociado como cloro y Na+) del ultrafiltrado.
a) Transporte de sodio: Como hemos comentado, la reabsorción de Na+ es el principal motor para el transporte de múltiples elementos que se acoplan a los intercambiadores de sodio en las células del túbulo.
El Na+, es el catión más abundante en el ultrafiltrado, y en función de la región del túbulo donde se reabsorba, parte del Na+ entra por difusión facilitada a través de canales situados en la cara apical de las células del túbulo. Pero el mayor porcentaje de Na+, se reabsorbe en la región proximal del túbulo utilizando un mecanismo de transporte activo con gran gasto energético. De hecho, aproximadamente el 80% de la energía utilizada para el transporte activo a nivel tubular se consumirá en el transporte de Na+, de ahí, que las células del túbulo en la región proximal contengan muchas mitocondrias que serán necesarias para suministrar el ATP que requerirá el transporte a este nivel.
- Transporte de sodio a través de la membrana basolateral
El sodio es transportado fuera de la célula del túbulo por un transportador activo primario, la bomba de Na+-K +-ATPasa de la membrana basolateral. A partir de ahí, el Na+ es arrastrado por el agua hacia los capilares peritubulares. Este arrastre es favorecido porque el agua fluye rápidamente por las diferencias de presiones entre un intersticio con muy baja presión osmótica hacia un capilar que al contener proteínas y otros coloides presenta una elevada presión osmótica.
Es importante recordar que la bomba Na+-K+-ATPasa es una enzima ATPasa que saca tres iones sodio (Na+) a la vez que ingresa dos iones potasio (K+) en el interior de la célula, generando un gradiente electronegativo intracelular
- Transporte de sodio a través de la membrana apical
El gradiente electronegativo generado en el interior de la célula del túbulo favorece la entrada del Na+ desde el ultrafiltrado, y para ello, se utilizan diferentes mecanismos en función de la región del túbulo La bomba de Na+-K+-ATPasa de la pared basal había generado un gradiente electronegativo en el interior de la célula del túbulo, al sacar 3 Na+ hacia fuera por 2 K+ que entra, por lo que se favorece la entrada de Na+ desde el borde apical. Pero además este Na+ que entra abre canales de escape para el K+ que difunde rápidamente hacia el intersticio, acentuando la electronegatividad intracelular y favoreciendo la incorporación de Na+.
b) Reabsorción de cloro: Se produce por vía paracelular, sin requerir energía para su transporte, en el último segmento del túbulo proximal, y asa de Henle. Pero un pequeño porcentaje de cloro es absorbido mediante un cotransportador Na+/2Cl-/K+, que aprovecha el movimiento de cargas positivas para recuperar cloro.
c) Transporte del Agua: En el asa de Henle, la permeabilidad de las células del túbulo cambia, y esta modificación, tiene una función primordial en la capacidad renal para concentrar la orina en función de la dinámica de reabsorción del agua mediante un mecanismo de intercambio a contracorriente condicionado en gran medida por su disposición en forma de U, paralela al conducto colector, y penetrando hasta la papila de la médula renal, lo que ocasiona que las nefronas se dispongan de forma radial en el riñón.
En el asa de Henle se distingue un segmento delgado, que da continuidad al tubo proximal, formado por células epiteliales muy delgadas, con pocas mitocondrias, y en consecuencia baja actividad metabólica. Sin embrago, en esta rama descendente siguen estando presente aquaporinas que permitirán la reabsorción de agua.
La rama delgada del asa, se continua con una rama ascendente gruesa, de células epiteliales con bombas de Na¿-K¿-2Cl- en su región apical y bombas de Na+-K+-ATPasa en su zona basolateral, que al mantener una alta actividad metabólica permiten la reabsorción de iones como el sodio (Na+), cloro (Cl-) y potasio (K+). Sin embargo, en la región ascendente, las acuaporinas son escasas, lo que prácticamente imposibilita la reabsorción de agua a este nivel.
Como consecuencia de estas características diferenciales en la absorción en el asa de Henle, se genera un intercambio de solutos y solventes hacia el espacio intersticial que será clave en la reabsorción de elementos a este nivel. Aproximadamente el 20% del agua que llega a la rama descendente será reabsorbida siguiendo un gradiente osmótico, y como consecuencia por difusión simple sin consumo de energía. Es más, esta difusión es tan importante que arrastrara algo de Na+ con el agua que difunde. Por el contrario, en la rama ascendente la actividad de transportadores hace que se lleguen a reabsorber hasta un 25% del Na+, al que acompañaran otros iones como el K+ o el Cl- o calcio, bicarbonato y magnesio que también se reabsorben a este nivel.
Como consecuencia, se genera un mecanismo a contracorriente por el que a medida que el filtrado glomerular pasa por el asa de Henle, el ultrafiltrado pierde agua y va concentrándose. Al llegar a las ramas ascendentes ocurrirá el proceso opuesto, la salida de solutos del filtrado al espacio extracelular. El resultado neto es que en el asa se ha generado un gradiente osmótico que arrastra agua, que pasa posteriormente a los capilares peritubulares de las nefronas, devolviéndola a la circulación sistémica.
Un elemento muy importante en la reabsorción en el asa de Henle es la urea. La urea, principal producto final del metabolismo proteico, es eliminada en su mayor parte por la orina. Pero una parte será reabsorbida en la rama ascendente del asa de Henle contribuyendo a aumentar la concentración de solutos en el espacio extracelular. Su excreción no sólo está determinada por la filtración glomerular sino también por la reabsorción tubular que le permite jugar un papel importante en la producción de una orina concentrada y en el mantenimiento del agua corporal.
5.2 Transporte en el Túbulo contorneado distal y conducto colector
Mientras que en el túbulo proximal y en el asa de Henle la dinámica de movimientos de solventes y solutos solamente estaba condicionada por principios físicos y la disponibilidad de transportadores; en esta porción de la nefrona se va a regular la reabsorción de los elementos presentes en el ultrafiltrado en función de los requerimientos homeostáticos. Fundamentalmente una regulación endocrina a este nivel permitirá, adaptar la excreción o reabsorción de agua y otras sales a las necesidades hídricas en cada momento
5.2.1 Hormona antidiurética (ADH). Como su nombre indica, la ADH inhibe la secreción de agua y con ello la producción de orina al regular la cantidad de aquaporinas permeables para la reabsorción de agua. Cuando el cuerpo está sobrehidratado, desciende la osmolalidad del líquido extracelular, y en paralelo, desciende la secreción de ADH en la secreción por la hipófisis posterior. Como consecuencia, a nivel de túbulos colectores, la actividad de las aquaporinas desciende y se excreta más agua.
Junto a esta actividad sobre las aquaporinas, la ADH aumenta la reabsorción de urea a nivel de túbulos colectores como veremos más adelante
5.2.2 Aldosterona. La aldosterona actúa modulando la reabsorción del Na+ que ha llegado hasta la región terminal de la nefrona. De hecho, hasta el 5% del Na+ filtrado puede ser reabsorbido gracias a la acción de la aldosterona.
Aunque desde una perspectiva fisiológica la función de la aldosterona se relaciona con la regulación de la presión arterial, para ejercer esta actividad, esta hormona que se sintetiza en la corteza de las glándulas suprarrenales, tiene su efecto principalmente en el riñón, específicamente a nivel del túbulo contorneado distal y del túbulo colector donde se expresan receptores de mineralocorticoides. Tras su unión a estos receptores, la aldosterona provoca la actividad de bombas de Na+/K+/ATPasa, provocando la reabsorción de Na+ y con el de Cl- y agua en aquellas regiones con aquaporinas; y la salida de K+ hacia la zona luminal del túbulo que será excretado en la orina.
5.2.3 Péptido natriurético atrial o auricular (PNA). Este péptido forma parte de una familia de al menos tres péptidos con actividad hipotensora. El PNA es sintetizado fundamentalmente en los miocitos auriculares y ventriculares, y tiene un efecto natriurético disminuyendo la reabsorción del sodio a nivel de nefrona terminal inhibiendo la expresión de los transportadores de Na+ en esta región.
Junto a esta actividad modulando la reabsorción de Na+, y con él, los elementos que pueden acompañarle, a nivel renal, el PNA actúa sobre el músculo liso vascular disminuyendo su actividad en respuesta a substancias vasoconstrictoras; disminuye la secreción de aldosterona, e inhibe la secreción de ADH, así como la secreción de renina. Además, dilata la arteria aferente glomerular; contrae la arteria eferente glomerular y relaja las células mesangiales, con incremento de la tasa de filtrado glomerular.
5.2.4 Hormona paratiroidea (PTH), también actúa a este nivel, aumentando la reabsorción de calcio principalmente en el tubo contorneado distal.
5.3 Secreción de substancias en la formación de la orina
El plasma vehicula diferentes metabolitos y elementos que no son útiles para el organismo, y que, en consecuencia, deben ser eliminados. La forma más directa es no reabsorberlos a partir del ultrafiltrado. Pero en ocasiones además de no ser reabsorbidas, es necesario que elementos no útiles del plasma sean secretados hacia la luz del túbulo para ser excretados en la orina. Sustancias como H+, K+, NH4+ (ion amonio), creatinina, y algunos ácidos y bases orgánicos son secretados desde los capilares peritubulares hacia la luz tubular. Pero también substancias que se han producido como resultado de la actividad metabólica en las células el túbulo en la reabsorción de solventes (como CO3H-) son secretadas para ser eliminadas por la orina.
Por tanto, en la formación de la orina es importante considerar la secreción de:
Medicamentos y metabolitos, que sobre todo al estar unidos a proteínas transportadoras no son filtrados, y por lo tanto, deben secretarse.
Sustancias fisiológicamente no útiles o productos intermedios que se han utilizado en la reabsorción tubular.
Especialmente importante es la secreción de urea por su actividad modulando la osmolaridad en la región medular interna renal. Es obvio que la urea, vista como un simple metabolito de desecho, debe ser eliminada. Pero, además, en el proceso de reabsorción de agua en la nefrona, la actividad de la urea es clave para formar el gradiente medular, y en consecuencia, reabsorber el agua en el asa de Henle. Aproximadamente el 50% de la urea filtrada en el glomérulo se reabsorbe en el túbulo proximal a través de una vía transcelular por un mecanismo pasivo de arrastre de solventes. El resto, continua sin ser absorbida por la estructura tubular que es impermeable a la urea, hasta llegar a la parte distal del tubo colector, donde se expresan transportadores de urea que hacen a esta región de nuevo permeable a la urea. Por tanto, la práctica totalidad de la urea que entra en el túbulo colector baja hasta la médula interna, incrementando su concentración en el túbulo colector a medida que desciende. Obviamente, si además se produce reabsorción de agua a este nivel, se incrementará aún más la concentración de urea en la región medular. Como el colector en esta región cuenta con transportadores de urea, que además son estimulados entre otros factores por la ADH, a medida que se incrementa el nivel de urea y/o se reabsorbe agua, la urea sale del túbulo colector hacia el intersticio. Esto hace que en la zona medular interna se produzca una alta concentración de urea. A medida que se incrementa la concentración de urea es secretada por difusión al asa de Henle, incrementando la osmolaridad en esta región, y con ello el arrastre de agua. Conforme la nefrona va saliendo de la región medular, el proceso se invierte, y la urea retorna de nuevo al túbulo colector donde volverá a ser reconcentrada y reabsorbida.
Por lo tanto, una gran cantidad de urea simplemente se recicla a lo largo del túbulo, aunque una parte importante de esta urea pasa desde el líquido intersticial a los capilares peritubulares para ser llevada fuera de los riñones. Como la urea reciclada desde el espacio intersticial al colector sigue al agua que no se ha reabsorbido, el porcentaje de urea reciclado depende en gran medida de volumen de agua en el túbulo colector, y por tanto de la actividad de la ADH. En ausencia de ADH, los trasportadores de urea tienen menor actividad. Además, el túbulo colector es más impermeable al agua. Por lo tanto, concentración de orina es menor y tiene menos trasportadores por lo que será menos reabsorbida y más excretada en la orina. Por el contrario, si aumenta la secreción de ADH, se incrementa la concentración de urea en el túbulo colector y se facilita su salida, con lo que se incrementa el gradiente osmótico medular formando orina más concentrada
Relevancia de la función tubular renal:
El producto filtrado en el glomérulo se verá sometido a procesos de secreción (paso de sustancias desde el plasma a la luz tubular) y procesos de reabsorción (paso de sustancias desde la luz tubular al plasma en los diferentes segmentos tubulares; lo que determina que al final, la composición de la orina sea diferente a la inicial filtrada, tanto en los solutos, como en el contenido de agua.
En la actividad del túbulo, se van a integrar mecanismos de transporte que incluyen
- Vía intercelular: movimiento de agua y solutos mediante arrastre por solvente, siguiendo diferencias osmóticas.
- Vía transcelular: mediante transportadores activos primarios y secundarios, así como mediante transporte facilitado (antitransporte y cotransporte). Muchos de estos transportadores muestran saturación por lo que tienen un transporte máximo. También se da la difusión de solutos, muchos de ellos dependiente del pH pues la forma difusible es la no disociada. El motor de todos los movimientos de solutos y agua a través de la superficie transepitelial, son las bombas de Na/K ubicadas en la membrana basolateral.
Relación anatomo-funcional.
TÚBULO PROXIMAL (TP): En él se realiza la reabsorción y secreción casi total de los principales solutos, además de la reabsorción del 70% del agua filtrada. El motor fundamental en estos procesos son movimientos de arrastre del sodio por las bombas de sodio/potasio ubicadas en la membrana basolateral de sus células.
Junto con el sodio, mediante cotransporte se reabsorbe la glucosa, los aminoácidos, los fosfatos, sulfatos, etc. Este tipo de transporte presenta saturación y por tanto un máximo (Tm). Significa que a partir de cierta concentración del soluto en plasma (umbral), todo exceso en la filtración se excretará. Mientras no se alcance el umbral todo lo filtrado será reabsorbido.
Además, el movimiento de sodio condiciona un antitransporte sodio/hidrogenión (NHE3) que facilita la secreción de hidrogeniones y la recuperación del bicarbonato filtrado (este antitransporte es regulado hormonalmente, se inhibe con la PTH y el glucagón y se activa con la angiotensina II, alfa-catecolaminas o la endotelina.
En la parte final del TP el aumento de la concentración de cloruro hace que éste junto al sodio pasen en forma de ClNa por las uniones intercelulares.
El potasio se moviliza mediante conductancias específicas y se reabsorbe siempre la misma proporción del filtrado, aunque en la parte final del TP se produce algo de secreción.
Respecto a la secreción en el TP, se produce secreción de todos los ácidos y bases orgánicas, toxinas, y drogas, así como la mayor parte del excedente de productos que circulan en el plasma.
En este segmento se reabsorbe el 70% del agua filtrada, y se realiza en condiciones de isotonicidad. Para ello se establece un gradiente osmolar entre la luz tubular y el espacio basolateral donde se acumulan sales por la actividad de las bombas de sodio/potasio. El incremento de la presión de agua en dicho espacio supone el paso de ésta hacia el capilar.
ASA DE HENLE.
RAMA DESCENDENTE DELGADA DE HENLE: Se caracteriza por su alta permeabilidad al agua y la nula reabsorción de ClNa e impermeabilidad a la urea.
RAMA ASCENDENTE DELGADA DE HENLE: Se caracteriza por su impermeabilidad al agua y la permeabilidad al ClNa que sale por gradiente químico, así como para la urea que entra por gradiente químico.
RAMA ASCENDENTE GRUESA DE HENLE: Se caracteriza por su impermeabilidad al agua, la alta actividad de las bombas basolaterales de sodio/potasio y la ubicación luminal de un cotransportador sodio/potasio/2cloruros, que saca estos iones del túbulo, por lo que el líquido tubular se hace aún más hipotónico. Este transportador está regulado por la ADH que lo activa
TÚBULO CONTORNEADO DISTAL: En la superficie apical nos encontramos con el cotransportador sodio/cloruro. En el lado basolateral nos encontramos el intercambiador 2sodio / calcio, de forma que la reabsorción de sodio supone secreción de calcio y depende del cotransportador apical sodio/cloruro. Las bombas sodio/potasio y las de calcio y magnesio.
La mácula densa se encarga de analizar la concentración tubular de sodio, de forma que cuando ésta aumenta sus células liberan renina.
TÚBULO CONECTOR Y CONDUCTO COLECTOR: En estos segmentos los transportadores y canales están regulados hormonalmente.
En la región apical se expresan canales específicos de sodio regulados por la aldosterona. Los canales específicos de potasio que favorecen su secreción y son activados por la aldosterona e inhibidos por el hidrogenión luminal. Cotransporte cloruro/potasio con poca actividad.
En la región basolateral nos encontramos con las bombas de sodio/potasio reguladas por la aldosterona y en las células intercalares tipo A los intercambiadores sodio / hidrogenión y cloruro / bicarbonato; y aquaporinas.
6. FUNCION ENDOCRINA DEL RIÑON
Probablemente en la práctica clínica habitual, la importancia de la función renal en el manejo y depuración del contenido hídrico del organismo, o en el mantenimiento del equilibrio acido-base, ensombrece una actividad renal clave en el manejo de la homeostasis, que es la función endocrina renal. Esta función renal presenta una doble vertiente, como órgano en el que se producen hormonas con actividad exocrina y paracrina, pero también como pieza fundamental que contribuye a la degradación de otras hormonas como la insulina o la hormona paratiroidea.
A nivel renal, se van a producir hormonas que tienen diferentes funciones específicas e importantes en la regulación de la propia actividad renal, que ya ha sido mencionada en los apartados previos, y, sobre todo, en el mantenimiento del flujo sanguíneo.
6.1 Eritropoyetina y hematopoyesis
Se trata de proteínas bioactivas, reguladoras de la hematopoyesis que tras unirse a receptores específicos expresados en las células progenitoras eritrocíticas (eritropoyetina, EPO) y trombopoyéticas (TPO) en la médula ósea, regulan su producción y maduración.
La eritropoyetina es una glicoproteína de 30,4 kDa, cuya estructura proteica consta de 165 aminoácidos, y está codificada en el ser humano por un gen de 2,9 kb localizado en el cromosoma 7 (q11-q22). En condiciones fisiológicas, la concentración plasmática basal de esta hormona en el adulto se encuentra en un rango de 6-32 UI/mL (100 pg/mL aprox.) y varía según el sexo y edad. La función principal de esta hormona es controlar la producción de eritrocitos (eritropoyesis), promoviendo su supervivencia, proliferación y diferenciación en la médula ósea, aunque también se ha descrito una actividad antiapoptótica y citoprotectora de la eritropoyetina en otros tejidos; por ejemplo, a nivel neuronal parece jugar un papel protector muy importante.
En los adultos, aproximadamente el 90% de la eritropoyetina se origina en los riñones. Concretamente, se produce en los fibroblastos intersticiales de la corteza renal, donde su síntesis es regulada a nivel transcripcional. La activación genética de la EPO se encuentra bajo el control de muchos factores de transcripción. Entre los factores que actúan inhibiendo la expresión del gen que codifica para la eritropoyetina se encuentran GATA-2 y NF-κB (nuclear factor kappa-light-chain-enhancer of activated B).
Además, el locus del gen de eritropoyetina tiene un promotor que es activado por factores de transcripción inducibles por hipoxia (HIFs) que se unen al gen de la eritropoyetina en lugares que permiten una regulación transcripcional en respuesta a los niveles locales de oxígeno en sangre. HIF presenta en su secuencia un aminoácido prolina cuyo radical es un grupo hidroxilo. En situaciones de normoxia, el oxígeno mantiene hidroxilada la prolina de la subunidad HIF¿, haciendo que esta sea reconocida por un sistema de degradación proteosomal. En hipoxia, la hidroxilación de la prolina de HIF¿ no es posible debido a la falta de oxígeno, por lo que se puede formar HIF¿/ß activo que actúa como factor de transcripción que tras unirse a regiones promotoras induce la síntesis de eritropoyetina. Por lo tanto, si a nivel renal se detectan bajos niveles de oxígeno, aumentan los niveles de HIF (sobre todo HIF¿2) y con ello la transcripción de EPO. Una vez que el hematocrito y la hemoglobina son restaurados, HIF¿2 se desactiva y la producción de EPO vuelve a sus valores normales.
Por su parte, la trombopoyetina (TPO) es la glicoproteína principal responsable de la producción y activación de plaquetas. Aunque el hígado es el principal órgano responsable de la mayor parte de la producción de TPO, el riñón, específicamente las células del túbulo contorneado proximal, también producen TPO. De hecho, diferentes estudios han demostrado la importancia de la producción renal de TPO en pacientes con insuficiencia renal terminal, en los que el descenso en los niveles plasmáticos de esta hormona puede condicionar la actividad plaquetaria.
6.2 Producción de renina, regulación de la presión sanguínea y el pH
La renina es una proteasa producida por las células granulares de la arteriola aferente. Esta enzima, cataliza el angiotensinógeno (producido por el hígado, que circula libremente) en angiotensina I.
Su liberación esta estimulada a través de tres mecanismos principales responsables de detectar una caída en la presión arterial: barorreceptores en la arteriola aferente; una concentración disminuida de cloruro de sodio en la mácula densa: y un aumento de catecolaminas que activan receptores beta-adrenérgicos en las células yuxtaglomerulares.
Una vez activada la angiotensina I, la enzima convertidora de angiotensina (ECA), hará que se transforme en angiotensina II. La angiotensina II aumenta la presión sanguínea mediante la estimulación las células del músculo liso vascular. Además, la angiotensina II actúa en el intercambiador Na/H en los túbulos proximales del riñón para estimular la reabsorción de Na+ y la excreción de H+ que está acoplado a la reabsorción de bicarbonato. Esto hace que en respuesta a angiotensina II se favorezca la producción de hormona antidiurética, la secreción de aldosterona, la reabsorción de sodio, y la retención de agua, dando como resultado un aumento del volumen y de la presión sanguíneas, así como del pH.
La hormona antidiurética (ADH o vasopresina) es un péptido de 9 aminoácidos liberado por la hipófisis posterior, que actúa a nivel de los túbulos renales donde promueve la recuperación de agua, disminuye el volumen de orina y con ello regula la osmolaridad plasmática y la presión arterial.
La producción de angiotensina II, estimula la liberación de ADH, aunque el principal estímulo para la producción de ADH son los cambios en la osmolaridad sérica y/o en el volumen sanguíneo. Estos parámetros, son controlados por mecanorreceptores y quimiorreceptores. La ADH actúa a nivel tubular estimulando el movimiento de las proteínas aquaporinas hacia la membrana celular apical de las células principales de los conductos colectores para formar canales de agua, lo que permite el movimiento transcelular del agua desde el lumen del conducto colector hacia el espacio intersticial en la médula del riñón. Desde allí, ingresa a los capilares vasa recta para regresar a la circulación. El agua es atraída por el ambiente altamente osmótico de la médula renal profunda.
Por su parte, la aldosterona es producida en la corteza suprarrenal en respuesta a la angiotensina II o directamente en respuesta al aumento de K+ plasmático. Esta hormona favorece la reabsorción de Na+ por parte de la nefrona, y con ello, la retención de agua. También es importante para regular los niveles de K+, favoreciendo su excreción.
6.3 Hormona paratiroidea y calcitriol
La hormona paratiroidea (PTH) y el calcitriol, forma activa de la vitamina D, van a jugar un papel clave regulando el metabolismo fofo-cálcico en el organismo.
La PTH es un péptido de 84 aminoácidos secretado por las células principales de las glándulas paratiroideas en respuesta a la disminución de los niveles circulantes de Ca++. Su principal función es aumentar la concentración de Ca++ en sangre y en el líquido extracelular, y en paralelo, los niveles de iones fósforo en la sangre, promoviendo su disminución. En gran medida, la actividad de la PTH depende de su acción sobre las células del túbulo renal, donde estimula la formación de calcitriol.
La vitamina D es una prohormona sintetizada a partir de la interacción entre los rayos ultravioleta de la luz solar y el 7-dehidrocolesterol en la piel. Una vez sintetizada, la vitamina D3 se hidroxila en el hígado para producir 25(OH) D3, que a su vez es hidroxilado por 1-α hidroxilasa (producida por el túbulo proximal del riñón) a 1-α,25-(OH)2 D3 (calcitriol).
Aunque el calcitriol presenta diferentes actividades sobre las células del sistema inmune innato, en la pared vascular, o sobre el manejo celular de la insulina entre otros, la principal actividad del calcitriol se asocia a su capacidad para modular el balance calcio/fosforo, incrementando la calcemia al promover el metabolismo óseo, la reabsorción de Ca++ a nivel intestinal y renal, y la eliminación de fosforo.
6.4 Otros mediadores asociados a la actividad renal con función vascular y/o presora
6.4.1 Hormonas natriuréticas: Los péptidos natriuréticos constituyen una familia de péptidos con acciones importantes en el mantenimiento de la homeostasis cardiovascular, regulando la presión arterial y el volumen del fluido extracelular. Los representantes más estudiados son: el péptido natriurético atrial (PNA), el péptido natriurético tipo B (PNB) y el péptido natriurético tipo C (PNC). Aunque la principal función de estos péptidos se relaciona tradicionalmente con la actividad cardiaca, los tres péptidos tienen una representación funcional renal que ha crecido en importancia en los últimos años.
Quizás el PNA sea el que mayor relevancia ha tenido entre estos péptidos, ya que se ha propuesto que actúa generando un "ajuste fino" de la presión arterial. Este péptido se produce en células de las aurículas en respuesta al estiramiento excesivo de la pared auricular, que habitualmente se observa en personas con presión arterial elevada o insuficiencia cardíaca. Los sitios de acción del PNA a nivel renal incluyen la médula interna, los tubos colectores, los glomérulos y las células mesangiales. El PNA estimula la excreción renal de Na+ y agua, disminuyendo la presión arterial. Además, actúa inhibiendo la liberación de aldosterona y, por tanto, inhibiendo la recuperación de Na+ en los conductos colectores; lo que junto a su acción inhibiendo la liberación de ADH, dará como resultado una menor recuperación de agua.
En cuanto al PNB, a dosis fisiológicas induce natriuresis y diuresis sin cambios en el flujo renal o en la tasa de filtrado glomerular, mientras que a dosis superiores, induce aumento del flujo sanguíneo renal y de la filtración glomerular.
Como consecuencia, la acción de PNA y PNB hace que descienda la presión sanguínea que se detecta a nivel auricular.
Especial interés han suscitado en los últimos años una serie de estudios que indican que el PNC se encuentra presente en el riñón, e inhibe el proceso de fibrosis que limita la actividad funcional del riñón. La fibrosis renal se observa habitualmente asociada a la edad, y se ha propuesto que la acción reno-protectora del PNC podría permitir el diseño de biomarcadores de daño renal asociado a la edad y/o terapias que prevengan este daño.
6.4.2 Endotelinas: Son péptidos de 21 aminoácidos, sin aparente función fisiológica, pero cuya potente actividad vasoconstrictora parece jugar un papel muy importante en enfermos con daño renal.
Son producidas por las células endoteliales de los vasos sanguíneos renales, células mesangiales y células del túbulo, la producción de endotelinas es estimulada por agentes como la angiotensina II, bradicinina o epinefrina. En situaciones fisiológicas, la actividad de las endotelinas parece que no tiene una gran influencia sobre la presión arterial. Pero se ha descrito que en enfermos con enfermedad renal su incremento mantenido daño podocitario y vasoconstricion en las arteriolas glomerulares provocando un descenso en el filtrado glomerular y retención de sodio.
6.4.3 Prostaglandinas y ciclooxigenasas: Las prostaglandinas son compuestos lipídicos producidos en todo el cuerpo que contribuyen a la vasodilatación y la inflamación. La síntesis de prostaglandinas se produce a partir del ácido araquidónico, y esta catalizada fundamentalmente por las ciclooxigenasas (COX) que originan prostanoides funcionales.
Las dos isoformas principales de ciclooxigenasa, COX-1 y COX-2, están expresadas a nivel renal, y modulan la actividad de prostaglandinas que juegan un papel fisiológico regulando el flujo vascular renal y participando en la homeostasis renal de la sal y el agua. A nivel renal las dos prostaglandinas con mayor relevancia son la prostaglandina E2 (PGE2) y prostaciclina (PGI2).
La PGE2 es sintetizada por el epitelio tubular y las células intersticiales, en los túbulos renales y participan en los mecanismos celulares que regulan el transporte de cloruro y sodio en el asa de Henle. Además, regulan la respuesta vasodilatadora renal manteniendo una perfusión adecuada del órgano y la redistribución del flujo sanguíneo de la corteza renal a las nefronas en la región intramedular.
La PGI2 se localiza fundamentalmente en la corteza renal, participando entre otros en la regulación del flujo vascular glomerular, la tasa de filtración glomerular y la secreción de renina.
6.5 Otras funciones endocrinas del riñón
6.5.1 Metabolismo de la glucosa
El riñón participa en la regulación de la glucemia a diferentes niveles, pero fundamentalmente por su actividad en la gluconeogénesis y mediante el manejo renal de insulina.
Junto al hígado, en el riñón se produce gluconeogénesis para obtener glucosa en situaciones de ayuno. Las células de la médula renal poseen glucosa-6-fosfatasa, permitiendo que se genere glucosa a partir de lactato, glicerol o aminoácidos. De hecho, en situaciones de acidosis aumenta la gluconeogénesis renal, al contrario de lo que ocurre a nivel hepático, lo que juega un papel importante ante situaciones como la cetoacidosis diabética.
Por otra parte, el riñón, es el órgano principal donde se regulan los niveles plasmáticos de insulina, fundamentalmente ligada a los mecanismos descritos anteriormente de reabsorción tubular proximal (99%) y filtración glomerular. Tras ser reabsorbida, la insulina es degradada en los endosomas, lo que explica que, en pacientes con insuficiencia renal, el requerimiento de insulina se reduce drásticamente debido a la disminución de la degradación de la insulina.
6.5.2 Metabolismo de la gastrina
Diferentes estudios demuestran un incremento significativo de los niveles de gastrina en situaciones de fracaso renal, lo que sugiere que, al menos de forma parcial, esta hormona sufre un metabolismo renal que podría implicar mayor riesgo de sufrir enfermedad péptica en pacientes con enfermedad renal.
7. REFLEXIÓN SOBRE LA FISIOLOGÍA RENAL
El aparato urinario se diseña evolutivamente para depurar el plasma, y con ello, el medio interno de metabolitos y otros elementos no necesarios del organismo. Junto a esta actividad colabora con otros sistemas biológicos como el cardiovascular, el respiratorio o el digestivo en el mantenimiento de la homeostasis, regulando el pH del plasma, sintetizando hormonas y otros mediadores; pero también trabaja en estrecha relación con el sistema nervioso central y el endocrino para llevar a cabo el control del volumen hídrico del organismo, donde su papel es fundamental.
En consecuencia, la función del sistema renal ha evolucionado para resolver varios aspectos esenciales:
1. Mantener un flujo sanguíneo estable que permita una actividad continua de filtración glomerular.
2. Realizar un proceso de depuración selectiva que evite la perdida de elementos necesarios para el organismo. Condicionando el dintel de filtración glomerular para evitar la pérdida de proteínas y nutrientes, y realizando un proceso de intercambio a nivel tubular para devolver al plasma todos aquellos solutos que son importantes en el medio interno
3. Depurar elementos tóxicos para el organismo o aquellos acumulados en el plasma en exceso.
4. Interactuar con otros sistemas biológicos para mantener la homeostasis, participando entre otros en condicionar el pH o el volumen hídrico del organismo a las necesidades inmediatas.