El ácido úrico (AU) es un producto final del metabolismo de las purinas que es sintetizado principalmente en hígado e intestinos, aunque también en tejidos periféricos como el músculo, endotelio y riñones. La asociación entre AU y enfermedad renal es muy estrecha, ya que el Au se elimina en sus 2/3 partes por el riñón, por lo que cuando cae el filtrado glomerular, los niveles de ácido úrico aumentan. Una tercera parte se elimina por las heces, y en presencia de estrés oxidativo, el AU se puede metabolizar a alantoina, parabanato y aloxano. La mayoría del Au plasmático es filtrado por el riñón, y el 90% del mismo sufre reabsorción tubular proximal a través del transportador aniónico URAT1, que es el lugar de acción de algunos fármacos uricosúricos como probenecid, benzbromarona y losartán. Más recientemente, se ha propuesto GLUT9 [1], un miembro de la familia de transportadores de glucosa, como un regulador principal en la homeostasis del AU. En humanos, se expresa principalmente en la membrana basolateral del túbulo contorneado proximal [2].
La hiperuricemia se define como el aumento del AU por encima de su punto de solubilidad en agua (6,8 mg/dl) y puede aparecer por una sobreproducción, una disminución en la excreción o ambos procesos.
La hiperuricemia puede dar lugar a un espectro clínico variable: artritis gotosa aguda debida a la precipitación de cristales de urato monosódico a nivel de articulaciones; la gota tofácea debida a la precipitación de los cristales en piel y tejido celular subcutáneo; la nefrolitiasis úrica; la nefropatía aguda por ácido úrico debida a precipitación de cristales intratubulares (frecuente en procesos linfoproliferativos tras tratamientos quimioterápicos, asociada al síndrome de lisis tumoral) y la nefropatía crónica por ácido úrico debida al depósito de cristales de urato en el intersticio medular, produciendo fibrosis intersticial. Además existen alteraciones congénitas que afectan al gen de la uromodulina y que producen una nefropatía familiar juvenil hiperuricémica. Pero, un gran porcentaje de pacientes con niveles elevados de ácido úrico permanecen asintomáticos. En los últimos años se ha demostrado en modelos experimentales que la hiperuricemia produce daño renal no relacionado con la precipitación de cristales de urato, por lo que el tratamiento de la misma independientemente de la presencia de síntomas sería beneficioso.
En los pacientes con ERC existen diferentes factores que pueden aumentar los niveles de ácido úrico y vienen reflejados en la (Tabla 1).
GOTA EN LA ENFERMEDAD RENAL CRÓNICADesconocemos la prevalencia de gota en los pacientes con enfermedad renal crónica (ERC). Ifudu y cols [3], mostraron que entre pacientes con ERC avanzada la prevalencia de artropatía gotosa era de un 6,5%, desapareciendo casi por completo cuando los pacientes entraban en diálisis. Datos similares fueron publicados en un estudio epidemiológico japonés [4], con una prevalencia de un 14% en pacientes con ERC sin tratamiento sustitutivo, descendiendo hasta un 2,8% en pacientes en diálisis. Goicoechea y cols analizaron la prevalencia de gota en una cohorte de 400 pacientes (228 hombres y 172 mujeres) con una edad media de 66,9±16,4 años: 35 estadio 1, 49 estadio 2, 230 estadio 3 y 86 estadio 4 de ERC. 113 pacientes recibían tratamiento con alopurinol y 287 no tomaban ningún fármaco hipouricemiante. De los 400 pacientes, un 14% presentaron artropatía gotosa: 43 hombres (19,5%) y 13 mujeres (7,6%). Según la etiología de la ERC, la nefropatía vascular y la no filiada (que incluía la patología obstructiva) fueron las que más se asociaron con la artropatía gotosa. Respecto a las comorbilidades, los pacientes hipertensos presentaron con más frecuencia gota (un 16% vs 7%, p=0,023). No encontramos asociación entre gota, cardiopatía, diabetes y dislipemia [5]. Existía una correlación inversa entre los niveles de AU y filtrado glomerular estimado (r=-0,338, p<0,001) que mejoraba cuando excluíamos los 113 pacientes que estaban recibiendo alopurinol (r=-0,447, p<0,001). Así 52 de los pacientes con gota tenían ERC estadio 3 o 4, y sólo 4 de los pacientes estadio 2. El 48,5% de los hombres en nuestra consulta con artropatía gotosa tenían hiperuricemia (úrico > 7 mg/dl), un 23% de ellos, a pesar de recibir tratamiento con alopurinol. Un 45% de los hombres y un 51% de las mujeres presentaban hiperuricemia asintomática, 11% y 9% respectivamente recibiendo tratamiento con alopurinol [4].
El tratamiento de la gota sigue cuatro principios tenga el paciente o no ERC: a) disminuir el AU, b) administrar profilaxis cuando estemos disminuyendo el AU, c) tratar el ataque agudo de gota y d) medidas no farmacológicas higiénico-dietéticas. El objetivo es mantener los niveles de AU por debajo de 6 mg/dl (5 mg/dl en caso de gota tofácea) para disminuir la frecuencia y duración de los ataques de gota. El 90% de las causas de hiperuricemia se deben a una excreción disminuida de AU, y sólo un 10% a una hiperproducción. La hiperuricemia es necesaria, aunque no suficiente para producir gota. Hay muchos más individuos con hiperuricemia que con evidencia de gota. A pesar de ello, el principal objetivo en el tratamiento de la gota es disminuir los niveles de AU para prevenir los ataques de gota, prevenir y disminuir los tofos y controlar la artritis inflamatoria. En las últimas guías publicadas, se recomienda iniciar el tratamiento con fármacos hipouricemiantes tras el primer ataque de gota en pacientes con ERC con estadio mayor o igual a 2. Esta recomendación se basa en que estos pacientes tienen opciones limitadas para el tratamiento de la gota. Las indicaciones de tratamiento en pacientes con función renal normal con fármacos hipouricemiantes, incluyen los ataques recurrentes de gota (≥ 2/año), la presencia de tofos y/o nefrolitiasis [6].
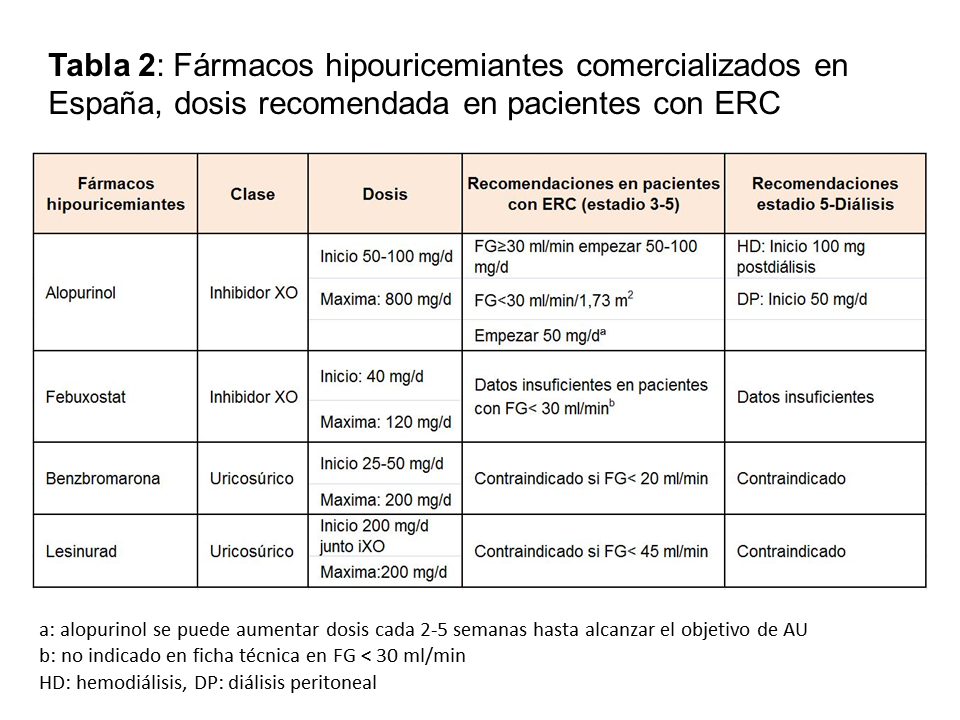
Se recomienda a todos los pacientes con gota una dieta pobre en alimentos con alto contenido en purinas, pérdida de peso, no ingerir alcohol (sobre todo cerveza), y la prohibición de bebidas con alto contenido en fructosa (refrescos). La prohibición total de alimentos con alto contenido en purinas no está recomendada, puesto que su impacto implica la reducción de 1 mg/dl de acido úrico y por lo tanto, estas medidas nunca pueden sustituir al tratamiento farmacológico [7]. Los fármacos hipouricemiantes incluyen: a) inhibidores de la xantina-oxidasa (XO) que bloquean el metabolismo de las purinas, b) uricosúricos que actúan sobre la principal causa de hiperuricemia, que es la hipoexcreción y 3) tratamiento con uricasa, que oxida el urato a través de una reacción enzimática a alantoina. En la (Tabla 2) se enumeran los diferentes fármacos hipouricemiantes comercializados en España, su mecanismo de acción y sus dosis en los diferentes estadios de ERC. Aunque la diálisis en principio es uricosúrica, y se reducen el número de ataques de gota, algunas veces es necesaria la utilización de fármacos hipouricemiantes durante la misma para disminuir los tofos. Independientemente del fármaco hipouricemiante utilizado, existen unas normas comunes en la utilización de todos ellos: a) iniciar siempre el tratamiento con profilaxis, b) empezar con la dosis más baja, con monitorización de los niveles de AU hasta que el objetivo se alcance, c) el fármaco hipouricemiante no debe ser retirado ni modificado en su dosis durante un ataque de gota y 4) en tratamientos nuevos, el fármaco debe ser introducido tras la resolución del ataque agudo de gota.
Inhibidores de xantino-oxidasa (IXO)La xantino-oxidasa es una enzima que cataliza la transformación de la hipoxantina en xantina y de xantina en AU. Los IXO son considerados primer tratamiento de elección en pacientes con gota.
AlopurinolEs el fármaco hipouricemiante más utilizado, usado desde 1960. El alopurinol es un análogo estructural de la hipoxantina, lo que condiciona una inhibición competitiva de la XO. Además, el alopurinol es un sustrato de la XO que cataboliza su trasformación a oxipurinol. Desde hace años, se ha establecido que la dosis de alopurinol se debe ajustar a la función renal para lograr el mismo nivel de oxipurinol que conseguiría una dosis de 300 mg, en un paciente con función normal [8]. Este ajuste de dosis fue desarrollado para disminuir la aparición del síndrome de hipersensibilidad por alopurinol (SHA), que se caracteriza por rash, eosinofilia, leucocitosis, fiebre, hepatitis, fracaso renal agudo y altas cifras de mortalidad. Sin embargo, con esta estrategia, menos del 50% de sujetos con ERC, alcanzan el objetivo de AU [9]. Estudios recientes han mostrado que el pico máximo de dosis de alopurinol no se asocia con mayor SHA, mientras que si se asocia con la dosis inicial de alopurinol, y con variantes genéticas (HLA B5801). Además el riesgo es más elevado durante los 6 primeros meses de tratamiento [10] [11]. Así, las últimas recomendaciones, indican que la dosis de alopurinol se puede aumentar en pacientes con ERC. Se debe empezar con una dosis baja de 50 mg/día en estadio 4 y 5 (FG < 30 ml/min) y con una dosis de 100 mg/día en el resto de estadios. El alopurinol se puede utilizar en pacientes en hemodiálisis y en diálisis peritoneal. Iniciar con la dosis más baja, reduce los números de ataques gota, SHA y otras reacciones alérgicas. La dosis posteriormente, debe ser titulada, aumentando progresivamente en 50-100 mg/día cada 2-5 semanas hasta conseguir el AU deseado [23].
FebuxostatFebuxostat es un potente inhibidor no purínico de la XO que ejerce su inhibición sobre las formas oxidada y reducida de la enzima. Los estudios clínicos demuestran mayor eficacia en la reducción de AU de febuxostat, frente a 200-300 mg de alopurinol [12]. Febuxostat puede administrarse en pacientes con ERC con FG menor de 30 ml/min/1,73 m2. Sin embargo, los datos sobre su eficacia en estos casos son escasos [13]. En relación con los efectos adversos, se han descritos reacciones cutáneas graves e incluso síndrome de Stevens-Johnson en pacientes que previamente han tenido reacción a alopurinol, por lo que la Agencia Europea y Canadiense del medicamento han publicado un aviso recientemente [14] [15]. A diferencia del alopurinol, no se ha encontrado asociación con HLAB5801 [16]. Febuxostat debe usarse con precaución en pacientes con antecedentes de cardiopatía isquémica y de insuficiencia cardiaca [17]. En España, ambos IXO corresponden a la primera línea de tratamiento de pacientes con gota.
UricosúricosLos uricosúricos aumentan la excreción renal de AU, disminuyendo la uricemia. Los uricosúricos actúan a través de proteínas transportadoras que están implicadas en la reabsorción y/o secreción del AU. Entre estos transportadores se encuentran el urato transportador tipo 1 (URAT 1), transportador de glucosa 9 (GLUT9), y transportadores de aniones orgánicos: OAT 1, OAT 3, OAT 4 y OAT10. Los uricosúricos aprobados por la Agencia Española del Medicamento son benzbromarona y lesinurad. El probenecid y sulfinpirazona no están aprobados en España. Benzbromarona es un uricosúrico potente que puede ser administrado en todos los pacientes con diferentes grados de enfermedad renal. Este fármaco no está aprobado por FDA y por algunos países europeos por su hepatotoxicidad [18]. Lesinurad es un inhibidor de URAT1 y OAT4 que debe ser administrado conjuntamente con un IXO. El uso de lesinurad se ha asociado a fracaso renal agudo y está contraindicado en sujetos con FG menor de 30 y no está recomendado con FG menor de 45 ml/min/1,73 m2 [19]. Los uricosúricos deben ser evitados en pacientes con nefrolitiasis y con uricosuria mayor de 800 mg/24 h. Aunque no se desarrollen como uricosúricos, hay dos fármacos que tienen propiedades uricosúricas: losartan y fenofibrato que pueden ayudar a disminuir los niveles de AU en tratamientos concomitantes.
UricasaLos homínidos no expresamos el gen que codifica la uricasa, enzima que degrada el AU a alantoína, una molécula con mayor solubilidad que el urato y más fácilmente eliminable. La pegloticasa es una uricasa porcina pegilada, indicada en pacientes con gota refractaria a IXO. Se administra intravenosamente cada dos semanas durante seis meses. No está aprobada por la EMA que retiró su autorización en 2016, aunque si por la FDA. Como es porcina tiene un alto riesgo de inmunogenicidad y produce reacciones alérgicas infusionales. También se ha informado sobre casos de insuficiencia cardiaca. Puede administrarse en pacientes con cualquier grado de enfermedad renal crónica y también en diálisis [20]. La rasburicasa está aprobada en España para la prevención del síndrome de lisis tumoral asociada al tratamiento quimioterápico. Tiene una vida media muy corta (unas 20h), a diferencia de la pegloticasa (vida media de unos 7 días).
HIPERURICEMIA Y ENFERMEDAD RENALTradicionalmente, la hiperuricemia asociada con hiperuricosuria produce enfermedad renal por el deposito intraluminal de cristales en los túbulos colectores de la nefrona, de una forma similar al depósito de cristales en la artropatía gotosa. Los cristales de ácido úrico tienen la capacidad de adherirse a la superficie de las células epiteliales renales e inducen una respuesta inflamatoria aguda.
Sin embargo, basado en estudios experimentales, se ha demostrado que la hiperuricemia a largo plazo produce cambios hemodinámicos e histológicos a nivel renal que pueden conducir al desarrollo de enfermedad renal crónica de novo no relacionada con el depósito de cristales de urato a nivel del intersiticio medular o a acelerar la progresión de una nefropatía existente. En un modelo murino en el que se generó hiperuricemia mediante la administración de ácido oxónico, un inhibidor de la uricasa, en ratas 5/6 nefrectomizadas se observó un aumento de la presión arterial con vasoconstricción de la arteriola aferente, vasoconstricción cortical con descenso de la tasa de filtración glomerular por nefrona e hipertensión intraglomerular con desarrollo posterior de glomeruloesclerosis y fibrosis túbulo-intersticial [21]. Por lo tanto las principales lesiones que produce la hiperuricemia a nivel renal son glomeruloesclerosis, arteriolopatía y fibrosis intersticial. El mecanismo de lesión se debe al desarrollo de una arteriolopatía glomerular que deteriora la respuesta de autorregulación renal y causa hipertensión glomerular.
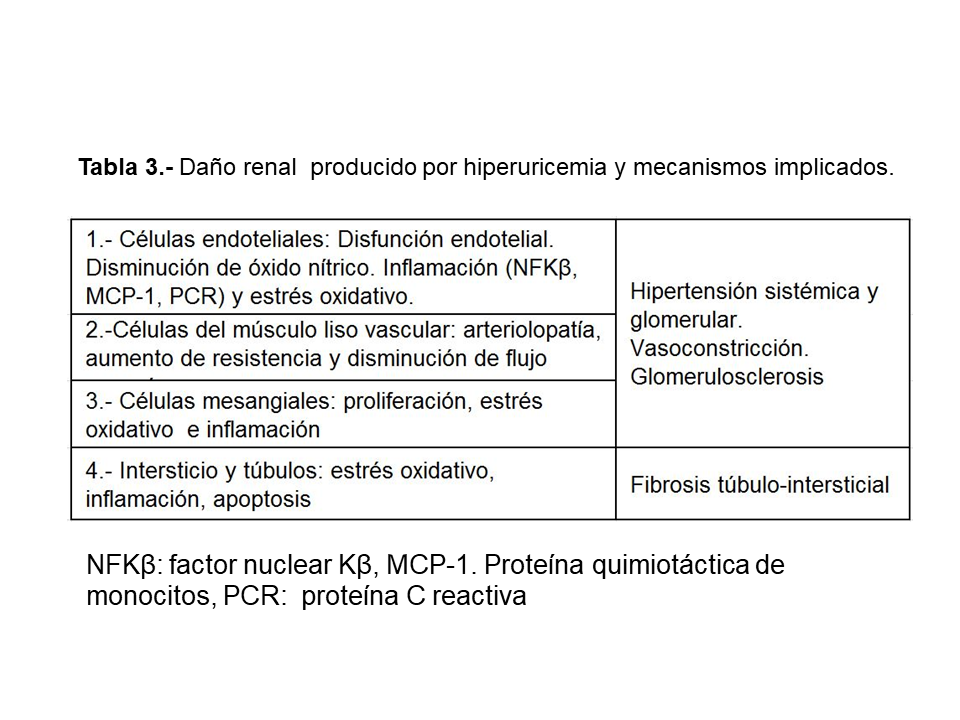
Los posibles mecanismos por los que la hiperuricemia puede aumentar la incidencia de ERC y acelerar su progresión son sintetizados en la (Tabla 3) [22].
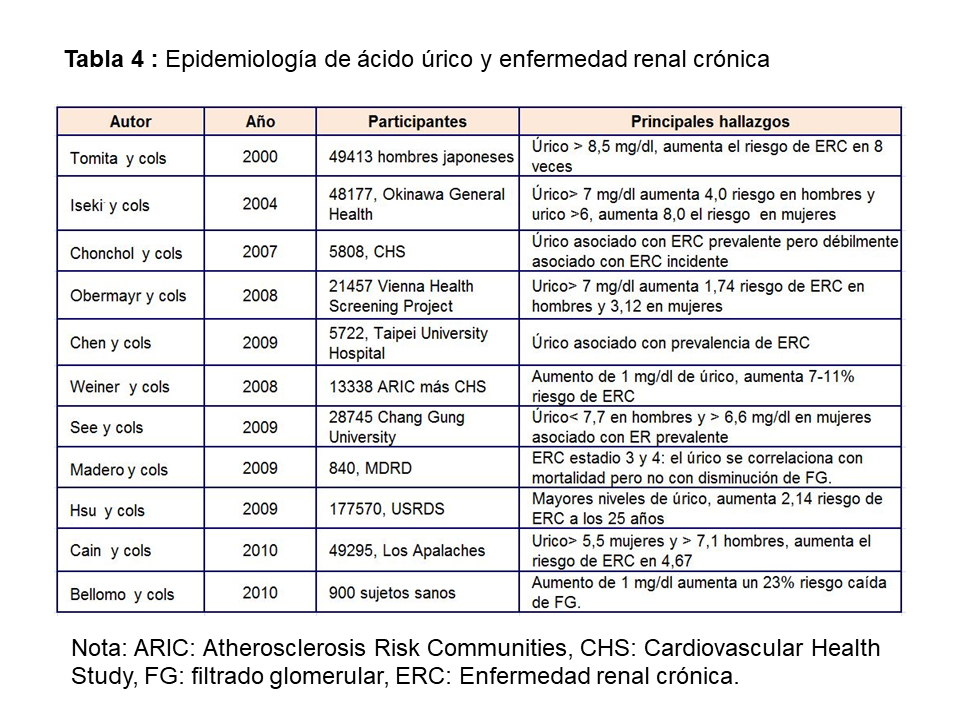
ÁCIDO ÚRICO COMO PREDICTOR DE ENFERMEDAD RENALNumerosos estudios observacionales han señalado una asociación entre hiperuricemia y desarrollo de enfermedad renal. Dos grandes estudios prospectivos epidemiológicos realizados en Japón fueron los primeros en examinar la relación entre AU y desarrollo de enfermedad renal [23] [24]. En el primero se evaluó el riesgo de insuficiencia renal en una cohorte prospectiva de 49.413 hombres japoneses estatificados por cuartiles de AU, según niveles de ERC y seguidos durante 5,4 años. El tener un AU por encima de 8,5 mg/dl aumentaba 8 veces el riesgo de desarrollar ERC frente a niveles de hiperuricemia moderada (5-6,4 mg/dl). En el segundo de los estudios, Iseki y cols [24] evaluaron la incidencia acumulativa de ERC en una cohorte de 48.177 hombres y mujeres japoneses seguidos durante 7 años. La incidencia de ERC fue mayor en el grupo de hombres con úrico >7 mg/dl y mujeres con >6 mg/dl. Hsu y cols [25] publican un gran estudio epidemiológico que incluye 175.700 sujetos sanos, seguidos durante 25 años y encuentran que existe una asociación entre hiperuricemia y desarrollo de ERC. Estos datos se corroboran con otro gran estudio epidemiológico realizado en Los Apalaches, que incluye a 49.295 sujetos sanos [26]. Los datos combinados del estudio ARIC (Atherosclerosis Risk in Communities y CHS (Cardiovascular Health Study) [27], que incluyen un total de 13.338 pacientes, muestran que cada aumento de 1 mg/dl de ácido úrico incrementa el riesgo de desarrollo de ERC entre un 7-16%. Estos resultados contrastan con los datos por separado del estudio CHS [28] que no muestran asociación entre niveles de AU e incidencia de ERC, aunque los sujetos incluidos en los quintiles cuarto y quinto de ácido úrico sí tenían un mayor riesgo de presentar un descenso más rápido del filtrado glomerular (> 3 ml/min/1,73 m2). Una explicación a estos resultados contradictorios podría ser que el CHS sólo incluyó pacientes mayores de 65 años. Tampoco se confirmó esta asociación en el estudio MDRD (Modification of Diet of Renal Disease), en el que la hiperuricemia no se asoció con mayor incidencia de ERC [29]. Por el contrario, Bellomo y cols [30] en 900 adultos sanos seguidos durante 5 años encontraron que el aumento de 50 mmol/l (1 mg/dl) de ácido úrico se asocia con el aumento de un 23% de riesgo de una caída de FG de más de 2 ml/min/año. Un estudio reciente retrospectivo basado en 680 pacientes diagnosticados de poliquistosis renal, muestra que el aumento de AU se asocia con hipertensión, mayor volumen renal y mayor progresión a enfermedad renal crónica [31]. The Jerusalem Lipid Research study mostró en 2.449 sujetos que la hiperuricemia aumentaba el riesgo de ERC en hombres en 1.94 y en mujeres en 5.6, además aumentaba el riesgo de fracaso renal agudo y de mortalidad global [32].
Estos resultados en población general (Tabla 4) se han confirmado en población diabética y en trasplantados renales. En diabéticos tipo 1 [33], el aumento de AU se asocia a un deterioro en la tasa de FG incluso en pacientes que no tienen albuminuria y aún más importante [34], la hiperuricemia en DM tipo 1 es factor predictivo de desarrollo de albuminuria a los 6 años en un estudio de 324 pacientes [35]. Recientemente se ha publicado un estudio en 1.449 pacientes diabéticos tipo 2 seguidos durante 5 años [36]. La hiperuricemia aumenta el riesgo de desarrollo de enfermedad renal crónica, definida como una caída del filtrado glomerular por debajo de 60 ml/min/1,73 m2 o la aparición de macroalbuminuria, independientemente de la edad, sexo, índice de masa corporal, hemoglobina glicosilada, duración de la diabetes, hipertensión y albuminuria basal.
En trasplantados renales la media de AU durante los 6 primeros meses postrasplante predice de forma independiente la supervivencia del injerto independientemente del grado de función renal durante esos primeros meses y de otros factores que influyen en la función del injerto [37].
En resumen, la mayoría de los estudios epidemiológicos realizados en población general, así como los realizados en diabéticos y trasplantados renales demuestran una asociación entre hiperuricemia y caída del filtrado glomerular a largo plazo.
ÁCIDO ÚRICO E HIPERTENSIÓN ARTERIALEstudios clínicos y experimentales avalan la posibilidad de que un aumento de AU pueda producir hipertensión arterial. Los factores dietéticos, genéticos o medioambientales pueden condicionar el desarrollo de hiperuricemia y a largo plazo el desarrollo de HTA. Por una parte, la dieta rica en fructosa o rica en carnes con purinas y la exposición al plomo puede causar hiperuricemia. Además, las madres con altos niveles de AU por su dieta o condicionados por la presencia de preeclampsia, obesidad o prehipertensión pueden transferir AU a la circulación fetal a través de la placenta, lo que puede condicionar un retraso de crecimiento intrauterino y una reducción en el número de nefronas. Y se ha observado que los niños nacidos con bajo número de nefronas pueden tener hiperuricemia en edad adulta. La hiperuricemia crónica estimula el sistema renina angiotensina e inhibe la liberación de óxido nítrico endotelial, contribuyendo a la vasoconstricción renal y posiblemente aumentando la presión arterial. La vasoconstricción renal persistente puede contribuir a la arterioesclerosis y al desarrollo de hipertensión sal sensible, incluso si la hiperuricemia es corregida.
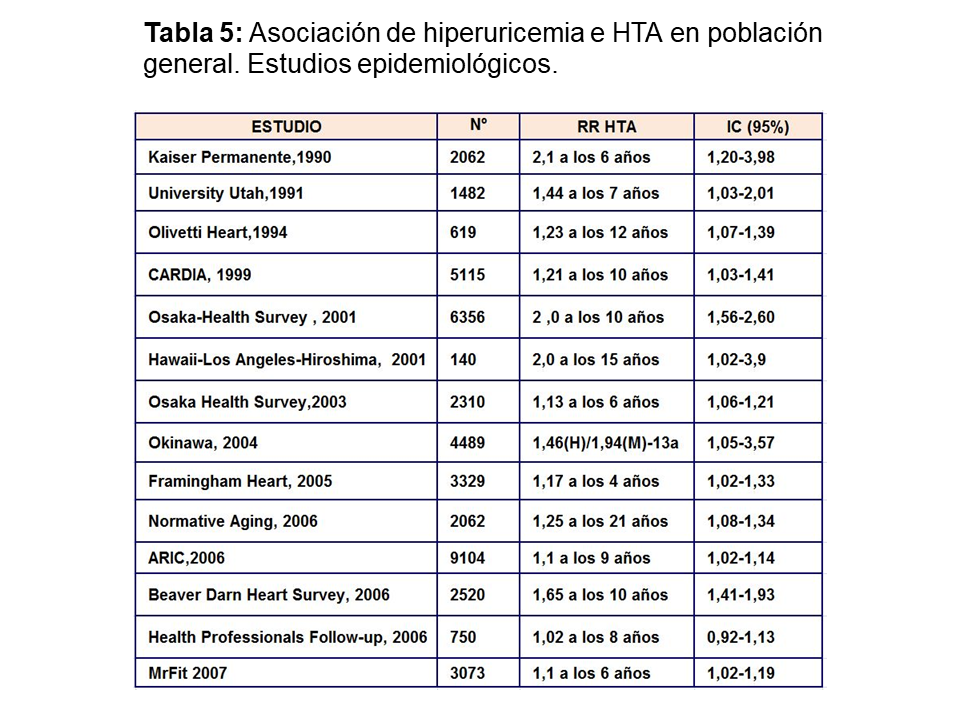
Muchos ensayos epidemiológicos realizados en población general han demostrado que el aumento de ácido úrico incrementa el riesgo relativo de desarrollo de hipertensión arterial (Tabla 5). Sin embargo sólo existe un pequeño estudio de intervención terapéutica [38], donde se demuestra que el control del AU disminuye la presión arterial. Treinta adolescentes con HTA esencial de inicio reciente y que nunca habían sido tratados, con niveles de AU superior a 6 mg/dl fueron randomizados a recibir placebo o alopurinol 200 mg, dos veces al día durante cuatro semanas. El grupo de adolescentes que fue tratado con alopurinol, sufrió un descenso significativo de la PAS y PAD.
Por lo tanto las evidencias actuales que avalan que existe una relación entre hiperuricemia e hipertensión arterial se pueden resumir:
1) un nivel elevado de AU predice el desarrollo de hipertensión en estudios epidemiológicos realizados en población general.
2) niveles elevados de AU se observan en un 25-60% de pacientes con hipertensión esencial no tratados y casi en un 90% de pacientes adolescentes con HTA de diagnóstico reciente.
3) El aumento de AU en ratas resulta en hipertensión arterial, con las características clínicas, hemodinámicas e histológicas típicas de la hipertensión arterial esencial.
4) La disminución del AU, en pacientes adolescentes con HTA de reciente diagnóstico, con un inhibidor de la xantino-oxidasa disminuye la presión arterial.
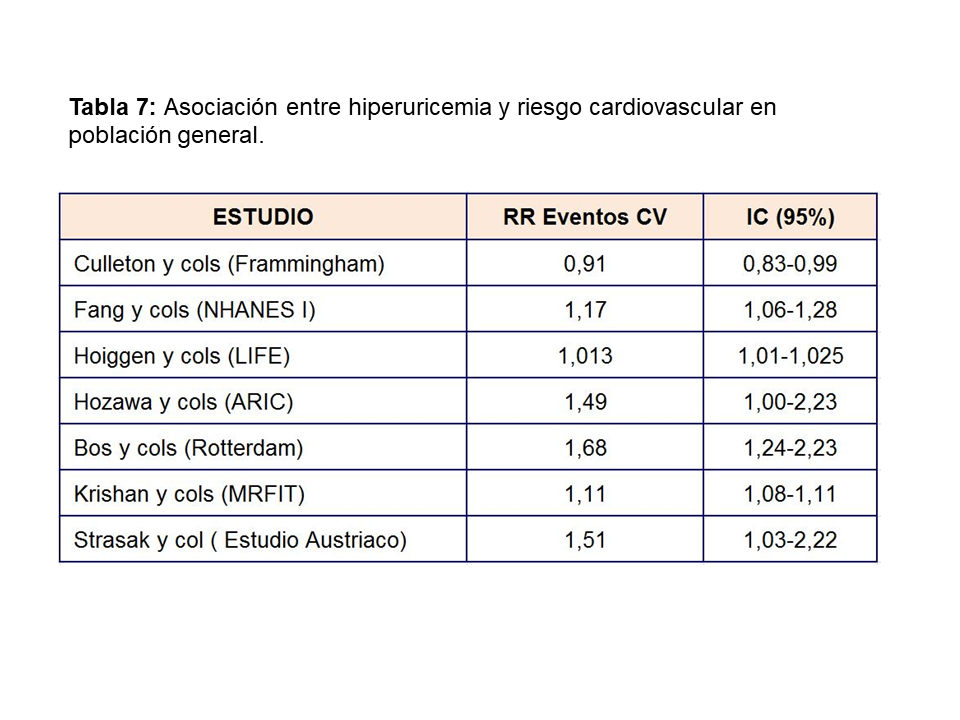
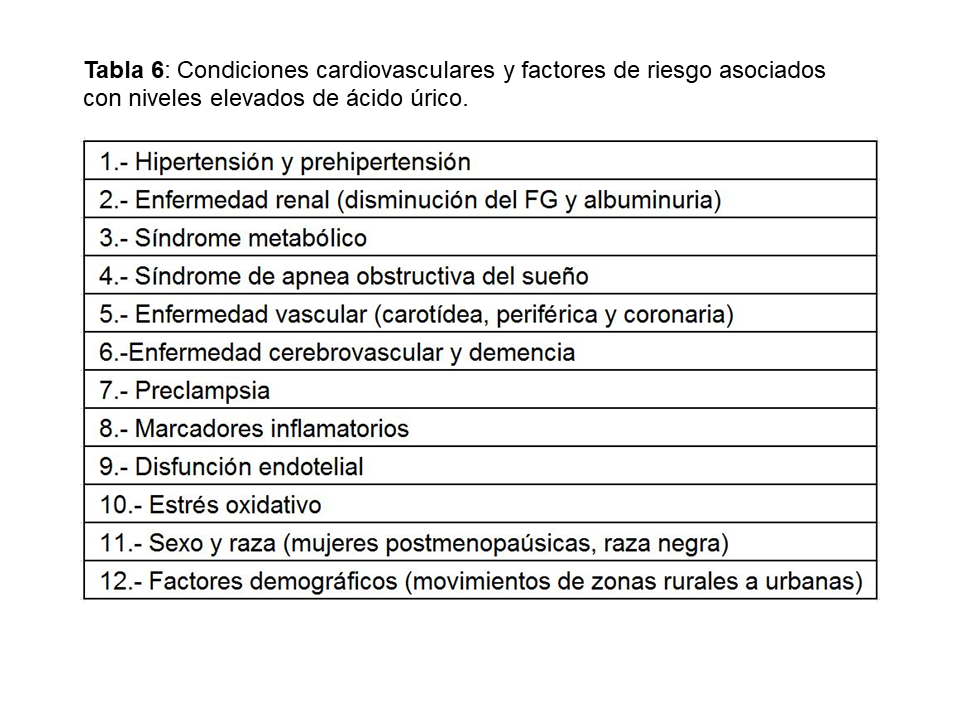
ÁCIDO ÚRICO Y ENFERMEDAD CARDIOVASCULAREl aumento de AU se correlaciona con otros muchos factores de riesgo cardiovasculares: diabetes, hipertensión, síndrome metabólico…etc (Tabla 6) lo que hizo inicialmente considerarle como un epifenómeno y no como un factor causal de riesgo cardiovascular [39]. Sin embargo, más recientemente, análisis posthoc de grandes estudios epidemiológicos realizados en población general [40], han encontrado una asociación entre hiperuricemia y aumento del riesgo cardiovascular a largo plazo como se muestra en la (Tabla 7). El único estudio que no encontró dicha asociación fue el estudio Frammingham. Wen y cols, en un gran estudio epidemiológico de población general realizado en Taiwan, encuentran que en 484.569 adultos con una edad media de 41 años y seguidos durante una mediana de 8,5 años, el aumento de ácido úrico se asocia con un mayor riesgo cardiovascular [41]. La importancia de este estudio, además del gran tamaño muestral, es que incluye pacientes de bajo riesgo cardiovascular. En este subgrupo de pacientes, el tener niveles de úrico por encima de 8 mg/dl, aumenta la mortalidad cardiovascular en un 230%. Ensayos clínicos han mostrado que la disminución de AU disminuye el grosor íntima-medio carotídeo [42], la angina [43], la hipertrofia ventricular izquierda [44], la rigidez arterial y eventos cardiovasculares en sujetos con o sin ERC [45] [46] [47] [48].
Sin embargo, todos estos trabajos solo muestran una asociación entre riesgo cardiovascular e hiperuricemia y los estudios de intervención son en la actualidad escasos. El AU puede inducir crecimiento de los cardiomiocitos y fibrosis intersticial cardiaca, hecho que se corrobora en un trabajo realizado en Japón, en el que los pacientes con mayores niveles de AU tuvieron mayor prevalencia de hipertrofia ventricular izquierda [49]. Se ha realizado un estudio aleatorizado y cruzado en el que se randomiza a 65 pacientes con angina crónica estable a recibir placebo o altas dosis de alopurinol (600 mg/día). Cuando los pacientes reciben tratamiento con alopurinol, mejora su capacidad de ejercicio y el tiempo hasta la aparición de dolor torácico [50]. Un análisis epidemiológico realizado en Italia [51] en 149.217 sujetos sanos, ha mostrado que la concentración de AU se correlaciona con la morbilidad cardiovascular y esta asociación es mayor en pacientes con ERC previa.
Recientemente ha sido publicado el estudio CARES [52] (Cardiovascular Safety of Febuxostat and Allopurinol in patients with gout and cardiovascular comorbidities), que ha mostrado resultados no muy satisfactorios en relación a seguridad cardiovascular y que ponen en duda el beneficio cardiovascular que podría ofrecer la disminución del ácido úrico. El estudio CARES incluyó 6.190 pacientes con gota que fueron randomizados a recibir allopurinol o febuxostat. Los pacientes que recibieron febuxostat no tuvieron más eventos cardiovasculares como infarto agudo de miocardio, arritmias, angina inestable u hospitalización por insuficiencia cardiaca. Sin embargo, la mortalidad cardiovascular fue significativamente mayor en el grupo tratado con febuxostat con respecto al grupo tratado con allopurinol HR 1,34 (1,03-1,73), así como la mortalidad de cualquier causa (HR 1,22 (1,01-1,47). En este ensayo clínico fueron incluidos pacientes con ERC leve (estadio 1-3) y una de sus principales limitaciones fue el % elevado de pacientes que abandonaron el ensayo clínico por diferentes motivos. Estos resultados han originado un aviso de FDA (https://www.fda.gov/drugs/drug-safety-and-availability/fda-adds-boxed-warning-increased-risk-death-gout-medicine-uloric-febuxostat) y de la AEMPS (https://www.aemps.gob.es/informa/notasInformativas/medicamentosUsoHumano/seguridad/2019/NI_MUH_FV-10-2019-febuxostat.htm) en el que se advierte que el febuxostat aumenta la mortalidad global y cardiovascular, por lo que no debe ser recomendado en pacientes con riesgo cardiovascular. Sin embargo, el estudio CARES, a pesar de haber sido publicado en el NEJM tiene sus limitaciones. En primer lugar y como he reflejado previamente una tasa de abandono del tratamiento de casi el 50% en el grupo tratado, en segundo lugar hay hallazgos muy diferentes en relación a los eventos cardiovasculares fatales y no fatales, no habiendo diferencias significativas en los eventos cardiovasculares no fatales en el grupo tratado con febuxostat, y por último, sin un grupo placebo estos resultados no contestan si el tratamiento con febuxostat aumenta el riesgo de eventos cardiovasculares fatales, o es que el tratamiento con allopurinol los disminuye. Además resultados posteriores no avalan estos resultados.
Recientemente, ha sido publicado un estudio observacional del registro de MEDICARE [54] en donde se comparan 24.936 pacientes mayores de 65 años con gota tratados con febuxostat vs allopurinol. En este análisis no se encontró mayor riesgo cardiovascular ni mortalidad en pacientes tratados con febuxostat respecto a los tratados con alopurinol. En junio/2019 se publica el ensayo clínico FREED (Febuxostat for Cerebral an CaRdiorenovascular events PrEvEntion Study) en el que se han incluído 1070 pacientes ancianos con hipertensión e hiperuricemia randomizados a tratamiento con febuxostat o tratamiento estándar. El tratamiento con febuxostat disminuyó el endpoint compuesto primario (HR 0.750 (0.592-0.950), p= 0.017, y no aumentó la mortalidad cardiovascular [55].
En 2020, se publican los resultados del estudio FAST (Febuxostat vs Allopurinol Streamlined Trial) en el que se compara el efecto de febuxostat vs alopurinol en la prevención de eventos cardiovasculares, no mostrando ninguno de ellos superioridad sobre el otro fármaco, y una vez más confirmando la seguridad cardiovascular a largo plazo [56].
Por lo tanto, serán necesarios los resultados de otros grandes ensayos clínicos en marcha, para confirmar la seguridad cardiovascular de estos fármacos hipouricemiantes: FAST Study (Febuxostat vs Allopurinol Streamlined Trial) and ALLHEART Study (Allopurinol and Cardiovascular Outcomes in Patients with Ischemic Heart Disease) y para indicar si es necesario tratar la hiperuricemia asintomática en pacientes con/sin alto riesgo cardiovascular [57].
HIPERURICEMIA Y SÍNDROME METABÓLICOLa hiperuricemia se asocia en varios estudios epidemiológicos con resistencia a la insulina, diabetes y esteatosis hepática.
Resistencia a la insulina y diabetes: La hiperuricemia se asocia en estudios epidemiológicos con resistencia a la insulina y desarrollo de diabetes. Hay pocos estudios que hayan mostrado que la disminución del AU mejora la resistencia a la insulina en humanos. El índice de resistencia a la insulina (HOMA) mejora tras tratamiento con alopurinol y benzbromarona en dos ensayos clínicos randomizados pequeños [58] [59]. Otro trabajo, ha mostrado que la hemoglobina glicosilada mejora cuando pacientes diabéticos normotensos son tratados con alopurinol [60]. Además el tratamiento con alopurinol disminuye la incidencia de macroalbuminuria y el desarrollo de nefropatía diabética tanto en pacientes con DM tipo 1 como tipo 2 [51] [52].
Esteatosis hepática: La disminución de AU mejora el hígado graso en varios modelos animales de síndrome metabólico [61] [62]. Además estudios observacionales han mostrado una asociación independiente entre niveles de AU y desarrollo de hígado graso. Los mecanismos implicados en esta asociación serían la disfunción endotelial, resistencia a la insulina y activación del inflamasoma NLRP3. Sin embargo, hasta el momento no disponemos de ensayos clínicos que demuestren que la disminución de AU disminuye la esteatosis hepática en humanos [63].
ÁCIDO ÚRICO Y PRONÓSTICO EN PACIENTES CON ERCLos datos actuales sugieren que el ácido úrico puede ser un factor de riesgo o un biomarcador de pronóstico renal y cardiovascular en población renal.
Aunque la hiperuricemia es una condición muy frecuente que acompaña a los pacientes con ERC, la relación entre hiperuricemia y caída del filtrado glomerular o riesgo cardiovascular está menos establecida que en población general. En un estudio de 177 pacientes no diabéticos con ERC, no se encontró una relación entre progresión de ERC y ácido úrico tras ajustar para proteinuria y función renal basal. Unos resultados similares se encontraron en 223 pacientes con nefropatía IgA en que la hiperuricemia no se asociaba con mayor progresión de ERC cuando se ajustaba para otras variables [64]. En ese trabajo los niveles de ácido úrico se correlacionaban con cambios histopatológicos crónicos túbulo-intersticiales. En pacientes en diálisis peritoneal, la hiperuricemia se relaciona con una caída de la función renal residual y un aumento de la disfunción endotelial. Por otro lado, los datos del estudio MDRD [29] con un seguimiento largo, no muestran una asociación entre aumento de AU y progresión de la ERC, pero sí, el aumento de 1 mg/dl de AU se asocia con un aumento de riesgo de un 17 y un 16% en mortalidad global y mortalidad cardiovascular. Conclusiones de otros estudios son contradictorios, con resultados de disminución, aumento y efectos neutrales sobre la mortalidad de pacientes con ERC.
En trasplantes renales, los trabajos que han evaluado el aumento de ácido úrico sobre mortalidad ofrecen resultados diferentes. En un estudio prospectivo de 90 pacientes prevalentes trasplantados renales, un aumento del AU en una desviación estándar se asoció con un 22% de disminución del FG, sin embargo los niveles de AU basales no fueron predictivos de la caída del FG en el tiempo. En 2010 Hairian y cols [37], mostraron que un aumento de 1 mg/dl de AU aumentaba en un 26% el riesgo de pérdida del injerto, pero no el riesgo de muerte.
Respecto a la mortalidad, Suliman y cols [65], mostraron en 298 pacientes incidentes en estadio 5 de ERC seguidos durante un tiempo medio de 6 años que los niveles elevados de AU aumentaban mortalidad global y cardiovascular. Datos del estudio MDRD en pacientes con estadio 3 y 4, confirman estos resultados [29]. También se ha visto que en trasplantados renales un ácido úrico por encima de 7,1 mg/dl aumenta el número de eventos cardiovasculares [66], aunque en un grupo de pacientes portadores de trasplante renal de donante vivo, la hiperuricemia no se asoció con mayor mortalidad. Así mismo, datos de un sub-estudio del ARIC que incluyó 461 pacientes con FG de 60 ml/min/1,73 m2, mostró que el aumento de ácido úrico no predice eventos cardiovasculares en hemodiálisis [67].
DISMINUCIÓN DE ÁCIDO ÚRICO Y EFECTOS SOBRE RIESGO CARDIOVASCULAR Y PRONÓSTICO RENALHasta Junio/2020 se habían publicado muchos estudios de asociación entre hiperuricemia, riesgo cardiovascular y riesgo renal, pero los trabajos de intervención eran escasos y de tamaño muestral pequeño. Kanbay y cols [68] demuestran en 59 sujetos sanos, que el tratamiento con alopurinol en pacientes con hiperuricemia asintomática aumenta el FG. Talaat y cols, en 52 pacientes con ERC estadio 3 y 4, muestran que la retirada de alopurinol empeora la hipertensión arterial y la función renal. Siu y cols, randomizan 54 pacientes con ERC estadio 3 y 4 a recibir alopurinol a dosis de 100 a 300 mg/día durante 12 meses o seguir con su terapia habitual [69]. El tratamiento con alopurinol retrasó la progresión de la enfermedad renal. Kao y cols tratan a 53 pacientes con ERC estadio 3 e hipertrofia ventricular izquierda con 300 mg/dia de alopurinol, mejorando la función endotelial y la HVI [70]. Goicoechea y cols realizaron un estudio en 113 pacientes con ERC [71] randomizados a continuar con su medicación habitual o a recibir tratamiento con 100 mg/día de alopurinol y los siguieron durante una media de 2 años. Los principales resultados fueron: 1) el alopurinol disminuía marcadores inflamatorios y riesgo de hospitalización, 2) El tratamiento con alopurinol redujo el riesgo de eventos cardiovasculares en un 71%, 3) Los pacientes tratados con alopurinol tuvieron un aumento de FG a los dos años de 1,2 ml/min/1,73 m2 respecto a una caída de FG de 3,39 ml/min/1,73 m2 en el grupo de tratamiento estándar (p=0,018). El alopurinol redujo la progresión de ERC definida como una caída de FG mayor de 0,2 ml/min/1,73 m2/mes en un 47%. Posteriormente, Kanbay y cols [72] realizan un estudio en 105 sujetos: 72 hiperuricémicos y 33 sujetos grupo control normouricémicos con función renal normal. Los 72 pacientes hiperuricémicos fueron randomizados a recibir 300 mg de alopurinol durante 4 meses o nada. El tratamiento con alopurinol produjo un descenso de ácido úrico que se asoció con una mejoría de función endotelial (p=0,003), del filtrado glomerular estimado (p=0,001) y de presión arterial sistólica (p=0,001). No tenemos datos suficientes para afirmar si el efecto beneficioso del alopurinol se debe a la reducción del ácido úrico o al efecto antioxidante que se produce al inhibir el enzima xantino-oxidasa. Aunque los estudios experimentales sugieren que la mejoría en la función endotelial, diabetes, insuficiencia cardiaca e insuficiencia renal, ocurre cuando disminuye el ácido úrico con tratamiento con alopurinol y no con otras drogas hipouricemiantes [73] [74].
Shi y cols. en un estudio abierto randomizado y controlado, evalúan el tratamiento con alopurinol en 40 pacientes con nefropatía IgA. Tras 6 meses de tratamiento, el tratamiento con alopurinol no influyó en la progresión de la ERC ni en la proteinuria, aunque si mejoró significativamente la presión arterial. Sin embargo, 6 meses es un tiempo demasiado corto para poder ver efecto sobre la progresión de la enfermedad renal [75].
En junio/2020, en el NEJM, se publican dos ensayos clínicos randomizados sobre el tratamiento de la hiperuricemia en pacientes con ERC estadio 3 y 4 (ensayo CKD-FIX) [76] y en pacientes diabéticos tipo 1 con albuminuria (ensayo PERL) [77]. En ambas poblaciones, el tratamiento con alopurinol no ofreció beneficios sobre la función renal. Dos consideraciones sobre estos dos ensayos: 1) en el CKD-FIX se incluyeron pacientes con progresión rápida de la enfermedad renal y proteinuria mientras que en los pequeños ensayos publicados previamente, el grado de disfunción renal y la albuminuria era menor y 2) el nivel medio de ácido úrico en el ensayo clínico PERL fue de 6,1 mg/dl, por lo que un gran porcentaje de pacientes no tenían hiperuricemia. Por lo tanto, todavía quedan muchos interrogantes por resolver, como cuáles son los niveles plasmáticos idóneos de AU, si la mayor reducción del AU aumenta el beneficio o si el efecto beneficioso demostrado por los inhibidores de xantino-oxidasa se debe a su efecto antioxidante o efecto endotelial y que población se beneficiaría más de una reducción de AU: estadios iniciales de ERC, nefropatías intersticiales o vasculares y no glomerulares… etc. En el momento actual, las principales guías no recomiendan el tratamiento de la hiperuricemia asintomática en pacientes con ERC y/o riesgo cardiovascular elevado.
Aparte de estos pequeños estudios de intervención randomizados, se han publicado algunos estudios posthoc que corroboran el efecto de la disminución del AU sobre la progresión de la ERC. Un análisis posthoc del estudio ATTEMPT que incluyó 1.123 pacientes con síndrome metabólico sin antecedentes de riesgo cardiovascular, de los cuales 349 tenía ERC estadio 3, demostró que el tratamiento multifactorial mejora la función renal y disminuye los niveles de ácido úrico. Estos cambios hacen que el subgrupo de pacientes con ERC estadio 3 tengan menos eventos cardiovasculares [78]. En un análisis posthoc del estudio RENAAL [79] en pacientes diabéticos tipo 2, que incluye 1.232 pacientes, se ha determinado la relación entre el cambio de los niveles de AU a los 6 meses y la aparición de un evento renal, definido como la progresión a la diálisis o el aumento de creatinina en un 50%. Los autores concluyen que: a) el tratamiento con losartan disminuye los niveles de ácido úrico, b) la reducción de 0,5 mg/dl de ácido úrico se asocia con una disminución de riesgo de evento renal en un 6% durante los primeros seis meses y c) esta disminución de AU explica aproximadamente 1/5 parte (20%) del efecto renoprotector que ofrece el losartan. Por lo tanto estos hallazgos corroboran que el ácido úrico puede ser un factor modificable en la progresión de la enfermedad renal crónica.
Igual que con alopurinol, el febuxostat (inhibidor selectivo de la xantino-oxidasa) ha mostrado en pequeños ensayos clínicos que también puede ofrecer protección renal. Así, en un estudio experimental realizado en ratas 5/6 nefrectomizadas normo e hiperuricémicas [80], el febuxostat protege del daño renal, y previene proteinuria, conservando la morfología de los vasos glomerulares y la presión glomerular, por lo tanto previene la progresión de la ERC independientemente del efecto AU. En el estudio de extensión FOCUS [81], 116 pacientes tratados con febuxostat fueron seguidos durante 5 años. Los pacientes con una reducción de AU mayor de 6 mg/dl, fueron los que sufrieron una caída menor del filtrado glomerular a lo largo del seguimiento. La reducción de 1 mg/dl de AU supuso una mejoría del filtrado glomerular en 1 ml/min/1,73 m2. Sin embargo, un ensayo clínico recientemente publicado, nos ofrece resultados dudosos en cuanto su eficacia en la progresión de la enfermedad renal. El ensayo clínico FEATHER [82] incluyó 467 pacientes japoneses con ERC estadio 3 e hiperuricemia asintomática que fueron randomizados a recibir febuxostat o placebo. Los pacientes fueron seguidos durante 108 semanas. El tratamiento con febuxostat no enlenteció la progresión de la enfermedad renal, con una caída de FGe en el grupo placebo de (-0,47±4,48 ml/min/1,73 m2) vs (0,23±5,26 ml/min/1,73 m2 en el grupo febuxostat. Sin embargo, el febuxostat si fue beneficioso en el grupo de pacientes sin proteinuria y con niveles menores de creatinina, sugiriendo que es más eficaz en pacientes con menor grado de daño renal. Este estudio tiene como importantes limitaciones que se ha realizado en población japonesa, con poco tiempo de seguimiento de 2 años y en un grupo de pacientes con muy poca progresión de enfermedad renal, ya que la caída de FGe en el grupo placebo fue menor de 1 ml/min/año.
Para resolver las dudas en la relación de causalidad entre hiperuricemia, daño renal y daño cardiovascular se ha intentado utilizar la genética y los estudios de randomización mendeliana. En estudios de asociación del genoma completo (GWAS) se han identificado unos 30 loci relacionados con el control del AU, principalmente codificando los transportadores tubulares renales de urato o sus proteínas reguladoras. La identificación de polimorfismos genéticos que influyen en el AU permite investigar si estos polimorfismos en estudios de randomización mendeliana se relacionan con el riesgo de enfermedad renal. Estos análisis mitigarían los factores de confusión demostrando causalidad. Sin embargo, estos estudios han mostrado resultados dispares, no siendo capaces de demostrar asociación concluyente entre estas variantes y las consecuencias clínicas [83] [84].
En resumen, los pacientes con ERC tienen con frecuencia hiperuricemia asociada a la caída del filtrado glomerular que en la mayor parte de los casos es asintomática. La hiperuricemia produce enfermedad renal por mecanismos distintos a la precipitación de cristales de urato monosódico y además acelera la progresión de la enfermedad renal. Esto unido a que aumenta el riesgo de mortalidad global y cardiovascular en pacientes con ERC, son motivos suficientes para cambiar la actitud nefrológica y empezar a tratar la hiperuricemia asintomática, sobre todo en estadios más precoces de ERC. Sin embargo, todavía quedan muchos interrogantes por resolver, como cuál es el target de AU, si la mayor reducción del AU aumenta el beneficio o si el efecto beneficioso demostrado por los inhibidores de xantino-oxidasa se debe a su efecto antioxidante o sobre la función endotelial o a la reducción del AU. Además los dos últimos ensayos clínicos publicados: FEATHER [81] y CARES [51], más que resolvernos las dudas, nos plantean más interrogantes sobre la seguridad cardiovascular del febuxostat y si es menos efectivo en la protección renal que el alopurinol.
CONCEPTOS CLAVE_ La artropatía gotosa es mucho más frecuente en los pacientes con ERC que en la población general, sin embargo el % de pacientes con hiperuricemia y ERC que permanecen asintomáticos es mucho mayor.
_ A pesar del tratamiento con alopurinol existe un porcentaje elevado de pacientes con ERC que no consiguen reducir los niveles de ácido úrico.
_ La hiperuricemia produce cambios hemodinámicos e histológicos renales que conducen a una glomeruloesclerosis y fibrosis túbulo intersticial.
_ La hiperuricemia aumenta el riesgo de desarrollo de HTA y enfermedad renal en la población general.
_ La hiperuricemia asintomática se asocia con una mayor incidencia de enfermedad renal crónica en población general.
_ El aumento de ácido úrico predice el desarrollo de nefropatía diabética en pacientes con diabetes tipo 1 y tipo 2.
_ En pacientes con ERC el aumento de ácido úrico puede aumentar el riesgo cardiovascular y acelerar la progresión de la ERC.
_ El tratamiento con inhibidores de la xantino-oxidasa pueden disminuir inflamación, progresión de enfermedad renal, tasa de hospitalización y riesgo cardiovascular en pacientes con ERC.
_ El tratamiento con febuxostat versus allopurinol puede aumentar el riesgo cardiovascular, por lo que no debe usarse en pacientes con eventos cardiovasculares previos.
_ Actualmente, existen evidencias débiles, para tratar la hiperuricemia asintomática en pacientes con ERC y mejorar su pronóstico renal.